Adrenalin
| Strukturformel ⓘ | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Strukturformel von (R)-(−)-Adrenalin | ||||||||||
| Allgemeines | ||||||||||
| Freiname | Epinephrin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C9H13NO3 | |||||||||
| Kurzbeschreibung |
weißer Feststoff | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code | ||||||||||
| Wirkstoffklasse |
| |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 183,20 g·mol−1 | |||||||||
| Schmelzpunkt |
211–212 °C | |||||||||
| pKS-Wert |
8,6 | |||||||||
| Löslichkeit |
| |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten |
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Adrenalin (gebildet 1901 aus lateinisch ad ‚an‘ und ren ‚Niere‘) oder Epinephrin (1900 gebildet aus altgriechisch ἐπί epi ‚auf‘ und νεφρός nephros ‚Niere‘) ist ein im Nebennierenmark gebildetes Hormon, das zur Gruppe der Katecholamine gehört. Auch im Zentralnervensystem kommt Adrenalin vor, dort ist es als Neurotransmitter in adrenergen Nervenzellen vorhanden. Seine Effekte vermittelt Adrenalin über eine Aktivierung von G-Protein-gekoppelten Rezeptoren, den Adrenozeptoren. Die wirksamere Form L-Adrenalin kam vor 1919 als Suprarenin (von lateinisch supra, ‚über‘) auf den Markt. ⓘ
Einmal ins Blut ausgeschüttet, vermittelt Adrenalin eine Herzfrequenzsteigerung, einen durch Blutgefäßverengung bewirkten Blutdruckanstieg und eine Bronchiolenerweiterung. Das Hormon bewirkt zudem eine schnelle Energiebereitstellung durch Fettabbau (Lipolyse) sowie die Freisetzung und Biosynthese von Glucose. Es reguliert die Durchblutung (Zentralisierung) und die Magen-Darm-Tätigkeit (Hemmung). Als Stresshormon ist es an der „Flucht- oder Kampfreaktion (fight-or-flight response)“ beteiligt. ⓘ
Epinephrin (Medikament) ⓘ
Adrenalin, auch als Epinephrin bekannt, ist ein Hormon und ein Medikament, das an der Regulierung der viszeralen Funktionen (z. B. der Atmung) beteiligt ist. Adrenalin wird normalerweise sowohl von den Nebennieren als auch von einer kleinen Anzahl von Neuronen in der Medulla oblongata produziert. Es spielt eine wichtige Rolle bei der "Kampf-oder-Flucht"-Reaktion, indem es den Blutfluss zu den Muskeln, die Leistung des Herzens durch Einwirkung auf den SA-Knoten, die Pupillenerweiterung und den Blutzuckerspiegel erhöht. Dies geschieht durch Bindung an Alpha- und Beta-Rezeptoren. Es kommt in vielen Tieren und einigen Einzellern vor. Im Jahr 1895 wurde Adrenalin erstmals von dem polnischen Physiologen Napoleon Cybulski isoliert. ⓘ
Medizinische Verwendung
Als Medikament wird es zur Behandlung einer Reihe von Erkrankungen eingesetzt, darunter allergische Reaktionen, Anaphylaxie, Herzstillstand und oberflächliche Blutungen. Inhaliertes Adrenalin kann zur Verbesserung der Symptome von Krupp eingesetzt werden. Es kann auch bei Asthma eingesetzt werden, wenn andere Behandlungen nicht wirksam sind. Es wird intravenös, durch Injektion in einen Muskel, durch Inhalation oder durch Injektion direkt unter die Haut verabreicht. Häufige Nebenwirkungen sind Zittern, Angstzustände und Schweißausbrüche. Ein schneller Herzschlag und hoher Blutdruck können auftreten. Gelegentlich kann es zu einem abnormalen Herzrhythmus kommen. Während die Sicherheit der Anwendung während der Schwangerschaft und Stillzeit unklar ist, muss der Nutzen für die Mutter berücksichtigt werden. ⓘ
Es gibt Argumente für die Verwendung von Adrenalininfusionen anstelle der weithin akzeptierten Behandlung mit Inotropika bei Frühgeborenen mit klinischen kardiovaskulären Problemen. Obwohl es genügend Daten gibt, die Adrenalininfusionen als praktikable Behandlung empfehlen, sind weitere Studien erforderlich, um abschließend festzustellen, dass diese Infusionen die Morbiditäts- und Mortalitätsrate bei kardiovaskulär beeinträchtigten Frühgeborenen erfolgreich reduzieren. ⓘ
Physiologische Wirkungen
Das Nebennierenmark trägt nur geringfügig zu den gesamten zirkulierenden Katecholaminen bei (L-DOPA hat eine höhere Konzentration im Plasma), obwohl es über 90 % des zirkulierenden Adrenalins liefert. In anderen Geweben findet sich nur wenig Adrenalin, meist in verstreuten chromaffinen Zellen und in einer kleinen Anzahl von Neuronen, die Adrenalin als Neurotransmitter nutzen. Nach einer Adrenalektomie verschwindet Adrenalin unterhalb der Nachweisgrenze im Blut. ⓘ
Pharmakologische Dosen von Adrenalin stimulieren α1-, α2-, β1-, β2- und β3-Adrenozeptoren des sympathischen Nervensystems. Die Rezeptoren des sympathischen Nervensystems werden aufgrund ihrer Reaktionsfähigkeit auf Adrenalin als adrenerge Rezeptoren eingestuft. Der Begriff "adrenergisch" wird oft falsch interpretiert, da der wichtigste sympathische Neurotransmitter Noradrenalin und nicht Adrenalin ist, das 1946 von Ulf von Euler entdeckt wurde. Adrenalin hat eine β2-Adrenozeptor-vermittelte Wirkung auf den Stoffwechsel und die Atemwege, wobei es keine direkte neuronale Verbindung zwischen den sympathischen Ganglien und den Atemwegen gibt. ⓘ
Das Konzept, dass das Nebennierenmark und das sympathische Nervensystem an der Flucht-, Kampf- und Schreckreaktion beteiligt sind, wurde ursprünglich von Walter Bradford Cannon vorgeschlagen. Im Gegensatz zur Nebennierenrinde ist das Nebennierenmark jedoch nicht für das Überleben erforderlich. Bei Patienten, denen die Nebennierenrinde entfernt wurde, bleiben die hämodynamischen und metabolischen Reaktionen auf Reize wie Hypoglykämie und körperliche Anstrengung normal. ⓘ
Bewegung
Ein physiologischer Stimulus für die Adrenalinausschüttung ist Bewegung. Dies wurde erstmals durch die Messung der Erweiterung der (denervierten) Pupille einer Katze auf einem Laufband nachgewiesen und später durch eine biologische Untersuchung von Urinproben bestätigt. Biochemische Methoden zur Messung von Katecholaminen im Plasma wurden ab 1950 veröffentlicht. Obwohl viele wertvolle Arbeiten unter Verwendung fluorimetrischer Assays zur Messung der Gesamtkatecholaminkonzentration veröffentlicht wurden, ist diese Methode zu unspezifisch und unempfindlich, um die sehr geringen Mengen an Adrenalin im Plasma genau zu bestimmen. Durch die Entwicklung von Extraktionsmethoden und radio-enzymatischen Assays (REA) mit Enzym-Isotopen-Derivaten konnte die Analyse auf eine Empfindlichkeit von 1 pg für Adrenalin reduziert werden. Frühe REA-Plasmatests wiesen darauf hin, dass Adrenalin und die Gesamtkatecholamine erst spät bei körperlicher Anstrengung ansteigen, meist dann, wenn der anaerobe Stoffwechsel einsetzt. ⓘ
Während der Belastung steigt die Adrenalinkonzentration im Blut zum Teil durch die erhöhte Sekretion des Nebennierenmarks und zum Teil durch den verringerten Metabolismus von Adrenalin aufgrund des reduzierten Blutflusses zur Leber. Die Infusion von Adrenalin zur Reproduktion der zirkulierenden Konzentrationen von Adrenalin bei Probanden in Ruhe hat nur geringe hämodynamische Auswirkungen, abgesehen von einem geringen β2-vermittelten Abfall des diastolischen Blutdrucks. Die Infusion von Adrenalin innerhalb des physiologischen Bereichs unterdrückt die Hyperreaktivität der menschlichen Atemwege in ausreichendem Maße, um die konstriktorischen Effekte von inhaliertem Histamin zu unterdrücken. ⓘ
Eine Verbindung zwischen dem sympathischen Nervensystem und der Lunge wurde 1887 nachgewiesen, als Grossman zeigte, dass die Stimulierung der Herzbeschleunigungsnerven die muskarininduzierte Verengung der Atemwege aufhob. In Experimenten am Hund, bei denen die Sympathikuskette auf der Höhe des Zwerchfells durchtrennt wurde, zeigte Jackson, dass die Lunge nicht direkt vom Sympathikus innerviert wird, sondern dass die Bronchokonstriktion durch die Freisetzung von Adrenalin aus dem Nebennierenmark aufgehoben wird. Ein erhöhtes Auftreten von Asthma ist bei adrenalektomierten Patienten nicht bekannt; Patienten mit einer Prädisposition für Asthma werden durch die Kortikosteroid-Ersatztherapie in gewissem Maße vor einer Hyperreaktivität der Atemwege geschützt. Sportliche Betätigung führt bei gesunden Menschen zu einer fortschreitenden Erweiterung der Atemwege, die mit der Arbeitsbelastung korreliert und durch Betablockade nicht verhindert wird. Die fortschreitende Dilatation der Atemwege bei zunehmender Belastung wird durch eine fortschreitende Verringerung des vagalen Tonus im Ruhezustand vermittelt. Die Betablockade mit Propranolol führt bei normalen Personen zu einem Wiederanstieg des Atemwegswiderstands nach der Belastung, und zwar über den gleichen Zeitraum wie die Bronchokonstriktion, die bei belastungsinduziertem Asthma beobachtet wird. Die Verringerung des Atemwegswiderstands bei körperlicher Anstrengung reduziert die Atemarbeit. ⓘ
Emotionale Reaktionen
Jede emotionale Reaktion hat eine Verhaltenskomponente, eine autonome Komponente und eine hormonelle Komponente. Die hormonelle Komponente umfasst die Freisetzung von Adrenalin, eine adrenomedulläre Reaktion, die als Reaktion auf Stress auftritt und vom sympathischen Nervensystem gesteuert wird. Die wichtigste Emotion, die im Zusammenhang mit Adrenalin untersucht wurde, ist Angst. In einem Experiment zeigten Probanden, denen Adrenalin gespritzt wurde, im Vergleich zu einer Kontrollgruppe mehr negative und weniger positive Gesichtsausdrücke bei Angstfilmen. Diese Versuchspersonen berichteten auch über eine intensivere Angst bei den Filmen und eine größere durchschnittliche Intensität der negativen Erinnerungen als die Kontrollpersonen. Die Ergebnisse dieser Studie zeigen, dass es erlernte Zusammenhänge zwischen negativen Gefühlen und Adrenalinspiegeln gibt. Insgesamt ist die höhere Adrenalinmenge positiv mit einem erregten Zustand negativer Gefühle korreliert. Diese Ergebnisse können zum Teil darauf zurückzuführen sein, dass Adrenalin physiologische Sympathikusreaktionen auslöst, darunter eine erhöhte Herzfrequenz und das Zittern der Knie, was dem Gefühl der Angst zugeschrieben werden kann, unabhängig vom tatsächlichen Ausmaß der Angst, die das Video hervorruft. In Studien wurde zwar ein eindeutiger Zusammenhang zwischen Adrenalin und Angst festgestellt, bei anderen Emotionen wurden jedoch keine derartigen Ergebnisse erzielt. In der gleichen Studie äußerten die Probanden weder eine größere Belustigung bei einem Belustigungsfilm noch eine größere Wut bei einem Wutfilm. Ähnliche Ergebnisse wurden auch in einer Studie mit Nagetieren bestätigt, die entweder in der Lage waren oder nicht, Adrenalin zu produzieren. Die Ergebnisse unterstützen die Idee, dass Adrenalin eine Rolle bei der Kodierung von emotional erregenden Ereignissen spielt und zu einem höheren Erregungsniveau aufgrund von Angst beiträgt. ⓘ
Gedächtnis
Es wurde festgestellt, dass adrenerge Hormone wie Adrenalin beim Menschen eine retrograde Verbesserung des Langzeitgedächtnisses bewirken können. Die Freisetzung von Adrenalin aufgrund von emotional belastenden Ereignissen, bei denen es sich um endogenes Adrenalin handelt, kann die Gedächtniskonsolidierung der Ereignisse modulieren und so eine Gedächtnisstärke gewährleisten, die proportional zur Bedeutung der Erinnerung ist. Die Adrenalinaktivität nach dem Lernen steht auch in Wechselwirkung mit dem Grad der Erregung, der mit der ursprünglichen Kodierung verbunden war. Es gibt Hinweise darauf, dass Adrenalin eine Rolle bei der langfristigen Stressanpassung und speziell bei der Kodierung des emotionalen Gedächtnisses spielt. Adrenalin kann auch eine Rolle bei der Erhöhung der Erregung und des Furchtgedächtnisses unter bestimmten pathologischen Bedingungen spielen, einschließlich der posttraumatischen Belastungsstörung. Insgesamt gibt es "umfangreiche Hinweise darauf, dass Epinephrin (EPI) die Gedächtniskonsolidierung für emotional erregende Aufgaben bei Tieren und Menschen moduliert". Studien haben auch ergeben, dass das Wiedererkennungsgedächtnis unter Beteiligung von Adrenalin von einem Mechanismus abhängt, der auf β-Adrenozeptoren beruht. Adrenalin kann die Blut-Hirn-Schranke nicht ohne weiteres überwinden, so dass seine Auswirkungen auf die Gedächtniskonsolidierung zumindest teilweise durch β-Adrenozeptoren in der Peripherie ausgelöst werden. Studien haben ergeben, dass Sotalol, ein β-Adrenozeptor-Antagonist, der ebenfalls nicht ohne weiteres ins Gehirn gelangt, die gedächtnissteigernden Wirkungen von peripher verabreichtem Adrenalin blockiert. Diese Ergebnisse legen nahe, dass β-Adrenozeptoren notwendig sind, damit Adrenalin eine Wirkung auf die Gedächtniskonsolidierung hat. ⓘ
Pathologie
Eine erhöhte Adrenalinausschüttung wird bei Phäochromozytomen, Hypoglykämie, Myokardinfarkt und in geringerem Maße bei essentiellem Tremor (auch als benigner, familiärer oder idiopathischer Tremor bezeichnet) beobachtet. Ein allgemeiner Anstieg der sympathischen Neuralaktivität geht in der Regel mit einer erhöhten Adrenalinausschüttung einher, wobei jedoch eine Selektivität bei Hypoxie und Hypoglykämie besteht, wenn das Verhältnis von Adrenalin zu Noradrenalin deutlich erhöht ist. Es muss also eine gewisse Autonomie des Nebennierenmarks gegenüber dem übrigen sympathischen System bestehen. ⓘ
Ein Myokardinfarkt geht mit hohen Konzentrationen von zirkulierendem Adrenalin und Noradrenalin einher, insbesondere bei kardiogenem Schock. ⓘ
Der benigne familiäre Tremor (BFT) spricht auf periphere β-Adrenalinblocker an, und es ist bekannt, dass die β2-Stimulation einen Tremor verursacht. Bei Patienten mit BFT wurde ein erhöhter Adrenalinspiegel im Plasma festgestellt, nicht jedoch ein erhöhter Noradrenalinspiegel. ⓘ
Niedrige oder fehlende Adrenalinkonzentrationen können bei autonomer Neuropathie oder nach einer Nebennierenresektion auftreten. Ein Versagen der Nebennierenrinde, wie bei der Addison-Krankheit, kann die Adrenalinsekretion unterdrücken, da die Aktivität des synthetisierenden Enzyms Phenylethanolamin-N-Methyltransferase von der hohen Kortisolkonzentration abhängt, die aus der Rinde in das Mark abfließt. ⓘ
Terminologie
Im Jahr 1901 ließ Jōkichi Takamine einen gereinigten Extrakt aus den Nebennieren patentieren, der von Parke, Davis & Co in den USA als Marke geschützt wurde. Der britische Approved Name und die Bezeichnung im Europäischen Arzneibuch für diesen Wirkstoff lautet daher Adrenalin. ⓘ
Allerdings hatte der Pharmakologe John Abel bereits 1897 einen Extrakt aus Nebennieren hergestellt und dafür den Namen Epinephrin (von altgriechisch ἐπῐ́ (epí), "auf", und νεφρός (nephrós), "Niere") geprägt. In dem Glauben, dass Abels Extrakt mit dem von Takamine identisch sei (was inzwischen bestritten wird), wurde Epinephrin in den USA zum Gattungsnamen und ist nach wie vor der von den Vereinigten Staaten angenommene Name und der internationale Freiname des Arzneimittels (auch wenn häufig der Name Adrenalin verwendet wird). ⓘ
Die Terminologie ist heute einer der wenigen Unterschiede zwischen dem INN- und dem BAN-Namensystem. Während europäische Mediziner und Wissenschaftler den Begriff Adrenalin bevorzugen, ist es bei amerikanischen Medizinern und Wissenschaftlern genau umgekehrt. Dennoch werden auch dort die Rezeptoren für diese Substanz als adrenerge Rezeptoren oder Adrenozeptoren bezeichnet, und Arzneimittel, die ihre Wirkung nachahmen, werden oft als Adrenergika bezeichnet. Die Geschichte von Adrenalin und Epinephrin wird von Rao beschrieben. ⓘ
Adrenalin besitzt ein Stereozentrum, somit existieren zwei Enantiomere. Ist der Name „Adrenalin“ durch keinen Deskriptor näher gekennzeichnet, ist das natürlich vorkommende (R)-(−)-Adrenalin gemeint. (S)-(+)-Adrenalin hat dagegen praktisch keine Bedeutung. ⓘ
Mechanismus der Wirkung
| Organ | Wirkungen |
|---|---|
| Herz | Erhöht die Herzfrequenz; Kontraktilität; Erregungsleitung über den AV-Knoten |
| Lunge | Erhöht die Atemfrequenz; Bronchodilatation |
| Leber | Stimuliert die Glykogenolyse |
| Muskeln | Stimuliert die Glykogenolyse und die Glykolyse |
| Gehirn | |
| Systemisch | Vasokonstriktion und Vasodilatation |
| Löst Lipolyse aus | |
| Kontraktion der Muskeln |
Als Hormon wirkt Adrenalin auf fast alle Körpergewebe durch Bindung an adrenerge Rezeptoren. Seine Auswirkungen auf die verschiedenen Gewebe hängen von der Art des Gewebes und der Ausprägung spezifischer Formen von adrenergen Rezeptoren ab. So bewirkt ein hoher Adrenalinspiegel beispielsweise eine Entspannung der glatten Muskulatur in den Atemwegen, aber eine Kontraktion der glatten Muskulatur, die die meisten Arteriolen auskleidet. ⓘ
Adrenalin ist ein nicht-selektiver Agonist aller adrenergen Rezeptoren, einschließlich der wichtigsten Subtypen α1, α2, β1, β2 und β3. Die Bindung von Adrenalin an diese Rezeptoren löst eine Reihe von metabolischen Veränderungen aus. Die Bindung an α-adrenerge Rezeptoren hemmt die Insulinsekretion in der Bauchspeicheldrüse, stimuliert die Glykogenolyse in Leber und Muskeln, stimuliert die Glykolyse und hemmt die insulinvermittelte Glykogenese in den Muskeln. Die Bindung an β-adrenerge Rezeptoren löst die Glukagonsekretion in der Bauchspeicheldrüse, eine erhöhte Sekretion von adrenocorticotropem Hormon (ACTH) durch die Hypophyse und eine erhöhte Lipolyse im Fettgewebe aus. Zusammen führen diese Wirkungen zu einem Anstieg des Blutzuckerspiegels und der Fettsäuren, die Substrate für die Energieproduktion in den Zellen des gesamten Körpers liefern. ⓘ
Adrenalin veranlasst die Leberzellen, Glukose ins Blut freizusetzen, indem es sowohl über alpha- als auch beta-adrenerge Rezeptoren wirkt, um die Glykogenolyse zu stimulieren. Adrenalin bindet an β2-Rezeptoren auf den Leberzellen, wodurch sich die Konformation ändert und Gs, ein heterotrimeres G-Protein, GDP in GTP umwandeln kann. Dieses trimere G-Protein dissoziiert in die Untereinheiten Gs alpha und Gs beta/gamma. Gs alpha stimuliert die Adenylylcyclase und wandelt so Adenosintriphosphat in zyklisches Adenosinmonophosphat (AMP) um. Das zyklische AMP aktiviert die Proteinkinase A. Die Proteinkinase A phosphoryliert und aktiviert teilweise die Phosphorylase-Kinase. Adrenalin bindet auch an α1-Adrenorezeptoren und bewirkt einen Anstieg von Inositoltriphosphat, wodurch Kalziumionen in das Zytoplasma gelangen. Die Kalziumionen binden an Calmodulin, was zu einer weiteren Aktivierung der Phosphorylase-Kinase führt. Die Phosphorylase-Kinase phosphoryliert die Glykogenphosphorylase, die daraufhin Glykogen abbaut, was zur Produktion von Glukose führt. ⓘ
Adrenalin hat auch erhebliche Auswirkungen auf das Herz-Kreislauf-System. Es erhöht den peripheren Widerstand durch α1-Rezeptor-abhängige Vasokonstriktion und steigert die Herzleistung durch Bindung an β1-Rezeptoren. Das Ziel der Verringerung des peripheren Kreislaufs besteht darin, den koronaren und zerebralen Perfusionsdruck zu erhöhen und damit den Sauerstoffaustausch auf zellulärer Ebene zu steigern. Adrenalin erhöht zwar den Druck im Aorten-, Hirn- und Karotiskreislauf, senkt aber den Blutfluss in der Karotis und den endtidalen CO2- oder ETCO2-Wert. Es scheint, dass Adrenalin die Makrozirkulation auf Kosten der Kapillarbetten verbessert, in denen die eigentliche Perfusion stattfindet. ⓘ
Messung in biologischen Flüssigkeiten
Adrenalin kann in Blut, Plasma oder Serum als diagnostisches Hilfsmittel, zur Überwachung der therapeutischen Verabreichung oder zur Identifizierung des verursachenden Agens bei einem potenziellen Vergiftungsopfer quantifiziert werden. Die endogenen Adrenalinkonzentrationen im Plasma liegen bei Erwachsenen in Ruhe normalerweise unter 10 ng/L, können aber bei körperlicher Anstrengung um das 10-fache und bei Stress um das 50-fache oder mehr ansteigen. Phäochromozytom-Patienten haben häufig Adrenalin-Plasmaspiegel von 1000-10.000 ng/L. Die parenterale Verabreichung von Adrenalin an Akutpatienten mit Herzproblemen kann zu Plasmakonzentrationen von 10.000 bis 100.000 ng/L führen. ⓘ
Biosynthese

Chemisch gesehen gehört Adrenalin zu einer Gruppe von Monoaminen, den Katecholaminen. Adrenalin wird in den chromaffinen Zellen des Nebennierenmarks der Nebenniere und einer kleinen Anzahl von Neuronen in der Medulla oblongata im Gehirn über einen Stoffwechselweg synthetisiert, der die Aminosäuren Phenylalanin und Tyrosin in eine Reihe von Stoffwechselzwischenprodukten und schließlich in Adrenalin umwandelt. Tyrosin wird zunächst durch die Tyrosinhydroxylase zu L-DOPA oxidiert; dies ist der geschwindigkeitsbeschränkende Schritt. Anschließend wird es durch die DOPA-Decarboxylase (aromatische L-Aminosäure-Decarboxylase) zu Dopamin decarboxyliert. Dopamin wird dann durch Dopamin-beta-Hydroxylase unter Verwendung von Ascorbinsäure (Vitamin C) und Kupfer in Noradrenalin umgewandelt. Der letzte Schritt der Adrenalin-Biosynthese ist die Methylierung des primären Amins von Noradrenalin. Diese Reaktion wird durch das Enzym Phenylethanolamin-N-Methyltransferase (PNMT) katalysiert, das S-Adenosylmethionin (SAMe) als Methylspender verwendet. PNMT ist vor allem im Zytosol der endokrinen Zellen des Nebennierenmarks (auch als chromaffine Zellen bekannt) zu finden, wurde aber auch in geringen Mengen im Herzen und im Gehirn nachgewiesen. ⓘ
Biosynthesewege von Katecholaminen und Spurenaminen im menschlichen Gehirn
|
Die normale Konzentration von Adrenalin im Blut liegt unter 100 ng/l (etwa 500 pmol/l). ⓘ
Regulierung
Die wichtigsten physiologischen Auslöser der Adrenalinausschüttung sind Stressfaktoren wie körperliche Bedrohung, Aufregung, Lärm, helles Licht und hohe oder niedrige Umgebungstemperatur. Alle diese Reize werden im zentralen Nervensystem verarbeitet. ⓘ
Das adrenokortikotrope Hormon (ACTH) und das sympathische Nervensystem stimulieren die Synthese von Adrenalinvorläufern, indem sie die Aktivität der Tyrosinhydroxylase und der Dopamin-β-Hydroxylase, zwei Schlüsselenzyme der Katecholaminsynthese, steigern. ACTH regt auch die Nebennierenrinde zur Ausschüttung von Cortisol an, das die Expression von PNMT in den chromaffinen Zellen erhöht, wodurch die Adrenalinsynthese gesteigert wird. Dies geschieht meist als Reaktion auf Stress. Das sympathische Nervensystem, das über splanchnische Nerven auf das Nebennierenmark einwirkt, stimuliert die Freisetzung von Adrenalin. Acetylcholin, das von den präganglionären sympathischen Fasern dieser Nerven freigesetzt wird, wirkt auf nikotinische Acetylcholinrezeptoren, was zu einer Depolarisation der Zellen und einem Einstrom von Kalzium über spannungsgesteuerte Kalziumkanäle führt. Das Kalzium löst die Exozytose der chromaffinen Granula und damit die Freisetzung von Adrenalin (und Noradrenalin) in den Blutkreislauf aus. Damit Noradrenalin von PNMT im Zytosol bearbeitet werden kann, muss es zunächst aus den Granula der chromaffinen Zellen ausgeschüttet werden. Dies kann über den Catecholamin-H+-Austauscher VMAT1 geschehen. VMAT1 ist auch für den Transport von neu synthetisiertem Adrenalin aus dem Zytosol zurück in die Chromaffin-Granula verantwortlich, um die Freisetzung vorzubereiten. ⓘ
Im Gegensatz zu vielen anderen Hormonen übt Adrenalin (wie auch andere Katecholamine) keine negative Rückkopplung aus, um seine eigene Synthese herunterzuregulieren. Abnorm erhöhte Adrenalinspiegel können bei einer Reihe von Erkrankungen auftreten, z. B. bei heimlicher Adrenalinzufuhr, Phäochromozytomen und anderen Tumoren der sympathischen Ganglien. ⓘ
Die Wirkung des Adrenalins wird durch die Wiederaufnahme in die Nervenendigungen, eine geringe Verdünnung und den Metabolismus durch Monoaminoxidase und Katechol-O-Methyl-Transferase beendet. ⓘ
Geschichte
Extrakte aus der Nebenniere wurden erstmals 1895 von dem polnischen Physiologen Napoleon Cybulski gewonnen. Diese Extrakte, die er nadnerczyna ("Adrenalin") nannte, enthielten Adrenalin und andere Katecholamine. Der amerikanische Augenarzt William H. Bates entdeckte die Verwendung von Adrenalin bei Augenoperationen vor dem 20. April 1896. 1897 findet John Jacob Abel (1857-1938), der Vater der modernen Pharmakologie, eine natürliche Substanz, die von den Nebennieren produziert wird und die er Epinephrin nennt. Als erstes identifiziertes Hormon ist es nach wie vor ein wichtiges Mittel der ersten Wahl zur Behandlung von Herzstillständen, schweren allergischen Reaktionen und anderen Erkrankungen. Der japanische Chemiker Jōkichi Takamine und sein Assistent Keizo Uenaka entdeckten Adrenalin im Jahr 1900 unabhängig voneinander. Im Jahr 1901 gelang es Takamine, das Hormon aus den Nebennieren von Schafen und Rindern zu isolieren und zu reinigen. Adrenalin wurde erstmals 1904 von Friedrich Stolz und Henry Drysdale Dakin unabhängig voneinander im Labor synthetisiert. ⓘ
Auch wenn Sekretin als erstes Hormon genannt wird, ist Adrenalin das eigentliche erste Hormon, da die Entdeckung der blutdrucksteigernden Wirkung von Nebennierenextrakt 1895 vor der von Sekretin im Jahr 1902 erfolgte. 1895 veröffentlichten George Oliver (1841-1915), ein Allgemeinmediziner aus North Yorkshire, und Edward Albert Schäfer (1850-1935), ein Physiologe am University College of London, eine Arbeit darüber, dass die aktive Komponente des Nebennierenextrakts, die den Anstieg des Blutdrucks und der Herzfrequenz verursacht, aus dem Medulla, nicht aber aus der Rinde der Nebenniere stammt. 1897 entdeckte John Jacob Abel (1857-1938) von der Johns Hopkins University, der erste Vorsitzende der ersten US-Abteilung für Pharmakologie, eine Verbindung namens Epinephrin mit der Molekularformel C17H15NO4. Abel behauptete, dass sein Prinzip aus dem Extrakt der Nebenniere aktiv sei. Im Jahr 1900 reinigte der japanische Chemiker Jōkichi Takamine (1854-1922) zusammen mit seinem Assistenten Keizo Uenaka [ja] (1876-1960) ein 2000-mal aktiveres Prinzip als Epinephrin aus der Nebenniere und nannte es Adrenalin mit der Summenformel C10H15NO3. Darüber hinaus reinigte Thomas Aldrich vom Parke-Davis Scientific Laboratory im Jahr 1900 Adrenalin auch unabhängig. Takamine und Parke-Davis erhielten später im Jahr 1901 beide das Patent für Adrenalin. Der Kampf um die Terminologie zwischen Adrenalin und Epinephrin wurde erst mit der ersten Entdeckung der Adrenalinstruktur durch Hermann Pauly (1870-1950) im Jahr 1903 und der ersten Adrenalinsynthese durch den deutschen Chemiker Friedrich Stolz (1860-1936) im Jahr 1904 beendet. Beide glaubten, dass die Verbindung von Takamine das aktive Prinzip und die von Abel das inaktive war. ⓘ
Gesellschaft und Kultur
Adrenalin-Junkie
Ein Adrenalinjunkie ist eine Person, die auf der Suche nach Sensationen ist und ohne Rücksicht auf körperliche, soziale, rechtliche oder finanzielle Risiken neue und intensive Erfahrungen macht. Zu solchen Aktivitäten gehören extreme und riskante Sportarten, Drogenmissbrauch, ungeschützter Sex und Kriminalität. Der Begriff bezieht sich auf den Anstieg des zirkulierenden Adrenalinspiegels bei physiologischem Stress. Ein solcher Anstieg der zirkulierenden Adrenalinkonzentration ist auf die Aktivierung der sympathischen Nerven zurückzuführen, die das Nebennierenmark innervieren, da er schnell erfolgt und bei Tieren, denen die Nebenniere entfernt wurde, nicht auftritt. Obwohl ein solcher Stress die Adrenalinausschüttung auslöst, aktiviert er auch viele andere Reaktionen innerhalb des Belohnungssystems des Zentralnervensystems, das Verhaltensreaktionen steuert, so dass die zirkulierende Adrenalinkonzentration zwar vorhanden ist, aber möglicherweise nicht das Verhalten steuert. Dennoch erhöht die Adrenalininfusion allein die Wachsamkeit und spielt im Gehirn eine Rolle, unter anderem bei der Konsolidierung des Gedächtnisses. ⓘ
Stärke
Adrenalin wird mit großen Kraftleistungen in Verbindung gebracht, die oft in Krisenzeiten auftreten. Es gibt zum Beispiel Geschichten von Eltern, die einen Teil eines Autos anheben, während ihr Kind darunter eingeklemmt ist. ⓘ
Biosynthese und Abbau
Abbau
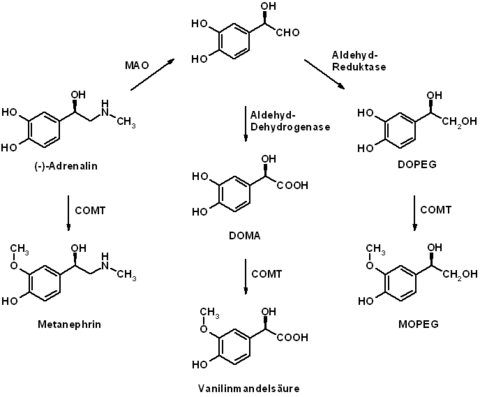
Adrenalin wird nach seiner Freisetzung relativ schnell wieder abgebaut. So beträgt die Plasmahalbwertszeit von Adrenalin bei intravenöser Gabe nur eine bis drei Minuten. Am Abbau von Adrenalin sind insbesondere die Enzyme Catechol-O-Methyltransferase (COMT) und Monoaminooxidase (MAO) beteiligt. Das durch O-Methylierung (COMT) gebildete primäre Abbauprodukt Metanephrin (siehe Metanephrine) besitzt bereits keine nennenswerte biologische Aktivität mehr. Durch weitere, insbesondere oxidative Stoffwechselprozesse unter Beteiligung der Monoaminooxidase ist eine Metabolisierung zu Vanillinmandelsäure und 3-Methoxy-4-hydroxyphenylethylenglykol (MOPEG) möglich. Diese Stoffwechselprodukte werden in konjugierter (z. B. als Sulfate) und unkonjugierter Form über den Urin ausgeschieden. Der zuverlässige qualitative und quantitative Nachweis aller Metabolite gelingt durch die Kopplung verschiedener chromatographischer Verfahren. ⓘ
Wirkungen
Adrenalin ist ein Stresshormon und schafft als solches die Voraussetzungen für die rasche Bereitstellung von Energiereserven, die in gefährlichen Situationen das Überleben sichern sollen (Kampf oder Flucht). Diese Effekte werden auf subzellularer Ebene durch Aktivierung der G-Protein-gekoppelten Adrenorezeptoren vermittelt. ⓘ
Herz-Kreislauf-System
Von besonderer Wichtigkeit ist die Wirkung von Adrenalin auf das Herz-Kreislauf-System. Hierzu zählt u. a. der Anstieg des zentralen Blutvolumens, der durch Kontraktion kleiner Blutgefäße, insbesondere in der Haut und in den Nieren, über die Aktivierung von α1-Adrenozeptoren geschieht. Zugleich wird eine β2-Adrenozeptor-vermittelte Erweiterung zentraler und muskelversorgender Blutgefäße beobachtet. ⓘ
Die Aktivierung von β1-Adrenozeptoren führt zu einer erhöhten Herzfrequenz (positiv chronotrope Wirkung), einer beschleunigten Erregungsleitung (positiv dromotrope Wirkung), einer erhöhten Kontraktilität (positiv inotrope Wirkung) und einer Senkung der Reizschwelle (positiv bathmotrope Wirkung). Diese Effekte verbessern die Herzleistung und tragen mit der Konstriktion kleiner Blutgefäße zur Erhöhung des Blutdrucks bei. Nach Vorbehandlung mit Alpha-Blockern führt Adrenalin jedoch zu einer paradoxen, therapeutisch genutzten Senkung des Blutdrucks (Adrenalinumkehr). Auch sehr niedrige Adrenalindosen (< 0,1 µg/kg) können eine leichte Senkung des Blutdrucks bewirken, die mit einer selektiven Aktivierung von β2-Adrenozeptoren der Blutgefäße erklärt wird. ⓘ
Chronisch erhöhte Adrenalinspiegel werden mit einer Hypertrophie des Herzens in Verbindung gebracht. ⓘ
Glatte Muskulatur, Atmung, Magen-Darm-Trakt, Harnblase
Neben der oben genannten Funktion auf das Herz-Kreislauf-System ist die Steigerung der Atmung und eine vorübergehende Inaktivierung nicht benötigter Prozesse, z. B. der Verdauung, im Rahmen der Stresshormonfunktion des Adrenalins von Bedeutung. Adrenalin führt über eine Aktivierung von β-Adrenozeptoren zu einer Erschlaffung der glatten Muskulatur. Dies hat beispielsweise eine Ruhigstellung des Magen-Darm-Trakts (Hemmung der Peristaltik) und eine Erweiterung der Bronchien zur Erleichterung der Atmung als Folge (β2-Adrenozeptoren). Ebenfalls über β2-Adrenozeptoren kann Adrenalin eine Relaxation des Uterus von Schwangeren bewirken. Andererseits kann Adrenalin in Organen, die vorwiegend α1-Adrenozeptoren exprimieren, eine Kontraktion der glatten Muskulatur vermitteln. So führt Adrenalin zu einer Kontraktion des Schließmuskels der Harnblase. ⓘ
Mobilisierung von Energiereserven
Die Freisetzung von Adrenalin aus der Nebenniere führt zu einer Mobilisierung von körpereigenen Energieträgern durch Steigerung des Fettabbaus (Lipolyse). Diese Lipolyse wird durch eine β-Adrenozeptor-vermittelte (vorwiegend β3-Adrenozeptoren) Aktivierung der hormonsensitiven Lipase katalysiert. Ebenso führt ein Anstieg des Adrenalinspiegels zu einer Freisetzung und Neubildung von Glucose und damit zu einem Anstieg des Blutzuckerspiegels (β2-Adrenozeptoren). Dieser Effekt wird durch α2-Adrenozeptor-vermittelte Hemmung der Insulinproduktionen und die β-Adrenozeptor-vermittelte Freisetzung von Glucagon verstärkt. Im Muskel kommt es durch Adrenalin zu verstärkter Glucose-Aufnahme. Adrenalin führt ebenfalls zu einer Erhöhung des Energieumsatzes (vorwiegend β2-Adrenozeptoren). ⓘ
Zentralnervensystem
Beobachtete zentralnervöse Effekte als Stresshormon werden als reflektorisch angesehen, da in der Nebenniere gebildetes Adrenalin die Blut-Hirn-Schranke nicht passieren kann. Ungeachtet dessen konnte in einigen Neuronen des Zentralnervensystems vor Ort produziertes Adrenalin als Neurotransmitter nachgewiesen werden. Diese Neurone kommen insbesondere in der Area reticularis superficialis ventrolateralis vor. Die Funktion dieser adrenergen Neurone ist nicht genau bekannt, jedoch wird eine Rolle bei der zentralen Blutdruckregulation und beim Barorezeptorreflex diskutiert. Das zentrale Nervensystem nimmt den Stressor wahr, daraufhin wird der Hypothalamus aktiv und aktiviert den Sympathicus. Dessen anregende Wirkung auf das Nebennierenmark bewirkt dessen Ausschüttung von Adrenalin und Noradrenalin. ⓘ
Sonstige Effekte
Als Folge einer Adrenalinfreisetzung oder einer lokalen Adrenalinanwendung können Schweißproduktion, Gänsehaut (pilomotorischer Reflex) und eine Pupillenerweiterung (Mydriasis) beobachtet werden. Zudem bekommt man auch einen trockenen Mund. Adrenalin ist ferner an der Blutgerinnung und Fibrinolyse beteiligt. ⓘ
Chemie
| Enantiomere von Adrenalin ⓘ | ||
| Name | (R)-Adrenalin | (S)-Adrenalin |
| Strukturformel | 
| |
| Andere Namen | L-Adrenalin (−)-Adrenalin |
D-Adrenalin (+)-Adrenalin |
| (RS)-Adrenalin DL-Adrenalin (±)-Adrenalin | ||
| CAS-Nummer | 51-43-4 | 150-05-0 |
| 329-65-7 (Racemat) | ||
| EG-Nummer | 200-098-7 | 205-752-5 |
| 206-347-6 (Racemat) | ||
| ECHA-Infocard | 100.000.090 | 100.005.230 |
| PubChem | 5816 | 247704 |
| 838 (Racemat) | ||
| Wikidata | Q132621 | Q27074317 |
| Q7279006 (Racemat) | ||

Adrenalin (chemisch: (R)-1-(3,4-Dihydroxyphenyl)-2-(N-methylamino)ethanol) gehört zur Gruppe der Katecholamine, zu der auch Noradrenalin und Dopamin zählen. Die wirksame Form (Eutomer) des Adrenalins besitzt stereochemisch eine (R)-Konfiguration [(R)-Adrenalin oder (−)-Adrenalin]. (R)-Adrenalin ist etwa 20- bis 50-mal wirksamer als (S)-Adrenalin. ⓘ
Synthese
Zur Synthese des Adrenalins sind in der Literatur mehrere Verfahren beschrieben. Das klassische Syntheseverfahren umfasst drei Schritte: Brenzkatechin (1) wird mit Chloressigsäurechlorid (2) zum 3,4-Dihydroxy-ω-chloracetophenon (3) acyliert. Die Reaktion entspricht indirekt der Friedel-Crafts-Acylierung, der bevorzugte Weg führt gleichwohl über die Ester-Zwischenstufe und schließt so eine Fries-Umlagerung mit ein. Die Aminierung des Chloracetophenons mit Methylamin ergibt das Adrenalon (4); die anschließende Reduktion liefert racemisches Adrenalin (5). Die Racematspaltung ist mit Hilfe von (2R,3R)-Weinsäure möglich. ⓘ

Alternativ kann man auch 3,4-Dimethoxybenzaldehyd mit Blausäure zum Cyanhydrin umsetzen, dessen Oxidation dann ein Nitriloketon liefert. Durch katalytische Reduktion entsteht ein Aminoketon, dessen schonende N-Methylierung liefert dann das sekundäre Amin. Durch Hydrolyse der Phenyletherfunktionen, Reduktion und Racematspaltung gelangt man dann zum Adrenalin. ⓘ
Handelsübliche Formen des Adrenalins sind auch das Hydrogentartrat und das Hydrochlorid. ⓘ
Stabilität
Wie alle Katecholamine ist Adrenalin oxidationsempfindlich. Ein Oxidationsprodukt des Adrenalins ist Adrenochrom. Für die Oxidation kann man Silber(I)-oxid (Ag2O) verwenden. Die Oxidation des Adrenalins kann auch in wässriger Lösung durch Spuren von Eisen- und Iodidionen katalysiert werden. Antioxidansien, wie z. B. Ascorbinsäure und Natriummetabisulfit können die Bildung von Adrenochrom verlangsamen. Die Geschwindigkeit der Oxidation ist darüber hinaus vom pH-Wert der Lösung abhängig. Als Stabilitätsoptimum gilt ein leicht saurer pH-Wert. ⓘ

Adrenalin als Arzneistoff
Anwendungsgebiete
In der Medizin wird Adrenalin vor allem als Notfallmedikament bei der Herz-Lungen-Wiederbelebung bei Herzstillstand und dem anaphylaktischen Schock eingesetzt. Es ist in verschiedenen Darreichungsformen erhältlich und verschreibungspflichtig. ⓘ
Notfallmedizin
Für die Anwendung in der Notfallmedizin wird Adrenalin intravenös, alternativ auch intraossär, früher auch endobronchial (erstmals 1967 beschrieben und 1974 etabliert) und intrakardial, verabreicht. In den aktuellen Empfehlungen des European Resuscitation Council wird die Gabe von Adrenalin bei der Reanimation als Standard empfohlen. In einer großen placebo-kontrollierten Studie konnte ein verbessertes Überleben durch Anwendung von Adrenalin bei der Reanimation außerhalb des Krankenhauses gezeigt werden, allerdings ging dies auch mit einer höheren Zahl von neurologischen Schäden einher. ⓘ
Ein weiteres Hauptanwendungsgebiet von Adrenalin in der Medizin ist der Kreislaufschock, beispielsweise bei anaphylaktischen Reaktionen oder Sepsis. Die Behandlung anaphylaktischer Reaktionen und des anaphylaktischen Schocks erfolgt über eine intramuskuläre Verabreichung von Adrenalin. Sollte im akuten Schockgeschehen keine Zustandsbesserung mit der intramuskulären Gabe erfolgen, kann Adrenalin auch intravenös titriert verabreicht werden. Für Patienten mit schwerwiegenden allergischen Reaktionen in der Vergangenheit (z. B. drohende Erstickung durch Anschwellen der Stimmritze (Glottisödem)) stehen Adrenalin-Fertigspritzen zur Verfügung, die dann von dem Betroffenen nach einer Allergenexposition mit beginnender Symptomatik selbst appliziert werden können. ⓘ
Für die Anwendung in der Herz-Lungen-Wiederbelebung und beim Schock stehen die den Blutkreislauf zentralisierenden Wirkungen des Adrenalins im Vordergrund. Durch eine Aktivierung von α1-Adrenozeptoren wird eine Konstriktion kleiner Blutgefäße in der Haut und in den Nieren erreicht, während große zentrale Blutgefäße erweitert werden. Auf diese Weise soll Adrenalin den koronaren und zerebralen Perfusionsdruck steigern. ⓘ
Atemwegserkrankungen
Für die Anwendung als Zusatzmedikation bei der akuten Laryngitis subglottica („Pseudo-Krupp“) steht Adrenalin als Lösung zur Inhalation zur Verfügung. Bis 2002 waren in Deutschland Adrenalin-haltige Inhalationspräparate auch für die Akutbehandlung des Asthma bronchiale zugelassen. Mit Inkrafttreten des FCKW-Verbots wurden diese jedoch vom Markt genommen. Die inhalative Anwendung anderer Adrenalinpräparate zur Akutbehandlung asthmatischer Beschwerden ist somit außerhalb der arzneimittelrechtlichen Zulassung und entspricht einem Off-Label-Use. ⓘ
Die Anwendung des Adrenalins bei Atemwegserkrankungen basiert auf seiner bronchienrelaxierenden Wirkung, die über eine Aktivierung von β2-Adrenozeptoren vermittelt wird. Systemische Nebenwirkungen nach Resorption müssen jedoch in Kauf genommen werden. ⓘ
Lokale Vasokonstriktion
Adrenalin kann weiterhin zur lokalen Gefäßverengung bei Blutungen eingesetzt werden. Die gefäßverengende Wirkung wird auch zum Schließen von Cuts im Boxsport verwendet. Diese vasokonstriktive Wirkung beruht auf einer Aktivierung von α1-Adrenozeptoren kleiner Blutgefäße in der Haut und im Muskelgewebe und ihrer darauf folgenden Verengung. ⓘ
Verdünntes Adrenalin (etwa als 1:1000 bzw. 1:5000 verdünnte Suprarenin-Lösung) wird ferner, nachdem der Chirurg Heinrich Braun Untersuchungen mit Kokain dazu angestellt hatte, seit Beginn des 20. Jahrhunderts als vasokonstriktiver Zusatz zu Lokalanästhetika verwendet, um deren Abtransport zu verlangsamen und damit ihre Wirkungsdauer zu verlängern und auch die Toxizität zu verringern. ⓘ
Antidot
Adrenalin ist das Mittel der zweiten Wahl bei Betablockervergiftungen und kann eingesetzt werden, wenn kein spezifischer β-Agonist zur Verfügung steht. Für diese Notfallanwendung besteht jedoch ebenfalls keine arzneimittelrechtliche Zulassung (Off-Label-Use). ⓘ
Nebenwirkungen
Die Nebenwirkungen des Adrenalins entsprechen weitgehend seinen Hauptwirkungen und sind auf dessen Bedeutung als Stresshormon zurückzuführen. Adrenalin führt zu einer Kontraktion kleiner Blutgefäße, insbesondere der Haut und der Nieren, verbunden mit einem Blutdruckanstieg und, insbesondere bei lokaler Anwendung, vereinzelten Nekrosen. Bei systemischer Anwendung stehen kardiale Nebenwirkungen, wie z. B. Herzinsuffizienz, Angina-pectoris-Anfälle, Herzinfarkt, tachykarde Herzrhythmusstörungen, bis hin zum Kammerflimmern und Herzstillstand im Vordergrund. Daher ist seine Anwendung teilweise umstritten. Die systemische Anwendung von Adrenalin kann darüber hinaus eine Erhöhung des Blutzuckerspiegels (Hyperglykämie), eine Erniedrigung des Kaliumspiegels (Hypokaliämie), eine metabolische Azidose und eine Absenkung der Magnesiumkonzentration (Hypomagnesiämie) zur Folge haben. Des Weiteren können Mydriasis, Miktionsschwierigkeiten, Speichelfluss, Schwitzen bei gleichzeitigem Kältegefühl in den Extremitäten, Übelkeit, Erbrechen, Schwindel und Kopfschmerz beobachtet werden. Als psychische Nebenwirkungen durch den Einsatz von Adrenalin können Ruhelosigkeit, Nervosität, Angst, Halluzinationen, Krämpfe bis hin zu Psychosen auftreten. ⓘ
Wechselwirkungen
Einige Inhalationsanästhetika, die das Herz für Katecholamine sensibilisieren, führen zu einer verstärkten Wirkung von Adrenalin am Herz und somit zu einer erhöhten Gefahr von Herzinsuffizienz, Angina-pectoris-Anfällen, Herzinfarkt und tachykarden Herzrhythmusstörungen. ⓘ
Die Wirkungen und Nebenwirkungen von Adrenalin können ebenfalls durch eine Hemmung des Adrenalinabbaus oder einer vermehrten (Nor-)Adrenalinfreisetzung verstärkt werden. Dies ist insbesondere bei gleichzeitiger Anwendung von MAO-Hemmern, Levodopa, L-Thyroxin, Theophyllin, trizyklischen Antidepressiva und Reserpin zu beobachten. ⓘ
Adrenalin seinerseits hemmt die blutdrucksenkende Wirkung von Alphablockern und die kardialen Effekte der Betablocker. Da Adrenalin zu einem Anstieg des Blutzuckerspiegels führt, ist die Wirkung oraler Antidiabetika herabgesetzt. ⓘ
Dosierung
Adrenalin wird als Lösung intravenös verabreicht. Typischerweise ist die Konzentration in einer Ampulle 1 mg/ml (auch als Adrenalinlösung 1:1.000 oder Adrenalinlösung 0,1%ig bezeichnet). Je nach Anwendungsgebiet ist es gebräuchlich, im Verhältnis 1:10 mit 0,9 % Natriumchloridlösung zu verdünnen (dann als Adrenalinlösung 1:10.000 oder Adrenalinlösung 0,01%ig bezeichnet). Die Reanimationsdosis beträgt 1 mg alle 3–5 Minuten. In der Intensivmedizin und zur Behandlung eines Low-output-Syndroms wird bei Erwachsenen eine Dosierung von 2–20 µg/min eingesetzt. ⓘ
Handelsnamen nach Darreichungsform

Ampullen (Injektionslösung)
- Suprarenin (D)
- Adrenalin 1:1000 Infectopharm (D)
- sowie Generika (A, CH)
Autoinjektoren (Injektionslösung in Fertigpen)
- Emerade (D)
- EpiPen (A, CH)
- Fastjekt (D)
- Jext (D, A, CH, NL, DK, E, I, FIN, N, SLO, S, UK)
- Anapen (D, A, CH) – Lincoln Medical Limited rief am 5. Juni 2012 alle noch haltbaren Chargen wegen möglicher Nichtabgabe von Adrenalin zurück.
Inhalationslösung
- InfectoKrupp Inhal (D) ⓘ

