Ozon

| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Ozon
| |||
| Systematische IUPAC-Bezeichnung
Trisauerstoff | |||
| Andere Namen
2λ4-Trioxidien; Catena-Tri-Sauerstoff
| |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin-Referenz
|
1101 | ||
IUPHAR/BPS
|
|||
| MeSH | Ozon | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
O3 | ||
| Molekulare Masse | 47,997 g-mol-1 | ||
| Erscheinungsbild | Farbloses bis blassblaues Gas | ||
| Geruch | Stechend | ||
| Dichte | 2,144 mg cm-3 (bei 0 °C) | ||
| Schmelzpunkt | -192,2 °C; -313,9 °F; 81,0 K | ||
| Siedepunkt | -112 °C; -170 °F; 161 K | ||
Löslichkeit in Wasser
|
1,05 g L-1 (bei 0 °C) | ||
| Löslichkeit in anderen Lösungsmitteln | Sehr gut löslich in CCl4, Schwefelsäure | ||
| Dampfdruck | 55,7 atm (-12,15 °C oder 10,13 °F oder 261,00 K) | ||
Magnetische Suszeptibilität (χ)
|
+6,7-10-6 cm3/mol | ||
Brechungsindex (nD)
|
1,2226 (Flüssigkeit), 1,00052 (Gas, STP, 546 nm - beachten Sie die hohe Dispersion) | ||
| Struktur | |||
Raumgruppe
|
C2v | ||
Koordinationsgeometrie
|
Digonal | ||
Molekulare Form
|
Dihedral | ||
| Hybridisierung | sp2 für O1 | ||
Dipolmoment
|
0.53 D | ||
| Thermochemie | |||
Std. molare
Entropie (S |
238,92 J K-1 mol-1 | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
142,67 kJ mol-1 | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
    
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H270, H314 | ||
| NFPA 704 (Feuerdiamant) | |||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LCLo (niedrigste veröffentlichte)
|
12,6 ppm (Maus, 3 Std.) 50 ppm (Mensch, 30 min) 36 ppm (Kaninchen, 3 Std.) 21 ppm (Maus, 3 Std.) 21,8 ppm (Ratte, 3 Std.) 24,8 ppm (Meerschweinchen, 3 Std.) 4,8 ppm (Ratte, 4 Std.) | ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
TWA 0,1 ppm (0,2 mg/m3) | ||
REL (Empfohlen)
|
C 0,1 ppm (0,2 mg/m3) | ||
IDLH (Unmittelbare Gefahr)
|
5 ppm | ||
| Verwandte Verbindungen | |||
Verwandte Verbindungen
|
Schwefeldioxid Trischwefel Disulfurmonoxid Zyklisches Ozon | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Ozon (/ˈoʊzoʊn/), auch Trisauerstoff, ist ein anorganisches Molekül mit der chemischen Formel O
3. Es ist ein blassblaues Gas mit einem deutlich stechenden Geruch. Es ist ein Allotrop des Sauerstoffs, das viel weniger stabil ist als das zweiatomige Allotrop O
2 und zerfällt in der unteren Atmosphäre zu O
2 (Dioxygen) zerfällt. Ozon entsteht aus Dioxygen durch die Einwirkung von ultraviolettem (UV) Licht und elektrischen Entladungen in der Erdatmosphäre. Es ist in sehr geringen Konzentrationen in der gesamten Erdatmosphäre vorhanden, wobei die höchste Konzentration in der Ozonschicht der Stratosphäre zu finden ist, die den größten Teil der ultravioletten (UV-)Strahlung der Sonne absorbiert. ⓘ
Der Geruch von Ozon erinnert an Chlor und kann von vielen Menschen bereits bei Konzentrationen von 0,1 ppm in der Luft wahrgenommen werden. Die O3-Struktur von Ozon wurde im Jahr 1865 bestimmt. Später wurde nachgewiesen, dass das Molekül eine gebogene Struktur hat und schwach diamagnetisch ist. Unter Standardbedingungen ist Ozon ein hellblaues Gas, das bei Tiefsttemperaturen zu einer dunkelblauen Flüssigkeit und schließlich zu einem violettschwarzen Feststoff kondensiert. Die Instabilität von Ozon im Vergleich zum gebräuchlicheren Sauerstoff ist so groß, dass sich sowohl konzentriertes als auch flüssiges Ozon bei erhöhten Temperaturen, physikalischen Schocks oder schneller Erwärmung bis zum Siedepunkt explosionsartig zersetzen kann. Daher wird es im Handel nur in geringen Konzentrationen verwendet. ⓘ
Ozon ist ein starkes Oxidationsmittel (weitaus stärker als Dioxygen) und wird in vielen Bereichen der Industrie und des Verbrauchers als Oxidationsmittel eingesetzt. Aufgrund seines hohen Oxidationspotenzials schädigt Ozon jedoch ab einer Konzentration von etwa 0,1 ppm die Schleimhäute und das Gewebe der Atemwege von Tieren und auch von Pflanzen. Während dies Ozon in Bodennähe zu einer starken Gefahr für die Atemwege und zu einem Schadstoff macht, ist eine höhere Konzentration in der Ozonschicht (zwischen zwei und acht ppm) von Vorteil, da sie verhindert, dass schädliches UV-Licht die Erdoberfläche erreicht. ⓘ
Ozon (von altgriechisch ὄζειν ozein „riechen“, ὄζον ozon: wörtlich „das Riechende“) ist ein aus drei Sauerstoffatomen (O) aufgebautes Molekül (O3) und das daraus bestehende farblose bis bläuliche, in hoher Konzentration tiefblaue Gas von charakteristischem Geruch. Ozonmoleküle in der Luft zerfallen unter Normalbedingungen innerhalb einiger Tage zu biatomarem, das heißt aus zwei Sauerstoffatomen bestehendem, Sauerstoff (O2). ⓘ
Die Ozonschicht in der Stratosphäre schützt die Lebewesen auf der Erde vor Schädigungen durch energiereiche mutagene ultraviolette Strahlung der Sonne. ⓘ
Nomenklatur
Der Trivialname Ozon ist der am häufigsten verwendete und bevorzugte IUPAC-Name. Die systematischen Namen 2λ4-Trioxidien und Catena-Tri-Sauerstoff, gültige IUPAC-Namen, sind nach der substitutiven bzw. additiven Nomenklatur aufgebaut. Der Name Ozon leitet sich von ozein (ὄζειν), dem griechischen Verb für Geruch, ab und bezieht sich auf den charakteristischen Geruch von Ozon. ⓘ
In geeigneten Kontexten kann Ozon als Trioxidan betrachtet werden, bei dem zwei Wasserstoffatome entfernt wurden, und als solches kann Trioxidanyliden als systematischer Name gemäß der Substitutionsnomenklatur verwendet werden. Bei diesen Bezeichnungen wird die Radikalität des Ozonmoleküls standardmäßig nicht berücksichtigt. In einem noch spezifischeren Kontext kann damit auch der nichtradikalische Singulett-Grundzustand bezeichnet werden, während der diradikalische Zustand als Trioxidandiyl bezeichnet wird. ⓘ
Trioxidandiyl (oder Ozonid) wird unsystematisch als Bezeichnung für die Substituentengruppe (-OOO-) verwendet. Es sollte darauf geachtet werden, dass der Name der Gruppe nicht mit dem oben genannten kontextspezifischen Namen für Ozon verwechselt wird. ⓘ
Geschichte


Im Jahr 1785 führte der niederländische Chemiker Martinus van Marum Experimente mit elektrischen Funken über Wasser durch, als er einen ungewöhnlichen Geruch bemerkte, den er den elektrischen Reaktionen zuschrieb, ohne zu erkennen, dass er tatsächlich Ozon erzeugt hatte. ⓘ
Ein halbes Jahrhundert später bemerkte Christian Friedrich Schönbein denselben stechenden Geruch und erkannte ihn als den Geruch, der häufig nach einem Blitzschlag auftritt. 1839 gelang es ihm, die gasförmige Chemikalie zu isolieren, und er gab ihr den Namen "Ozon", abgeleitet von dem griechischen Wort ozein (ὄζειν), das "riechen" bedeutet. Aus diesem Grund wird Schönbein allgemein die Entdeckung des Ozons zugeschrieben. Die Formel für Ozon, O3, wurde erst 1865 von Jacques-Louis Soret bestimmt und 1867 von Schönbein bestätigt. ⓘ
In der zweiten Hälfte des 19. Jahrhunderts und bis weit ins 20. Jahrhundert hinein wurde Ozon von Naturforschern und Gesundheitssuchenden als gesunder Bestandteil der Umwelt angesehen. Beaumont, Kalifornien, hatte als offiziellen Slogan "Beaumont: Zone of Ozone", wie auf Postkarten und dem Briefkopf der Handelskammer zu lesen ist. Naturforscher, die in der freien Natur arbeiteten, hielten die höheren Lagen wegen ihres Ozongehalts oft für vorteilhaft. "Es herrscht eine ganz andere Atmosphäre [in höheren Lagen] mit genügend Ozon, um die nötige Energie [für die Arbeit] zu erhalten", schrieb der Naturforscher Henry Henshaw, der auf Hawaii arbeitete. Die Luft am Meer galt wegen ihres angeblichen Ozongehalts als gesund. Der Geruch, der zu diesem Glauben führte, ist in Wirklichkeit der von halogenierten Algenmetaboliten und Dimethylsulfid. ⓘ
Ein Großteil der Anziehungskraft von Ozon scheint auf seinen "frischen" Geruch zurückzuführen zu sein, der Assoziationen mit reinigenden Eigenschaften weckte. Wissenschaftler erkannten seine schädlichen Auswirkungen. Im Jahr 1873 dokumentierten James Dewar und John Gray McKendrick, dass Frösche träge wurden, Vögel nach Luft schnappten und das Blut von Kaninchen einen verminderten Sauerstoffgehalt aufwies, nachdem sie "ozonisierter Luft" ausgesetzt waren, die "eine zerstörerische Wirkung ausübte". Schönbein selbst berichtet, dass beim Einatmen von Ozon Brustschmerzen, Schleimhautreizungen und Atembeschwerden auftreten und kleine Säugetiere sterben. 1911 stellten Leonard Hill und Martin Flack in den Proceedings of the Royal Society B fest, dass die gesundheitsfördernden Wirkungen von Ozon "durch bloße Wiederholung zu einem festen Bestandteil des allgemeinen Glaubens geworden sind; und doch fehlte es bisher fast völlig an exakten physiologischen Beweisen für seine guten Wirkungen ... Das einzige gründlich gesicherte Wissen über die physiologische Wirkung von Ozon, das bisher erlangt wurde, ist, dass es Reizungen und Ödeme der Lunge verursacht und zum Tod führt, wenn es in relativ starker Konzentration für eine gewisse Zeit eingeatmet wird." ⓘ
Während des Ersten Weltkriegs wurde Ozon im Queen Alexandra Military Hospital in London als mögliches Desinfektionsmittel für Wunden getestet. Das Gas wurde bis zu 15 Minuten lang direkt auf Wunden aufgetragen. Dabei wurden sowohl die Bakterienzellen als auch das menschliche Gewebe geschädigt. Andere Desinfektionsverfahren, wie die Spülung mit Antiseptika, wurden für besser befunden. ⓘ
Bis in die 1920er Jahre war nicht sicher, ob kleine Mengen von Oxozon, O
4, in Ozonproben vorhanden waren, da es schwierig war, analytische chemische Verfahren auf die explosive, konzentrierte Chemikalie anzuwenden. Im Jahr 1923 gelang es Georg-Maria Schwab (im Rahmen seiner Doktorarbeit bei Ernst Hermann Riesenfeld) als erstem, Ozon zu verfestigen und genaue Analysen durchzuführen, die die Oxozon-Hypothese eindeutig widerlegten. Weitere bis dahin nicht gemessene physikalische Eigenschaften von reinem, konzentriertem Ozon wurden in den 1920er Jahren von der Riesenfeld-Gruppe bestimmt. ⓘ
Im Jahre 1839 beschrieb Christian Friedrich Schönbein erstmals die einzigartige Erscheinung, dass ein chemisches Element in Gasform in zwei verschiedenen molekularen Formen nebeneinander beständig ist – Ozon und Disauerstoff. Zunächst erschien diese Tatsache aber zu eigenartig, als dass die einfache Deutung Schönbeins, eine Allotropie im Gaszustand, allgemeine Anerkennung gefunden hätte. ⓘ
Die Abbaureaktionen von Ozon durch Stickoxide beschrieb 1970 erstmals Paul Josef Crutzen (Nobelpreis für Chemie 1995). ⓘ
Physikalische Eigenschaften
Ozon ist ein farbloses oder blassblaues Gas, das in Wasser wenig und in inerten, unpolaren Lösungsmitteln wie Tetrachlorkohlenstoff oder Fluorkohlenwasserstoffen, in denen es eine blaue Lösung bildet, sehr viel besser löslich ist. Bei 161 K (-112 °C; -170 °F) kondensiert es und bildet eine dunkelblaue Flüssigkeit. Es ist gefährlich, diese Flüssigkeit bis zum Siedepunkt erwärmen zu lassen, da sowohl konzentriertes gasförmiges Ozon als auch flüssiges Ozon detonieren können. Bei Temperaturen unter 80 K (-193,2 °C; -315,7 °F) bildet es einen violett-schwarzen Feststoff. ⓘ
Die meisten Menschen können etwa 0,01 μmol/mol Ozon in der Luft nachweisen, wo es einen sehr spezifischen, scharfen Geruch hat, der an Chlorbleiche erinnert. Eine Exposition von 0,1 bis 1 μmol/mol verursacht Kopfschmerzen, brennende Augen und Reizungen der Atemwege. Selbst niedrige Konzentrationen von Ozon in der Luft sind sehr schädlich für organische Materialien wie Latex, Kunststoffe und tierisches Lungengewebe. ⓘ
Ozon ist schwach diamagnetisch. ⓘ
Struktur
Nach experimentellen Erkenntnissen aus der Mikrowellenspektroskopie ist Ozon ein gebogenes Molekül mit C2v-Symmetrie (ähnlich dem Wassermolekül). Die O - O Abstände betragen 127,2 pm (1,272 Å). Der O - O - O Winkel beträgt 116,78°. Das Zentralatom ist sp²-hybridisiert mit einem einsamen Paar. Ozon ist ein polares Molekül mit einem Dipolmoment von 0,53 D. Das Molekül kann als Resonanzhybrid mit zwei beteiligten Strukturen dargestellt werden, die jeweils eine Einfachbindung auf der einen und eine Doppelbindung auf der anderen Seite aufweisen. Die Anordnung weist eine Gesamtbindungsordnung von 1,5 für beide Seiten auf. Sie ist isoelektronisch mit dem Nitritanion. Natürlich vorkommendes Ozon kann aus substituierten Isotopen (16O, 17O, 18O) zusammengesetzt sein. Eine zyklische Form wurde vorhergesagt, aber nicht beobachtet. ⓘ

Reaktionen
Ozon ist eines der stärksten bekannten Oxidationsmittel, weit stärker als O2. Außerdem ist es in hohen Konzentrationen instabil und zerfällt in gewöhnlichen zweiatomigen Sauerstoff. Seine Halbwertszeit variiert mit den atmosphärischen Bedingungen wie Temperatur, Luftfeuchtigkeit und Luftbewegung. Unter Laborbedingungen beträgt die Halbwertszeit (HLT) durchschnittlich ~ 1500 Minuten (25 Stunden) in ruhender Luft bei Raumtemperatur (24 °C), null Luftfeuchtigkeit und null Luftwechsel pro Stunde (ACH). In einer typischen Büro- oder Wohnumgebung, in der der Luftwechsel pro Stunde zwischen 5 und 8 ACH liegt, hat Ozon eine Halbwertszeit von nur dreißig Minuten. ⓘ
- 2 O
3 → 3 O
2 ⓘ
Diese Reaktion läuft mit zunehmender Temperatur schneller ab. Die Verpuffung von Ozon kann durch einen Funken ausgelöst werden und kann bei Ozonkonzentrationen von 10 Gew.-% oder mehr auftreten. ⓘ
Ozon kann auch aus Sauerstoff an der Anode einer elektrochemischen Zelle erzeugt werden. Bei dieser Reaktion können kleinere Mengen Ozon für Forschungszwecke erzeugt werden. ⓘ
- O
3(g) + 2H+ + 2e- ⇌ O
2(g) + H
2O E°= 2,075V ⓘ
Dies kann als unerwünschte Reaktion in einem Hoffman-Gasapparat bei der Elektrolyse von Wasser beobachtet werden, wenn die Spannung über der erforderlichen Spannung eingestellt wird. ⓘ
Mit Metallen
Ozon oxidiert die meisten Metalle (außer Gold, Platin und Iridium) zu Oxiden der Metalle in ihrer höchsten Oxidationsstufe. Zum Beispiel:
- Cu + O
3 → CuO + O
2 ⓘ
- Ag + O
3 → AgO + O
2 ⓘ
Mit Stickstoff- und Kohlenstoffverbindungen
Ozon oxidiert auch Stickstoffoxid zu Stickstoffdioxid:
- NO + O
3 → NO
2 + O
2
Diese Reaktion wird von Chemilumineszenz begleitet. Das NO
2 kann weiter zu einem Nitratradikal oxidiert werden:
- NO .
2 + O
3 → NO
3 + O
2
Das NO
3 bildet, kann mit NO
2 unter Bildung von N
2O
5. ⓘ
Festes Nitroniumperchlorat kann aus NO2, ClO2 und O
3-Gasen hergestellt werden:
- NO .
2 + ClO
2 + 2 O
3 → NO
2ClO
4 + 2 O
2 ⓘ
Ozon reagiert nicht mit Ammoniumsalzen, aber es oxidiert Ammoniak zu Ammoniumnitrat:
- 2 NH
3 + 4 O
3 → NH
4NO
3 + 4 O
2 + H
2O ⓘ
Ozon reagiert mit Kohlenstoff zu Kohlendioxid, auch bei Raumtemperatur:
- C + 2 O
3 → CO
2 + 2 O
2 ⓘ
Mit schwefelhaltigen Verbindungen
Ozon oxidiert Sulfide zu Sulfaten. Zum Beispiel wird Blei(II)sulfid zu Blei(II)sulfat oxidiert:
- PbS + 4 O3 → PbSO4 + 4 O2 ⓘ
Schwefelsäure kann aus Ozon, Wasser und entweder elementarem Schwefel oder Schwefeldioxid hergestellt werden:
- S + H2O + O3 → H2SO4
- 3 SO2 + 3 H2O + O3 → 3 H2SO4 ⓘ
In der Gasphase reagiert Ozon mit Schwefelwasserstoff und bildet Schwefeldioxid:
- H2S + O3 → SO2 + H2O ⓘ
In einer wässrigen Lösung finden jedoch zwei konkurrierende gleichzeitige Reaktionen statt, eine zur Bildung von elementarem Schwefel und eine zur Bildung von Schwefelsäure:
- H2S + O3 → S + O2 + H2O
- 3 H2S + 4 O3 → 3 H2SO4 ⓘ
Mit Alkenen und Alkinen
Alkene können durch Ozon oxidativ gespalten werden, wobei Alkohole, Aldehyde, Ketone und Carbonsäuren entstehen, je nach dem zweiten Schritt der Aufarbeitung. ⓘ
Ozon kann auch Alkine unter Bildung eines Säureanhydrids oder eines Diketonprodukts spalten. Wenn die Reaktion in Gegenwart von Wasser durchgeführt wird, hydrolysiert das Anhydrid zu zwei Carbonsäuren. ⓘ
In der Regel wird die Ozonolyse in einer Lösung von Dichlormethan bei einer Temperatur von -78 °C durchgeführt. Nach einer Abfolge von Spaltungen und Umlagerungen entsteht ein organisches Ozonid. Bei reduktiver Aufarbeitung (z. B. Zink in Essigsäure oder Dimethylsulfid) entstehen Ketone und Aldehyde, bei oxidativer Aufarbeitung (z. B. wässriges oder alkoholisches Wasserstoffperoxid) werden Carbonsäuren gebildet. ⓘ
Andere Substrate
Alle drei Atome des Ozons können ebenfalls reagieren, wie bei der Reaktion von Zinn(II)-chlorid mit Salzsäure und Ozon:
Iodperchlorat kann durch Behandlung von in kalter wasserfreier Perchlorsäure gelöstem Iod mit Ozon hergestellt werden:
Ozon kann auch mit Kaliumiodid reagieren, wobei Sauerstoff und Jodgas entstehen, das zur quantitativen Bestimmung titriert werden kann:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{2KI + O3 + H2O -> 2KOH + O2 + I2 <span title="Aus: Englische Wikipedia, Abschnitt "Other substrates"" class="plainlinks">[https://en.wikipedia.org/wiki/Ozone#Other_substrates <span style="color:#dddddd">ⓘ</span>]</span>}}
Verbrennung
Ozon kann für Verbrennungsreaktionen und brennbare Gase verwendet werden; Ozon liefert höhere Temperaturen als die Verbrennung in Dioxygen (O2). Im Folgenden wird eine Reaktion für die Verbrennung von Kohlenstoffsubnitrid beschrieben, die ebenfalls zu höheren Temperaturen führen kann:
- 3 C
4N
2 + 4 O
3 → 12 CO + 3 N
2 ⓘ
Ozon kann bei kryogenen Temperaturen reagieren. Bei 77 K (-196,2 °C; -321,1 °F) reagiert atomarer Wasserstoff mit flüssigem Ozon unter Bildung eines Wasserstoffsuperoxidradikals, das dimerisiert:
- H + O
3 → HO2 + O - 2 HO2 → H
2O
4 ⓘ
Zersetzung von Ozon
Arten der Ozonzersetzung
Ozon ist eine giftige Substanz, die häufig in menschlicher Umgebung vorkommt oder erzeugt wird (Flugzeugkabinen, Büros mit Fotokopierern, Laserdruckern, Sterilisatoren...), und ihr katalytischer Abbau ist sehr wichtig, um die Umweltverschmutzung zu verringern. Diese Art der Zersetzung ist die am weitesten verbreitete, vor allem mit festen Katalysatoren, und sie hat viele Vorteile wie eine höhere Umwandlung bei niedrigerer Temperatur. Außerdem können das Produkt und der Katalysator sofort getrennt werden, so dass der Katalysator leicht zurückgewonnen werden kann, ohne dass ein Trennverfahren erforderlich ist. Die am häufigsten verwendeten Materialien für die katalytische Zersetzung von Ozon in der Gasphase sind Edelmetalle wie Pt, Rh oder Pd und Übergangsmetalle wie Mn, Co, Cu, Fe, Ni oder Ag. ⓘ
Es gibt zwei weitere Möglichkeiten für die Zersetzung von Ozon in der Gasphase: Bei der ersten handelt es sich um eine thermische Zersetzung, bei der das Ozon nur durch die Einwirkung von Wärme zersetzt werden kann. Das Problem ist, dass diese Art der Zersetzung bei Temperaturen unter 250 °C sehr langsam ist. Die Zersetzungsrate kann jedoch bei höheren Temperaturen gesteigert werden, was jedoch mit hohen Energiekosten verbunden ist. ⓘ
Die zweite Art der Zersetzung ist die photochemische Zersetzung, bei der Ozon mit ultravioletter Strahlung (UV) bestrahlt wird und Sauerstoff und radikale Peroxide entstehen. ⓘ
Kinetik der Zersetzung von Ozon in molekularen Sauerstoff
Der Prozess der Ozonzersetzung ist eine komplexe Reaktion, an der zwei Elementarreaktionen beteiligt sind, die schließlich zu molekularem Sauerstoff führen, und das bedeutet, dass die Reaktionsreihenfolge und das Geschwindigkeitsgesetz nicht durch die Stöchiometrie der angepassten Gleichung bestimmt werden können. ⓘ
Gesamtreaktion: 2 O3 → 3 O2 ⓘ
Geschwindigkeitsgesetz (beobachtet): V = K - [O3]2 - [O2]-1 ⓘ
Es wurde festgestellt, dass die Ozonzersetzung einer Kinetik erster Ordnung folgt, und aus dem obigen Geschwindigkeitsgesetz lässt sich ableiten, dass die partielle Ordnung in Bezug auf molekularen Sauerstoff -1 und in Bezug auf Ozon 2 ist, so dass die globale Reaktionsordnung 1 ist. ⓘ
Die Zersetzung von Ozon besteht aus zwei elementaren Schritten: Der erste entspricht einer unimolekularen Reaktion, da ein einziges Ozonmolekül in zwei Produkte (molekularer Sauerstoff und Sauerstoff) zerfällt. Der Sauerstoff aus dem ersten Schritt ist ein Zwischenprodukt, da er als Reaktant am zweiten Schritt teilnimmt, der eine bimolekulare Reaktion ist, da zwei verschiedene Reaktanten (Ozon und Sauerstoff) zu einem Produkt führen, das dem molekularen Sauerstoff in der Gasphase entspricht. ⓘ
Schritt 1: Unimolekulare Reaktion O3 → O2 + O ⓘ
Schritt 2: Bimolekulare Reaktion O3 + O → 2 O2 ⓘ
Diese beiden Schritte haben unterschiedliche Reaktionsgeschwindigkeiten, wobei der erste Schritt reversibel und schneller ist als der zweite, der langsamer abläuft, was bedeutet, dass der entscheidende Schritt die zweite Reaktion ist und diese zur Bestimmung der beobachteten Reaktionsgeschwindigkeit herangezogen wird. Die Reaktionsgeschwindigkeitsgesetze für jeden Schritt lauten wie folgt: V1 = K1 - [O3] V2 = K2 - [O] - [O3] ⓘ
Mit dem folgenden Mechanismus lässt sich das Geschwindigkeitsgesetz der experimentell beobachteten Ozonzersetzung erklären, und er ermöglicht auch die Bestimmung der Reaktionsreihenfolge in Bezug auf Ozon und Sauerstoff, mit der die Gesamtreaktionsreihenfolge bestimmt wird. Der langsamere Schritt, die bimolekulare Reaktion, ist derjenige, der die Geschwindigkeit der Produktbildung bestimmt, und wenn man bedenkt, dass bei diesem Schritt zwei Sauerstoffmoleküle entstehen, hat das Geschwindigkeitsgesetz folgende Form: V = 2 K2 - [O] - [O3] ⓘ
Diese Gleichung hängt jedoch von der Konzentration des Sauerstoffs (Zwischenprodukt) ab, die anhand des ersten Schritts bestimmt werden kann. Da der erste Schritt schneller und reversibel und der zweite Schritt langsamer ist, befinden sich die Reaktanten und Produkte des ersten Schritts im Gleichgewicht, so dass die Konzentration des Zwischenprodukts wie folgt bestimmt werden kann: ⓘ
Unter Verwendung dieser Gleichungen ergibt sich die Bildungsrate von molekularem Sauerstoff wie unten dargestellt: ⓘ
Der vorgestellte Mechanismus ermöglicht es schließlich, die experimentell beobachtete Geschwindigkeit mit einer Geschwindigkeitskonstante (Kobs), die einer Kinetik erster Ordnung entspricht, wie folgt zu bestimmen: ⓘ
wobei ⓘ
Reduktion zu Ozoniden
Bei der Reduktion von Ozon entsteht das Ozonid-Anion, O-
3. Derivate dieses Anions sind explosiv und müssen bei Tiefsttemperaturen gelagert werden. Ozonide für alle Alkalimetalle sind bekannt. KO3, RbO3 und CsO3 können aus ihren jeweiligen Superoxiden hergestellt werden:
- KO2 + O3 → KO3 + O2
Obwohl KO3 wie oben beschrieben gebildet werden kann, kann es auch aus Kaliumhydroxid und Ozon gebildet werden:
- 2 KOH + 5 O3 → 2 KO3 + 5 O2 + H2O
NaO3 und LiO3 müssen durch Einwirkung von CsO3 in flüssigem NH3 auf ein Ionenaustauscherharz mit Na+- oder Li+-Ionen hergestellt werden:
- CsO3 + Na+ → Cs+ + NaO3
Eine Lösung von Calcium in Ammoniak reagiert mit Ozon zu Ammoniumozonid und nicht zu Calciumozonid:
- 3 Ca + 10 NH3 + 6 O
3 → Ca-6NH3 + Ca(OH)2 + Ca(NO3)2 + 2 NH4O3 + 2 O2 + H2 ⓘ
Anwendungen
Ozon kann zur Entfernung von Eisen und Mangan aus Wasser verwendet werden, wobei sich ein Niederschlag bildet, der gefiltert werden kann:
- 2 Fe2+ + O3 + 5 H2O → 2 Fe(OH)3(s) + O2 + 4 H+
- 2 Mn2+ + 2 O3 + 4 H2O → 2 MnO(OH)2(s) + 2 O2 + 4 H+
Ozon oxidiert auch in Wasser gelösten Schwefelwasserstoff zu schwefliger Säure:
- 3 O
3 + H2S → H2SO3 + 3 O2 ⓘ
Diese drei Reaktionen sind von zentraler Bedeutung für die Aufbereitung von Brunnenwasser mit Ozon. ⓘ
Ozon entgiftet auch Cyanide, indem es sie in Cyanate umwandelt.
- CN- + O3 → CNO-
+ O2 ⓘ
Ozon zersetzt auch Harnstoff vollständig:
- (NH2)2CO + O3 → N2 + CO2 + 2 H2O ⓘ
Spektroskopische Eigenschaften
Ozon ist ein gebogenes triatomisches Molekül mit drei Schwingungsmoden: symmetrische Streckung (1103,157 cm-1), Biegung (701,42 cm-1) und antisymmetrische Streckung (1042,096 cm-1). Die symmetrische Streckung und die Beugung sind schwache Absorber, aber die antisymmetrische Streckung ist stark und dafür verantwortlich, dass Ozon ein wichtiges kleines Treibhausgas ist. Diese IR-Bande wird auch zum Nachweis von Ozon in der Umgebung und in der Atmosphäre verwendet, obwohl UV-basierte Messungen üblicher sind. ⓘ
Das elektromagnetische Spektrum von Ozon ist recht komplex. Eine Übersicht findet sich im MPI Mainz UV/VIS Spectral Atlas of Gaseous Molecules of Atmospheric Interest. ⓘ
Alle Banden sind dissoziativ, was bedeutet, dass das Molekül nach der Absorption eines Photons in O + O2 zerfällt. Die wichtigste Absorption ist die Hartley-Bande, die sich von etwas über 300 nm bis hinunter zu etwas über 200 nm erstreckt. Diese Bande ist für die Absorption von UV-C in der Stratosphäre verantwortlich. ⓘ
Bei hohen Wellenlängen geht die Hartley-Bande in die so genannte Huggins-Bande über, die rasch abfällt und bei ~360 nm verschwindet. Oberhalb von 400 nm, bis weit in den NIR-Bereich hinein, liegen die Chappius- und Wulf-Bande. Dort sind unstrukturierte Absorptionsbanden nützlich, um hohe Ozonkonzentrationen in der Umgebung nachzuweisen, aber sie sind so schwach, dass sie keine große praktische Wirkung haben. ⓘ
Es gibt weitere Absorptionsbanden im fernen UV, die von 200 nm langsam ansteigen und bei ~120 nm ein Maximum erreichen. ⓘ
Ozon in der Erdatmosphäre


Der Gesamtgehalt an Ozon (die Menge an Ozon in einer bestimmten vertikalen Säule) in der Atmosphäre wird standardmäßig in Dobson-Einheiten ausgedrückt. Punktmessungen werden als Molanteile in nmol/mol (parts per billion, ppb) oder als Konzentrationen in μg/m3 angegeben. Die Untersuchung der Ozonkonzentration in der Atmosphäre begann in den 1920er Jahren. ⓘ
Ozonschicht
Lage und Produktion
Die höchsten Ozonkonzentrationen in der Atmosphäre befinden sich in der Stratosphäre, in einem Bereich, der auch als Ozonschicht bezeichnet wird, zwischen etwa 10 km und 50 km über der Oberfläche (oder zwischen etwa 6 und 31 Meilen). Doch selbst in dieser "Schicht" liegt die Ozonkonzentration nur bei zwei bis acht Teilen pro Million, so dass der meiste Sauerstoff dort aus Dioxygen, O2, mit etwa 210.000 Teilen pro Million Volumen besteht. ⓘ
Das Ozon in der Stratosphäre wird hauptsächlich durch kurzwellige ultraviolette Strahlen zwischen 240 und 160 nm erzeugt. Sauerstoff beginnt bei 240 nm in den Herzberg-Bändern schwach zu absorbieren, aber der größte Teil des Sauerstoffs wird durch Absorption in den starken Schumann-Runge-Bändern zwischen 200 und 160 nm dissoziiert, wo Ozon nicht absorbiert. Zwar ist das Licht kürzerer Wellenlängen, das sogar bis zur Röntgengrenze reicht, energiereich genug, um molekularen Sauerstoff zu dissoziieren, doch gibt es relativ wenig davon, und die starke Sonnenemission bei Lyman-alpha, 121 nm, fällt auf einen Punkt, an dem die Absorption von molekularem Sauerstoff ein Minimum ist. ⓘ
Der Prozess der Bildung und Zerstörung von Ozon wird als Chapman-Zyklus bezeichnet und beginnt mit der Photolyse von molekularem Sauerstoff ⓘ
gefolgt von der Reaktion des Sauerstoffatoms mit einem anderen Sauerstoffmolekül zur Bildung von Ozon.
- O + O
2 + M → O
3 + M ⓘ
wobei "M" den dritten Körper bezeichnet, der die überschüssige Energie der Reaktion abführt. Das Ozonmolekül kann dann ein UV-C-Photon absorbieren und dissoziieren ⓘ
- O
3 → O + O
2 + kinetische Energie ⓘ
Die überschüssige kinetische Energie erwärmt die Stratosphäre, wenn die O-Atome und der molekulare Sauerstoff auseinanderfliegen und mit anderen Molekülen zusammenstoßen. Diese Umwandlung von UV-Licht in kinetische Energie erwärmt die Stratosphäre. Die Sauerstoffatome, die bei der Photolyse von Ozon entstehen, reagieren dann wieder mit anderen Sauerstoffmolekülen, wie im vorhergehenden Schritt, um weiteres Ozon zu bilden. In der klaren Atmosphäre, die nur aus Stickstoff und Sauerstoff besteht, kann Ozon mit dem atomaren Sauerstoff reagieren und zwei Moleküle O2 bilden ⓘ
- O
3 + O → 2 O
2 ⓘ
Eine Schätzung der Geschwindigkeit dieses Abbruchschritts des Kreislaufs von atomarem Sauerstoff zurück zu Ozon lässt sich einfach anhand des Verhältnisses der Konzentration von O2 zu O3 ermitteln. Die Abbruchreaktion wird durch das Vorhandensein bestimmter freier Radikale katalysiert, von denen die wichtigsten Hydroxyl (OH), Stickstoffoxid (NO) sowie atomares Chlor (Cl) und Brom (Br) sind. In der zweiten Hälfte des 20. Jahrhunderts wurde festgestellt, dass die Ozonmenge in der Stratosphäre abnimmt, was vor allem auf die zunehmenden Konzentrationen von Fluorchlorkohlenwasserstoffen (FCKW) und ähnlichen chlorierten und bromierten organischen Molekülen zurückzuführen ist. Die Besorgnis über die gesundheitlichen Auswirkungen des Rückgangs führte 1987 zum Montrealer Protokoll, dem Verbot der Herstellung zahlreicher ozonabbauender Chemikalien und im ersten und zweiten Jahrzehnt des 21. Jahrhunderts zum Beginn der Erholung der stratosphärischen Ozonkonzentrationen. ⓘ
Bedeutung für das oberirdische Leben auf der Erde

Das Ozon in der Ozonschicht filtert die Wellenlängen des Sonnenlichts von etwa 200 nm bis 315 nm heraus, wobei die Ozonabsorption bei etwa 250 nm ihren Höhepunkt erreicht. Diese UV-Absorption durch Ozon ist für das Leben wichtig, da sie die UV-Absorption durch gewöhnlichen Sauerstoff und Stickstoff in der Luft (die alle Wellenlängen < 200 nm absorbieren) um das untere UV-C (200-280 nm) und das gesamte UV-B-Band (280-315 nm) erweitert. Der kleine nicht absorbierte Teil des UV-B, der nach dem Durchgang durch Ozon verbleibt, verursacht Sonnenbrand beim Menschen und direkte DNA-Schäden in lebenden Geweben bei Pflanzen und Tieren. Die Wirkung von Ozon auf UV-B-Strahlen im mittleren Bereich wird durch seine Wirkung auf UV-B bei 290 nm veranschaulicht, dessen Strahlungsintensität am oberen Ende der Atmosphäre 350 Millionen Mal so stark ist wie an der Oberfläche. Dennoch erreicht genügend UV-B-Strahlung mit ähnlicher Frequenz den Boden, um einen Sonnenbrand zu verursachen, und dieselben Wellenlängen gehören auch zu denen, die für die Produktion von Vitamin D beim Menschen verantwortlich sind. ⓘ
Die Ozonschicht hat nur geringe Auswirkungen auf die längeren UV-Wellenlängen, die als UV-A (315-400 nm) bezeichnet werden. Diese Strahlung verursacht jedoch keinen Sonnenbrand oder direkte DNA-Schäden, und obwohl sie bei bestimmten Menschen wahrscheinlich langfristige Hautschäden verursacht, ist sie für Pflanzen und die Gesundheit von Oberflächenorganismen auf der Erde im Allgemeinen nicht so gefährlich (siehe Ultraviolett für weitere Informationen über nahes Ultraviolett). ⓘ
Ozon in geringer Konzentration
| Teil einer Serie über ⓘ |
| Verschmutzung |
|---|
 |
|
|
Schwaches Ozon (oder troposphärisches Ozon) ist ein Schadstoff in der Atmosphäre. Es wird nicht direkt von Automotoren oder Industrieanlagen emittiert, sondern entsteht durch die Reaktion des Sonnenlichts auf Luft, die Kohlenwasserstoffe und Stickoxide enthält, die direkt an der Quelle der Verschmutzung oder viele Kilometer windabwärts zu Ozon reagieren. ⓘ
Ozon reagiert direkt mit einigen Kohlenwasserstoffen, wie z. B. Aldehyden, und leitet so deren Entfernung aus der Luft ein, aber die Produkte selbst sind wichtige Bestandteile des Smogs. Die Photolyse von Ozon durch UV-Licht führt zur Bildung des Hydroxylradikals HO-, das bei der Entfernung von Kohlenwasserstoffen aus der Luft eine Rolle spielt, aber auch der erste Schritt bei der Bildung von Smogbestandteilen wie Peroxyacylnitraten ist, die stark augenreizend sein können. Die Lebensdauer von Ozon in der Troposphäre beträgt etwa 22 Tage; die wichtigsten Mechanismen zur Beseitigung von Ozon sind die Ablagerung am Boden, die oben erwähnte Reaktion, bei der HO- entsteht, sowie Reaktionen mit OH und dem Peroxyradikal HO2-. ⓘ
Es gibt Hinweise auf erhebliche Ertragseinbußen in der Landwirtschaft aufgrund des erhöhten bodennahen Ozons und der Verschmutzung, die die Photosynthese beeinträchtigt und das Wachstum einiger Pflanzenarten insgesamt hemmt. Die US-Umweltschutzbehörde schlägt eine sekundäre Regelung zur Verringerung von Ernteschäden vor, zusätzlich zu der primären Regelung, die dem Schutz der menschlichen Gesundheit dient. ⓘ
Niedrige Ozonwerte in städtischen Gebieten
Einige Beispiele für Städte mit erhöhten Ozonwerten sind Denver, Colorado, Houston, Texas, und Mexiko-Stadt, Mexiko. Houston hat einen Wert von etwa 41 nmol/mol, während Mexiko-Stadt mit einem Wert von etwa 125 nmol/mol weitaus gefährlicher ist. ⓘ
Schwaches Ozon, oder troposphärisches Ozon, ist die besorgniserregendste Art der Ozonverschmutzung in städtischen Gebieten und nimmt allgemein zu. Die Ozonverschmutzung in städtischen Gebieten betrifft die dichter besiedelten Gebiete und wird durch den hohen Anteil an Fahrzeugen verschlimmert, die die Schadstoffe NO2 und VOC ausstoßen, die am meisten zu den problematischen Ozonwerten beitragen. Die Ozonverschmutzung in städtischen Gebieten ist besonders problematisch, wenn die Temperaturen steigen und die hitzebedingte Sterblichkeit bei Hitzewellen zunimmt. Während Hitzewellen in städtischen Gebieten kann die bodennahe Ozonbelastung um 20 % höher sein als gewöhnlich. Die Ozonverschmutzung in städtischen Gebieten erreicht im Sommer und Herbst höhere Überschreitungswerte, was mit den Wetter- und Verkehrsmustern erklärt werden kann. Es muss noch genauer erforscht werden, welche Bevölkerungsgruppen in städtischen Gebieten am stärksten von Ozon betroffen sind, da farbige und von Armut betroffene Menschen generell stärker von der Verschmutzung betroffen sind, auch wenn diese Bevölkerungsgruppen wahrscheinlich weniger zur Verschmutzung beitragen. ⓘ
Wie bereits erwähnt, ist Denver, Colorado, eine der vielen Städte in den Vereinigten Staaten, die hohe Ozonwerte aufweisen. Nach Angaben der American Lung Association steht das Gebiet Denver-Aurora an 14. Stelle der am stärksten mit Ozon verschmutzten Gebiete in den Vereinigten Staaten. Das Problem der hohen Ozonwerte ist in diesem Gebiet nicht neu. Im Jahr 2004 stufte die US-Umweltschutzbehörde die Denver Metro/North Front Range (Adams, Arapahoe, Boulder, Broomfield, Denver, Douglas, Jefferson und Teile der Bezirke Larimer und Weld) als Nichtübertreffungsgebiet für die 8-Stunden-Ozon-Norm von 1997 ein", verschob diesen Status jedoch bis 2007. Der Non-Attainment-Standard bedeutet, dass ein Gebiet die von der EPA festgelegten Luftqualitätsstandards nicht erfüllt. Als Reaktion darauf wurde der Colorado Ozone Action Plan (Ozon-Aktionsplan) erstellt, der zahlreiche Änderungen mit sich brachte. Die erste wichtige Änderung bestand darin, dass die Emissionsprüfung von Kraftfahrzeugen auf weitere Bezirke ausgeweitet wurde, die zuvor keine Emissionsprüfung vorschrieben, wie z. B. Gebiete in Larimer und Weld County. Außerdem wurden Änderungen vorgenommen, um die Emissionen von Stickstoffoxiden (NOx) und flüchtigen organischen Verbindungen (VOC) zu verringern, was zur Senkung der Ozonwerte beitragen dürfte. ⓘ
Einen großen Anteil an den hohen Ozonwerten in der Region hat die Erdöl- und Erdgasindustrie im Denver-Julesburg Basin (DJB), das sich mit den meisten Ballungsräumen in Colorado überschneidet. Ozon entsteht auf natürliche Weise in der Stratosphäre der Erde, wird aber auch durch menschliche Aktivitäten in der Troposphäre erzeugt. Wie bereits kurz erwähnt, reagieren NOx und flüchtige organische Verbindungen (VOC) mit dem Sonnenlicht, um Ozon durch einen Prozess namens Photochemie zu erzeugen. Erhöhte Ozonwerte für eine Stunde (<75 ppb) treten zwischen Juni und August auf, was darauf hindeutet, dass erhöhte Ozonwerte durch die regionale Photochemie verursacht werden". In einem Artikel der University of Colorado-Boulder heißt es: "VOC-Emissionen aus Erdöl und Erdgas spielen eine wichtige Rolle bei der Ozonproduktion und können zu erhöhten O3-Werten in der Northern Colorado Front Range (NCFR) beitragen. Unter Verwendung komplexer Analysen zur Erforschung von Windmustern und Emissionen großer Öl- und Erdgasbetriebe kamen die Autoren zu dem Schluss, dass "erhöhte O3-Werte in der NCFR überwiegend mit dem Lufttransport aus N-ESE korreliert sind, d. h. aus den Aufwindsektoren, in denen sich die O&NG-Betriebe im Wattenberg-Feldgebiet des DJB befinden". ⓘ
Der 2008 erstellte Colorado Ozone Action Plan sieht vor, "Emissionskontrollen für große industrielle NOx-Quellen" und "landesweite Kontrollanforderungen für neue Öl- und Gaskondensattanks und pneumatische Ventile" zu bewerten. Im Jahr 2011 wurde der Regional Haze Plan veröffentlicht, der einen spezifischeren Plan zur Verringerung der NOx-Emissionen enthält. Diese Bemühungen sind immer schwieriger umzusetzen und brauchen viele Jahre, bis sie verwirklicht sind. Natürlich gibt es auch andere Gründe für die anhaltend hohen Ozonwerte. Dazu gehören: eine wachsende Bevölkerung, die zu mehr Autoabgasen führt, und die Berge entlang des NCFR, die Emissionen zurückhalten können. Die täglichen Luftqualitätsmesswerte können auf der Website des Colorado Department of Public Health and Environment abgerufen werden. Wie bereits erwähnt, werden in Denver auch heute noch hohe Ozonwerte gemessen. Es wird viele Jahre dauern und einen systemorientierten Ansatz erfordern, um das Problem der hohen Ozonwerte in der Front Range von Colorado zu bekämpfen. ⓘ
Ozon-Rissbildung

Ozongas greift alle Polymere an, die in ihrer Kettenstruktur olefinische oder Doppelbindungen aufweisen, wie Naturkautschuk, Nitrilkautschuk und Styrol-Butadien-Kautschuk. Produkte, die aus diesen Polymeren hergestellt werden, sind besonders anfällig für diesen Angriff, der dazu führt, dass die Risse mit der Zeit länger und tiefer werden, wobei die Geschwindigkeit des Risswachstums von der Belastung des Gummiteils und der Ozonkonzentration in der Atmosphäre abhängt. Solche Materialien können durch Zugabe von Ozonschutzmitteln wie Wachsen geschützt werden, die sich mit der Oberfläche verbinden und einen Schutzfilm bilden oder sich mit dem Material vermischen und einen langfristigen Schutz bieten. Ozonrissbildung war beispielsweise früher ein ernstes Problem bei Autoreifen, ist aber bei modernen Reifen kein Thema mehr. Andererseits können viele kritische Produkte wie Dichtungen und O-Ringe durch Ozon, das in Druckluftsystemen entsteht, angegriffen werden. Auch Kraftstoffleitungen aus verstärktem Gummi können angegriffen werden, vor allem im Motorraum, wo Ozon von elektrischen Komponenten erzeugt wird. Die Lagerung von Gummiprodukten in unmittelbarer Nähe eines Gleichstrom-Elektromotors kann die Ozonrissbildung beschleunigen. Der Kommutator des Motors erzeugt Funken, die ihrerseits Ozon produzieren. ⓘ
Ozon kann Materialien, insbesondere verschiedene Elastomere und Kautschuke schädigen: es kann zur Ozonrissbildung kommen. Früher war das Problem vor allem bei Reifen sehr verbreitet. Seit etwa den 1950er Jahren werden den Elastomeren Ozonschutzmittel zugesetzt. Aufgrund der Präventionsmaßnahmen tritt das Problem daher kaum noch auf. ⓘ
Ozon als Treibhausgas
Obwohl Ozon bereits vor der industriellen Revolution in Bodennähe vorhanden war, liegen die Spitzenkonzentrationen heute weit über den vorindustriellen Werten, und selbst die Hintergrundkonzentrationen weit entfernt von Verschmutzungsquellen sind wesentlich höher. Ozon wirkt als Treibhausgas und absorbiert einen Teil der von der Erde ausgestrahlten Infrarotenergie. Die Quantifizierung der Treibhausgaswirkung von Ozon ist schwierig, da es nicht überall auf der Welt in gleichmäßigen Konzentrationen vorhanden ist. Die am weitesten akzeptierten wissenschaftlichen Einschätzungen zum Klimawandel (z. B. der Dritte Bewertungsbericht des Zwischenstaatlichen Ausschusses für Klimaänderungen) deuten jedoch darauf hin, dass der Strahlungsantrieb von troposphärischem Ozon etwa 25 % desjenigen von Kohlendioxid beträgt. ⓘ
Das jährliche globale Erwärmungspotenzial von troposphärischem Ozon liegt zwischen 918 und 1022 Tonnen Kohlendioxidäquivalent/Tonnen troposphärisches Ozon. Das bedeutet, dass Ozon in der Troposphäre pro Molekül eine etwa 1.000-mal stärkere Strahlungswirkung hat als Kohlendioxid. Allerdings ist troposphärisches Ozon ein kurzlebiges Treibhausgas, das in der Atmosphäre viel schneller zerfällt als Kohlendioxid. Das bedeutet, dass das globale Erwärmungspotenzial von troposphärischem Ozon über einen Zeitraum von 20 Jahren viel geringer ist, nämlich etwa 62 bis 69 Tonnen Kohlendioxidäquivalent/Tonne troposphärisches Ozon. ⓘ
Aufgrund seiner Kurzlebigkeit hat das troposphärische Ozon keine starken globalen Auswirkungen, aber es hat sehr starke Strahlungseffekte auf regionaler Ebene. Tatsächlich gibt es Regionen auf der Welt, in denen troposphärisches Ozon einen Strahlungsantrieb von bis zu 150 % des Kohlendioxids hat. So ist beispielsweise der Ozonanstieg in der Troposphäre nachweislich für ~30 % der Erwärmung des oberen Südpolarmeeres zwischen 1955 und 2000 verantwortlich. ⓘ
Auswirkungen auf die Gesundheit
In den letzten Jahrzehnten haben Wissenschaftler die Auswirkungen der akuten und chronischen Ozonbelastung auf die menschliche Gesundheit untersucht. Hunderte von Studien deuten darauf hin, dass Ozon bei den derzeit in städtischen Gebieten anzutreffenden Werten schädlich für den Menschen ist. Ozon hat nachweislich Auswirkungen auf die Atemwege, das Herz-Kreislauf-System und das zentrale Nervensystem. Frühzeitiger Tod und Probleme bei der reproduktiven Gesundheit und Entwicklung werden ebenfalls mit Ozonbelastung in Verbindung gebracht. ⓘ
Gefährdete Bevölkerungsgruppen
Die American Lung Association hat fünf Bevölkerungsgruppen ermittelt, die besonders anfällig für die Auswirkungen der Ozonbelastung sind:
- Kinder und Teenager
- Menschen im Alter von 65 Jahren und älter
- Menschen, die im Freien arbeiten oder Sport treiben
- Menschen mit bestehenden Lungenerkrankungen wie Asthma und chronisch obstruktiver Lungenerkrankung (auch bekannt als COPD, zu der Emphysem und chronische Bronchitis gehören)
- Menschen mit Herz-Kreislauf-Erkrankungen
Weitere Hinweise deuten darauf hin, dass Frauen, Menschen mit Übergewicht und einkommensschwache Bevölkerungsgruppen ebenfalls einem höheren Risiko durch Ozon ausgesetzt sein könnten, obwohl weitere Forschungsarbeiten erforderlich sind. ⓘ
Akute Ozonbelastung
Die akute Ozonbelastung reicht von Stunden bis zu ein paar Tagen. Da Ozon ein Gas ist, wirkt es direkt auf die Lunge und das gesamte Atmungssystem. Eingeatmetes Ozon führt zu Entzündungen und akuten - aber reversiblen - Veränderungen der Lungenfunktion sowie zu einer Überempfindlichkeit der Atemwege. Diese Veränderungen führen zu Kurzatmigkeit, Keuchen und Husten, was Lungenkrankheiten wie Asthma oder chronisch obstruktive Lungenerkrankung (COPD) verschlimmern kann und eine medizinische Behandlung erforderlich macht. Es hat sich gezeigt, dass die akute und chronische Exposition gegenüber Ozon das Risiko von Atemwegsinfektionen erhöht, was auf den folgenden Mechanismus zurückzuführen ist. ⓘ
Es wurden mehrere Studien durchgeführt, um den Mechanismus der schädlichen Wirkung von Ozon, insbesondere in der Lunge, zu ermitteln. Diese Studien haben gezeigt, dass die Exposition gegenüber Ozon Veränderungen in der Immunreaktion des Lungengewebes hervorruft, was zu einer Störung der angeborenen und der adaptiven Immunreaktion führt und die Schutzfunktion der Lungenepithelzellen beeinträchtigt. Man geht davon aus, dass diese Veränderungen der Immunantwort und die damit verbundene Entzündungsreaktion Faktoren sind, die wahrscheinlich zum erhöhten Risiko von Lungeninfektionen und zur Verschlimmerung oder Auslösung von Asthma und reaktiven Atemwegen nach Exposition gegenüber bodennaher Ozonbelastung beitragen. ⓘ
Das angeborene (zelluläre) Immunsystem besteht aus verschiedenen chemischen Signalen und Zelltypen, die auf breiter Basis und gegen mehrere Arten von Krankheitserregern wirken, in der Regel Bakterien oder Fremdkörper/Substanzen im Wirt. Zu den Zellen des angeborenen Systems gehören Phagozyten und Neutrophile, von denen man annimmt, dass sie zum Mechanismus der Ozonpathologie in der Lunge beitragen, da sich die Funktionsweise dieser Zelltypen nach der Exposition gegenüber Ozon nachweislich verändert. Makrophagen, Zellen, die dazu dienen, Krankheitserreger oder fremdes Material durch den Prozess der "Phagozytose" zu beseitigen, verändern nachweislich die Menge der Entzündungssignale, die sie als Reaktion auf Ozon freisetzen, wobei sie entweder hochreguliert werden und zu einer Entzündungsreaktion in der Lunge führen oder herunterreguliert werden und den Immunschutz verringern. Neutrophile, ein weiterer wichtiger Zelltyp des angeborenen Immunsystems, der in erster Linie bakterielle Krankheitserreger bekämpft, sind innerhalb von 6 Stunden nach der Exposition gegenüber hohen Ozonwerten in den Atemwegen zu finden. Trotz hoher Konzentrationen im Lungengewebe scheint ihre Fähigkeit, Bakterien zu beseitigen, durch die Ozonbelastung beeinträchtigt zu sein. ⓘ
Das adaptive Immunsystem ist der Zweig der Immunität, der durch die Entwicklung von Antikörpern gegen bestimmte Krankheitserreger einen langfristigen Schutz bietet und ebenfalls durch hohe Ozonbelastung beeinträchtigt wird. Lymphozyten, eine zelluläre Komponente der adaptiven Immunreaktion, produzieren nach einer Ozonbelastung vermehrt entzündungsfördernde chemische Stoffe, so genannte Zytokine", die zu einer Hyperreaktivität der Atemwege und einer Verschlimmerung der Asthmasymptome beitragen können. ⓘ
Die Epithelzellen der Atemwege spielen auch eine wichtige Rolle beim Schutz des Menschen vor Krankheitserregern. In normalem Gewebe bildet die Epithelschicht eine Schutzbarriere und enthält außerdem spezialisierte Ziliarkörper, die Fremdkörper, Schleim und Krankheitserreger aus der Lunge entfernen. Wenn sie Ozon ausgesetzt sind, werden die Zilien beschädigt, und die mukoziliäre Clearance von Krankheitserregern wird reduziert. Außerdem wird die Epithelbarriere geschwächt, so dass Krankheitserreger die Barriere überwinden, sich vermehren und in tiefer liegende Gewebe eindringen können. Zusammengenommen tragen diese Veränderungen der Epithelbarriere dazu bei, dass Menschen anfälliger für Lungeninfektionen werden. ⓘ
Das Einatmen von Ozon wirkt sich nicht nur auf das Immunsystem und die Lunge aus, sondern kann auch das Herz beeinträchtigen. Ozon verursacht ein kurzzeitiges autonomes Ungleichgewicht, das zu Veränderungen der Herzfrequenz und einer Verringerung der Herzfrequenzvariabilität führt; eine hohe Exposition von nur einer Stunde führt bei älteren Menschen zu supraventrikulären Arrhythmien, die das Risiko eines vorzeitigen Todes und eines Schlaganfalls erhöhen. Ozon kann auch zu einer Vasokonstriktion führen, die den systemischen arteriellen Druck erhöht, was bei Patienten mit vorbestehenden Herzerkrankungen zu einem erhöhten Risiko für kardiale Morbidität und Mortalität beiträgt. ⓘ
Chronische Ozonbelastung
Wird Ozon über Wochen, Monate oder Jahre hinweg länger als acht Stunden am Stück eingeatmet, spricht man von chronischer Exposition. Zahlreiche Studien deuten darauf hin, dass diese Exposition ernsthafte Auswirkungen auf die Gesundheit verschiedener Bevölkerungsgruppen hat. ⓘ
In einer Studie wurde ein signifikanter positiver Zusammenhang zwischen chronischem Ozon und der Gesamtmortalität, der Kreislauf- und der Atemwegsmortalität mit einem Anstieg des Risikos um 2 %, 3 % bzw. 12 % pro 10 ppb festgestellt, und es wurde ein Zusammenhang (95 % CI) zwischen jährlichem Ozon und der Gesamtmortalität mit einer Hazard Ratio von 1,02 (1,01-1,04) und der kardiovaskulären Mortalität von 1,03 (1,01-1,05) festgestellt. In einer ähnlichen Studie wurden ähnliche Zusammenhänge mit der Gesamtmortalität und noch größere Auswirkungen auf die kardiovaskuläre Mortalität festgestellt. Ein erhöhtes Sterberisiko aufgrund von Atemwegserkrankungen wird mit einer langfristigen chronischen Ozonbelastung in Verbindung gebracht. ⓘ
Chronisches Ozon hat nachteilige Auswirkungen auf Kinder, insbesondere auf solche mit Asthma. Das Risiko einer Krankenhauseinweisung bei Kindern mit Asthma steigt mit der chronischen Ozonbelastung; bei jüngeren Kindern und Kindern mit niedrigem Einkommen ist das Risiko noch größer. ⓘ
Erwachsene mit Atemwegserkrankungen (Asthma, COPD, Lungenkrebs) haben ein höheres Mortalitäts- und Morbiditätsrisiko, und bei kritisch kranken Patienten besteht bei chronischer Ozonbelastung ebenfalls ein erhöhtes Risiko, ein akutes Atemnotsyndrom zu entwickeln. ⓘ
Von Luftreinigern erzeugtes Ozon
Ozongeneratoren, die als Luftreiniger verkauft werden, erzeugen absichtlich das Gas Ozon. Sie werden oft als Mittel zur Bekämpfung der Luftverschmutzung in Innenräumen vermarktet und verwenden irreführende Begriffe zur Beschreibung von Ozon. So wird es beispielsweise als "energetisierter Sauerstoff" oder "reine Luft" bezeichnet, was den Eindruck erweckt, Ozon sei eine gesunde oder "bessere" Art von Sauerstoff. Nach Angaben der EPA ist Ozon jedoch nicht in der Lage, viele geruchsverursachende Chemikalien zu entfernen, und beseitigt auch keine Viren, Bakterien, Schimmel oder andere biologische Schadstoffe. Außerdem heißt es in einem anderen Bericht, dass "die Ergebnisse einiger kontrollierter Studien zeigen, dass Ozonkonzentrationen, die deutlich über diesen [humanen Sicherheits-]Normen liegen, selbst dann möglich sind, wenn der Benutzer die Betriebsanweisungen des Herstellers befolgt". ⓘ
Das California Air Resources Board hat eine Seite, auf der Luftreiniger (viele mit Ionisatoren) aufgelistet sind, die den Ozongrenzwert von 0,050 Teilen pro Million in Innenräumen einhalten. Aus diesem Artikel:
| Alle tragbaren Luftreinigungsgeräte, die in Kalifornien verkauft werden, müssen vom California Air Resources Board (CARB) zertifiziert sein. Um zertifiziert zu werden, müssen Luftreiniger auf elektrische Sicherheit und Ozonemissionen getestet werden und einen Grenzwert für die Ozonemissionskonzentration von 0,050 Teilen pro Million einhalten. Weitere Informationen zu dieser Verordnung finden Sie unter Luftreinigerverordnung. ⓘ |
Ozon-Luftverschmutzung

Ozonvorläufer sind eine Gruppe von Schadstoffen, die vor allem bei der Verbrennung von fossilen Brennstoffen freigesetzt werden. Die bodennahe Ozonbelastung (troposphärisches Ozon) entsteht in der Nähe der Erdoberfläche durch die Einwirkung der UV-Strahlen des Tageslichts auf diese Vorläuferstoffe. Das bodennahe Ozon stammt in erster Linie aus Vorläufersubstanzen fossiler Brennstoffe, aber auch Methan ist eine natürliche Vorläufersubstanz, und der sehr niedrige natürliche Hintergrundwert von bodennahem Ozon gilt als sicher. In diesem Abschnitt werden die gesundheitlichen Auswirkungen der Verbrennung fossiler Brennstoffe untersucht, die das bodennahe Ozon weit über die Hintergrundwerte ansteigen lässt. ⓘ
Es gibt zahlreiche Belege dafür, dass bodennahes Ozon die Lungenfunktion beeinträchtigen und die Atemwege reizen kann. Die Exposition gegenüber Ozon (und den Schadstoffen, die es produzieren) wird mit vorzeitigem Tod, Asthma, Bronchitis, Herzinfarkt und anderen kardiopulmonalen Problemen in Verbindung gebracht. ⓘ
Langfristige Ozonbelastung erhöht nachweislich das Risiko, an einer Atemwegserkrankung zu sterben. In einer Studie mit 450 000 Bewohnern von Städten in den Vereinigten Staaten wurde ein signifikanter Zusammenhang zwischen den Ozonwerten und Atemwegserkrankungen über einen Zeitraum von 18 Jahren festgestellt. Die Studie ergab, dass Menschen, die in Städten mit hohen Ozonwerten wie Houston oder Los Angeles lebten, ein um über 30 % erhöhtes Risiko hatten, an einer Lungenerkrankung zu sterben. ⓘ
Luftqualitätsrichtlinien wie die der Weltgesundheitsorganisation, der US-Umweltschutzbehörde (EPA) und der Europäischen Union beruhen auf detaillierten Studien, die darauf abzielen, die Werte zu ermitteln, die messbare Gesundheitsschäden verursachen können. ⓘ
Nach Angaben von Wissenschaftlern der US-Umweltbehörde EPA können anfällige Personen bereits von Ozonwerten ab 40 nmol/mol beeinträchtigt werden. In der EU liegt der derzeitige Zielwert für Ozonkonzentrationen bei 120 µg/m3, was etwa 60 nmol/mol entspricht. Dieser Zielwert gilt gemäß der Richtlinie 2008/50/EG für alle Mitgliedsstaaten. Die Ozonkonzentration wird als maximaler Tagesmittelwert von 8-Stunden-Mittelwerten gemessen, und der Zielwert sollte ab Januar 2010 an nicht mehr als 25 Kalendertagen pro Jahr überschritten werden. Während die Richtlinie für die Zukunft die strikte Einhaltung des Grenzwerts von 120 µg/m3 vorschreibt (d. h. die mittlere Ozonkonzentration darf an keinem Tag des Jahres überschritten werden), gibt es für diese Anforderung kein Datum, und sie wird als langfristiges Ziel behandelt. ⓘ
In den USA wird die EPA durch das Gesetz über saubere Luft (Clean Air Act) angewiesen, nationale Luftqualitätsnormen (National Ambient Air Quality Standards) für verschiedene Schadstoffe, darunter auch bodennahes Ozon, festzulegen, und Bezirke, die diese Normen nicht einhalten, müssen Maßnahmen zur Senkung ihrer Werte ergreifen. Im Mai 2008 senkte die EPA aufgrund eines Gerichtsbeschlusses ihren Ozonstandard von 80 nmol/mol auf 75 nmol/mol. Dieser Schritt war umstritten, da die Wissenschaftler und der Beirat der Behörde selbst eine Senkung des Standards auf 60 nmol/mol empfohlen hatten. Viele Gesundheits- und Umweltgruppen befürworteten ebenfalls den Standard von 60 nmol/mol, und die Weltgesundheitsorganisation empfiehlt 100 µg/m3 (51 nmol/mol). ⓘ
Am 7. Januar 2010 kündigte die US-Umweltschutzbehörde (EPA) eine Überarbeitung der nationalen Luftqualitätsnorm (NAAQS) für den Schadstoff Ozon, die Hauptkomponente von Smog, an:
... Die EPA schlägt vor, den 8-Stunden-Primärstandard, der in der endgültigen Regelung von 2008 auf 0,075 μmol/mol festgelegt wurde, stattdessen auf einen niedrigeren Wert im Bereich von 0,060 bis 0,070 μmol/mol festzulegen, um Kinder und andere gefährdete Bevölkerungsgruppen besser vor einer Reihe von O
3 -bedingten Gesundheitsschäden zu schützen, die von einer verminderten Lungenfunktion und verstärkten Atemwegssymptomen bis hin zu schwerwiegenden Indikatoren für die respiratorische Morbidität, einschließlich Besuchen in Notaufnahmen und Krankenhauseinweisungen aufgrund von Atemwegserkrankungen, und möglicherweise kardiovaskulär bedingter Morbidität sowie einer nicht unfallbedingten und kardiopulmonalen Gesamtmortalität reichen ... ⓘ
Am 26. Oktober 2015 veröffentlichte die EPA eine endgültige Regelung, die am 28. Dezember 2015 in Kraft trat und mit der der 8-stündige primäre NAAQS-Wert von 0,075 ppm auf 0,070 ppm geändert wurde. ⓘ
Die EPA hat einen Luftqualitätsindex (AQI) entwickelt, um der Öffentlichkeit die Luftverschmutzungswerte zu erklären. Nach den derzeitigen Normen werden durchschnittliche Ozonmolfraktionen von 85 bis 104 nmol/mol als "ungesund für empfindliche Gruppen", 105 nmol/mol bis 124 nmol/mol als "ungesund" und 125 nmol/mol bis 404 nmol/mol als "sehr ungesund" bezeichnet. ⓘ
Ozon kann auch bei der Luftverschmutzung in Innenräumen vorkommen, teilweise als Folge von elektronischen Geräten wie Fotokopierern. Es ist auch bekannt, dass ein Zusammenhang zwischen der Zunahme von Pollen, Pilzsporen und Ozon durch Gewitter und Krankenhauseinweisungen von Asthmatikern besteht. ⓘ
In der viktorianischen Ära besagte ein britischer Volksmythos, dass der Geruch des Meeres durch Ozon verursacht wird. Tatsächlich wird der charakteristische "Meeresgeruch" durch Dimethylsulfid verursacht, eine Chemikalie, die vom Phytoplankton gebildet wird. Die viktorianischen Briten empfanden den daraus resultierenden Geruch als "belebend". ⓘ
Hitzewellen
Eine Untersuchung zur Bewertung der gemeinsamen Mortalitätseffekte von Ozon und Hitze während der Hitzewellen in Europa im Jahr 2003 kam zu dem Schluss, dass diese sich offenbar addieren. ⓘ
Physiologie
Ozon wird zusammen mit reaktiven Sauerstoffformen wie Superoxid, Singulett-Sauerstoff, Wasserstoffperoxid und Hypochlorit-Ionen von weißen Blutkörperchen und anderen biologischen Systemen (z. B. den Wurzeln von Ringelblumen) als Mittel zur Zerstörung von Fremdkörpern produziert. Ozon reagiert direkt mit organischen Doppelbindungen. Wenn Ozon zu Dioxygen zerfällt, entstehen freie Sauerstoffradikale, die sehr reaktiv sind und zahlreiche organische Moleküle schädigen können. Darüber hinaus wird angenommen, dass die starken oxidierenden Eigenschaften von Ozon zu Entzündungen beitragen können. Der kausale Zusammenhang zwischen der Entstehung von Ozon im Körper und seiner Wirkung ist noch nicht geklärt und wird unterschiedlich interpretiert, da auch andere chemische Prozesse im Körper einige der gleichen Reaktionen auslösen können. Es gibt Hinweise darauf, dass der Antikörper-katalysierte Wasser-Oxidationsweg der menschlichen Immunantwort mit der Ozonproduktion in Verbindung steht. In diesem System wird Ozon durch die Antikörper-katalysierte Produktion von Trioxidan aus Wasser und von Neutrophilen produziertem Singulett-Sauerstoff erzeugt. ⓘ
Wenn es eingeatmet wird, reagiert Ozon mit Verbindungen, die die Lungen auskleiden, und bildet spezifische, aus Cholesterin gewonnene Metaboliten, von denen man annimmt, dass sie den Aufbau und die Pathogenese atherosklerotischer Plaques (eine Form von Herzkrankheit) fördern. Diese Metaboliten kommen nachweislich auf natürliche Weise in menschlichen Arterien mit Atherosklerose vor und gehören zu einer Klasse von Secosterinen, die als Atheronale bezeichnet werden und durch Ozonolyse der Cholesterin-Doppelbindung unter Bildung eines 5,6-Secosterin sowie eines sekundären Kondensationsprodukts durch Aldolisierung entstehen. ⓘ
Auswirkungen auf das Pflanzenwachstum und die Ernteerträge
Ozon hat nachweislich einen negativen Einfluss auf das Pflanzenwachstum: "... Ozon reduzierte die Gesamtchlorophyll-, Carotinoid- und Kohlenhydratkonzentration und erhöhte den Gehalt an 1-Aminocyclopropan-1-carbonsäure (ACC) und die Ethylenproduktion. Bei den behandelten Pflanzen war der Ascorbat-Pool im Blatt verringert, während die Lipidperoxidation und der Austritt gelöster Stoffe deutlich höher waren als bei den ozonfreien Kontrollen. Die Daten deuten darauf hin, dass Ozon bei Zitruspflanzen Schutzmechanismen gegen oxidativen Stress auslöst." Studien, die Paprikapflanzen als Modell verwendet haben, haben gezeigt, dass Ozon den Fruchtertrag verringert und die Fruchtqualität verändert. Außerdem wurde ein Rückgang des Chlorophyllgehalts und der antioxidativen Abwehrkräfte auf den Blättern sowie ein Anstieg des Gehalts an reaktiven Sauerstoffspezies (ROS) und der Lipid- und Proteinschäden beobachtet. ⓘ
Eine Studie aus dem Jahr 2022 kommt zu dem Schluss, dass Ostasien aufgrund der Ozonverschmutzung, die ein Nebenprodukt der Verbrennung fossiler Brennstoffe ist, jährlich 63 Milliarden Dollar an Ernten einbüßt. China verliert etwa ein Drittel seiner potenziellen Weizenproduktion und ein Viertel seiner Reisproduktion. ⓘ

Ozon hat nachteilige Effekte auf Pflanzen und deren Wachstum. So sinken die Konzentrationen von Chlorophyll, Carotinoiden und Kohlenhydraten, während bei der Aminocyclopropancarbonsäure eine Erhöhung eintritt und vermehrt Ethen gebildet wird. Es konnte gezeigt werden, dass eine erhöhte Exposition von Zitruspflanzen gegenüber Ozon Schutzreaktionen gegen oxidativen Stress auslöste. Über längere Zeit anhaltende hohe Ozonbelastungen können besonders Laubbäume, Sträucher und Kulturpflanzen schädigen und deren Wachstum vermindern, so dass es zu Ertragseinbußen kommen kann. ⓘ
Sicherheitsvorschriften
Aufgrund der stark oxidierenden Eigenschaften von Ozon ist Ozon ein primäres Reizmittel, das vor allem die Augen und die Atemwege angreift und schon bei geringen Konzentrationen gefährlich sein kann. Das kanadische Zentrum für Sicherheit und Gesundheit am Arbeitsplatz berichtet, dass:
Selbst sehr niedrige Ozonkonzentrationen können die oberen Atemwege und die Lunge schädigen. Der Schweregrad der Schädigung hängt sowohl von der Ozonkonzentration als auch von der Dauer der Exposition ab. Selbst eine sehr kurzfristige Exposition gegenüber relativ niedrigen Konzentrationen kann zu schweren und dauerhaften Lungenschäden oder zum Tod führen. ⓘ
Zum Schutz von Arbeitnehmern, die potenziell Ozon ausgesetzt sind, hat die U.S. Occupational Safety and Health Administration einen zulässigen Expositionsgrenzwert (PEL) von 0,1 μmol/mol (29 CFR 1910.1000 Tabelle Z-1) festgelegt, der als zeitlich gewichteter 8-Stunden-Mittelwert berechnet wird. Höhere Konzentrationen sind besonders gefährlich, und NIOSH hat einen Grenzwert für die unmittelbare Lebens- und Gesundheitsgefährdung (IDLH) von 5 μmol/mol festgelegt. Arbeitsumgebungen, in denen Ozon verwendet wird oder in denen es wahrscheinlich erzeugt wird, sollten über eine angemessene Belüftung verfügen, und es ist ratsam, ein Ozonmessgerät zu haben, das einen Alarm auslöst, wenn die Konzentration den OSHA PEL überschreitet. Kontinuierliche Überwachungsgeräte für Ozon sind von verschiedenen Anbietern erhältlich. ⓘ
In Passagierflugzeugen kann eine erhöhte Ozonbelastung auftreten, wobei die Werte von der Flughöhe und den atmosphärischen Turbulenzen abhängen. Die Vorschriften der US-Luftfahrtbehörde Federal Aviation Administration legen einen Grenzwert von 250 nmol/mol mit einem maximalen Vier-Stunden-Durchschnitt von 100 nmol/mol fest. Einige Flugzeuge sind mit Ozonkonvertern im Belüftungssystem ausgestattet, um die Exposition der Passagiere zu verringern. ⓘ
Produktion

Ozongeneratoren werden zur Erzeugung von Ozon zur Luftreinigung oder zur Beseitigung von Rauchgeruch in unbewohnten Räumen eingesetzt. Diese Ozongeneratoren können über 3 g Ozon pro Stunde erzeugen. Ozon bildet sich in der Natur häufig unter Bedingungen, unter denen O2 nicht reagiert. Das in der Industrie verwendete Ozon wird in μmol/mol (ppm, parts per million), nmol/mol (ppb, parts per billion), μg/m3, mg/h (Milligramm pro Stunde) oder Gewichtsprozent gemessen. Der Bereich der angewandten Konzentrationen reicht von 1 % bis 5 % (in Luft) und von 6 % bis 14 % (in Sauerstoff) bei Methoden der älteren Generation. Neue elektrolytische Verfahren können Konzentrationen von 20 bis 30 % an gelöstem Ozon im Ausgangswasser erreichen. ⓘ
Temperatur und Luftfeuchtigkeit spielen eine große Rolle dabei, wie viel Ozon mit herkömmlichen Erzeugungsmethoden (wie Koronaentladung und ultraviolettes Licht) erzeugt wird. Alte Erzeugungsmethoden erzeugen weniger als 50 % der Nennkapazität, wenn sie mit feuchter Umgebungsluft betrieben werden, im Gegensatz zu sehr trockener Luft. Neue Generatoren, die elektrolytische Methoden verwenden, können eine höhere Reinheit und Auflösung erreichen, indem sie Wassermoleküle als Quelle für die Ozonproduktion nutzen. ⓘ
Koronale Entladungsmethode

Dies ist der gängigste Typ von Ozongeneratoren für die meisten industriellen und privaten Anwendungen. Es gibt zwar verschiedene Varianten der Koronarentladungsmethode, einschließlich medizinischer und industrieller Ozongeneratoren, aber diese Geräte arbeiten in der Regel mit einer Koronaentladungsröhre oder Ozonplatte. Sie sind in der Regel kostengünstig und benötigen keine andere Sauerstoffquelle als die Umgebungsluft, um Ozonkonzentrationen von 3-6 % zu erzeugen. Schwankungen in der Umgebungsluft, die auf das Wetter oder andere Umweltbedingungen zurückzuführen sind, verursachen Schwankungen in der Ozonproduktion. Sie erzeugen jedoch auch Stickoxide als Nebenprodukt. Der Einsatz eines Lufttrockners kann die Bildung von Salpetersäure durch den Entzug von Wasserdampf verringern oder verhindern und die Ozonproduktion erhöhen. Bei Raumtemperatur bildet sich Salpetersäure zu einem Dampf, der beim Einatmen gefährlich ist. Zu den Symptomen können Brustschmerzen, Kurzatmigkeit, Kopfschmerzen sowie eine trockene Nase und ein brennender Rachen gehören. Die Verwendung eines Sauerstoffkonzentrators kann die Ozonproduktion weiter erhöhen und das Risiko der Salpetersäurebildung weiter verringern, da nicht nur der Wasserdampf, sondern auch der Großteil des Stickstoffs entfernt wird. ⓘ
Ultraviolettes Licht
UV-Ozongeneratoren oder Vakuum-Ultraviolett (VUV)-Ozongeneratoren verwenden eine Lichtquelle, die ein schmalbandiges ultraviolettes Licht erzeugt, eine Untergruppe des von der Sonne erzeugten Lichts. Das UV der Sonne erhält die Ozonschicht in der Stratosphäre der Erde. ⓘ
UV-Ozongeneratoren verwenden Umgebungsluft für die Ozonproduktion, es werden keine Luftaufbereitungssysteme verwendet (Lufttrockner oder Sauerstoffkonzentrator), daher sind diese Generatoren in der Regel weniger teuer. Allerdings erzeugen UV-Ozongeneratoren in der Regel Ozon mit einer Konzentration von etwa 0,5 % oder weniger, was die mögliche Ozonproduktionsrate begrenzt. Ein weiterer Nachteil dieser Methode besteht darin, dass die Umgebungsluft (Sauerstoff) über einen längeren Zeitraum der UV-Quelle ausgesetzt werden muss und dass alle Gase, die der UV-Quelle nicht ausgesetzt sind, nicht behandelt werden. Dies macht UV-Generatoren unpraktisch für den Einsatz in Situationen, in denen sich Luft- oder Wasserströme schnell bewegen (z. B. Luftentkeimung im Kanal). Die Erzeugung von Ozon ist eine der potenziellen Gefahren der ultravioletten keimtötenden Bestrahlung. VUV-Ozongeneratoren werden in Schwimmbädern und Spas eingesetzt, die Millionen von Litern Wasser enthalten. VUV-Ozongeneratoren erzeugen im Gegensatz zu Koronaentladungsgeneratoren keine schädlichen Stickstoffnebenprodukte, und im Gegensatz zu Koronaentladungssystemen funktionieren VUV-Ozongeneratoren auch in feuchten Umgebungen sehr gut. Außerdem sind in der Regel keine teuren Abgasmechanismen erforderlich, und es werden keine Lufttrockner oder Sauerstoffkonzentratoren benötigt, die zusätzliche Kosten und Wartung erfordern. ⓘ
Kaltes Plasma
Bei der Kaltplasmamethode wird reines Sauerstoffgas einem durch DBD erzeugten Plasma ausgesetzt. Der zweiatomige Sauerstoff wird in einzelne Atome gespalten, die sich dann in Tripletts rekombinieren und Ozon bilden. In der Industrie werden einige DBD-Ozongeneratoren häufig fälschlicherweise als CD-Corona-Entladungsgeneratoren bezeichnet. In der Regel erzeugen alle Ozongeneratoren mit festen, flachen Metallelektroden Ozon nach dem Verfahren der dielektrischen Barrierenentladung. Kaltplasmageräte verwenden reinen Sauerstoff als Eingangsquelle und erzeugen eine maximale Konzentration von etwa 24 % Ozon. Sie erzeugen in einer bestimmten Zeit weitaus größere Mengen Ozon als die ultraviolette Erzeugung, die einen Wirkungsgrad von etwa 2 % hat. Die Entladungen manifestieren sich als fadenförmige Übertragung von Elektronen (Mikroentladungen) in einem Spalt zwischen zwei Elektroden. Um die Mikroentladungen gleichmäßig zu verteilen, muss ein dielektrischer Isolator verwendet werden, der die Metallelektroden voneinander trennt und Lichtbogenbildung verhindert. ⓘ
Elektrolytische
Bei der elektrolytischen Ozonerzeugung (EOG) werden Wassermoleküle in H2, O2 und O3 aufgespalten. Bei den meisten EOG-Verfahren wird das Wasserstoffgas entfernt, so dass Sauerstoff und Ozon als einzige Reaktionsprodukte übrig bleiben. Daher kann EOG eine höhere Auflösung in Wasser erreichen, ohne dass andere konkurrierende Gase, wie z. B. die in der Umgebungsluft vorhandenen Stickstoffgase, bei der Koronaentladungsmethode auftreten. Diese Erzeugungsmethode kann Konzentrationen von 20-30 % erreichen und ist unabhängig von der Luftqualität, da Wasser als Ausgangsmaterial verwendet wird. Die elektrolytische Erzeugung von Ozon ist in der Regel ungünstig, da zur Erzeugung von Ozon im Vergleich zu Sauerstoff eine hohe Überspannung erforderlich ist. Aus diesem Grund wird bei der typischen Wasserelektrolyse kein Ozon erzeugt. Es ist jedoch möglich, das Überpotenzial von Sauerstoff durch eine sorgfältige Auswahl des Katalysators so zu erhöhen, dass Ozon bei der Elektrolyse bevorzugt erzeugt wird. Typische Katalysatoren für diesen Ansatz sind Bleidioxid oder bordotierter Diamant. ⓘ
Das Verhältnis von Ozon zu Sauerstoff wird verbessert, indem die Stromdichte an der Anode erhöht wird, der Elektrolyt um die Anode auf nahezu 0 °C abgekühlt wird, ein saurer Elektrolyt (wie verdünnte Schwefelsäure) anstelle einer basischen Lösung verwendet wird und gepulster Strom anstelle von Gleichstrom angelegt wird. ⓘ
Besondere Überlegungen
Aufgrund seiner Instabilität kann Ozon nicht über längere Zeit bei Raumtemperatur gelagert oder wie andere industriell verwendete Gase in Druckflaschen gekauft werden (näheres siehe Abschnitt "Lagerung"). Vor seiner Anwendung (chemische Synthese, Wasseraufbereitung, als Bleichmittel etc.) muss es an Ort und Stelle erzeugt werden. ⓘ
Zur Herstellung wird meistens getrocknete Luft oder Sauerstoff (Taupunkt mind. −65 °C) als Trägergas eingesetzt. In selteneren Fällen wird Sauerstoff mit Argon, Kohlenstoffdioxid u. ä. gemischt. Im Ozonerzeuger (Ozongenerator) werden die Sauerstoffmoleküle durch stille elektrische Entladung zu Sauerstoffatomen dissoziiert, wonach noch im Plasma der Entladungsfilamente die Ozonsynthese und Ozonanreicherung stattfindet. In Luft bewegen sich typische Endkonzentrationen zwischen einem und fünf Prozent Massenanteil, in Sauerstoff zwischen sechs und dreizehn Prozent Massenanteil. ⓘ
Aus reinem, trockenem Sauerstoff können bis zu 90 g·m−3, aus Luft (bei Kühlung) bis zu 40 g·m−3 Ozon gewonnen werden. Für 1 kg Ozon aus Sauerstoff (im Bereich von 1–6 Gew-%) werden 7–14 kWh Strom und 1,8 m3/h Kühlwasser verbraucht. ⓘ
Die in der Praxis eingesetzten technischen Vorrichtungen können auf folgenden Elektrodenkonfigurationen basieren:
- ineinander geschobene Röhren (z. B. metallisch innenbeschichtetes Glasrohr im Stahlrohr)
- parallele Platten
- drahtumwickelte Elektroden für Oberflächenentladungen
- Spitze zu Platte
Bei Anlagen mit mehr als 20 kg Ozon pro Stunde werden üblicherweise nur Röhrenozonisatoren eingesetzt. ⓘ
In erster Näherung ist die Ozonanreicherung eine Funktion des elektrischen Energieeintrags pro Gasvolumen. Zur Optimierung des Wirkungsgrades können folgende Parameter variiert werden:
- Elektrodenabstand
- Elektrodenausrichtung
- Dielektrikumsmaterial
- Spitzenspannung und Frequenz ⓘ
Auch durch Überlagerung eines inhomogenen elektrischen Feldes während des Energieeintrags (Dielektrophorese) kann das chemische Gleichgewicht, welches sich aus Synthese und Zersetzung bei wenigen Gewichtsprozenten einstellt, zugunsten des Ozons verschoben werden. ⓘ
Obwohl die Ozonbildung aus Sauerstoff unter Wärmeabsorption erfolgt, sind Ozonerzeugerkessel in industriellen Anwendungen wassergekühlt, da fast 90 Prozent der eingetragenen Energie infolge der hohen Zersetzungsrate wieder abgeführt werden müssen. Für den Wirkungsgrad der Ozonsynthese ist die Gastemperatur ein weiterer dominierender Faktor. ⓘ
Wegen der hohen Reaktivität von Ozon sind nur wenige Materialien gegen Ozon beständig. Dazu gehören Edelstahl (z. B. 316L), Glas, Polytetrafluorethylen (PTFE), Perfluoralkoxy-Polymere (PFA), Polyvinylidenfluorid (PVDF) und Perfluorkautschuk. Bedingt beständig ist Viton, das unter Ozon keiner mechanischen Wechselbelastung ausgesetzt werden darf. ⓘ
Ozon kann nicht wie andere technische Gase gelagert und transportiert werden (da es schnell in zweiatomigen Sauerstoff zerfällt) und muss daher vor Ort erzeugt werden. Die verfügbaren Ozongeneratoren unterscheiden sich in der Anordnung und Ausführung der Hochspannungselektroden. Bei Produktionskapazitäten von mehr als 20 kg pro Stunde kann ein Gas-Wasser-Röhrenwärmetauscher als Erdungselektrode verwendet und mit röhrenförmigen Hochspannungselektroden auf der Gasseite versehen werden. Die typischen Gasdrücke liegen bei Sauerstoff bei etwa 2 bar (200 kPa) absolut und bei Luft bei 3 bar (300 kPa) absolut. In großen Anlagen können mehrere Megawatt elektrischer Leistung installiert sein, die als einphasiger Wechselstrom mit 50 bis 8000 Hz und Spitzenspannungen zwischen 3.000 und 20.000 Volt angelegt werden. Die angelegte Spannung steht in der Regel in umgekehrtem Verhältnis zur angelegten Frequenz. ⓘ
Silikonkautschuke sind in der Regel für die Verwendung als Dichtungen bei Ozonkonzentrationen unter 1 Gew.-% geeignet, z. B. in Anlagen zur beschleunigten Alterung von Gummimustern. ⓘ
Unbeabsichtigte Produktion
Ozon kann aus O
2 durch elektrische Entladungen und durch Einwirkung hochenergetischer elektromagnetischer Strahlung gebildet werden. Nicht unterdrückte Lichtbögen in elektrischen Kontakten, Motorbürsten oder mechanischen Schaltern brechen die chemischen Bindungen des Luftsauerstoffs, der die Kontakte umgibt, auf [O
2 → 2O]. Freie Sauerstoffradikale in und um den Lichtbogen rekombinieren und bilden Ozon [O
3]. Bestimmte elektrische Geräte erzeugen erhebliche Mengen an Ozon. Dies gilt insbesondere für Geräte, die mit hohen Spannungen arbeiten, wie z. B. ionische Luftreiniger, Laserdrucker, Fotokopierer, Taser und Lichtbogenschweißgeräte. Elektromotoren mit Bürsten können durch wiederholte Funkenbildung im Inneren des Geräts Ozon erzeugen. Große Motoren mit Bürsten, wie sie in Aufzügen oder Hydraulikpumpen verwendet werden, erzeugen mehr Ozon als kleinere Motoren. ⓘ
Ozon entsteht auch bei den Catatumbo-Blitzgewittern am Catatumbo-Fluss in Venezuela, obwohl es aufgrund der Instabilität des Ozons zweifelhaft ist, dass es Auswirkungen auf die Ozonosphäre hat. Der Catatumbo ist der weltweit größte natürliche Ozonerzeuger, weshalb er von der UNESCO zum Weltnaturerbe erklärt wurde. ⓘ
Herstellung im Labor

Im Labor kann Ozon durch Elektrolyse mit einer 9-Volt-Batterie, einer Kathode aus Bleistiftgraphitstäben, einer Anode aus Platindraht und einem 3-molaren Schwefelsäureelektrolyten hergestellt werden. Die Halbzellenreaktionen laufen wie folgt ab:
- 3 H2O → O3 + 6 H+ + 6 e- (ΔE° = -1,53 V)
- 6 H+ + 6 e- → 3 H2 (ΔE° = 0 V)
- 2 H2O → O2 + 4 H+ + 4 e- (ΔE° = 1,23 V) ⓘ
Bei der Nettoreaktion werden drei Äquivalente Wasser in ein Äquivalent Ozon und drei Äquivalente Wasserstoff umgewandelt. Die Sauerstoffbildung ist eine konkurrierende Reaktion. ⓘ
Sie kann auch durch einen Hochspannungsbogen erzeugt werden. In der einfachsten Form wird Hochspannungswechselstrom, z. B. der Ausgang eines Neontransformators, an zwei Metallstäbe angeschlossen, deren Enden nahe genug beieinander liegen, um einen Lichtbogen zu erzeugen. Der entstehende Lichtbogen wandelt atmosphärischen Sauerstoff in Ozon um. ⓘ
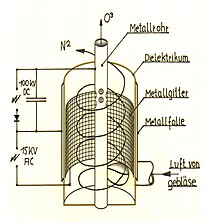
Oft ist es wünschenswert, das Ozon einzuschließen. Dies kann mit einem Gerät erreicht werden, das aus zwei konzentrischen Glasröhren besteht, die oben miteinander versiegelt sind und Gasöffnungen am oberen und unteren Ende der äußeren Röhre aufweisen. In den inneren Kern sollte ein Stück Metallfolie eingeführt werden, das mit einer Seite der Stromquelle verbunden ist. Die andere Seite der Stromquelle sollte mit einem weiteren Stück Folie verbunden sein, das um das äußere Rohr gewickelt ist. Eine Quelle von trockenem O
2 wird an den unteren Anschluss angeschlossen. Wenn eine Hochspannung an die Folienkabel angelegt wird, entlädt sich der Strom zwischen dem trockenen Sauerstoff in der Mitte und bildet O
3 und O
2, die aus der oberen Öffnung fließen. Dies wird als Siemen's Ozonisator bezeichnet. Die Reaktion lässt sich wie folgt zusammenfassen:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{3O2 ->[Strom] 2O3 <span title="Aus: Englische Wikipedia, Abschnitt "Laboratory production"" class="plainlinks">[https://en.wikipedia.org/wiki/Ozone#Laboratory_production <span style="color:#dddddd">ⓘ</span>]</span>}}
Anwendungen
Industrie
Am häufigsten wird Ozon bei der Herstellung von Arzneimitteln, synthetischen Schmiermitteln und vielen anderen kommerziell nutzbaren organischen Verbindungen verwendet, wo es zur Spaltung von Kohlenstoff-Kohlenstoff-Bindungen eingesetzt wird. Es kann auch zum Bleichen von Stoffen und zur Abtötung von Mikroorganismen in Luft und Wasser verwendet werden. Viele kommunale Trinkwassersysteme töten Bakterien mit Ozon anstelle des gebräuchlicheren Chlors ab. Ozon hat ein sehr hohes Oxidationspotenzial. Ozon bildet keine chlororganischen Verbindungen und verbleibt auch nach der Behandlung nicht im Wasser. In Quellwasser mit hohen Bromidkonzentrationen kann Ozon das mutmaßliche Karzinogen Bromat bilden. Der U.S. Safe Drinking Water Act schreibt vor, dass diese Systeme eine Chlormenge zuführen, die auf der Grundlage der Ergebnisse regelmäßiger Tests einen Mindestwert von 0,2 μmol/mol freies Restchlor in den Leitungen aufrechterhält. Wo elektrische Energie im Überfluss vorhanden ist, ist Ozon eine kostengünstige Methode der Wasseraufbereitung, da es bei Bedarf produziert wird und keinen Transport und keine Lagerung von gefährlichen Chemikalien erfordert. Nach seinem Zerfall hinterlässt es keinen Geschmack oder Geruch im Trinkwasser. ⓘ
Obwohl niedrige Ozonkonzentrationen als Desinfektionsmittel für Wohnräume angepriesen werden, übersteigt die Ozonkonzentration in trockener Luft, die für eine schnelle und deutliche Wirkung auf Krankheitserreger in der Luft erforderlich ist, die von der US-Arbeitsschutzbehörde und der Umweltschutzbehörde empfohlenen Werte. Die Kontrolle der Luftfeuchtigkeit kann sowohl die abtötende Wirkung des Ozons als auch die Geschwindigkeit, mit der es wieder zu Sauerstoff zerfällt, erheblich verbessern (mehr Luftfeuchtigkeit ermöglicht eine höhere Wirksamkeit). Die Sporenformen der meisten Krankheitserreger sind sehr tolerant gegenüber atmosphärischem Ozon in Konzentrationen, bei denen Asthmapatienten Probleme zu bekommen beginnen. ⓘ
Im Jahr 1908 wurde die künstliche Ozonisierung der Central Line der Londoner U-Bahn als Desinfektionsmittel in der Luft eingeführt. Das Verfahren erwies sich als sinnvoll, wurde aber 1956 wieder eingestellt. Die positive Wirkung wurde jedoch durch das Ozon aufrechterhalten, das zufällig durch die elektrischen Entladungen der Zugmotoren erzeugt wurde (siehe oben: Zufällige Erzeugung). ⓘ
Ozongeneratoren wurden Schulen und Universitäten in Wales für das Herbstsemester 2021 zur Verfügung gestellt, um Klassenzimmer nach COVID-19-Ausbrüchen zu desinfizieren. ⓘ
In der Industrie wird Ozon verwendet für:
- Wäsche in Krankenhäusern, Lebensmittelfabriken, Pflegeheimen usw. zu desinfizieren;
- Desinfektion von Wasser anstelle von Chlor
- Desodorierung von Luft und Gegenständen, z. B. nach einem Brand. Dieses Verfahren wird häufig in der Textilrestaurierung eingesetzt.
- Abtöten von Bakterien auf Lebensmitteln oder auf Kontaktflächen;
- Wasserintensive Industrien wie Brauereien und Molkereien können gelöstes Ozon als Ersatz für chemische Desinfektionsmittel wie Peressigsäure, Hypochlorit oder Hitze wirksam einsetzen.
- Desinfektion von Kühltürmen und Bekämpfung von Legionellen bei reduziertem Chemikalienverbrauch, Wasserabfluss und erhöhter Leistung.
- Desinfektion von Schwimmbädern und Whirlpools
- Töten von Insekten in gelagertem Getreide
- Entfernen von Hefe- und Schimmelsporen aus der Luft in Lebensmittelverarbeitungsbetrieben;
- Waschen von frischem Obst und Gemüse zur Abtötung von Hefe, Schimmel und Bakterien;
- Chemischer Angriff auf Verunreinigungen im Wasser (Eisen, Arsen, Schwefelwasserstoff, Nitrite und komplexe organische Stoffe, die als "Farbe" zusammengefasst werden);
- Unterstützung der Ausflockung (Agglomeration von Molekülen, die bei der Filtration hilft, bei der Eisen und Arsen entfernt werden);
- Herstellung von chemischen Verbindungen durch chemische Synthese
- Reinigen und Bleichen von Stoffen (ersteres wird in der Textilrestaurierung verwendet, letzteres ist patentiert);
- als Antichlor bei der Bleiche auf Chlorbasis wirken;
- Unterstützung bei der Verarbeitung von Kunststoffen, um das Anhaften von Druckfarben zu ermöglichen;
- Alterung von Gummiproben zur Bestimmung der Nutzungsdauer einer Gummipartie;
- Beseitigung von Wasserparasiten wie Giardia lamblia und Cryptosporidium in Oberflächenwasseraufbereitungsanlagen. ⓘ
Ozon ist ein Reagenz bei vielen organischen Reaktionen im Labor und in der Industrie. Unter Ozonolyse versteht man die Spaltung eines Alkens in Carbonylverbindungen. ⓘ
Viele Krankenhäuser auf der ganzen Welt verwenden große Ozongeneratoren, um Operationssäle zwischen den Operationen zu dekontaminieren. Die Räume werden gereinigt und dann luftdicht verschlossen, bevor sie mit Ozon gefüllt werden, das alle verbleibenden Bakterien wirksam abtötet oder neutralisiert. ⓘ
Ozon wird als Alternative zu Chlor oder Chlordioxid beim Bleichen von Zellstoff verwendet. Es wird häufig in Verbindung mit Sauerstoff und Wasserstoffperoxid eingesetzt, um bei der Herstellung von hochwertigem, weißem Papier auf chlorhaltige Verbindungen verzichten zu können. ⓘ
Ozon kann zur Entgiftung von Zyanidabfällen (z. B. aus dem Gold- und Silberbergbau) eingesetzt werden, indem es Zyanid zu Zyanat und schließlich zu Kohlendioxid oxidiert. ⓘ
Wasserdesinfektion
Seit der Erfindung der Dielectric Barrier Discharge (DBD)-Plasmareaktoren werden diese zur Wasserbehandlung mit Ozon eingesetzt. Angesichts billigerer alternativer Desinfektionsmittel wie Chlor wurden solche Anwendungen der DBD-Ozon-Wasserdekontamination jedoch durch den hohen Stromverbrauch und die sperrige Ausrüstung eingeschränkt. Da die Forschung jedoch die negativen Auswirkungen gängiger Desinfektionsmittel wie Chlor im Hinblick auf toxische Rückstände und die Unwirksamkeit bei der Abtötung bestimmter Mikroorganismen aufgedeckt hat, ist die plasmabasierte DBD-Ozon-Dekontamination für die derzeit verfügbaren Technologien von Interesse. Obwohl die Ozonierung von Wasser mit einer hohen Bromidkonzentration zur Bildung unerwünschter bromhaltiger Desinfektionsnebenprodukte führt, kann die Ozonierung im Allgemeinen ohne Bedenken angewandt werden, es sei denn, das Trinkwasser wird durch Entsalzung hergestellt. Zu den Vorteilen von Ozon gehören ein hohes thermodynamisches Oxidationspotenzial, eine geringere Empfindlichkeit gegenüber organischem Material und eine bessere Toleranz gegenüber pH-Schwankungen, wobei die Fähigkeit zur Abtötung von Bakterien, Pilzen, Viren sowie Sporen und Zysten erhalten bleibt. Obwohl Ozon in Europa seit Jahrzehnten weit verbreitet ist, wird es in den USA aufgrund des hohen Energieverbrauchs, der sperrigen Installation und des Stigmas, das mit der Ozontoxizität verbunden ist, nur selten zur Dekontaminierung eingesetzt. In Anbetracht dessen haben sich die jüngsten Forschungsanstrengungen auf die Untersuchung effektiver Ozonwasserbehandlungssysteme konzentriert. Die Forscher haben sich mit leichten und kompakten Oberflächen-DBD-Reaktoren mit geringem Stromverbrauch, energieeffizienten Volumen-DBD-Reaktoren und DBD-Reaktoren mit geringem Stromverbrauch im Mikromaßstab befasst. Solche Studien können dazu beitragen, den Weg für eine erneute Akzeptanz der plasmabasierten DBD-Ozon-Dekontamination von Wasser zu ebnen, insbesondere in den USA. ⓘ
Verbraucher
Geräte, die hohe Ozonkonzentrationen erzeugen, von denen einige mit Ionisierung arbeiten, werden zur Desinfektion und Desodorierung von unbewohnten Gebäuden, Räumen, Rohrleitungen, Holzschuppen, Booten und anderen Fahrzeugen eingesetzt. ⓘ
Ozonisiertes Wasser wird zum Waschen von Kleidung und zur Desinfektion von Lebensmitteln, Trinkwasser und Oberflächen im Haushalt verwendet. Nach Angaben der U.S. Food and Drug Administration (FDA) ist sie dabei, "die Vorschriften für Lebensmittelzusatzstoffe zu ändern, um die sichere Verwendung von Ozon in gasförmiger und wässriger Phase als antimikrobielles Mittel für Lebensmittel, einschließlich Fleisch und Geflügel, zu ermöglichen". Studien an der California Polytechnic University haben gezeigt, dass 0,3 μmol/mol Ozon, gelöst in gefiltertem Leitungswasser, eine Reduzierung von mehr als 99,99 % bei lebensmittelbedingten Mikroorganismen wie Salmonellen, E. coli 0157:H7 und Campylobacter bewirken kann. Diese Menge entspricht dem 20.000-fachen der oben genannten, von der WHO empfohlenen Grenzwerte. Ozon kann verwendet werden, um Pestizidrückstände von Obst und Gemüse zu entfernen. ⓘ
Ozon wird in Haushalten und Whirlpools eingesetzt, um Bakterien im Wasser abzutöten und die erforderliche Menge an Chlor oder Brom zu reduzieren, indem es diese in ihren freien Zustand reaktiviert. Da Ozon nicht lange genug im Wasser verbleibt, ist es allein nicht in der Lage, eine Kreuzkontamination unter den Badegästen zu verhindern, und muss in Verbindung mit Halogenen verwendet werden. Gasförmiges Ozon, das durch ultraviolettes Licht oder durch Koronaentladung erzeugt wird, wird in das Wasser eingeleitet. ⓘ
Ozon wird auch häufig bei der Wasseraufbereitung in Aquarien und Fischteichen eingesetzt. Seine Verwendung kann das Bakterienwachstum minimieren, Parasiten bekämpfen, die Übertragung einiger Krankheiten verhindern und die "Gelbfärbung" des Wassers reduzieren oder beseitigen. Ozon darf nicht mit den Kiemenstrukturen der Fische in Berührung kommen. Natürliches Salzwasser (mit Lebewesen) bietet genügend "Sofortbedarf", so dass kontrollierte Ozonmengen Bromidionen zu hypobromiger Säure aktivieren und das Ozon in wenigen Sekunden bis Minuten vollständig zerfällt. Bei Verwendung von sauerstoffgespeistem Ozon ist der Gehalt an gelöstem Sauerstoff im Wasser höher und die Kiemenstrukturen der Fische verkümmern, so dass sie auf sauerstoffangereichertes Wasser angewiesen sind. ⓘ
Aquakultur
Die Ozonierung - ein Verfahren, bei dem Wasser mit Ozon versetzt wird - kann in der Aquakultur eingesetzt werden, um den Abbau organischer Stoffe zu erleichtern. Ozon wird auch in Kreislaufsystemen eingesetzt, um den Nitritgehalt durch Umwandlung in Nitrat zu senken. Wenn der Nitritgehalt im Wasser hoch ist, reichert sich Nitrit auch im Blut und im Gewebe der Fische an, wo es den Sauerstofftransport beeinträchtigt (es bewirkt eine Oxidation der Häm-Gruppe des Hämoglobins von Eisen (Fe2+
) zu Eisen(III) (Fe3+
), wodurch Hämoglobin nicht mehr in der Lage ist, O
2). Trotz dieser scheinbar positiven Wirkungen wurde der Einsatz von Ozon in Kreislaufsystemen mit einer Verringerung des Gehalts an bioverfügbarem Jod in Salzwassersystemen in Verbindung gebracht, was zu Jodmangelsymptomen wie Kropf und vermindertem Wachstum der Larven der Seezunge (Solea senegalensis) führte. ⓘ
Ozonathaltiges Meerwasser wird zur Oberflächendesinfektion von Schellfisch- und Heilbutteiern gegen das Nodavirus verwendet. Das Nodavirus ist ein tödliches, vertikal übertragenes Virus, das bei Fischen eine hohe Sterblichkeit verursacht. Schellfischeier sollten nicht mit hohen Ozonkonzentrationen behandelt werden, da die so behandelten Eier nicht schlüpfen und nach 3-4 Tagen sterben. ⓘ
Landwirtschaft
Die Anwendung von Ozon auf frisch aufgeschnittene Ananas und Bananen zeigt einen Anstieg der Flavonoide und des Gesamtphenolgehalts, wenn die Exposition bis zu 20 Minuten dauert. Eine Abnahme des Ascorbinsäuregehalts (eine Form von Vitamin C) wird beobachtet, aber die positive Wirkung auf den Gesamtphenolgehalt und die Flavonoide kann die negative Wirkung ausgleichen. Tomaten zeigen bei der Behandlung mit Ozon eine Zunahme von β-Carotin, Lutein und Lycopin. Die Anwendung von Ozon auf Erdbeeren in der Vorerntezeit zeigt jedoch einen Rückgang des Ascorbinsäuregehalts. ⓘ
Ozon erleichtert die Extraktion einiger Schwermetalle aus dem Boden mit Hilfe von EDTA. EDTA bildet mit einigen Schwermetallen (Pb, Zn) starke, wasserlösliche Koordinationsverbindungen, die es ermöglichen, sie aus dem kontaminierten Boden herauszulösen. Wird kontaminierter Boden mit Ozon vorbehandelt, erhöht sich die Wirksamkeit der Extraktion von Pb, Am und Pu um 11,0-28,9%, 43,5% bzw. 50,7%. ⓘ
Alternative Medizin
Die Verwendung von Ozon zur Behandlung von Krankheiten wird nicht durch hochwertige Beweise gestützt und gilt allgemein als Alternativmedizin. ⓘ
Bildung
Raumluftreinigungsgeräte

Beim Betrieb von Raumluftreinigungsgeräten kann es gezielt oder ungewollt zur Bildung von Ozon kommen. So bilden einige Ionisatoren Ozon, um geruchlich wahrgenommene Moleküle der Umgebungsluft zu spalten und zu eliminieren. Allerdings bergen die Abbauprodukte von Nikotin und Zigarettenrauch, neben dem Ozon selbst, hohe gesundheitliche Risiken, so dass z. B. die Deutsche Lungenstiftung davor warnt, den schlechten Geruch verrauchter Räume mit Ozon generierenden Luftreinigern zu beseitigen. Die Richtlinie VDI 6022 Blatt 5 „Raumlufttechnik, Raumluftqualität - Vermeidung allergener Belastungen - Anforderung an die Prüfung und Bewertung von technischen Geräten und Komponenten mit Einfluss auf die Atemluft“ empfiehlt daher, beim Einsatz von Ionisatoren gegebenenfalls die Ozon-Emissionsrate zu bestimmen. ⓘ
Ozon kann auch beim Betrieb von elektrostatischen Abscheidern (Elektrofiltern), die zur Raumluftreinigung eingesetzt werden, entstehen. Dies ist insbesondere dann der Fall, wenn durch die negative Polung der Sprühelektrode eine negative Koronaentladung erzielt wird. Deshalb wird in der Regel bei raumlufttechnischen Anlagen von dieser Konstellation abgesehen. ⓘ
Ozon kann ebenfalls beim Betrieb von Raumluftreinigungsgeräten entstehen, die gezielt nichtthermisches Plasma erzeugen. Die Menge des erzeugten Ozons hängt dabei von der Bauart und der Leistungsaufnahme des eingesetzten Geräts ab. ⓘ
Fotokopierer
Bei älteren Fotokopierern sowie Laserdruckern kann man einen typischen „Ozongeruch“ wahrnehmen. Dieser Geruch rührt nur indirekt vom durch die Ionisation der Luft im Gerät gebildeten Ozon her; er kommt vielmehr durch Spuren nitroser Gase (NOx) zustande, die durch Reaktion des Ozons mit dem Luftstickstoff gebildet werden. Das Funktionsprinzip der Geräte erfordert eine Ionisierung der Luft bei Spannungen von 5–15 kV. Meist besitzen die Geräte Ozonfilter, die das produzierte Ozon in Kohlenstoffdioxid umwandeln. Dennoch sollten diese Geräte möglichst nicht in unbelüfteten Räumen verwendet werden. Moderne Drucker und Fotokopierer arbeiten mit einer Transferrollentechnik, welche die Ozonbildung verhindert und die ältere Coronadrahttechnik weitestgehend ersetzt hat. ⓘ
Gewinnung und Darstellung
Darstellung im Labor
Ozon kann aus der Reaktion von Kaliumpermanganat mit konzentrierter Schwefelsäure gewonnen werden. Das als Zwischenprodukt entstehende instabile Dimanganheptoxid Mn2O7 zerfällt bei Raumtemperatur zu Mangandioxid und Sauerstoff, der reich an Ozon ist. ⓘ
Bei der Elektrolyse verdünnter Schwefelsäure (ca. 20 %) entwickelt sich an einer Gold- oder Platinanode besonders bei hohen Stromdichten Ozon. Bei guter Kühlung lassen sich so 4–5 % Ozongehalt im entstehenden Sauerstoff erreichen, eine Konzentration, die ausreicht, um alle Reaktionen des Ozons im präparativen Maßstab ausführen zu können. Über ausgefeilte Apparaturen (z. B. feine Platindrahtwendeln) und Kühlung auf −14 °C lassen sich noch erheblich höhere Ozonkonzentrationen erreichen. ⓘ
Ozon lässt sich weiterhin aus Luftsauerstoff unter Einwirkung von Ultraviolettstrahlung oder stillen elektrischen Entladungen herstellen. Entsprechende, als Ozonisatoren bezeichnete Geräte gibt es im Handel. ⓘ
Technische Erzeugung
Erzeugung durch Elektrolyse von Wasser
Neben der Darstellung durch Ionisierung von Luftsauerstoff oder reinem Sauerstoff besteht die Möglichkeit, Ozon durch Elektrolyse von Wasser herzustellen. Hierbei werden meist Blei(IV)-Oxid Anoden verwendet, welche durch eine Polyelektrolytmembran von der Kathodenseite getrennt sind. An der Anode wird Wasser zu molekularem Sauerstoff oder bei Überspannung zu Ozon oxidiert. Die an der Anode entstehenden Protonen wandern durch die Membran an die Kathode und werden dort zu molekularem Wasserstoff reduziert. Das eigentliche Reaktionssystem ist jedoch komplexer. Die Ozonausbeute liegt bei der Darstellung durch Wasserelektrolyse bei etwa 20 %. Zudem entsteht das Ozon direkt in der Lösung und muss bei der Nutzung in flüssigen Medien nicht erst gelöst werden. ⓘ
Lagerung
Flüssiges Ozon lässt sich in Form einer 30 bis 75 %igen Lösung in flüssigem Sauerstoff bei −183 °C in Gegenwart von Stabilisatoren wie CClF3, OF2, SF6 oder andere ohne Explosionsgefahr lagern. Gasförmiges Ozon lässt sich im reinen Zustand (keine Verunreinigungen durch organische Verbindungen, Schwefel oder bestimmte Metalle) bei −112 bis −50 °C bei leichtem Überdruck recht gut lagern. ⓘ
Verwendung
Ozon in der Wasseraufbereitung
Bei der Wasseraufbereitung dient Ozon unter anderem zur umweltfreundlichen Oxidation von Eisen, Mangan, organischer Substanz und zur Entkeimung. Der erste Ozongenerator zur Trinkwasseraufbereitung wurde 1893 in Oudshoorn (Niederlande) installiert, es folgten Paris (Frankreich, 1898), das Wasserwerk Schierstein in Wiesbaden (1901) sowie Paderborn (1902). In diesen beiden deutschen Städten endete dadurch „schlagartig“ eine Typhus-Epidemie. Eine Ozonierung gehört in vielen Trinkwasserwerken zu den zentralen Aufbereitungsstufen. ⓘ
Oberflächenwasser kann in den wärmeren Jahreszeiten höhere Gehalte an Algen enthalten. Wird ein derartiges Wasser zu Brauchwasser für die Verwendung in der Industrie aufbereitet, so kann durch eine Hochozonisierung die Reinigungswirkung der Filteranlagen deutlich verbessert werden. Ozon tötet durch sein hohes Oxidationspotential sowohl Keime wie auch Algen weitgehend ab und verbessert die Abfiltrierbarkeit dieser feindispersen Verunreinigungen und damit die Reinigungswirkung. ⓘ
Auch in der Behandlung von kommunalen und industriellen Abwässern kommt Ozon zum Einsatz (Kläranlage). Die Ozonierung wird dabei der üblichen Abwasserreinigung durch Mikroorganismen zusätzlich nachgeschaltet. Allerdings handelt es sich bei Kläranlagen mit Ozonanlagen meist um Pilotprojekte (wie zum Beispiel in Regensdorf-Watt in der Schweiz), denn die Produktion von Ozon in solch großen Maßstäben ist teuer, energieaufwändig und die Schutzmaßnahmen gegen den giftigen und ätzenden Stoff sind erheblich. Zurzeit wird diskutiert, ob die Abwasserreinigung durch die ungiftige Aktivkohle nicht ungefährlicher, billiger und umweltfreundlicher ist. ⓘ
Ziele einer weitergehenden Ozonbehandlung des konventionell gereinigten Abwassers sind: (a) Abtötung pathogener Keime (Desinfektion) zur Sicherung des Vorfluters (z. B. in Hinsicht auf die Badegewässerrichtlinie) (b) oxidative Elimination/Transformation von nicht oder nur schlecht abbaubaren organischen Spurenstoffen (insbesondere Medikamentenrückstände). ⓘ
Ein Nachteil der Ozonierung ist die Entstehung von unbekannten und möglicherweise giftigen Produkten, wenn Ozon mit Schadstoffen im Wasser reagiert. So wird die Bildung von krebserregenden Nitrosaminen vermutet. Des Weiteren werden einige Schadstoffe, zum Beispiel iodhaltige Röntgenkontrastmittel, von Ozon praktisch nicht abgebaut. Sie gelangen deshalb weiterhin in die Umwelt. ⓘ
Ozon kann sehr gut in Verfahrenskombinationen mit nachfolgenden biologischen Systemen (Biofilter) eingesetzt werden, so beispielsweise bei der Oxidation des chemischen Sauerstoffbedarfs (CSB) zum biologischen Sauerstoffbedarf (BSB), der dann im Biofilter weiterverarbeitet wird. Ebenso findet Ozon in Fischkreisläufen in der Aquakultur oder Aquariensystemen Anwendung. ⓘ
Bei den meisten „chlorfrei“ benannten Produkten oder Verfahren wird Ozon eingesetzt, so zum Beispiel beim Bleichen von Papier. In diesem Zusammenhang ist oft von „aktivem Sauerstoff“ die Rede. ⓘ
Ozon in der Abgasbehandlung
Bei der oxidierenden Gaswäsche wird Ozon als Oxidationsmittel in Gaswäschern eingesetzt, um in der Waschflüssigkeit gelöste Substanzen chemisch umzusetzen und so das treibende Konzentrationsgefälle zwischen zu reinigendem Gas und Waschflüssigkeit zu erhöhen. Dieses Verfahren findet bei reaktionsträgen organischen Stoffen und bei heterogenen Gasgemischen mit häufig geruchsintensiven Stoffen Anwendung. Alternativ besteht die Möglichkeit, schwer wasserlösliche Verunreinigungen mittels Ozon, das in den Abgasstrom geleitet wird, in höhere Oxidationsstufen überzuführen, die dann mit einem Gaswäscher entfernt werden können. ⓘ
Zur Beseitigung von Gerüchen
Die Behandlung mit Ozon kann der Desodorierung, also der Entfernung von unangenehmen Gerüchen, dienen. Diese Ozonbehandlung wird in der professionellen Fahrzeugaufbereitung vorgenommen, insbesondere bei Gebrauchtwagen mit Geruchsbelastung im Innenraum (z. B. ehemalige Raucherfahrzeuge). Durch die oxidierende Wirkung des Ozons werden Geruchsstoffe in geruchsneutrale Stoffe umgewandelt. Ebenso werden Keime und geruchverursachende Bakterien dabei – auch an sonst unzugänglichen Stellen – abgetötet. Als Ergebnis ist das Fahrzeug nach dieser Behandlung desinfiziert und in der Regel geruchsfrei. ⓘ
Waschen und Behandeln von Textilien
Einige moderne Waschmaschinen haben ein Ozonprogramm, welches Umgebungsluft nutzt und mittels eines Ozongenerators die Wäsche desinfiziert und Gerüche eliminiert. Auch Wäschereien nutzen diese Technik. Das Behandeln von Textilien mit Ozon kann dazu genutzt werden, ihre Färbung verblassen zu lassen, um beispielsweise neue Jeanshosen wie schon getragene und verwaschene aussehen zu lassen (vintage). ⓘ
Ozon als Bleichmittel
Ozon wird in modernen Industrien auch als starkes Bleichmittel eingesetzt, es muss jedoch aufgrund seiner chemischen Flüchtigkeit und Instabilität am besten am Ort der Verwendung hergestellt werden. ⓘ
Weitere Verwendungen
Ozon wurde z. B. zur Beschleunigung des Aushärtens von Lacken benutzt. Früher – und in der Alternativmedizin teilweise noch heute – wurde die Ozontherapie in Behandlungsversuchen verschiedener Leiden eingesetzt, beispielsweise gegen Diabetes und Krebs. Solche Behandlungen zählen oft zur Quacksalberei und die intravenöse Anwendung von Ozon wurde in Deutschland 1984 wegen der möglichen schweren Nebenwirkungen verboten. ⓘ
Ozon ist auch ein wichtiges Reagens in der synthetischen Chemie. Beispielsweise kann Vanillin aus Eugenol erhalten werden, indem man dieses mit Ozon oxidiert. Die Ozonolyse, die Umsetzung von ungesättigten Verbindungen mit Ozon, war jahrzehntelang ein wichtiges Verfahren zur Strukturaufklärung solcher Stoffe. ⓘ
Messung von Ozon

Immissionsmessung
Ozon in der Außenluft kann photometrisch erfasst werden. Dazu wird die kontinuierlich angesaugte Probenluft durch eine Messküvette geleitet, die mit monochromatischer Strahlung einer bestimmten Wellenlänge beaufschlagt wird. Die durchtretende und somit nicht absorbierte Strahlung wird mittels Photodiode oder Photomultiplier gemessen und gibt damit Auskunft über die Ozonkonzentration in der Luft. Dieses Messverfahren beruht auf dem lambert-beerschen Gesetz. ⓘ
Ein anderes Verfahren zur messtechnischen Erfassung von Ozon in der Außenluft ist das Kaliumiodid-Verfahren: In wässriger Lösung reagiert Ozon mit Kaliumiodid unter Freisetzung von Iod und Sauerstoff. Die Extinktion der Iodlösung ist ein Maß für die Ozonkonzentration der Probenluft, die durch die Kaliumiodidlösung geleitet wurde. Das Verfahren ist nicht selektiv bezüglich Ozon. Als Absorptionsgefäße sind Muenke-Waschflaschen zu verwenden. ⓘ
Auch die differenzielle optische Absorptionsspektroskopie DOAS wird zur Ozonmessung eingesetzt. Untersuchungen zur Qualitätssicherung unterschiedlicher Messmethoden liegen ebenfalls vor. ⓘ
Problematisch bei der Immissionsmessung von Ozon ist, dass keine haltbaren Prüfgase hergestellt werden können. Zudem ist darauf zu achten, dass die eingesetzten Werkstoffe nicht mit dem Ozon reagieren können. ⓘ
Bioindikation
Wirkungen von Ozon können mit Tabakpflanzen systematisch untersucht werden. Zur Bioindikation werden die makroskopisch erkennbaren Blattschäden an der Pflanze als Wirkungsmessgröße herangezogen. ⓘ








![{\displaystyle K_{1}={K_{1} \over K_{-1}}={[O_{2}]\cdot [O] \over [O_{3}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/790e2ee894cf7ce231dd072be28e6e51e8340ac6)
![{\displaystyle [O]={K_{1}\cdot [O_{3}] \over K_{-1}\cdot [O_{2}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e2379ad127a03a4bf3ca94183a20b5fa3fc00e11)
![{\displaystyle V={2K_{2}\cdot K_{1}\cdot [O_{3}]^{2} \over K_{-1}\cdot [O_{2}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d1395af6c802f7969c8c5d37d0a2a5cc4b9cd371)
![{\displaystyle V={K_{obs}\cdot [O_{3}]^{2} \over [O_{2}]}=K_{obs}\cdot [O_{3}]^{2}\cdot [O_{2}]^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/66b7f62c5f8599754ba525ce4adf754150878cf8)


![{\displaystyle {\ce {O2->[{\ce {Photon}}][({\ce {Strahlung}}\ \lambda \ <\ 240\ {\ce {nm}})]2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/720750fc58d51d296f62aef0ea622559a8d4b6cd)
