Influenza
| Influenza ⓘ | |
|---|---|
| Andere Namen | Grippe, die Grippe, Grippe |
 | |
| Influenzavirus, etwa 100.000-fach vergrößert | |
| Fachgebiet | Ansteckende Krankheit |
| Symptome | Fieber, laufende Nase, Halsschmerzen, Muskelschmerzen, Kopfschmerzen, Husten, Müdigkeit |
| Gewöhnlicher Ausbruch | 1-4 Tage nach der Exposition |
| Dauer | 2-8 Tage |
| Verursacher | Influenza-Viren |
| Vorbeugung | Händewaschen, Grippeimpfungen |
| Medikation | Antivirale Medikamente wie Oseltamivir |
| Häufigkeit | 3-5 Millionen schwere Fälle pro Jahr |
| Todesfälle | >290.000-650.000 Todesfälle pro Jahr |
Die Grippe (Influenza) ist eine durch Influenzaviren hervorgerufene Infektionskrankheit, die in der Regel als "Grippe" bezeichnet wird. Die Symptome reichen von leicht bis schwer und umfassen häufig Fieber, eine laufende Nase, Halsschmerzen, Muskelschmerzen, Kopfschmerzen, Husten und Müdigkeit. Diese Symptome treten ein bis vier Tage nach der Virusinfektion auf (in der Regel zwei Tage) und halten etwa 2-8 Tage an. Durchfall und Erbrechen können auftreten, insbesondere bei Kindern. Die Influenza kann sich zu einer Lungenentzündung entwickeln, die durch das Virus oder eine nachfolgende bakterielle Infektion verursacht werden kann. Zu den weiteren Komplikationen der Infektion gehören akutes Atemnotsyndrom, Meningitis, Enzephalitis und die Verschlimmerung bereits bestehender Gesundheitsprobleme wie Asthma und Herz-Kreislauf-Erkrankungen. ⓘ
Es gibt vier Arten von Influenzaviren, die als Influenzaviren A, B, C und D bezeichnet werden. Wasservögel sind die Hauptquelle des Influenza-A-Virus (IAV), das auch bei verschiedenen Säugetieren, einschließlich Menschen und Schweinen, verbreitet ist. Das Influenza-B-Virus (IBV) und das Influenza-C-Virus (ICV) infizieren in erster Linie Menschen, während das Influenza-D-Virus (IDV) bei Rindern und Schweinen vorkommt. IAV und IBV zirkulieren beim Menschen und verursachen saisonale Epidemien, und ICV verursacht eine milde Infektion, vor allem bei Kindern. IDV kann den Menschen infizieren, ist aber nicht dafür bekannt, Krankheiten zu verursachen. Beim Menschen werden Influenzaviren hauptsächlich durch Tröpfcheninfektion beim Husten und Niesen übertragen. Eine Übertragung durch Aerosole und mit dem Virus kontaminierte Gegenstände und Oberflächen ist ebenfalls möglich. ⓘ
Häufiges Händewaschen und das Bedecken von Mund und Nase beim Husten und Niesen verringern die Übertragung. Eine jährliche Impfung kann helfen, sich vor der Grippe zu schützen. Influenzaviren, insbesondere IAV, entwickeln sich schnell weiter, so dass die Grippeimpfstoffe regelmäßig aktualisiert werden, um den im Umlauf befindlichen Grippestämmen zu entsprechen. Die derzeit verwendeten Impfstoffe bieten Schutz gegen die IAV-Subtypen H1N1 und H3N2 sowie einen oder zwei IBV-Subtypen. Eine Grippeinfektion wird mit Labormethoden wie Antikörper- oder Antigentests und einer Polymerase-Kettenreaktion (PCR) zum Nachweis viraler Nukleinsäure diagnostiziert. Die Krankheit kann mit unterstützenden Maßnahmen und in schweren Fällen mit antiviralen Medikamenten wie Oseltamivir behandelt werden. Bei gesunden Menschen verläuft die Influenza in der Regel selbstlimitierend und selten tödlich, in Hochrisikogruppen kann sie jedoch tödlich verlaufen. ⓘ
In einem typischen Jahr erkranken 5-15 % der Bevölkerung an Influenza. Jährlich gibt es 3 bis 5 Millionen schwere Fälle mit bis zu 650.000 atemwegsbedingten Todesfällen weltweit. Die meisten Todesfälle ereignen sich in Hochrisikogruppen, darunter Kleinkinder, ältere Menschen und Menschen mit chronischen Erkrankungen. In den gemäßigten Regionen der Welt erreicht die Zahl der Grippefälle im Winter ihren Höhepunkt, während die Grippe in den Tropen ganzjährig auftreten kann. Seit Ende des 19. Jahrhunderts treten alle 10 bis 50 Jahre große Ausbrüche neuartiger Grippestämme auf, die sich weltweit ausbreiten, so genannte Pandemien. Seit 1900 gab es fünf Grippepandemien: die Spanische Grippe 1918-1920, die schwerste Grippepandemie, die Asiatische Grippe 1957, die Hongkong-Grippe 1968, die Russische Grippe 1977 und die Schweinegrippe-Pandemie 2009. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| J09 | Grippe durch nachgewiesene Vogelgrippe-Viren |
| J10 | Grippe durch sonstige nachgewiesene Influenzaviren |
| J10.0 | Grippe mit Pneumonie, sonstige Influenzaviren nachgewiesen |
| J10.1 | Grippe mit sonstigen Manifestationen an den Atemwegen, sonstige Influenzaviren nachgewiesen |
| J10.8 | Grippe mit sonstigen Manifestationen, sonstige Influenzaviren nachgewiesen |
| J11 | Grippe, Viren nicht nachgewiesen |
| ICD-10 online (WHO-Version 2019) | |
Die Influenza (italienisch für „Einfluss“), auch (echte) Grippe oder Virusgrippe genannt, ist eine durch Viren der Familie Orthomyxoviridae und dabei überwiegend von den Gattungen Influenzavirus A oder B ausgelöste fieberhafte Infektionskrankheit bei Menschen. Die Grippe tritt meist epidemisch und unter Beteiligung der Atemwege auf. Von der Influenza ist die wegen teilweiser Symptomähnlichkeit verständliche umgangssprachliche Bezeichnung Grippaler Infekt für eine Erkältung klar abzugrenzen, da nach den Erkenntnissen der modernen Medizin die eine Erkältung verursachenden Viren zweifelsfrei keine Grippeviren sind. In der Tiermedizin werden durch Influenzaviren hervorgerufene Erkrankungen ebenfalls als Influenza bezeichnet und nach der betroffenen Tierart benannt (Aviäre Influenza, Pferdeinfluenza, Schweineinfluenza). Diese Erkrankungen können ebenfalls auf den Menschen übergehen und sind damit Zoonosen. ⓘ
Anzeichen und Symptome

Die Zeit zwischen der Exposition gegenüber dem Virus und dem Auftreten von Symptomen, die so genannte Inkubationszeit, beträgt 1-4 Tage, in der Regel 1-2 Tage. Viele Infektionen verlaufen jedoch asymptomatisch. Die ersten Symptome treten plötzlich auf und sind überwiegend unspezifisch: Fieber, Schüttelfrost, Kopfschmerzen, Muskelschmerzen oder -kater, Unwohlsein, Appetitlosigkeit, Energielosigkeit/Müdigkeit und Verwirrung. Diese Symptome werden in der Regel von Atemwegssymptomen wie trockenem Husten, Halsschmerzen oder trockenem Rachen, heiserer Stimme und verstopfter oder laufender Nase begleitet. Husten ist das häufigste Symptom. Auch gastrointestinale Symptome können auftreten, darunter Übelkeit, Erbrechen, Durchfall und Gastroenteritis, insbesondere bei Kindern. Die üblichen Grippesymptome halten in der Regel 2-8 Tage an. Eine Studie aus dem Jahr 2021 legt nahe, dass die Influenza ähnlich wie COVID lang anhaltende Symptome verursachen kann. ⓘ
Symptomatische Infektionen verlaufen in der Regel mild und beschränken sich auf die oberen Atemwege, doch kommt es relativ häufig zu einer Lungenentzündung. Eine Lungenentzündung kann durch die primäre Virusinfektion oder durch eine sekundäre bakterielle Infektion verursacht werden. Die primäre Lungenentzündung ist gekennzeichnet durch schnelles Fieber, Husten, erschwerte Atmung und einen niedrigen Sauerstoffgehalt, der eine bläuliche Haut verursacht. Sie tritt besonders häufig bei Personen auf, die eine kardiovaskuläre Grunderkrankung wie eine rheumatische Herzerkrankung haben. Bei der sekundären Lungenentzündung kommt es typischerweise zu einer Besserung der Symptome über einen Zeitraum von 1 bis 3 Wochen, gefolgt von wiederkehrendem Fieber, Auswurf und Flüssigkeitsansammlungen in der Lunge, sie kann aber auch nur wenige Tage nach dem Auftreten von Grippesymptomen auftreten. Auf etwa ein Drittel der Fälle von primärer Lungenentzündung folgt eine sekundäre Lungenentzündung, die am häufigsten durch die Bakterien Streptococcus pneumoniae und Staphylococcus aureus verursacht wird. ⓘ
Möglich, aber weniger kennzeichnend für eine Influenza sind:
- Augentränen
- trockene Kehle
- angeschwollene Nasenschleimhaut
- Tracheobronchitis bei schwerer Grippe
- Appetitlosigkeit, Müdigkeit, Übelkeit, Erbrechen und Durchfall ⓘ
Virologie
Arten von Viren

Influenzaviren bestehen aus vier Arten. Jede der vier Arten ist das einzige Mitglied ihrer eigenen Gattung, und die vier Influenza-Gattungen umfassen vier der sieben Gattungen der Familie der Orthomyxoviridae. Diese sind:
- Influenza-A-Virus (IAV), Gattung Alphainfluenzavirus
- Influenza-B-Virus (IBV), Gattung Betainfluenzavirus
- Influenza-C-Virus (ICV), Gattung Gammainfluenzavirus
- Influenza-D-Virus (IDV), Gattung Deltainfluenzavirus ⓘ
IAV ist für die meisten Fälle schwerer Erkrankungen sowie für saisonale Epidemien und gelegentliche Pandemien verantwortlich. Es infiziert Menschen aller Altersgruppen, führt aber bei älteren und sehr jungen Menschen sowie bei Menschen mit chronischen Gesundheitsproblemen überproportional häufig zu schweren Erkrankungen. Vögel sind das Hauptreservoir von IAV, insbesondere Wasservögel wie Enten, Gänse, Küstenvögel und Möwen, aber das Virus zirkuliert auch unter Säugetieren, einschließlich Schweinen, Pferden und Meeressäugetieren. IAV wird auf der Grundlage der viralen Proteine Hämagglutinin (H) und Neuraminidase (N) in Subtypen eingeteilt. Bis 2019 sind 18 H-Subtypen und 11 N-Subtypen identifiziert worden. Die meisten potenziellen Kombinationen wurden bei Vögeln gefunden, aber H17-18 und N10-11 wurden nur bei Fledermäusen gefunden. Nur von den H-Subtypen H1-3 und den N-Subtypen N1-2 ist bekannt, dass sie beim Menschen zirkuliert haben; die derzeit im Umlauf befindlichen IAV-Subtypen sind H1N1 und H3N2. IAVs können spezifischer klassifiziert werden, um auch die natürliche Wirtsspezies, die geografische Herkunft, das Jahr der Isolierung und die Stammnummer, wie z. B. H1N1/A/duck/Alberta/35/76, zu erfassen. ⓘ
IBV infiziert hauptsächlich Menschen, wurde aber auch bei Robben, Pferden, Hunden und Schweinen nachgewiesen. IBV hat keine Subtypen wie IAV, sondern zwei antigenisch unterschiedliche Linien, die als B/Victoria/2/1987-like und B/Yamagata/16/1988-like oder einfach als (B/)Victoria(-like) und (B/)Yamagata(-like) bezeichnet werden. Beide Linien sind beim Menschen im Umlauf, wobei Kinder überproportional häufig betroffen sind. IBVs tragen neben IAVs zu saisonalen Epidemien bei, wurden aber noch nie mit einer Pandemie in Verbindung gebracht. ⓘ
ICV ist wie IBV hauptsächlich beim Menschen anzutreffen, wurde aber auch bei Schweinen, Wildhunden, Dromedarkamelen, Rindern und Hunden nachgewiesen. Eine ICV-Infektion betrifft in erster Linie Kinder und verläuft in der Regel asymptomatisch oder mit leichten, erkältungsähnlichen Symptomen, obwohl auch schwerere Symptome wie Gastroenteritis und Lungenentzündung auftreten können. Im Gegensatz zu IAV und IBV stand ICV bisher nicht im Mittelpunkt der Forschung im Hinblick auf antivirale Medikamente, Impfstoffe und andere Maßnahmen gegen Influenza. ICV wird in sechs genetische/antigene Linien eingeteilt. ⓘ
IDV wurde von Schweinen und Rindern isoliert, wobei letztere das natürliche Reservoir darstellen. Eine Infektion wurde auch bei Menschen, Pferden, Dromedarkamelen und kleinen Wiederkäuern wie Ziegen und Schafen beobachtet. IDV ist entfernt mit ICV verwandt. Während Rinderarbeiter gelegentlich positiv auf eine frühere IDV-Infektion getestet wurden, ist nicht bekannt, dass es beim Menschen Krankheiten verursacht. ICV und IDV weisen eine langsamere antigene Entwicklung auf als IAV und IBV. Aufgrund dieser antigenen Stabilität entstehen relativ wenige neue Linien. ⓘ
Genom und Struktur
Influenzaviren haben ein einzelsträngiges RNA-Genom mit negativem Sinn, das segmentiert ist. Der negative Sinn des Genoms bedeutet, dass es als Vorlage für die Synthese von Boten-RNA (mRNA) verwendet werden kann. IAV und IBV haben acht Genomsegmente, die für 10 Hauptproteine kodieren. ICV und IDV haben sieben Genomsegmente, die für neun Hauptproteine kodieren. Drei Segmente kodieren für drei Untereinheiten eines RNA-abhängigen RNA-Polymerase-Komplexes (RdRp): PB1, eine Transkriptase, PB2, die 5'-Kappen erkennt, und PA (P3 für ICV und IDV), eine Endonuklease. Das Matrixprotein (M1) und das Membranprotein (M2) teilen sich ein Segment, ebenso wie das Nicht-Strukturprotein (NS1) und das Kernexportprotein (NEP). Bei IAV und IBV werden Hämagglutinin (HA) und Neuraminidase (NA) auf je einem Segment kodiert, während ICV und IDV ein Hämagglutinin-Esterase-Fusionsprotein (HEF) auf einem Segment kodieren, das die Funktionen von HA und NA vereint. Das letzte Genomsegment kodiert für das virale Nukleoprotein (NP). Influenzaviren kodieren auch für verschiedene akzessorische Proteine, wie PB1-F2 und PA-X, die durch alternative offene Leserahmen exprimiert werden und für die Unterdrückung der Wirtsabwehr, die Virulenz und die Pathogenität wichtig sind. ⓘ
Das Viruspartikel, ein so genanntes Virion, ist pleomorph und variiert in seiner Form zwischen fadenförmig, bazillenförmig und kugelförmig. Klinische Isolate sind in der Regel pleomorph, während Stämme, die an das Wachstum im Labor angepasst sind, in der Regel kugelförmige Virionen produzieren. Fadenförmige Virionen haben einen Durchmesser von etwa 250 mal 80 Nanometern (nm), bazillenförmige einen Durchmesser von 120 bis 250 mal 95 nm und kugelförmige einen Durchmesser von 120 nm. Das Virion besteht aus jedem Segment des Genoms, das an Nukleoproteine in separaten Ribonukleoproteinkomplexen (RNP) für jedes Segment gebunden ist, die alle von einer Lipid-Doppelschichtmembran, der Virushülle, umgeben sind. An jedes RNP ist eine Kopie des RdRp, einschließlich aller Untereinheiten, gebunden. Die Hülle wird strukturell durch Matrixproteine im Inneren verstärkt, die die RNPs einschließen, und die Hülle enthält HA- und NA- (oder HEF-) Proteine, die sich von der Außenfläche der Hülle nach außen erstrecken. HA- und HEF-Proteine haben eine ausgeprägte "Kopf"- und "Stiel"-Struktur. M2-Proteine bilden Protonen-Ionenkanäle durch die Virushülle, die für den Eintritt und Austritt des Virus erforderlich sind. IBVs enthalten ein Oberflächenprotein namens NB, das in der Hülle verankert ist, dessen Funktion jedoch unbekannt ist. ⓘ
Lebenszyklus

Der virale Lebenszyklus beginnt mit der Bindung an eine Zielzelle. Die Bindung wird durch die viralen HA-Proteine auf der Oberfläche der Hülle vermittelt, die an Zellen binden, die Sialinsäure-Rezeptoren auf der Oberfläche der Zellmembran enthalten. Bei N1-Subtypen mit der "G147R"-Mutation und N2-Subtypen kann das NA-Protein den Eintritt initiieren. Vor der Bindung fördern die NA-Proteine den Zugang zu den Zielzellen, indem sie Schleim abbauen, was dazu beiträgt, extrazelluläre Decoy-Rezeptoren zu entfernen, die den Zugang zu den Zielzellen behindern würden. Nach der Bindung wird das Virus durch ein Endosom, das das Virion enthält, in die Zelle internalisiert. Das Endosom wird durch die zelluläre vATPase auf einen niedrigeren pH-Wert angesäuert, was eine Konformationsänderung des HA auslöst, die die Fusion der Virushülle mit der endosomalen Membran ermöglicht. Gleichzeitig diffundieren Wasserstoffionen durch M2-Ionenkanäle in das Virion, wodurch die internen Protein-Protein-Wechselwirkungen unterbrochen werden und die RNPs in das Zytosol der Wirtszelle freigesetzt werden. Die M1-Proteinhülle, die die RNPs umgibt, wird abgebaut, wodurch die RNPs im Zytosol vollständig entmantelt werden. ⓘ
Die RNPs werden dann mit Hilfe von viralen Lokalisierungssignalen in den Zellkern importiert. Dort transkribiert die virale RNA-Polymerase mRNA unter Verwendung des genomischen Negativ-Sense-Strangs als Vorlage. Die Polymerase schnappt sich die 5'-Kappen für die virale mRNA von der zellulären RNA, um die mRNA-Synthese zu starten, und das 3'-Ende der mRNA wird am Ende der Transkription polyadenyliert. Sobald die virale mRNA transkribiert ist, wird sie aus dem Zellkern exportiert und von den Ribosomen des Wirts in einer Cap-abhängigen Weise übersetzt, um virale Proteine zu synthetisieren. RdRp synthetisiert auch komplementäre Positiv-Sinn-Stränge des viralen Genoms in einem komplementären RNP-Komplex, der dann von viralen Polymerasen als Vorlage für die Synthese von Kopien des Negativ-Sinn-Genoms verwendet wird. Während dieser Prozesse funktionieren die RdRps von Vogelgrippeviren (AIV) optimal bei einer höheren Temperatur als bei Säugetier-Influenzaviren. ⓘ
Neu synthetisierte virale Polymerase-Untereinheiten und NP-Proteine werden in den Zellkern importiert, um die virale Replikationsrate weiter zu erhöhen und RNPs zu bilden. HA-, NA- und M2-Proteine werden mit Hilfe von M1- und NEP-Proteinen durch den Golgi-Apparat zur Zellmembran transportiert und in die Zellmembran eingebaut. Virale Nicht-Strukturproteine wie NS1, PB1-F2 und PA-X regulieren zelluläre Prozesse des Wirts, um antivirale Reaktionen zu deaktivieren. PB1-F2 interagiert auch mit PB1, um die Polymerasen länger im Zellkern zu halten. M1- und NEP-Proteine lokalisieren sich in den späteren Phasen der Infektion im Zellkern, binden an virale RNPs und vermitteln deren Export ins Zytoplasma, wo sie mit Hilfe von recycelten Endosomen zur Zellmembran wandern und in die Segmente des Genoms gebündelt werden. ⓘ
Progene Viren verlassen die Zelle durch Knospung aus der Zellmembran, die durch die Anhäufung von M1-Proteinen an der zytoplasmatischen Seite der Membran eingeleitet wird. Das virale Genom wird in eine Virushülle eingebaut, die aus Teilen der Zellmembran besteht, die HA-, NA- und M2-Proteine enthalten. Am Ende der Knospung bleiben die HA-Proteine an die zelluläre Sialinsäure gebunden, bis sie durch die Sialidase-Aktivität der NA-Proteine gespalten werden. Das Virion wird dann aus der Zelle freigesetzt. Die Sialidaseaktivität von NA spaltet auch alle Sialinsäurereste von der Virusoberfläche ab, was dazu beiträgt, dass neu zusammengesetzte Viren nicht in der Nähe der Zelloberfläche aggregieren und die Infektiosität verbessern. Ähnlich wie bei anderen Aspekten der Influenza-Replikation ist die optimale NA-Aktivität temperatur- und pH-abhängig. Letztendlich löst das Vorhandensein großer Mengen viraler RNA in der Zelle die Apoptose aus, d. h. den programmierten Zelltod, der durch zelluläre Faktoren eingeleitet wird, um die virale Replikation einzuschränken. ⓘ
Antigene Drift und Verschiebung
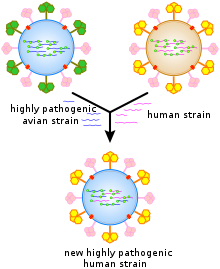
Zwei wichtige Prozesse, durch die sich Influenzaviren weiterentwickeln, sind die Antigendrift und der Antigenshift. Antigendrift bedeutet, dass sich die Antigene eines Influenzavirus durch die allmähliche Anhäufung von Mutationen im Antigen-Gen (HA oder NA) verändern. Dies kann als Reaktion auf den evolutionären Druck durch die Immunantwort des Wirts auftreten. Antigendrift ist besonders häufig beim HA-Protein, bei dem schon wenige Aminosäureveränderungen in der Kopfregion eine Antigendrift auslösen können. Das Ergebnis ist die Produktion neuartiger Stämme, die die bereits vorhandene Antikörper-vermittelte Immunität umgehen können. Antigendrift tritt bei allen Influenzaspezies auf, ist aber bei B langsamer als bei A und am langsamsten bei C und D. Antigendrift ist eine der Hauptursachen für die saisonale Grippe und macht es erforderlich, dass die Grippeimpfstoffe jährlich aktualisiert werden. HA ist der Hauptbestandteil von inaktivierten Impfstoffen, so dass die Überwachung die Antigendrift dieses Antigens unter den zirkulierenden Stämmen überwacht. Die Antigenentwicklung bei Influenzaviren des Menschen scheint schneller zu verlaufen als bei Influenzaviren von Schweinen und Pferden. Bei Wildvögeln scheint die Antigenvariation innerhalb eines Subtyps begrenzt zu sein, wurde aber bei Geflügel beobachtet. ⓘ
Antigenshift ist eine plötzliche, drastische Veränderung des Antigens eines Influenzavirus, in der Regel HA. Während des Antigenshifts können antigenisch unterschiedliche Stämme, die dieselbe Zelle infizieren, Genomsegmente miteinander reassortieren, wodurch hybride Nachkommen entstehen. Da alle Influenzaviren segmentierte Genome haben, sind alle zur Reassortierung fähig. Eine Antigenverschiebung findet jedoch nur zwischen Influenzaviren der gleichen Gattung statt und kommt am häufigsten bei IAVs vor. Reassortierung ist insbesondere bei AIVs sehr häufig und führt zu einer großen Vielfalt von Influenzaviren bei Vögeln, ist aber bei Menschen, Pferden und Hunden eher selten. Schweine, Fledermäuse und Wachteln haben Rezeptoren sowohl für Säugetier- als auch für Vogelinfluenzaviren, so dass sie potenzielle "Mischgefäße" für Reassortierung sind. Wenn sich ein Tierstamm mit einem menschlichen Stamm reassortiert, kann ein neuer Stamm entstehen, der von Mensch zu Mensch übertragen werden kann. Dies hat bereits zu Pandemien geführt, die jedoch nur in begrenzter Zahl aufgetreten sind, so dass es schwierig ist, vorherzusagen, wann die nächste eintreten wird. ⓘ
Mechanismus
Übertragung
Das Virus dringt über die Schleimhaut der Atemwege, des Mundes und der Augen in den Körper ein. Es erreicht diese Eintrittsorte
- durch Tröpfcheninfektion, also über den Kontakt der Schleimhaut mit Exspirationströpfchen, die beim Niesen, Husten, Sprechen oder Atmen von infizierten Personen entstehen. Die größeren infektiösen Tröpfchen sinken innerhalb von etwa zwei Metern nach unten und verkleben besonders fest an rauen Oberflächen. Wenn die Exspirationströpfchen jedoch bereits in der Luft trocknen, können die darin enthaltenen sehr kleinen Viren von ca. 0,1 µm Durchmesser als Aerosol (auch Tröpfchenkerne oder airborne genannt) über weite Strecken in der Luft schweben und stundenlang infektiös bleiben. Trockene Raumluft in geheizten Räumen und die niedrige absolute Luftfeuchtigkeit im Winter begünstigen Aerosole und könnten ein Grund für das Auftreten von Grippewellen im Winter sein. Infizierte Personen können durch Tragen von Atemmasken den Tröpfchenausstoß stark vermindern, da die frischen Tröpfchen direkt vor deren Mund gut im Filtermaterial kleben bleiben. Gegen eine Infektion über das Aerosol kann man sich durch eine Gegenluftströmung schützen. Einfache Atemmasken über Mund und Nase halten die als Aerosol übertragenen Viren teilweise zurück, aber nicht zuverlässig, weil die Filtermaterialien Viren nicht vollständig zurückhalten können, die Masken nicht dicht genug anliegen und die Augen überhaupt nicht abdecken. Lüften kann das Infektionsrisiko durch Verdünnen der Aerosolkonzentration im Raum verringern, wenn dabei das Aerosol nicht in andere Wohnräume des Gebäudes gelangt. ⓘ
- über Kontaktinfektion oder Schmierinfektion mit Viren, die in Exspirationströpfchen oder durch verschmiertes Nasensekret oder Berührung von Infizierten auf Gegenstände gelangen und dort innerhalb von zwei Tagen besonders leicht von glatten Oberflächen über die Hände auf die eigenen Schleimhäute übertragen werden.
- durch Kotpartikel erkrankter Wirte und Vektoren
- durch Viren auf Hautschuppen, Haaren, Gefieder und Staub
- durch Kontakt mit Speichel erkrankter Personen
Das Virus ist unempfindlich gegen Austrocknung und bleibt bei niedriger Temperatur und niedriger Luftfeuchtigkeit länger infektiös. ⓘ
| Temperatur | Luftfeuchtigkeit | Umgebung | Zeit | Quelle ⓘ | |
|---|---|---|---|---|---|
| (°C) | (%rF) | aktiv | kontakt-infektiös | ||
| <0 | im Eis | unbegrenzt | |||
| 0 | >30 d | ||||
| ? | glatte Oberflächen wie Edelstahl oder Plastik | 24–48 h | <24 h | ||
| ? | Textilien, Papier, Papiertaschentücher | 8–12 h | <15 min | ||
| ? | Geldscheine | 1–17 d | |||
| 20 | auf Oberflächen an Luft | 2–8 h | |||
| 21 | 20 | als Aerosol in Luft | > 60 min | ||
| 40 | = 56 min | ||||
| 70 | = 28 min | ||||
| 22 | im Wasser | >4 d | |||
| 34 | auf Händen | <5 min | |||
| 56 | <3 h | ||||
| 60 | <30 min | ||||
| >70 | wenige Sekunden | ||||
t½ = Halbwertszeit ⓘ
Die Inkubationszeit beträgt je nach Untersuchung, Methode oder Virus-Subtyp 1,2 bis 4 Tage. ⓘ
Pathophysiologie
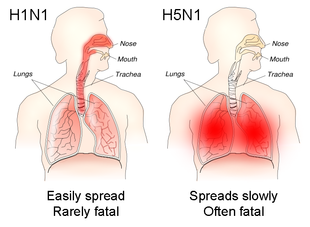
Beim Menschen verursachen Influenzaviren zunächst eine Infektion, indem sie Epithelzellen im Atemtrakt infizieren. Die Erkrankung während der Infektion ist in erster Linie das Ergebnis einer Entzündung und Beeinträchtigung der Lunge, die durch die Infektion und das Absterben von Epithelzellen verursacht wird, in Verbindung mit einer Entzündung, die durch die Reaktion des Immunsystems auf die Infektion verursacht wird. Auch andere Organe als die Atemwege können betroffen sein, aber die Mechanismen, durch die die Influenza in diesen Fällen verursacht wird, sind unbekannt. Schwere Atemwegserkrankungen können durch mehrere, sich nicht ausschließende Mechanismen verursacht werden, darunter die Obstruktion der Atemwege, der Verlust der Alveolarstruktur, der Verlust der Integrität des Lungenepithels aufgrund einer Infektion und des Absterbens von Epithelzellen sowie der Abbau der extrazellulären Matrix, die die Lungenstruktur aufrechterhält. Insbesondere die Infektion der Alveolarzellen scheint die Ursache für schwere Symptome zu sein, da dies zu einem beeinträchtigten Gasaustausch führt und es den Viren ermöglicht, Endothelzellen zu infizieren, die große Mengen entzündungsfördernder Zytokine produzieren. ⓘ
Eine durch Influenzaviren verursachte Lungenentzündung ist durch eine hohe Virusreplikation in den unteren Atemwegen gekennzeichnet, die von einer starken proinflammatorischen Reaktion, einem so genannten Zytokinsturm, begleitet wird. Eine Infektion mit H5N1 oder H7N9 führt insbesondere zu hohen Konzentrationen entzündungsfördernder Zytokine. Bei bakteriellen Infektionen schafft die frühe Abnahme der Makrophagen während der Influenza ein günstiges Umfeld in der Lunge für das Bakterienwachstum, da diese weißen Blutkörperchen bei der Reaktion auf bakterielle Infektionen eine wichtige Rolle spielen. Mechanismen des Wirtes zur Förderung der Gewebereparatur können unbeabsichtigt eine bakterielle Infektion ermöglichen. Eine Infektion induziert auch die Produktion von systemischen Glukokortikoiden, die die Entzündung reduzieren können, um die Integrität des Gewebes zu erhalten, aber ein verstärktes Bakterienwachstum ermöglichen. ⓘ
Die Pathophysiologie der Influenza wird maßgeblich davon beeinflusst, an welche Rezeptoren Influenzaviren beim Eindringen in Zellen binden. Influenzaviren von Säugetieren binden bevorzugt an Sialinsäuren, die über eine α-2,6-Bindung mit dem Rest des Oligosaccharids verbunden sind, wie sie am häufigsten in verschiedenen Atemwegszellen, z. B. in Atemwegs- und Netzhautepithelzellen, vorkommen. AIVs bevorzugen Sialinsäuren mit einer α-2,3-Verknüpfung, die bei Vögeln am häufigsten in gastrointestinalen Epithelzellen und beim Menschen im unteren Respirationstrakt vorkommen. Außerdem wird das HA-Protein von verschiedenen Proteasen in HA1, die bindende Untereinheit, und HA2, die Fusionsuntereinheit, gespalten, was sich darauf auswirkt, welche Zellen infiziert werden können. Bei Säugetier-Influenzaviren und gering pathogenen AIVs erfolgt die Spaltung extrazellulär, was die Infektion auf Zellen beschränkt, die über die entsprechenden Proteasen verfügen, während bei hoch pathogenen AIVs die Spaltung intrazellulär erfolgt und von ubiquitären Proteasen durchgeführt wird, was die Infektion einer größeren Vielfalt von Zellen ermöglicht und damit zu einer schwereren Erkrankung beiträgt. ⓘ
Immunologie
Zellen verfügen über Sensoren zur Erkennung viraler RNA, die dann die Interferonproduktion auslösen können. Interferone vermitteln die Expression von antiviralen Proteinen und von Proteinen, die Immunzellen an den Infektionsort rekrutieren, und sie informieren auch nicht infizierte Zellen in der Nähe über die Infektion. Einige infizierte Zellen setzen proinflammatorische Zytokine frei, die Immunzellen an den Infektionsort locken. Immunzellen kontrollieren die Virusinfektion, indem sie infizierte Zellen abtöten und Viruspartikel und apoptotische Zellen phagozytieren. Eine überschießende Immunreaktion kann jedoch den Wirtsorganismus durch einen Zytokinsturm schädigen. Um der Immunreaktion entgegenzuwirken, kodieren Influenzaviren für verschiedene Nichtstrukturproteine, darunter NS1, NEP, PB1-F2 und PA-X, die die Immunreaktion des Wirts durch Unterdrückung der Interferonproduktion und der Genexpression des Wirts unterdrücken. ⓘ
B-Zellen, eine Art von weißen Blutkörperchen, produzieren Antikörper, die an die Influenza-Antigene HA und NA (oder HEF) und in geringerem Maße an andere Proteine binden. Sobald sie an diese Proteine gebunden sind, blockieren die Antikörper die Bindung der Virionen an zelluläre Rezeptoren und neutralisieren das Virus. Beim Menschen tritt etwa 1 Woche nach der Virusexposition eine beträchtliche Antikörperreaktion auf. Diese Antikörperreaktion ist in der Regel robust und lang anhaltend, insbesondere bei ICV und IDV. Mit anderen Worten: Menschen, die in der Kindheit einem bestimmten Virusstamm ausgesetzt waren, besitzen auch später im Leben noch Antikörper gegen diesen Stamm, die einen gewissen Schutz gegen verwandte Stämme bieten können. Es gibt jedoch eine "antigene Erbsünde", bei der der erste HA-Subtyp, dem eine Person ausgesetzt ist, die auf Antikörpern basierende Immunantwort auf zukünftige Infektionen und Impfstoffe beeinflusst. ⓘ
Vorbeugung
Impfung

Die jährliche Impfung ist die wichtigste und wirksamste Methode zur Vorbeugung von Grippe und grippebedingten Komplikationen, insbesondere für Risikogruppen. Die Grippeimpfstoffe sind drei- oder vierwertig und bieten Schutz gegen einen H1N1-Stamm, einen H3N2-Stamm und einen oder zwei IBV-Stämme, die den beiden IBV-Stämmen entsprechen. Es werden zwei Arten von Impfstoffen verwendet: inaktivierte Impfstoffe, die abgetötete" (d. h. inaktivierte) Viren enthalten, und abgeschwächte Influenza-Lebendimpfstoffe (LAIV), die abgeschwächte Viren enthalten. Es gibt drei Arten von inaktivierten Impfstoffen: ganze Viren, gespaltene Viren, bei denen das Virus durch ein Detergens aufgespalten wird, und Untereinheiten, die nur die viralen Antigene HA und NA enthalten. Die meisten Grippeimpfstoffe sind inaktiviert und werden per intramuskulärer Injektion verabreicht. LAIVs werden in die Nasenhöhle gesprüht. ⓘ
Die Impfempfehlungen sind von Land zu Land unterschiedlich. In einigen Ländern wird die Impfung für alle Menschen ab einem bestimmten Alter, z. B. ab 6 Monaten, empfohlen, während in anderen Ländern die Empfehlung auf Risikogruppen wie Schwangere, Kleinkinder (außer Neugeborene), ältere Menschen, Menschen mit chronischen Erkrankungen, Beschäftigte im Gesundheitswesen, Personen, die mit Risikopersonen in Kontakt kommen, und Personen, die das Virus leicht übertragen, beschränkt ist. Kleinkinder können aus Sicherheitsgründen keinen Grippeimpfstoff erhalten, aber sie können eine passive Immunität von ihrer Mutter erben, wenn ihr während der Schwangerschaft inaktivierte Impfstoffe verabreicht werden. Die Grippeimpfung trägt auch dazu bei, die Wahrscheinlichkeit eines Reassortiments zu verringern. ⓘ
Im Allgemeinen sind Grippeimpfstoffe nur dann wirksam, wenn eine antigene Übereinstimmung zwischen den Impfstoffstämmen und den zirkulierenden Stämmen besteht. Außerdem werden die meisten im Handel erhältlichen Grippeimpfstoffe durch Vermehrung von Influenzaviren in embryonierten Hühnereiern hergestellt, was 6-8 Monate dauert. Da die Grippesaison in der nördlichen und der südlichen Hemisphäre unterschiedlich verläuft, trifft sich die WHO zweimal im Jahr, einmal für jede Hemisphäre, um auf der Grundlage von Beobachtungen aus HA-Hemmtests zu erörtern, welche Stämme in Grippeimpfstoffe aufgenommen werden sollten. Andere Herstellungsmethoden umfassen einen inaktivierten Impfstoff auf der Basis von MDCK-Zellkulturen und einen rekombinanten Untereinheiten-Impfstoff, der durch Überexpression von Baculoviren in Insektenzellen hergestellt wird. ⓘ
Antivirale Chemoprophylaxe
Die Grippe kann durch eine Postexpositionsprophylaxe mit den antiviralen Medikamenten Oseltamivir, das von Personen ab drei Monaten oral eingenommen werden kann, und Zanamivir, das von Personen ab sieben Jahren inhaliert werden kann, verhindert oder in ihrem Schweregrad reduziert werden. Die Chemoprophylaxe ist vor allem für Personen mit einem hohen Risiko für Komplikationen und für Personen, die aufgrund von Kontraindikationen oder mangelnder Wirksamkeit nicht geimpft werden können, sinnvoll. Eine Postexpositions-Chemoprophylaxe wird nur empfohlen, wenn Oseltamivir innerhalb von 48 Stunden nach dem Kontakt mit einem bestätigten oder vermuteten Influenza-Fall und Zanamivir innerhalb von 36 Stunden eingenommen wird. Es wird empfohlen, die Chemoprophylaxe Personen anzubieten, die noch keinen Impfstoff für die aktuelle Grippesaison erhalten haben, die weniger als zwei Wochen nach dem Kontakt geimpft wurden, wenn eine erhebliche Diskrepanz zwischen dem Impfstoff und den zirkulierenden Stämmen besteht, oder während eines Ausbruchs in einem geschlossenen Umfeld, unabhängig von der Impfgeschichte. ⓘ
Infektionskontrolle
Handhygiene ist wichtig, um die Verbreitung der Influenza zu verringern. Dazu gehören häufiges Händewaschen mit Wasser und Seife, die Verwendung von Handdesinfektionsmitteln auf Alkoholbasis und das Vermeiden von Berührungen von Augen, Nase und Mund mit den Händen. Auch das Bedecken von Nase und Mund beim Husten oder Niesen ist wichtig. Andere Methoden zur Begrenzung der Influenza-Übertragung bestehen darin, bei Krankheit zu Hause zu bleiben, den Kontakt mit anderen bis einen Tag nach Abklingen der Symptome zu vermeiden und Oberflächen zu desinfizieren, die mit dem Virus kontaminiert sein könnten, wie z. B. Türklinken. Gesundheitserziehung durch Medien und Plakate wird häufig eingesetzt, um die Menschen an die oben genannten Verhaltensregeln und Hygiene zu erinnern. ⓘ
Die Verwendung von Masken ist nicht unumstritten, da die bisherige Forschung keinen signifikanten Rückgang der saisonalen Grippe durch die Verwendung von Masken gezeigt hat. Auch die Wirksamkeit des Screenings an den Einreisepunkten in die Länder ist nicht gut erforscht. Soziale Distanzierungsmaßnahmen wie die Schließung von Schulen, die Vermeidung des Kontakts mit infizierten Personen durch Isolierung oder Quarantäne und die Einschränkung von Massenveranstaltungen können die Übertragung verringern, aber diese Maßnahmen sind oft teuer, unpopulär und schwer umzusetzen. Folglich sind die allgemein empfohlenen Methoden zur Infektionskontrolle die Umgangsformen beim Atmen, die Handhygiene und das Tragen von Masken, die kostengünstig und einfach durchzuführen sind. Pharmazeutische Maßnahmen sind wirksam, aber in den frühen Stadien eines Ausbruchs möglicherweise nicht verfügbar. ⓘ
In Einrichtungen des Gesundheitswesens können infizierte Personen in Gruppen untergebracht oder einzelnen Zimmern zugewiesen werden. Beim Kontakt mit infizierten Personen wird Schutzkleidung wie Masken, Handschuhe und Kittel empfohlen, wenn das Risiko besteht, mit infizierten Körperflüssigkeiten in Berührung zu kommen. Die Unterbringung von Patienten in Unterdruckräumen und die Vermeidung aerosolbildender Tätigkeiten können hilfreich sein, doch werden spezielle Luftbehandlungs- und Belüftungssysteme nicht als notwendig erachtet, um die Ausbreitung der Influenza über die Luft zu verhindern. In Heimen müssen Neuaufnahmen unter Umständen so lange gesperrt werden, bis die Ausbreitung der Influenza unter Kontrolle ist. Bei der Entlassung von Patienten in Pflegeheime ist Vorsicht geboten, wenn ein Influenzaausbruch bekannt ist. ⓘ
Da Influenzaviren auch in Tieren wie Vögeln und Schweinen zirkulieren, ist es wichtig, die Übertragung durch diese Tiere zu verhindern. Wasseraufbereitung, Stallhaltung, Quarantäne für kranke Tiere, Impfung und Biosicherheit sind die wichtigsten Maßnahmen. Die Unterbringung von Geflügelställen und Schweineställen auf höher gelegenen Flächen, weit entfernt von landwirtschaftlichen Betrieben mit hoher Besatzdichte, Hinterhofhaltungen, Märkten für lebendes Geflügel und Gewässern, trägt dazu bei, den Kontakt mit Wildvögeln zu minimieren. Die Schließung von Märkten für lebendes Geflügel scheint die wirksamste Maßnahme zu sein und hat sich bei der Eindämmung der Ausbreitung von H5N1, H7N9 und H9N2 als wirksam erwiesen. Weitere Biosicherheitsmaßnahmen sind die Reinigung und Desinfektion von Einrichtungen und Fahrzeugen, das Verbot von Besuchen in Geflügelfarmen, das Verbringen von Schlachtvögeln in die Farmen, das Wechseln der Kleidung, die Desinfektion von Fußbädern und die Behandlung von Lebensmitteln und Wasser. ⓘ
Wenn die Märkte für lebendes Geflügel nicht geschlossen werden, können "saubere Tage", an denen unverkauftes Geflügel entfernt und die Einrichtungen desinfiziert werden, sowie "No-Carry-Over"-Maßnahmen zur Beseitigung von infektiösem Material vor der Ankunft von neuem Geflügel eingesetzt werden, um die Verbreitung von Influenzaviren zu verringern. Wenn ein neuartiges Influenzavirus die oben genannten Biosicherheitsmaßnahmen durchbrochen hat, kann eine rasche Erkennung und Ausrottung durch Quarantäne, Dekontamination und Keulung erforderlich sein, um zu verhindern, dass das Virus endemisch wird. Es gibt Impfstoffe gegen die Subtypen H5, H7 und H9, die in einigen Ländern eingesetzt werden. In China beispielsweise konnte durch die Impfung von Hausvögeln gegen H7N9 die Ausbreitung des Virus erfolgreich eingedämmt werden, was darauf hindeutet, dass die Impfung eine wirksame Strategie sein kann, wenn sie mit anderen Maßnahmen zur Eindämmung der Übertragung kombiniert wird. Bei Schweinen und Pferden hängt das Influenzamanagement von der Impfung mit Biosicherheitsmaßnahmen ab. ⓘ
Hygiene
Schon durch einfache hygienische Maßnahmen lässt sich ohne pharmazeutische Präparate die Häufigkeit von Influenza-Infektionen während einer Grippewelle deutlich absenken. So sollten mit ungewaschenen Händen nicht die Nase oder der Mund berührt oder die Augen gerieben werden. Zusätzlich sollte Händeschütteln allgemein und speziell mit Infizierten auch sonstiger körperlicher Kontakt vermieden werden und durch häufiges Waschen der Hände mit üblichen Reinigungsseifen und das Desinfizieren kontaminierter Oberflächen das Risiko der Virusübertragung vermindert werden. Das Tragen eines Mund-Nasen-Schutzes senkt ebenfalls das Risiko, Erreger zu verteilen oder selbst aufzunehmen, war aber in Europa anders als etwa in Asien zumindest bis zum Beginn der COVID-19-Pandemie in der Öffentlichkeit nicht gebräuchlich. Bei Aufnahme in ein Krankenhaus können Influenza-Patienten zur Expositionsprophylaxe isoliert werden, durch denselben Virustyp Infizierte auch in einer Kohortenisolierung. ⓘ
Vitamin D
Metaanalysen haben ergeben, dass es bisher weder erwiesen ist, dass Infektionen mit dem Influenza-Virus oder gar klinisch manifeste Influenza-Erkrankungen durch Vitamin-D-Mangel begünstigt werden, noch dass die Substitution mit Vitamin D oder dessen aktiven Metaboliten das Risiko von beiden senkt. Dennoch werden Vitamin-D-haltige Nahrungsergänzungsmittel als möglicher Schutz vor Grippe beworben. ⓘ
Neuraminidase-Hemmer
Zur Postexpositionsprophylaxe und zur Therapie nach Auftreten von Symptomen können Präparate wie Oseltamivir und Zanamivir angewendet werden. Ihre Wirksamkeit ist allerdings gering, durchschnittlich verringern sie die Dauer einer Influenzaerkrankung nur um weniger als einen Tag. ⓘ
Diagnose

Die Diagnose auf der Grundlage der Symptome ist bei ansonsten gesunden Menschen während saisonaler Epidemien ziemlich genau und sollte bei Lungenentzündung, akutem Atemnotsyndrom (ARDS), Sepsis oder beim Auftreten von Enzephalitis, Myokarditis oder Abbau von Muskelgewebe vermutet werden. Da die Influenza anderen viralen Atemwegserkrankungen ähnelt, ist zur Bestätigung eine Labordiagnose erforderlich. Zu den üblichen Methoden der Probenentnahme für Tests gehören Nasen- und Rachenabstriche. Es können auch Proben aus den unteren Atemwegen entnommen werden, wenn die Infektion die oberen, aber nicht die unteren Atemwege passiert hat. Ein Grippetest wird für alle Personen empfohlen, die während der Grippesaison mit grippeähnlichen Symptomen ins Krankenhaus eingeliefert werden oder die mit einem Grippefall in Verbindung stehen. Bei schweren Fällen verbessert eine frühere Diagnose die Aussichten des Patienten. Zu den Diagnosemethoden, mit denen Influenza nachgewiesen werden kann, gehören Viruskulturen, Tests zum Nachweis von Antikörpern und Antigenen sowie Tests auf der Grundlage von Nukleinsäuren. ⓘ
Viren können in einer Kultur aus Säugetierzellen oder embryonierten Eiern 3-10 Tage lang gezüchtet werden, um die zytopathische Wirkung zu überwachen. Die endgültige Bestätigung kann dann durch Antikörperfärbung, Hämadsorption mit roten Blutkörperchen oder Immunfluoreszenzmikroskopie erfolgen. Schalenkulturen, die eine Infektion durch Immunfärbung nachweisen können, bevor ein zytopathischer Effekt auftritt, sind empfindlicher als herkömmliche Kulturen und liefern Ergebnisse innerhalb von 1-3 Tagen. Kulturen können zur Charakterisierung neuartiger Viren, zur Beobachtung der Empfindlichkeit gegenüber antiviralen Medikamenten und zur Überwachung der Antigendrift verwendet werden, sind jedoch relativ langsam und erfordern spezielle Fähigkeiten und Geräte. ⓘ
Serologische Tests können verwendet werden, um eine Antikörperreaktion auf Influenza nach einer natürlichen Infektion oder Impfung nachzuweisen. Zu den gängigen serologischen Tests gehören Hämagglutinationshemmungstests, mit denen HA-spezifische Antikörper nachgewiesen werden, Virusneutralisationstests, mit denen überprüft wird, ob Antikörper das Virus neutralisiert haben, und Enzymimmunoabsorptionstests. Diese Methoden sind in der Regel relativ kostengünstig und schnell, aber weniger zuverlässig als nukleinsäurebasierte Tests. ⓘ
Bei direkten Fluoreszenz- oder Immunfluoreszenz-Antikörper-Tests (DFA/IFA) werden die Epithelzellen der Atemwege in den Proben mit fluoreszenzmarkierten influenzaspezifischen Antikörpern angefärbt und anschließend unter einem Fluoreszenzmikroskop untersucht. Sie können zwischen IAV und IBV unterscheiden, aber nicht den Subtyp von IAV bestimmen. Influenza-Schnelltests (RIDTs) sind eine einfache Methode, um Testergebnisse zu erhalten, sie sind kostengünstig und liefern schnell Ergebnisse (in weniger als 30 Minuten), so dass sie häufig verwendet werden, aber sie können nicht zwischen IAV und IBV oder zwischen IAV-Subtypen unterscheiden und sind nicht so empfindlich wie nukleinsäurebasierte Tests. ⓘ
Nukleinsäure-basierte Tests (NATs) amplifizieren und weisen virale Nukleinsäure nach. Die meisten dieser Tests benötigen einige Stunden, aber molekulare Schnelltests sind ebenso schnell wie RIDTs. Unter den NATs ist die reverse Transkriptions-Polymerase-Kettenreaktion (RT-PCR) der traditionellste und gilt als Goldstandard für die Influenza-Diagnose, da er schnell ist und IAV-Subtypen bestimmen kann, aber er ist relativ teuer und neigt eher zu falsch-positiven Ergebnissen als Kulturen. Andere NATs, die verwendet wurden, umfassen schleifenvermittelte isothermische Amplifikationstests, einfache Amplifikationstests und Nukleinsäuresequenz-basierte Amplifikation. Mit Nukleinsäuresequenzierungsverfahren kann eine Infektion durch den Erhalt der Nukleinsäuresequenz von Virusproben nachgewiesen werden, um das Virus und die Resistenz gegen antivirale Medikamente zu identifizieren. Die traditionelle Methode ist die Sanger-Sequenzierung, die jedoch weitgehend durch Methoden der nächsten Generation ersetzt wurde, die eine höhere Sequenzierungsgeschwindigkeit und einen größeren Durchsatz aufweisen. ⓘ
Die Diagnostik erfolgt meistens aus einem Nasenabstrich aus der hinteren Nasenhöhle oder aus dem klassischen tiefen Rachenabstrich. Andere Untersuchungsflüssigkeiten sind Trachealsekret, die Bronchoalveoläre Lavage (BAL), Nasenspülflüssigkeit, Rachenspülflüssigkeit oder das Blut.
- Direkter Erregernachweis in der Elektronenmikroskopie oder Zellkultur
- Influenzaantikörper im Blut (erst ab der zweiten Krankheitswoche bedingt aussagekräftig), seltener breitneutralisierende Anti-IAV-Antikörper
- Labor: Die Blutsenkungsgeschwindigkeit ist erhöht, Leukozyten variabel
- Influenza-PCR (wichtigste Methode)
- Influenza-Schnelltest: Dieser Test liefert innerhalb von 15 Minuten ein Ergebnis. Es handelt sich hierbei um ein Verfahren, in dem Proteine des Virus mittels farblich markierter Antikörper auf einem Teststreifen sichtbar gemacht werden. ⓘ
Behandlung
Die Behandlung der Grippe bei leichter oder mittelschwerer Erkrankung ist unterstützend und umfasst fiebersenkende Medikamente wie Paracetamol und Ibuprofen, ausreichende Flüssigkeitszufuhr, um eine Dehydrierung zu vermeiden, und Ruhe zu Hause. Hustentropfen und Rachensprays können bei Halsschmerzen hilfreich sein. Es wird empfohlen, während einer Grippeerkrankung auf Alkohol und Tabak zu verzichten. Aspirin wird zur Behandlung der Grippe bei Kindern nicht empfohlen, da ein erhöhtes Risiko für die Entwicklung des Reye-Syndroms besteht. Kortikosteroide werden ebenfalls nicht empfohlen, es sei denn, es handelt sich um die Behandlung eines septischen Schocks oder einer zugrundeliegenden Erkrankung, wie z. B. einer chronisch obstruktiven Lungenerkrankung oder einer Verschlimmerung von Asthma, da sie mit einer erhöhten Sterblichkeit verbunden sind. Wenn eine bakterielle Sekundärinfektion auftritt, kann eine Behandlung mit Antibiotika erforderlich sein. ⓘ
Antivirale Mittel
| Medikament | Art der Verabreichung | Zugelassenes Alter der Anwendung ⓘ |
|---|---|---|
| Oseltamivir | Oral | Mindestens zwei Wochen alt |
| Zanamivir | Inhalation | Mindestens fünf Jahre alt |
| Peramivir | Intravenöse Injektion | Mindestens 18 Jahre alt |
| Laninamivir | Inhalation | 40 Milligramm (mg) für Personen, die mindestens 10 Jahre alt sind, 20 mg für Personen unter 10 Jahren |
| Baloxavir Marboxil | Oral | Mindestens 12 Jahre alt |
Antivirale Arzneimittel werden in erster Linie zur Behandlung schwer kranker Patienten eingesetzt, insbesondere bei Patienten mit geschwächtem Immunsystem. Virostatika sind am wirksamsten, wenn sie innerhalb der ersten 48 Stunden nach Auftreten der Symptome verabreicht werden. Eine spätere Verabreichung kann bei Patienten mit zugrundeliegenden Immundefekten, bei Patienten mit schwereren Symptomen oder bei Patienten, die ein höheres Risiko für die Entwicklung von Komplikationen haben, dennoch von Vorteil sein, wenn diese Personen das Virus noch ausscheiden. Eine antivirale Behandlung wird auch empfohlen, wenn eine Person mit Verdacht auf Influenza ins Krankenhaus eingeliefert wird, anstatt auf die Testergebnisse zu warten, und wenn sich die Symptome verschlimmern. Die meisten antiviralen Medikamente gegen Influenza lassen sich in zwei Kategorien einteilen: Neuraminidase-Hemmer (NA) und M2-Inhibitoren. Eine bemerkenswerte Ausnahme bildet Baloxavir Marboxil, das auf die Endonuklease-Aktivität der viralen RNA-Polymerase abzielt und als Alternative zu NA- und M2-Inhibitoren gegen IAV und IBV eingesetzt werden kann. ⓘ
NA-Inhibitoren zielen auf die enzymatische Aktivität von NA-Rezeptoren ab und imitieren die Bindung von Sialinsäure im aktiven Zentrum von NA auf IAV- und IBV-Virionen, so dass die Virusfreisetzung aus infizierten Zellen und die Virusreplikationsrate beeinträchtigt werden. Zu den NA-Inhibitoren gehören Oseltamivir, das in Form eines Prodrugs oral eingenommen und in der Leber in seine aktive Form umgewandelt wird, und Zanamivir, ein Pulver, das nasal inhaliert wird. Oseltamivir und Zanamivir sind zur Prophylaxe und Postexpositionsprophylaxe wirksam, und die Forschung zeigt insgesamt, dass die NA-Hemmer die Komplikationsrate, die Krankenhauseinweisung, die Sterblichkeit und die Krankheitsdauer wirksam reduzieren. Außerdem sind die Ergebnisse umso besser, je früher die NA-Hemmer verabreicht werden, obwohl eine späte Verabreichung in schweren Fällen immer noch von Vorteil sein kann. Zu den weiteren NA-Hemmern gehören Laninamivir und Peramivir, wobei letzteres als Alternative zu Oseltamivir für Personen verwendet werden kann, die es nicht vertragen oder nicht aufnehmen können. ⓘ
Die Adamantane Amantadin und Rimantadin sind oral verabreichte Medikamente, die den M2-Ionenkanal des Influenzavirus blockieren und so die Entschalung des Virus verhindern. Diese Medikamente sind nur gegen IAV wirksam, werden aber wegen der weit verbreiteten Resistenz gegen sie bei IAV nicht mehr zur Anwendung empfohlen. Die Adamantan-Resistenz trat erstmals 2003 bei H3N2 auf und verbreitete sich bis 2008 weltweit. Die Oseltamivir-Resistenz ist nicht mehr weit verbreitet, da der pandemische H1N1-Stamm von 2009 (H1N1 pdm09), der gegen Adamantane resistent ist, die im Umlauf befindlichen resistenten Stämme anscheinend ersetzt hat. Seit der Pandemie 2009 wurde die Oseltamivir-Resistenz vor allem bei Patienten beobachtet, die sich einer Therapie unterziehen, insbesondere bei immungeschwächten Personen und kleinen Kindern. Oseltamivir-Resistenzen werden in der Regel bei H1N1, seltener auch bei H3N2 und IBVs gemeldet. Aus diesem Grund wird Oseltamivir für immunkompetente Menschen als erstes Medikament der Wahl empfohlen, während für immungeschwächte Menschen Oseltamivir gegen H3N2 und IBV und Zanamivir gegen H1N1 pdm09 empfohlen wird. Eine Resistenz gegen Zanamivir wird seltener beobachtet, und eine Resistenz gegen Peramivir und Baloxavir Marboxil ist möglich. ⓘ
Zur Influenza-Therapie beim Menschen sind Medikamente aus verschiedenen Substanzklassen zugelassen: den Hemmern des viralen Membranproteins (M2), das als Protonenpumpe dem Schutz des viralen Hämagglutinins vor niedrigen zellulären pH-Werten dient, und den erst vor wenigen Jahren entwickelten Neuraminidase-Hemmern, die die Aktivität des viralen Oberflächenenzyms Neuraminidase hemmen und damit die Loslösung des Virus bei der Freisetzung aus der Zelle blockieren. Die Viren können somit keine weiteren Zellen infizieren. Eine weitere Behandlungsoption sind Endonuklease-Hemmer, von denen ein Vertreter bislang in Japan zugelassen ist. ⓘ
Da antivirale Substanzen nur in die Vermehrung der Viren eingreifen, können bereits im Körper befindliche Viren durch sie nicht inaktiviert oder an der Infektion weiterer Zellen gehindert werden. Dies hat zur Folge, dass der Erfolg einer antiviralen Therapie auch von der rechtzeitigen Einnahme abhängt. Liegt der Zeitpunkt des Auftretens der ersten Krankheitsanzeichen (Symptome) mutmaßlich länger als 48 Stunden zurück, ist die Beeinflussung des Krankheitsverlaufes durch diese Wirkstoffe nur noch minimal; daher wird die Einnahme dann nicht mehr empfohlen. ⓘ
Prognose
Bei gesunden Menschen verläuft die Grippeinfektion in der Regel selbstlimitierend und selten tödlich. Die Symptome dauern in der Regel 2-8 Tage. Die Grippe kann dazu führen, dass Menschen bei der Arbeit oder in der Schule fehlen, und sie wird mit einer verminderten Arbeitsleistung und bei älteren Erwachsenen mit einer eingeschränkten Unabhängigkeit in Verbindung gebracht. Müdigkeit und Unwohlsein können mehrere Wochen nach der Genesung anhalten, und bei gesunden Erwachsenen können Lungenfunktionsstörungen auftreten, deren Abklingen mehrere Wochen dauern kann. Komplikationen und Sterblichkeit treten vor allem bei Hochrisikopopulationen und bei Krankenhausaufenthalten auf. Schwere Erkrankungen und Sterblichkeit sind in der Regel auf eine Lungenentzündung durch die primäre Virusinfektion oder eine sekundäre bakterielle Infektion zurückzuführen, die zu ARDS fortschreiten kann. ⓘ
Weitere mögliche Komplikationen der Atemwege sind Sinusitis, Bronchitis, Bronchiolitis, übermäßige Flüssigkeitsansammlungen in der Lunge sowie die Verschlimmerung von chronischer Bronchitis und Asthma. Mittelohrentzündung und Krupp können auftreten, am häufigsten bei Kindern. Bei einer sekundären S. aureus-Infektion wurde, vor allem bei Kindern, nach einer Grippe ein toxisches Schocksyndrom mit Hypotonie, Fieber, Rötung und Schälen der Haut beobachtet. Komplikationen, die das kardiovaskuläre System betreffen, sind selten und umfassen Perikarditis, fulminante Myokarditis mit schnellem, langsamem oder unregelmäßigem Herzschlag sowie die Verschlimmerung bereits bestehender Herz-Kreislauf-Erkrankungen. Eine Entzündung oder Schwellung der Muskeln, die mit einem Abbau des Muskelgewebes einhergeht, tritt selten auf, in der Regel bei Kindern, und äußert sich in einer extremen Empfindlichkeit und Muskelschmerzen in den Beinen sowie einer Abneigung gegen das Gehen für 2-3 Tage. ⓘ
Die Influenza kann sich auf die Schwangerschaft auswirken und zu einer geringeren Größe des Neugeborenen, einem erhöhten Risiko einer Frühgeburt und einem erhöhten Risiko des Todes des Kindes kurz vor oder nach der Geburt führen. In seltenen Fällen wurden neurologische Komplikationen mit der Influenza in Verbindung gebracht, darunter aseptische Meningitis, Enzephalitis, disseminierte Enzephalomyelitis, transversale Myelitis und Guillain-Barré-Syndrom. Außerdem können Fieberkrämpfe und das Reye-Syndrom auftreten, am häufigsten bei Kindern. Die Influenza-assoziierte Enzephalopathie kann direkt durch eine Infektion des Zentralnervensystems aufgrund des Virus im Blut auftreten und äußert sich in einem plötzlichen Fieberanstieg mit Krämpfen, gefolgt von einem raschen Übergang zum Koma. Eine atypische Form der Enzephalitis, die so genannte Enzephalitis lethargica, die durch Kopfschmerzen, Schläfrigkeit und Koma gekennzeichnet ist, kann selten einige Zeit nach der Infektion auftreten. Bei Überlebenden einer Influenza-assoziierten Enzephalopathie können neurologische Defekte auftreten. Vor allem bei Kindern kann es in schweren Fällen selten zu einer dramatischen Überproduktion von weißen Blutkörperchen kommen, die Zytokine freisetzen und schwere Entzündungen verursachen. ⓘ
Menschen, die mindestens 65 Jahre alt sind und deren Immunsystem aufgrund des Alters oder einer chronischen Krankheit geschwächt ist, gehören zu den Risikogruppen für die Entwicklung von Komplikationen, ebenso wie Kinder unter einem Jahr und Kinder, die zuvor nicht mehrfach mit Influenzaviren in Kontakt gekommen sind. Schwangere Frauen haben ein erhöhtes Risiko, das mit jedem Trimester zunimmt und bis zu zwei Wochen nach der Entbindung anhält. Fettleibigkeit, insbesondere ein Body-Mass-Index von über 35-40, wird mit einer stärkeren Virusreplikation, einem höheren Schweregrad der bakteriellen Sekundärinfektion und einer geringeren Wirksamkeit der Impfung in Verbindung gebracht. Menschen mit gesundheitlichen Vorbelastungen gelten ebenfalls als gefährdet, darunter solche mit angeborenen oder chronischen Herzproblemen oder Erkrankungen der Lunge (z. B. Asthma), der Nieren, der Leber, des Blutes, der Neurologie oder des Stoffwechsels (z. B. Diabetes) sowie Menschen, deren Immunsystem durch eine Chemotherapie, Asplenie, eine längere Steroidbehandlung, eine Funktionsstörung der Milz oder eine HIV-Infektion geschwächt ist. Auch aktueller oder früherer Tabakkonsum stellt ein Risiko dar. Die Rolle der Genetik bei der Influenza ist nicht gut erforscht, könnte aber ein Faktor für die Influenza-Mortalität sein. ⓘ
Das Gefährliche an der Influenza sind oftmals nicht die Viren selbst, sondern die bakterielle Sekundärinfektion, die auf eine Grippeerkrankung folgen kann. Da der Organismus durch den Virus-Infekt bereits geschwächt ist, können Bakterien leichter in den Körper eindringen, sich vermehren und zu weiteren Krankheiten führen. Besonders häufig ist die Besiedelung der durch das Virus vorgeschädigten Luftwege mit Pneumokokken. Die dann entstehende Pneumokokken-Pneumonie kann vor allem bei Patienten mit chronischen Krankheiten und bei Älteren lebensgefährlich verlaufen. Pneumokokkenimpfungen in Verbindung mit Grippeimpfungen senken das Risiko von Pneumokokken-Pneumonien und tödlichen Verläufen im Vergleich zu Pneumokokken-Impfungen allein, zu Grippeimpfungen allein und zu Placebo. Als weitere Komplikationen kommen primär virusbedingte Lungenentzündungen (Influenzapneumonien), Gehirnentzündungen (Enzephalitiden), Entzündungen der Skelettmuskulatur (Myositiden) sowie Herzmuskelentzündungen (Myokarditiden) und Herzinfarkte vor. Sie treten in erster Linie bei Menschen mit einem Risikofaktor auf wie chronischen Herz-Lungen-Erkrankungen, Stoffwechselerkrankungen und Immundefekten und können innerhalb weniger Stunden (perakut) zum Tod führen. ⓘ
Epidemiologie

Die Influenza ist typischerweise durch saisonale Epidemien und sporadische Pandemien gekennzeichnet. Der größte Teil der Influenza-Belastung ist das Ergebnis von Grippesaisons, die durch IAV und IBV verursacht werden. Von den IAV-Subtypen zirkulieren derzeit H1N1 und H3N2 beim Menschen und sind für die saisonale Influenza verantwortlich. Die Fälle treten überproportional häufig bei Kindern auf, aber die schwersten Fälle sind bei älteren Menschen, sehr jungen Menschen und immungeschwächten Personen zu verzeichnen. In einem typischen Jahr infizieren Influenzaviren 5-15 % der Weltbevölkerung, verursachen jährlich 3-5 Millionen Fälle schwerer Erkrankungen und sind für 290.000-650.000 Todesfälle aufgrund von Atemwegserkrankungen verantwortlich. 5-10 % der Erwachsenen und 20-30 % der Kinder erkranken jedes Jahr an Influenza. Die gemeldete Zahl der Grippefälle ist in der Regel viel niedriger als die tatsächliche Zahl der Fälle. ⓘ
Während saisonaler Epidemien haben schätzungsweise 80 % der ansonsten gesunden Menschen, die Husten oder Halsschmerzen haben, die Grippe. Etwa 30-40 % der Menschen, die wegen Influenza ins Krankenhaus eingeliefert werden, entwickeln eine Lungenentzündung, und etwa 5 % aller schweren Lungenentzündungen in Krankenhäusern sind auf Influenza zurückzuführen, die auch die häufigste Ursache für ARDS bei Erwachsenen ist. Bei Kindern ist die Influenza eine der beiden häufigsten Ursachen für ARDS, die andere ist das Respiratory-Syncytial-Virus. Etwa 3-5 % der Kinder entwickeln jedes Jahr eine grippebedingte Mittelohrentzündung. Erwachsene, die ein grippebedingtes Organversagen entwickeln, und Kinder mit PIM-Scores und akutem Nierenversagen haben eine höhere Sterblichkeitsrate. Bei der saisonalen Influenza sind vor allem sehr junge und ältere Menschen von der Sterblichkeit betroffen, während bei Grippepandemien häufig junge Erwachsene in hohem Maße betroffen sind. ⓘ

In den gemäßigten Regionen schwankt die Zahl der Grippefälle von Saison zu Saison. Niedrigere Vitamin-D-Spiegel, vermutlich aufgrund von weniger Sonnenlicht, geringerer Luftfeuchtigkeit, niedrigeren Temperaturen und geringfügigen Veränderungen der Virusproteine durch Antigendrift tragen zu jährlichen Epidemien bei, die ihren Höhepunkt in der Wintersaison erreichen. In der nördlichen Hemisphäre ist dies von Oktober bis Mai (genauer gesagt von Dezember bis April), in der südlichen Hemisphäre von Mai bis Oktober (genauer gesagt von Juni bis September). In den gemäßigten Regionen gibt es also jedes Jahr zwei verschiedene Grippesaisons, eine auf der Nordhalbkugel und eine auf der Südhalbkugel. In tropischen und subtropischen Regionen ist die Saisonalität komplexer und wird offenbar von verschiedenen klimatischen Faktoren wie Mindesttemperatur, Sonnenstunden, maximaler Niederschlag und hoher Luftfeuchtigkeit beeinflusst. In diesen Regionen kann die Influenza daher das ganze Jahr über auftreten. Influenza-Epidemien beginnen heute in der Regel in der östlichen oder südlichen Hemisphäre, wobei Asien ein wichtiges Reservoir für Influenzaviren ist. ⓘ
IAV und IBV zirkulieren gemeinsam, so dass beide die gleichen Übertragungsmuster aufweisen. Die Saisonabhängigkeit der ICV ist jedoch kaum bekannt. Eine ICV-Infektion tritt am häufigsten bei Kindern unter 2 Jahren auf, und im Erwachsenenalter sind die meisten Menschen dem Virus ausgesetzt. ICV-assoziierte Krankenhausaufenthalte treten am häufigsten bei Kindern unter 3 Jahren auf und gehen häufig mit einer Koinfektion mit einem anderen Virus oder einem Bakterium einher, was den Schweregrad der Erkrankung erhöhen kann. Betrachtet man alle Krankenhausaufenthalte aufgrund von Atemwegserkrankungen bei Kleinkindern, so scheint ICV nur einen kleinen Prozentsatz dieser Fälle ausmachen zu können. Es kann zu großen Ausbrüchen von ICV-Infektionen kommen, so dass die Inzidenz erheblich schwankt. ⓘ
Ausbrüche von Influenza, die durch neue Influenzaviren verursacht werden, sind häufig. Je nach dem Grad der bereits bestehenden Immunität in der Bevölkerung können sich neuartige Influenzaviren schnell ausbreiten und Pandemien mit Millionen von Todesfällen verursachen. Diese Pandemien werden im Gegensatz zur saisonalen Grippe durch Antigenverschiebungen bei tierischen Influenzaviren verursacht. Bislang wurden alle bekannten Grippepandemien durch IAV verursacht, und sie folgen demselben Muster der Ausbreitung von einem Ursprungsort auf den Rest der Welt im Verlauf mehrerer Wellen innerhalb eines Jahres. Pandemische Stämme werden in der Regel mit höheren Raten von Lungenentzündungen bei ansonsten gesunden Personen in Verbindung gebracht. Im Allgemeinen zirkuliert der pandemische Stamm nach jeder Influenzapandemie als Ursache der saisonalen Grippe weiter und ersetzt die früheren Stämme. Von 1700 bis 1889 traten Influenzapandemien etwa alle 50-60 Jahre auf. Seitdem treten Pandemien etwa alle 10-50 Jahre auf, so dass sie im Laufe der Zeit immer häufiger werden könnten. ⓘ
Die Influenzaviren und die durch sie ausgelösten Erkrankungen existieren weltweit, allerdings kommen im Gegensatz zu den anderen Virustypen (insbesondere A) die Influenza-C- und -D-Viren nur sehr selten als Erreger der Virusgrippe vor. Es handelt sich um eine auch „sporadisch“, also außerhalb von Epidemien und Pandemien, sehr häufige Infektion: Jährlich sind nach Schätzungen der World Health Organization (WHO) 10 bis 20 % der Weltbevölkerung betroffen. Bereits mit sechs Jahren haben nahezu alle Kinder beispielsweise in den Niederlanden Infektionen mit mindestens einem der Virus-Subtypen durchgemacht. In Deutschland wurden zu Ende der Saison 2017/2018, in der seit 2001 die höchsten Fallzahlen gemeldet wurden, insgesamt etwa 334.000 Fälle von ambulant Erkrankten mit Virus-Nachweis gemeldet. Die Influenzaviren „zirkulieren“ auf der Nordhemisphäre meist von Anfang Oktober bis Mitte Mai. ⓘ
In Folge der mit der COVID-19-Pandemie in Deutschland einhergehenden Basis-Hygienemaßnahmen lag die Zahl der in den Kalenderwochen 10 bis 32 registrierten Fälle saisonaler Influenza im Jahr 2020 im Mittel rund 54 Prozent unter den Werten der Vorjahre. ⓘ
Geschichte

Es ist unmöglich zu sagen, wann ein Influenzavirus erstmals Menschen infiziert hat oder wann die erste Influenzapandemie aufgetreten ist. Möglicherweise ereignete sich die erste Grippeepidemie um 6.000 v. Chr. in China, und mögliche Beschreibungen der Influenza finden sich in griechischen Schriften aus dem 5. Sowohl 1173-1174 n. Chr. als auch 1387 n. Chr. traten in Europa Epidemien auf, die als "Influenza" bezeichnet wurden. Ob diese und andere Epidemien durch Influenza verursacht wurden, ist unklar, da es zu dieser Zeit kein einheitliches Benennungsmuster für epidemische Atemwegserkrankungen gab und "Influenza" erst Jahrhunderte später vollständig mit Atemwegserkrankungen in Verbindung gebracht wurde. Möglicherweise wurde die Influenza bereits 1493 nach Amerika eingeschleppt, als eine grippeähnliche Epidemie den größten Teil der Bevölkerung auf den Antillen tötete. ⓘ
Der erste überzeugende Bericht über eine Influenza-Pandemie stammt aus dem Jahr 1510; sie begann in Ostasien, bevor sie sich nach Nordafrika und dann nach Europa ausbreitete. Nach der Pandemie traten saisonale Grippefälle auf, gefolgt von Pandemien in den Jahren 1557 und 1580. Die Grippepandemie von 1557 war möglicherweise das erste Mal, dass die Influenza mit Fehlgeburten und dem Tod von Schwangeren in Verbindung gebracht wurde. Die Grippepandemie von 1580 entstand während des Sommers in Asien, breitete sich dann in Afrika, Europa und schließlich in Amerika aus. Gegen Ende des 16. Jahrhunderts begann man wahrscheinlich, die Influenza als eine spezifische, erkennbare Krankheit mit epidemischen und endemischen Formen zu verstehen. Im Jahr 1648 wurde entdeckt, dass auch Pferde an Grippe erkranken. ⓘ
Die Grippedaten nach 1700 sind aussagekräftiger, so dass es einfacher ist, Grippepandemien nach diesem Zeitpunkt zu identifizieren, die das Verständnis für die Grippe schrittweise erweiterten. Die erste Grippepandemie des 18. Jahrhunderts begann im Frühjahr 1729 in Russland und breitete sich im Laufe von drei Jahren in verschiedenen Wellen weltweit aus, wobei die späteren Wellen tödlicher verliefen. Die zweite Grippepandemie des 18. Jahrhunderts fand 1781-1782 statt und begann im Herbst in China. Seit dieser Pandemie wird die Grippe mit plötzlichen Ausbrüchen von Fieberkrankheiten in Verbindung gebracht. Die nächste Grippepandemie fand von 1830 bis 1833 statt und begann im Winter in China. Diese Pandemie hatte eine hohe Ansteckungsrate, die Sterblichkeitsrate war jedoch gering. ⓘ
Eine kleinere Influenza-Pandemie trat von 1847 bis 1851 zeitgleich mit der dritten Cholera-Pandemie auf und war die erste Grippe-Pandemie, die statistisch erfasst wurde, so dass die Influenza-Sterblichkeit zum ersten Mal klar erfasst wurde. Die hoch pathogene Vogelgrippe wurde 1878 erkannt und bald mit der Übertragung auf den Menschen in Verbindung gebracht. Zur Zeit der Pandemie von 1889, die möglicherweise durch einen H2N2-Stamm verursacht wurde, war die Grippe zu einer leicht erkennbaren Krankheit geworden. ⓘ
Der für die Grippe verantwortliche mikrobielle Erreger wurde 1892 von R. F. J. Pfeiffer als die Bakterienart Haemophilus influenzae identifiziert, die "Influenza" in ihrem Namen beibehält. In den folgenden Jahren begann sich das Gebiet der Virologie herauszubilden, da Viren als Ursache vieler Krankheiten identifiziert wurden. Von 1901 bis 1903 konnten italienische und österreichische Forscher nachweisen, dass die Vogelgrippe, die damals als "Geflügelpest" bezeichnet wurde, durch einen mikroskopisch kleinen Erreger verursacht wurde, der kleiner war als Bakterien, indem sie Filter mit Poren verwendeten, die für Bakterien zu klein waren, um sie zu passieren. Die grundlegenden Unterschiede zwischen Viren und Bakterien waren jedoch noch nicht vollständig verstanden. ⓘ
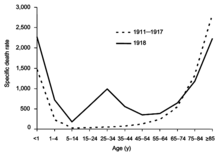
Die Spanische Grippe-Pandemie von 1918 bis 1920 war die verheerendste Grippe-Pandemie und eine der tödlichsten Pandemien der Geschichte. Die Pandemie, die wahrscheinlich durch H1N1 verursacht wurde, begann wahrscheinlich in den USA, bevor sie sich durch Soldaten während und nach dem Ersten Weltkrieg weltweit ausbreitete. Die erste Welle in der ersten Hälfte des Jahres 1918 verlief relativ glimpflich und ähnelte früheren Grippepandemien, doch die zweite Welle später im selben Jahr hatte eine viel höhere Sterblichkeitsrate und war für die meisten Todesfälle verantwortlich. Einige Monate nach der zweiten Welle trat vielerorts eine dritte Welle mit geringerer Sterblichkeit auf. Ende 1920 waren schätzungsweise ein Drittel bis die Hälfte aller Menschen auf der Welt infiziert, und es gab mehrere zehn Millionen Tote, darunter unverhältnismäßig viele junge Erwachsene. Während der Pandemie von 1918 wurde der Übertragungsweg über die Atemwege eindeutig identifiziert, und es wurde nachgewiesen, dass die Influenza durch einen "Filterüberträger" und nicht durch ein Bakterium ausgelöst wird, aber es herrschte noch ein Jahrzehnt lang Uneinigkeit über die Ursache der Influenza, und die Influenzaforschung ging zurück. Nach der Pandemie zirkulierte H1N1 beim Menschen in saisonaler Form bis zur nächsten Pandemie. ⓘ
1931 veröffentlichte Richard Shope drei Arbeiten, in denen er ein Virus als Ursache der Schweinegrippe identifizierte, einer damals neu anerkannten Krankheit bei Schweinen, die erstmals während der zweiten Welle der Pandemie von 1918 beschrieben wurde. Die Forschungen von Shope gaben der Erforschung der menschlichen Influenza neuen Auftrieb, und zahlreiche Fortschritte in den Bereichen Virologie, Serologie, Immunologie, experimentelle Tiermodelle, Impfstoffkunde und Immuntherapie sind seitdem aus der Influenzaforschung hervorgegangen. Nur zwei Jahre nach der Entdeckung der Influenzaviren, im Jahr 1933, wurde das IAV als Erreger der menschlichen Grippe identifiziert. Im Laufe der 1930er Jahre wurden Subtypen von IAV entdeckt, und 1940 wurde IBV entdeckt. ⓘ
Während des Zweiten Weltkriegs arbeitete die US-Regierung an der Entwicklung inaktivierter Grippeimpfstoffe, was dazu führte, dass der erste Grippeimpfstoff 1945 in den Vereinigten Staaten zugelassen wurde. ICV wurde zwei Jahre später, 1947, entdeckt. Im Jahr 1955 wurde bestätigt, dass die Vogelgrippe durch IAV verursacht wird. Seit dem Zweiten Weltkrieg gab es vier Influenzapandemien, die jeweils weniger schwerwiegend waren als die Pandemie von 1918. Die erste dieser Pandemien war die Asiatische Grippe von 1957 bis 1958, die durch einen H2N2-Stamm verursacht wurde und in der chinesischen Provinz Yunnan begann. Die Zahl der Todesopfer überstieg wahrscheinlich eine Million, vor allem unter den sehr jungen und sehr alten Menschen. Bemerkenswert ist, dass die Pandemie von 1957 die erste Grippepandemie war, die vor dem Hintergrund eines globalen Überwachungssystems und von Laboratorien auftrat, die in der Lage waren, das neue Influenzavirus zu untersuchen. Nach der Pandemie war H2N2 der für die saisonale Grippe verantwortliche IAV-Subtyp. Das erste antivirale Medikament gegen Influenza, Amantadin, wurde 1966 zugelassen, weitere antivirale Medikamente werden seit den 1990er Jahren eingesetzt. ⓘ
1968 wurde H3N2 durch eine Reassortierung zwischen einem H3N2-Stamm von Vögeln und einem H2N2-Stamm, der beim Menschen zirkulierte, in den Menschen eingeführt. Der neuartige H3N2-Stamm tauchte zuerst in Hongkong auf und verbreitete sich weltweit, was die Hongkong-Grippe-Pandemie auslöste, die 500 000 bis 2 000 000 Todesfälle zur Folge hatte. Dies war die erste Pandemie, die sich in erheblichem Maße durch Flugreisen verbreitete. Nach der Pandemie zirkulierten H2N2 und H3N2 gemeinsam bis 1971, als die Verbreitung von H2N2 abnahm und vollständig durch H3N2 ersetzt wurde. 1977 tauchte H1N1 beim Menschen wieder auf, möglicherweise nachdem es bei einem Laborunfall aus einer Gefriertruhe freigesetzt worden war, und löste eine Pseudopandemie aus. Ob die "Pandemie" von 1977 in die Naturgeschichte der Grippepandemien aufgenommen werden sollte, ist umstritten. Dieser H1N1-Stamm war antigenetisch ähnlich wie die H1N1-Stämme, die vor 1957 im Umlauf waren. Seit 1977 sind sowohl H1N1 als auch H3N2 als Teil der saisonalen Grippe beim Menschen im Umlauf. Im Jahr 1980 wurde das derzeitige Klassifizierungssystem zur Einteilung der Influenzaviren in Subtypen eingeführt. ⓘ

Irgendwann teilte sich das IBV in zwei Linien auf, die B/Victoria-ähnliche und die B/Yamagata-ähnliche Linie, die beide seit 1983 beim Menschen kursieren. 1996 wurde HPAI H5N1 in Guangdong, China, nachgewiesen, und ein Jahr später tauchte es bei Geflügel in Hongkong auf, von wo aus es sich allmählich weltweit verbreitete. Damals kam es zu einem kleinen H5N1-Ausbruch beim Menschen in Hongkong, und seit 1997 treten sporadisch Fälle beim Menschen auf, die eine hohe Sterblichkeitsrate aufweisen. Die jüngste Grippepandemie war die Schweinegrippe-Pandemie von 2009, die ihren Ursprung in Mexiko hatte und zu Hunderttausenden von Todesfällen führte. Sie wurde durch einen neuartigen H1N1-Stamm verursacht, bei dem es sich um eine Neuzusammensetzung von Menschen-, Schweine- und Vogelgrippeviren handelte. Die Pandemie von 2009 hatte zur Folge, dass frühere im Umlauf befindliche H1N1-Stämme durch den neuen Stamm ersetzt wurden, nicht aber durch andere Influenzaviren. Folglich sind H1N1, H3N2 und beide IBV-Stämme seit der Pandemie 2009 in saisonaler Form im Umlauf. ⓘ
Im Jahr 2011 wurde IDV bei Schweinen in Oklahoma, USA, entdeckt, und Rinder wurden später als das Hauptreservoir von IDV identifiziert. Im selben Jahr wurde das Vogelvirus H7N9 in China entdeckt und verursachte ab 2013 Infektionen beim Menschen, die zunächst in Shanghai und Anhui auftraten und überwiegend in China blieben. HPAI H7N9 tauchte irgendwann im Jahr 2016 auf und hat gelegentlich Menschen infiziert. Andere AIV haben seit den 1990er Jahren seltener Menschen infiziert, darunter H5N6, H6N1, H7N2-4, H7N7 und H10N7-8, und HPAI H-Subtypen wie H5N1-3, H5N5-6 und H5N8 haben sich seit den 2010er Jahren in weiten Teilen der Welt verbreitet. Künftige Grippepandemien, die durch ein Influenzavirus aviären Ursprungs ausgelöst werden könnten, werden als nahezu unvermeidlich angesehen, und die zunehmende Globalisierung hat die Ausbreitung neuartiger Viren erleichtert, so dass kontinuierlich Anstrengungen unternommen werden, um sich auf künftige Pandemien vorzubereiten und die Prävention und Behandlung von Influenza zu verbessern. ⓘ
Etymologie
Das Wort Influenza stammt von dem italienischen Wort influenza ab, das aus dem mittelalterlichen Latein influentia stammt und ursprünglich "Heimsuchung" oder "Einfluss" bedeutet. Aus dem 14. Jahrhundert sind Begriffe wie influenza di freddo (Einfluss der Kälte) und influenza di stelle (Einfluss der Sterne) überliefert. Letzteres bezog sich auf die Ursache der Krankheit, die damals von einigen auf ungünstige astrologische Bedingungen zurückgeführt wurde. Bereits 1504 begann man, die Influenza als "Heimsuchung" oder "Ausbruch" einer Krankheit zu bezeichnen, die viele Menschen an einem einzigen Ort gleichzeitig befällt. Während eines Grippeausbruchs im Jahr 1743, der in Italien begann und sich über ganz Europa ausbreitete, gelangte das Wort in die englische Sprache und wurde anglisiert. Seit Mitte des 18. Jahrhunderts wird der Begriff Influenza auch für schwere Erkältungen verwendet. Die verkürzte Form des Wortes, "(die) Grippe", ist erstmals 1839 als "flue" (Grippe) belegt, die Schreibweise "flu" (Grippe) wurde erstmals 1893 belegt. Andere Bezeichnungen für die Influenza sind epidemischer Katarrh, la grippe aus dem Französischen, Schwitzkrankheit, und, insbesondere im Zusammenhang mit der Pandemie von 1918, Spanisches Fieber. ⓘ
Forschung

Die Influenza-Forschung ist breit gefächert und versucht zu verstehen, wie Influenzaviren in den Wirt eindringen, welche Beziehung zwischen Influenzaviren und Bakterien besteht, wie Influenzasymptome entstehen und warum manche Influenzaviren tödlicher sind als andere. In regelmäßigen Abständen werden von Influenzaviren kodierte Nichtstrukturproteine entdeckt, und ihre Funktionen werden kontinuierlich erforscht. Frühere Pandemien, insbesondere die Pandemie von 1918, sind Gegenstand zahlreicher Untersuchungen zum Verständnis von Grippepandemien. Im Rahmen der Pandemievorsorge ist das Global Influenza Surveillance and Response System ein globales Netz von Labors, das die Übertragung und Epidemiologie der Grippe überwacht. Weitere Forschungsbereiche sind die Verbesserung der Diagnose, Behandlung und Vorbeugung von Influenza. ⓘ
Bestehende Diagnosemethoden haben neben ihren Vorteilen auch eine Reihe von Einschränkungen. NATs haben beispielsweise eine hohe Sensitivität und Spezifität, sind aber in unterversorgten Regionen aufgrund der hohen Kosten, der Komplexität, der Wartung und der erforderlichen Schulung unpraktisch. Kostengünstige, tragbare RIDTs können Influenza schnell diagnostizieren, haben aber eine sehr unterschiedliche Empfindlichkeit und sind nicht in der Lage, IAV-Subtypen zu bestimmen. Aufgrund dieser und anderer Einschränkungen konzentriert sich die Forschung zu neuen Diagnosemethoden auf die Entwicklung neuer Methoden, die kostengünstig, weniger arbeitsintensiv und weniger komplex als die bestehenden Methoden sind und gleichzeitig in der Lage sind, Influenzaspezies und IAV-Subtypen zu unterscheiden. Ein in der Entwicklung befindlicher Ansatz sind Lab-on-a-Chips, d. h. Diagnosegeräte, die eine Vielzahl von Diagnosetests, wie RT-PCR und serologische Tests, in Form von Mikrochips nutzen. Diese Chips haben viele potenzielle Vorteile, darunter eine hohe Reaktionseffizienz, einen geringen Energieverbrauch und eine geringe Abfallerzeugung. ⓘ
Aufgrund des Ausscheidens der Adamantine als brauchbare Medikamente und der Besorgnis über die Oseltamivir-Resistenz werden derzeit auch neue antivirale Medikamente entwickelt. Dazu gehören: NA-Inhibitoren, die intravenös injiziert werden können, wie intravenöse Formulierungen von Zanamivir; Favipiravir, ein Polymerase-Inhibitor, der gegen verschiedene RNA-Viren eingesetzt wird; Pimodivir, das die während der viralen Transkription erforderliche Cap-Bindung verhindert; und Nitazoxanid, das die HA-Reifung hemmt. Die Verringerung übermäßiger Entzündungen in den Atemwegen ist ebenfalls Gegenstand zahlreicher Forschungsarbeiten, da dies einer der wichtigsten Mechanismen der Influenza-Pathologie ist. Zu den weiteren in der Entwicklung befindlichen Therapieformen gehören monoklonale und polyklonale Antikörper, die auf virale Proteine abzielen, Rekonvaleszenzplasma, verschiedene Ansätze zur Modifizierung der antiviralen Reaktion des Wirts und stammzellbasierte Therapien zur Reparatur von Lungenschäden. ⓘ
Ein Großteil der Forschung zu LAIVs konzentriert sich auf die Identifizierung von Genomsequenzen, die gelöscht werden können, um harmlose Influenzaviren in Impfstoffen zu erzeugen, die dennoch Immunität verleihen. Die hohe Variabilität und die schnelle Entwicklung von Influenzavirus-Antigenen ist jedoch ein großes Hindernis bei der Entwicklung wirksamer Impfstoffe. Darüber hinaus lässt sich nur schwer vorhersagen, welche Stämme in der nächsten Grippesaison im Umlauf sein werden, die Herstellung einer ausreichenden Menge an Grippeimpfstoffen für die nächste Saison ist schwierig, LAIVs sind nur begrenzt wirksam, und wiederholte jährliche Impfungen haben möglicherweise eine geringere Wirksamkeit. Aus diesen Gründen wird an "breit wirksamen" oder "universellen" Grippeimpfstoffen geforscht, die gegen viele oder alle Grippeviren schützen können. Zu den Ansätzen für die Entwicklung eines solchen Impfstoffs gehören HA-Stiel-basierte Methoden wie Chimären, die den gleichen Stiel, aber unterschiedliche Köpfe haben, HA-Kopf-basierte Methoden wie rechnerisch optimierte, breit neutralisierende Antigene, anti-idiotypische Antikörper und Impfstoffe, die Immunreaktionen auf hochkonservierte virale Proteine auslösen. mRNA-Impfstoffe, die Schutz gegen Influenza bieten, werden ebenfalls erforscht. ⓘ
Bei Tieren
Vögel
Wasservögel wie Enten, Gänse, Küstenvögel und Möwen sind das Hauptreservoir für IAVs. Bei Vögeln kann es sich bei den AIVs entweder um gering pathogene aviäre Influenzaviren (LPAI) handeln, die wenig bis keine Symptome hervorrufen, oder um hoch pathogene aviäre Influenzaviren (HPAI), die schwere Erkrankungen verursachen. Zu den Symptomen einer HPAI-Infektion gehören Energie- und Appetitlosigkeit, verringerte Eierproduktion, weichschalige oder missgebildete Eier, Schwellungen an Kopf, Kamm, Kehllappen und Sprunggelenken, violette Verfärbung von Kehllappen, Kämmen und Beinen, Nasenausfluss, Husten, Niesen, Koordinationsstörungen und Durchfall. Mit dem HPAI-Virus infizierte Vögel können auch plötzlich und ohne jegliche Anzeichen einer Infektion sterben. ⓘ
Die Unterscheidung zwischen LPAI und HPAI basiert im Allgemeinen darauf, wie tödlich ein AIV-Virus für Hühner ist. Auf genetischer Ebene kann ein AIV in der Regel als HPAI-Virus identifiziert werden, wenn es eine multibasische Spaltstelle im HA-Protein aufweist, die zusätzliche Reste im HA-Gen enthält. Die meisten AIVs sind LPAI. Zu den bemerkenswerten HPAI-Viren gehören HPAI H5N1 und HPAI H7N9. HPAI-Viren stellen im 21. Jahrhundert eine große Krankheitslast dar und haben zum Tod einer großen Zahl von Vögeln geführt. Im Fall von H7N9 waren einige zirkulierende Stämme ursprünglich LPAI, wurden aber durch den Erwerb der HA-Multibasisspaltstelle zu HPAI. Das Vogelgrippevirus H9N2 ist ebenfalls besorgniserregend, da es zwar ein LPAI-Virus ist, aber im Zuge der Reassortierung häufig Gene an H5N1 und H7N9 abgibt. ⓘ
Zugvögel können die Influenza über große Entfernungen verbreiten. Ein Beispiel hierfür war die Infektion eines H5N1-Stammes im Jahr 2005 am Qinghai-See in China, einem Zwischenstopp- und Brutgebiet für viele Zugvögel, von wo aus das Virus in mehr als 20 Länder in Asien, Europa und im Nahen Osten verbreitet wurde. AIVs können von Wildvögeln auf Hausenten in Freilandhaltung übertragen werden, die wiederum über kontaminiertes Wasser, Aerosole und Pilzsporen auf Geflügel übergehen. Enten fungieren daher als wichtige Vermittler zwischen Wild- und Hausvögeln. Die Übertragung auf Geflügel erfolgt in der Regel in Hinterhofhaltungen und auf Lebendtiermärkten, wo mehrere Arten miteinander interagieren. Von dort aus können sich AIVs in Geflügelfarmen ausbreiten, wenn keine angemessene Biosicherheit gewährleistet ist. Bei Geflügel erfolgt die Übertragung von HPAI durch Aerosole und kontaminierte Fäkalien, Käfige, Futtermittel und tote Tiere. Eine Rückübertragung von HPAI-Viren von Geflügel auf Wildvögel ist aufgetreten und wird mit Massensterben und interkontinentaler Ausbreitung in Verbindung gebracht. ⓘ
AIVs haben gelegentlich Menschen über Aerosole, Fomite und kontaminiertes Wasser infiziert. Direkte Übertragungen durch Wildvögel sind selten. Stattdessen erfolgt die Übertragung meist durch Hausgeflügel, vor allem Hühner, Enten und Gänse, aber auch durch eine Vielzahl anderer Vögel wie Perlhühner, Rebhühner, Fasane und Wachteln. Der Hauptrisikofaktor für eine Infektion mit AIVs ist der Kontakt mit Vögeln in landwirtschaftlichen Betrieben und auf Märkten für lebendes Geflügel. Eine Infektion mit einem AIV hat in der Regel eine Inkubationszeit von 3-5 Tagen, kann aber auch bis zu 9 Tage dauern. H5N1 und H7N9 verursachen schwere Erkrankungen der unteren Atemwege, während andere AIV wie H9N2 eine leichtere Erkrankung der oberen Atemwege verursachen, häufig mit Bindehautentzündung. Begrenzte Übertragungen der Subtypen H2, H5-7, H9 und H10 von einer Person auf eine andere durch Tröpfchen in der Atemluft, Aerosole und Fomite sind aufgetreten, eine dauerhafte Übertragung von AIVs von Mensch zu Mensch ist jedoch nicht bekannt. Vor 2013 war H5N1 der häufigste AIV, der Menschen infizierte. Seitdem ist H7N9 für die meisten menschlichen Fälle verantwortlich. ⓘ
Schweine

Die Influenza bei Schweinen ist eine Atemwegserkrankung, die der Influenza beim Menschen ähnelt und weltweit vorkommt. Asymptomatische Infektionen sind häufig. Die Symptome treten typischerweise 1-3 Tage nach der Infektion auf und umfassen Fieber, Lethargie, Anorexie, Gewichtsverlust, erschwerte Atmung, Husten, Niesen und Nasenausfluss. Bei Sauen kann es zu einem Abbruch der Trächtigkeit kommen. Zu den Komplikationen gehören Sekundärinfektionen und eine potenziell tödliche Bronchopneumonie. Schweine werden innerhalb eines Tages nach der Infektion ansteckend und verbreiten das Virus in der Regel 7-10 Tage lang, was zu einer raschen Ausbreitung innerhalb einer Herde führen kann. Schweine erholen sich in der Regel innerhalb von 3-7 Tagen nach Auftreten der Symptome von der Infektion. Zu den Präventions- und Kontrollmaßnahmen gehören inaktivierte Impfstoffe und die Keulung infizierter Bestände. Die für die Schweinegrippe verantwortlichen Influenzaviren sind in der Regel die IAV-Subtypen H1N1, H1N2 und H3N2. ⓘ
Einige IAV können über Aerosole von Schweinen auf Menschen übertragen werden und umgekehrt. Außerdem gelten Schweine, ebenso wie Fledermäuse und Wachteln, als Überträger von Influenzaviren, da sie sowohl α-2,3- als auch α-2,6-Sialinsäurerezeptoren in ihren Atemwegen haben. Aus diesem Grund können sowohl Vogel- als auch Säugetier-Influenzaviren Schweine infizieren. Wenn es zu einer Koinfektion kommt, ist ein Reassortment möglich. Ein bemerkenswertes Beispiel hierfür war das Reassortment eines Schweine-, Vogel- und menschlichen Influenzavirus im Jahr 2009, das zu einem neuen H1N1-Stamm führte, der die Grippepandemie 2009 auslöste. Spillover-Ereignisse von Menschen auf Schweine scheinen jedoch häufiger zu sein als von Schweinen auf Menschen. ⓘ
Andere Tiere
Influenzaviren wurden bei vielen anderen Tieren gefunden, darunter Rinder, Pferde, Hunde, Katzen und Meeressäugetiere. Fast alle IAV-Viren stammen offenbar von Vorläuferviren bei Vögeln ab. Eine Ausnahme bilden die Influenza-ähnlichen Fledermausviren, deren Herkunft unklar ist. Diese Fledermausviren haben die HA- und NA-Subtypen H17, H18, N10 und N11. H17N10 und H18N11 sind nicht in der Lage, sich mit anderen IAVs zu reassortieren, können sich aber dennoch in anderen Säugetieren vermehren. AIVs kreuzen manchmal in Säugetiere über. So wurde beispielsweise Ende 2016 bis Anfang 2017 festgestellt, dass ein aviärer H7N2-Stamm Katzen in New York infiziert. ⓘ
Zu den IAV bei Pferden gehören H7N7 und zwei Linien von H3N8. H7N7 wurde jedoch seit den späten 1970er Jahren nicht mehr bei Pferden nachgewiesen, so dass es bei Pferden möglicherweise ausgestorben ist. H3N8 verbreitet sich bei Pferden über Aerosole und verursacht Erkrankungen der Atemwege. H3N8 bei Pferden bindet bevorzugt an α-2,3-Sialinsäuren, so dass Pferde in der Regel als Endwirte betrachtet werden, aber es ist eine Übertragung auf Hunde und Kamele erfolgt, was Anlass zu der Besorgnis gibt, dass Pferde Mischgefäße für ein Reassortment sein könnten. Bei Hunden sind nur das vom Pferd stammende H3N8 und das von Vögeln stammende H3N2 als IAV im Umlauf. Bei H3N8 bei Hunden wurde keine Reassortierung mit anderen Subtypen beobachtet. H3N2 hat ein viel breiteres Wirtsspektrum und kann sich mit H1N1 und H5N1 reassortieren. Ein isolierter Fall von H6N1, der wahrscheinlich von einem Huhn stammte, wurde bei einem Hund gefunden, so dass auch andere AIVs bei Hunden auftreten können. ⓘ
Andere Säugetiere, die mit IAV infiziert sind, sind H7N7 und H4N5 bei Robben, H1N3 bei Walen und H10N4 und H3N2 bei Nerzen. Es wurden verschiedene Mutationen identifiziert, die mit der Anpassung von AIVs an Säugetiere in Verbindung gebracht werden. Da sich die HA-Proteine darin unterscheiden, an welche Sialinsäuren sie binden, können Mutationen in der HA-Rezeptor-Bindungsstelle es AIVs ermöglichen, Säugetiere zu infizieren. Zu den weiteren Mutationen gehören Mutationen, die sich darauf auswirken, welche Sialinsäuren NA-Proteine spalten, sowie eine Mutation in der PB2-Polymerase-Untereinheit, die die Toleranz gegenüber niedrigeren Temperaturen in den Atemwegen von Säugetieren verbessert und den RNP-Aufbau durch Stabilisierung der NP- und PB2-Bindung fördert. ⓘ
IBV kommt hauptsächlich beim Menschen vor, wurde aber auch bei Schweinen, Hunden, Pferden und Robben nachgewiesen. Ebenso infiziert ICV in erster Linie den Menschen, wurde aber auch bei Schweinen, Hunden, Rindern und Dromedarkamelen beobachtet. IDV verursacht eine grippeähnliche Erkrankung bei Schweinen, aber seine Auswirkungen auf sein natürliches Reservoir, Rinder, sind relativ unbekannt. Es kann entweder selbst eine Atemwegserkrankung hervorrufen, die der menschlichen Influenza ähnelt, oder es kann Teil eines Komplexes der bovinen Atemwegserkrankung (BRD) mit anderen Erregern während einer Koinfektion sein. BRD ist ein Problem für die Rinderindustrie, so dass die mögliche Beteiligung von IDV an BRD zur Erforschung von Impfstoffen für Rinder geführt hat, die Schutz gegen IDV bieten können. Zwei antigene Linien sind im Umlauf: D/swine/Oklahoma/1334/2011 (D/OK) und D/bovine/Oklahoma/660/2013 (D/660). ⓘ
Arbeitsgemeinschaft Influenza
Die in Deutschland beheimatete Arbeitsgemeinschaft Influenza (AGI) wurde 1992 von vier pharmazeutischen Unternehmen und dem ebenfalls industrienahen Deutschen Grünen Kreuz (DGK) gegründet. Nach dem Inkrafttreten des Infektionsschutzgesetzes (Anfang 2001) übernahm das Robert Koch-Institut (RKI) die wissenschaftliche Federführung der AGI unter Beibehaltung der bisherigen Sponsoren DKG, Aventis Pasteur MSD, Chiron Behring, Niddapharm, SmithKline Beecham Pharma und Solvay Arzneimittel. Als Reaktion auf Frühphase die Pandemie H1N1 2009/10 („Schweinegrippe“) ist das RKI seit dem Winter 2009/10 für die Arbeitsgemeinschaft Influenza alleinverantwortlich. Die AGI ist seitdem eine Gemeinschaft der Sentinel-Praxen und des RKI, deren Arbeit ausschließlich aus öffentlichen Mitteln finanziert wird. Auf seiner Website beschreibt das RKI die AGI wie folgt: „Die AGI ist ein Netzwerk von rund 700 Haus- und Kinderärzten, die zusammen etwa ein Prozent der Bevölkerung versorgen. Sie teilen dem Robert Koch-Institut das ganze Jahr über freiwillig und ehrenamtlich wöchentlich die Zahl der akuten Atemwegserkrankungen in ihrer Praxis mit. Auf dieser Grundlage ermitteln die Experten im RKI die Krankheitslast durch akute Atemwegsinfektionen in der Bevölkerung – speziell durch Influenza.“ Die AGI veröffentlicht u. a. Wochen- und Saisonberichte, in denen die jeweils erfassten Daten des Verlaufes der Erkrankung in Deutschland festgehalten sind und bewertet werden. ⓘ
Influenza und Schwangerschaft
In der Schwangerschaft ist die Immunabwehr herabgesetzt, was überschießende Immunreaktionen gegen das Fremdprotein des Embryos verhindert. Deswegen ist für Schwangere das Risiko, während einer Influenza-Epidemie mit dem Virus angesteckt zu werden, größer als bei nicht-schwangeren Frauen. Zudem gibt es Anhaltspunkte dafür, dass die Influenza-Infektion bei Schwangeren schwerer verlaufen kann. ⓘ
Therapie
Um eine Infektion mit Influenzaviren zu behandeln, steht eine Reihe spezifischer, antiviraler Medikamente zur Verfügung. Diese können in begrenztem Umfang die Erkrankung abkürzen und lebensgefährliche Komplikationen bei gefährdeten Patientengruppen verhindern. Alle antiviralen Medikamente sind verschreibungspflichtig, unter anderem, da sie bei nicht gefährdeten Patienten nicht angewandt werden sollten, um eine Resistenzentwicklung von Virusstämmen zu vermeiden. Auch wurden nennenswerte Nebenwirkungen beobachtet und sind der Zeitpunkt der Einnahme und bestimmte wichtige Kontraindikationen zu beachten. ⓘ
Neben der spezifischen Therapie einer Influenza werden auch symptomatisch die Beschwerden der Patienten behandelt. Diese symptomatische Therapie soll die Entstehung oder das Fortschreiten von Komplikationen verhindern und die meist unangenehmen Symptome wie Fieber, Schüttelfrost, Behinderung der Atemwege oder Labilität des Herz-Kreislaufsystems lindern. Sie haben auf die Vermehrung, Elimination oder Übertragung des Virus keinen Einfluss. ⓘ
Endonuklease-Hemmer
Das Influenza-Virus besitzt einen Polymerase-Komplex. Dieser besteht aus drei Proteinen: PB1, PB2 und PA. PB1 und PB2 sind das "polymerase basic protein 1 und 2". PA ist das "polymerase acidic protein". Alle sind essentiell für die Virusvermehrung. PB2 verbindet sich mit der Spitze der Pre-Messenger-RNA des Wirtes, um die Vermehrung der Virus-RNA zu ermöglichen. Der PB1-Inhibitor Favipiravir (Avigan) wurde 2014 in Japan zur Behandlung der Influenza zugelassen. Pimodivir ist ein PB2-Inhibitor für Influenza-A-Viren. 2018 wurde ein selektiver PA-Inhibitor, Baloxavirmarboxil, in einer internationalen Studie an Erwachsenen und Jugendlichen mit unkomplizierter Influenza erfolgreich getestet. ⓘ
Pflanzenheilkunde
Zur Vorbeugung vor Infektionen mit Viren („Infektblocker“) werden Präparate zum Lutschen angeboten, beispielsweise mit Zistrosenextrakt. Polyphenole aus der Zistrose sollen Viruspartikel in unspezifischer Art und Weise binden und die Proteine der Virushülle denaturieren. Eine klinische Wirksamkeit gegen Influenza-Viren konnte nicht überzeugend gezeigt werden. Bestimmte Senfölglycoside aus Kapuzinerkresse und Meerrettichwurzel, für die in vitro ein breites antibakterielles Wirkungsspektrum gegen Pneumokokken und andere problematische Erreger nachgewiesen wurde, können die Beschwerden durch mögliche bakterielle Sekundärinfektionen der Atemwege mildern. ⓘ
Symptomatische Therapie
Einer durch die Influenza begünstigten zusätzlichen Infektion mit Bakterien in Form einer eitrigen Halsentzündung, akuten Bronchitis, Lungenentzündung oder Meningitis kann durch eine möglichst spezifische Antibiotika-Therapie begegnet werden. Bei manchen Influenzainfektionen mit längerem Erkrankungsverlauf steht bei bereits überwundener Virusinfektion meist nur noch der bakterielle Infekt im Vordergrund.
Der Krankheitsverlauf kann durch zusätzliche Maßnahmen wie eine ausreichende Flüssigkeitszufuhr (erheblicher Wasserverlust durch Fieber), ausreichend befeuchtete Luft, Inhalation, und die Gabe von Medikamenten, die zur Abschwellung der Nasenschleimhaut führen, günstig beeinflusst werden. ⓘ
Als weitere symptomatische Maßnahmen werden fiebersenkende Mittel (besonders bei Kreislauflabilität oder Herzerkrankung) wie Paracetamol und Ibuprofen verabreicht. Die Anwendung von Acetylsalicylsäure (ASS) soll bei Kindern unter zwölf Jahren nur auf ärztliche Verordnung erfolgen, da bei einer Virusinfektion die Gefahr für das Auftreten des gefährlichen, häufig tödlich verlaufenden Reye-Syndroms besteht. ⓘ
Da zahlreiche influenzabedingte Schädigungen der Lunge und nachfolgende Todesfälle auf eine Überreaktion des Immunsystems (Zytokinsturm) zurückgeführt werden, arbeiten Forscher an der Entwicklung von Substanzen, die bei einer Influenza-Erkrankung die Immunreaktion regulieren. ⓘ
Meldepflicht
In Deutschland ist eine „zoonotische Influenza“ eine meldepflichtige Krankheit nach § 6 Absatz 1 des Infektionsschutzgesetzes. Die namentliche Meldepflicht besteht bei Verdacht, Erkrankung und Tod. Meldepflichtig ist die zoonotische Influenza nach dem Recht Deutschlands durch das Masernschutzgesetz seit dem 1. März 2020. Nach dem Recht Sachsens besteht eine namentliche Meldepflicht bezüglich Erkrankung und Tod an Influenza. ⓘ
In Österreich sind „Infektionen mit dem Influenzavirus A/H5N1 oder einem anderen Vogelgrippevirus“ anzeigepflichtige Krankheiten gemäß § 1 Abs. 1 Epidemiegesetz 1950. Die Meldepflicht bezieht sich auf Verdachts-, Erkrankungs- und Todesfälle. ⓘ
In der Schweiz ist eine „Influenza A HxNy (neuer Subtyp)“ eine meldepflichtige Krankheit und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Die Pflicht besteht bei klinischem Verdacht und erstreckt sich auch auf die Rücksprache mit Fachärztin oder Facharzt für Infektiologie und die Veranlassung einer erregerspezifischen Labordiagnostik. ⓘ

