Antidepressivum
| Antidepressivum ⓘ | |
|---|---|
| Wirkstoffklasse | |
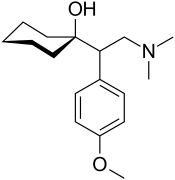 Die Skelettstruktur des SNRI Venlafaxin, ein typisches Beispiel für ein Antidepressivum. | |
| Bezeichner der Klasse | |
| Verwendung | Depressive Störungen |
| ATC-Code | N06A |
| Klinische Daten | |
| Drogen.de | Medikamenten-Klassen |
| Verbraucherberichte | Best Buy Medikamente |
| WebMD | MedicineNet RxList |
| Externe Links | |
| MeSH | D000928 |
Antidepressiva sind Medikamente, die zur Behandlung von schweren depressiven Störungen, einigen Angststörungen, einigen chronischen Schmerzzuständen und zur Bewältigung einiger Abhängigkeiten eingesetzt werden. Zu den häufigen Nebenwirkungen von Antidepressiva gehören Mundtrockenheit, Gewichtszunahme, Schwindel, Kopfschmerzen, sexuelle Funktionsstörungen und emotionale Abstumpfung. Bei Kindern, Jugendlichen und jungen Erwachsenen besteht ein leicht erhöhtes Risiko für Selbstmordgedanken und -verhalten. Nach dem Absetzen eines Antidepressivums kann ein Absetzsyndrom auftreten, das einer wiederkehrenden Depression ähnelt. ⓘ
Einige Überprüfungen von Antidepressiva zur Behandlung von Depressionen bei Erwachsenen ergeben einen Nutzen, andere nicht. Die Belege für den Nutzen bei Kindern und Jugendlichen sind unklar. Die einundzwanzig am häufigsten verschriebenen Antidepressiva erwiesen sich in einer Metastudie aus dem Jahr 2016 bei Erwachsenen mit schweren depressiven Störungen als wirksamer als Placebo. In der medizinischen Fachwelt ist umstritten, inwieweit die beobachteten Wirkungen von Antidepressiva auf den Placebo-Effekt zurückzuführen sind, wobei einige behaupten, dass es darüber hinaus keine Wirkung gibt. Die meisten Untersuchungen zur Wirkung von Antidepressiva wurden an Menschen mit sehr schweren Symptomen durchgeführt, einer Bevölkerungsgruppe, die sehr viel schwächer auf Placebos reagiert, so dass die Ergebnisse nicht auf die allgemeine Bevölkerung übertragen werden können. ⓘ
Es gibt wirksame Behandlungen für Depressionen, die keine Medikamente beinhalten oder in Verbindung mit Medikamenten eingesetzt werden können. ⓘ
Ein Antidepressivum oder Thymoleptikum ist ein Arzneimittel aus der Klasse der Psychopharmaka, das vornehmlich in der Behandlung von Depressionen verwendet wird. Antidepressiva können darüber hinaus aber auch bei einer Vielzahl von anderen psychischen Störungen eingesetzt werden. Weitere Anwendungsgebiete sind z. B.
- Zwangsstörungen und Panikattacken,
- einige Angststörungen oder Phobien, die posttraumatische Belastungsstörung,
- Essstörungen, chronische Schmerzen und Entzugssyndrome,
- Schlafstörungen und das prämenstruell-dysphorische Syndrom.
Mit über 1,4 Milliarden DDD (definierte Tagesdosis) waren Antidepressiva 2016 in Deutschland die mit Abstand am häufigsten ambulant verordnete Gruppe von Psychopharmaka. Die ersten klassischen Antidepressiva wurden in den 1950er Jahren eingeführt. ⓘ
Medizinische Anwendungen
Antidepressiva werden zur Behandlung von schweren depressiven Störungen und anderen Erkrankungen eingesetzt, darunter einige Angststörungen, einige chronische Schmerzzustände und zur Behandlung einiger Abhängigkeiten. Antidepressiva werden häufig in Kombination miteinander eingesetzt. ⓘ
Die Befürworter der Monoamin-Hypothese der Depression empfehlen, das Antidepressivum mit dem Wirkmechanismus zu wählen, der sich auf die auffälligsten Symptome auswirkt. Sie plädieren zum Beispiel dafür, dass Menschen mit MDD, die auch ängstlich oder reizbar sind, mit SSRIs oder Noradrenalin-Wiederaufnahmehemmern behandelt werden sollten, und diejenigen, die an Energieverlust und Lebensfreude leiden, mit Noradrenalin- und Dopamin-verstärkenden Medikamenten. ⓘ
Major depressive Störung
In den Leitlinien des britischen National Institute for Health and Care Excellence (NICE) aus dem Jahr 2009 heißt es, dass Antidepressiva nicht routinemäßig für die Erstbehandlung leichter Depressionen eingesetzt werden sollten, da das Nutzen-Risiko-Verhältnis schlecht ist. In den Leitlinien wird empfohlen, eine Behandlung mit Antidepressiva in Betracht zu ziehen bei:
- Menschen mit einer mittelschweren oder schweren Depression in der Vorgeschichte,
- Personen mit leichten Depressionen, die bereits seit längerer Zeit bestehen,
- als Zweitlinientherapie für leichte Depressionen, die nach anderen Maßnahmen fortbestehen,
- als Erstlinientherapie bei mittelschweren oder schweren Depressionen. ⓘ
In den Leitlinien wird ferner darauf hingewiesen, dass die Behandlung mit Antidepressiva in den meisten Fällen mit psychosozialen Maßnahmen kombiniert und mindestens sechs Monate lang fortgesetzt werden sollte, um das Risiko eines Rückfalls zu verringern, und dass selektive Serotonin-Wiederaufnahmehemmer (SSRI) in der Regel besser verträglich sind als andere Antidepressiva. ⓘ
Die Behandlungsrichtlinien der American Psychiatric Association empfehlen, dass die Erstbehandlung individuell zugeschnitten sein sollte, und zwar auf der Grundlage von Faktoren wie dem Schweregrad der Symptome, gleichzeitig bestehenden Störungen, früheren Behandlungserfahrungen und den Präferenzen des Betroffenen. Zu den Optionen gehören Pharmakotherapie, Psychotherapie, Elektrokonvulsionstherapie (EKT), transkranielle Magnetstimulation (TMS) oder Lichttherapie. Sie empfahlen Antidepressiva als erste Behandlungsoption für Menschen mit leichten, mittelschweren oder schweren schweren Depressionen, die allen Menschen mit schweren Depressionen verabreicht werden sollten, sofern keine EKT geplant ist. ⓘ
Überprüfungen von Antidepressiva zeigen im Allgemeinen, dass sie Erwachsenen mit Depressionen helfen. Auf der anderen Seite wird behauptet, dass die meisten Studien über Antidepressiva durch mehrere Faktoren beeinträchtigt werden: das Fehlen eines aktiven Placebos, was bedeutet, dass viele Personen im Placebo-Arm einer Doppelblindstudie herausfinden können, dass sie keine echte Behandlung erhalten, wodurch die Doppelblindheit zerstört wird; eine kurze Nachbeobachtungszeit nach Beendigung der Behandlung; eine nicht systematische Erfassung der unerwünschten Wirkungen; sehr strenge Ausschlusskriterien bei Patientenstichproben; Studien, die von der Industrie bezahlt werden; selektive Veröffentlichung der Ergebnisse. Das bedeutet, dass die geringen positiven Auswirkungen, die gefunden werden, möglicherweise statistisch nicht signifikant sind. ⓘ
Angststörungen
Generalisierte Angststörung
Antidepressiva werden vom National Institute for Health and Care Excellence (NICE) zur Behandlung der generalisierten Angststörung (GAD) empfohlen, die auf konservative Maßnahmen wie Aufklärung und Selbsthilfeaktivitäten nicht angesprochen hat. GAD ist eine weit verbreitete Störung, deren zentrales Merkmal die übermäßige Sorge um eine Reihe verschiedener Ereignisse ist. Zu den Hauptsymptomen gehören übermäßige Ängste vor verschiedenen Ereignissen und Problemen sowie Schwierigkeiten bei der Kontrolle beunruhigender Gedanken, die mindestens sechs Monate lang anhalten. ⓘ
Antidepressiva bewirken bei GAD eine mäßige bis leichte Verringerung der Ängste. Die Wirksamkeit der verschiedenen Antidepressiva ist ähnlich. ⓘ
Soziale Angststörung
Einige Antidepressiva werden zur Behandlung der sozialen Angststörung eingesetzt, doch ist ihre Wirksamkeit nicht ganz überzeugend, da nur ein kleiner Teil der Antidepressiva eine gewisse Wirksamkeit bei dieser Erkrankung gezeigt hat. Paroxetin war das erste Medikament, das von der FDA zur Behandlung dieser Störung zugelassen wurde. Seine Wirksamkeit wird als vorteilhaft angesehen, obwohl nicht jeder auf das Medikament anspricht. Später wurden auch Sertralin und Fluvoxamin mit verlängerter Wirkstofffreisetzung für diese Erkrankung zugelassen, während Escitalopram mit akzeptabler Wirksamkeit außerhalb der Zulassung eingesetzt wird. Es gibt jedoch nicht genügend Beweise, um Citalopram für die Behandlung der sozialen Phobie zu unterstützen, und Fluoxetin war in klinischen Studien nicht besser als Placebo. SSRI werden als Erstbehandlung für soziale Ängste eingesetzt, aber sie wirken nicht bei jedem. Eine Alternative wäre Venlafaxin, das zu den SNRI gehört. Es zeigte in fünf klinischen Studien im Vergleich zu Placebo einen Nutzen bei sozialer Phobie, während die anderen SNRI als nicht besonders nützlich für diese Störung angesehen werden, da viele von ihnen nicht für diese Störung getestet wurden. Bislang ist unklar, ob Duloxetin und Desvenlafaxin für Menschen mit sozialen Ängsten von Nutzen sein können. Eine andere Klasse von Antidepressiva, die so genannten MAOIs, gelten jedoch als wirksam bei sozialen Ängsten, haben jedoch viele unerwünschte Nebenwirkungen und werden daher nur selten eingesetzt. Phenelzin hat sich als eine gute Behandlungsoption erwiesen, aber seine Verwendung ist durch diätetische Einschränkungen eingeschränkt. Moclobemid ist ein RIMA und zeigte gemischte Ergebnisse, wurde aber dennoch in einigen europäischen Ländern für die Behandlung sozialer Angstzustände zugelassen. TCA-Antidepressiva wie Clomipramin und Imipramin gelten bei dieser Angststörung nicht als besonders wirksam. Damit bleiben SSRI wie Paroxetin, Sertralin und Fluvoxamin CR als akzeptable und verträgliche Behandlungsoptionen für diese Störung übrig. ⓘ
Zwangsneurosen
SSRI sind eine Zweitlinientherapie für erwachsene Zwangsstörungen mit leichten funktionellen Beeinträchtigungen und eine Erstlinientherapie für solche mit mittleren oder schweren Beeinträchtigungen. Bei Kindern werden SSRI als Zweitlinientherapie bei mittelschwerer bis schwerer Beeinträchtigung in Betracht gezogen, wobei eine sorgfältige Überwachung auf psychiatrische Nebenwirkungen erfolgt. Die Wirksamkeit wurde sowohl in Kurzzeitbehandlungsstudien von 6 bis 24 Wochen als auch in Absetzstudien von 28 bis 52 Wochen Dauer nachgewiesen. Clomipramin, ein TCA-Präparat, gilt als wirksam und nützlich für die Behandlung von Zwangsstörungen, wird jedoch als Zweitlinientherapie eingesetzt, da es weniger gut verträglich ist als die SSRI. Trotzdem hat es in Studien keine Überlegenheit gegenüber Fluvoxamin gezeigt. Alle SSRIs können bei Zwangsstörungen wirksam eingesetzt werden. Auch der Einsatz von SNRI kann versucht werden, obwohl keine SNRI für die Behandlung von Zwangsstörungen zugelassen sind. Trotz dieser Behandlungsmöglichkeiten bleiben die Symptome bei vielen Patienten auch nach Beginn der medikamentösen Behandlung bestehen, und weniger als die Hälfte erreicht eine Remission. ⓘ
Posttraumatische Belastungsstörung
Antidepressiva sind eine der Behandlungsmöglichkeiten für PTBS, ihre Wirksamkeit ist jedoch nicht gut belegt. Paroxetin und Sertralin, beide aus der Klasse der Serotonin-Wiederaufnahmehemmer, sind von der FDA für die Behandlung von PTBS zugelassen worden. Die Ansprech- und Remissionsraten von Paroxetin sind etwas höher als die von Sertralin bei dieser Erkrankung, doch wird keines der beiden Medikamente als sehr hilfreich für eine breite Patientengruppe angesehen. Fluoxetin und Venlafaxin werden off-label eingesetzt. Fluoxetin hat zu unbefriedigenden, gemischten Ergebnissen geführt. Venlafaxin zeigte Ansprechraten von 78 %, was deutlich höher ist als das, was Paroxetin und Sertralin erreichten. Allerdings wurden damit nicht so viele Symptome der PTBS wie mit Paroxetin und Sertralin behandelt, was zum Teil darauf zurückzuführen ist, dass Venlafaxin ein SNRI ist. Diese Medikamentenklasse hemmt die Wiederaufnahme von Noradrenalin, was bei einigen Patienten zu Angstzuständen führen kann. Fluvoxamin, Escitalopram und Citalopram wurden bei dieser Störung nicht gut getestet. MAOIs können zwar hilfreich sein, werden aber wegen ihrer unerwünschten Nebenwirkungen nicht häufig eingesetzt. Somit bleiben Paroxetin und Sertralin als akzeptable Behandlungsoptionen für manche Menschen übrig, obwohl wirksamere Antidepressiva benötigt werden. ⓘ
Panikstörung
Die Panikstörung lässt sich im Vergleich zu anderen Störungen relativ gut mit Medikamenten behandeln. Mehrere Klassen von Antidepressiva haben sich bei dieser Störung als wirksam erwiesen, wobei SSRI und SNRI als Erstlinientherapie eingesetzt werden. Paroxetin, Sertralin und Fluoxetin sind von der FDA für die Behandlung der Panikstörung zugelassen, obwohl auch Fluvoxamin, Escitalopram und Citalopram als wirksam gelten. Der SNRI Venlafaxin ist ebenfalls für diese Erkrankung zugelassen. Anders als bei sozialen Ängsten und PTBS haben sich einige TCA-Antidepressiva wie Clomipramin und Imipramin bei Panikstörungen als wirksam erwiesen. Auch das MAOI Phenelzin wird als nützlich angesehen. Für die Behandlung der Panikstörung stehen zahlreiche Medikamente zur Verfügung, allerdings muss die Anfangsdosis niedriger sein als bei der Behandlung der Major Depression, da die Betroffenen zu Beginn der Behandlung über eine Zunahme der Angstzustände berichtet haben, die durch die Einnahme der Medikamente ausgelöst wird. Zusammenfassend lässt sich sagen, dass die Behandlungsmöglichkeiten für die Panikstörung zwar akzeptabel und nützlich zu sein scheinen, dass aber viele Menschen auch nach der Behandlung noch Rest-Symptome aufweisen. ⓘ
Essstörungen
Antidepressiva werden bei der Behandlung von Bulimia nervosa als Alternative oder zusätzlicher erster Schritt zu Selbsthilfeprogrammen empfohlen. SSRI (insbesondere Fluoxetin) werden anderen Antidepressiva vorgezogen, da sie gut verträglich sind und die Symptome in Kurzzeitstudien besser reduzieren. Die langfristige Wirksamkeit ist noch unzureichend beschrieben. Bupropion wird aufgrund eines erhöhten Anfallsrisikos nicht für die Behandlung von Essstörungen empfohlen. ⓘ
Ähnliche Empfehlungen gelten für Binge-Eating-Störungen. SSRI führen kurzfristig zu einer Verringerung des Essanfallverhaltens, wurden jedoch nicht mit einer signifikanten Gewichtsabnahme in Verbindung gebracht. ⓘ
Klinische Studien haben überwiegend negative Ergebnisse für den Einsatz von SSRI bei der Behandlung von Anorexia nervosa erbracht. Die Behandlungsrichtlinien des National Institute of Health and Care Excellence raten von der Verwendung von SSRI bei dieser Störung ab. In den Leitlinien der American Psychiatric Association wird darauf hingewiesen, dass SSRI keinen Vorteil in Bezug auf die Gewichtszunahme bieten, dass sie aber zur Behandlung von gleichzeitig bestehenden depressiven Störungen, Angstzuständen oder Zwangsstörungen eingesetzt werden können. ⓘ
Schmerzen
Fibromyalgie
Eine Metaanalyse aus dem Jahr 2012 kam zu dem Schluss, dass sich die Behandlung mit Antidepressiva positiv auf Schmerzen, gesundheitsbezogene Lebensqualität, Depressionen und Schlaf beim Fibromyalgiesyndrom auswirkt. Trizyklika scheinen die wirksamste Klasse zu sein, mit moderaten Auswirkungen auf Schmerzen und Schlaf und geringen Auswirkungen auf Müdigkeit und gesundheitsbezogene Lebensqualität. Der Anteil der Personen, die unter Trizyklika eine Schmerzreduktion von 30 % erfuhren, betrug 48 % gegenüber 28 % unter Placebo. Bei SSRIs und SNRIs lag der Anteil der Patienten, die eine 30 %ige Schmerzreduzierung erfuhren, bei 36 % (20 % in den Placebo-Vergleichsarmen) und 42 % (32 % in den entsprechenden Placebo-Vergleichsarmen). Ein Abbruch der Behandlung aufgrund von Nebenwirkungen war häufig. Antidepressiva wie Amitriptylin, Fluoxetin, Duloxetin, Milnacipran, Moclobemid und Pirlindol werden von der Europäischen Rheumaliga (EULAR) auf der Grundlage "begrenzter Nachweise" für die Behandlung der Fibromyalgie empfohlen. ⓘ
Neuropathische Schmerzen
Eine Meta-Analyse der Cochrane Collaboration aus dem Jahr 2014 ergab, dass das Antidepressivum Duloxetin bei der Behandlung von Schmerzen infolge einer diabetischen Neuropathie wirksam ist. Dieselbe Gruppe überprüfte Daten zu Amitriptylin bei der Behandlung neuropathischer Schmerzen und fand nur wenige nützliche Daten aus randomisierten klinischen Studien. Sie kam zu dem Schluss, dass die langjährige erfolgreiche Anwendung in der Gemeinschaft zur Behandlung von Fibromyalgie und neuropathischen Schmerzen die weitere Verwendung rechtfertigt. Die Gruppe war besorgt darüber, dass das Ausmaß der Schmerzlinderung durch Amitriptylin überschätzt werden könnte, und wies darauf hin, dass nur eine kleine Anzahl von Menschen durch die Einnahme dieses Medikaments eine signifikante Schmerzlinderung erfährt. ⓘ
Andere Anwendungen
Antidepressiva können bei der Behandlung von Menschen, die sowohl an Depressionen als auch an Alkoholabhängigkeit leiden, in bescheidenem Maße hilfreich sein, allerdings sind die Belege für diesen Zusammenhang von geringer Qualität. Buproprion wird zur Unterstützung der Raucherentwöhnung eingesetzt. Antidepressiva werden auch zur Kontrolle einiger Symptome der Narkolepsie eingesetzt. Antidepressiva können zur Schmerzlinderung bei Menschen mit aktiver rheumatoider Arthritis eingesetzt werden, weitere Untersuchungen sind jedoch erforderlich. Antidepressiva haben sich bei der Behandlung von Depressionen bei Menschen mit körperlichen Erkrankungen als besser erwiesen als ein Placebo, auch wenn dieses Ergebnis möglicherweise durch eine verzerrte Berichterstattung übertrieben wurde. ⓘ
Beschränkungen und Strategien
Zwischen 30 und 50 % der Personen, die mit einem bestimmten Antidepressivum behandelt werden, sprechen nicht an. Etwa ein Drittel der Betroffenen erreicht eine vollständige Remission, ein Drittel zeigt ein Ansprechen und ein Drittel ist ein Non-Responder. Eine partielle Remission ist durch das Vorhandensein von schlecht definierten Restsymptomen gekennzeichnet. Zu diesen Symptomen gehören typischerweise gedrückte Stimmung, Angstzustände, Schlafstörungen, Müdigkeit und vermindertes Interesse oder Vergnügen. Es ist derzeit unklar, welche Faktoren eine partielle Remission vorhersagen. Klar ist jedoch, dass Restsymptome ein starker Prädiktor für einen Rückfall sind, wobei die Rückfallquote bei Menschen mit Restsymptomen 3-6 Mal höher ist als bei denen, die eine vollständige Remission erleben. Hinzu kommt, dass Antidepressiva im Laufe der Behandlung an Wirksamkeit verlieren. Nach Angaben der Centers for Disease Control and Prevention hat weniger als ein Drittel der Amerikaner, die ein Antidepressivum einnehmen, im vergangenen Jahr einen Psychiater aufgesucht. In der klinischen Praxis wird eine Reihe von Strategien angewandt, um diese Einschränkungen und Abweichungen zu überwinden. Dazu gehören der Wechsel des Medikaments, die Verstärkung und die Kombination. ⓘ
Umstellung auf andere Antidepressiva
Die Praxisleitlinie der American Psychiatric Association aus dem Jahr 2000 empfiehlt für den Fall, dass nach einer sechs- bis achtwöchigen Behandlung mit einem Antidepressivum kein Ansprechen erzielt wird, den Wechsel zu einem Antidepressivum derselben Klasse und anschließend zu einer anderen Klasse von Antidepressiva. Eine Meta-Analyse aus dem Jahr 2006 ergab, dass die Ergebnisse früherer Studien sehr unterschiedlich ausfielen: Bei Personen, die nicht auf ein SSRI-Antidepressivum angesprochen hatten, sprachen zwischen 12 % und 86 % auf ein neues Medikament an. Je mehr Antidepressiva eine Person jedoch bereits ausprobiert hatte, desto geringer war die Wahrscheinlichkeit, dass sie auf ein neues Antidepressivum ansprach. Eine spätere Meta-Analyse ergab jedoch keinen Unterschied zwischen der Umstellung auf ein neues Medikament und der Beibehaltung des alten Medikaments. 34 % der behandlungsresistenten Personen sprachen auf das neue Medikament an, während 40 % auch ohne Umstellung ansprachen. ⓘ
Verstärkung und Kombination
Für ein teilweises Ansprechen empfehlen die Leitlinien der American Psychiatric Association eine Augmentation, d. h. die Hinzufügung eines Medikaments aus einer anderen Klasse. Dazu gehören Lithium und Schilddrüsenhormone, Dopaminagonisten, Sexualsteroide, NRIs, glukokortikoid-spezifische Wirkstoffe oder die neueren Antikonvulsiva. ⓘ
Bei einer Kombinationsstrategie wird ein weiteres Antidepressivum, in der Regel aus einer anderen Klasse, hinzugefügt, um auf andere Mechanismen einzuwirken. Obwohl dies in der klinischen Praxis angewandt werden kann, gibt es nur wenige Belege für die relative Wirksamkeit oder die unerwünschten Wirkungen dieser Strategie. Zu den weiteren durchgeführten Tests gehört die Verwendung von Psychostimulanzien als Ergänzungstherapie. Mehrere Studien haben die Wirksamkeit einer Kombination von Modafinil bei behandlungsresistenten Personen gezeigt. Es wurde zur Bekämpfung der SSRI-assoziierten Müdigkeit eingesetzt. ⓘ
Langfristige Einnahme und Absetzen
Die Wirkung von Antidepressiva hält in der Regel nicht an, wenn das Medikament abgesetzt wird. Dies führt zu einer hohen Rückfallquote. Eine Metaanalyse aus dem Jahr 2003 ergab, dass 18 % der Personen, die auf ein Antidepressivum angesprochen hatten, einen Rückfall erlitten, während sie es noch einnahmen, verglichen mit 41 %, deren Antidepressivum durch ein Placebo ersetzt wurde. ⓘ
Ein allmählicher Verlust des therapeutischen Nutzens tritt bei einer Minderheit der Betroffenen im Verlauf der Behandlung auf. In einigen Studien wurde eine Strategie vorgeschlagen, die eine Pharmakotherapie zur Behandlung der akuten Episode und eine anschließende Psychotherapie in der verbleibenden Phase vorsieht. Bei Patienten, die ihre Antidepressiva absetzen wollen, hat sich gezeigt, dass die Teilnahme an kurzen psychologischen Interventionen wie präventiver kognitiver Therapie oder achtsamkeitsbasierter kognitiver Therapie während des Absetzens das Risiko eines Rückfalls verringert. ⓘ
Unerwünschte Wirkungen
Antidepressiva können je nach Person und Präparat verschiedene unerwünschte Wirkungen hervorrufen. ⓘ
Fast alle Medikamente, die mit der Serotoninregulierung zu tun haben, können eine Serotonintoxizität (auch Serotoninsyndrom genannt) hervorrufen - ein Überschuss an Serotonin, der als Hauptsymptome Manie, Unruhe, Erregung, emotionale Labilität, Schlaflosigkeit und Verwirrung hervorrufen kann. Obwohl es sich um einen ernsten Zustand handelt, ist er nicht besonders häufig und tritt im Allgemeinen nur bei hohen Dosen oder bei gleichzeitiger Einnahme anderer Medikamente auf. Unter der Voraussetzung, dass ordnungsgemäße medizinische Maßnahmen ergriffen werden (innerhalb von etwa 24 Stunden), ist sie selten tödlich. Antidepressiva scheinen das Diabetesrisiko um das 1,3-fache zu erhöhen. ⓘ
MAOIs neigen zu ausgeprägten (manchmal tödlichen) Wechselwirkungen mit einer Vielzahl von Medikamenten und frei verkäuflichen Arzneimitteln. Wenn sie zusammen mit Lebensmitteln eingenommen werden, die einen sehr hohen Tyramingehalt aufweisen (z. B. reifer Käse, Wurstwaren oder Hefeextrakte), können sie eine potenziell tödliche hypertensive Krise verursachen. Bei niedrigeren Dosen kann es aufgrund des Blutdruckanstiegs lediglich zu Kopfschmerzen kommen. ⓘ
Als Reaktion auf diese unerwünschten Wirkungen wurde eine andere Art von MAOI entwickelt: die Klasse der reversiblen Inhibitoren der Monoaminoxidase A (RIMA). Ihr Hauptvorteil besteht darin, dass sie keine spezielle Diät erfordern, während sie bei der Behandlung depressiver Störungen angeblich genauso wirksam sind wie SSRI und Trizyklika. ⓘ
Trizyklika und SSRI können die so genannte medikamenteninduzierte QT-Verlängerung verursachen, insbesondere bei älteren Erwachsenen; dieser Zustand kann in eine bestimmte Art von Herzrhythmusstörungen, die so genannten Torsades de points, ausarten, die möglicherweise zu einem plötzlichen Herzstillstand führen können. ⓘ
Einige Antidepressiva stehen auch im Verdacht, Selbstmordgedanken zu verstärken. ⓘ
Schwangerschaft
Die Einnahme von SSRI in der Schwangerschaft wird mit einer Reihe von Risiken in Verbindung gebracht, wobei der Nachweis der Kausalität unterschiedlich gut ist. Da Depressionen unabhängig voneinander mit negativen Schwangerschaftsergebnissen in Verbindung gebracht werden, war es in einigen Fällen schwierig, festzustellen, inwieweit die beobachteten Zusammenhänge zwischen der Einnahme von Antidepressiva und bestimmten unerwünschten Ergebnissen eine ursächliche Beziehung widerspiegeln. In anderen Fällen scheint die Zuordnung der negativen Folgen zur Antidepressiva-Exposition ziemlich eindeutig zu sein. ⓘ
Die Einnahme von SSRI in der Schwangerschaft ist mit einem etwa 1,7-fach erhöhten Risiko für einen Spontanabort verbunden und steht in Zusammenhang mit Frühgeburten und niedrigem Geburtsgewicht. ⓘ
Eine systematische Überprüfung des Risikos schwerer Geburtsfehler bei antidepressiv-exponierten Schwangerschaften ergab einen geringen Anstieg (3 % bis 24 %) des Risikos schwerer Missbildungen und ein Risiko für kardiovaskuläre Geburtsfehler, das sich nicht von dem nicht-exponierter Schwangerschaften unterschied. In einer Studie über fluoxetinexponierte Schwangerschaften wurde ein um 12 % erhöhtes Risiko für schwere Fehlbildungen festgestellt, das jedoch keine statistische Signifikanz erreichte. In anderen Studien wurde ein erhöhtes Risiko für kardiovaskuläre Missbildungen bei depressiven Müttern festgestellt, die sich nicht einer SSRI-Behandlung unterzogen, was auf die Möglichkeit einer Verzerrung der Datenerhebung hindeutet, z. B. dass besorgte Mütter ihre Kinder aggressiver untersuchen lassen. In einer anderen Studie wurde kein Anstieg von kardiovaskulären Geburtsfehlern und ein um 27 % erhöhtes Risiko für schwerwiegende Fehlbildungen bei Schwangerschaften unter SSRI-Behandlung festgestellt. Die FDA rät, das Risiko von Geburtsfehlern bei der Verwendung von Paroxetin und MAOI zu vermeiden. ⓘ
Eine systematische Überprüfung und Meta-Analyse aus dem Jahr 2013 ergab, dass die Einnahme von Antidepressiva während der Schwangerschaft statistisch signifikant mit einigen Schwangerschaftsergebnissen wie dem Gestationsalter und der Frühgeburt verbunden war, nicht jedoch mit anderen Ergebnissen. In der gleichen Übersichtsarbeit wurde darauf hingewiesen, dass die Unterschiede zwischen den exponierten und den nicht exponierten Gruppen gering waren und es daher zweifelhaft ist, ob sie klinisch signifikant sind. ⓘ
Bei Neugeborenen (Säuglinge, die weniger als 28 Tage alt sind) kann es zu einem Entzugssyndrom kommen, wenn das Antidepressivum bei der Geburt abrupt abgesetzt wird. Es wurde nachgewiesen, dass Antidepressiva in unterschiedlichen Mengen in der Muttermilch vorhanden sind, aber ihre Auswirkungen auf Säuglinge sind derzeit nicht bekannt. ⓘ
Außerdem hemmen SSRI die Synthese von Stickstoffmonoxid, das eine wichtige Rolle bei der Regulierung des Gefäßtonus spielt. Mehrere Studien haben auf ein erhöhtes Frühgeburtenrisiko im Zusammenhang mit der Einnahme von SSRI hingewiesen, und dieser Zusammenhang könnte auf ein erhöhtes Risiko einer Präeklampsie in der Schwangerschaft zurückzuführen sein. ⓘ
Antidepressiva-induzierte Manie
Ein weiteres mögliches Problem bei der Einnahme von Antidepressiva ist die Möglichkeit einer durch Antidepressiva ausgelösten Manie oder Hypomanie bei Menschen mit oder ohne Diagnose einer bipolaren Störung. Viele Fälle von bipolarer Depression sind denen von unipolarer Depression sehr ähnlich. Daher kann eine Person fälschlicherweise mit einer unipolaren Depression diagnostiziert und mit Antidepressiva behandelt werden. Studien haben gezeigt, dass eine durch Antidepressiva ausgelöste Manie bei 20-40 % der Menschen mit bipolarer Störung auftreten kann. Bei bipolarer Depression können Antidepressiva (am häufigsten SSRI) die Symptome von Hypomanie und Manie verschlimmern oder auslösen. ⓘ
Selbstmord
Studien haben gezeigt, dass die Einnahme von Antidepressiva mit einem erhöhten Risiko für suizidales Verhalten und Suizidgedanken (Suizidalität) bei Personen unter 25 Jahren verbunden ist. Dieses Problem ist so gravierend, dass die US-amerikanische Gesundheitsbehörde FDA (Food and Drug Administration) eingriff und vor dem erhöhten Suizidrisiko während der Behandlung mit Antidepressiva warnte. Nach Angaben der FDA tritt das erhöhte Suizidrisiko innerhalb der ersten ein bis zwei Monate der Behandlung auf. Das National Institute for Health and Care Excellence (NICE) verortet das erhöhte Risiko in den "frühen Phasen der Behandlung". Eine Meta-Analyse deutet darauf hin, dass der Zusammenhang zwischen der Einnahme von Antidepressiva und suizidalem Verhalten oder Suizidgedanken altersabhängig ist. Im Vergleich zu Placebo wird die Einnahme von Antidepressiva mit einer Zunahme von suizidalem Verhalten oder Suizidgedanken bei Personen unter 25 Jahren in Verbindung gebracht (OR=1,62). Eine Überprüfung von RCTs und epidemiologischen Studien durch Healy und Whitaker ergab einen Anstieg der Suizidalität um den Faktor 2,4. Bei den 25- bis 64-Jährigen gibt es keinen oder möglicherweise einen leichten Schutzeffekt (OR=0,79). Die Behandlung mit Antidepressiva hat eine schützende Wirkung gegen Suizidalität bei den über 65-Jährigen (OR=0,37). ⓘ
Sexuelle Dysfunktion
Auch sexuelle Nebenwirkungen sind bei SSRIs häufig, wie z. B. Verlust des Sexualtriebs, Ausbleiben des Orgasmus und erektile Dysfunktion. Obwohl diese sexuellen Nebenwirkungen in der Regel reversibel sind, können sie in seltenen Fällen auch nach dem vollständigen Absetzen des Medikaments auftreten. ⓘ
In einer Studie mit 1022 ambulanten Patienten lag die sexuelle Funktionsstörung bei allen Antidepressiva im Durchschnitt bei 59,1 %, wobei die Werte bei SSRI zwischen 57 % und 73 %, bei Mirtazapin bei 24 %, bei Nefazodon bei 8 %, bei Amineptin bei 7 % und bei Moclobemid bei 4 % lagen. Moclobemid, ein selektiver reversibler MAO-A-Hemmer, verursacht keine sexuelle Dysfunktion und kann sogar zu einer Verbesserung aller Aspekte der sexuellen Funktion führen. ⓘ
Zu den biochemischen Mechanismen, die als Ursache vermutet werden, gehören ein erhöhter Serotoninspiegel, der insbesondere die 5-HT2- und 5-HT3-Rezeptoren betrifft, ein verminderter Dopaminspiegel, ein verminderter Noradrenalinspiegel, eine Blockade der cholinergen und α1-adrenergen Rezeptoren, eine Hemmung der Stickstoffmonoxid-Synthetase und ein erhöhter Prolaktinspiegel. Mirtazapin hat Berichten zufolge weniger sexuelle Nebenwirkungen, höchstwahrscheinlich, weil es 5-HT2- und 5-HT3-Rezeptoren antagonisiert und in einigen Fällen sexuelle Funktionsstörungen, die durch SSRIs hervorgerufen werden, durch denselben Mechanismus umkehren kann. ⓘ
Bupropion, ein schwacher NDRI- und Nikotinantagonist, kann bei der Behandlung einer verminderten Libido als Folge einer SSRI-Behandlung nützlich sein. ⓘ
Emotionale Abstumpfung
Bestimmte Antidepressiva können zu einer emotionalen Abstumpfung führen, die durch eine verringerte Intensität sowohl positiver als auch negativer Emotionen sowie durch Symptome von Apathie, Gleichgültigkeit und Amotivation gekennzeichnet ist. Dies kann je nach Situation als vorteilhaft oder nachteilig empfunden werden. Diese Nebenwirkung wird vor allem mit serotonergen Antidepressiva wie SSRI und SNRI in Verbindung gebracht, kann aber bei atypischen Antidepressiva wie Bupropion, Agomelatin und Vortioxetin geringer ausfallen. Höhere Dosen von Antidepressiva scheinen eher zu emotionalem Abstumpfen zu führen als niedrigere Dosen. Sie kann durch eine Verringerung der Dosis, das Absetzen des Medikaments oder den Wechsel zu einem anderen Antidepressivum, das weniger zu dieser Nebenwirkung neigt, verringert werden. ⓘ
Veränderungen des Gewichts
Appetit- oder Gewichtsveränderungen sind bei Antidepressiva üblich, hängen aber weitgehend vom Medikament ab und hängen damit zusammen, auf welche Neurotransmitter sie wirken. Mirtazapin und Paroxetin können beispielsweise mit Gewichtszunahme und/oder gesteigertem Appetit einhergehen, während andere (wie Bupropion und Venlafaxin) den gegenteiligen Effekt erzielen. ⓘ
Die antihistaminischen Eigenschaften bestimmter Antidepressiva der TCA- und TeCA-Klassen tragen nachweislich zu den häufigen Nebenwirkungen wie Appetitsteigerung und Gewichtszunahme bei, die mit diesen Medikamentenklassen in Verbindung gebracht werden. ⓘ
Risiko des Todes
Eine Meta-Analyse aus dem Jahr 2017 ergab, dass Antidepressiva in der Allgemeinbevölkerung mit einem signifikant erhöhten Risiko für Todesfälle (+33 %) und neue kardiovaskuläre Komplikationen (+14 %) verbunden waren. Bei Menschen mit bestehenden Herz-Kreislauf-Erkrankungen war das Risiko dagegen nicht erhöht. ⓘ
Absetzsyndrom
Das Absetzsyndrom von Antidepressiva, auch Antidepressiva-Entzugssyndrom genannt, ist ein Zustand, der nach der Unterbrechung, Reduzierung oder dem Absetzen von Antidepressiva auftreten kann. Die Symptome können grippeähnliche Beschwerden, Schlafstörungen, Übelkeit, Gleichgewichtsstörungen, sensorische Veränderungen und Angstzustände umfassen. Das Problem beginnt in der Regel innerhalb von drei Tagen und kann sich über mehrere Monate hinziehen. In seltenen Fällen kann eine Psychose auftreten. ⓘ
Ein Absetzsyndrom kann nach dem Absetzen jedes Antidepressivums auftreten, einschließlich selektiver Serotonin-Wiederaufnahmehemmer (SSRI), Serotonin-Norepinephrin-Wiederaufnahmehemmer (SNRI) und trizyklischer Antidepressiva (TCA). Das Risiko ist größer bei Personen, die das Medikament schon länger einnehmen, und wenn das betreffende Medikament eine kurze Halbwertszeit hat. Der Grund für das Auftreten ist unklar. Die Diagnose wird anhand der Symptome gestellt. ⓘ
Zu den Präventionsmethoden gehört die schrittweise Verringerung der Dosis bei denjenigen, die die Einnahme beenden wollen, obwohl es möglich ist, dass bei der Reduzierung der Dosis Symptome auftreten. Die Behandlung kann darin bestehen, das Medikament wieder aufzunehmen und die Dosis langsam zu verringern. Die Betroffenen können auch auf das langwirksame Antidepressivum Fluoxetin umgestellt werden, dessen Dosis dann schrittweise verringert werden kann. ⓘ
Etwa 20-50 % der Menschen, die ein Antidepressivum plötzlich absetzen, entwickeln ein Antidepressivum-Absetzsyndrom. Dieser Zustand ist im Allgemeinen nicht schwerwiegend. Allerdings beschreibt etwa die Hälfte der Betroffenen die Symptome als schwerwiegend. Einige setzen das Antidepressivum aufgrund der Schwere der Symptome wieder ab. ⓘ
Pharmakologie
Die älteste und wahrscheinlich am weitesten akzeptierte wissenschaftliche Theorie zur Wirkung von Antidepressiva ist die Monoamin-Hypothese (die bis in die 1950er Jahre zurückverfolgt werden kann), die besagt, dass Depressionen auf ein Ungleichgewicht (meist einen Mangel) der Monoamin-Neurotransmitter (nämlich Serotonin, Noradrenalin und Dopamin) zurückzuführen sind. Ursprünglich stützte man sich auf die Beobachtung, dass bestimmte Hydrazin-Mittel gegen Tuberkulose antidepressiv wirken, was später mit ihrer hemmenden Wirkung auf die Monoaminoxidase in Verbindung gebracht wurde, das Enzym, das den Abbau der Monoamin-Neurotransmitter katalysiert. Alle derzeit auf dem Markt befindlichen Antidepressiva beruhen auf der Monoamin-Hypothese, möglicherweise mit Ausnahme von Agomelatin, das auf einem dualen melatonergisch-serotonergen Weg wirkt. Trotz des Erfolgs der Monoamin-Hypothese weist sie eine Reihe von Einschränkungen auf: Zum einen setzen alle monoaminergen Antidepressiva mit einer Verzögerung von mindestens einer Woche ein, und zum anderen gibt es einen beträchtlichen Anteil (>40 %) depressiver Patienten, die nicht angemessen auf monoaminerge Antidepressiva ansprechen. Es wurde eine Reihe alternativer Hypothesen vorgeschlagen, darunter die Glutamat-, die neurogene, die epigenetische, die Cortisol-Hypersekretions- und die Entzündungshypothese. ⓘ
Arten
Selektive Serotonin-Wiederaufnahme-Hemmer
Man geht davon aus, dass selektive Serotonin-Wiederaufnahmehemmer (SSRI) den extrazellulären Spiegel des Neurotransmitters Serotonin erhöhen, indem sie dessen Rückresorption in die präsynaptische Zelle einschränken und so den Serotoninspiegel im synaptischen Spalt erhöhen, der zur Bindung an den postsynaptischen Rezeptor zur Verfügung steht. Sie sind unterschiedlich selektiv für die anderen Monoamintransporter, wobei reine SSRI nur eine geringe Affinität zu den Noradrenalin- und Dopamintransportern haben. ⓘ
SSRIs sind in vielen Ländern die am häufigsten verschriebenen Antidepressiva. Die Wirksamkeit von SSRIs bei leichten oder mittelschweren Depressionen ist umstritten. ⓘ
Serotonin-Norepinephrin-Wiederaufnahmehemmer
Serotonin-Norepinephrin-Wiederaufnahmehemmer (SNRI) sind starke Hemmstoffe der Wiederaufnahme von Serotonin und Noradrenalin. Es ist bekannt, dass diese Neurotransmitter eine wichtige Rolle für die Stimmung spielen. SNRIs stehen im Gegensatz zu den weit verbreiteten selektiven Serotonin-Wiederaufnahmehemmern (SSRIs), die hauptsächlich auf Serotonin allein wirken. ⓘ
Der menschliche Serotonintransporter (SERT) und der Noradrenalin-Transporter (NET) sind Membranproteine, die für die Wiederaufnahme von Serotonin und Noradrenalin verantwortlich sind. Eine ausgewogene duale Hemmung der Monoamin-Wiederaufnahme kann möglicherweise Vorteile gegenüber anderen Antidepressiva bieten, indem sie ein breiteres Spektrum von Symptomen behandelt. ⓘ
SNRI werden manchmal auch zur Behandlung von Angststörungen, Zwangsstörungen, Aufmerksamkeitsdefizit-/Hyperaktivitätsstörungen (ADHS), chronischen neuropathischen Schmerzen und dem Fibromyalgiesyndrom (FMS) sowie zur Linderung von Wechseljahrsbeschwerden eingesetzt. ⓘ
Modulatoren und Stimulatoren von Serotonin
Serotoninmodulatoren und -stimulatoren (SMS), manchmal auch einfach als "Serotoninmodulatoren" bezeichnet, sind eine Art von Arzneimitteln mit einer multimodalen Wirkung, die spezifisch für das Serotonin-Neurotransmittersystem ist. Genauer gesagt, modulieren SMS gleichzeitig einen oder mehrere Serotoninrezeptoren und hemmen die Wiederaufnahme von Serotonin. Der Begriff wurde in Bezug auf den Wirkmechanismus des serotonergen Antidepressivums Vortioxetin geprägt, das als Serotonin-Wiederaufnahmehemmer (SRI), partieller Agonist des 5-HT1A-Rezeptors und Antagonist der 5-HT3- und 5-HT7-Rezeptoren wirkt. Technisch gesehen kann er jedoch auch auf Vilazodon angewandt werden, das ebenfalls ein Antidepressivum ist und als SRI und partieller 5-HT1A-Rezeptor-Agonist wirkt. ⓘ
Ein alternativer Begriff ist partieller Serotonin-Agonist/Wiederaufnahmehemmer (SPARI), der nur auf Vilazodon angewendet werden kann. ⓘ
Serotoninantagonisten und Wiederaufnahmehemmer
Serotoninantagonisten und Wiederaufnahmehemmer (SARI) werden zwar hauptsächlich als Antidepressiva eingesetzt, sind aber auch Anxiolytika und Hypnotika. Sie wirken durch Antagonisierung von Serotoninrezeptoren wie 5-HT2A und Hemmung der Wiederaufnahme von Serotonin, Noradrenalin und/oder Dopamin. Darüber hinaus wirken die meisten auch als α1-adrenerge Rezeptorantagonisten. Die meisten der derzeit auf dem Markt befindlichen SARI gehören zur Klasse der Phenylpiperazinverbindungen. Dazu gehören Trazodon und Nefazodon. ⓘ
Noradrenalin-Wiederaufnahme-Hemmer
Noradrenalin-Wiederaufnahmehemmer (NRIs oder NERIs) sind eine Art von Medikamenten, die als Wiederaufnahmehemmer für den Neurotransmitter Noradrenalin wirken, indem sie die Wirkung des Noradrenalin-Transporters (NET) blockieren. Dies wiederum führt zu erhöhten extrazellulären Konzentrationen von Noradrenalin. ⓘ
NRI werden aufgrund ihrer psychostimulierenden Wirkung häufig zur Behandlung von Krankheiten wie ADHS und Narkolepsie und aufgrund ihrer appetitzügelnden Wirkung bei Fettleibigkeit eingesetzt. Sie werden auch häufig als Antidepressiva zur Behandlung von schweren depressiven Störungen, Angst- und Panikstörungen eingesetzt. Darüber hinaus besitzen viele Missbrauchsdrogen wie Kokain und Methylphenidat eine NRI-Aktivität, wobei zu erwähnen ist, dass NRI ohne kombinierte Dopamin-Wiederaufnahmehemmer-Eigenschaften (DRI) keine nennenswerten Belohnungseffekte haben und daher als vernachlässigbares Missbrauchspotenzial angesehen werden. Allerdings wurde festgestellt, dass Noradrenalin synergistisch mit Dopamin wirkt, wenn die Wirkungen auf die beiden Neurotransmitter kombiniert werden (z. B. im Fall von NDRIs), um belohnende Effekte in psychostimulierenden Drogen zu erzeugen. ⓘ
Selektive Noradrenalin-/Dopamin-Wiederaufnahmehemmer (SNDRI)
Die NDRI hemmen die Wiederaufnahme von Noradrenalin und Dopamin. Einsatzgebiete sind Depressionen, vor allem bei Antriebsschwäche, und Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS). ⓘ
Die bisher einzigen Wirkstoffe in dieser Klasse sind Bupropion, Amineptin und Methylphenidat, wobei letzterer Wirkstoff für die antidepressive Therapie keine Zulassung hat. ⓘ
Trizyklische Antidepressiva
Die meisten trizyklischen Antidepressiva (TCA) wirken in erster Linie als Serotonin-Norepinephrin-Wiederaufnahmehemmer (SNRI), indem sie den Serotonin-Transporter (SERT) bzw. den Noradrenalin-Transporter (NET) blockieren, was zu einer Erhöhung der synaptischen Konzentrationen dieser Neurotransmitter und damit zu einer Verbesserung der Neurotransmission führt. Mit der einzigen Ausnahme von Amineptin haben die TCAs eine schwache Affinität zum Dopamin-Transporter (DAT) und sind daher als Dopamin-Wiederaufnahmehemmer (DRIs) nur wenig wirksam. ⓘ
Obwohl TCAs manchmal bei depressiven Störungen verschrieben werden, sind sie in den meisten Teilen der Welt in der klinischen Anwendung weitgehend durch neuere Antidepressiva wie selektive Serotonin-Wiederaufnahmehemmer (SSRIs), Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRIs) und Noradrenalin-Wiederaufnahmehemmer (NRIs) ersetzt worden. Es hat sich gezeigt, dass die Nebenwirkungen von TCAs und SSRIs ähnlich stark sind. ⓘ
Tetrazyklische Antidepressiva
Tetrazyklische Antidepressiva (TeCA) sind eine Klasse von Antidepressiva, die erstmals in den 1970er Jahren eingeführt wurden. Sie sind nach ihrer chemischen Struktur benannt, die vier Atomringe enthält, und sind eng mit den trizyklischen Antidepressiva (TCA) verwandt, die drei Atomringe enthalten. ⓘ
Monoaminoxidase-Hemmer
MAO-Hemmer wirken durch eine Blockade der Monoaminoxidase Enzyme. Diese Enzyme bauen normalerweise Monoamine wie Serotonin, Noradrenalin und Dopamin ab und verringern dadurch deren Verfügbarkeit zur Signalübertragung im Gehirn. ⓘ
MAO-Hemmer werden in selektiv oder nichtselektiv sowie reversibel oder irreversibel unterteilt. Selektive Inhibitoren der MAO-A (z. B. Moclobemid, reversibel) hemmen nur den Typ A der Monoaminoxidase. Sie zeigen eine antidepressive Wirkung und sind meist gut verträglich. Selektiv MAO-B-hemmende Wirkstoffe (z. B. Selegilin, Rasagilin, beide irreversibel) werden in erster Linie in der Parkinson-Behandlung eingesetzt. Nichtselektive MAO-Hemmer (z. B. Tranylcypromin, irreversibel) hemmen MAO-A und MAO-B und sind wirksam bei Depressionen und Angststörungen. Irreversible MAO-Hemmer binden die MAO-A bzw. MAO-B dauerhaft. Um diese Wirkung aufzuheben, muss das betroffene Enzym vom Körper erst neu gebildet werden, was Wochen dauern kann. Reversibilität bedeutet, dass das Medikament nur schwach an die MAO bindet, und MAO-A bzw. MAO-B spätestens mit dem Abbau des Medikaments wieder intakt frei gibt. ⓘ
Patienten, die nichtselektive, irreversible MAO-Hemmer einnehmen, müssen eine strenge, tyraminarme Diät halten. Denn in Verbindung mit dem Verzehr bestimmter Lebensmittel (z. B. Käse und Nüssen) kann die Einnahme von nichtselektiven irreversiblen MAO-Hemmern zu einem gefährlichen Blutdruckanstieg führen. Außerdem muss zwischen der Einnahme eines irreversiblen MAO-A-Hemmers und einem anderen Antidepressivum eine Wartezeit eingehalten werden, um schwerwiegende Interaktionen zu vermeiden (zum Beispiel das Serotonin-Syndrom). Deswegen werden heute nach Möglichkeit reversible MAO-A-Hemmer (Reversible Inhibitor of Monoaminooxidase A, RIMA) als Antidepressiva angewendet, etwa Moclobemid. Dieses gilt als gut wirksam und frei von diesen Nebenwirkungen. Nicht-selektive MAO-Hemmer haben zudem eine stärkere noradrenerge Wirkung als selektive MAO-A Hemmer, was erklären könnte, dass sie verglichen mit RIMA und SSRI als wirksamer gelten. Moclobemid und Tranylcypromin werden in etwa gleich oft verschrieben. ⓘ
Monoaminoxidase-Hemmer (MAOI) sind Chemikalien, die die Aktivität der Enzymfamilie der Monoaminoxidase hemmen. Sie werden seit langem als Medikamente zur Behandlung von Depressionen verschrieben. Sie sind besonders wirksam bei der Behandlung atypischer Depressionen. Sie werden auch bei der Behandlung der Parkinson-Krankheit und verschiedener anderer Störungen eingesetzt. ⓘ
Aufgrund potenziell tödlicher Wechselwirkungen mit Nahrungsmitteln und Arzneimitteln wurden MAOIs in der Vergangenheit nur als letztes Mittel zur Behandlung eingesetzt, wenn andere Klassen von Antidepressiva (z. B. selektive Serotonin-Wiederaufnahmehemmer und trizyklische Antidepressiva) versagt haben. ⓘ
MAOIs haben sich als wirksam erwiesen bei der Behandlung von Panikstörungen mit Agoraphobie, sozialer Phobie, atypischer Depression oder gemischter Angst und Depression, Bulimie und posttraumatischer Belastungsstörung sowie Borderline-Persönlichkeitsstörung. Einer retrospektiven Analyse zufolge scheinen MAOI bei der Behandlung von bipolaren Depressionen besonders wirksam zu sein. Es gibt Berichte über die Wirksamkeit von MAOI bei Zwangsstörungen (OCD), Trichotillomanie, Dysmorphophobie und vermeidenden Persönlichkeitsstörungen, doch handelt es sich dabei um unkontrollierte Fallberichte. ⓘ
NMDA-Rezeptor-Antagonisten
NMDA-Rezeptor-Antagonisten wie Ketamin und Esketamin sind schnell wirkende Antidepressiva und scheinen über die Blockade des ionotropen Glutamat-NMDA-Rezeptors zu wirken. ⓘ
Andere
Siehe die Liste der Antidepressiva und der Behandlung von Depressionen für andere Medikamente, die nicht speziell beschrieben sind. ⓘ
Ergänzende Medikamente
Zusatzmedikamente sind eine Oberkategorie von Substanzen, die die Wirksamkeit von Antidepressiva erhöhen oder diese "verstärken". Sie wirken durch die Beeinflussung von Variablen, die dem Antidepressivum sehr ähnlich sind, und beeinflussen manchmal einen völlig anderen Wirkmechanismus. Dies kann versucht werden, wenn die Behandlung von Depressionen in der Vergangenheit keinen Erfolg gezeigt hat. ⓘ
Gängige Arten von Zusatzmedikamenten lassen sich im Allgemeinen in die folgenden Kategorien einteilen:
- Zwei oder mehr Antidepressiva zusammen eingenommen
- Aus der gleichen Wirkstoffklasse (wirken auf den gleichen Bereich des Gehirns, oft auf einem viel höheren Niveau)
- Aus verschiedenen Klassen (mit Wirkung auf mehrere Teile des Gehirns, die nicht gleichzeitig von einem der beiden Medikamente allein abgedeckt werden)
- Ein Antipsychotikum in Kombination mit einem Antidepressivum, insbesondere atypische Antipsychotika wie Aripiprazol (Abilify), Quetiapin (Seroquel), Olanzapin (Zyprexa) und Risperidon (Risperdal).
Es ist nicht bekannt, ob eine psychologische Therapie, die gleichzeitig mit der Einnahme von Antidepressiva durchgeführt wird, die antidepressive Wirkung der Medikamente verstärkt. ⓘ
Weniger verbreitete Hilfsmittel
Lithium wurde zur Ergänzung der antidepressiven Therapie bei Patienten eingesetzt, die auf Antidepressiva allein nicht ansprachen. Darüber hinaus senkt Lithium das Selbstmordrisiko bei wiederkehrenden Depressionen drastisch. Es gibt einige Hinweise darauf, dass bei Patienten mit normaler Schilddrüsenfunktion zusätzlich das Schilddrüsenhormon Trijodthyronin verabreicht werden sollte. ⓘ
Psychopharmakologen haben auch versucht, ein Stimulans, insbesondere D-Amphetamin, zu verabreichen. Der Einsatz von Stimulanzien bei behandlungsresistenten Depressionen ist jedoch relativ umstritten. Ein 2007 veröffentlichter Übersichtsartikel kam zu dem Schluss, dass Psychostimulanzien bei behandlungsresistenten Depressionen mit gleichzeitiger antidepressiver Therapie wirksam sein können, doch konnte keine sicherere Schlussfolgerung gezogen werden, da die für die Betrachtung zur Verfügung stehenden Studien erhebliche Mängel aufwiesen und die Ergebnisse teilweise widersprüchlich waren. ⓘ
Geschichte

Vor den 1950er Jahren wurden Opioide und Amphetamine häufig als Antidepressiva eingesetzt. Später wurde ihre Verwendung aufgrund ihres Suchtpotenzials und ihrer Nebenwirkungen eingeschränkt. Extrakte aus dem Johanniskraut wurden als "Nerventonikum" zur Linderung von Depressionen verwendet. ⓘ
Im 19. und 20. Jahrhundert geriet Johanniskraut in den meisten Ländern in Vergessenheit, außer in Deutschland, wo Hypericum-Extrakte schließlich zugelassen, verpackt und verschrieben wurden. In den 1970er- und 1980er-Jahren wurden kleinere Wirksamkeitsstudien durchgeführt, und in den 1990er-Jahren erlangte es aufgrund einer Metaanalyse zunehmende Aufmerksamkeit. In den meisten Ländern ist die Pflanze nach wie vor ein rezeptfreies Arzneimittel (OTC). Besorgniserregend sind die Bleiverunreinigungen; im Durchschnitt sind die Bleiwerte bei Frauen in den Vereinigten Staaten, die Johanniskraut einnehmen, um etwa 20 % erhöht. Die Forschung wird fortgesetzt, um seinen aktiven Bestandteil Hyperforin zu untersuchen und seine Wirkungsweise besser zu verstehen. ⓘ
Isoniazid, Iproniazid und Imipramin
1951 begannen Irving Selikoff und Edward H. Robitzek im Sea View Hospital auf Staten Island mit klinischen Versuchen zu zwei neuen, von Hoffman-LaRoche entwickelten Tuberkulosehemmern, Isoniazid und Iproniazid. Zunächst wurden nur Patienten mit einer schlechten Prognose behandelt, deren Zustand sich jedoch dramatisch verbesserte. Selikoff und Robitzek stellten "eine subtile allgemeine Stimulierung fest ... die Patienten zeigten eine neue Vitalität, und tatsächlich führte dies gelegentlich zu disziplinarischen Problemen". Die Aussicht auf eine Heilung der Tuberkulose in den Versuchen des Sea View Hospital wurde in der allgemeinen Presse mit Begeisterung diskutiert. ⓘ
Als der Psychiater Max Lurie aus Cincinnati 1952 von den stimulierenden Nebenwirkungen von Isoniazid erfuhr, probierte er es an seinen Patienten aus. Im darauffolgenden Jahr berichteten er und Harry Salzer, dass Isoniazid bei zwei Dritteln ihrer Patienten die Depressionen linderte, und prägten den Begriff Antidepressivum, um seine Wirkung zu bezeichnen. Ein ähnlicher Vorfall ereignete sich in Paris, wo Jean Delay, Leiter der Psychiatrie am Sainte-Anne-Krankenhaus, von seinen Kollegen der Lungenheilkunde am Cochin-Krankenhaus von dieser Wirkung erfuhr. Im Jahr 1952 (vor Lurie und Salzer) berichtete Delay zusammen mit dem Assistenzarzt Jean-Francois Buisson über die positive Wirkung von Isoniazid bei depressiven Patienten. Die Art der antidepressiven Wirkung von Isoniazid ist immer noch unklar. Es wird vermutet, dass seine Wirkung auf die Hemmung der Diaminoxidase in Verbindung mit einer schwachen Hemmung der Monoaminoxidase A zurückzuführen ist. ⓘ
Selikoff und Robitzek experimentierten auch mit einem anderen Antituberkulosemittel, Iproniazid, das eine stärkere psychostimulierende Wirkung, aber eine ausgeprägtere Toxizität zeigte. Später beschrieben Jackson Smith, Gordon Kamman, George E. Crane und Frank Ayd die psychiatrischen Anwendungen von Iproniazid. Ernst Zeller stellte fest, dass Iproniazid ein starker Monoaminoxidase-Hemmer ist. Dennoch blieb Iproniazid relativ unbekannt, bis Nathan S. Kline, der einflussreiche Forschungsleiter des Rockland State Hospital, begann, es in der medizinischen und populären Presse als "psychischen Energizer" bekannt zu machen. Roche unternahm erhebliche Marketinganstrengungen für Iproniazid. Die Verkaufszahlen stiegen, bis es 1961 aufgrund von Berichten über tödliche Hepatotoxizität zurückgerufen wurde. ⓘ
Die antidepressive Wirkung eines Trizyklikums, einer dreiringigen Verbindung, wurde erstmals 1957 von Roland Kuhn in einer Schweizer psychiatrischen Klinik entdeckt. Antihistamin-Derivate wurden zur Behandlung des chirurgischen Schocks und später als Neuroleptika eingesetzt. Obwohl 1955 nachgewiesen wurde, dass Reserpin bei der Linderung von Angstdepressionen wirksamer war als Placebo, wurden Neuroleptika als Sedativa und Antipsychotika entwickelt. ⓘ
Bei dem Versuch, die Wirksamkeit von Chlorpromazin zu verbessern, entdeckte Kuhn in Zusammenarbeit mit der Geigy Pharmaceutical Company die Verbindung "G 22355", die später in Imipramin umbenannt wurde. Imipramin wirkte positiv bei Patienten mit Depressionen, die geistige und motorische Behinderungen aufwiesen. Kuhn bezeichnete seine neue Substanz als "Thymoleptikum", das "auf die Gefühle wirkt", im Gegensatz zu den Neuroleptika, die "auf die Nerven wirken" (1955-56). Diese setzten sich allmählich durch und führten 1951 zur Patentierung und Herstellung in den USA durch Häfliger und SchinderA. ⓘ
Antidepressiva wurden in den 1950er Jahren zu verschreibungspflichtigen Medikamenten. Man schätzte, dass nicht mehr als 50 bis 100 Personen pro Million Menschen an der Art von Depression litten, die mit diesen neuen Medikamenten behandelt werden konnte, und die Pharmaunternehmen waren nicht gerade begeistert, für diesen kleinen Markt zu werben. Die Umsätze in den 1960er Jahren blieben gering im Vergleich zu den Umsätzen mit Beruhigungsmitteln, die für andere Zwecke vermarktet wurden. Imipramin wurde weiterhin häufig verwendet, und es wurden zahlreiche Nachfolgeprodukte eingeführt. Die Verwendung von Monoaminoxidase-Hemmern (MAOI) nahm zu, nachdem "reversible" Formen entwickelt und eingeführt worden waren, die nur den MAO-A-Subtyp der Inhibitoren betrafen und die Verwendung dieses Medikaments sicherer machten. ⓘ
In den 1960er Jahren ging man davon aus, dass der Wirkmechanismus der Trizyklika in der Hemmung der Wiederaufnahme von Noradrenalin besteht. Die Wiederaufnahme von Noradrenalin wurde jedoch mit stimulierenden Wirkungen in Verbindung gebracht. Später ging man davon aus, dass Trizyklika das Serotonin beeinflussen, wie 1969 von Carlsson und Lindqvist sowie Lapin und Oxenkrug vorgeschlagen. ⓘ
Antidepressiva der zweiten Generation
Die Forscher begannen mit einem Prozess des rationalen Wirkstoffdesigns, um von Antihistaminika abgeleitete Verbindungen zu isolieren, die selektiv auf diese Systeme abzielen würden. Der erste patentierte Wirkstoff dieser Art war Zimelidin im Jahr 1971, während der erste klinische Wirkstoff Indalpin war. Fluoxetin wurde 1988 von der US-amerikanischen Food and Drug Administration (FDA) für den kommerziellen Einsatz zugelassen und war damit der erste Blockbuster-SSRI. Fluoxetin wurde in den frühen 1970er Jahren bei Eli Lilly and Company von Bryan Molloy, Klaus Schmiegel, David T. Wong und anderen entwickelt. SSRIs wurden zusammen mit anderen neueren Medikamenten wie SNRIs und NRIs mit verschiedenen selektiven Wirkungen als "neuartige Antidepressiva" bekannt. ⓘ
Schnell wirkende Antidepressiva
Esketamin (Markenname Spravato), das erste schnell wirkende Antidepressivum, das für die klinische Behandlung von Depressionen zugelassen wurde, wurde im März 2019 in den Vereinigten Staaten für diese Indikation eingeführt. ⓘ
Forschung
Im Oktober 2018 hat die Food and Drug Administration der USA (FDA) einer großen Studie über Psilocybin in der Therapie von behandlungsresistenten Depressionen den Status eines beschleunigten Studienprogramms verliehen. Anfang 2020 gewährte die FDA den Status eines „beschleunigten Studienprogramms“ auch einem Programm zur Behandlung von schweren Depressionen (major depression disorder [MDD]) mit Psilocybin zur Durchbruchstherapie. Eine Behandlungsresistenz ist hier keine Voraussetzung mehr für den Psilocybin-Einsatz in der Studie. ⓘ
Gesellschaft und Kultur
Verschreibungstrends
In den Vereinigten Staaten waren Antidepressiva im Jahr 2013 die am häufigsten verschriebenen Medikamente. Von den geschätzten 16 Millionen "Langzeit"-Konsumenten (über 24 Monate) sind etwa 70 Prozent weiblich. Im Jahr 2017 nahmen etwa 16,5 % der Weißen in den Vereinigten Staaten Antidepressiva ein, verglichen mit 5,6 % der Schwarzen in den Vereinigten Staaten. ⓘ
Im Vereinigten Königreich zeigten Zahlen aus dem Jahr 2010, dass sich die Zahl der vom National Health Service (NHS) verschriebenen Antidepressiva innerhalb eines Jahrzehnts fast verdoppelt hat. Eine weitere 2014 veröffentlichte Analyse ergab, dass die Zahl der jährlich in der Gemeinschaft abgegebenen Antidepressiva in den 14 Jahren zwischen 1998 und 2012 um 25 Millionen gestiegen ist, nämlich von 15 Millionen auf 40 Millionen. Fast 50 % dieses Anstiegs entfielen auf die vier Jahre nach dem Bankencrash 2008, in denen der jährliche Anstieg der Verschreibungen von 6,7 % auf 8,5 % stieg. Diese Quellen deuten auch darauf hin, dass neben der Rezession weitere Faktoren Einfluss auf Veränderungen bei den Verschreibungsraten haben könnten: Verbesserungen bei der Diagnose, eine Verringerung des Stigmas, das die psychische Gesundheit umgibt, allgemeinere Verschreibungstrends, Merkmale des Hausarztes, geografische Lage und Wohnsituation. Ein weiterer Faktor, der zu einem steigenden Verbrauch von Antidepressiva beitragen kann, ist die Tatsache, dass diese Medikamente jetzt auch bei anderen Erkrankungen wie sozialen Ängsten und posttraumatischen Belastungsstörungen eingesetzt werden. ⓘ
Vereinigte Staaten: Die am häufigsten verschriebenen Antidepressiva auf dem US-amerikanischen Einzelhandelsmarkt im Jahr 2010 waren:
| Name des Medikaments | Wirkstoffklasse | Verschreibungen insgesamt ⓘ |
|---|---|---|
| Sertralin | SSRI | 33,409,838 |
| Citalopram | SSRI | 27,993,635 |
| Fluoxetin | SSRI | 24,473,994 |
| Escitalopram | SSRI | 23,000,456 |
| Trazodon | SARI | 18,786,495 |
| Venlafaxin (alle Formulierungen) | SNRI | 16,110,606 |
| Bupropion (alle Formulierungen) | NDRI | 15,792,653 |
| Duloxetin | SNRI | 14,591,949 |
| Paroxetin | SSRI | 12,979,366 |
| Amitriptylin | TCA | 12,611,254 |
| Venlafaxin XR | SNRI | 7,603,949 |
| Bupropion XL | NDRI | 7,317,814 |
| Mirtazapin | TeCA | 6,308,288 |
| Venlafaxin ER | SNRI | 5,526,132 |
| Bupropion SR | NDRI | 4,588,996 |
| Desvenlafaxin | SNRI | 3,412,354 |
| Nortriptylin | TCA | 3,210,476 |
| Bupropion ER | NDRI | 3,132,327 |
| Venlafaxin | SNRI | 2,980,525 |
| Bupropion | NDRI | 753,516 |
Niederlande: In den Niederlanden ist Paroxetin das am häufigsten verschriebene Antidepressivum, gefolgt von Amitriptylin, Citalopram und Venlafaxin. ⓘ
Therapietreue
Im Jahr 2003 hielten sich weltweit 30 bis 60 % der Menschen nicht an die Anweisungen ihres Arztes zur Einnahme ihrer Antidepressiva, und im Jahr 2013 zeigte sich in den USA, dass etwa 50 % der Menschen ihre Antidepressiva nicht wie vom Arzt verordnet einnahmen. ⓘ
Wenn Menschen ihre Antidepressiva nicht einnehmen, besteht ein größeres Risiko, dass das Medikament nicht hilft, dass sich die Symptome verschlimmern, dass sie bei der Arbeit fehlen oder weniger produktiv sind und dass die Person ins Krankenhaus eingeliefert werden muss. Dadurch steigen auch die Kosten für die Pflege der Betroffenen. ⓘ
Sozialwissenschaftliche Perspektive
Einige Wissenschaftler haben die Notwendigkeit hervorgehoben, den Einsatz von Antidepressiva und anderen medizinischen Behandlungen kulturübergreifend zu untersuchen, da in verschiedenen Kulturen unterschiedliche Erscheinungsformen, Symptome, Bedeutungen und Assoziationen von Depressionen und anderen Erkrankungen innerhalb der Bevölkerung verschrieben und beobachtet werden. Diese kulturübergreifenden Diskrepanzen, so wurde argumentiert, haben Auswirkungen auf die wahrgenommene Wirksamkeit und den Einsatz von Antidepressiva und anderen Strategien bei der Behandlung von Depressionen in diesen verschiedenen Kulturen. In Indien werden Antidepressiva weitgehend als Mittel zur Bekämpfung der Marginalität betrachtet, die dem Einzelnen die Fähigkeit zur Wiedereingliederung in die Gesellschaft versprechen - eine Ansicht und Assoziation, die im Westen nicht zu beobachten ist. ⓘ
Auswirkungen auf die Umwelt
Da die meisten Antidepressiva durch die Hemmung der Wiederaufnahme der Neurotransmitter Serotonin, Dopamin und Noradrenalin wirken, können diese Medikamente die natürlichen Neurotransmitterwerte in anderen Organismen beeinträchtigen, auf die sie indirekt einwirken. Die Antidepressiva Fluoxetin und Sertralin wurden in Wasserorganismen nachgewiesen, die sich in von Abwässern dominierten Flüssen aufhalten. Das Vorhandensein von Antidepressiva in Oberflächengewässern und Wasserorganismen ist besorgniserregend, da ökotoxikologische Auswirkungen auf Wasserorganismen aufgrund der Fluoxetin-Exposition nachgewiesen wurden. ⓘ
Es wurde nachgewiesen, dass Korallenriff-Fische aggressives Verhalten durch Serotonin modulieren. Die künstliche Erhöhung des Serotoninspiegels bei Krustentieren kann den sozialen Status vorübergehend umkehren und untergeordnete Tiere in aggressive und territorial dominante Männchen verwandeln. ⓘ
Die Exposition gegenüber Fluoxetin erhöht nachweislich die serotonerge Aktivität bei Fischen und reduziert in der Folge aggressives Verhalten. Die perinatale Exposition gegenüber Fluoxetin in relevanten Umweltkonzentrationen führt bei 1 Monat alten Tintenfischen nachweislich zu erheblichen Veränderungen der Gedächtnisverarbeitung. Diese Beeinträchtigung kann Tintenfische benachteiligen und ihr Überleben beeinträchtigen. Etwas weniger als 10 % des oral verabreichten Fluoxetins wird vom Menschen unverändert oder als Glucuronid ausgeschieden. ⓘ
Einteilung der Antidepressiva
Selektive Wiederaufnahmehemmer
Selektive Serotonin-Wiederaufnahmehemmer (SSRI)
Die SSRI blockieren speziell die Rezeptoren, die für die Wiederaufnahme des Botenstoffes Serotonin zuständig sind. Die durch Eingriff in weitere Transmittersysteme verursachten Nebenwirkungen der trizyklischen Antidepressiva spielen bei der SSRI-Behandlung eine entsprechend geringere Rolle. ⓘ
Wirkstoffe dieser Gruppe sind zum Beispiel Fluvoxamin, Fluoxetin, Citalopram, Escitalopram, Sertralin, Paroxetin. Mehrere Medikamente dieser Gruppe werden auch zur Behandlung von Angststörungen, Panikattacken, Zwangsstörungen und Bulimie eingesetzt. ⓘ
SSRI sind die am häufigsten eingesetzten Antidepressiva. Die Wirkung der SSRI auf das depressive Syndrom ist abhängig von der Schwere der Erkrankung. So ist bei leichtgradigen Depressionen häufig keine statistisch nachweisbare Überlegenheit gegenüber der Gabe von Scheinmedikamenten (Placebo) festzustellen. Bei schwerer ausgeprägten Depressionen hingegen sprechen etwa 50–75 % der Patienten auf ein SSRI an, während etwa 25–33 % der Patienten auf Placebo ansprechen. ⓘ
Schon kurz nach Einführung der ersten Wirkstoffe dieser Gruppe wurde über gewalttätiges Verhalten und Suizide unter SSRI-Medikation berichtet; eine möglicherweise suizidalitätssteigernde Wirkung dieser Substanzen ist bislang weder gesichert noch widerlegt. Beim Absetzen von SSRI nach längerer Einnahme kann sich ein Absetzsyndrom entwickeln. Eine Abhängigkeit von SSRI entsprechend der DSM-IV-Definition ist aber nicht bekannt. ⓘ
Multimodales Antidepressivum (Serotonin-Wiederaufnahmehemmer, Serotonin-1A-Rezeptoragonist, partieller Serotonin-1B-Rezeptorantagonist, Serotonin-1D-/3-/7-Rezeptorantagonist, Modulator der Serotonin-, Noradrenalin-, Dopamin-, Histamin-, Acetylcholin-, GABA und Glutamat Systeme) ⓘ
Vortioxetin besitzt einen multimodalen Wirkmechanismus und somit gleichzeitig an fünf verschiedene Serotonin-Untereinheiten effektiv ist. ⓘ
Selektive Noradrenalin-Wiederaufnahmehemmer (SNARI, SNRI)
Die NARI hemmen den Transporter, der Noradrenalin nach erfolgter Signalübertragung natürlicherweise wieder zu den Speicherplätzen zurückbefördert. Noradrenalin verbleibt länger am Wirkort, und seine Wirksamkeit als Signalüberträger steigt. Wirkstoffe dieser Gruppe sind zum Beispiel Reboxetin und Viloxazin. Anwendungsgebiete sind akute depressive Erkrankungen, darunter mit Antriebsstörungen einhergehende Depressionen. Viloxazin wurde im Juli 2006 vom Markt genommen. Reboxetin hingegen ist in Deutschland weiterhin auf dem Markt. Jedoch müssen die gesetzlichen Krankenkassen die Kosten für Medikamente mit dem Wirkstoff Reboxetin seit 1. April 2011 nicht mehr tragen. Die Kosten muss der Patient nun selbst bezahlen, falls die Krankenkasse des Patienten keine Ausnahme macht. ⓘ
Dopamin-Wiederaufnahmehemmer (DRI, DARI)
Amineptin ist seit 2005 gemäß BtMG (D) nicht mehr verschreibungsfähig. Es war die einzige verschreibungsfähige, arzneilich als Antidepressivum verwendete Substanz, die eine Abhängigkeit auslösen konnte. Weitere DRI sind Nomifensin und Medifoxamin, die aber wegen starker Nebenwirkungen mittlerweile nicht mehr gebräuchlich sind. ⓘ
Andere Arten von Antidepressiva
Noradrenerge und spezifisch serotonerge Antidepressiva (NaSSA)
Diese tetrazyklischen, im Englischen als Noradrenergic and Specific Serotonergic Antidepressants (NaSSA) bezeichneten Wirkstoffe sind Antagonisten an präsynaptischen Auto-Rezeptoren des Alpha-2 Adrenozeptortyps und bewirken dadurch eine verstärkte Ausschüttung von Noradrenalin. Zudem sind sie Antagonisten an spezifischen Serotoninrezeptoren, meist 5-HT2A und 5-HT2C. Meist wirken sie als H1-Antihistaminika sedierend. NaSSA werden bei Depressionen (besonders bei Hemmung, Gewichtsverlust, Schlafstörung und Ängsten), teilweise auch als Schlafmittel eingesetzt. Wirkstoffe: zum Beispiel Mirtazapin und Mianserin. ⓘ
Serotonin-Antagonist-und-Wiederaufnahmehemmer (SARI)
Diese im Englischen Serotonin Antagonist and Reuptake Inhibitor (SARI) heißenden Wirkstoffe sind Antagonisten an Serotoninrezeptoren, meist (5-HT2A). Zudem sind sie meist Antagonisten des Alpha-1 Adrenozeptortyps. Ein Wirkstoff aus dieser Gruppe ist das Trazodon. Es wird eingesetzt zur Behandlung von Depressionen unterschiedlicher Ätiologie mit oder ohne Angstkomponente, anhaltenden Schlafstörungen bei Depressionen sowie zur Behandlung von im Rahmen von Depressionen auftretenden erektilen Dysfunktionen ohne schwerwiegende organische Ursachen. ⓘ
Glutamerge Modulation / Serotonin-Wiederaufnahmeverstärker (SRE)
Tianeptin hat eine modulierende Wirkung auf glutamerge NMDA- und AMPA-Rezeptoren und scheint auf diese Weise stressbedingte Veränderungen im Hippocampus und präfrontalen Cortex verhindern bzw. rückgängig machen zu können. ⓘ
Serotonin-(5-HT2)-Antagonist und Melatonin-(MT1- und MT2)-Agonist
Agomelatin wirkt agonistisch auf die melatonergen MT1- und MT2-Rezeptoren und antagonistisch auf die serotonergen 5HT2C-Rezeptoren. Die dem Melatonin strukturell verwandte chemische Verbindung aus der Gruppe der Antidepressiva wird in der Behandlung von Episoden einer Major Depression bei Erwachsenen eingesetzt. ⓘ
Aminpräkursoren
Im Rahmen der Depressionsbehandlung sind mit Aminpräkursoren die Stoffwechsel-Vorstufen der Monoamin-Neurotransmitter Serotonin, Noradrenalin und Dopamin gemeint. Darunter fallen L-Tryptophan, 5-Hydroxytryptophan für Serotonin und L-Phenylalanin, L-Tyrosin und L-DOPA sowohl für Noradrenalin als auch Dopamin. ⓘ
Phasenprophylaktika (Stimmungsstabilisatoren) mit antidepressiver Wirkung
Für die Prophylaxe von Depressionen werden andere Arzneimittel verwendet als für die Akuttherapie. Dabei wird zwischen monopolarem Verlauf und bipolarem (Wechsel zwischen manisch und depressiv) Verlauf unterschieden.
- Lithium (in der Regel mit komplexem Wirkungsmechanismus) → Lithiumtherapie
- Valproat: In mehreren Studien konnte keine signifikante antidepressive Wirkung von Valproat festgestellt werden, jedoch eine gute anti-manische Wirkung.
- Carbamazepin: Eine eindeutige antidepressive Wirkung wird von mehreren Studien bestätigt; beste Datenlage hinsichtlich eines antidepressiven Effektes unter allen Antikonvulsiva.
- Lamotrigin: Die vorhandenen Daten sprechen für einen antidepressiven Effekt (bei monopolaren Depressionen) bei diesem Antikonvulsivum, obwohl es nicht viele Studien über eine antidepressive Wirkung von Lamotrigin bei monopolaren Depressionen gibt. Kein Zweifel besteht jedoch an seiner antidepressiven Wirksamkeit im Rahmen einer bipolaren Störung – in Deutschland ist es als Präventionsmittel gegen depressive Episoden bei bipolaren Störungen zugelassen. ⓘ
Omega-3-Fettsäure Eicosapentaensäure (EPA)
Es konnte nachgewiesen werden, dass die Omega-3-Fettsäure Eicosapentaensäure (kurz: EPA) einen antidepressiven Effekt bei einer Dosierung von mehr als 1 g/Tag aufweist. Auch auf Schizophrenie hat EPA einen positiven Effekt. ⓘ
Vitamin D3
Cholecalciferol (Vitamin-D3) ist genau genommen kein Vitamin, sondern ein Prohormon (der Körper kann es im Gegensatz zu echten Vitaminen selbst bilden). Aus Cholecalciferol wird das Hormon Calcitriol gebildet. Calcitriol (auch Vitamin-D-Hormon genannt) wirkt dabei im Zusammenspiel mit Vitamin-D-Rezeptoren im Körper sehr viel breiter als nur in Zusammenhang mit der bekannten Knochenbildung, u. a. eben auch in Bereichen, die Auswirkungen auf die Stimmungslage haben. Den Ergebnissen einer Studie der Universität Amsterdam zufolge war der Vitamin-D-Gehalt im Blut bei Patienten mit Depressionen durchschnittlich 14 % niedriger als in der Kontrollgruppe. Der Effekt einer Behandlung mit Vitamin D3 ist aber gering. ⓘ
Pharmakoökonomie
Zur Behandlung depressiver Störungen wurden in Deutschland im Jahr 2002 etwa 4 Milliarden Euro ausgegeben (direkte Krankheitskosten). Der Anteil der Kosten für Medikamente an den gesamten direkten Kosten ist international vergleichbar und beträgt etwa 4–11 %. ⓘ


