NMDA-Rezeptor

Der N-Methyl-D-Aspartat-Rezeptor (auch als NMDA-Rezeptor oder NMDAR bezeichnet) ist ein Glutamatrezeptor und Ionenkanal, der in Neuronen vorkommt. Der NMDA-Rezeptor ist einer von drei Typen ionotroper Glutamatrezeptoren, die anderen beiden sind AMPA- und Kainatrezeptoren. Je nach Zusammensetzung seiner Untereinheiten sind seine Liganden Glutamat und Glycin (oder D-Serin). Die Bindung der Liganden reicht jedoch in der Regel nicht aus, um den Kanal zu öffnen, da er durch Mg2+-Ionen blockiert werden kann, die nur entfernt werden, wenn das Neuron ausreichend depolarisiert ist. Der Kanal fungiert also als "Zufallsdetektor", und nur wenn beide Bedingungen erfüllt sind, öffnet sich der Kanal und lässt positiv geladene Ionen (Kationen) durch die Zellmembran fließen. Es wird angenommen, dass der NMDA-Rezeptor für die Steuerung der synaptischen Plastizität und die Vermittlung von Lern- und Gedächtnisfunktionen von großer Bedeutung ist. ⓘ
Der NMDA-Rezeptor ist ionotrop, d. h. er ist ein Protein, das den Durchgang von Ionen durch die Zellmembran ermöglicht. Der NMDA-Rezeptor heißt so, weil das Agonistenmolekül N-Methyl-D-Aspartat (NMDA) selektiv an ihn bindet und nicht an andere Glutamatrezeptoren. Die Aktivierung von NMDA-Rezeptoren führt zur Öffnung des Ionenkanals, der für Kationen nicht selektiv ist, mit einem kombinierten Umkehrpotential nahe 0 mV. Während das Öffnen und Schließen des Ionenkanals in erster Linie durch die Ligandenbindung gesteuert wird, ist der Stromfluss durch den Ionenkanal spannungsabhängig. Extrazelluläre Magnesium- (Mg2+) und Zink- (Zn2+) Ionen können an spezifische Stellen des Rezeptors binden und so den Durchgang anderer Kationen durch den offenen Ionenkanal blockieren. Durch eine Depolarisierung der Zelle werden die Mg2+- und Zn2+-Ionen aus der Pore verdrängt und abgestoßen, wodurch ein spannungsabhängiger Fluss von Natrium- (Na+) und Kalzium- (Ca2+) Ionen in die Zelle und Kalium (K+) aus der Zelle ermöglicht wird. Es wird angenommen, dass der Ca2+-Fluss durch NMDA-Rezeptoren insbesondere bei der synaptischen Plastizität, einem zellulären Mechanismus für Lernen und Gedächtnis, eine entscheidende Rolle spielt, und zwar aufgrund von Proteinen, die an Ca2+-Ionen binden und durch diese aktiviert werden. ⓘ
Die Aktivität des NMDA-Rezeptors wird durch zahlreiche psychoaktive Drogen wie Phencyclidin (PCP), Alkohol (Ethanol) und Dextromethorphan (DXM) beeinträchtigt. Die betäubenden und schmerzlindernden Wirkungen der Drogen Ketamin und Distickstoffoxid sind teilweise auf ihre Wirkung auf die NMDA-Rezeptoraktivität zurückzuführen. Eine Überaktivierung von NMDAR erhöht jedoch die zytosolischen Konzentrationen von Kalzium und Zink, was erheblich zum neuronalen Tod beiträgt, der durch Cannabinoide verhindert werden kann, wobei ein HINT1-Protein erforderlich ist, um den toxischen Auswirkungen der NMDAR-vermittelten NO-Produktion und der Zinkfreisetzung durch Aktivierung des CB1-Rezeptors entgegenzuwirken. Neben der Verhinderung der Methamphetamin-induzierten Neurotoxizität durch Hemmung der Expression der Stickstoffmonoxid-Synthase (nNOS) und der Astrozyten-Aktivierung wird beobachtet, dass Methamphetamin-induzierte Hirnschäden durch einen CB1-abhängigen bzw. -unabhängigen Mechanismus reduziert werden, und die Hemmung der Methamphetamin-induzierten Astrogliose erfolgt wahrscheinlich durch einen CB2-Rezeptor-abhängigen Mechanismus für THC. Seit 1989 ist bekannt, dass Memantin ein nicht-kompetitiver Antagonist des NMDA-Rezeptors ist, der in den Kanal des Rezeptors eindringt, nachdem dieser aktiviert wurde, und dadurch den Ionenfluss blockiert. ⓘ
Eine Überaktivierung des Rezeptors, die zu einem übermäßigen Einstrom von Ca2+ führt, kann zu Exzitotoxizität führen, die bei einigen neurodegenerativen Erkrankungen vermutet wird. Die Blockierung von NMDA-Rezeptoren könnte daher theoretisch bei der Behandlung solcher Krankheiten von Nutzen sein. Eine Unterfunktion der NMDA-Rezeptoren (aufgrund von Glutathionmangel oder anderen Ursachen) könnte jedoch zu einer Beeinträchtigung der synaptischen Plastizität führen und andere negative Auswirkungen haben. Das Hauptproblem bei der Verwendung von NMDA-Rezeptor-Antagonisten zur Neuroprotektion besteht darin, dass die physiologischen Aktionen des NMDA-Rezeptors für eine normale neuronale Funktion unerlässlich sind. Um klinisch nützlich zu sein, müssen NMDA-Antagonisten eine übermäßige Aktivierung blockieren, ohne die normalen Funktionen zu beeinträchtigen. Memantin hat diese Eigenschaft. ⓘ
| NMDA-Rezeptor ⓘ | ||
|---|---|---|

| ||
| EM-Struktur des NMDA-Rezeptors, komplexiert mit Esketamin, Glycin und Glutamat, gemäß PDB 7EU7. Untereinheiten GluN1 in orange-rot, GluN2A in blau, Liganden in magenta. Vorn/rechts Bänderdarstellung, hinten/links van-der-Waals-Oberfläche in grau. Teile der Struktur der Sicht wegen ausgeblendet. | ||
| Sekundär- bis Quartärstruktur | Heterotetramer | |
| Bezeichner | ||
| Gen-Name(n) | GRIN1, GRIN2A, GRIN2B, GRIN2C, GRIN2D, GRIN3A, GRIN3B | |
| Transporter-Klassifikation | ||
| TCDB | 1.A.10.1.6 | |
| Bezeichnung | glutamatgesteuerter Ionenkanal | |

Geschichte
Der Entdeckung der NMDA-Rezeptoren folgte in den 1960er Jahren die Synthese und Untersuchung von N-Methyl-D-Asparaginsäure (NMDA) durch Jeff Watkins und Kollegen. In den frühen 1980er Jahren wurde nachgewiesen, dass NMDA-Rezeptoren an mehreren zentralen synaptischen Pfaden beteiligt sind. In den frühen 1990er Jahren wurde die Selektivität der Rezeptoruntereinheiten entdeckt, was zur Entdeckung einer neuen Klasse von Verbindungen führte, die selektiv die NR2B-Untereinheit hemmen. Diese Erkenntnisse führten zu einer heftigen Kampagne in der pharmazeutischen Industrie. Man ging davon aus, dass NMDA-Rezeptoren mit einer Vielzahl von neurologischen Erkrankungen wie Epilepsie, Parkinson, Alzheimer, Huntington und anderen ZNS-Erkrankungen in Verbindung gebracht werden. ⓘ
Im Jahr 2002 entdeckten Hilmar Bading und Mitarbeiter, dass die zellulären Folgen der Stimulation von NMDA-Rezeptoren von der Position des Rezeptors auf der neuronalen Zelloberfläche abhängen. Synaptische NMDA-Rezeptoren fördern die Genexpression, die mit der Plastizität zusammenhängenden Ereignisse und die erworbene Neuroprotektion. Extrasynaptische NMDA-Rezeptoren fördern die Todessignalisierung; sie führen zur Abschaltung der Transkription, zur mitochondrialen Dysfunktion und zum strukturellen Zerfall. Diese pathologische Triade der extrasynaptischen NMDA-Rezeptor-Signalisierung stellt einen gemeinsamen Konversionspunkt in der Ätiologie verschiedener akuter und chronischer neurodegenerativer Erkrankungen dar. Die molekulare Grundlage für die toxische extrasynaptische NMDA-Rezeptor-Signalübertragung wurde von Hilmar Bading und Mitarbeitern im Jahr 2020 aufgedeckt. Extrasynaptische NMDA-Rezeptoren bilden einen Todessignalkomplex mit TRPM4. NMDAR/TRPM4-Interaktions-Interface-Inhibitoren (auch als Interface-Inhibitoren bekannt) unterbrechen den NMDAR/TRPM4-Komplex und entgiften extrasynaptische NMDA-Rezeptoren. ⓘ
Eine zufällige Entdeckung wurde 1968 gemacht, als eine Frau, die Amantadin als Grippemittel einnahm, eine bemerkenswerte Remission ihrer Parkinson-Symptome erlebte. Dieser Befund, über den Scawab et al. berichteten, war der Beginn der medizinischen Chemie von Amantadinderivaten im Zusammenhang mit Erkrankungen des ZNS. Vor dieser Entdeckung war Memantin, ein weiteres Adamantan-Derivat, 1963 von Eli Lilly and Company synthetisiert worden. Ziel war es, ein blutzuckersenkendes Medikament zu entwickeln, das jedoch keine derartige Wirkung zeigte. Erst 1972 wurde eine mögliche therapeutische Bedeutung von Memantin für die Behandlung neurodegenerativer Erkrankungen entdeckt. Seit 1989 ist Memantin als nicht-kompetitiver Antagonist des NMDA-Rezeptors bekannt. ⓘ
Struktur

Funktionelle NMDA-Rezeptoren sind Heterotetramere, die aus zwei GluN1- und typischerweise zwei GluN2-Untereinheiten bestehen. Es gibt ein GluN1-, vier GluN2- und zwei GluN3-Untereinheiten kodierende Gene, und jedes Gen kann mehr als eine Spleißvariante produzieren. ⓘ
- GluN1 - GRIN1
- GluN2
- GluN2A - GRIN2A
- GluN2B - GRIN2B
- GluN2C - GRIN2C
- GluN2D - GRIN2D
- GluN3
- GluN3A - GRIN3A
- GluN3B - GRIN3B ⓘ
Gating

Der NMDA-Rezeptor ist ein Glutamat- und Ionenkanal-Protein-Rezeptor, der aktiviert wird, wenn Glycin und Glutamat an ihn binden. Der Rezeptor ist ein heteromerer Komplex, der über drei verschiedene Untereinheiten mit mehreren intrazellulären Proteinen interagiert: GluN1, GluN2 und GluN3. GluN1 hat aufgrund des alternativen Spleißens des Gens GRIN1 acht verschiedene Isoformen. Es gibt vier verschiedene GluN2-Untereinheiten (A-D) und zwei verschiedene Glun3-Untereinheiten (A und B). Sechs verschiedene Gene kodieren für GluN2 und GluN3. Alle Untereinheiten haben eine gemeinsame Membrantopologie, die von einem großen extrazellulären N-Terminus, einer Membranregion mit drei Transmembransegmenten, einer re-entrant pore loop, einer extrazellulären Schleife zwischen den Transmembransegmenten, die strukturell nicht gut bekannt sind, und einem intrazellulären C-Terminus dominiert wird, die je nach Untereinheit unterschiedlich groß sind und mehrere Interaktionsstellen mit vielen intrazellulären Proteinen bieten. Abbildung 1 zeigt eine Grundstruktur der GluN1/GluN2-Untereinheiten, die die Bindungsstelle für Memantin, Mg2+ und Ketamin bildet. ⓘ

Mg2+ blockiert den NMDA-Rezeptorkanal in einer spannungsabhängigen Weise. Die Kanäle sind auch sehr durchlässig für Ca2+. Die Aktivierung des Rezeptors hängt von der Glutamatbindung, der D-Serin- oder Glycinbindung an seiner GluN1-verknüpften Bindungsstelle und der AMPA-Rezeptor-vermittelten Depolarisation der postsynaptischen Membran ab, die die spannungsabhängige Kanalblockade durch Mg2+ aufhebt. Die Aktivierung und Öffnung des Rezeptorkanals ermöglicht somit den Fluss von K+-, Na+- und Ca2+-Ionen, und der Einstrom von Ca2+ löst intrazelluläre Signalwege aus. Allosterische Rezeptorbindungsstellen für Zink, Proteine und die Polyamine Spermidin und Spermin sind ebenfalls Modulatoren für die NMDA-Rezeptorkanäle. ⓘ
Die Untereinheit GluN2B ist an der Modulation von Aktivitäten wie Lernen, Gedächtnis, Verarbeitung und Fütterungsverhalten beteiligt und wird auch mit einer Reihe von menschlichen Störungen in Verbindung gebracht. Die grundlegende Struktur und die Funktionen des NMDA-Rezeptors lassen sich auf die Untereinheit GluN2B zurückführen. So werden beispielsweise die Glutamat-Bindungsstelle und die Kontrolle der Mg2+-Blockade von der GluN2B-Untereinheit gebildet. Auch die hochaffinen Stellen für den Glycin-Antagonisten werden ausschließlich vom GluN1/GluN2B-Rezeptor gebildet. ⓘ
Es wird davon ausgegangen, dass die Transmembransegmente von GluN1/GluN2B der Teil des Rezeptors sind, der die Bindungstaschen für nichtkompetitive NMDA-Rezeptorantagonisten bildet, aber die Strukturen der Transmembransegmente sind, wie oben erwähnt, nicht vollständig bekannt. Es wird behauptet, dass drei Bindungsstellen innerhalb des Rezeptors, A644 auf der GluNB-Untereinheit und A645 und N616 auf der GluN1-Untereinheit, für die Bindung von Memantin und verwandten Verbindungen wichtig sind, wie in Abbildung 2 zu sehen ist. ⓘ
Der NMDA-Rezeptor bildet ein Heterotetramer aus zwei GluN1- und zwei GluN2-Untereinheiten (die Untereinheiten wurden früher als GluN1 und GluN2 bezeichnet), zwei obligatorischen GluN1-Untereinheiten und zwei regional lokalisierten GluN2-Untereinheiten. Eine verwandte Genfamilie von GluN3 A- und B-Untereinheiten hat eine hemmende Wirkung auf die Rezeptoraktivität. Durch selektives Spleißen der GluN1-Transkripte und unterschiedliche Expression der GluN2-Untereinheiten entstehen mehrere Rezeptor-Isoformen mit unterschiedlichen Verteilungen und funktionellen Eigenschaften im Gehirn. ⓘ
Jede Rezeptoruntereinheit ist modular aufgebaut und jedes Strukturmodul stellt auch eine funktionelle Einheit dar:
- Die extrazelluläre Domäne enthält zwei globuläre Strukturen: eine modulatorische Domäne und eine ligandenbindende Domäne. GluN1-Untereinheiten binden den Co-Agonisten Glycin und GluN2-Untereinheiten binden den Neurotransmitter Glutamat.
- Das Agonisten-bindende Modul ist mit einer Membrandomäne verbunden, die aus drei Transmembransegmenten und einer Wiedereintrittsschleife besteht, die an den Selektivitätsfilter von Kaliumkanälen erinnert.
- Die Membrandomäne steuert Reste zur Kanalpore bei und ist für die hohe unitäre Leitfähigkeit, die hohe Kalziumpermeabilität und die spannungsabhängige Magnesiumblockade des Rezeptors verantwortlich.
- Jede Untereinheit hat eine ausgedehnte zytoplasmatische Domäne, die Reste enthält, die direkt durch eine Reihe von Proteinkinasen und Proteinphosphatasen modifiziert werden können, sowie Reste, die mit einer großen Anzahl von Struktur-, Adaptor- und Gerüstproteinen interagieren. ⓘ
Die Glycin-bindenden Module der Untereinheiten GluN1 und GluN3 sowie das Glutamat-bindende Modul der Untereinheit GluN2A wurden als lösliche Proteine exprimiert, und ihre dreidimensionale Struktur wurde mit atomarer Auflösung durch Röntgenkristallographie gelöst. Dabei wurde eine gemeinsame Faltung mit Aminosäure-bindenden bakteriellen Proteinen und mit dem Glutamat-bindenden Modul von AMPA-Rezeptoren und Kainat-Rezeptoren festgestellt. ⓘ
Der Wirkmechanismus
NMDA-Rezeptoren spielen eine entscheidende Rolle bei der Entwicklung des zentralen Nervensystems. Die Prozesse des Lernens, des Gedächtnisses und der Neuroplastizität beruhen auf dem Mechanismus der NMDA-Rezeptoren. NMDA-Rezeptoren sind Glutamat-gesteuerte Kationenkanäle, die eine Erhöhung der Kalziumpermeabilität ermöglichen. Die Kanalaktivierung von NMDA-Rezeptoren ist das Ergebnis der Bindung von zwei Co-Agonisten, Glycin und Glutamat. ⓘ
Eine Überaktivierung von NMDA-Rezeptoren, die einen übermäßigen Ca2+-Einstrom verursacht, kann zu Exzitotoxizität führen. Es wird vermutet, dass Exzitotoxizität bei einigen neurodegenerativen Erkrankungen wie der Alzheimer-Krankheit, der Parkinson-Krankheit und der Huntington-Krankheit eine Rolle spielt. Die Blockierung von NMDA-Rezeptoren könnte daher theoretisch bei der Behandlung solcher Krankheiten von Nutzen sein. Es ist jedoch wichtig, die physiologische Aktivität der NMDA-Rezeptoren zu erhalten und gleichzeitig zu versuchen, ihre übermäßige, exzitotoxische Aktivität zu blockieren. Dies kann möglicherweise durch nichtkompetitive Antagonisten erreicht werden, die den Ionenkanal des Rezeptors blockieren, wenn dieser übermäßig geöffnet ist. ⓘ
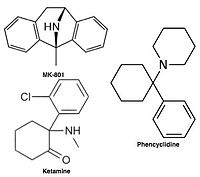
Unkompetitive NMDA-Rezeptor-Antagonisten oder Kanalblocker dringen in den Kanal des NMDA-Rezeptors ein, nachdem dieser aktiviert wurde, und blockieren so den Ionenfluss. MK-801, Ketamin, Amantadin und Memantin sind Beispiele für solche Antagonisten (siehe Abbildung 1). Die Ausschaltrate eines Antagonisten aus dem Rezeptorkanal ist ein wichtiger Faktor, da eine zu langsame Ausschaltrate die normale Funktion des Rezeptors beeinträchtigen kann und eine zu schnelle Ausschaltrate zu einer unwirksamen Blockade eines übermäßig geöffneten Rezeptors führen kann. ⓘ
Memantin ist ein Beispiel für einen nicht-kompetitiven Kanalblocker des NMDA-Rezeptors mit einer relativ schnellen Ausschaltrate und geringer Affinität. Bei physiologischem pH-Wert ist seine Amingruppe positiv geladen und sein Rezeptorantagonismus ist spannungsabhängig. Damit ahmt es die physiologische Funktion von Mg2+ als Kanalblocker nach. Memantin blockiert NMDA-Rezeptor-assoziierte Kanäle nur bei längerer Aktivierung des Rezeptors, wie sie unter exzitotoxischen Bedingungen auftritt, indem es das Magnesium an der Bindungsstelle ersetzt. Bei normaler Rezeptoraktivität bleiben die Kanäle nur für einige Millisekunden offen, und unter diesen Umständen kann Memantin nicht in den Kanälen binden und beeinträchtigt daher nicht die normale synaptische Aktivität. ⓘ
Varianten
GluN1
Es gibt acht Varianten der GluN1-Untereinheit, die durch alternatives Spleißen von GRIN1 entstehen:
- GluN1-1a, GluN1-1b; GluN1-1a ist die am häufigsten vorkommende Form.
- GluN1-2a, GluN1-2b;
- GluN1-3a, GluN1-3b;
- GluN1-4a, GluN1-4b; ⓘ
GluN2

Während in wirbellosen Organismen nur eine einzige GluN2-Untereinheit vorkommt, werden in Wirbeltieren vier verschiedene Isoformen der GluN2-Untereinheit exprimiert, die mit den Bezeichnungen GluN2A bis GluN2D bezeichnet werden (kodiert von GRIN2A, GRIN2B, GRIN2C, GRIN2D). Es gibt deutliche Hinweise darauf, dass die Gene, die für die GluN2-Untereinheiten in Wirbeltieren kodieren, mindestens zwei Runden der Genduplikation durchlaufen haben. Sie enthalten die Bindungsstelle für Glutamat. Noch wichtiger ist, dass jede GluN2-Untereinheit eine andere intrazelluläre C-terminale Domäne hat, die mit verschiedenen Signalmolekülen interagieren kann. Im Gegensatz zu den GluN1-Untereinheiten werden die GluN2-Untereinheiten in verschiedenen Zelltypen und Entwicklungszeitpunkten unterschiedlich exprimiert und kontrollieren die elektrophysiologischen Eigenschaften des NMDA-Rezeptors. In klassischen Schaltkreisen ist GluN2B hauptsächlich in unreifen Neuronen und an extrasynaptischen Stellen wie Wachstumskegeln vorhanden und enthält die Bindungsstelle für den selektiven Inhibitor Ifenprodil. In Pyramidenzell-Synapsen im neu entwickelten dorsolateralen präfrontalen Kortex von Primaten ist GluN2B jedoch ausschließlich in der postsynaptischen Dichte vorhanden und vermittelt höhere kognitive Operationen wie das Arbeitsgedächtnis. Dies steht im Einklang mit der Ausweitung der GluN2B-Aktivitäten und -Expressionen in der kortikalen Hierarchie bei Affen und Menschen sowie in der Evolution des Primatenkortex. ⓘ
Wechsel von GluN2B zu GluN2A

Während im frühen postnatalen Gehirn GluN2B vorherrscht, nimmt die Zahl der GluN2A-Untereinheiten während der frühen Entwicklung zu; schließlich werden die GluN2A-Untereinheiten zahlreicher als GluN2B. Dies wird als GluN2B-GluN2A-Entwicklungswechsel bezeichnet und ist aufgrund der unterschiedlichen Kinetik, mit der jede GluN2-Untereinheit zur Rezeptorfunktion beiträgt, bemerkenswert. So führt beispielsweise ein höherer Anteil der Untereinheit GluN2B zu NMDA-Rezeptoren, die länger offen bleiben als solche mit mehr GluN2A. Dies könnte zum Teil die Ursache dafür sein, dass das Gedächtnis in der unmittelbaren postnatalen Periode besser funktioniert als im späteren Leben, was das Prinzip der genetisch veränderten "Doogie-Mäuse" ist. Der genaue zeitliche Verlauf dieser Umschaltung im menschlichen Kleinhirn wurde mit Hilfe von Expressions-Mikroarrays und RNA-Seq geschätzt und ist in der Abbildung rechts dargestellt. ⓘ
Es gibt drei hypothetische Modelle zur Beschreibung dieses Umschaltmechanismus:
- Zunahme von synaptischem GluN2A bei gleichzeitiger Abnahme von GluN2B
- Extrasynaptische Verdrängung von GluN2B weg von der Synapse mit Zunahme von GluN2A
- Zunahme von GluN2A, die die Anzahl von GluN2B verdünnt, ohne dass letzteres abnimmt. ⓘ
Die Untereinheiten GluN2B und GluN2A spielen auch eine unterschiedliche Rolle bei der Vermittlung des exzitotoxischen neuronalen Todes. Man nimmt an, dass der entwicklungsbedingte Wechsel in der Untereinheitenzusammensetzung die entwicklungsbedingten Veränderungen in der NMDA-Neurotoxizität erklärt. Die homozygote Unterbrechung des Gens für GluN2B bei Mäusen führt zu perinataler Letalität, während die Unterbrechung des Gens für GluN2A lebensfähige Mäuse hervorbringt, allerdings mit beeinträchtigter Plastizität des Hippocampus. Eine Studie legt nahe, dass Reelin eine Rolle bei der Reifung des NMDA-Rezeptors spielen könnte, indem es die Mobilität der GluN2B-Untereinheit erhöht. ⓘ
Wechsel von GluN2B zu GluN2C
Körnerzellvorläufer (GCPs) des Kleinhirns wandern nach einer symmetrischen Zellteilung in der externen Körnerzellschicht (EGL) in die interne Körnerzellschicht (IGL), wo sie GluN2B herunterregulieren und GluN2C aktivieren, ein Prozess, der unabhängig von der Neuregulin-Beta-Signalisierung durch ErbB2- und ErbB4-Rezeptoren ist. ⓘ
Rolle bei der Exzitotoxizität
In einer Reihe von Studien wurde festgestellt, dass NMDA-Rezeptoren eine wichtige Rolle bei der Exzitotoxizität spielen. Da NMDA-Rezeptoren eine wichtige Rolle für die Gesundheit und Funktion von Neuronen spielen, wurde viel darüber diskutiert, wie diese Rezeptoren sowohl das Zellüberleben als auch den Zelltod beeinflussen können. Neuere Erkenntnisse stützen die Hypothese, dass eine Überstimulation extrasynaptischer NMDA-Rezeptoren mehr mit Exzitotoxizität zu tun hat als die Stimulation ihrer synaptischen Gegenstücke. Während die Stimulierung extrasynaptischer NMDA-Rezeptoren zum Zelltod beizutragen scheint, gibt es außerdem Hinweise darauf, dass die Stimulierung synaptischer NMDA-Rezeptoren zur Gesundheit und Langlebigkeit der Zelle beiträgt. Es gibt zahlreiche Belege für die duale Natur der NMDA-Rezeptoren in Abhängigkeit von ihrem Standort, und die Hypothese, die die beiden unterschiedlichen Mechanismen erklärt, ist als "Lokalisierungshypothese" bekannt. ⓘ
Unterschiedliche Kaskadenpfade
Um die Lokalisierungshypothese zu stützen, müsste man nachweisen, dass NMDA-Rezeptoren je nach ihrer Position in der Zellmembran unterschiedliche zelluläre Signalwege aktivieren. Es wurden Experimente durchgeführt, bei denen entweder ausschließlich synaptische oder nichtsynaptische NMDA-Rezeptoren stimuliert wurden. Diese Art von Experimenten hat gezeigt, dass je nach dem Ort des Signalursprungs unterschiedliche Signalwege aktiviert oder reguliert werden. Viele dieser Signalwege nutzen dieselben Proteinsignale, werden aber je nach Ort durch NMDARs gegensätzlich reguliert. So bewirkt beispielsweise eine synaptische NMDA-Erregung eine Abnahme der intrazellulären Konzentration der p38 mitogen-aktivierten Proteinkinase (p38MAPK). Eine extrasynaptische Stimulation von NMDARs regulierte die p38MAPK in umgekehrter Weise und verursachte einen Anstieg der intrazellulären Konzentration. Experimente dieser Art wurden seither wiederholt, wobei die Ergebnisse darauf hindeuten, dass sich diese Unterschiede über viele Wege erstrecken, die mit dem Zellüberleben und der Exzitotoxizität verbunden sind. ⓘ
Zwei spezifische Proteine wurden als Hauptwege identifiziert, die für diese unterschiedlichen zellulären Reaktionen verantwortlich sind: ERK1/2 und Jacob. ERK1/2 ist für die Phosphorylierung von Jacob bei Erregung durch synaptische NMDARs verantwortlich. Diese Information wird dann in den Zellkern transportiert. Die Phosphorylierung von Jacob findet bei extrasynaptischer NMDA-Stimulation nicht statt. Dies ermöglicht es den Transkriptionsfaktoren im Zellkern, je nach Phosphorylierungszustand von Jacob unterschiedlich zu reagieren. ⓘ
Neuronale Plastizität
NMDA-Rezeptoren (NMDARs) haben einen entscheidenden Einfluss auf die Induktion der synaptischen Plastizität. NMDARs lösen über eine schnelle synaptische Übertragung sowohl die Langzeitpotenzierung (LTP) als auch die Langzeitdepression (LTD) aus. Experimentelle Daten deuten darauf hin, dass extrasynaptische NMDA-Rezeptoren LTP hemmen und gleichzeitig LTD erzeugen. Die Hemmung der LTP kann durch die Einführung eines NMDA-Antagonisten verhindert werden. Eine Theta-Burst-Stimulation, die normalerweise eine LTP bei synaptischen NMDARs auslöst, führt bei selektiver Anwendung auf extrasynaptische NMDARs zu einer LTD. Die Experimente zeigen auch, dass extrasynaptische Aktivität für die Bildung von LTP nicht erforderlich ist. Darüber hinaus sind sowohl synaptische als auch extrasynaptische Aktivität an der Ausprägung einer vollständigen LTD beteiligt. ⓘ
Die Rolle der verschiedenen Untereinheiten
Ein weiterer Faktor, der die durch NMDAR induzierte Toxizität zu beeinflussen scheint, sind die beobachteten Unterschiede in der Zusammensetzung der Untereinheiten. NMDA-Rezeptoren sind Heterotetramere mit zwei GluN1-Untereinheiten und zwei variablen Untereinheiten. Zwei dieser variablen Untereinheiten, GluN2A und GluN2B, führen nachweislich bevorzugt zu Zellüberlebens- bzw. Zelltodkaskaden. Obwohl beide Untereinheiten in synaptischen und extrasynaptischen NMDARs zu finden sind, gibt es Hinweise darauf, dass die Untereinheit GluN2B häufiger in extrasynaptischen Rezeptoren vorkommt. Diese Beobachtung könnte dazu beitragen, die dualistische Rolle zu erklären, die NMDA-Rezeptoren bei der Exzitotoxizität spielen. ⓘ
Trotz der überzeugenden Beweise und der relativen Einfachheit dieser beiden Theorien, die im Tandem funktionieren, gibt es immer noch Meinungsverschiedenheiten über die Bedeutung dieser Behauptungen. Einige Probleme beim Nachweis dieser Theorien ergeben sich aus der Schwierigkeit, mit pharmakologischen Mitteln die Subtypen bestimmter NMDARs zu bestimmen. Darüber hinaus erklärt die Theorie der Variation der Untereinheiten nicht, wie dieser Effekt vorherrschen könnte, da weithin davon ausgegangen wird, dass das häufigste Tetramer, das aus zwei GluN1-Untereinheiten und je einer der Untereinheiten GluN2A und GluN2B besteht, einen hohen Prozentsatz der NMDARs ausmacht. ⓘ
Exzitotoxizität in einem klinischen Umfeld
Seit den späten 1950er Jahren geht man davon aus, dass Exzitotoxizität eine Rolle bei den degenerativen Eigenschaften neurodegenerativer Erkrankungen spielt. NMDA-Rezeptoren scheinen bei vielen dieser degenerativen Erkrankungen des Gehirns eine wichtige Rolle zu spielen. Vor allem exzitotoxische Ereignisse, an denen NMDA-Rezeptoren beteiligt sind, wurden mit der Alzheimer-Krankheit und der Huntington-Krankheit sowie mit anderen Erkrankungen wie Schlaganfällen und Epilepsie in Verbindung gebracht. Die Behandlung dieser Erkrankungen mit einem der vielen bekannten NMDA-Rezeptor-Antagonisten führt jedoch zu einer Vielzahl unerwünschter Nebenwirkungen, die zum Teil schwerwiegend sein können. Diese Nebenwirkungen werden zum Teil deshalb beobachtet, weil die NMDA-Rezeptoren nicht nur ein Signal für den Zelltod geben, sondern auch eine wichtige Rolle für die Vitalität der Zellen spielen. Eine Behandlung für diese Zustände könnte in der Blockierung von NMDA-Rezeptoren bestehen, die nicht an der Synapse zu finden sind. Eine Klasse von Exzitotoxizität bei Krankheiten sind Funktionsgewinn-Mutationen in GRIN2B und GRIN1, die mit kortikalen Fehlbildungen wie Polymikrogyrie einhergehen. ⓘ
Liganden
Agonisten
Die Aktivierung von NMDA-Rezeptoren erfordert die Bindung von Glutamat oder Aspartat (Aspartat stimuliert die Rezeptoren nicht so stark). Darüber hinaus benötigen NMDARs auch die Bindung des Co-Agonisten Glycin für die effiziente Öffnung des Ionenkanals, der Teil dieses Rezeptors ist. ⓘ
D-Serin hat sich ebenfalls als Co-Agonist des NMDA-Rezeptors erwiesen, und zwar mit noch größerer Wirksamkeit als Glycin. Es wird von der Serin-Racemase produziert und ist in denselben Bereichen wie die NMDA-Rezeptoren angereichert. Der Entzug von D-Serin kann die NMDA-vermittelte exzitatorische Neurotransmission in vielen Bereichen blockieren. Kürzlich wurde gezeigt, dass D-Serin sowohl von Neuronen als auch von Astrozyten freigesetzt werden kann, um NMDA-Rezeptoren zu regulieren. ⓘ
NMDA-Rezeptor (NMDAR)-vermittelte Ströme stehen in direktem Zusammenhang mit der Membrandepolarisation. NMDA-Agonisten weisen daher eine schnelle Mg2+-Entbindungskinetik auf, die die Wahrscheinlichkeit der Kanalöffnung mit der Depolarisation erhöht. Diese Eigenschaft ist von grundlegender Bedeutung für die Rolle des NMDA-Rezeptors bei Gedächtnis und Lernen, und es wurde vermutet, dass dieser Kanal ein biochemisches Substrat des Hebbschen Lernens ist, bei dem er als Koinzidenzdetektor für Membrandepolarisation und synaptische Übertragung fungieren kann. ⓘ
Beispiele
Einige bekannte NMDA-Rezeptor-Agonisten sind:
- Asparaginsäure (Aspartat) - endogener Glutamat-Agonist. Der Begriff N-Methyl-D-Aspartat (NMDA) ist teilweise von D-Aspartat abgeleitet.
- Glutaminsäure (Glutamat) - endogener Glutamat-Agonist
- Tetrazolylglycin - synthetischer Glutamat-Agonist
- Homocysteinsäure - endogener Agonist des Glutamatbereichs
- Ibotensäure - natürlich vorkommender Glutamat-Agonist, gefunden in Amanita muscaria
- Chinolinsäure (Chinolinat) - endogener Glutamat-Agonist
- Glycin - endogener Agonist der Glycinstelle
- Positive allosterische Modulatoren
- Cerebrosterol - endogener schwacher positiver allosterischer Modulator
- Cholesterin - endogener schwacher positiver allosterischer Modulator
- Dehydroepiandrosteron (DHEA) - endogener schwacher positiver allosterischer Modulator
- Dehydroepiandrosteron-Sulfat (DHEA-S) - endogener schwach positiver allosterischer Modulator
- Nebostinel (Neboglamin) - synthetischer positiver allosterischer Modulator der Glycinstelle
- Pregnenolonsulfat - endogener schwacher positiver allosterischer Modulator
- Polyamine
- Spermidin - endogener Agonist der Polyaminstelle
- Spermin - endogener Agonist der Polyaminstelle ⓘ
Neramexan

Ein Beispiel für ein Memantin-Derivat ist Neramexan, das durch die Untersuchung einer Reihe von Aminoalkyl-Cyclohexanen mit Memantin als Vorlage als NMDA-Rezeptor-Antagonisten entdeckt wurde. Neramexan bindet an der gleichen Stelle wie Memantin innerhalb des mit dem NMDA-Rezeptor verbundenen Kanals und mit vergleichbarer Affinität. Es zeigt auch eine sehr ähnliche Bioverfügbarkeit und Blockierungskinetik in vivo wie Memantin. Neramexane wurde für vier Indikationen, darunter die Alzheimer-Krankheit, in klinischen Studien geprüft. ⓘ
Partielle Agonisten

N-Methyl-D-Asparaginsäure (NMDA), nach der der NMDA-Rezeptor benannt wurde, ist ein partieller Agonist der aktiven oder Glutamat-Erkennungsstelle. ⓘ
3,5-Dibrom-L-phenylalanin, ein natürlich vorkommendes halogeniertes Derivat von L-Phenylalanin, ist ein schwacher partieller NMDA-Rezeptor-Agonist, der an der Glycinstelle wirkt. 3,5-Dibromo-L-Phenylalanin wurde als neuer therapeutischer Wirkstoffkandidat für die Behandlung neuropsychiatrischer Störungen und Krankheiten wie Schizophrenie und neurologischer Störungen wie ischämischer Schlaganfall und epileptische Anfälle vorgeschlagen. ⓘ
Andere partielle Agonisten des NMDA-Rezeptors, die an neuartigen Stellen wirken, wie Rapastinel (GLYX-13) und Apimostinel (NRX-1074), werden derzeit für die Entwicklung neuer Arzneimittel mit antidepressiver und analgetischer Wirkung ohne offensichtliche psychotomimetische Aktivitäten geprüft. ⓘ
Beispiele
- Aminocyclopropancarbonsäure (ACC) - synthetischer partieller Agonist der Glycinstelle
- Cycloserin (D-Cycloserin) - natürlich vorkommender partieller Agonist der Glycinstelle, der in Streptomyces orchidaceus gefunden wird
- HA-966 - synthetischer partieller Agonist mit schwachem Glycinanteil
- Homochinolinsäure - synthetischer partieller Agonist der Glutamatstelle
- N-Methyl-D-Asparaginsäure (NMDA) - synthetischer partieller Agonist an der Glutamat-Stelle ⓘ
Zu den positiv allosterischen Modulatoren gehören:
- Zelquistinel (AGN-241751) - synthetischer partieller Agonist mit neuem Wirkort
- Apimostinel (NRX-1074) - synthetischer partieller Agonist mit neuartigem Wirkort
- Rapastinel (GLYX-13) - synthetischer partieller Agonist mit neuartigem Wirkort ⓘ
Antagonisten
Antagonisten des NMDA-Rezeptors werden als Narkosemittel bei Tieren und manchmal auch bei Menschen eingesetzt und werden aufgrund ihrer halluzinogenen Eigenschaften häufig als Freizeitdrogen verwendet, zusätzlich zu ihren einzigartigen Wirkungen bei hohen Dosierungen, wie z. B. Dissoziation. Wenn bestimmte NMDA-Rezeptor-Antagonisten Nagetieren in hohen Dosen verabreicht werden, können sie eine Form von Hirnschäden, die so genannten Olney-Läsionen, verursachen. Zu den NMDA-Rezeptorantagonisten, die nachweislich Olney-Läsionen hervorrufen, gehören Ketamin, Phencyclidin und Dextrorphan (ein Metabolit von Dextromethorphan) sowie einige NMDA-Rezeptorantagonisten, die nur in der Forschung eingesetzt werden. Die bisher veröffentlichten Forschungsergebnisse zu den Olney-Läsionen sind nicht schlüssig, was das Auftreten von NMDA-Rezeptor-Antagonisten in menschlichem oder Affen-Gehirngewebe anbelangt. ⓘ
Bei den meisten NMDAR-Antagonisten handelt es sich um nicht-kompetitive oder nicht-kompetitive Blocker der Kanalpore oder um Antagonisten der Glycin-Koregulationsstelle und nicht um Antagonisten der aktiven/Glutamatstelle. ⓘ
Beispiele
Häufige Wirkstoffe, bei denen der NMDA-Rezeptor-Antagonismus der primäre oder ein Hauptwirkmechanismus ist:
- 4-Chlorokynurenin (AV-101) - Antagonist der Glycinstelle; Prodrug von 7-Chlorokynurensäure
- 7-Chlorokynurensäure - Glycin-Antagonist
- Agmatin - endogener Antagonist von Polyaminstellen
- Argiotoxin-636 - natürlich vorkommender Dizocilpin- oder verwandter Standortantagonist, der in Argiope-Gift gefunden wird
- AP5 - Glutamat-Antagonist
- AP7 - Glutamat-Antagonist
- CGP-37849 - Glutamat-Antagonist
- Delucemine (NPS-1506) - Dizocilpin oder Antagonist einer verwandten Stelle; abgeleitet von Argiotoxin-636
- Dextromethorphan (DXM) - Antagonist an der Dizocilpin-Stelle; Prodrug von Dextrorphan
- Dextrorphan (DXO) - Dizocilpin-Wirkstoffantagonist
- Dexanabinol - Dizocilpin-verwandter Wirkort-Antagonist
- Diethylether - unbekannter Wirkort-Antagonist
- Diphenidin - Dizocilpin-Standort-Antagonist
- Dizocilpin (MK-801) - Dizocilpin-Wirkort-Antagonist
- Eliprodil - Ifenprodil-Ortsantagonist
- Esketamin - Dizocilpin-Standort-Antagonist
- Hodgkinsin - undefinierter Wirkort-Antagonist
- Ifenprodil - Ifenprodil-Ortsantagonist
- Kaitocephalin - natürlich vorkommender Glutamat-Antagonist, gefunden in Eupenicillium shearii
- Ketamin - Dizocilpin-Antagonist
- Kynurensäure - endogener Antagonist der Glycinstelle
- Lanicemine - Dizocilpin-Antagonist mit niedrigem Wirkungsgrad
- LY-235959 - Glutamat-Antagonist
- Memantine - Dizocilpin-Antagonist mit niedrigem Trapping-Gehalt
- Methoxetamin - Dizocilpin-Wirkort-Antagonist
- Midafotel - Glutamat-Antagonist
- Distickstoffoxid (N2O) - Antagonist mit unbestimmtem Wirkort
- PEAQX - Glutamat-Antagonist
- Perzinfotel - Glutamat-Antagonist
- Phencyclidin (PCP) - Dizocilpin-Antagonist
- Phenylalanin - eine natürlich vorkommende Aminosäure, Antagonist der Glycinstelle
- Psychotridin - unbestimmter Wirkort-Antagonist
- Selfotel - Glutamat-Antagonist
- Tiletamin - Dizocilpin-Antagonist
- Traxoprodil - Ifenprodil-Ortsantagonist
- Xenon - unbekannter Wirkort-Antagonist ⓘ
Zu den häufigen Wirkstoffen, bei denen ein schwacher NMDA-Rezeptor-Antagonismus eine sekundäre oder zusätzliche Wirkung ist, gehören:
- Amantadin - ein antivirales und antiparkinsonistisches Medikament; Dizocilpin-Antagonist mit niedrigem Wirkungsspektrum
- Atomoxetin - ein Norepinephrin-Wiederaufnahmehemmer zur Behandlung von ADHS
- Dextropropoxyphen - ein opioides Analgetikum
- Ethanol (Alkohol) - ein Euphorisierungs-, Beruhigungs- und Anxiolytikum, das in der Freizeit verwendet wird; unbekannter Wirkort-Antagonist
- Guaifenesin - ein schleimlösendes Mittel
- Huperzin A - ein natürlich vorkommender Acetylcholinesterase-Hemmer und potenzielles Antidementivum
- Ibogain - ein natürlich vorkommendes Halluzinogen und ein Mittel, das süchtig macht
- Ketobemidon - ein Opioid-Analgetikum
- Methadon - ein Opioid-Analgetikum
- Minocyclin - ein Antibiotikum
- Tramadol - ein atypisches Opioid-Analgetikum und Serotonin-freisetzendes Mittel ⓘ
Nitromemantin
Der NMDA-Rezeptor wird durch Nitrosylierung reguliert, und Aminoadamantan kann als zielgerichtetes Shuttle verwendet werden, um Stickstoffoxid (NO) in die Nähe der Stelle im NMDA-Rezeptor zu bringen, wo es nitrosylieren und die Leitfähigkeit des Ionenkanals regulieren kann. Ein NO-Donator, der zur Verringerung der NMDA-Rezeptoraktivität eingesetzt werden kann, ist das Alkylnitrat Nitroglycerin. Im Gegensatz zu vielen anderen NO-Donatoren haben Alkylnitrate keine potenziell NO-assoziierten neurotoxischen Wirkungen. Alkylnitrate spenden NO in Form einer Nitrogruppe, wie in Abbildung 7 zu sehen, -NO2-, die ein sicherer Donor ist, der Neurotoxizität vermeidet. Die Nitrogruppe muss auf den NMDA-Rezeptor ausgerichtet sein, da andernfalls andere Wirkungen von NO wie die Erweiterung von Blutgefäßen und die daraus resultierende Hypotonie auftreten könnten. Nitromemantin ist ein Memantin-Derivat der zweiten Generation, das die Exzitotoxizität, die durch eine Überaktivierung des glutamatergen Systems entsteht, durch Blockierung des NMDA-Rezeptors reduziert, ohne die Sicherheit zu beeinträchtigen. Vorläufige Studien an Tiermodellen zeigen, dass Nitromemantine als Neuroprotektiva sowohl in vitro als auch in vivo wirksamer sind als Memantin. Memantin und neuere Derivate könnten zu sehr wichtigen Waffen im Kampf gegen neuronale Schäden werden. ⓘ

Zu den negativen allosterischen Modulatoren gehören:
- 25-Hydroxycholesterin - endogener schwacher negativer allosterischer Modulator
- Conantokine - natürlich vorkommende negative allosterische Modulatoren der Polyaminstelle in Conus geographus ⓘ
Modulatoren
Beispiele
Der NMDA-Rezeptor wird durch eine Reihe von endogenen und exogenen Verbindungen moduliert:
- Es hat sich gezeigt, dass Aminoglykoside eine ähnliche Wirkung wie Polyamine haben, was ihre neurotoxische Wirkung erklären könnte.
- CDK5 reguliert die Menge der NR2B-haltigen NMDA-Rezeptoren an der synaptischen Membran und beeinflusst damit die synaptische Plastizität.
- Polyamine aktivieren die NMDA-Rezeptoren nicht direkt, sondern verstärken oder hemmen die Glutamat-vermittelten Reaktionen.
- Reelin moduliert die NMDA-Funktion über Kinasen der Src-Familie und DAB1. und verstärkt so die LTP im Hippocampus.
- Die Src-Kinase erhöht die NMDA-Rezeptorströme.
- Na+, K+ und Ca2+ passieren nicht nur den NMDA-Rezeptorkanal, sondern modulieren auch die Aktivität von NMDA-Rezeptoren.
- Zn2+ und Cu2+ blockieren im Allgemeinen die NMDA-Stromaktivität auf nichtkompetitive und spannungsunabhängige Weise. Allerdings kann Zink den Strom je nach neuronaler Aktivität verstärken oder hemmen.
- Pb2+ ist ein starker NMDAR-Antagonist. Präsynaptische Defizite, die sich aus einer Pb2+-Exposition während der Synaptogenese ergeben, werden durch eine Unterbrechung der NMDAR-abhängigen BDNF-Signalübertragung vermittelt.
- Proteine der Klasse I des Haupthistokompatibilitätskomplexes sind endogene negative Regulatoren von NMDAR-vermittelten Strömen im erwachsenen Hippocampus und werden für entsprechende NMDAR-induzierte Veränderungen im AMPAR-Trafficking und NMDAR-abhängige synaptische Plastizität sowie Lernen und Gedächtnis benötigt.
- Die Aktivität von NMDA-Rezeptoren reagiert auch auffallend empfindlich auf Änderungen des pH-Werts und wird unter physiologischen Bedingungen teilweise durch die Umgebungskonzentration von H+ gehemmt. Der Grad der Hemmung durch H+ ist bei Rezeptoren des NR1a-Subtyps, der das positiv geladene Insert Exon 5 enthält, stark reduziert. Die Wirkung dieses Inserts kann von positiv geladenen Polyaminen und Aminoglykosiden nachgeahmt werden, was ihre Wirkungsweise erklärt.
- Die Funktion des NMDA-Rezeptors wird auch stark durch chemische Reduktion und Oxidation reguliert, und zwar über die so genannte "redox modulatory site". Über diese Stelle verstärken Reduktionsmittel die Aktivität des NMDA-Kanals drastisch, während Oxidationsmittel entweder die Wirkung der Reduktionsmittel umkehren oder die nativen Reaktionen unterdrücken. Es wird allgemein angenommen, dass NMDA-Rezeptoren durch endogene Redoxmittel wie Glutathion, Liponsäure und den essentiellen Nährstoff Pyrrolochinolinchinon moduliert werden. ⓘ
Entwicklung von NMDA-Rezeptor-Antagonisten
Das Hauptproblem bei der Entwicklung von NMDA-Antagonisten für die Neuroprotektion besteht darin, dass die physiologische NMDA-Rezeptoraktivität für die normale neuronale Funktion unerlässlich ist. Eine vollständige Blockade der gesamten NMDA-Rezeptoraktivität führt zu Nebenwirkungen wie Halluzinationen, Erregung und Narkose. Um klinisch relevant zu sein, muss ein NMDA-Rezeptor-Antagonist seine Wirkung auf die Blockierung einer übermäßigen Aktivierung beschränken, ohne die normale Funktion des Rezeptors einzuschränken. ⓘ
Kompetitive NMDA-Rezeptor-Antagonisten
Kompetitive NMDA-Rezeptorantagonisten, die zuerst entwickelt wurden, sind keine gute Option, da sie mit dem Agonisten Glutamat konkurrieren und an die gleiche Stelle (NR2-Untereinheit) des Rezeptors binden und daher auch die normale Funktion blockieren. Sie blockieren gesunde Bereiche des Gehirns, bevor sie sich auf pathologische Bereiche auswirken, da gesunde Bereiche geringere Mengen des Agonisten enthalten als pathologische Bereiche. Diese Antagonisten können durch hohe Glutamatkonzentrationen, die unter exzitotoxischen Umständen auftreten können, vom Rezeptor verdrängt werden. ⓘ
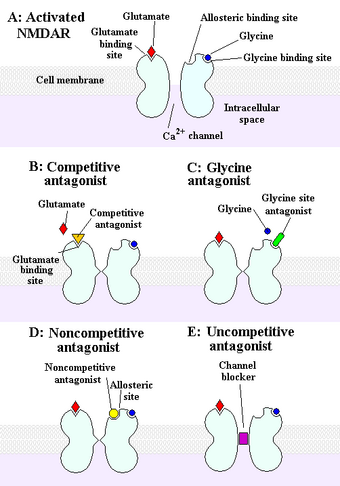
Nichtkompetitive NMDA-Rezeptorantagonisten
Nichtkompetitive NMDA-Rezeptorantagonisten blockieren innerhalb des Ionenkanals an der Mg2+-Stelle (Porenbereich) und verhindern den übermäßigen Zufluss von Ca2+. Nichtkompetitiver Antagonismus bezieht sich auf eine Art von Blockierung, die durch eine erhöhte Glutamatkonzentration nicht überwunden werden kann und die von einer vorherigen Aktivierung des Rezeptors durch den Agonisten abhängt, d. h. es gelangt nur in den Kanal, wenn dieser durch den Agonisten geöffnet wird. ⓘ
Memantin und verwandte Verbindungen

Aufgrund dieser unerwünschten Nebenwirkungen von Blockern mit hoher Affinität wurde die Suche nach klinisch erfolgreichen NMDA-Rezeptorantagonisten für neurodegenerative Erkrankungen fortgesetzt und konzentrierte sich auf die Entwicklung von Blockern mit niedriger Affinität. Allerdings durfte die Affinität nicht zu niedrig und die Verweildauer nicht zu kurz sein (wie bei Mg2+), damit die Membrandepolarisation die Blockade aufhebt. Die Entdeckung war also die Entwicklung eines nichtkompetitiven Antagonisten mit einer längeren Verweildauer als Mg2+ im Kanal, aber kürzer als MK-801. Auf diese Weise würde das erhaltene Medikament nur übermäßig geöffnete NMDA-Rezeptor-assoziierte Kanäle blockieren, nicht aber die normale Neurotransmission. Memantin ist dieses Medikament. Es ist ein Derivat von Amantadin, das zunächst als Grippemittel eingesetzt wurde, dessen Wirksamkeit bei der Parkinson-Krankheit aber später zufällig entdeckt wurde. Die chemischen Strukturen von Memantin und Amantadin sind in Abbildung 5 dargestellt. Zunächst wurde angenommen, dass es sich um ein dopaminerges oder anticholinerges Mittel handelt, später stellte sich heraus, dass es ein NMDA-Rezeptor-Antagonist ist. ⓘ
Memantin ist das erste Medikament, das für die Behandlung der schweren und fortgeschrittenen Alzheimer-Krankheit zugelassen wurde, bei der zum Beispiel Anticholinergika nicht viel bewirken. Es trägt zur Wiederherstellung der synaptischen Funktion bei und verbessert auf diese Weise das beeinträchtigte Gedächtnis und Lernen. Im Jahr 2015 wurde Memantin auch für weitere neurologische Erkrankungen geprüft. ⓘ
Zahlreiche Memantin-Derivate der zweiten Generation befinden sich in der Entwicklung, die möglicherweise noch bessere neuroprotektive Wirkungen zeigen, wobei der Hauptgedanke darin besteht, neben dem zugehörigen Ionenkanal auch andere sichere, aber wirksame Modulationsstellen am NMDA-Rezeptor zu nutzen. ⓘ
Struktur-Aktivitäts-Beziehung (SAR)

Memantin (1-Amino-3,5-dimethyladamantan) ist ein Aminoalkyl-Cyclohexan-Derivat und ein atypischer Wirkstoff mit nicht planarer, dreidimensionaler trizyklischer Struktur. Abbildung 8 zeigt die SAR für das Aminoalkyl-Cyclohexan-Derivat. Memantin weist in seiner Struktur mehrere für seine Wirksamkeit wichtige Merkmale auf:
- Drei-Ring-Struktur mit einem Brückenkopf-Amin, -NH2
- Die -NH2-Gruppe wird unter dem physiologischen pH-Wert des Körpers protoniert und trägt eine positive Ladung, -NH3+
- Zwei Methyl-(CH3)-Seitengruppen, die dazu dienen, die Verweildauer zu verlängern und die Stabilität sowie die Affinität für den NMDA-Rezeptorkanal im Vergleich zu Amantadin (1-Adamantanamin) zu erhöhen. ⓘ
Trotz des geringen strukturellen Unterschieds zwischen Memantin und Amantadin, zwei Adamantan-Derivaten, ist die Affinität für die Bindungsstelle der NR1/NR2B-Untereinheit für Memantin viel größer. Bei Patch-Clamp-Messungen hat Memantin eine IC50 von (2,3+0,3) μM, während Amantadin eine IC50 von (71,0+11,1) μM hat. Die Bindungsstelle mit der höchsten Affinität wird als dominante Bindungsstelle bezeichnet. Es handelt sich um eine Verbindung zwischen der Amingruppe von Memantin und der NR1-N161-Bindungstasche der NR1/NR2B-Untereinheit. Die Methyl-Seitengruppen spielen eine wichtige Rolle bei der Erhöhung der Affinität zu den offenen NMDA-Rezeptorkanälen und machen es zu einem wesentlich besseren neuroprotektiven Medikament als Amantadin. Die Bindungstaschen für die Methylgruppen befinden sich an den NR1-A645 und NR2B-A644 des NR1/NR2B. Die Bindungstaschen sind in Abbildung 2 dargestellt. Memantin bindet an oder in der Nähe der Mg2+-Stelle innerhalb des mit dem NMDA-Rezeptor verbundenen Kanals. Die -NH2-Gruppe auf Memantin, die bei physiologischem pH-Wert im Körper protoniert wird, stellt den Bereich dar, der an oder in der Nähe der Mg2+-Stelle bindet. Es hat sich gezeigt, dass das Hinzufügen von zwei Methylgruppen zur -N-Gruppe der Memantin-Struktur die Affinität verringert und einen IC50-Wert von (28,4+1,4) μM ergibt. ⓘ
Derivate der zweiten Generation von Memantin; Nitromemantin
Mehrere Derivate von Nitromemantin, einem Derivat der zweiten Generation von Memantin, wurden synthetisiert, um eine detaillierte Struktur-Aktivitäts-Beziehung (SAR) dieser neuen Arzneimittel zu untersuchen. Eine Klasse, die eine dem Brückenkopf-Amin (NH2) gegenüberliegende Nitrogruppe (NO2) enthält, zeigte ein vielversprechendes Ergebnis. Nitromemantin nutzt die Memantin-Bindungsstelle am NMDA-Rezeptor, um die NOx-Gruppe (X= 1 oder 2) für eine Interaktion mit der S-Nitrosylierungs-/Redoxstelle außerhalb der Memantin-Bindungsstelle zu nutzen. Die Verlängerung der Seitenketten von Memantin kompensiert die schlechtere Arzneimittelaffinität im Kanal, die mit der Hinzufügung der -ONO2-Gruppe verbunden ist. ⓘ
Therapeutische Anwendung
Es wird angenommen, dass Exzitotoxizität bei einigen neurodegenerativen Erkrankungen wie der Alzheimer-Krankheit, der Parkinson-Krankheit, der Huntington-Krankheit und der amyotrophen Lateralsklerose eine Rolle spielt. Die Blockierung von NMDA-Rezeptoren könnte daher theoretisch bei der Behandlung solcher Krankheiten von Nutzen sein. Es ist jedoch wichtig, die physiologische Aktivität der NMDA-Rezeptoren zu erhalten und gleichzeitig zu versuchen, ihre übermäßige, exzitotoxische Aktivität zu blockieren. Dies kann möglicherweise durch nichtkompetitive Antagonisten erreicht werden, die den Ionenkanal des Rezeptors blockieren, wenn dieser übermäßig geöffnet ist. ⓘ
Memantin ist ein Beispiel für einen nicht-kompetitiven NMDA-Rezeptor-Antagonisten, der für die neurodegenerative Krankheit Alzheimer zugelassen ist. Im Jahr 2015 befindet sich Memantin noch in der klinischen Prüfung für weitere neurologische Erkrankungen. ⓘ
Modulation des Rezeptors
Der NMDA-Rezeptor ist ein unspezifischer Kationenkanal, der den Durchgang von Ca2+ und Na+ in die Zelle und von K+ aus der Zelle ermöglichen kann. Das exzitatorische postsynaptische Potenzial (EPSP), das durch die Aktivierung eines NMDA-Rezeptors entsteht, erhöht die Ca2+-Konzentration in der Zelle. Das Ca2+ kann wiederum als zweiter Bote in verschiedenen Signalwegen fungieren. Der Kationenkanal des NMDA-Rezeptors wird jedoch bei ruhendem Membranpotenzial durch Mg2+ blockiert. Magnesium hebt die Blockade nicht sofort auf; um alle verfügbaren Kanäle freizugeben, muss die postsynaptische Zelle für einen ausreichend langen Zeitraum (im Bereich von Millisekunden) depolarisiert werden. ⓘ
Daher funktioniert der NMDA-Rezeptor als "molekularer Zufallsdetektor". Sein Ionenkanal öffnet sich nur, wenn die folgenden beiden Bedingungen erfüllt sind: Glutamat ist an den Rezeptor gebunden, und die postsynaptische Zelle ist depolarisiert (wodurch das Mg2+, das den Kanal blockiert, entfernt wird). Diese Eigenschaft des NMDA-Rezeptors erklärt viele Aspekte der Langzeitpotenzierung (LTP) und der synaptischen Plastizität. ⓘ
Bei einem Ruhemembranpotenzial ist die Pore des NMDA-Rezeptors geöffnet und ermöglicht den Zufluss externer Magnesiumionen, die sich an den Kanal binden, um eine weitere Ionenpermeation zu verhindern. Externe Magnesiumionen liegen im millimolaren Bereich, während intrazelluläre Magnesiumionen im mikromolaren Bereich liegen, was zu einem negativen Membranpotential führt. NMDA-Rezeptoren werden durch eine Reihe von endogenen und exogenen Verbindungen moduliert und spielen eine Schlüsselrolle bei einer Vielzahl von physiologischen (z. B. Gedächtnis) und pathologischen Prozessen (z. B. Exzitotoxizität). Magnesium potenziert die NMDA-induzierten Reaktionen bei positiven Membranpotenzialen und blockiert gleichzeitig den NMDA-Kanal. Kalzium, Kalium und Natrium werden verwendet, um die Aktivität von NMDARs, die die NMDA-Membran passieren, zu modulieren. Änderungen der H+-Konzentration können die Aktivität von NMDA-Rezeptoren unter verschiedenen physiologischen Bedingungen teilweise hemmen. ⓘ
Klinische Bedeutung
NMDAR-Antagonisten wie Ketamin, Esketamin, Tiletamin, Phencyclidin, Distickstoffoxid und Xenon werden als Allgemeinanästhetika eingesetzt. Diese und ähnliche Drogen wie Dextromethorphan und Methoxetamin haben auch dissoziative, halluzinogene und euphorisierende Wirkungen und werden als Freizeitdrogen verwendet. ⓘ
Gegen NMDAR gerichtete Wirkstoffe wie Ketamin, Esketamin (JNJ-54135419), Rapastinel (GLYX-13), Apimostinel (NRX-1074), Zelquistinel (AGN-241751), 4-Chlorkynurenin (AV-101) und Rislenemdaz (CERC-301, MK-0657) werden derzeit für die Behandlung von Gemütskrankheiten, einschließlich schwerer Depressionen und behandlungsresistenter Depressionen, entwickelt. Darüber hinaus wird Ketamin in einigen Kliniken bereits als Off-Label-Therapie zu diesem Zweck eingesetzt. ⓘ
Forschungsergebnisse deuten darauf hin, dass Tianeptin antidepressive Wirkungen durch indirekte Veränderung und Hemmung der Glutamatrezeptoraktivität und der Freisetzung von BDNF hervorruft, was wiederum die neuronale Plastizität beeinflusst. Tianeptin wirkt auch auf die NMDA- und AMPA-Rezeptoren. In Tiermodellen hemmt Tianeptin die pathologischen, durch Stress ausgelösten Veränderungen der glutamatergen Neurotransmission in der Amygdala und im Hippocampus. ⓘ
Memantin, ein NMDAR-Antagonist mit niedrigem Wirkungsgrad, ist in den Vereinigten Staaten und in Europa für die Behandlung der mittelschweren bis schweren Alzheimer-Krankheit zugelassen und hat jetzt vom britischen National Institute for Health and Care Excellence eine begrenzte Empfehlung für Patienten erhalten, bei denen andere Behandlungsmöglichkeiten versagen. ⓘ
Cochleäre NMDARs sind Gegenstand intensiver Forschung, um pharmakologische Lösungen für die Behandlung von Tinnitus zu finden. NMDARs werden mit einer seltenen Autoimmunerkrankung in Verbindung gebracht, der Anti-NMDA-Rezeptor-Enzephalitis (auch als NMDAR-Enzephalitis bekannt), die in der Regel auf eine Kreuzreaktivität von Antikörpern zurückzuführen ist, die das Immunsystem gegen ektopisches Hirngewebe produziert, wie es z. B. in Teratomen vorkommt. Diese sind als Anti-Glutamat-Rezeptor-Antikörper bekannt. ⓘ
Im Vergleich zu dopaminergen Stimulanzien wie Methamphetamin kann der NMDAR-Antagonist Phencyclidin bei gesunden Probanden ein breiteres Spektrum von Symptomen hervorrufen, die der Schizophrenie ähneln, was zur Glutamat-Hypothese der Schizophrenie geführt hat. Experimente, bei denen Nagetiere mit NMDA-Rezeptor-Antagonisten behandelt werden, sind heute das gängigste Modell, wenn es darum geht, neue Schizophrenie-Therapien zu testen oder den genauen Mechanismus von bereits für die Behandlung von Schizophrenie zugelassenen Medikamenten zu erforschen. ⓘ
NMDAR-Antagonisten wie Eliprodil, Gavestinel, Licostinel und Selfotel wurden ausgiebig für die Behandlung der durch Exzitotoxizität vermittelten Neurotoxizität in Situationen wie ischämischem Schlaganfall und traumatischen Hirnverletzungen untersucht, waren aber in klinischen Versuchen, die in geringen Dosen zur Vermeidung von Sedierung durchgeführt wurden, nicht erfolgreich. Diese Anwendung wurde noch nicht in klinischen Studien getestet. ⓘ
Name
Der Name „NMDA-Rezeptor“ rührt daher, dass diese Rezeptoren durch die Bindung des für sie spezifischen Partialagonisten N-Methyl-D-Aspartat (NMDA) aktiviert werden können, der zwar im Körper normalerweise nicht vorkommt, im Experiment aber ebenso wie der „Originalagonist“ Glutamat zur Öffnung der Ionenkanal-Untereinheit des Rezeptors führt. ⓘ
Wirkung von Alkohol auf den NMDA-Rezeptor
Bindet Alkohol (Ethanol) am NMDA-Rezeptor, so wird der Einstrom von Calcium-Ionen vermindert. Somit nimmt die Frequenz exzitatorischer Potentiale ab, Alkohol reduziert folglich die Wirkung des wichtigsten exzitatorischen Systems, wobei gleichzeitig die Funktion des wichtigsten inhibitorischen Systems (GABA) durch die Bindung an den GABA-Rezeptor verstärkt wird. Die alkoholinduzierte Blockade des NMDA-Rezeptors wird unter anderem mit Gedächtnisstörungen nach exzessivem Alkoholkonsum in Verbindung gebracht. Bei übermäßigem oder langfristigem Alkoholkonsum steigt die Zahl der NMDA-Rezeptoren an, wobei gleichzeitig der Calciumeinstrom zunimmt. Diese Gegenregulierung führt beim Alkoholentzug zu Entzugserscheinungen, da es beim Wegfall der Hemmung des NMDA-Rezeptors zu einer Überfunktion des exzitatorischen Systems kommt, was sich in Form von Unruhe, Angst oder Schlaflosigkeit zeigt. ⓘ


