Carbamazepin
 | |
 | |
| Klinische Daten | |
|---|---|
| Handelsnamen | Tegretol, Temporol, Neurotol, andere |
| AHFS/Drugs.com | Monographie |
| MedlinePlus | a682237 |
| Lizenz-Daten |
|
| Schwangerschaft Kategorie |
|
| Wege der Verabreichung | Durch den Mund |
| Wirkstoffklasse | Antikonvulsivum |
| ATC-Code |
|
| Rechtlicher Status | |
| Rechtlicher Status |
|
| Pharmakokinetische Daten | |
| Bioverfügbarkeit | ~100% |
| Proteinbindung | 70–80% |
| Verstoffwechselung | Leber (CYP3A4) |
| Stoffwechselprodukte | Aktive Epoxidform (Carbamazepin-10,11-Epoxid) |
| Eliminationshalbwertszeit | 36 Stunden (Einzeldosis), 16-24 Stunden (wiederholte Verabreichung) |
| Ausscheidung | Urin (72%), Fäkalien (28%) |
| Bezeichnungen | |
IUPAC-Bezeichnung
| |
| CAS-Nummer | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Chemische und physikalische Daten | |
| Formel | C15H12N2O |
| Molare Masse | 236,274 g-mol-1 |
| 3D-Modell (JSmol) | |
SMILES
| |
InChI
| |
| (Überprüfen) | |
Carbamazepin (CBZ), das unter anderem unter dem Handelsnamen Tegretol vertrieben wird, ist ein Antikonvulsivum, das hauptsächlich zur Behandlung von Epilepsie und neuropathischen Schmerzen eingesetzt wird. Es wird als Zusatztherapie bei Schizophrenie zusammen mit anderen Medikamenten und als Mittel der zweiten Wahl bei bipolarer Störung eingesetzt. Carbamazepin scheint bei fokalen und generalisierten Anfällen ebenso gut zu wirken wie Phenytoin und Valproat. Es ist nicht wirksam bei abwesenden oder myoklonischen Anfällen. ⓘ
Carbamazepin wurde 1953 von dem Schweizer Chemiker Walter Schindler entdeckt. Es wurde erstmals 1962 auf den Markt gebracht. Es ist als Generikum erhältlich. Es steht auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation. Im Jahr 2018 war es mit mehr als 2 Millionen Verschreibungen das 204. am häufigsten verschriebene Medikament in den Vereinigten Staaten. Die neueren, aber strukturell verwandten Medikamente Oxcarbazepin und Eslicarbazepinacetat weisen beide ähnliche Wechselwirkungen, Nebenwirkungen und Wirkprofile auf. ⓘ
| Strukturformel ⓘ | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Carbamazepin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C15H12N2O | |||||||||||||||
| Kurzbeschreibung |
weißes bis fast weißes, kristallines und polymorphes Pulver | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
N03AF01 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus |
Blockade der Natriumkanäle | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 236,27 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt |
| |||||||||||||||
| Löslichkeit |
sehr schwer löslich in Wasser (205 mg·l−1), leicht löslich in Dichlormethan, wenig löslich in Aceton und Ethanol 96 % | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten |
114 mg·kg−1 (LD50, Maus, i.p.) | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Carbamazepin zählt chemisch zur Klasse der Dibenzazepine und ist ein Antikonvulsivum, das vorwiegend gegen fokale Epilepsien eingesetzt wird. Darüber hinaus wird es auch als Phasenprophylaktikum bei verschiedenen psychiatrischen Erkrankungen eingesetzt. Strukturchemisch ist es dem Imipramin ähnlich. ⓘ
Medizinische Anwendungen

Carbamazepin wird in der Regel zur Behandlung von Anfallsleiden und neuropathischen Schmerzen eingesetzt. Es wird außerhalb der Zulassung als Zweitlinientherapie bei bipolaren Störungen und in Kombination mit einem Antipsychotikum in einigen Fällen von Schizophrenie eingesetzt, wenn die Behandlung mit einem herkömmlichen Antipsychotikum allein versagt hat. Allerdings gibt es keine Belege für diese Anwendung. Es ist nicht wirksam bei Absence-Anfällen oder myoklonischen Anfällen. Obwohl Carbamazepin im Vergleich zu Phenytoin und Valproat eine ähnliche Wirksamkeit (gemessen an der Zahl der Patienten, die das Medikament weiter einnehmen) und Effizienz (gemessen an der Verringerung von Anfallsrezidiven und der Verbesserung der Remission) aufweist, sollte die Wahl des Medikaments individuell getroffen werden, da weitere Forschung erforderlich ist, um festzustellen, welches Medikament für Menschen mit neu auftretenden Anfällen am hilfreichsten ist. ⓘ
In den Vereinigten Staaten sind die von der FDA zugelassenen medizinischen Anwendungen Epilepsie (einschließlich partieller Anfälle, generalisierter tonisch-klonischer Anfälle und gemischter Anfälle), Trigeminusneuralgie sowie manische und gemischte Episoden der Bipolar-I-Störung. Carbamazepin ist das einzige von der FDA zugelassene Medikament zur Behandlung der Trigeminusneuralgie. ⓘ
Das Medikament soll auch bei ADHS wirksam sein. ⓘ
Seit 2014 steht eine Formulierung mit kontrollierter Freisetzung zur Verfügung, für die es vorläufige Hinweise auf weniger Nebenwirkungen und unklare Hinweise darauf gibt, ob es einen Unterschied in der Wirksamkeit gibt. ⓘ
Neben der Behandlung von Epilepsien ist eine weitere wichtige Indikation für Carbamazepin die Behandlung bei affektiven Störungen wie Manie. Indiziert ist es vor allem zur Akutbehandlung von Manien und schizomanischen Episoden sowie zur Phasenprophylaxe bipolarer und schizoaffektiver Störungen, wird allerdings zunehmend von moderneren Präparaten verdrängt. Darüber hinaus wird Carbamazepin zum Schutz vor Entzugsanfällen im Benzodiazepin- und Alkoholentzug eingesetzt. Carbamazepin wird auch zur Therapie einer Trigeminusneuralgie verwendet. ⓘ
Es kann auch bei starken Stimmungsschwankungen und Autoaggression in der Therapie der Borderline-Persönlichkeitsstörung angewendet werden. Des Weiteren spielt seine Anwendung als Koanalgetikum bei neuropathischen Schmerzen eine gewichtige Rolle. ⓘ
Unerwünschte Wirkungen
In den USA enthält die Packungsbeilage für Carbamazepin Warnhinweise in Bezug auf:
- Auswirkungen auf die körpereigene Produktion von roten Blutkörperchen, weißen Blutkörperchen und Blutplättchen: Selten wird über schwerwiegende Auswirkungen wie aplastische Anämie und Agranulozytose berichtet, häufiger kommt es zu geringfügigen Veränderungen, wie z. B. einer verminderten Anzahl weißer Blutkörperchen oder Blutplättchen, die sich jedoch nicht zu ernsteren Problemen entwickeln.
- Erhöhtes Risiko für Selbstmord
- erhöhtes Risiko einer Hyponatriämie und SIADH
- Risiko von Krampfanfällen, wenn die Person die Einnahme des Arzneimittels abrupt beendet
- Risiken für den Fötus bei schwangeren Frauen, insbesondere angeborene Missbildungen wie Spina bifida und Entwicklungsstörungen. ⓘ
Häufige unerwünschte Wirkungen können Schläfrigkeit, Schwindel, Kopfschmerzen und Migräne, motorische Koordinationsstörungen, Übelkeit, Erbrechen und/oder Verstopfung sein. Alkoholkonsum während der Einnahme von Carbamazepin kann zu einer verstärkten Depression des zentralen Nervensystems führen. Zu den weniger häufigen Nebenwirkungen gehören ein erhöhtes Risiko von Krampfanfällen bei Menschen mit gemischten Anfallsleiden, Herzrhythmusstörungen, verschwommenes oder doppeltes Sehen. In seltenen Fällen wurde auch über eine auditorische Nebenwirkung berichtet, bei der die Patienten Töne etwa einen Halbton tiefer als zuvor wahrnehmen; diese ungewöhnliche Nebenwirkung wird von den meisten Menschen nicht bemerkt und verschwindet, wenn die Person die Einnahme von Carbamazepin beendet. ⓘ
Pharmakogenetik
Schwerwiegende Hautreaktionen wie das Stevens-Johnson-Syndrom (SJS) oder die toxische epidermale Nekrolyse (TEN), die auf eine Carbamazepin-Therapie zurückzuführen sind, treten bei Personen mit einer bestimmten Genvariante (Allel) des humanen Leukozytenantigens, HLA-B*1502, häufiger auf. Die Odds Ratios für die Entwicklung von SJS oder TEN bei Menschen, die dieses Allel tragen, können im zwei-, drei- oder sogar vierstelligen Bereich liegen, je nach untersuchter Population. HLA-B*1502 kommt fast ausschließlich bei Menschen mit Vorfahren aus weiten Teilen Asiens vor, während es in europäischen, japanischen, koreanischen und afrikanischen Populationen nur sehr selten oder gar nicht vorkommt. Es hat sich jedoch gezeigt, dass das HLA-A*31:01-Allel bei Japanern, Chinesen, Koreanern und Europäern ein starker Prädiktor sowohl für leichte als auch für schwere unerwünschte Reaktionen auf Carbamazepin ist, wie z. B. die DRESS-Form schwerer Hautreaktionen. Es wird vermutet, dass Carbamazepin als starkes Antigen wirkt, das sich an den Antigen-präsentierenden Bereich von HLA-B*1502 bindet und ein immerwährendes Aktivierungssignal auf unreifen CD8-T-Zellen auslöst, was zu weit verbreiteten zytotoxischen Reaktionen wie SJS/TEN führt. ⓘ
Wechselwirkungen
Carbamazepin kann zu Arzneimittelwechselwirkungen führen. Zu den Arzneimitteln, die den Abbau von Carbamazepin vermindern oder dessen Spiegel anderweitig erhöhen, gehören Erythromycin, Cimetidin, Propoxyphen und Kalziumkanalblocker. Grapefruitsaft erhöht die Bioverfügbarkeit von Carbamazepin durch Hemmung des Enzyms CYP3A4 in der Darmwand und in der Leber. Bei gleichzeitiger Verabreichung von Phenobarbital, Phenytoin oder Primidon werden niedrigere Carbamazepin-Spiegel beobachtet, was zu einem Durchbruch der Anfallsaktivität führen kann. ⓘ
Valproinsäure und Valnoctamid hemmen beide die mikrosomale Epoxidhydrolase (mEH), das Enzym, das für den Abbau des aktiven Metaboliten Carbamazepin-10,11-epoxid in inaktive Metaboliten verantwortlich ist. Durch die Hemmung der mEH verursachen Valproinsäure und Valnoctamid eine Anhäufung des aktiven Metaboliten, wodurch die Wirkung von Carbamazepin verlängert und seine Ausscheidung verzögert wird. ⓘ
Carbamazepin kann als Induktor von Cytochrom-P450-Enzymen die Clearance vieler Arzneimittel erhöhen, wodurch ihre Konzentration im Blut auf subtherapeutische Werte sinkt und ihre gewünschten Wirkungen verringert werden. Zu den Arzneimitteln, die unter Carbamazepin schneller metabolisiert werden, gehören Warfarin, Lamotrigin, Phenytoin, Theophyllin, Valproinsäure, viele Benzodiazepine und Methadon. Carbamazepin erhöht auch den Metabolismus der Hormone in Antibabypillen und kann deren Wirksamkeit verringern, was zu unerwarteten Schwangerschaften führen kann. ⓘ
Pharmakologie
Mechanismus der Wirkung
Carbamazepin ist ein Natriumkanalblocker. Es bindet bevorzugt an spannungsabhängige Natriumkanäle in deren inaktiver Konformation, was die wiederholte und anhaltende Auslösung eines Aktionspotenzials verhindert. Carbamazepin hat Auswirkungen auf das Serotoninsystem, doch ist die Bedeutung für die Antiseizureffekte ungewiss. Es gibt Hinweise darauf, dass Carbamazepin ein Serotonin-freisetzender Wirkstoff und möglicherweise sogar ein Serotonin-Wiederaufnahme-Hemmer ist. Es wurde vermutet, dass Carbamazepin auch spannungsabhängige Kalziumkanäle blockieren kann, wodurch die Freisetzung von Neurotransmittern verringert wird. ⓘ
Pharmakokinetik

Carbamazepin wird nach oraler Einnahme relativ langsam, aber praktisch vollständig resorbiert. Die höchsten Konzentrationen im Blutplasma werden je nach Darreichungsform nach 4 bis 24 Stunden erreicht. Tabletten mit langsamer Wirkstofffreisetzung führen zu einer etwa 15 % geringeren Absorption und zu 25 % niedrigeren Plasmaspitzenkonzentrationen als herkömmliche Tabletten sowie zu geringeren Konzentrationsschwankungen, jedoch nicht zu wesentlich niedrigeren Mindestkonzentrationen. ⓘ
20 bis 30 % der Substanz zirkulieren in Form von Carbamazepin selbst, der Rest sind Metaboliten. 70 bis 80 % sind an Plasmaproteine gebunden. Die Konzentrationen in der Muttermilch betragen 25 bis 60 % derjenigen im Blutplasma. ⓘ
Carbamazepin selbst ist pharmakologisch nicht aktiv. Es wird hauptsächlich durch CYP3A4 zu Carbamazepin-10,11-Epoxid aktiviert, das allein für die krampflösende Wirkung des Arzneimittels verantwortlich ist. Das Epoxid wird dann durch mikrosomale Epoxidhydrolase (mEH) zu Carbamazepin-trans-10,11-diol und weiter zu seinen Glucuroniden inaktiviert. Andere Metaboliten sind verschiedene Hydroxylderivate und Carbamazepin-N-Glucuronid. ⓘ
Die Plasmahalbwertszeit beträgt etwa 35 bis 40 Stunden, wenn Carbamazepin als Einzeldosis verabreicht wird, aber es ist ein starker Induktor von Leberenzymen, und die Plasmahalbwertszeit verkürzt sich auf etwa 12 bis 17 Stunden, wenn es wiederholt verabreicht wird. Die Halbwertszeit kann durch andere Enzyminduktoren wie Phenytoin oder Phenobarbital weiter auf 9-10 Stunden verkürzt werden. Etwa 70 % werden über den Urin ausgeschieden, fast ausschließlich in Form von Metaboliten, und 30 % über die Fäkalien. ⓘ
Carbamazepin wird in der Leber über das Cytochrom-P450-Enzymsystem (vor allem CYP3A4, aber auch 1A2 und 2C9) verarbeitet, dessen Aktivität es auch induziert. Dies ist vor allem im Hinblick auf potentielle (Arzneimittel-)Wechselwirkungen relevant. ⓘ
Pharmakodynamik (Wirkmechanismus)
Der Wirkmechanismus ist noch nicht vollständig geklärt. Es wird jedoch angenommen, dass Carbamazepin durch Blockade von (spannungsabhängigen) Natriumkanälen in den Axonen der Nervenzellen und somit auf die (ektope) Erregungsausbreitung wirkt und einen membranstabilisierenden Effekt ausübt. ⓘ
Geschichte
Carbamazepin wurde 1953 von dem Chemiker Walter Schindler bei der J.R. Geigy AG (heute Teil von Novartis) in Basel, Schweiz, entdeckt. Es wurde 1963 in der Schweiz unter dem Markennamen "Tegretol" erstmals als Medikament zur Behandlung von Epilepsie auf den Markt gebracht; gleichzeitig wurde seine Anwendung bei Trigeminusneuralgie (früher bekannt als Tic Douloureux) eingeführt. Im Vereinigten Königreich wird es seit 1965 als Antikonvulsivum und Antiepileptikum eingesetzt, in den USA ist es seit 1968 zugelassen. ⓘ
1971 setzten Dr. Takezaki und Dr. Hanaoka erstmals Carbamazepin ein, um die Manie bei Patienten zu kontrollieren, die auf Antipsychotika nicht ansprachen (Lithium war zu dieser Zeit in Japan nicht erhältlich). Dr. Okuma, der unabhängig arbeitete, tat dasselbe mit Erfolg. Da sie auch Epileptologen waren, waren sie mit der Antiaggressionswirkung dieses Medikaments vertraut. Carbamazepin wurde in den 1970er Jahren für bipolare Störungen untersucht. ⓘ
Gesellschaft und Kultur
Auswirkungen auf die Umwelt
Carbamazepin und seine Biotransformationsprodukte wurden im Abwasser von Kläranlagen und in Flüssen, die behandeltes Abwasser aufnehmen, nachgewiesen. Es wurden Feld- und Laborstudien durchgeführt, um die Akkumulation von Carbamazepin in Lebensmittelpflanzen zu verstehen, die in mit Klärschlamm behandelten Böden angebaut werden, wobei die Konzentrationen von Carbamazepin im Klärschlamm und die Konzentrationen von Klärschlamm im Boden variieren. Unter Berücksichtigung nur der Studien, in denen Konzentrationen verwendet wurden, die üblicherweise in der Umwelt vorkommen, kam eine Überprüfung im Jahr 2014 zu dem Schluss, dass "die Akkumulation von Carbamazepin in Pflanzen, die in mit Klärschlamm behandelten Böden angebaut werden, je nach Ansatz ein geringfügiges Risiko für die menschliche Gesundheit darstellt." ⓘ
Markennamen
Carbamazepin ist weltweit unter vielen Markennamen erhältlich, darunter Tegretol. ⓘ
Darstellung
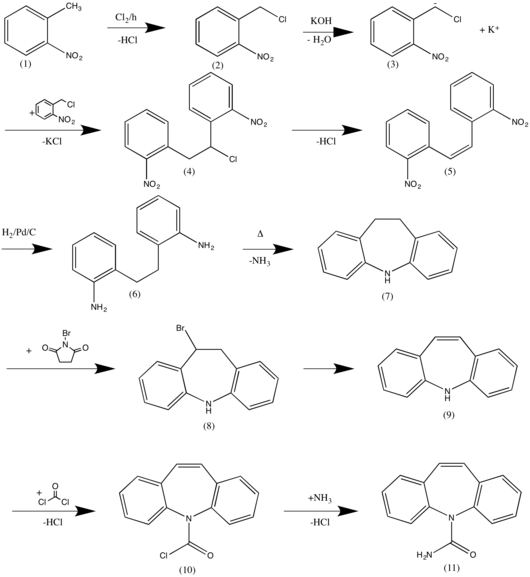
Die Synthese startet mit 2-Nitrotoluol (1), das radikalisch mit Chlor umgesetzt (SSS-Regel) wird. Eine starke Base erzeugt aus (2) an der CH-aciden Stelle das entsprechende Carbanion. Ein weiteres Molekül 2-Nitrobenzylchlorid reagiert mit (3) über eine nukleophile Substitution (SN2 Mechanismus) zu (4). Eine Eliminierungsreaktion zweiter Ordnung ergibt (5). Eine Hydrierung mittels Palladium/Kohle Katalysator erzeugt (6), welches nach Verkochen zu einem hydrierten Dibenzoazepin (7) reagiert. Mit N-Bromsuccinimid wird einfach bromiert und anschließend erneut über einen Eliminationsmechanismus zweiter Ordnung das Dibenzoazepin (9) hergestellt. Mittels einer nukleophilen Substitution reagiert Phosgen mit dem Stickstoffnukleophil zu einem Carbaminsäurechlorid und anschließend mit Ammoniak zu Carbamazepin (11). ⓘ
Analytik
Zur zuverlässigen qualitativen und quantitativen Bestimmung von Carbamazepin in verschiedenen Untersuchungsgütern eignet sich die Kopplung der HPLC mit der Massenspektrometrie nach angemessener Probenvorbereitung. ⓘ
Klinische Angaben
Anwendung in der Schwangerschaft und Stillzeit
Carbamazepin kann Fehlbildungen beim Ungeborenen verursachen (teratogene Wirkung). Insbesondere das Risiko für Spaltbildungen der Wirbelsäule (Spina bifida, „offener Rücken“) ist erhöht. Neuere Untersuchungen weisen jedoch auf eine nur geringfügige Erhöhung des Auftretens großer Fehlbildungen hin. Die Kombination mit anderen Antikonvulsiva kann die Fehlbildungsrate weiter erhöhen. Für eine Behandlung mit Carbamazepin in der Schwangerschaft ist die Nutzen-Risiko-Abwägung besonders sorgfältig zu treffen. ⓘ
Wechselwirkungen
Durch die Aktivierung von Cytochrom-P450-Isoenzymen in der Leber beschleunigt Carbamazepin neben seinem eigenen auch den Abbau von anderen Medikamenten, etwa von Phenprocoumon, der Antibabypille, von einigen Antidepressiva und von Neuroleptika, von Cyclosporin, von Astemizol, von Valproinsäure u.v.m. So können gleichzeitig verordnete Medikamente unter der Gabe von Carbamazepin ihre Wirkung verlieren, eine Überprüfung der Serumspiegel und eine Dosisanpassung ist also notwendig. ⓘ
Besonderes Augenmerk ist auf Medikamente zu legen, welche dagegen die Verstoffwechselung von Carbamazepin hemmen (Anstieg des Serumspiegels, Vergiftungsgefahr). ⓘ
Substanzen, welche die Plasmakonzentration von Carbamazepin erhöhen können, sind:
- Grapefruitsaft,
- Fluoxetin,
- Fluvoxamin,
- möglicherweise Desipramin,
- Isoniazid,
- Verapamil,
- Diltiazem,
- Dextropropoxyphen,
- Viloxazin,
- möglicherweise Cimetidin,
- Acetazolamid,
- Danazol,
- Nicotinamid (bei Erwachsenen und nur in hohen Dosen),
- Nefazodon, Makrolid-Antibiotika (z. B. Erythromycin, Troleandromycin, Josamycin, Clarithromycin),
- Azolderivate (z. B. Itraconazol, Ketoconazol, Fluconazol),
- Terfenadin,
- Loratadin,
- Protease-Hemmer zur HIV-Behandlung ⓘ
Substanzen, welche die Plasmakonzentration von Carbamazepin senken können, sind dagegen:
- pflanzliche Präparate, die Johanniskraut (Hypericum perforatum) enthalten
- Phenobarbital,
- Primidone,
- Progabide,
- Theophyllin,
- Mesuximid,
- Rifampicin,
- Cisplatin,
- Doxorubicin,
- Clonazepam,
- Valproinsäure oder Valpromid,
- Oxcarbazepin ⓘ
Auswirkungen auf die Fähigkeit, am Straßenverkehr teilzunehmen oder Maschinen zu bedienen
Die Fähigkeit des Patienten, schnell zu reagieren, kann durch Schwindelgefühle oder Schläfrigkeit beeinträchtigt werden, insbesondere zu Beginn der Therapie oder im Zusammenhang mit Dosisanpassungen. ⓘ
Gegenanzeigen
Bei Vorliegen von Reizleitungsstörungen des Herzen ist Carbamazepin kontraindiziert. ⓘ
Dosierung
Carbamazepin sollte anfangs langsam in der Dosis gesteigert werden (einschleichend), da vor allem bei Therapiebeginn Nebenwirkungen auftreten. Der angestrebte Serumspiegel beträgt 6 bis 8 (12) μg/ml. Besonders geeignet sind dafür Retardformen. Im Verlauf der Therapie sind eine regelmäßige Dosisanpassung (Aktivierung des Leberstoffwechsels) sowie monatliche Kontrolluntersuchungen (Nebenwirkungen) nötig. Zum Abschluss der Therapie muss die Dosis ausschleichend verringert werden. ⓘ
Umwelt- und Trinkwasserrelevanz
Bei den in Abwasser und Klärschlamm regelmäßig gefundenen Rückständen von Arzneimitteln handelt es sich nach Angaben des österreichischen Umweltbundesamts oftmals um Carbamazepin. Carbamazepin und seine Transformationsprodukte wurden zudem in Kläranlagenausläufen und Flüssen nachgewiesen. Mit natürlichen Aufbereitungstechniken wird Carbamazepin bei der Trinkwasseraufbereitung zumeist nicht entfernt, weshalb der Stoff ohne geeignete technische Maßnahmen (bspw. Ozonung oder Aktivkohlefiltration) ins abgegebene Trinkwasser gelangt. Das Umweltbundesamt der Bundesrepublik Deutschland hat für Carbamazepin und den Metaboliten 10,11-Dihydroxy-10,11–Dihydro-Carbamazepin in Trinkwasser jeweils einen Gesundheitlichen Orientierungswert von 0,3 µg/L abgeleitet. ⓘ
Literatur
- Stefan Brunnhuber, Sabine Frauenknecht, Klaus Lieb: Intensivkurs Psychiatrie und Psychotherapie. Elsevier, Urban & Fischer, München 2005, ISBN 3-437-42131-X, S. 60f.
- Günter Krämer, Hans-Christian Hopf, Herausgeber. Carbamazepin in der Neurologie. G. Thieme, Stuttgart/ New York 1987, ISBN 3-13-714101-X. ⓘ
Handelsnamen
- Monopräparate
Carbaflux (D), Carbagamma (D), Carsol (CH), Deleptin (A), Finlepsin (D), Neurotop (A, CH), Tegretal (D), Tegretol (A, CH), Timonil (D, CH), zahlreiche Generika (D, A) ⓘ