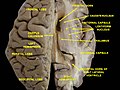
Thalamus
| Thalamus ⓘ | |
|---|---|
 Thalamus markiert (MRI-Querschnitt) | |
 Der Thalamus in einer 360°-Drehung | |
| Einzelheiten | |
| Teil des | Diencephalon |
| Teile | Siehe Liste der Thalamuskerne |
| Arterie | Arteria cerebri posterior und ihre Äste |
| Bezeichnungen | |
| Lateinisch | Thalamus dorsalis |
| Anatomische Begriffe der Neuroanatomie [Bearbeiten auf Wikidata] | |
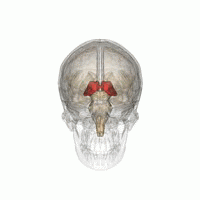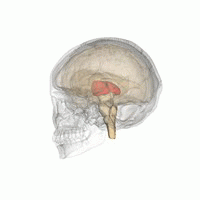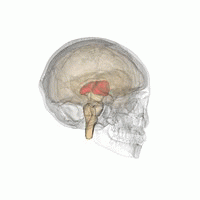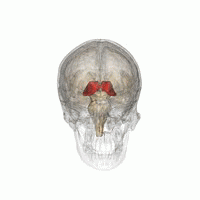
Der Thalamus (von griechisch θάλαμος, "Kammer") ist eine große Masse grauer Substanz, die sich im dorsalen Teil des Zwischenhirns (einer Abteilung des Vorderhirns) befindet. Vom Thalamus gehen Nervenfasern in alle Richtungen zur Großhirnrinde und ermöglichen so einen drehscheibenartigen Informationsaustausch. Der Thalamus hat mehrere Funktionen, z. B. die Weiterleitung von sensorischen und motorischen Signalen an die Großhirnrinde und die Regulierung von Bewusstsein, Schlaf und Wachsamkeit. ⓘ
Anatomisch gesehen handelt es sich um eine paramediane, symmetrische Struktur mit zwei Hälften (links und rechts) innerhalb des Wirbeltiergehirns, die zwischen der Großhirnrinde und dem Mittelhirn liegt. Es bildet sich während der Embryonalentwicklung als Hauptprodukt des Zwischenhirns und wurde erstmals 1893 von dem Schweizer Embryologen und Anatomen Wilhelm His sen. erkannt. ⓘ
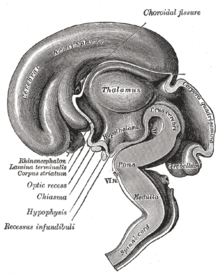

Der Thalamus (von altgriechisch θάλαμος thálamos, deutsch ‚Schlafgemach‘, ‚Kammer‘) bildet den größten Teil des Zwischenhirns. Er setzt sich aus vielen Kerngebieten zusammen, die eine besonders starke Verbindung zur gesamten Großhirnrinde aufweisen. ⓘ
Bei den meisten Menschen sind der rechte und linke Thalamus entwicklungsbedingt über eine dünne Bindegewebsbrücke, die Adhaesio interthalamica (auch Massa intermedia) verwachsen. Diese enthält jedoch nur in Ausnahmefällen kreuzende Fasern (Kommissuren). ⓘ
Anatomie
Der Thalamus ist eine paarige Struktur aus grauer Substanz, die sich im Vorderhirn befindet, das dem Mittelhirn übergeordnet ist, nahe dem Zentrum des Gehirns, mit Nervenfasern, die in alle Richtungen zur Großhirnrinde ausstrahlen. Die mediale Oberfläche des Thalamus bildet den oberen Teil der Seitenwand des dritten Ventrikels und ist mit der entsprechenden Oberfläche des gegenüberliegenden Thalamus durch ein abgeflachtes graues Band, die interthalamische Adhäsion, verbunden. Der laterale Teil des Thalamus ist der phylogenetisch jüngste Teil des Thalamus (Neothalamus) und umfasst die lateralen Kerne, das Pulvinar und die medialen und lateralen Nuclei geniculae. Im Thalamus befinden sich Bereiche der weißen Substanz, darunter das Stratum zonale, das die dorsale Oberfläche bedeckt, sowie die äußere und die innere Marklamelle. Die äußere Lamina bedeckt die laterale Oberfläche und die innere Lamina unterteilt die Kerne in anteriore, mediale und laterale Gruppen. ⓘ
Blutversorgung
Der Thalamus wird von mehreren Arterien mit Blut versorgt: der Arteria polaris (hintere Kommunikationsarterie), den paramedianen thalamisch-subthalamischen Arterien, den inferolateralen (thalamogeniculären) Arterien und den posterioren (medialen und lateralen) Aderhautarterien. Dies sind alles Äste der hinteren Hirnarterie. ⓘ
Einige Menschen haben die Arterie von Percheron, eine seltene anatomische Variante, bei der ein einziger arterieller Stamm aus der hinteren Hirnarterie entspringt und beide Teile des Thalamus versorgt. ⓘ
Thalamuskerne




Zu den Abkömmlingen des Zwischenhirns gehören der dorsal gelegene Epithalamus (im Wesentlichen die Habenula und die Annexe) und der Perithalamus (Präthalamus), der die Zona incerta und den retikulären Thalamuskern enthält. Aufgrund ihres unterschiedlichen ontogenetischen Ursprungs werden der Epithalamus und der Perithalamus formal vom eigentlichen Thalamus unterschieden. Der Metathalamus setzt sich aus dem Nucleus geniculatus lateralis und dem Nucleus geniculatus medialis zusammen. ⓘ
Der Thalamus besteht aus einem System von Lamellen (die aus myelinisierten Fasern bestehen), die verschiedene Thalamusbereiche voneinander trennen. Andere Bereiche sind durch bestimmte Neuronengruppen definiert, wie der periventrikuläre Kern, die intralaminären Elemente, der Nucleus limitans" und andere. Diese letztgenannten Strukturen, die sich in ihrer Struktur vom Hauptteil des Thalamus unterscheiden, wurden zum Allothalamus und nicht zum Isothalamus zusammengefasst. Diese Unterscheidung vereinfacht die globale Beschreibung des Thalamus. ⓘ
Verbindungen

Der Thalamus hat über den mammillothalamischen Trakt zahlreiche Verbindungen zum Hippocampus; dieser Trakt umfasst die Mammillarkörper und die Fornix. ⓘ
Der Thalamus ist über die thalamokortikalen Strahlen mit der Großhirnrinde verbunden. ⓘ
Der spinothalamische Trakt ist eine sensorische Bahn, die ihren Ursprung im Rückenmark hat. Sie leitet Informationen über Schmerzen, Temperatur, Juckreiz und grobe Berührungen an den Thalamus weiter. Er besteht aus zwei Hauptteilen: dem lateralen spinothalamischen Trakt, der Schmerz und Temperatur überträgt, und dem anterioren (oder ventralen) spinothalamischen Trakt, der grobe Berührungen und Druck überträgt. ⓘ
Funktion
Der Thalamus hat mehrere Funktionen, von denen allgemein angenommen wird, dass er als Relaisstation oder Knotenpunkt fungiert, der Informationen zwischen verschiedenen subkortikalen Bereichen und der Großhirnrinde weiterleitet. Insbesondere verfügt jedes sensorische System (mit Ausnahme des Geruchssystems) über einen Thalamuskern, der sensorische Signale empfängt und sie an das zugehörige primäre kortikale Gebiet weiterleitet. Im visuellen System beispielsweise werden die Eingänge von der Netzhaut an den Nucleus geniculatus lateralis des Thalamus gesendet, der wiederum an den visuellen Kortex im Okzipitallappen projiziert. Es wird angenommen, dass der Thalamus sowohl sensorische Informationen verarbeitet als auch weiterleitet - jedes der primären sensorischen Relaisgebiete erhält starke Rückkopplungsverbindungen von der Großhirnrinde. In ähnlicher Weise fungiert der Nucleus geniculatus medialis als wichtiges auditorisches Relais zwischen dem Colliculus inferior des Mittelhirns und dem primären auditorischen Cortex. Der ventrale Nucleus posterior ist ein wichtiges somatosensorisches Relais, das Berührungs- und propriozeptive Informationen an den primären somatosensorischen Kortex weiterleitet. ⓘ
Der Thalamus spielt auch eine wichtige Rolle bei der Regulierung von Schlaf- und Wachzuständen. Die Thalamuskerne haben starke reziproke Verbindungen zur Großhirnrinde und bilden thalamo-kortiko-thalamische Schaltkreise, von denen man annimmt, dass sie am Bewusstsein beteiligt sind. Der Thalamus spielt eine wichtige Rolle bei der Regulierung der Erregung, des Bewusstseinsniveaus und der Aktivität. Eine Schädigung des Thalamus kann zu einem dauerhaften Koma führen. ⓘ
Die Rolle des Thalamus in den eher anterioren pallidalen und nigralen Territorien bei Störungen des Basalgangliensystems ist zwar bekannt, aber noch wenig erforscht. Der Beitrag des Thalamus zu den vestibulären oder tektalen Funktionen wird nahezu ignoriert. Der Thalamus wurde bisher als "Relais" betrachtet, das lediglich Signale an die Großhirnrinde weiterleitet. Neuere Forschungen legen nahe, dass die Funktion des Thalamus selektiver ist. Viele verschiedene Funktionen sind mit verschiedenen Regionen des Thalamus verbunden. Dies gilt für viele sensorische Systeme (mit Ausnahme des Geruchssystems), wie z. B. das auditorische, somatische, viszerale, gustatorische und visuelle System, bei denen lokalisierte Läsionen spezifische sensorische Defizite hervorrufen. Eine wichtige Rolle des Thalamus ist die Unterstützung des motorischen und des sprachlichen Systems, und ein Großteil der Schaltkreise, die für diese Systeme verantwortlich sind, werden gemeinsam genutzt. Der Thalamus ist funktionell mit dem Hippocampus verbunden, und zwar als Teil des erweiterten Hippocampus-Systems an den thalamischen anterioren Kernen, die für das räumliche Gedächtnis und die räumlichen sensorischen Daten von entscheidender Bedeutung für das menschliche episodische Ereignisgedächtnis sind. Die Verbindung der thalamischen Region mit dem mesio-temporalen Lappen ermöglicht eine Differenzierung der Funktionsweise von Erinnerungs- und Vertrautheitsgedächtnis. ⓘ
Die für die motorische Kontrolle notwendigen neuronalen Informationsprozesse wurden als Netzwerk unter Beteiligung des Thalamus als subkortikales motorisches Zentrum vorgeschlagen. Untersuchungen der Gehirnanatomie von Primaten legten nahe, dass der Thalamus eine Schlüsselfunktion bei der Bereitstellung der spezifischen Kanäle von den Basalganglien und dem Kleinhirn zu den kortikalen motorischen Bereichen erfüllt. Bei einer Untersuchung der motorischen Reaktion auf Sakkaden und Antisakkaden bei drei Affen wurde festgestellt, dass die Thalamusregionen an der Erzeugung von Antisakkaden-Augenbewegungen beteiligt sind (d. h. an der Fähigkeit, die reflexartige, ruckartige Bewegung der Augen in Richtung eines dargebotenen Reizes zu hemmen). ⓘ
Neuere Forschungsergebnisse deuten darauf hin, dass der mediodorsale Thalamus (MD) eine umfassendere Rolle bei der Kognition spielen könnte. Insbesondere kann der mediodorsale Thalamus "die Konnektivität (Signalstärke) genau der Schaltkreise im Kortex verstärken, die für den aktuellen Kontext geeignet sind, und dadurch zur Flexibilität (des Säugetiergehirns) beitragen, komplexe Entscheidungen zu treffen, indem er die vielen Assoziationen, von denen Entscheidungen abhängen, mit schwach verbundenen kortikalen Schaltkreisen verdrahtet". Die Forscher fanden heraus, dass "die Steigerung der MD-Aktivität die Fähigkeit der Mäuse zu 'denken' vergrößerte und ihre Fehlerquote bei der Entscheidung, welchen widersprüchlichen sensorischen Reizen sie folgen sollten, um die Belohnung zu finden, um mehr als 25 Prozent verringerte." ⓘ
Zuführende (afferente) Nervenzellen leiten Informationen aus dem Körper und den Sinnesorganen in den Thalamus, wo sie in den „spezifischen Thalamuskernen“ jeweils auf eine nachfolgende Nervenzelle umgeschaltet werden, die zur Großhirnrinde führt. Diese Umschaltung (Synapse) ermöglicht eine primitive Informationsverarbeitung, indem der Thalamus als Filter fungiert und entscheidet, welche Informationen für den Organismus im Moment so wichtig sind, dass sie an die Großhirnrinde weitergeleitet und bewusst werden sollen. Der Thalamus wird deshalb oft als „Tor zum Bewusstsein“ bezeichnet. Gesteuert wird diese Umschaltung/Informationsverarbeitung von den „unspezifischen Thalamuskernen“, die wiederum von anderen Hirnarealen ihren Input bekommen. Diese Regulation ist notwendig, damit der Thalamus Entscheidungen („Was ist gerade wichtig?“) auf die Gesamtsituation (z. B. Schlaf, Futtersuche, Paarungszeit) abstimmen kann. Die zuführenden Nervenzellen zum Thalamus sind überwiegend überkreuzt, so dass jede Thalamusseite die gegenüberliegende Körperhälfte repräsentiert. ⓘ
Im Thalamus befinden sich auch Opioidrezeptoren. ⓘ
Entwicklung
Der Thalamuskomplex besteht aus dem Perithalamus (oder Präthalamus, früher auch als ventraler Thalamus bezeichnet), dem mittleren Zwischenhirnorganismus (der später die Zona limitans intrathalamica (ZLI) bildet) und dem Thalamus (dorsaler Thalamus). Die Entwicklung des Thalamus kann in drei Stufen unterteilt werden. Der Thalamus ist die größte Struktur, die aus dem embryonalen Zwischenhirn hervorgeht, dem hinteren Teil des Vorderhirns, der zwischen dem Mittelhirn und dem Großhirn liegt. ⓘ
Frühe Gehirnentwicklung
Nach der Neurulation wird die Anlage des Präthalamus und des Thalamus im Neuralrohr eingeleitet. Daten aus verschiedenen Modellorganismen der Wirbeltiere unterstützen ein Modell, in dem die Interaktion zwischen zwei Transkriptionsfaktoren, Fez und Otx, von entscheidender Bedeutung ist. Fez wird im Präthalamus exprimiert, und funktionelle Experimente zeigen, dass Fez für die Bildung des Präthalamus erforderlich ist. Im hinteren Bereich grenzen Otx1 und Otx2 an die Expressionsdomäne von Fez und sind für die korrekte Entwicklung des Thalamus erforderlich. ⓘ
Bildung von Progenitor-Domänen
Zu Beginn der Thalamusentwicklung bilden sich zwei Vorläuferdomänen, eine kaudale und eine rostrale Domäne. Aus der kaudalen Domäne entstehen alle glutamatergen Neuronen im erwachsenen Thalamus, während aus der rostralen Domäne alle GABAergen Neuronen im erwachsenen Thalamus hervorgehen. ⓘ
Die Bildung des mitteldiencephalen Organismus (MDO)
An der Schnittstelle zwischen den Expressionsdomänen von Fez und Otx wird in der Thalamus-Anlage der mid-diencephalic organizer (MDO, auch ZLI organizer genannt) gebildet. Der MDO ist der zentrale Signalorganisator im Thalamus. Ein Fehlen des Organizers führt zum Fehlen des Thalamus. Der MDO reift während der Entwicklung von ventral nach dorsal. Mitglieder der Sonic Hedgehog (SHH)-Familie und der Wnt-Familie sind die wichtigsten Signale, die vom MDO ausgehen. ⓘ
Neben seiner Bedeutung als Signalzentrum reift der Organizer zu der morphologischen Struktur der Zona limitans intrathalamica (ZLI) heran. ⓘ
Reifung und Parzellierung des Thalamus
Nach seiner Induktion beginnt der MDO, die Entwicklung der Thalamusanlage durch die Freisetzung von Signalmolekülen wie SHH zu steuern. Bei Mäusen ist die Funktion der Signalübertragung an der MDO nicht direkt untersucht worden, da das Zwischenhirn bei SHH-Mutanten vollständig fehlt. ⓘ
Studien an Küken haben gezeigt, dass SHH sowohl notwendig als auch ausreichend für die Geninduktion im Thalamus ist. Bei Zebrafischen wurde gezeigt, dass die Expression von zwei SHH-Genen, SHH-a und SHH-b (früher als twhh bezeichnet), das MDO-Territorium markiert, und dass SHH-Signale für die molekulare Differenzierung sowohl des Präthalamus als auch des Thalamus ausreichen, aber nicht für deren Erhalt erforderlich sind, und dass SHH-Signale von der MDO/Alarplatte für die Reifung des präthalamischen und thalamischen Territoriums ausreichen, während ventrale Shh-Signale entbehrlich sind. ⓘ
Die Exposition gegenüber SHH führt zur Differenzierung der thalamischen Neuronen. SHH-Signale von der MDO induzieren eine von hinten nach vorn verlaufende Welle der Expression des proneuralen Gens Neurogenin1 im größten (kaudalen) Teil des Thalamus und Ascl1 (früher Mash1) in dem verbleibenden schmalen Streifen rostraler Thalamuszellen unmittelbar neben der MDO und im Prähthalamus. ⓘ
Diese Zonierung der proneuralen Genexpression führt zur Differenzierung von glutamatergen Relaisneuronen aus den Neurogenin1+-Vorläufern und von GABAergen inhibitorischen Neuronen aus den Ascl1+-Vorläufern. In Fischen wird die Auswahl dieser alternativen Neurotransmitter-Schicksale durch die dynamische Expression von Her6, dem Homolog von HES1, gesteuert. Die Expression dieses haarähnlichen bHLH-Transkriptionsfaktors, der Neurogenin unterdrückt, aber für Ascl1 erforderlich ist, geht im kaudalen Thalamus nach und nach verloren, während sie im Präthalamus und im Streifen der rostralen Thalamuszellen erhalten bleibt. Darüber hinaus haben Studien an Küken und Mäusen gezeigt, dass die Blockierung des Shh-Signalwegs zum Fehlen des rostralen Thalamus und zu einer erheblichen Abnahme des kaudalen Thalamus führt. Aus dem rostralen Thalamus entsteht hauptsächlich der retikuläre Nukleus, während der kaudale Thalamus den Relais-Thalamus bildet und sich weiter in die Thalamuskerne aufteilt. ⓘ
Beim Menschen hat sich gezeigt, dass eine häufige genetische Variation in der Promotorregion des Serotonintransporters (das SERT-Long- und -Short-Allel: 5-HTTLPR) die Entwicklung verschiedener Regionen des Thalamus bei Erwachsenen beeinträchtigt. Menschen, die zwei kurze Allele (SERT-ss) erben, haben mehr Neuronen und ein größeres Volumen im pulvinaren und möglicherweise im limbischen Bereich des Thalamus. Die Vergrößerung des Thalamus bietet eine anatomische Grundlage dafür, warum Menschen, die zwei SERT-ss-Allele geerbt haben, anfälliger für schwere Depressionen, posttraumatische Belastungsstörungen und Selbstmord sind. ⓘ
Klinische Bedeutung
Ein durch einen Schlaganfall geschädigter Thalamus kann zu einem thalamischen Schmerzsyndrom führen, bei dem ein einseitiges brennendes oder schmerzendes Gefühl auftritt, das häufig von Stimmungsschwankungen begleitet wird. Eine beidseitige Ischämie des von der Arteria paramediana versorgten Bereichs kann schwerwiegende Probleme verursachen, darunter akinetischen Mutismus, und von okulomotorischen Problemen begleitet sein. Ein verwandtes Konzept ist die thalamokortikale Dysrhythmie. Der Verschluss der Arteria Percheron kann zu einem beidseitigen Thalamusinfarkt führen. ⓘ
Das alkoholische Korsakoff-Syndrom ist auf eine Schädigung des Mammillarkörpers, des mammillothalamischen Faszikulus oder des Thalamus zurückzuführen. ⓘ
Bei der tödlichen familiären Insomnie handelt es sich um eine erbliche Prionenkrankheit, bei der es zu einer Degeneration des Thalamus kommt, wodurch der Patient allmählich seine Fähigkeit zu schlafen verliert und sich zu einem Zustand völliger Schlaflosigkeit entwickelt, der unweigerlich zum Tod führt. Im Gegensatz dazu kann eine Schädigung des Thalamus zu einem Koma führen. ⓘ
Weitere Bilder
Mediale Gruppe der Thalamuskerne. ⓘ
Thalamuskerne


Entsprechend ihrer Efferenzen und vor allem ihres Einflusses auf die Großhirnrinde werden spezifische und unspezifische Thalamuskerne unterschieden. Diese Unterscheidung ist jedoch umstritten, da die Trennung nicht so scharf ausfällt wie vermutet wurde: Unspezifische Kerne haben teilweise eng abgrenzbare Projektionen und auch die Efferenzen spezifischer thalamischer Kerne sind oft nicht nur auf ein Cortexareal beschränkt. Der Anschaulichkeit halber wird die Unterteilung jedoch oft noch getroffen. ⓘ
Spezifische Thalamuskerne
Die spezifischen Thalamuskerne werden in ihrer Gesamtheit auch Palliothalamus bezeichnet. Sie sind jeweils mit abgrenzbaren Bereichen der Großhirnrinde verbunden und werden deshalb als spezifisch bezeichnet. Sie erhalten sensible (Tasten, Vibration, Schmerz) und sensorische (Sehen, Hören, Schmecken) Impulse aus der Peripherie (Sinnesorgane) und leiten diese nach Umschaltung über die Thalamusstrahlung an die zuständigen Bezirke in der Großhirnrinde weiter. Außerdem werden Informationen aus motorischen Zentren (Kleinhirn, Basalganglien) an die motorischen Areale der Großhirnrinde geleitet. ⓘ
Die spezifischen Thalamuskerne sind:
- anteriore Kerngruppe (Nuclei anteriores)
- mediale Kerngruppe (Nuclei mediales)
- ventrale Kerngruppe (Nuclei ventrales)
- Nucleus ventralis anterolateralis
- Nucleus ventralis anterior (VA)
- Nucleus ventralis lateralis (VL)
- Nucleus ventralis intermedius (VIM)
- Nucleus ventralis posterior (VP)
- Nucleus ventralis posterolateralis (VPL)
- Nucleus ventralis posteromedialis (VPM)
- Nucleus ventralis anterolateralis
- posteriore Kerngruppe (Nuclei posteriores)
- dorsale Kerngruppe (Nuclei dorsales)
- Pulvinar
- Metathalamus, bestehend aus:
- Corpus geniculatum laterale
- Corpus geniculatum mediale. ⓘ
Unspezifische Thalamuskerne
Die unspezifischen Thalamuskerne, auch unter dem Namen Truncothalamus bekannt, haben nur wenige direkte Verbindungen zur Großhirnrinde und diese sind, im Gegensatz zu denen der spezifischen Thalamuskerne, nicht auf bestimmte Bereiche eingrenzbar. Sie sind efferent vor allem mit den spezifischen Thalamuskernen verbunden, steuern diese also an. Auch hierdurch kommt es bei Erregung der unspezifischen Thalamuskerne zu einer unspezifischen Aktivierung der Großhirnrinde. Afferenzen erhalten sie vor allem aus der Formatio reticularis, aus dem Kleinhirn und aus den Basalganglien. ⓘ
Wichtige unspezifische Kerne:
- Nuclei intralaminares
- Nucleus centromedianus
- Nuclei mediani
- Nucleus reticularis ⓘ
Thalamus ventralis
Für das Prinzip der Verschaltung des Thalamus (dorsalis) ist es entscheidend, dass alle corticothalamischen und thalamocorticalen Projektionen reziprok sind. Das heißt, dass eine Erregung des Cortex durch den Thalamus (dorsalis) nun reziprok auch eine Erregung des Thalamus (dorsalis) durch den Cortex zur Folge hat. Dies gilt analog auch für hemmende Impulse des Thalamus (dorsalis). Somit wird schnell klar, dass eine reziproke Erregung schnell zu einer corticalen Übererregung führen würde, während eine Hemmung des Cortex über die reziproke Hemmung des Thalamus (dorsalis), dazu führen würde, dass der Cortex im Ruhezustand gar nicht mehr aktiviert werden könnte. ⓘ
Daher muss es eine zweite Regulationsstation für den Thalamus (dorsalis) geben. Dies ist der Thalamus ventralis (auch Subthalamus), der entwicklungsgeschichtlich vom Thalamus (dorsalis) abgespalten wird. Zum Thalamus ventralis gehören unter anderem wichtige Kerngebiete, die funktionell den Basalganglien zugeordnet werden (Nucleus subthalamicus und Globus pallidus). Durch eine komplizierte Verschaltung innerhalb der Basalganglien kontrollieren diese Kerne den Thalamus (dorsalis) direkt (im Falle des internen Segment des Globus pallidus) oder indirekt. Siehe hierzu den Artikel zur Funktion der Basalganglien. ⓘ
Eine andere wichtige Kontrollinstanz des Thalamus ventralis ist der Nucleus reticularis thalami (netzartiger Thalamuskern), der den Thalamus (dorsalis) netzartig umgibt. Er ist intern derart gegliedert, dass es im Nucleus reticularis entsprechende Areale für jedes Areal des Thalamus (dorsalis) gibt. Der Nucleus reticularis erhält ebenfalls Fasern des Cortex, die Kopien aller Projektionen des Cortex auf den Thalamus (dorsalis) erhalten und projiziert seinerseits mit zeitlicher Verzögerung nun antagonistisch auf das entsprechende thalamische Areal. Eine erregende Projektion auf den Thalamus (dorsalis) bewirkt somit über den Nucleus reticularis eine zeitlich verzögerte Hemmung des erregten Thalamuskerns. Eine Hemmung des Thalamus (dorsalis) wird analog über den Nucleus reticularis aufgehoben. Somit wird das oben geschilderte „Dilemma“ gelöst. ⓘ
Krankheiten
Eine Schädigung des Thalamus betrifft vor allem die entgegengesetzte (kontralaterale) Körperseite und führt zu folgender Art von Störungen: