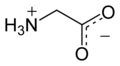
Glycin
| |||
| |||
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Name
Aminoessigsäure
| |||
| Systematische IUPAC-Bezeichnung
2-Aminoethansäure | |||
| Andere Bezeichnungen
Aminoethansäure, Glycocol
| |||
| Bezeichner | |||
3D-Modell (JSmol)
|
| ||
| Abkürzungen | Gly, G | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| EC-Nummer |
| ||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| UNII |
| ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C2H5NO2 | ||
| Molare Masse | 75,067 g-mol-1 | ||
| Erscheinungsbild | Weißer Feststoff | ||
| Dichte | 1,1607 g/cm3 | ||
| Schmelzpunkt | 233 °C (451 °F; 506 K) (Zersetzung) | ||
Löslichkeit in Wasser
|
24,99 g/100 mL (25 °C) | ||
| Löslichkeit | löslich in Pyridin schwer löslich in Ethanol unlöslich in Ether | ||
| Acidität (pKa) | 2,34 (Carboxyl), 9,6 (Amino) | ||
Magnetische Suszeptibilität (χ)
|
-40,3-10-6 cm3/mol | ||
| Pharmakologie | |||
ATC-Code
|
B05CX03 (WHO) | ||
| Gefahren | |||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (mittlere Dosis)
|
2600 mg/kg (Maus, oral) | ||
Wenn nicht anders angegeben, gelten die Daten für Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Glycin (Symbol Gly oder G; /ˈɡlaɪsiːn/) ist eine Aminosäure mit einem einzigen Wasserstoffatom als Seitenkette. Sie ist die einfachste stabile Aminosäure (Carbaminsäure ist instabil) und hat die chemische Formel NH2-CH2-COOH. Glycin ist eine der proteinogenen Aminosäuren. Sie wird durch alle Codons kodiert, die mit GG beginnen (GGU, GGC, GGA, GGG). Glycin ist aufgrund seiner kompakten Form wesentlich an der Bildung von Alpha-Helices in der sekundären Proteinstruktur beteiligt. Aus demselben Grund ist es die am häufigsten vorkommende Aminosäure in den Triple-Helices von Kollagen. Glycin ist auch ein hemmender Neurotransmitter - eine Störung seiner Freisetzung im Rückenmark (z. B. bei einer Clostridium tetani-Infektion) kann zu spastischen Lähmungen aufgrund einer ungehemmten Muskelkontraktion führen. ⓘ
Sie ist die einzige achirale proteinogene Aminosäure. Aufgrund ihrer minimalen Seitenkette mit nur einem Wasserstoffatom kann sie sich in hydrophile oder hydrophobe Umgebungen einfügen. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glycin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H5NO2 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser, kristalliner Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
B05CX03 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 75,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,161 g·cm−3 | ||||||||||||||||||
| Schmelzpunkt |
Zersetzung: 232–236 °C | ||||||||||||||||||
| pKS-Wert |
| ||||||||||||||||||
| Löslichkeit |
gut löslich in Wasser
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
7930 mg·kg−1 (LD50, Ratte, oral) | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−528,5 kJ/mol | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Glycin, abgekürzt Gly oder G, (auch Glyzin oder Glykokoll, von altgr. κόλλα kólla: Leim, nach systematischer chemischer Nomenklatur Aminoessigsäure oder Aminoethansäure), ist die kleinste und einfachste 'α-Aminosäure und wurde erstmals 1820 aus Gelatine, d. h. aus Kollagenhydrolysat, gewonnen. Es gehört zur Gruppe der hydrophilen Aminosäuren und ist als einzige proteinogene (oder eiweißbildende) Aminosäure achiral und damit nicht optisch aktiv. ⓘ
Glycin ist nicht essentiell, kann also vom menschlichen Organismus selbst synthetisiert werden und ist wichtiger Bestandteil nahezu aller Proteine und ein wichtiger Knotenpunkt im Stoffwechsel. ⓘ
Der Name leitet sich vom süßen Geschmack reinen Glycins her (griechisch γλυκύς glykýs, deutsch ‚süß‘). ⓘ
Geschichte und Etymologie
Glycin wurde 1820 von dem französischen Chemiker Henri Braconnot entdeckt, als er Gelatine durch Abkochen mit Schwefelsäure hydrolysierte. Ursprünglich nannte er es "Gelatinezucker", aber der französische Chemiker Jean-Baptiste Boussingault wies nach, dass es Stickstoff enthält. Der amerikanische Wissenschaftler Eben Norton Horsford, damals Schüler des deutschen Chemikers Justus von Liebig, schlug den Namen "Glycocoll" vor; der schwedische Chemiker Berzelius schlug jedoch den einfacheren Namen "Glycin" vor. Der Name stammt von dem griechischen Wort γλυκύς "süß schmeckend" (das auch mit den Vorsilben Glyco- und Gluco- verwandt ist, wie in Glykoprotein und Glukose). Im Jahr 1858 stellte der französische Chemiker Auguste Cahours fest, dass Glycin ein Amin der Essigsäure ist. ⓘ
Glycin ist die erste Aminosäure, die durch einen sauren Aufschluss von Eiweißen gewonnen wurde. Dies gelang Henri Braconnot 1819 in Nancy, der Leim mit Schwefelsäure hydrolysierte, mit dem Ziel, aus tierischem Material Zucker zu extrahieren. ⓘ
Die nach Aufreinigung gewonnenen süß schmeckenden Kristalle nannte er daher sucre de gélatine, zu deutsch „Leimzucker“. Gelatine ist der Hauptbestandteil von Glutinleim. ⓘ
Synthese
Das bei der Reaktion von Formaldehyd, Cyanwasserstoff und Ammoniak (Strecker-Synthese) entstehende Aminonitril (genauer: α-Aminoacetonitril) liefert bei der Hydrolyse Glycin:
Diese Reaktion spielte als Teilreaktion eine besondere Rolle in der Hypothese, dass organische Moleküle als „Bausteine“ für die ersten primitiven Organismen vor ca. 4 Mrd. Jahren aus den einfachen anorganischen Verbindungen der Uratmosphäre der Erde entstanden waren. Für diese Uratmosphäre wurde eine Zusammensetzung aus Wasser (H2O), Methan (CH4), Ammoniak (NH3), Wasserstoff (H2) und Kohlenstoffmonoxid (CO) sowie Helium (He) und anderen Edelgasen angenommen (vgl. → Miller-Urey-Experiment). ⓘ
Chemisch kann Glycin auch aus Monochloressigsäure und Ammoniak hergestellt werden:
Im Körper wird das meiste Glycin mit der Nahrung aufgenommen, es kann aber auch aus Serin hergestellt werden. ⓘ
Obwohl Glycin aus hydrolysiertem Protein isoliert werden kann, wird dieser Weg für die industrielle Produktion nicht genutzt, da es durch chemische Synthese bequemer hergestellt werden kann. Die beiden wichtigsten Verfahren sind die Aminierung von Chloressigsäure mit Ammoniak, wobei Glycin und Ammoniumchlorid entstehen, und die Strecker-Aminosäuresynthese, die in den Vereinigten Staaten und Japan das wichtigste Syntheseverfahren darstellt. Auf diese Weise werden jährlich etwa 15 Tausend Tonnen hergestellt. ⓘ
Glycin fällt auch als Verunreinigung bei der Synthese von EDTA an, die durch Reaktionen mit dem Ammoniak-Coprodukt entsteht. ⓘ
Chemische Reaktionen
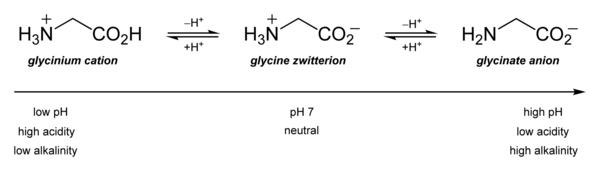
Seine Säure-Base-Eigenschaften sind am wichtigsten. In wässriger Lösung ist Glycin amphoter: Unterhalb von pH = 2,4 wandelt es sich in das Ammoniumkation Glycinium um. Oberhalb von etwa 9,6 wandelt es sich in Glycinat um.
Glycin fungiert als zweizähniger Ligand für viele Metallionen und bildet Aminosäurekomplexe. Ein typischer Komplex ist Cu(Glycinat)2, d. h. Cu(H2NCH2CO2)2, der sowohl in cis- als auch in trans-Isomeren vorliegt. ⓘ
Mit Säurechloriden wandelt sich Glycin in die Amidocarbonsäure um, z. B. Hippursäure und Acetylglycin. Mit salpetriger Säure erhält man Glykolsäure (van Slyke-Bestimmung). Mit Methyljodid wird das Amin quaternisiert und man erhält Trimethylglycin, ein Naturprodukt:
- H
3N+
CH
2COO-
+ 3 CH3I → (CH
3)
3N+
CH
2COO-
+ 3 HI ⓘ
Glycin kondensiert mit sich selbst zu Peptiden, beginnend mit der Bildung von Glycylglycin:
- 2 H
3N+
CH
2COO-
→ H
3N+
CH
2CONHCH
2COO-
+ H2O
Bei der Pyrolyse von Glycin oder Glycylglycin entsteht 2,5-Diketopiperazin, das cyclische Diamid. ⓘ
Es bildet Ester mit Alkoholen. Sie werden oft als Hydrochlorid isoliert, z. B. Glycinmethylesterhydrochlorid. Andernfalls neigt der freie Ester zur Umwandlung in Diketopiperazin. ⓘ
Als bifunktionelles Molekül reagiert Glycin mit vielen Reagenzien. Diese lassen sich in N-zentrierte und Carboxylat-zentrierte Reaktionen einteilen. ⓘ
Stoffwechsel
Biosynthese
Glycin ist für die menschliche Ernährung nicht essentiell, da es im Körper aus der Aminosäure Serin biosynthetisiert wird, die sich wiederum aus 3-Phosphoglycerat ableitet, aber die metabolische Kapazität für die Glycinbiosynthese reicht nicht aus, um den Bedarf für die Kollagensynthese zu decken. In den meisten Organismen katalysiert das Enzym Serin-Hydroxymethyltransferase diese Umwandlung mit Hilfe des Cofaktors Pyridoxalphosphat:
- Serin + Tetrahydrofolat → Glycin + N5,N10-Methylen-Tetrahydrofolat + H2O ⓘ
In der Leber von Wirbeltieren wird die Glycinsynthese durch die Glycinsynthase (auch Glycinspaltungsenzym genannt) katalysiert. Diese Umwandlung ist leicht reversibel:
- CO2 + NH+
4 + N5,N10-Methylen-Tetrahydrofolat + NADH + H+ ⇌ Glycin + Tetrahydrofolat + NAD+ ⓘ
Glycin kann nicht nur aus Serin synthetisiert werden, sondern auch aus Threonin, Cholin oder Hydroxyprolin über den interorganischen Stoffwechsel der Leber und der Nieren gewonnen werden. ⓘ
Abbau
Glycin wird über drei Wege abgebaut. Der vorherrschende Weg in Tieren und Pflanzen ist der umgekehrte Weg des oben erwähnten Glycin-Synthase-Weges. In diesem Zusammenhang wird das beteiligte Enzymsystem gewöhnlich als Glycinspaltsystem bezeichnet:
- Glycin + Tetrahydrofolat + NAD+ ⇌ CO2 + NH+
4 + N5,N10-Methylen-Tetrahydrofolat + NADH + H+ ⓘ
Auf dem zweiten Weg wird Glycin in zwei Schritten abgebaut. Der erste Schritt ist die Umkehrung der Glycin-Biosynthese aus Serin mit Hilfe der Serin-Hydroxymethyl-Transferase. Serin wird dann durch Serindehydratase in Pyruvat umgewandelt. ⓘ
Im dritten Weg seines Abbaus wird Glycin durch D-Aminosäure-Oxidase in Glyoxylat umgewandelt. Glyoxylat wird dann durch hepatische Laktatdehydrogenase in einer NAD+-abhängigen Reaktion zu Oxalat oxidiert. ⓘ
Die Halbwertszeit von Glycin und seine Ausscheidung aus dem Körper variieren je nach Dosis erheblich. In einer Studie schwankte die Halbwertszeit zwischen 0,5 und 4,0 Stunden. ⓘ
Glycin reagiert äußerst empfindlich auf Antibiotika, die auf Folat abzielen, und der Glycinspiegel im Blut sinkt innerhalb einer Minute nach einer Antibiotika-Injektion stark ab. Einige Antibiotika können innerhalb weniger Minuten nach ihrer Verabreichung mehr als 90 % des Glycins verbrauchen. ⓘ
Physiologische Funktion
Die Hauptfunktion von Glycin besteht darin, als Vorläufer von Proteinen zu fungieren. Die meisten Proteine enthalten nur geringe Mengen an Glycin, eine bemerkenswerte Ausnahme ist Kollagen, das aufgrund seiner periodisch wiederkehrenden Rolle bei der Bildung der Helixstruktur des Kollagens in Verbindung mit Hydroxyprolin etwa 35 % Glycin enthält. Im genetischen Code wird Glycin durch alle Codons kodiert, die mit GG beginnen, nämlich GGU, GGC, GGA und GGG. ⓘ
Als biosynthetisches Zwischenprodukt
In höheren Eukaryonten wird δ-Aminolävulinsäure, die wichtigste Vorstufe der Porphyrine, durch das Enzym ALA-Synthase aus Glycin und Succinyl-CoA biosynthetisiert. Glycin bildet die zentrale C2N-Untereinheit aller Purine. ⓘ
Als Neurotransmitter
Glycin wirkt im Zentralnervensystem über den Glycinrezeptor als inhibitorischer Neurotransmitter, also als hemmender Signalstoff. Die Wirkung erfolgt über die Öffnung von ligandengesteuerten Chlorid-Kanälen und führt so zu einem inhibitorischen postsynaptischen Potential (IPSP), was die Aktivität der nachgeschalteten Nervenzelle herabsetzt. ⓘ
Am NMDA-Rezeptor hingegen wirkt es neben dem hauptsächlichen Agonisten Glutamat an einer speziellen Glycin-Bindungsstelle stimulierend. ⓘ
Glycin freisetzende Nervenzellen (glycinerge Neurone) kommen vor allem im Hirnstamm und im Rückenmark vor, in letzterem hemmen sie die Aktivität der Motoneuronen des Vorderhorns, wodurch es zu einer Herabsetzung der Aktivität der von diesen Zellen innervierten Muskeln kommt. ⓘ
Eine Herabsetzung der Glycinwirkung bewirken Strychnin, das als Antagonist die Bindungsstelle des Glycinrezeptors blockiert, und das Tetanustoxin, das die Ausschüttung von Glycin hemmt. Durch die Blockade der Glycinrezeptoren oder einen verminderten Glycinspiegel wird die Hemmung der Motoneuronenaktivität vermindert, sodass es zu lebensbedrohlichen Krämpfen kommen kann. ⓘ
Durch abnormale Ansammlung von Glycin kann es zur Glycin-Enzephalopathie kommen. ⓘ
Verwendungen
In den USA wird Glycin in der Regel in zwei Qualitäten verkauft: United States Pharmacopeia ("USP") und technische Qualität. Auf den Verkauf der USP-Qualität entfallen etwa 80 bis 85 Prozent des US-Marktes für Glycin. Wenn ein höherer Reinheitsgrad als der USP-Standard erforderlich ist, z. B. für intravenöse Injektionen, kann ein teureres Glycin in pharmazeutischer Qualität verwendet werden. Technisches Glycin, das den USP-Standards entsprechen kann oder auch nicht, wird zu einem niedrigeren Preis für industrielle Anwendungen verkauft, z. B. als Mittel für die Metallkomplexierung und -veredelung. ⓘ
Tierische und menschliche Lebensmittel
Glycin wird in Lebensmitteln nur selten wegen seines Nährwerts verwendet, außer in Aufgüssen. Stattdessen spielt Glycin in der Lebensmittelchemie eine Rolle als Aromastoff. Es ist leicht süß und wirkt dem Nachgeschmack von Saccharin entgegen. Es hat auch konservierende Eigenschaften, was vielleicht auf seine Komplexbildung mit Metallionen zurückzuführen ist. Metall-Glycinat-Komplexe, z. B. Kupfer(II)-Glycinat, werden als Zusatzstoffe für Tierfutter verwendet. ⓘ
Die US-amerikanische "Food and Drug Administration" betrachtet Glycin und seine Salze nicht mehr als allgemein als sicher für die Verwendung in Lebensmitteln anerkannt". ⓘ
Chemisches Ausgangsmaterial
Glycin ist ein Zwischenprodukt bei der Synthese einer Vielzahl von chemischen Produkten. Es wird für die Herstellung der Herbizide Glyphosat, Iprodion, Glyphosin, Imiprothrin und Eglinazin verwendet. Es wird als Zwischenprodukt für Arzneimittel wie Thiamphenicol verwendet. ⓘ
Forschung im Labor
Glycin ist ein wichtiger Bestandteil einiger Lösungen, die bei der SDS-PAGE-Methode der Proteinanalyse verwendet werden. Es dient als Puffermittel, das den pH-Wert aufrechterhält und eine Beschädigung der Probe während der Elektrophorese verhindert. Glycin wird auch verwendet, um proteinmarkierende Antikörper von Western-Blot-Membranen zu entfernen, um das Sondieren zahlreicher interessanter Proteine vom SDS-PAGE-Gel zu ermöglichen. Auf diese Weise können mehr Daten aus derselben Probe gewonnen werden, was die Zuverlässigkeit der Daten erhöht und den Aufwand für die Probenverarbeitung und die Anzahl der erforderlichen Proben verringert. Dieser Vorgang wird als Stripping bezeichnet. ⓘ
Vorhandensein im Raum
Das Vorhandensein von Glycin außerhalb der Erde wurde 2009 anhand der Analyse von Proben bestätigt, die 2004 von der NASA-Raumsonde Stardust vom Kometen Wild 2 genommen und anschließend zur Erde zurückgebracht worden waren. Glycin war bereits 1970 im Murchison-Meteoriten nachgewiesen worden. Die Entdeckung von Glycin im Weltraum untermauerte die Hypothese der so genannten Soft-Panspermie, die besagt, dass die "Bausteine" des Lebens im gesamten Universum verbreitet sind. Im Jahr 2016 wurde der Nachweis von Glycin im Kometen 67P/Churyumov-Gerasimenko durch die Raumsonde Rosetta bekannt gegeben. ⓘ
Der Nachweis von Glycin außerhalb des Sonnensystems im interstellaren Medium ist umstritten. Im Jahr 2008 entdeckte das Max-Planck-Institut für Radioastronomie die Spektrallinien eines Glycinvorläufers (Aminoacetonitril) in der Large Molecule Heimat, einer riesigen Gaswolke in der Nähe des galaktischen Zentrums im Sternbild Sagittarius. ⓘ
Entwicklung
Es wird angenommen, dass Glycin durch frühe genetische Codes definiert wurde. So sind z. B. Bereiche mit geringer Komplexität (in Proteinen), die den Proto-Peptiden des frühen genetischen Codes ähneln könnten, stark mit Glycin angereichert. ⓘ
Vorkommen in Lebensmitteln
| Lebensmittel | g/100g |
|---|---|
| Snacks, Schweineschwarten | 11.04 |
| Sesamsamenmehl (fettarm) | 3.43 |
| Getränke, Eiweißpulver (auf Sojabasis) | 2.37 |
| Saatgut, Saflorsamenmehl, teilweise entfettet | 2.22 |
| Fleisch, Bison, Rindfleisch und andere (verschiedene Teile) | 1.5-2.0 |
| Gelatine-Desserts | 1.96 |
| Samen, Kürbis- und Kürbiskernmehl | 1.82 |
| Pute, alle Klassen, Rücken, Fleisch und Haut | 1.79 |
| Hähnchen, Masthähnchen oder Brathähnchen, Fleisch und Haut | 1.74 |
| Schweinefleisch, gemahlen, 96% mager / 4% Fett, gekocht, Krümel | 1.71 |
| Speck und Rindfleischstäbchen | 1.64 |
| Erdnüsse | 1.63 |
| Krustentiere, Languste | 1.59 |
| Gewürze, Senfkörner, gemahlen | 1.59 |
| Salami | 1.55 |
| Nüsse, Butternüsse, getrocknet | 1.51 |
| Fisch, Lachs, rosa, in Dosen, abgetropft, Feststoffe | 1.42 |
| Mandeln | 1.42 |
| Fisch, Makrele | 0.93 |
| Getreide, verzehrfertig, Müsli, selbstgemacht | 0.81 |
| Lauch, (Zwiebel und unterer Teil der Blätter), gefriergetrocknet | 0.7 |
| Käse, Parmesan (und andere), gerieben | 0.56 |
| Sojabohnen, grün, gekocht, gekocht, abgetropft, ohne Salz | 0.51 |
| Brot, Eiweiß (einschließlich Gluten) | 0.47 |
| Ei, ganz, gekocht, gebraten | 0.47 |
| Bohnen, weiß, reife Kerne, gekocht, mit Salz | 0.38 |
| Linsen, reife Samen, gekocht, gekocht, mit Salz | 0.37 |
Eigenschaften
Glycin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der sauren Carboxygruppe an das einsame Elektronenpaar des Stickstoffatoms der basischen Aminogruppe wandert:

Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert, hier 5,97) der Fall, bei dem das Glycin auch seine geringste Löslichkeit in Wasser hat. ⓘ
- Van-der-Waals-Volumen: 48
- Hydrophobizitätsgrad: −0,4 ⓘ
Freies Glycin hat einen süßen Geschmack, wobei der Erkennungsschwellenwert bei 25 bis 35 mmol/L liegt. ⓘ
Vorkommen
Die folgenden Beispiele geben einen Überblick über Glycingehalte und beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Glycin, bezogen auf das Gesamtprotein, angegeben:
| Lebensmittel | Gesamt- protein |
Glycin | Anteil ⓘ |
|---|---|---|---|
| Schweinefleisch, roh | 21 g | 0,95 g | 4,5 % |
| Hähnchenbrustfilet, roh | 21 g | 0,95 g | 4,4 % |
| Lachs, roh | 20,5 g | 0,95 g | 4,7 % |
| Gelatinepulver, ungesüßt | 86 g | 19 g | 22,3 % |
| Hühnerei | 12,5 g | 0,43 g | 3,4 % |
| Kuhmilch, 3,7 % Fett | 3,3 g | 0,07 g | 2,1 % |
| Walnüsse | 15 g | 0,82 g | 5,4 % |
| Kürbiskerne | 30 g | 1,85 g | 6,1 % |
| Weizen-Vollkornmehl | 14 g | 0,55 g | 4,0 % |
| Mais-Vollkornmehl | 7,0 g | 0,28 g | 4,1 % |
| Reis, ungeschält | 8,0 g | 0,39 g | 4,9 % |
| Sojabohnen, getrocknet | 36,5 g | 1,9 g | 5,2 % |
| Erbsen, getrocknet | 24,5 g | 1,1 g | 4,4 % |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes Glycin als Proteinbestandteil, jedoch kein freies Glycin. ⓘ
Glycin wurde 2009 erstmals in Partikelproben aus der Koma eines Kometen nachgewiesen, gesammelt mit der Raumsonde Stardust 2004 in der Nähe von 81P/Wild 2. 2016 gelang der Nachweis auch im Schweif des Kometen 67P/Tschurjumow-Gerassimenko. ⓘ
Funktionen
Stoffwechsel
Die Umsetzung von Serin zu Glycin dient neben der Erzeugung von Glycin auch der Umsetzung von Tetrahydrofolsäure zu N5-N10-Methylen-Tetrahydrofolsäure (TH4), die unter anderem für die Synthese von Thymin-Nukleotiden (DNA-Bestandteil) benötigt wird. ⓘ
Umgekehrt kann Glycin unter Aufnahme von CH3 aus TH4 zur Synthese von Serin dienen, welches dann für die Proteinsynthese, als Grundsubstanz des Cholins oder als Pyruvat zur Verfügung steht. ⓘ
Auch für die Synthese anderer Bestandteile der Erbsubstanz (Purine) wird Glycin häufig benötigt. ⓘ
Es dient ebenfalls der Biosynthese von Häm (Sauerstoff-Bindung im Blut), Kreatin (Energiespeicher im Muskel) oder Glutathion:
- Glycin + Succinyl-CoA → 5-Aminolävulinsäure → Porphyrinsynthese zum Aufbau des Häm. ⓘ
- Glycin + Guanodingruppe (aus Arginin) → Guanidinoacetat, welches dann in die Kreatininsynthese eingehen kann. ⓘ
- Glycin + Glu-Cys-Peptidbindung → Glutathionsäure ⓘ
Als Nebenprodukt kann aus Glycin auch gesundheitsschädliche Oxalsäure gebildet werden. ⓘ
Als sog. glucogene oder glucoplastische Aminosäure kann Glycin im Rahmen des Stoffwechsels über Pyruvat zu Glucose umgesetzt werden. ⓘ
Proteinbestandteil
Aufgrund seiner geringen Größe wird Glycin bevorzugt in Polypeptide an räumlich beengten Positionen (der Protein-Sekundärstruktur) eingebaut. ⓘ
Besonders häufig kommt es im Kollagen, dem häufigsten Protein in tierischen Organismen, vor. Hier macht es gut ein Drittel aller Aminosäuren aus, da es aufgrund seiner geringen Größe das Aufwickeln des Kollagens zu dessen Tripelhelix-Struktur erlaubt. ⓘ
Verwendung
Als Geschmacksverstärker wird Glycin Lebensmitteln zugesetzt. ⓘ
Glycin sowie sein Natriumsalz sind in der EU als Lebensmittelzusatzstoff der Nummer E 640 ohne Höchstmengenbeschränkung für Lebensmittel allgemein zugelassen, negative gesundheitliche Auswirkungen sind nicht bekannt. ⓘ
Weiterhin ist Glycin ein Bestandteil von Infusionslösungen zur parenteralen Ernährung. ⓘ
Bei der monopolaren transurethralen Resektion kann Glycin neben einem Gemisch aus Mannitol und Sorbitol als Zusatz zur Spülflüssigkeit eingesetzt werden. ⓘ
In der molekularbiologischen bzw. biochemischen Forschung wird Glycin in Form eines TRIS-Glycin-Puffersystems bei der Proteinauftrennung mittels SDS-PAGE verwendet; die Glycin-Ionen fungieren dabei als Folgeionen im Sammelgel. ⓘ