Botulinumtoxin
| Botulinumtoxin Serotyp A (Clostridium botulinum) ⓘ | ||
|---|---|---|
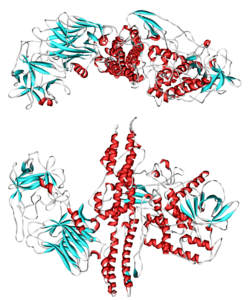
| ||
| Bändermodell nach PDB 3BTA | ||
|
Vorhandene Strukturdaten: siehe UniProt-Eintrag | ||
| Masse/Länge Primärstruktur | 447+848 AS (L+S) | |
| Sekundär- bis Quartärstruktur | Heterodimer L+S | |
| Kofaktor | Zn2+ | |
| Präkursor | 1296 Aminosäuren; 146 kDa | |
| Bezeichner | ||
| Gen-Name(n) | BoNT/A | |
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | M03AX01 | |
| DrugBank | DB00083 | |
| Wirkstoffklasse | Muskelrelaxans | |
| Transporter-Klassifikation | ||
| TCDB | 1.C.8 | |
| Bezeichnung | Botulinum/Tetanus Toxinfamilie | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.24.69, Metalloprotease | |
| MEROPS | M27.002 | |
| Reaktionsart | Hydrolyse | |
| Substrat | Proteine der Neuroexozytose, Synaptobrevine, Syntaxine | |
| Produkte | Spaltprodukte | |
| Vorkommen | ||
| Homologie-Familie | Botulinumtoxin | |
| Übergeordnetes Taxon | Clostridium | |
Botulinumtoxin (BTX), auch Botulinum-Neurotoxin (BoNT), Botulismustoxin, Botulinustoxin, Botulin – bekannt auch unter dem Handelsnamen Botox für das erste Botulinumtoxin-Fertigpräparat – ist ein Sammelbegriff für mehrere sehr ähnliche neurotoxische Proteine. Die Neurotoxine werden von verschiedenen Stämmen der Bakterienspezies Clostridium botulinum, Clostridium butyricum, Clostridium baratii sowie Clostridium argentinense gebildet und ausgeschieden; es sind damit Exotoxine. ⓘ
Die Giftwirkung dieser Proteine beruht auf der Hemmung der Erregungsübertragung von Nervenzellen, was neben Störungen des vegetativen Nervensystems insbesondere eine Muskelschwäche bis hin zum Stillstand der Lungenfunktion zur Folge haben kann. Botulinumtoxin ist für Lebewesen wie den Menschen das mit Abstand tödlichste bekannte Gift. Die LD50-Werte für Mäuse betragen 3 ng/kg bei Inhalation, bis 4 ng/kg bei subkutaner Aufnahme und bei intravenöser Gabe sind bereits 30 pg/kg (0,03 ng/kg) tödlich. ⓘ
Die Vergiftung mit Botulinustoxinen wird Botulismus genannt und ist eine gefürchtete Lebensmittelvergiftung, sie kann auch infolge von Darminfektionen und Wundinfektionen mit C. botulinum auftreten. Seit den 1980er-Jahren werden die von dem Bakterium erzeugten toxischen Proteine zu medizinischen Zwecken eingesetzt, vorwiegend zur Behandlung neurologischer Bewegungsstörungen (Dystonie). Die Verwendung in der kosmetischen Medizin zur vorübergehenden Abschwächung von Falten (Wirkungsdauer 3–6 Monate) ist wegen der dadurch bedingten massiven Zunahme von Tierversuchen heftig kritisiert worden. Außerdem besteht das Risiko gravierender Nervenschäden ohne medizinische Notwendigkeit für den Eingriff. ⓘ
Clostridium botulinum kommt ubiquitär im Erdboden wie im Sediment von Gewässern vor und bildet widerstandsfähige Endosporen, ebenso wie Clostridium tetani, welches das strukturell ähnliche Tetanustoxin produziert. Welchen evolutionären Nutzen solche für den Wirt pathogenen Wirkstoffe dem parasitierenden Mikroorganismus bringen, ist Gegenstand der Diskussion. ⓘ
 | |
| Klinische Daten | |
|---|---|
| Handelsnamen | Botox, Myobloc, Jeuveau, andere |
| AHFS/Drugs.com | Monographie |
| MedlinePlus | a619021 |
| Lizenz-Daten |
|
| Schwangerschaft Kategorie |
|
| Wege der Verabreichung | IM (zugelassen), SC, intradermal, in die Drüsen |
| ATC-Code |
|
| Rechtlicher Status | |
| Rechtlicher Status |
|
| Kennzeichnungsmittel | |
| CAS-Nummer | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| Chemische und physikalische Daten | |
| Formel | C6760H10447N1743O2010S32 |
| Molare Masse | 149323,05 g-mol-1 |
| | |
| Bontoxilysin ⓘ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Kennzeichnungsmittel | |||||||||
| EC-Nr. | 3.4.24.69 | ||||||||
| Datenbanken | |||||||||
| IntEnz | IntEnz Ansicht | ||||||||
| BRENDA | BRENDA-Eintrag | ||||||||
| ExPASy | NiceZyme Ansicht | ||||||||
| KEGG | KEGG-Eintrag | ||||||||
| MetaCyc | Stoffwechselweg | ||||||||
| PRIAM | Profil | ||||||||
| PDB-Strukturen | RCSB PDB PDBe PDBsum | ||||||||
| Gen Ontologie | AmiGO / SchnellGO | ||||||||
| |||||||||
Botulinumtoxin (BoNT), oft abgekürzt als Botox, ist ein neurotoxisches Protein, das von dem Bakterium Clostridium botulinum und verwandten Arten produziert wird. Es verhindert die Freisetzung des Neurotransmitters Acetylcholin aus den Axonenden an der neuromuskulären Verbindung und verursacht dadurch schlaffe Lähmungen. Das Toxin verursacht die Krankheit Botulismus. Das Toxin wird auch kommerziell für medizinische und kosmetische Zwecke verwendet. ⓘ
Die sieben Haupttypen von Botulinumtoxin werden als Typen A bis G bezeichnet (A, B, C1, C2, D, E, F und G). Gelegentlich werden neue Typen gefunden. Die Typen A und B sind in der Lage, beim Menschen Krankheiten zu verursachen, und werden auch kommerziell und medizinisch verwendet. Die Typen C-G sind weniger verbreitet; die Typen E und F können beim Menschen Krankheiten verursachen, während die anderen Typen Krankheiten bei anderen Tieren hervorrufen. Die Botulinumtoxin-Typen A und B werden in der Medizin zur Behandlung verschiedener Muskelkrämpfe eingesetzt. ⓘ
Medizinische Anwendungen
Botulinumtoxine sind von Bakterien produzierte Exotoxine. Werden sie in einen Muskel gespritzt, so blockieren sie dort gezielt durch Zerstörung von Proteinkomplexen die Freisetzung des Neurotransmitters Acetylcholin. Dadurch kann der entsprechende Muskel nicht mehr wie gewohnt angespannt werden. Andere Nervenfunktionen – wie das Fühlen oder Tasten – werden nicht beeinflusst. Nach einer therapeutischen Injektion baut sich die Wirkung langsam auf und erreicht – je nach Indikation und Dosis – nach etwa zehn Tagen ihren Höhepunkt. Nach zwei bis sechs Monaten ist die Neuaussprossung der Nervenenden beendet, wodurch die Muskeln wieder aktiviert werden können. Die Injektion kann mit gleichzeitiger Messung eines Elektromyogrammes (EMG) im Muskel, der sogenannten Stimulationstechnik, ultraschallgesteuert oder nach anatomischer Kenntnis erfolgen. Es gibt eine Anzahl von Patienten mit Nerven-Muskelkrankheiten, bei denen der Körper nach vorhergehender langer und hochdosierter Anwendung neutralisierende Antikörper gegen den Subtyp A bildet; die Wirksamkeit der Medikamente nimmt dadurch ab oder geht ganz verloren. Seit 2001 sind auch Subtyp-B-Präparate (Neurobloc bzw. Myobloc, Zulassung 2001 gegen Schiefhalssyndrom) verfügbar. Diese besitzen allerdings eine deutlich kürzere Wirkungsdauer. ⓘ
Botulinumtoxin wird zur Behandlung einer Reihe von therapeutischen Indikationen eingesetzt, von denen viele nicht in der zugelassenen Arzneimittelbezeichnung enthalten sind. ⓘ
Spastizität der Muskeln
Botulinumtoxin wird zur Behandlung einer Reihe von Erkrankungen eingesetzt, die durch übermäßige Muskelbewegungen gekennzeichnet sind, z. B. Zerebralparese, Spastizität nach Schlaganfall, Spastizität nach Rückenmarksverletzung, Spasmen von Kopf und Hals, Augenlid, Vagina, Gliedmaßen, Kiefer und Stimmbändern. In ähnlicher Weise wird Botulinumtoxin verwendet, um das Zusammenpressen von Muskeln zu entspannen, einschließlich der Muskeln der Speiseröhre, des Kiefers, der unteren Harnwege und der Blase, oder das Zusammenpressen des Anus, das eine Analfissur verschlimmern kann. Botulinumtoxin scheint bei refraktärer überaktiver Blase wirksam zu sein. ⓘ
Andere Muskelstörungen
Schielen (Strabismus), auch bekannt als falsche Ausrichtung der Augen, wird durch ein Ungleichgewicht der Muskeln verursacht, die die Augen drehen. Dieser Zustand kann manchmal durch die Schwächung eines Muskels gelindert werden, der zu stark zieht oder gegen einen Muskel zieht, der durch eine Krankheit oder ein Trauma geschwächt ist. Die durch eine Toxininjektion geschwächten Muskeln erholen sich nach einigen Monaten von der Lähmung, so dass die Injektion scheinbar wiederholt werden muss. Die Muskeln passen sich jedoch an die Längen an, auf denen sie chronisch gehalten werden, so dass ein gelähmter Muskel, wenn er von seinem Antagonisten gedehnt wird, länger wird, während sich der Antagonist verkürzt, was einen dauerhaften Effekt hat. Wenn das beidäugige Sehen gut ist, kann der Gehirnmechanismus der motorischen Fusion, der die Augen auf ein für beide sichtbares Ziel ausrichtet, die korrigierte Ausrichtung stabilisieren. ⓘ
Im Januar 2014 wurde Botulinumtoxin von der britischen Arzneimittelzulassungsbehörde (Medicines and Healthcare products Regulatory Agency) für die Behandlung von Bewegungseinschränkungen im Knöchelbereich aufgrund von Spastizität der unteren Gliedmaßen im Zusammenhang mit einem Schlaganfall bei Erwachsenen zugelassen. ⓘ
Am 29. Juli 2016 hat die US-amerikanische Food and Drug Administration (FDA) AbobotulinumtoxinA zur Injektion für die Behandlung von Spastizität der unteren Gliedmaßen bei pädiatrischen Patienten ab zwei Jahren zugelassen. AbobotulinumtoxinA ist das erste und einzige von der FDA zugelassene Botulinumtoxin für die Behandlung der Spastik der unteren Gliedmaßen bei Kindern. In den USA genehmigt die FDA den Text der Etiketten von verschreibungspflichtigen Arzneimitteln und legt fest, für welche medizinischen Bedingungen der Arzneimittelhersteller das Medikament verkaufen darf. Verordner können sie jedoch für jede beliebige Erkrankung verschreiben, auch bekannt als Off-Label-Use. Botulinumtoxine wurden bei mehreren pädiatrischen Erkrankungen, darunter auch bei der kindlichen Esotropie, als Off-Label-Mittel eingesetzt. ⓘ
Übermäßiges Schwitzen
AbobotulinumtoxinA (BTX-A) wurde für die Behandlung von übermäßigem Schwitzen unter den Achseln unbekannter Ursache zugelassen, das mit topischen Mitteln nicht behandelt werden kann. ⓘ
Migräne
Im Jahr 2010 hat die FDA intramuskuläre Botulinumtoxin-Injektionen zur prophylaktischen Behandlung von chronischen Migränekopfschmerzen zugelassen. ⓘ
Kosmetische Indikationen
Bei kosmetischen Anwendungen gilt Botulinumtoxin als relativ sicher und wirksam bei der Reduzierung von Gesichtsfalten, insbesondere im obersten Drittel des Gesichts. Kommerzielle Formen werden unter den Markennamen Botox Cosmetic/Vistabel von Allergan, Dysport/Azzalure von Galderma und Ipsen, Xeomin/Bocouture von Merz und, nur in den USA, Jeuveau von Evolus, hergestellt von Daewoong, vertrieben. Die Wirkung der derzeitigen Botulinumtoxin-Injektionen zur Behandlung der Glabellafalten ("Elferfalten" zwischen den Augen) hält in der Regel zwei bis vier Monate an und ist in einigen Fällen produktabhängig, wobei einige Patienten eine längere Wirkungsdauer erleben. Die Injektion von Botulinumtoxin in die Muskeln unter den Gesichtsfalten bewirkt eine Entspannung dieser Muskeln, was zu einer Glättung der darüber liegenden Haut führt. Die Glättung der Falten ist in der Regel drei bis fünf Tage nach der Injektion sichtbar, wobei die maximale Wirkung in der Regel eine Woche nach der Injektion eintritt. Die Muskeln können wiederholt behandelt werden, um das geglättete Aussehen zu erhalten. ⓘ
Andere
Botulinumtoxin wird auch zur Behandlung von Störungen hyperaktiver Nerven eingesetzt, darunter übermäßiges Schwitzen, neuropathische Schmerzen und einige Allergiesymptome. Zusätzlich zu diesen Anwendungen wird Botulinumtoxin auch für die Behandlung chronischer Schmerzen untersucht. Studien zeigen, dass Botulinumtoxin in arthritische Schultergelenke injiziert werden kann, um chronische Schmerzen zu lindern und den Bewegungsumfang zu verbessern. Die Anwendung von Botulinumtoxin A bei Kindern mit zerebraler Lähmung ist in den Muskeln der oberen und unteren Gliedmaßen sicher. ⓘ
Nebeneffekte
Obwohl Botulinumtoxin in der klinischen Praxis im Allgemeinen als sicher gilt, können bei seiner Anwendung ernste Nebenwirkungen auftreten. Am häufigsten kann Botulinumtoxin in die falsche Muskelgruppe injiziert werden oder sich mit der Zeit von der Injektionsstelle ausbreiten, was zu einer vorübergehenden Lähmung der unbeabsichtigten Muskeln führt. ⓘ
Nebenwirkungen bei der kosmetischen Anwendung sind im Allgemeinen auf eine unbeabsichtigte Lähmung der Gesichtsmuskeln zurückzuführen. Dazu gehören partielle Gesichtslähmungen, Muskelschwäche und Schluckbeschwerden. Die Nebenwirkungen beschränken sich jedoch nicht auf direkte Lähmungen, sondern können auch Kopfschmerzen, grippeähnliche Symptome und allergische Reaktionen umfassen. So wie kosmetische Behandlungen nur einige Monate dauern, können auch die Nebenwirkungen von Lähmungen die gleiche Dauer haben. Zumindest in einigen Fällen wird berichtet, dass diese Wirkungen in den Wochen nach der Behandlung abklingen. Blutergüsse an der Injektionsstelle sind keine Nebenwirkung des Toxins, sondern eher der Verabreichungsart und können den Berichten zufolge vermieden werden, wenn der Arzt Druck auf die Injektionsstelle ausübt; wenn sie auftreten, dauern sie in bestimmten Fällen 7-11 Tage an. Bei der Injektion in den Kaumuskel des Kiefers kann der Verlust der Muskelfunktion zu einem Verlust oder einer Verringerung der Fähigkeit führen, feste Nahrung zu kauen. Bei fortgesetzter hoher Dosierung können die Muskeln verkümmern oder an Kraft verlieren; Untersuchungen haben gezeigt, dass sich diese Muskeln nach einer Pause von Botox wieder aufbauen. ⓘ
Die Nebenwirkungen der therapeutischen Anwendung können je nach Injektionsstelle und Dosis des injizierten Toxins sehr viel unterschiedlicher sein. Im Allgemeinen können die Nebenwirkungen bei der therapeutischen Anwendung schwerwiegender sein als bei der kosmetischen Anwendung. Sie können sich aus der Lähmung kritischer Muskelgruppen ergeben und zu Herzrhythmusstörungen, Herzinfarkt und in einigen Fällen zu Krampfanfällen, Atemstillstand und Tod führen. Darüber hinaus sind Nebenwirkungen, die bei der kosmetischen Anwendung auftreten, auch bei der therapeutischen Anwendung üblich, darunter Schluckbeschwerden, Muskelschwäche, allergische Reaktionen und grippeähnliche Syndrome. ⓘ
Als Reaktion auf das Auftreten dieser Nebenwirkungen hat die FDA im Jahr 2008 die Öffentlichkeit über die potenziellen Gefahren von Botulinumtoxin als Therapeutikum informiert. Das Toxin kann sich nämlich auf Bereiche ausbreiten, die von der Injektionsstelle entfernt sind, und unbeabsichtigte Muskelgruppen lähmen, insbesondere bei der Behandlung von Muskelspastiken bei Kindern, die wegen Zerebralparese behandelt werden. Im Jahr 2009 kündigte die FDA an, dass den verfügbaren Botulinumtoxin-Produkten Warnhinweise hinzugefügt werden sollen, die vor der Möglichkeit der Ausbreitung von der Injektionsstelle warnen. Die klinische Anwendung von Botulinumtoxin A bei Kindern mit zerebraler Kinderlähmung hat sich jedoch als sicher erwiesen und hat nur minimale Nebenwirkungen. Darüber hinaus kündigte die FDA Namensänderungen für mehrere Botulinumtoxin-Produkte an, um zu betonen, dass die Produkte nicht austauschbar sind und für eine ordnungsgemäße Anwendung unterschiedliche Dosierungen erfordern. Botox und Botox Cosmetic erhielten die INN OnabotulinumtoxinA, Myobloc die INN RimabotulinumtoxinB, und Dysport behielt seine INN AbobotulinumtoxinA. In diesem Zusammenhang gab die FDA eine Mitteilung an Angehörige der Gesundheitsberufe heraus, in der sie die neuen Medikamentennamen und die zugelassenen Verwendungszwecke für jedes Medikament wiederholte. Eine ähnliche Warnung wurde 2009 von Health Canada herausgegeben, in der davor gewarnt wurde, dass Botulinumtoxin-Produkte auf andere Körperteile übergreifen können. ⓘ
Die therapeutische Breite des Toxins ist bei einem durch Versuche mit Affen ermittelten LD50-Wert von etwa 2000 ng bei intraorbitaler (in die Augenhöhle) Injektion groß; dies entspricht etwa 50 Ampullen Botox. Bei einer Überdosierung, oder wenn das Toxin in die Blutbahn gelangt, steht ein polyvalentes Botulismus-Antitoxin vom Pferd zur Verfügung. Es gehört in größeren Krankenhäusern zum Notfalldepot. Meist erfolgt die intravenöse Injektion aber zu spät und der Patient kann sich nicht sofort vollständig erholen. Eine künstliche Beatmung über längere Zeit ist unabdingbar. ⓘ
Als Nebenwirkungen bei subkutaner oder intramuskulärer Injektion werden relativ häufig eine Ptosis (beim Lidkrampf), vorübergehende Muskelschwäche, lokale, aus der Injektion resultierende Schmerzen, Mundtrockenheit, Störungen der Akkommodation des Auges sowie Hämatome genannt. ⓘ
Bei kosmetischer Verwendung wurden am häufigsten Schluckstörungen (Dysphagie) und in Einzelfällen unter anderem Sarkoidose (eine Erkrankung des Bindegewebes) an der Injektionsstelle sowie Blutergüsse durch arterielle Schäden (Pseudoaneurysma) berichtet. In einer systematischen Übersichtsarbeit von 2015 über bekannte Komplikationen bei kosmetischer Verwendung von Botulinumtoxin wurde gefordert, die Patienten vor einem Eingriff über folgende mögliche, ernste Nebenwirkungen aufzuklären: Syndrom des trockenen Auges (Keratoconjunctivitis sicca), Schielen (Strabismus), Doppelsehen (Diplopie), Pseudoaneurysma der oberflächlichen Schläfenarterie (Arteria temporalis superficialis), Nackenschwäche (neck weakness), Stimmstörung (Dysphonie) und Schluckstörungen. ⓘ
Die lokale Injektion vermindert die Gefahr von Nebenwirkungen (im Gegensatz zu einer wenig sinnvollen systemischen Behandlung), verlangt aber dennoch einen hohen Kenntnisstand beim Anwendenden. Oft wird eine sogenannte Titrierung angewandt, d. h., es wird zunächst eine zu geringe Dosis injiziert, die in zwei- bis dreiwöchigem Abstand durch eine jeweils höhere Menge ergänzt wird. ⓘ
Nachteilig ist zunächst auch, dass die Wirkung im günstigsten Fall nach etwa 24 Stunden, im Normalfall nach zwei bis zehn Tagen eintritt, dann aber – je nach Dosierung und Indikation – zwei bis sechs Monate anhält. ⓘ
Lähmt Botulinumtoxin die emotionale Mimik, dann schränken auch gefühlsverarbeitende Hirnregionen – wie die linke Amygdala – ihre Aktivität ein. Dies verhindert das mimische Nachspielen und damit das Verstehen von Emotionen („embodied emotion“, „verkörpertes Gefühl“). ⓘ
Nachgewiesen ist die systemische Ausbreitung von Botulinumtoxin von der Stelle der lokalen Anwendung in andere Bereiche des Körpers, insbesondere im Nervensystem. Obwohl dieser Ausbreitung bereits Störungen und Schädigungen zugeordnet wurden, sind die zugrundeliegenden Mechanismen der Ausbreitung und ihrer Folgen bisher (Stand 2016) nahezu unerforscht. ⓘ
Rolle bei Krankheiten
Botulinumtoxin, das von Clostridium botulinum produziert wird, ist die Ursache für Botulismus. Menschen nehmen das Toxin am häufigsten durch den Verzehr unsachgemäß konservierter Lebensmittel auf, in denen C. botulinum gewachsen ist. Das Toxin kann aber auch über eine infizierte Wunde aufgenommen werden. Bei Säuglingen kann das Bakterium manchmal im Darm wachsen und dort Botulinumtoxin produzieren, was zu einem Zustand führen kann, der als Floppy-Baby-Syndrom bekannt ist. In allen Fällen kann sich das Toxin dann ausbreiten und die Nerven- und Muskelfunktion blockieren. In schweren Fällen kann das Toxin die Nerven, die das Atmungssystem oder das Herz kontrollieren, blockieren, was zum Tod führen kann. Botulismus kann schwer zu diagnostizieren sein, da er Krankheiten wie dem Guillain-Barré-Syndrom, Myasthenia gravis und Schlaganfällen ähneln kann. Andere Tests, wie z. B. eine Gehirnuntersuchung und eine Untersuchung der Rückenmarksflüssigkeit, können helfen, andere Ursachen auszuschließen. Wenn die Symptome des Botulismus frühzeitig erkannt werden, können verschiedene Behandlungen durchgeführt werden. Um kontaminierte Lebensmittel, die im Darm verbleiben, zu entfernen, können Einläufe oder induziertes Erbrechen eingesetzt werden. Bei Wundinfektionen kann infiziertes Material chirurgisch entfernt werden. Botulinum-Antitoxin ist verfügbar und kann eingesetzt werden, um eine Verschlimmerung der Symptome zu verhindern, obwohl es bestehende Nervenschäden nicht rückgängig machen kann. In schweren Fällen kann eine mechanische Beatmung eingesetzt werden, um Patienten mit Atemversagen zu unterstützen. Die Nervenschäden heilen mit der Zeit, im Allgemeinen über Wochen bis Monate. Mit der richtigen Behandlung kann die Sterblichkeitsrate bei Botulinum-Vergiftungen stark reduziert werden. ⓘ
Für die Behandlung von Botulismus stehen zwei Präparate von Botulinum-Antitoxinen zur Verfügung. Trivalentes (Serotypen A, B, E) Botulinum-Antitoxin wird aus Pferdequellen unter Verwendung ganzer Antikörper gewonnen. Das zweite Antitoxin ist das heptavalente Botulinum-Antitoxin (Serotypen A, B, C, D, E, F, G), das aus Antikörpern von Pferden gewonnen wird, die so verändert wurden, dass sie weniger immunogen sind. Dieses Antitoxin ist gegen alle Hauptstämme des Botulismus wirksam. ⓘ
Wirkmechanismus

Botulinumtoxin entfaltet seine Wirkung durch die Spaltung von Schlüsselproteinen, die für die Aktivierung des Nervs erforderlich sind. Zunächst bindet das Toxin spezifisch an Nerven, die den Neurotransmitter Acetylcholin verwenden. Sobald es an die Nervenendigung gebunden ist, nimmt das Neuron das Toxin durch rezeptorvermittelte Endozytose in ein Vesikel auf. Wenn sich das Vesikel weiter in die Zelle hineinbewegt, säuert es an und aktiviert einen Teil des Toxins, der es dazu veranlasst, die Vesikelmembran zu überwinden und in das Zellzytoplasma zu gelangen. BoNTs erkennen gleichzeitig verschiedene Klassen von Rezeptoren (Ganglioside, Synaptotagmin und SV2). Im Zytoplasma angekommen, spaltet das Toxin die SNARE-Proteine (Proteine, die die Fusion von Vesikeln mit ihren membrangebundenen Zielkompartimenten vermitteln), was bedeutet, dass die Acetylcholinvesikel nicht an die intrazelluläre Zellmembran binden können, wodurch die Zelle daran gehindert wird, Neurotransmittervesikel freizusetzen. Dadurch wird die Nervensignalübertragung unterbrochen, was zu Lähmungen führt. ⓘ
Das Toxin selbst wird als Einzelkette aus dem Bakterium freigesetzt und wird dann aktiviert, wenn es durch seine eigenen Proteasen gespalten wird. Die aktive Form besteht aus einem zweikettigen Protein, das aus einem 100-kDa-Polypeptid der schweren Kette besteht, das über eine Disulfidbindung mit einem 50-kDa-Polypeptid der leichten Kette verbunden ist. Die schwere Kette enthält Domänen mit mehreren Funktionen; sie verfügt über die Domäne, die für die spezifische Bindung an präsynaptische Nervenendigungen verantwortlich ist, sowie über die Domäne, die für die Translokation der leichten Kette in das Zellzytoplasma verantwortlich ist, wenn die Vakuole ansäuert. Die leichte Kette ist eine Zinkmetalloprotease der M27-Familie und stellt den aktiven Teil des Toxins dar. Sie wird in das Zytoplasma der Wirtszelle verlagert, wo sie das Wirtsprotein SNAP-25 spaltet, ein Mitglied der SNARE-Proteinfamilie, das für die Fusion verantwortlich ist. Das gespaltene SNAP-25 kann die Fusion der Vesikel mit der Wirtszellmembran nicht vermitteln und verhindert so die Freisetzung des Neurotransmitters Acetylcholin aus den Axonendigungen. Diese Blockade wird langsam rückgängig gemacht, wenn das Toxin an Aktivität verliert und die SNARE-Proteine von der betroffenen Zelle langsam regeneriert werden. ⓘ
Die sieben Toxin-Serotypen (A-G) werden traditionell nach ihrer Antigenität unterschieden. Sie weisen unterschiedliche Tertiärstrukturen und Sequenzunterschiede auf. Während die verschiedenen Toxintypen alle auf Mitglieder der SNARE-Familie abzielen, zielen verschiedene Toxintypen auf unterschiedliche Mitglieder der SNARE-Familie ab. Die Serotypen A, B und E verursachen beim Menschen Botulismus, wobei die Aktivität der Typen A und B in vivo am längsten anhält (mehrere Wochen bis Monate). Bestehende Toxintypen können rekombinieren und so "hybride" (mosaische, chimäre) Typen bilden. Beispiele hierfür sind BoNT/CD, BoNT/DC und BoNT/FA, wobei der erste Buchstabe für den leichten und der zweite für den schweren Kettentyp steht. BoNT/FA erlangte unter dem Namen "BoNT/H" große Aufmerksamkeit, da man fälschlicherweise annahm, dass es durch kein vorhandenes Antitoxin neutralisiert werden könne. ⓘ
Botulinumtoxine sind eng mit dem Tetanustoxin verwandt; die beiden werden als Clostridium-Neurotoxine bezeichnet, und die leichte Kette wird von MEROPS als Familie M27 klassifiziert. Zu den nichtklassischen Typen gehören BoNT/X (P0DPK1), das bei Mäusen und möglicherweise auch beim Menschen toxisch wirkt, ein BoNT/J (A0A242DI27), das in Enterokokken von Kühen vorkommt, und ein BoNT/Wo (A0A069CUU9), das in der Reis besiedelnden Weissella oryzae vorkommt. ⓘ
Geschichte
Erste Beschreibungen und Entdeckung von Clostridium botulinum
Einer der ersten dokumentierten Ausbrüche von lebensmittelbedingtem Botulismus ereignete sich 1793 im Dorf Wildbad im heutigen Baden-Württemberg, Deutschland. Dreizehn Menschen erkrankten und sechs starben, nachdem sie mit Blutwurst gefüllte Schweinemägen, eine lokale Delikatesse, gegessen hatten. Weitere Fälle von tödlichen Lebensmittelvergiftungen in Württemberg veranlassten die Behörden 1802 zu einer öffentlichen Warnung vor dem Verzehr geräucherter Blutwürste und zur Sammlung von Fallberichten über "Wurstvergiftungen". Zwischen 1817 und 1822 veröffentlichte der deutsche Arzt Justinus Kerner die erste vollständige Beschreibung der Symptome des Botulismus, die auf umfangreichen klinischen Beobachtungen und Tierversuchen beruhte. Er kam zu dem Schluss, dass sich das Toxin in verdorbenen Würsten unter anaeroben Bedingungen entwickelt, eine biologische Substanz ist, auf das Nervensystem wirkt und bereits in geringen Mengen tödlich ist. Kerner stellte die Hypothese auf, dass dieses "Wurstgift" zur Behandlung einer Reihe von Krankheiten eingesetzt werden könnte, die durch ein überaktives Nervensystem verursacht werden, und war damit der erste, der eine therapeutische Verwendung vorschlug. 1870 prägte der deutsche Arzt Müller den Begriff "Botulismus" für die durch eine Wurstvergiftung hervorgerufene Krankheit, abgeleitet von dem lateinischen Wort botulus, was "Wurst" bedeutet. ⓘ
1895 entdeckte der belgische Mikrobiologe Émile van Ermengem das heute als Clostridium botulinum bezeichnete Bakterium und bestätigte, dass ein von ihm produziertes Toxin Botulismus verursacht. Am 14. Dezember 1895 kam es in dem belgischen Dorf Ellezelles bei einer Beerdigung, bei der Menschen eingelegten und geräucherten Schinken aßen, zu einem großen Ausbruch von Botulismus; drei von ihnen starben. Durch die Untersuchung des kontaminierten Schinkens und die Autopsie der nach dem Verzehr verstorbenen Personen isolierte van Ermengem einen anaeroben Mikroorganismus, den er Bacillus botulinus nannte. Er führte auch Tierversuche mit Schinkenextrakten, isolierten Bakterienkulturen und Toxinextrakten der Bakterien durch. Daraus schloss er, dass die Bakterien selbst keinen lebensmittelbedingten Botulismus verursachen, sondern vielmehr ein Toxin produzieren, das nach der Einnahme die Krankheit verursacht. Aufgrund der Forschungen von Kerner und van Ermengem ging man davon aus, dass nur verunreinigtes Fleisch oder Fisch Botulismus verursachen kann. Diese Vorstellung wurde 1904 widerlegt, als in Darmstadt (Deutschland) ein Botulismusausbruch auftrat, der auf weiße Bohnen in Dosen zurückzuführen war. Im Jahr 1910 veröffentlichte der deutsche Mikrobiologe J. Leuchs eine Arbeit, in der er nachwies, dass die Ausbrüche in Ellezelles und Darmstadt durch verschiedene Stämme von Bacillus botulinus verursacht wurden und dass sich die Toxine serologisch voneinander unterschieden. 1917 wurde Bacillus botulinus in Clostridium botulinum umbenannt, da beschlossen wurde, dass sich der Begriff Bacillus nur auf eine Gruppe aerober Mikroorganismen beziehen sollte, während Clostridium nur zur Beschreibung einer Gruppe anaerober Mikroorganismen verwendet werden würde. Im Jahr 1919 identifizierte Georgina Burke anhand von Toxin-Antitoxin-Reaktionen zwei Stämme von Clostridium botulinum, die sie als A und B bezeichnete. ⓘ
Der Botulismus wurde im Februar 1815 vom württembergischen Arzt und Dichter Justinus Kerner das erste Mal wissenschaftlich beschrieben. Kerner erkannte 1820 den Wirkungsmechanismus des Toxins als Hemmung der Nervenleitung und schlug 1822 das Gift, das er als „Fettgift“ und „Fettsäure“ bezeichnete, in extrem niedrigen Dosen als Arzneistoff für verschiedene nervöse Störungen vor. Die Mediziner Rupprecht und Müller bezeichneten 1868 die Vergiftung erstmals als Botulismus. ⓘ

Nachdem ab den 1920er-Jahren Botulinumtoxine in größeren Mengen gewonnen werden konnten, gelang 1946 Carl Lammanna in Fort Detrick (Maryland) am USAMRIID die Reindarstellung des Toxintyps A. Dabei wurde der schon früher vermutete Aufbau aus zwei verschiedenen Proteinketten verifiziert. ⓘ
1949 wiesen Burgen, Dickens und Zatman in London die Hemmung der Acetylcholinsekretion als Ursache der Muskellähmung durch Botulinumtoxin A nach. Bis um 1970 wurden insgesamt sieben verschiedene Neurotoxin-Serotypen (A, B, C1, D, E, F und G) isoliert. ⓘ
1973–1978 wurde das Protein erstmals unter Schantz nach einem durch die FDA zugelassenen Verfahren an Freiwilligen als Arzneistoff getestet und 1980 durch Scott erstmals zur Medikation von Strabismus (Schielen) eingesetzt. 1989 erteilte die US-amerikanische Zulassungsbehörde FDA die erste Arzneimittelzulassung für ein Botulinumtoxin-Präparat. Unter dem Namen Oculinum wurde Botulinumtoxin A für die Indikationen Nystagmus („Augenzittern“) und Blepharospasmus (Lidkrampf) zugelassen. Nachdem die Firma Allergan das Produkt 1991 vom damaligen Hersteller übernommen hatte, wurde der Handelsname 1992 in Botox abgeändert. 1993 erfolgte die Zulassung von Botox in Deutschland, ebenso die des Wettbewerberprodukts Dysport (Ipsen). ⓘ
Innerhalb weniger Jahre kamen als weitere Indikationen Spastiken der Gesichtsmuskulatur und Beine sowie Torticollis spasmodicus (zervikale Dystonie, „Schiefhals“) hinzu. ⓘ
1992 veröffentlichten J. und A. Carruthers einen Bericht über einen vorübergehenden abschwächenden Effekt von Botulinustoxin A auf Hautfalten (Wirkungsdauer 3–6 Monate). Seither wurde das Toxin im kosmetischen Bereich off-label eingesetzt. Eine Zulassung für diese Verwendung erhielten Präparate erst ab 2002. ⓘ
Seit 2001 wird auch Botulinumtoxin B zur Behandlung der zervikalen Dystonie verwendet. ⓘ
Konservierung von Lebensmitteln
In den folgenden drei Jahrzehnten (1895-1925), als sich die Lebensmittelkonservenindustrie zu einer milliardenschweren Industrie entwickelte, wurde Botulismus zu einer Gefahr für die öffentliche Gesundheit. Karl Friedrich Meyer, ein schweizerisch-amerikanischer Veterinärwissenschaftler, richtete in der Hooper Foundation in San Francisco ein Zentrum ein, in dem er Techniken zur Züchtung des Organismus und zur Extraktion des Toxins sowie umgekehrt zur Verhinderung des Wachstums des Organismus und der Toxinproduktion und zur Inaktivierung des Toxins durch Erhitzen entwickelte. Die kalifornische Konservenindustrie wurde dadurch gerettet. ⓘ
Der Zweite Weltkrieg
Mit dem Ausbruch des Zweiten Weltkriegs wurde in Fort Detrick in Maryland die Waffentauglichkeit von Botulinumtoxin untersucht. Carl Lamanna und James Duff entwickelten die Konzentrations- und Kristallisationstechniken, die Edward J. Schantz zur Herstellung des ersten klinischen Produkts verwendete. Als das Chemical Corps der Armee aufgelöst wurde, wechselte Schantz zum Food Research Institute in Wisconsin, wo er Toxin für experimentelle Zwecke herstellte und der akademischen Gemeinschaft zur Verfügung stellte. ⓘ
Der Wirkungsmechanismus von Botulinumtoxin - die Blockierung der Freisetzung des Neurotransmitters Acetylcholin aus den Nervenenden - wurde Mitte des 20. Jahrhunderts aufgeklärt und ist nach wie vor ein wichtiges Forschungsthema. Nahezu alle Behandlungen mit Botulinumtoxin beruhen auf dieser Wirkung in verschiedenen Körpergeweben. ⓘ
Schielen
Augenärzte, die sich auf Augenmuskelstörungen (Schielen) spezialisiert hatten, entwickelten die Methode der EMG-gesteuerten Injektion von Lokalanästhetika als diagnostisches Verfahren, um den Beitrag eines einzelnen Muskels zu einer Augenbewegung zu bewerten (wobei das Elektromyogramm, das elektrische Signal eines aktivierten Muskels, zur Steuerung der Injektion verwendet wird). Da Schieloperationen häufig wiederholt werden mussten, wurde nach nicht-chirurgischen Injektionsbehandlungen mit verschiedenen Anästhetika, Alkoholen, Enzymen, Enzymblockern und Schlangenneurotoxinen gesucht. Schließlich injizierten Alan B. Scott und Kollegen, inspiriert von Daniel B. Drachmans Arbeit mit Küken an der Johns Hopkins University, Botulinumtoxin in die extraokulären Muskeln von Affen. Das Ergebnis war bemerkenswert: Wenige Pikogramm lösten eine Lähmung aus, die auf den Zielmuskel beschränkt war, lange anhielt und keine Nebenwirkungen hatte. ⓘ
Nachdem er Techniken zur Gefriertrocknung, Pufferung mit Albumin und zur Gewährleistung von Sterilität, Wirksamkeit und Sicherheit ausgearbeitet hatte, beantragte Scott bei der FDA die Zulassung als Prüfpräparat und begann in seinem Labor in San Francisco mit der Herstellung von Botulinum-Neurotoxin Typ A. Er injizierte 1977 die ersten Schielpatienten, berichtete 1980 über den klinischen Nutzen des Medikaments und schulte bald Hunderte von Augenärzten in der EMG-gesteuerten Injektion des Medikaments, das er Oculinum ("Augenausrichter") nannte. ⓘ
1986 war Oculinum Inc, Scotts Kleinsthersteller und Vertreiber von Botulinumtoxin, nicht in der Lage, eine Produkthaftpflichtversicherung abzuschließen, und konnte das Medikament nicht mehr liefern. Als die Vorräte zur Neige gingen, wurden die Patienten, die sich auf die regelmäßigen Injektionen verlassen hatten, verzweifelt. Vier Monate lang reisten amerikanische Blepharospasmus-Patienten für ihre Injektionen in kanadische Augenzentren, bis die Haftungsfragen geklärt waren. ⓘ
Auf der Grundlage der von 240 Forschern gesammelten Daten von Tausenden von Patienten erhielt Oculinum Inc. (das bald darauf von Allergan übernommen wurde) 1989 die FDA-Zulassung für die Vermarktung von Oculinum für den klinischen Einsatz in den Vereinigten Staaten zur Behandlung von Strabismus und Blepharospasmus bei Erwachsenen. Allergan begann daraufhin, die Marke Botox zu verwenden. Diese ursprüngliche Zulassung wurde im Rahmen des US-Gesetzes über Arzneimittel für seltene Krankheiten von 1983 erteilt. ⓘ
Kosmetika

Die Wirkung von BTX-A zur Reduzierung und Beseitigung von Stirnfalten wurde erstmals von Richard Clark, MD, einem plastischen Chirurgen aus Sacramento, Kalifornien, beschrieben und veröffentlicht. Im Jahr 1987 stand Clark vor der Herausforderung, die Entstellung zu beseitigen, die dadurch entstanden war, dass nur die rechte Seite der Stirnmuskeln funktionierte, nachdem die linke Seite der Stirn bei einem Facelifting gelähmt worden war. Die Patientin wollte nach dem Facelifting besser aussehen, hatte aber eine bizarre, einseitige Anhebung der rechten Stirnbraue, während die linke Augenbraue herabhing, und sie zeigte ständig tiefe, ausdrucksstarke Falten auf der rechten Stirn, während die linke Seite aufgrund der Lähmung vollkommen glatt war. Clark wusste, dass Botulinumtoxin sicher zur Behandlung von Babys mit Schielen eingesetzt wurde, und er beantragte und erhielt die Genehmigung der FDA, mit Botulinumtoxin zu experimentieren, um die sich bewegenden und faltenbildenden normal funktionierenden rechten Stirnmuskeln zu lähmen, damit beide Seiten der Stirn gleich aussehen. Diese Studie und der Fallbericht über den kosmetischen Einsatz von Botulinumtoxin zur Behandlung einer kosmetischen Komplikation einer Schönheitsoperation war der erste Bericht über die spezifische Behandlung von Falten und wurde 1989 in der Zeitschrift Plastic and Reconstructive Surgery veröffentlicht. Die Redakteure der Zeitschrift der American Society of Plastic Surgeons haben eindeutig festgestellt, dass "die erste beschriebene Anwendung des Toxins unter ästhetischen Umständen von Clark und Berris im Jahr 1989 erfolgte". ⓘ
Jean und Alastair Carruthers beobachteten, dass bei Patienten mit Blepharospasmus, die Injektionen im Bereich der Augen und des oberen Gesichts erhielten, auch die Glabellafalten ("Zornesfalten" zwischen den Augenbrauen) vermindert wurden. Alastair Carruthers berichtete, dass auch andere zu dieser Zeit diese Effekte bemerkten und das kosmetische Potenzial von Botulinumtoxin diskutierten. Im Gegensatz zu anderen Forschern sprachen die Carruthers nicht nur über die Möglichkeit der kosmetischen Anwendung von Botulinumtoxin. Sie führten eine klinische Studie an ansonsten normalen Personen durch, deren einziges Problem ihre Augenbrauenfurche war. Sie führten ihre Studie in den Jahren 1987-1989 durch und stellten ihre Ergebnisse 1990 auf der Jahrestagung der American Society for Dermatologic Surgery vor. Ihre Ergebnisse wurden dann 1992 veröffentlicht. ⓘ
Chronische Schmerzen
William J. Binder berichtete im Jahr 2000, dass Patienten, die kosmetische Injektionen im Gesicht erhielten, über eine Linderung ihrer chronischen Kopfschmerzen berichteten. Ursprünglich dachte man, dies sei ein indirekter Effekt der verringerten Muskelspannung, doch inzwischen weiß man, dass das Toxin die Freisetzung peripherer nozizeptiver Neurotransmitter hemmt und damit die für Migränekopfschmerzen verantwortlichen zentralen Schmerzverarbeitungssysteme unterdrückt. ⓘ
Gesellschaft und Kultur
Wirtschaft
Im Jahr 2018 sind Botulinumtoxin-Injektionen mit 7,4 Millionen Eingriffen in den Vereinigten Staaten laut der American Society of Plastic Surgeons die häufigste Schönheitsoperation. Die Qualifikationen für Botox-Injektoren variieren je nach Bezirk, Staat und Land. Zu den Anbietern von Botox-Kosmetika gehören Dermatologen, plastische Chirurgen, Ärzte in Schönheitssalons, Zahnärzte, Krankenschwestern, Krankenpfleger und Arzthelferinnen. ⓘ
Der weltweite Markt für Botulinumtoxin-Produkte, der durch ihre kosmetischen Anwendungen angetrieben wird, wird bis 2018 voraussichtlich 2,9 Milliarden US-Dollar erreichen. Der Markt für Gesichtsästhetik, zu dem sie gehören, wird im gleichen Zeitraum voraussichtlich 4,7 Milliarden US-Dollar (2 Milliarden US-Dollar in den USA) erreichen. ⓘ
- Globaler Markt
- Im Jahr 2019 wurden weltweit 6.271.488 Botulinumtoxin-Eingriffe vorgenommen. Die Größe des globalen Botulinumtoxin-Marktes belief sich im Jahr 2019 auf 4,83 Milliarden US-Dollar und wird bis 2027 voraussichtlich 7,71 Milliarden US-Dollar erreichen. ⓘ
- US-Markt
- Im Jahr 2020 wurden 4.401.536 Verfahren mit Botulinumtoxin Typ A durchgeführt. Im Jahr 2019 machte der Botulinumtoxin-Markt 3,19 Milliarden US-Dollar. ⓘ
- Botox-Kosten
- Die Kosten für Botox werden im Allgemeinen durch die Anzahl der verabreichten Einheiten (durchschnittlich 10,00 - 30,00 $ pro Einheit) oder durch die Fläche (200 - 1000 $) bestimmt und hängen von der Erfahrung des Arztes, dem Standort der Klinik, der Anzahl der Einheiten und der Komplexität der Behandlung ab. ⓘ
- Versicherung
- Botox für medizinische Zwecke wird in der Regel von der Versicherung übernommen, wenn es von Ihrem Arzt als medizinisch notwendig erachtet wird, und deckt eine Vielzahl medizinischer Probleme ab, darunter überaktive Blase (OAB), Harninkontinenz aufgrund neurologischer Erkrankungen, Kopfschmerzen und Migräne, Kiefergelenkschmerzen, Spastizität bei erwachsenen Patienten, zervikale Dystonie bei erwachsenen Patienten, schwere axilläre Hyperhidrose (oder andere Körperbereiche), Blepharospasmus, Spastizität der oberen oder unteren Gliedmaßen. ⓘ
- Migräne
- Bei migränebedingten Kopfschmerzen liegt die von der FDA empfohlene Dosierung bei 155 Einheiten und kostet zwischen 300 und 600 US-Dollar pro Behandlung, wenn die Kosten von der Krankenkasse übernommen werden. ⓘ
- Hyperhidrose
- Botox gegen übermäßiges Schwitzen ist von der FDA zugelassen. ⓘ
- Ästhetik
- Zu den Standardbereichen für Botox-Injektionen im Bereich der Ästhetik gehören das Gesicht und andere Bereiche, in denen sich durch alltägliche Muskelkontraktionen und/oder Gesichtsausdrücke wie Lächeln, Stirnrunzeln, Blinzeln und Hochziehen der Augenbrauen feine Linien und Falten bilden können. Zu diesen Bereichen gehören die Glabellaregion zwischen den Augenbrauen, horizontale Linien auf der Stirn, Krähenfüße um die Augen und sogar kreisförmige Bänder, die sich als Folge einer platysmalen Hyperaktivität um den Hals bilden. ⓘ
Bioterrorismus
Botulinumtoxin wurde als potenzieller Wirkstoff für bioterroristische Anschläge erkannt. Es kann über die Augen, die Schleimhäute, die Atemwege und die nicht intakte Haut aufgenommen werden. Die Wirkungen von Botulinumtoxin unterscheiden sich insofern von denen von Nervenkampfstoffen, als sich die Botulismus-Symptome relativ langsam (über mehrere Tage) entwickeln, während die Wirkungen von Nervenkampfstoffen im Allgemeinen viel schneller eintreten. Es gibt Hinweise darauf, dass eine Nervenexposition (die durch die Injektion von Atropin und Pralidoxim simuliert wird) die Sterblichkeit erhöht, indem sie den Toxizitätsmechanismus des Botulinumtoxins verstärkt. Was den Nachweis anbelangt, so zeigen Protokolle mit ABC-Nachweisgeräten (wie M-8-Papier oder ICAM) kein "Positiv" an, wenn Botulinumtoxin enthaltende Proben getestet werden. Zur Bestätigung der Diagnose einer Botulinumtoxin-Vergiftung, zu therapeutischen Zwecken oder zur Beweisführung bei Todesfalluntersuchungen kann Botulinumtoxin durch Immunoassay menschlicher biologischer Flüssigkeiten quantifiziert werden; bei vergifteten Patienten wurden Serumkonzentrationen von 12-24 Maus-LD50-Einheiten pro Milliliter festgestellt. ⓘ
Die japanische Weltuntergangssekte Aum Shinrikyo stellte Botulinumtoxin her und versprühte es in den 1990er Jahren als Aerosol in der Innenstadt von Tokio, wobei die Anschläge jedoch keine Todesopfer forderten. ⓘ
In den frühen 1980er Jahren berichteten deutsche und französische Zeitungen, dass die Polizei bei einer Razzia in einem Unterschlupf der Baader-Meinhof-Bande in Paris ein behelfsmäßiges Labor gefunden hatte, in dem sich Flaschen mit Clostridium botulinum, dem Hersteller von Botulinumtoxin, befanden. Später stellte sich heraus, dass diese Berichte falsch waren; ein solches Labor wurde nie gefunden. ⓘ
Markennamen
Botulinumtoxin A wird unter den Markennamen Jeuveau, Botox und Xeomin verkauft. Botulinumtoxin B wird unter dem Markennamen Myobloc verkauft. ⓘ
In den Vereinigten Staaten werden Botulinumtoxin-Produkte von einer Vielzahl von Unternehmen sowohl für therapeutische als auch für kosmetische Zwecke hergestellt. Ein US-amerikanischer Anbieter gab 2011 in seinen Unternehmensunterlagen an, dass er mit weniger als einem Gramm Rohbotulinumtoxin "den weltweiten Bedarf für 25 von Regierungsbehörden auf der ganzen Welt genehmigte Indikationen decken" könne. Myobloc oder Neurobloc, ein Botulinumtoxin-Typ-B-Produkt, wird von Solstice Neurosciences, einer Tochtergesellschaft von US WorldMeds, hergestellt. AbobotulinumtoxinA), eine therapeutische Formulierung des Typ-A-Toxins, die von Galderma im Vereinigten Königreich hergestellt wird, ist in den USA und anderen Ländern für die Behandlung von fokalen Dystonien und bestimmte kosmetische Anwendungen zugelassen. ⓘ
Neben den drei Hauptherstellern in den USA sind zahlreiche weitere Hersteller von Botulinumtoxin bekannt. Das in Deutschland von Merz hergestellte Xeomin ist in den USA sowohl für die therapeutische als auch für die kosmetische Anwendung erhältlich. Das Lanzhou Institute of Biological Products in China stellt ein BTX-A-Produkt her; 2014 war es das einzige in China zugelassene BTX-A. BTX-A wird auch unter den Namen Lantox und Prosigne auf dem Weltmarkt vertrieben. Neuronox, ein BTX-A-Produkt, wurde 2009 von Medy-Tox Inc. aus Südkorea eingeführt. ⓘ
Herstellung des Toxins
Botulismus-Toxine werden von Bakterien der Gattung Clostridium produziert, nämlich C. botulinum, C. butyricum, C. baratii und C. argentinense, die weit verbreitet sind, auch in Boden und Staub. Auch in Wohnungen können die Bakterien auf Fußböden, Teppichen und Arbeitsplatten gefunden werden, selbst nach der Reinigung. Lebensmittelbedingter Botulismus entsteht indirekt durch die Aufnahme von Lebensmitteln, die mit Clostridium-Sporen kontaminiert sind, die in einem anaeroben Milieu keimen, woraufhin sich die Bakterien vermehren und Toxin produzieren können. Kritisch ist, dass die Aufnahme von Toxin und nicht von Sporen oder vegetativen Bakterien Botulismus verursacht. Es ist jedoch bekannt, dass Botulismus durch Lebensmittelkonserven übertragen werden kann, die vor dem Einmachen oder nach dem Öffnen der Dose nicht richtig gekocht wurden, so dass er vermeidbar ist. Botulismus bei Säuglingen, der durch den Verzehr von Honig oder anderen Lebensmitteln, die diese Sporen enthalten können, entsteht, kann verhindert werden, indem diese Lebensmittel aus der Ernährung von Kindern unter 12 Monaten verbannt werden. ⓘ
Anfälligkeit von Organismen und Toxinen
Eine angemessene Kühlung bei Temperaturen unter 3 °C (38 °F) verlangsamt das Wachstum von C. botulinum. Der Organismus ist auch gegenüber hohem Salzgehalt, hohem Sauerstoffgehalt und niedrigem pH-Wert empfindlich. Das Toxin selbst wird durch Hitze, z. B. beim gründlichen Kochen, schnell zerstört. Die Sporen, die das Toxin produzieren, sind hitzetolerant und überleben kochendes Wasser über einen längeren Zeitraum. ⓘ
Das Botulinumtoxin wird denaturiert und somit bei Temperaturen über 85 °C (185 °F) für fünf Minuten inaktiviert. Da es sich um eine Zink-Metalloprotease handelt (siehe unten), ist die Aktivität des Toxins nach der Exposition auch anfällig für eine Hemmung durch Protease-Inhibitoren, z. B. zinkkoordinierende Hydroxamate. ⓘ
- Allgemeine Regeln der Arbeitshygiene beachten
- Möglichst wenig verunreinigte Rohware verwenden
- Umsetzung des 3F-Konzepts (Sterilisation 3 Minuten bei 121 °C, F0-Wert) oder 5-minütiges Erhitzen bei 100 °C. ⓘ
In der Industrie werden bei der Zubereitung gefährdeter Lebensmittel durch entsprechend langes Erhitzen bei Temperaturen über 100 °C das Bakterium und seine Sporen abgetötet und das Toxin inaktiviert. ⓘ
Forschung
Blepharospasmus und Strabismus
Augenärzte an Universitäten in den USA und Kanada haben die Verwendung von Botulinumtoxin als therapeutisches Mittel weiter verfeinert. Bis 1985 war ein wissenschaftliches Protokoll mit Injektionsstellen und Dosierung für die Behandlung von Blepharospasmus und Strabismus empirisch festgelegt worden. Die Nebenwirkungen bei der Behandlung dieses Leidens wurden als selten, leicht und behandelbar eingestuft. Die positiven Auswirkungen der Injektion hielten nur 4-6 Monate an. Daher mussten die Patienten mit Blepharospasmus zwei- bis dreimal pro Jahr eine erneute Injektion erhalten. ⓘ
1986 war Scotts Kleinsthersteller und Vertreiber von Botox nicht mehr in der Lage, das Medikament zu liefern, weil er keine Produkthaftungsversicherung abschließen konnte. Die Patienten wurden verzweifelt, da die Vorräte an Botox nach und nach aufgebraucht wurden, so dass er gezwungen war, Patienten, bei denen die nächste Injektion fällig gewesen wäre, im Stich zu lassen. Vier Monate lang mussten amerikanische Blepharospasmus-Patienten ihre Injektionen von teilnehmenden Ärzten in kanadischen Augenzentren durchführen lassen, bis die Haftungsfragen geklärt waren. ⓘ
Im Dezember 1989 wurde Botox von der amerikanischen Arzneimittelbehörde FDA für die Behandlung von Strabismus, Blepharospasmus und hemifazialem Spasmus bei Patienten über 12 Jahren zugelassen. ⓘ
Botox ist nicht für die Anwendung bei Kindern zugelassen. Es wurde jedoch von Ärzten zur Behandlung verschiedener Erkrankungen eingesetzt, u. a. zur Behandlung spastischer Zustände bei pädiatrischen Patienten mit zerebraler Lähmung, eine Therapie, die zum Tod der Patienten geführt hat. Bei der Behandlung der infantilen Esotropie bei Patienten unter 12 Jahren haben mehrere Studien zu unterschiedlichen Ergebnissen geführt. ⓘ
Ästhetik
Die Wirkung von BTX-A zur Verringerung und Beseitigung von Stirnfalten wurde erstmals von Richard Clark, MD, einem plastischen Chirurgen aus Sacramento, Kalifornien, beschrieben und veröffentlicht. Im Jahr 1987 stand Clark vor der Herausforderung, die Entstellung zu beseitigen, die dadurch entstanden war, dass nur die rechte Seite der Stirnmuskeln funktionierte, nachdem die linke Seite der Stirn bei einem Facelifting gelähmt worden war. Die Patientin wollte nach dem Facelifting besser aussehen, hatte aber eine bizarre, einseitig angehobene rechte Stirnbraue, während die linke Augenbraue herabhing, und sie zeigte tiefe, ausdrucksstarke Falten auf der rechten Stirn, während die linke Seite aufgrund der Lähmung vollkommen glatt war. Clark wusste, dass Botulinumtoxin sicher zur Behandlung von Säuglingen mit Schielen eingesetzt wurde, und er beantragte und erhielt die Genehmigung der FDA, mit Botulinumtoxin zu experimentieren, um die sich bewegenden und faltenbildenden normal funktionierenden rechten Stirnmuskeln zu lähmen, damit beide Seiten der Stirn gleich aussehen. Diese Studie und der Fallbericht über die kosmetische Verwendung von Botulinumtoxin zur Behandlung einer kosmetischen Komplikation einer kosmetischen Operation war der erste Bericht über die spezifische Behandlung von Falten und wurde 1989 in der Zeitschrift Plastic and Reconstructive Surgery veröffentlicht. Die Redakteure der Zeitschrift der American Society of Plastic Surgeons haben eindeutig festgestellt, dass "die erste beschriebene Verwendung des Toxins in ästhetischen Situationen von Clark und Berris im Jahr 1989 erfolgte". ⓘ
JD und JA Carruthers untersuchten und berichteten 1992 auch über die Verwendung von BTX-A als kosmetische Behandlung.[78] Sie führten eine Studie mit Patienten durch, deren einziges Problem ihre Glabellafalte oder Stirnfurche war. Die Studienteilnehmer waren ansonsten normal. Sechzehn von siebzehn Patienten, die zur Nachuntersuchung zur Verfügung standen, zeigten eine kosmetische Verbesserung. Über diese Studie wurde auf einer Tagung im Jahr 1991 berichtet. Die Studie zur Behandlung der glabellaren Zornesfalte wurde 1992 veröffentlicht. Dieses Ergebnis wurde anschließend von anderen Gruppen bestätigt (Brin und die Gruppe der Columbia University unter Monte Keen). Im Jahr 2002 gab die FDA nach umfangreichen klinischen Studien die Zulassung von Botulinumtoxin Typ A (Botox Cosmetic) zur vorübergehenden Verbesserung des Erscheinungsbildes von mittelschweren bis schweren Zornesfalten zwischen den Augenbrauen (Glabellafalten) bekannt. Die kosmetische Anwendung von Botulinumtoxin Typ A war schon lange vorher weit verbreitet. Die Ergebnisse von Botox Cosmetic können bis zu vier Monate anhalten und sind von Patient zu Patient unterschiedlich. Als Reaktion auf die zunehmende Besorgnis in der Öffentlichkeit genehmigte die US-amerikanische Food and Drug Administration (FDA) eine alternative Methode zur Prüfung der Produktsicherheit, bei der für jede auf dem Markt befindliche Charge ein LD50-Test erforderlich ist. ⓘ
Das Material wird in die hyperaktiven Muskeln der Oberlippe injiziert, was zu einer Verringerung der Aufwärtsbewegung der Lippe führt, so dass das Lächeln weniger vom Zahnfleisch verdeckt wird. Botox wird in der Regel in die drei Lippenhebemuskeln injiziert, die an der seitlichen Seite der Nasenflügel zusammenlaufen: der Musculus levator labii superioris (LLS), der Musculus levator labii superioris alaeque nasi (LLSAN) und der Musculus zygomaticus minor (ZMi). ⓘ
Syndrom der oberen Motoneuronen
BTX-A ist heute eine gängige Behandlung für Muskeln, die vom Syndrom der oberen Motoneuronen (UMNS) betroffen sind, wie z. B. bei Zerebralparese, für Muskeln mit einer beeinträchtigten Fähigkeit, sich effektiv zu verlängern. Von UMNS betroffene Muskeln sind häufig durch Schwäche, Verlust der reziproken Hemmung, verminderte Bewegungskontrolle und Hypertonie (einschließlich Spastizität) eingeschränkt. Im Januar 2014 wurde Botulinumtoxin von der britischen Arzneimittelbehörde MHRA (Medicines and Healthcare products Regulatory Agency) für die Behandlung von Behinderungen des Sprunggelenks aufgrund von Spastizität der unteren Gliedmaßen im Zusammenhang mit einem Schlaganfall bei Erwachsenen zugelassen. Die Bewegung der Gelenke kann durch ein schweres muskuläres Ungleichgewicht im Zusammenhang mit dem Syndrom eingeschränkt sein, wenn einige Muskeln stark hypertonisch sind und keine wirksame aktive Dehnung aufweisen. Die Injektion eines überaktiven Muskels, um seine Kontraktionskraft zu verringern, kann eine verbesserte reziproke Bewegung und damit eine verbesserte Bewegungs- und Sportfähigkeit ermöglichen. ⓘ
Sialorrhoe
Sialorrhoe ist ein Zustand, bei dem orale Sekrete nicht ausgeschieden werden können, was zu Speichelansammlungen im Mund führt. Dieser Zustand kann durch verschiedene neurologische Syndrome wie die Bellsche Lähmung, geistige Behinderung und zerebrale Lähmung verursacht werden. Die Injektion von BTX-A in die Speicheldrüsen ist hilfreich, um die Sekretion zu reduzieren. ⓘ
Zervikale Dystonie
BTX-A wird häufig zur Behandlung der zervikalen Dystonie eingesetzt, kann aber nach einiger Zeit unwirksam werden. Botulinumtoxin Typ B (BTX-B) wurde am 21. Dezember 2000 von der FDA für die Behandlung der zervikalen Dystonie zugelassen. Markennamen für BTX-B sind Myobloc in den Vereinigten Staaten und Neurobloc in der Europäischen Union. ⓘ
Chronische Migräne
Onabotulinumtoxin A (Handelsname Botox) erhielt am 15. Oktober 2010 die FDA-Zulassung für die Behandlung chronischer Migräne. Das Toxin wird zur Behandlung dieser chronischen Kopfschmerzen in den Kopf und den Nacken injiziert. Die Zulassung erfolgte, nachdem zwei von Allergan finanzierte Studien gezeigt hatten, dass sich die Häufigkeit chronischer Migräne bei Migränepatienten, die sich einer Botox-Behandlung unterzogen, nur geringfügig verbesserte. ⓘ
Seitdem haben mehrere randomisierte Kontrollstudien gezeigt, dass Botulinumtoxin Typ A die Kopfschmerzsymptome und die Lebensqualität verbessert, wenn es prophylaktisch bei Patienten mit chronischer Migräne eingesetzt wird, die folgende Merkmale aufweisen: von außen wahrgenommener Druck, kürzere Gesamtdauer der chronischen Migräne (<30 Jahre), "Entgiftung" von Patienten mit gleichzeitig bestehenden chronischen täglichen Kopfschmerzen aufgrund von Medikamentenübergebrauch und keine aktuelle Vorgeschichte mit anderen präventiven Kopfschmerzmedikamenten. ⓘ
Depressionen
In einigen kleinen Studien wurde ein Nutzen bei Menschen mit Depressionen festgestellt. Die Forschung stützt sich auf die Hypothese des Gesichtsfeedbacks. ⓘ
Vorzeitige Ejakulation
Das Medikament zur Behandlung der vorzeitigen Ejakulation befindet sich seit dem 7. August 2013 in der Entwicklung und befindet sich in Phase II der FDA-Studien. ⓘ
Etymologie
Die Namen für das Bakterium und das Toxin sind von dem lateinischen Wort botulus ‚Wurst‘ abgeleitet, ebenso wie die schon zuvor eingeführte Bezeichnung Botulismus für das Krankheitsbild bei einer Wurstvergiftung. Der Grund ist, dass Vergiftungen mit dem Botulinumtoxin früher häufig im Zusammenhang mit Wurst oder Wurstkonserven standen. Darauf beruht auch die historische Bezeichnung Wurstgift (englisch sausage poison). ⓘ
Das hauptsächlich den Botulismus verursachende Bakterium Clostridium botulinum ist ubiquitär als Spore anzutreffen. Das Bakterium benötigt nichtsaure, extrem sauerstoffarme Milieubedingungen, um auszukeimen und das Toxin zu produzieren. Solche Bedingungen sind in Wurst- und Gemüsekonserven sowie vakuumverpackten Lebensmitteln meist gegeben; zudem gilt die anaerobe Kernzone von Fleisch und Wurst meist als exzellentes Substrat für das Wachstum von Clostridium. ⓘ
Toxin-Typen
Serologisch unterscheidet man die Botulinumtoxine in die Typen A bis G, von denen A und B medizinisch genutzt werden. Lediglich die Typen A, B, E, und F sind toxisch für den Menschen. Die Botulinumtoxine besitzen eine große Ähnlichkeit in Bezug auf ihre Struktur und biochemische Wirkung mit dem ebenfalls von Clostridien (Clostridium tetani) gebildeten Tetanustoxin. ⓘ
| Typ | Einige Organismen, in denen der Typ wirksam ist | Toxisch für Menschen | UniProt / UNII | Varianten, Anmerkungen |
|---|---|---|---|---|
| A | Mensch (hauptsächlich USA), Küken | ja | UniProt P0DPI0 UniProt P0DPI1 (A1) UniProt Q45894 (A2) UNII: E211KPY694 |
Das medizinisch genutzte BoNT/A existiert in verschiedenen nativen, d. h. komplexierten Formen sowie auch aufgereinigten Formen, die frei von Komplexproteinen sind. |
| B | Mensch (hauptsächlich Europa), „Kinder-Botulismus“, Pferde, Rinder | ja | UniProt P10844 (B) UniProt B1INP5 (B1) UNII: 0Y70779M1F |
Rimabotulinumtoxin B |
| C | Wasservögel (C1); Rinder, Pferde, Nerze (C2) |
nein | UniProt P18640 UNII: FPM7829VMX |
Botulinumtoxin C1 (Botulinumneurotoxin C) Botulinumtoxin C2 |
| D | Rinder, Geflügel | nein | UniProt P19321 UNII: 331HTW151K |
|
| E | Mensch | ja | UniProt Q00496 UniProt P30995 UNII: T579M564JY |
|
| F | Mensch | ja | UniProt A7GBG3 UniProt P30996 UNII: U1R2P71O7G |
|
| G | Vergiftungsfälle bisher unbekannt | nein | UniProt Q60393 UNII: 2C3DD06QGJ |
Gebildet von Clostridium argentinense |
Neben den bisher sieben allgemein anerkannten „klassischen“ BoNT-Serotypen wurden mehrere neuartige BoNT-Typen postuliert. 2013 gab eine Forschergruppe in den USA an, in der Stuhlprobe eines Kindes einen weiteren Serotyp entdeckt zu haben, den sie als ‚Typ H‘ bezeichneten (BoNT/H). Die DNA-Struktur wurde trotz ihrer Entschlüsselung zunächst geheim gehalten. Untersuchungen des Centers for Disease Control and Prevention (CDC) zeigten später, dass es sich um einen Hybridtyp handelt mit strukturellen Ähnlichkeiten zu den Serotypen A und F. BoNT/X ist ein neuer Serotyp, der ebenfalls von C. botulinum gebildet wird. Eine auf molekularer Ebene den Botulin-Neurotoxinen ähnliche Variante ist das eBoNT/J (auch BoNT/En genannt) das jedoch durch ein Gen des Enterococcus faecium codiert wird. ⓘ
Durch Fortschritte in der DNA-Sequenzierungs-Technik konnten ferner Unterschiede innerhalb einzelner Serotypen aufgezeigt werden, was zu Einführung von Subtypen führte. Solche Subtypen können sich innerhalb eines Serotyps auf Aminosäureebene um bis zu 36 % unterscheiden. Bis 2019 wurden in der Literatur mehr als 40 Subtypen beschrieben. Es wurde gezeigt, dass sich die Subtypen eines Serotyps in ihrer biologischen Aktivität unterscheiden, beispielsweise in der Kinetik der Aufnahme und Substratspaltung, der Affinität zu Rezeptoren oder der Gesamtaktivität. ⓘ
Vergiftung
Jährlich werden in Deutschland 20–40 Fälle von Botulismus gemeldet, von denen 1–2 tödlich enden. Selten tritt der „viszerale Botulismus“ auf, der als „Säuglingsbotulismus“ oder „infantiler Botulismus“ bei Säuglingen und als „adulter infektiöser Botulismus“ bei Erwachsenen mit seltener Prädisposition als Infektion vorkommt. Dabei entwickelt sich das Bakterium aus über die Nahrung aufgenommenen Sporen im Dünndarm und produziert dort die Toxine. Als Antidot für alle Formen des Botulismus kommt entweder ein trivalentes (Typen A, B, E) oder ein polyvalentes Antiserum (Typen A–G) zum Einsatz, in den USA auch das Heptavalent Botulism Antitoxin. Alle drei werden aus Pferden gewonnen. ⓘ
Gefährdete Lebensmittel
In erster Linie sind Lebensmittel gefährdet, die unter anaeroben Bedingungen gelagert sind und deren Milieu nur schwach sauer oder neutral ist (pH > 4,5). Begünstigt werden kann die Bildung des Toxins durch geringen Salzgehalt und Lagertemperaturen über 10 °C, wobei Letzteres bei Konserven oft gegeben ist. C. botulinum stellt zudem hohe Nährstoffansprüche und benötigt daher ein komplexes Nährmedium. Klassischerweise gefährdet sind demnach Fleisch- und Fischkonserven, Mayonnaise, aber auch schwachsaure Frucht- oder Gemüsekonserven. Nicht gefährdet sind bei den Fleischprodukten hingegen (stark) gepökelte Produkte, da das im Pökelsalz enthaltene Nitrit C. botulinum im Wachstum hemmt. ⓘ
Kennzeichen kontaminierter Produkte
Ein wichtiges Indiz bei Konserven ist die Bombage (bzw. Bombierung), die Wölbung der Konservendeckel nach außen durch den entstehenden Innendruck. Entweichende Gase beim Öffnen eingemachter Produkte deuten ebenfalls auf eine Kontamination hin; in den meisten Fällen sind sie mit einem unangenehmen Geruch verbunden. Obwohl solche Konserven sofort entsorgt werden müssen, lassen sich hieraus keine Rückschlüsse über den Befall mit Botulinumtoxin erzeugenden Bakterien ziehen, denn gerade die Produktion des Giftes unter anaeroben Bedingungen und ohne Entwicklung von Gasen stellt eine große Gefahr dar. Besteht Unsicherheit, ob die beschriebenen Kennzeichen zutreffen, ist es empfehlenswert, aus Sicherheitsgründen den Konserveninhalt einige Minuten (5 Minuten bei 100 °C sind sicher) durchzukochen. Als hitzelabiles Protein wird das Botulinumtoxin dadurch denaturiert und unwirksam. ⓘ
Symptome beim Menschen
Die ersten Erscheinungen der als Botulismus bezeichneten Vergiftung treten nach 12 bis 40 Stunden auf und umfassen in der Regel Kopf- und Magenschmerzen, Übelkeit und Erbrechen sowie Schluck-, Sprech- und Sehstörungen, gefolgt von Muskellähmungen. Insbesondere die Lähmung der Augen- (Doppelsehen) und der Nackenmuskulatur (Halssteifigkeit) sind deutliche Hinweise auf Botulismus. In diesem Stadium der Vergiftung kann eine Bekämpfung mit Antitoxin noch möglich sein. Ohne Behandlung tritt in 50 % der Fälle nach 3–6 Tagen der Tod durch Atemlähmung ein. ⓘ
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis des Bakteriums oder des Toxins namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes, soweit der Nachweis auf eine akute Infektion hinweist. ⓘ
In der Schweiz ist die Krankheit Botulismus und der positive und negative laboranalytische Befund des Bakteriums meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 bzw. Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. ⓘ
Therapeutische Anwendung
Indikationen und Wirksamkeit
In der Neurologie wird Botulinumtoxin seit Anfang der 1980er-Jahre als zugelassenes Arzneimittel primär in der Behandlung von speziellen Bewegungsstörungen, den sog. fokalen Dystonien, eingesetzt. Dies sind Erkrankungen wie der Blepharospasmus (Lidkrampf), die oromandibuläre Dystonie (Mund-, Zungen-, Schlundkrampf), der Torticollis spasmodicus (Schiefhals) und andere zervikale Dystonien, der Graphospasmus (Schreibkrampf) und die spasmodische Dysphonie (Stimmbandkrampf). Weiterhin sind auch bei segmentalen oder sekundären Dystonien und Spastiken die Fokalsymptome mit Botulinumtoxin behandelbar. Hierzu zählen etwa der Spasmus hemifacialis, Bewegungsstörungen nach peripherer Affektion des Nervus facialis sowie bestimmte spastische Syndrome bei Erwachsenen und Kindern, beispielsweise bei spastischem Spitzfuß, bei Patienten mit Zerebralparese, bei der Armspastik nach Schlaganfall bzw. bei fokaler Spastik von Hand und Handgelenk nach Schlaganfall. Bei diesen Indikationen wird immer intramuskulär oder subkutan injiziert. Ein Behandlungserfolg mit Besserung bis zum zeitweiligen Verlust der Symptome liegt beim Lidkrampf bei etwa 90 %, beim Schiefhals zwischen 60 und 80 %. ⓘ
Weitere Anwendungsgebiete:
- Strabismus (Schielen)
- Behandlung von Spannungskopfschmerzen und Migräne, bei chronischer Migräne auch Zulassung zu Lasten der GKV
- Verringerung der Hyperhidrose (übermäßige Schweißproduktion)
- Erhöhte Speichelproduktion (z. B. bei Patienten mit M. Parkinson oder amyotropher Lateralsklerose)
- Bei der Therapie der Achalasie, einer Speiseröhrenengstellung, sowie bei diffusem Ösophagusspasmus (Spasmus der Speiseröhre)
- Bei Patienten mit einer Sphincter-oddi-Dysfunktion (SOD) Typ II
- Zur Behandlung des Morbus Hirschsprung (Aganglionose des Dickdarms)
- Bei Analfissuren
- Bei Blasenfunktionsstörungen (seit 2018 Leistung der GKV)
- Zahlreiche weitere Anwendungsgebiete sind in der Erprobung, z. B. orthopädische Krankheiten (Epicondylitis humeroradialis und humeroulnaris, Plantarfasziitis, myofasciale Triggerpunkte der Wirbelsäule u. a.) oder dermatologische Probleme, bei denen jeweils durch eine Muskelrelaxation eine Verbesserung erreicht werden kann. ⓘ
Zertifizierte ärztliche Ausbildungen werden u. a. vom Arbeitskreis Botulinumtoxin der Deutschen Gesellschaft für Neurologie (DGN) und von der Sektion Schmerz (IGOST) der Deutschen Gesellschaft für Orthopädie und Orthopädische Chirurgie (DGOOC) angeboten. ⓘ
Zahnmedizin
Vor der Anwendung von Botulinumtoxin zur Behandlung von Bruxismus (Zähneknirschen), der kraniomandibulären Dysfunktion (Kiefergelenksbeschwerden) sowie zur optischen Verschlankung des Gesichts wird gewarnt, da sie zu massiven Schäden am Kieferknochen führen kann. Botulinumtoxin wird hierzu in den Musculus masseter gespritzt, der die Muskelspannung reduzieren soll. Eine Zeitspanne von drei Monaten zwischen den Injektionen, die üblicherweise eingehalten wird, reiche nicht aus, den verloren gegangenen Knochen wieder zu regenerieren. Teilweise zeigen die Ergebnisse, dass der Kieferknochen auch längerfristig nicht mehr regeneriert. Der Knochenabbau kann zur Zahnlockerung – bis hin zum Zahnverlust – führen und erhöht die Frakturgefahr des Kieferknochens. Die amerikanische Food and Drug Administration (FDA) hat bislang (Stand Januar 2017) die Anwendung von Botulinumtoxin in diesem Bereich nicht zugelassen. In der aktuellen S3-Leitlinie Stand 2019 zum Bruxismus wird dagegen der Einsatz von Botulinumtoxin eher positiv bewertet. ⓘ
Faltenunterspritzung
Faltenunterspritzungen im Stirn-, Augen- und Halsbereich, zur Lippen- und Faltenunterfüllung und zur Therapie der Migräneerkrankung sind approbierten Ärzten und Heilpraktikern erlaubt, Zahnärzten und anderen Heilberufsangehörigen sowie Laien hingegen untersagt. ⓘ
In einem Fall jahrelanger Verstöße gegen das Verbot der Faltenunterspritzung für Zahnärzte bejahte das Oberverwaltungsgericht für das Land Nordrhein-Westfalen die für den Approbationsentzug vorausgesetzte Unzuverlässigkeit eines Zahnarztes. Man hielt dem Zahnarzt sein langjähriges und hartnäckiges Verhalten vor, was er nur durch einen ernsthaften Einstellungswandel hätte beseitigen können. ⓘ
Zugelassene Medikamente mit Botulinumtoxin als Wirkstoff
Das Botulinumtoxin wird als Medikament von verschiedenen Firmen hergestellt:
| Bezeichnung | Wirkstoff | Hersteller | Zugelassene Anwendungsgebiete |
|---|---|---|---|
| Botox (D, A, CH u. a.) | Toxin A | Allergan | Symptomatische Behandlung diverser Spastiken (fokale Spastizität von Hand- und Fußgelenk bei Erwachsenen, fokale Spastizität bei Patienten mit Zerebralparese ab 2 Jahren), Spasmen (Blepharospasmus, hemifazialer Spasmus) und Dystonien (zervikal, fokal); Linderung der Symptomatik bei chronischer Migräne) |
| Botox Cosmetics (USA) Vistabel (D, A, CH u. a.) |
Toxin A | Allergan | Vorübergehende Verbesserung des Aussehens von mittelstarken bis starken Falten der oberen Gesichtshälfte (Glabellafalten, Krähenfüße, horizontale Stirnfalten) bei Erwachsenen bei erheblicher psychologischer Belastung |
| Dysport (D) | Toxin A | Ipsen | Symptomatische Behandlung diverser Spastiken (obere Extremitäten und Fußgelenk bei Erwachsenen, untere Extremitäten bei gehfähigen Patienten mit Zerebralparese ab 2 Jahren), Spasmen (Blepharospasmus, hemifazialer Spasmus) und Dystonien (zervikal, fokal) |
| Azzalure (D) | Toxin A | Ipsen | Vorübergehende Verbesserung des Aussehens von mittelstarken bis starken Falten der oberen Gesichtshälfte (Glabellafalten, Krähenfüße) bei Erwachsenen unter 65 Jahren bei erheblicher psychologischer Belastung |
| Xeomin (D, A, CH u. a.) | Toxin A | Merz | Schiefhals (Torticollis), Lidkrampf (Blepharospasmus) und Spastik der oberen Extremitäten bei Erwachsenen |
| Bocouture (D, A, CH u. a.) | Toxin A | Merz | Vorübergehende Verbesserung des Aussehens von mittelstarken bis starken Falten der oberen Gesichtshälfte (Glabellafalten, Krähenfüße, horizontale Stirnfalten) bei Erwachsenen unter 65 Jahren bei erheblicher psychologischer Belastung |
| Nuceiva (CA, EU) Jeuveau (USA) |
Toxin A | Evolus | Behandlung der Falten zwischen den Augenbrauen (Glabellafalten) bei psychologischer Belastung |
| Myobloc (USA) | Toxin B | Elan | Behandlung von zervikaler Dystonie bei Erwachsenen zur Reduzierung des Schweregrads der abnormen Kopfposition und Nackenschmerzen |
| Neurobloc (EU) | Toxin B | Eisai | Behandlung von zervikaler Dystonie (Torticollis) bei Erwachsenen |
Seit April 2009 müssen alle in den USA verkauften Botulinumtoxinpräparate – nach Festlegung durch die FDA aufgrund von Berichten über Nebenwirkungen – einen Warnhinweis tragen. Für jedes zugelassene Produkt ist weiterhin eine Risk Evaluation and Mitigation Strategy (REMS) notwendig. Die betroffenen Präparate sind Botox und Botox Cosmetic, Myobloc und Dysport. ⓘ
Der Hersteller Eisai warnt vor Off-Label-Anwendung von „Neurobloc“ (Toxin B), da dies zu Schluckstörungen und Atembeschwerden führen könne, wenn sich das Nervengift auf benachbarte Strukturen ausbreite. ⓘ
Jede Charge von Produktionseinheiten eines Botulinumtoxin-Medikaments muss auf Grund der hohen Giftigkeit routinemäßig einer Prüfung unterzogen werden. Hierbei ist der klassische LD50-Test zugelassen, bei dem mindestens 100 Mäusen das Gift in das Abdomen injiziert wird. Nach 3 bis 4 Tagen wird der LD50-Wert über die Anzahl der getöteten Tiere ermittelt. Die Tiere erleiden Muskellähmungen, Sehstörungen und Atemnot, bevor sie ersticken. Weltweit werden jedes Jahr rund 600.000 Mäuse dazu verwendet. ⓘ
Im Europäischen Arzneibuch sind folgende alternative Testverfahren beschrieben:
- Ein Nervus-phrenicus-Zwerchfell-Präparat, bei dem Nerven aus zuvor getöteten Mäusen oder Ratten herauspräpariert (ex vivo) und als Testobjekt verwendet werden.
- Der Endopeptidase-Test, ein molekularbiologisches in-vitro-Verfahren, bei dem das Gift ein synthetisches Protein SNAP-25 spaltet.
- Eine lokale Muskellähmung, bei der das Gift den Mäusen in die Hautfalte zwischen Bauch und Hinterbein gespritzt und das Ausmaß der Lähmungen des Hinterbeins beurteilt wird (Bestimmung der Wirksamkeit an der Maus mit paralytischem Endpunkt).
- Bestimmung in Zellkulturen ⓘ
Weitere Verfahren sind:
- Zellkulturtests mit einer Zelllinie aus Mäusekrebszellen (Neuroblastoma)
- Der immunchemische ELISA-Test mit Antikörpern aus Versuchstieren ⓘ
Das Tierversuchsverbot für Kosmetika greift nicht, da Botulinumtoxin-Produkte als Medikamente zugelassen sind sowie für die Anwendung injiziert und nicht bloß aufgetragen werden. ⓘ
Bei Tierversuchen mit Mäusen und Ratten wurde festgestellt, dass sich Botulinumtoxin im Zentralnervensystem verbreitet. ⓘ
Gewinnung und Lagerung
Botulinumtoxin A wird aus Kulturen von Clostridium botulinum gewonnen. Bei einem pH-Wert von 3,5 wird das Protein aus dem Kulturmedium ausgefällt; durch eine Abfolge mehrerer Zentrifugations-, Fällungs- und Adsorptionsschritte wird das Toxin gereinigt. Die Gewinnung weiterer Botulinumtoxine erfolgt analog aus anderen Clostridium-Arten und -Stämmen. Das gereinigte Toxin kann bei −70 °C für längere Zeit gelagert und ohne Aktivitätsverlust aufgetaut werden. Eine aus dem festen Protein und steriler isotonischer Kochsalzlösung hergestellte Injektionslösung kann im Kühlschrank für maximal vier Stunden aufbewahrt werden. ⓘ
Einsatz als Kampfstoff
Aufgrund der hohen Letalität bei verhältnismäßig einfacher Herstellung und Transport besteht die Gefahr, dass Botulinumtoxin als Biologische Waffe eingesetzt wird. Es wird durch das CDC als Stoff eingestuft, von dem eine hohe Gefahr durch Verwendung bei Bioterrorismus ausgeht. Botulinumtoxin könnte dabei in Lebensmitteln, als Aerosol oder über die Trinkwasserversorgung verbreitet werden. Gelöst in Wasser ist das Toxin farblos, geruchlos und geschmacklos. ⓘ
Im Rahmen der UNSCOM-Inspektionen nach dem 2. Golfkrieg stieß man im Irak auf Programme zur Herstellung von biologischen Waffen, u. a. auch Botulinumtoxin. In Deutschland unterliegt Botulinumtoxin dem Kriegswaffenkontrollgesetz. ⓘ
Nachweis
Der Nachweis des Toxins wurde früher meist aufwendig über eine Kulturbestimmung des Bakteriums C. botulinum (Erregerisolierung aus Stuhl oder Wundmaterial) durchgeführt; eine schnellere Nachweismethode ist die RT-PCR. Ein direkter Nachweis des Botulinumtoxins aus Blut, Stuhl, Mageninhalt oder Erbrochenem ist über Bioassay-Methoden (ELISA oder Maus-Bioassay) möglich, das heißt, es wird die Wirkung von Proben auf Labortiere wie Mäuse bestimmt. ⓘ
Dokumentarfilm
- Antje Christ: Botox – ein Gift macht Karriere. D, 2010, 55 Minuten ⓘ