Hippocampus
| Hippocampus ⓘ | |
|---|---|
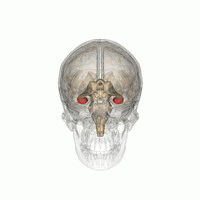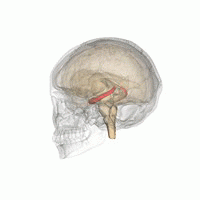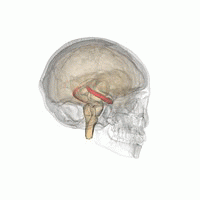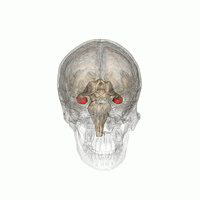 Der Mensch hat zwei Hippocampi, einen in jeder Hemisphäre des Gehirns. Sie befinden sich in den medialen Temporallappen des Großhirns. In dieser seitlichen Ansicht des menschlichen Gehirns befindet sich der Frontallappen auf der linken Seite, der Okzipitallappen auf der rechten Seite, und der Temporal- und Parietallappen sind weitgehend entfernt worden, um einen der darunter liegenden Hippocampi freizulegen. | |
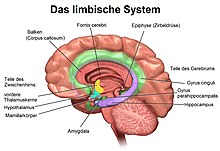
 Hippocampus (unterster rosa Bulbus) als Teil des limbischen Systems | |
| Einzelheiten | |
| Teil des | Temporallappen |
| Bezeichnungen | |
| Lateinisch | Hippocampus |
| Anatomische Begriffe der Neuroanatomie [Bearbeiten auf Wikidata] | |
Der Hippocampus (über lateinisch von griechisch ἱππόκαμπος, 'Seepferdchen') ist ein wichtiger Bestandteil des Gehirns des Menschen und anderer Wirbeltiere. Menschen und andere Säugetiere haben zwei Hippocampi, einen auf jeder Seite des Gehirns. Der Hippocampus ist Teil des limbischen Systems und spielt eine wichtige Rolle bei der Konsolidierung von Informationen aus dem Kurzzeitgedächtnis ins Langzeitgedächtnis und beim räumlichen Gedächtnis, das die Navigation ermöglicht. Der Hippocampus befindet sich im Allokortex und hat neuronale Projektionen in den Neokortex des Menschen und der Primaten. Der Hippocampus, das mediale Pallium, ist eine Struktur, die bei allen Wirbeltieren zu finden ist. Beim Menschen besteht er aus zwei ineinandergreifenden Hauptteilen: dem eigentlichen Hippocampus (auch Ammonshorn genannt) und dem Gyrus dentatus. ⓘ
Bei der Alzheimer-Krankheit (und anderen Formen der Demenz) ist der Hippocampus eine der ersten Hirnregionen, die geschädigt werden; Kurzzeitgedächtnisverlust und Desorientierung gehören zu den ersten Symptomen. Eine Schädigung des Hippocampus kann auch durch Sauerstoffmangel (Hypoxie), Enzephalitis oder mediale Temporallappenepilepsie verursacht werden. Bei Menschen mit ausgedehnten, bilateralen Hippocampus-Schäden kann eine anterograde Amnesie auftreten: die Unfähigkeit, neue Erinnerungen zu bilden und zu behalten. ⓘ
Da die verschiedenen neuronalen Zelltypen im Hippocampus fein säuberlich in Schichten organisiert sind, wurde er häufig als Modellsystem für die Untersuchung der Neurophysiologie verwendet. Die Form der neuronalen Plastizität, die als Langzeitpotenzierung (LTP) bekannt ist, wurde ursprünglich im Hippocampus entdeckt und ist in dieser Struktur häufig untersucht worden. Es wird allgemein angenommen, dass die LTP einer der wichtigsten neuronalen Mechanismen ist, durch den Erinnerungen im Gehirn gespeichert werden. ⓘ
Bei Nagetieren als Modellorganismen wurde der Hippocampus als Teil eines Gehirnsystems, das für das räumliche Gedächtnis und die Navigation verantwortlich ist, eingehend untersucht. Viele Neuronen im Hippocampus von Ratten und Mäusen reagieren als Ortszellen, d. h. sie feuern Aktionspotentiale ab, wenn das Tier einen bestimmten Teil seiner Umgebung durchquert. Hippocampus-Ortszellen interagieren in hohem Maße mit Kopfrichtungszellen, deren Aktivität als Trägheitskompass dient, und vermutlich auch mit Gitterzellen im benachbarten entorhinalen Kortex. ⓘ

Name

Die früheste Beschreibung des entlang des Bodens des Schläfenhorns des Seitenventrikels verlaufenden Grats stammt von dem venezianischen Anatomen Julius Caesar Aranzi (1587), der ihn zunächst mit einer Seidenraupe und dann mit einem Seepferdchen verglich (lateinisch hippocampus, von griechisch ἱππόκαμπος, von ἵππος, "Pferd" + κάμπος, "Seeungeheuer"). Der deutsche Anatom Duvernoy (1729), der die Struktur als erster darstellte, schwankte ebenfalls zwischen "Seepferdchen" und "Seidenraupe". Der dänische Anatom Jacob Winsløw schlug 1732 "Widderhorn" vor, und ein Jahrzehnt später verwendete sein Pariser Kollege, der Chirurg de Garengeot, cornu Ammonis - Horn des altägyptischen Gottes Amun, der oft mit einem Widderkopf dargestellt wurde. ⓘ
Ein weiterer Hinweis erschien mit dem Begriff pes hippocampi, der möglicherweise auf Diemerbroeck im Jahr 1672 zurückgeht, der einen Vergleich mit der Form der nach hinten gebogenen Vorderbeine und der Schwimmfüße des mythologischen Hippocampus anstellte, einem Seeungeheuer mit dem Vorderteil eines Pferdes und dem Schwanz eines Fisches. Der Hippocampus wurde damals als pes hippocampi major beschrieben, mit einer angrenzenden Ausbuchtung im Hinterhauptshorn, die als pes hippocampi minor bezeichnet und später in calcar avis umbenannt wurde. Die Umbenennung des Hippocampus in Hippocampus major und des Calcar avis in Hippocampus minor wird Félix Vicq-d'Azyr zugeschrieben, der 1786 die Nomenklatur der Teile des Gehirns systematisierte. Mayer verwendete 1779 fälschlicherweise den Begriff Hippopotamus, dem einige andere Autoren folgten, bis Karl Friedrich Burdach diesen Fehler 1829 aufklärte. 1861 wurde der Hippocampus minor zum Mittelpunkt eines Streits über die menschliche Evolution zwischen Thomas Henry Huxley und Richard Owen, der als die Große Hippocampus-Frage persifliert wurde. Der Begriff Hippocampus minor wurde in Anatomie-Lehrbüchern nicht mehr verwendet und in den Nomina Anatomica von 1895 offiziell gestrichen. Heute wird die Struktur einfach als Hippocampus bezeichnet, wobei der Begriff Cornu Ammonis (Ammons Horn) in den Namen der Hippocampus-Unterfelder CA1-CA4 erhalten geblieben ist. ⓘ
Ab 1706 wurde ein Hirnteil nach dem Seepferdchen (lateinisch Hippocampus) benannt. Das Seepferdchen wurde seinerseits seit den 1570er Jahren in latinisierter Form nach dem Meeresungeheuer Hippokamp aus der griechischen Mythologie bezeichnet, dessen vordere Hälfte ein Pferd, der hintere Teil ein Fisch ist. Der Name dieses Fabelwesens (altgriechisch ἱππόκαμπος hippokampos) ist zusammengesetzt aus hippos ‚Pferd‘ und kampos ‚Seeungeheuer‘. ⓘ
Der Hippocampus ähnelt insgesamt einem Seepferdchen ohne Kopf (siehe Abbildung). ⓘ
Beziehung zum limbischen System
Der Begriff limbisches System wurde 1952 von Paul MacLean eingeführt, um die Strukturen zu beschreiben, die den Rand der Hirnrinde säumen (lat. limbus = Grenze): Dazu gehören der Hippocampus, der cinguläre Kortex, der olfaktorische Kortex und die Amygdala. Paul MacLean schlug später vor, dass die limbischen Strukturen die neuronale Grundlage der Emotionen bilden. Der Hippocampus ist anatomisch mit Teilen des Gehirns verbunden, die mit emotionalem Verhalten zu tun haben - dem Septum, dem hypothalamischen Mammillarkörper und dem anterioren Kernkomplex im Thalamus - und wird allgemein als Teil des limbischen Systems angesehen. ⓘ
Anatomie

Der Hippocampus ist als eine Ausbuchtung der grauen Substanz zu erkennen, die sich vom Boden jedes Seitenventrikels in der Region des Unter- oder Schläfenhorns erhebt. Dieser Grat kann auch als eine nach innen gerichtete Falte des Archicortex in den medialen Temporallappen gesehen werden. Der Hippocampus ist nur bei Präparationen zu sehen, da er vom Gyrus parahippocampus verdeckt wird. Der Kortex verdünnt sich von sechs Schichten auf die drei oder vier Schichten, aus denen der Hippocampus besteht. ⓘ
Der Begriff Hippocampusformation wird verwendet, um den eigentlichen Hippocampus und die damit verbundenen Teile zu bezeichnen. Es besteht jedoch kein Konsens darüber, welche Teile dazu gehören. Manchmal wird gesagt, der Hippocampus umfasse den Gyrus dentatus und das Subiculum. In einigen Referenzen werden der Gyrus dentatus und das Subiculum zur Hippocampus-Formation gezählt, während andere auch das Presubiculum, das Parasubiculum und den entorhinalen Kortex einschließen. Der neuronale Aufbau und die Bahnen innerhalb der Hippocampus-Formation sind bei allen Säugetieren sehr ähnlich. ⓘ
Der Hippocampus, einschließlich des Gyrus dentatus, hat die Form einer gekrümmten Röhre, die mit einem Seepferdchen und dem Horn eines Widders verglichen wurde, der nach dem oft so dargestellten altägyptischen Gott cornu Ammonis genannt wird. Seine Abkürzung CA wird bei der Benennung der Hippocampus-Unterfelder CA1, CA2, CA3 und CA4 verwendet. Es handelt sich um einen Bereich, in dem sich die Hirnrinde zu einer einzigen Schicht dicht gepackter Pyramidenneuronen verengt, die sich zu einer engen U-Form zusammenrollen. Ein Rand des "U", CA4, ist in den nach hinten gerichteten, gebogenen Gyrus dentatus eingebettet. Der Hippocampus besteht aus einem vorderen und hinteren Teil (bei Primaten) bzw. einem ventralen und dorsalen Teil bei anderen Tieren. Beide Teile sind ähnlich aufgebaut, gehören aber zu unterschiedlichen neuronalen Schaltkreisen. Bei der Ratte ähneln die beiden Hippocampi einem Bananenpaar, das an den Stielen durch die Fornix-Kommissur (auch Hippocampus-Kommissur genannt) verbunden ist. Bei Primaten ist der untere Teil des Hippocampus in der Nähe der Basis des Schläfenlappens viel breiter als der obere Teil. Dies bedeutet, dass der Hippocampus im Querschnitt je nach Winkel und Lage des Schnitts verschiedene Formen aufweisen kann. ⓘ
In einem Querschnitt durch den Hippocampus, einschließlich des Gyrus dentatus, sind mehrere Schichten zu sehen. Der Gyrus dentatus besteht aus drei Zellschichten (oder vier, wenn der Hilus mit einbezogen wird). Die Schichten sind von außen nach innen - die molekulare Schicht, die innere molekulare Schicht, die körnige Schicht und der Hilus. Das CA3 im eigentlichen Hippocampus hat die folgenden Zellschichten, die als Strata bezeichnet werden: lacunosum-moleculare, radiatum, lucidum, pyramidal und oriens. CA2 und CA1 haben ebenfalls diese Schichten mit Ausnahme des Stratum lucidum. ⓘ
Der Input für den Hippocampus (aus verschiedenen kortikalen und subkortikalen Strukturen) kommt vom entorhinalen Kortex über den Perforansweg. Der entorhinale Kortex (EC) ist stark und wechselseitig mit vielen kortikalen und subkortikalen Strukturen sowie mit dem Hirnstamm verbunden. Verschiedene Thalamuskerne (aus der vorderen und mittleren Gruppe), der Nucleus septalis medialis, der Nucleus supramammillaris des Hypothalamus sowie die Raphe-Kerne und der Locus coeruleus des Hirnstamms senden alle Axone zum EC, so dass er als Schnittstelle zwischen dem Neokortex und den anderen Verbindungen sowie dem Hippocampus dient. ⓘ
Das EC befindet sich im parahippocampalen Gyrus, einer kortikalen Region, die an den Hippocampus angrenzt. Dieser Gyrus verbirgt den Hippocampus. Der parahippocampale Gyrus grenzt an den perirhinalen Kortex, der eine wichtige Rolle bei der visuellen Erkennung komplexer Objekte spielt. Es gibt auch deutliche Hinweise darauf, dass er einen Beitrag zum Gedächtnis leistet, der vom Beitrag des Hippocampus unterschieden werden kann. Es ist offensichtlich, dass eine vollständige Amnesie nur dann auftritt, wenn sowohl der Hippocampus als auch der Parahippocampus geschädigt sind. ⓘ
Der Gyrus dentatus stellt die Eingangsstation des Hippocampus dar. Seine Nervenzellkörper liegen im Körnerzellband (Stratum granulare). Die Hauptzellen sind erregende, glutamaterge Körnerzellen, die ihre Dendriten in die Molekularschicht (Stratum moleculare) nach außen entsenden. Außerdem gibt es eine Reihe unterschiedlicher hemmender, GABAerger Interneuronen, die durch ihre Morphologie, damit auch durch ihre Ein- und Ausgänge und ferner durch kennzeichnende Proteine unterschieden werden. Die Molekularschicht lässt sich unterteilen in die innere und äußere Molekularschicht. In beiden Teilen befinden sich kaum Nervenzellkörper, sondern nur Nervenfasern. Die Eingänge der beiden Schichten unterscheiden sich jedoch und können mit verschiedenen Färbungen visualisiert werden (siehe unten). Innerhalb des Bogens der Körnerzellschicht befindet sich der Hilus, auch Lamina multiformis genannt. Er enthält einige Interneurone, vor allem aber die Axone der Körnerzellen, die sogenannten Moosfasern (Beachte: Diese Axone haben bis auf den Namen nichts gemeinsam mit den Moosfasern im Kleinhirn). ⓘ
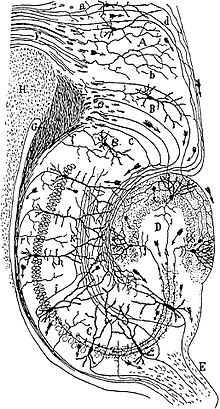
von Santiago Ramon y Cajal (1911) ⓘ
Das Subiculum ist das Übergangsfeld vom dreischichtigen, archicorticalen Hippocampus zum sechsschichtigen Neocortex. Es liegt zwischen der CA1-Region und dem Cortex entorhinalis. ⓘ
Schaltkreise

Der Haupteingang zum Hippocampus erfolgt über den entorhinalen Kortex (EC), während der Hauptausgang über CA1 zum Subiculum führt. Die Informationen erreichen CA1 über zwei Hauptwege: direkt und indirekt. Axone aus dem EC, die aus der Schicht III stammen, sind der Ursprung des direkten Perforans und bilden Synapsen an den sehr distalen apikalen Dendriten der CA1-Neuronen. Umgekehrt sind Axone, die aus der Schicht II stammen, der Ursprung des indirekten Weges, und die Informationen erreichen CA1 über den trisynaptischen Kreislauf. Im ersten Teil dieses Weges projizieren die Axone über die Perforansbahn zu den Körnerzellen des Gyrus dentatus (erste Synapse). Von dort gelangt die Information über die Moosfasern zum CA3 (zweite Synapse). Von dort aus verlassen die CA3-Achsen, die Schaffer-Kollateralen, den tiefen Teil des Zellkörpers und schlingen sich zu den apikalen Dendriten hinauf, um dann zu CA1 zu gelangen (dritte Synapse). Axone aus CA1 projizieren dann zurück zum entorhinalen Kortex und vervollständigen den Kreislauf. ⓘ
Die Korbzellen in CA3 erhalten einen erregenden Input von den Pyramidenzellen und geben dann eine hemmende Rückmeldung an die Pyramidenzellen. Diese rekurrente Hemmung ist ein einfacher Rückkopplungskreis, der erregende Reaktionen im Hippocampus dämpfen kann. Die Pyramidenzellen geben eine wiederkehrende Erregung ab, die ein wichtiger Mechanismus ist, der in einigen Mikroschaltkreisen der Gedächtnisverarbeitung zu finden ist. ⓘ
Mehrere andere Verbindungen spielen bei der Funktion des Hippocampus eine wichtige Rolle. Neben der Ausgabe an das EC gehen weitere Ausgabewege zu anderen kortikalen Bereichen, einschließlich des präfrontalen Kortex. Ein wichtiger Ausgang führt über den Fornix zum lateralen Septalbereich und zum Mammillarkörper des Hypothalamus (der über den Fornix mit dem Hippocampus verbunden ist). Der Hippocampus erhält modulierenden Input aus dem Serotonin-, Noradrenalin- und Dopaminsystem sowie aus dem Nucleus reuniens des Thalamus zum Feld CA1. Eine sehr wichtige Projektion kommt vom Nucleus septalis medialis, der cholinerge und Gamma-Aminobuttersäure (GABA)-stimulierende Fasern (GABA-erge Fasern) in alle Teile des Hippocampus sendet. Die Eingänge des Nucleus septalis medialis spielen eine Schlüsselrolle bei der Steuerung des physiologischen Zustands des Hippocampus; die Zerstörung dieses Kerns hebt den Theta-Rhythmus des Hippocampus auf und beeinträchtigt bestimmte Arten von Gedächtnisleistungen erheblich. ⓘ
Regionen

Es hat sich gezeigt, dass die Bereiche des Hippocampus funktionell und anatomisch unterschiedlich sind. Der dorsale Hippocampus (DH), der ventrale Hippocampus (VH) und der intermediäre Hippocampus haben unterschiedliche Funktionen, projizieren mit unterschiedlichen Bahnen und haben einen unterschiedlichen Anteil an Ortszellen. Der dorsale Hippocampus dient dem räumlichen Gedächtnis, dem verbalen Gedächtnis und dem Lernen von begrifflichen Informationen. Mit Hilfe des radialen Armlabyrinths wurde gezeigt, dass Läsionen im DH zu einer Beeinträchtigung des räumlichen Gedächtnisses führen, während dies bei VH-Läsionen nicht der Fall ist. Zu seinen Projektionsbahnen gehören der Nucleus septalis medialis und der Nucleus supramammillaris. Der dorsale Hippocampus hat auch mehr Ortszellen als die ventralen und intermediären Hippocampusregionen. ⓘ
Der intermediäre Hippocampus weist Überschneidungen mit dem ventralen und dorsalen Hippocampus auf. Cenquizca und Swanson (2007) lokalisierten mithilfe anterograder Tracing-Methoden die moderaten Projektionen zu zwei primären olfaktorischen kortikalen Arealen und prälimbischen Arealen des medialen präfrontalen Kortex. Diese Region weist die geringste Anzahl von Ortszellen auf. Der ventrale Hippocampus ist an der Furchtkonditionierung und an affektiven Prozessen beteiligt. Anagnostaras et al. (2002) zeigten, dass Veränderungen am ventralen Hippocampus die Menge an Informationen, die vom dorsalen und ventralen Hippocampus an die Amygdala gesendet wurden, verringerten und somit die Angstkonditionierung bei Ratten veränderten. Historisch gesehen war die erste weit verbreitete Hypothese, dass der Hippocampus am Geruchssinn beteiligt ist. Diese Idee wurde durch eine Reihe anatomischer Studien in Frage gestellt, in denen keine direkten Projektionen vom Riechkolben zum Hippocampus gefunden wurden. Spätere Arbeiten bestätigten jedoch, dass der Riechkolben sehr wohl in den ventralen Teil des lateralen entorhinalen Kortex projiziert, und das Feld CA1 im ventralen Hippocampus sendet Axone zum Hauptriechkolben, zum anterioren Riechkern und zum primären Riechkortex. Es besteht nach wie vor ein gewisses Interesse an den Geruchsreaktionen des Hippocampus, insbesondere an der Rolle des Hippocampus bei der Erinnerung an Gerüche, aber nur wenige Fachleute glauben heute, dass das Riechen seine Hauptfunktion ist. ⓘ
Funktion
Theorien über die Funktionen des Hippocampus
Im Laufe der Jahre haben drei Hauptvorstellungen über die Funktion des Hippocampus die Literatur dominiert: Reaktionshemmung, episodisches Gedächtnis und räumliche Wahrnehmung. Die Theorie der Verhaltenshemmung (von John O'Keefe und Lynn Nadel als "Vollbremsung!" karikiert) war bis in die 1960er Jahre sehr populär. Sie stützte sich zu einem großen Teil auf zwei Beobachtungen: erstens, dass Tiere mit Hippocampus-Schäden dazu neigen, hyperaktiv zu sein; zweitens, dass Tiere mit Hippocampus-Schäden oft Schwierigkeiten haben, zu lernen, Reaktionen zu unterdrücken, die ihnen zuvor beigebracht wurden, insbesondere wenn die Reaktion erfordert, ruhig zu bleiben, wie bei einem passiven Vermeidungstest. Der britische Psychologe Jeffrey Gray entwickelte diesen Gedankengang zu einer vollwertigen Theorie über die Rolle des Hippocampus bei Angstzuständen weiter. Die Inhibitionstheorie ist derzeit die am wenigsten populäre der drei Theorien. ⓘ
Die zweite wichtige Denkrichtung bezieht den Hippocampus auf das Gedächtnis. Obwohl es historische Vorläufer gab, erhielt diese Idee ihren Hauptimpuls durch einen berühmten Bericht des amerikanischen Neurochirurgen William Beecher Scoville und der britisch-kanadischen Neuropsychologin Brenda Milner, in dem die Ergebnisse einer chirurgischen Zerstörung des Hippocampus beschrieben wurden, die bei dem Versuch erfolgte, epileptische Anfälle bei dem Amerikaner Henry Molaison zu lindern, der bis zu seinem Tod im Jahr 2008 als "Patient H.M." bekannt war. Das unerwartete Ergebnis der Operation war eine schwere anterograde und teilweise retrograde Amnesie; Molaison war nach der Operation nicht in der Lage, neue episodische Erinnerungen zu bilden, und konnte sich nicht an Ereignisse erinnern, die unmittelbar vor der Operation stattgefunden hatten, aber er behielt Erinnerungen an Ereignisse, die viele Jahre zuvor stattgefunden hatten und bis in seine Kindheit zurückreichten. Dieser Fall erregte in der Fachwelt so großes Interesse, dass Molaison zum am intensivsten untersuchten Patienten der Medizingeschichte wurde. In den darauffolgenden Jahren wurden auch andere Patienten mit ähnlichen Schädigungen des Hippocampus und Amnesie (durch Unfall oder Krankheit) untersucht, und in Tausenden von Experimenten wurde die Physiologie der aktivitätsbedingten Veränderungen der synaptischen Verbindungen im Hippocampus untersucht. Man ist sich inzwischen einig, dass der Hippocampus eine wichtige Rolle für das Gedächtnis spielt; die genaue Art dieser Rolle ist jedoch nach wie vor sehr umstritten. Eine neuere Theorie besagt - ohne die Rolle des Hippocampus bei der räumlichen Wahrnehmung in Frage zu stellen -, dass der Hippocampus neue episodische Erinnerungen kodiert, indem er Repräsentationen in den neugeborenen Körnerzellen des Gyrus dentatus assoziiert und diese Repräsentationen sequenziell im CA3 anordnet, wobei er sich auf die im entorhinalen Kortex erzeugte Phasenpräzession stützt ⓘ

Die dritte wichtige Theorie der Hippocampusfunktion bezieht den Hippocampus auf den Raum. Die räumliche Theorie wurde ursprünglich von O'Keefe und Nadel vertreten, die von den Theorien des amerikanischen Psychologen E.C. Tolman über "kognitive Landkarten" bei Menschen und Tieren beeinflusst wurden. O'Keefe und sein Student Dostrovsky entdeckten 1971 im Hippocampus der Ratte Neuronen, die eine Aktivität zu zeigen schienen, die mit dem Standort der Ratte in ihrer Umgebung zusammenhing. Trotz der Skepsis anderer Forscher setzten O'Keefe und seine Mitarbeiter, insbesondere Lynn Nadel, die Untersuchung dieser Frage fort, was schließlich zu ihrem sehr einflussreichen Buch The Hippocampus as a Cognitive Map von 1978 führte. Heute ist man sich fast einig, dass die Funktion des Hippocampus eine wichtige Rolle bei der räumlichen Kodierung spielt, aber die Einzelheiten sind sehr umstritten. ⓘ
Spätere Forschungen haben sich darauf konzentriert, die Kluft zwischen den beiden Hauptauffassungen über die Funktion des Hippocampus zu überbrücken, die zwischen Gedächtnis und räumlicher Kognition aufgeteilt ist. In einigen Studien wurden diese Bereiche bis zu dem Punkt erweitert, an dem sie nahezu konvergieren. In einem Versuch, die beiden unterschiedlichen Auffassungen miteinander in Einklang zu bringen, wird vorgeschlagen, die Funktion des Hippocampus breiter zu fassen und ihm eine Rolle zuzuweisen, die sowohl die Organisation von Erfahrungen (mentales Mapping gemäß Tolmans ursprünglichem Konzept von 1948) als auch das Richtungsverhalten umfasst, das in allen Bereichen der Kognition als beteiligt angesehen wird, so dass die Funktion des Hippocampus als ein breiteres System betrachtet werden kann, das sowohl die Gedächtnis- als auch die Raumperspektive in seine Rolle einbezieht, die die Verwendung eines breiten Spektrums von kognitiven Karten beinhaltet. Dies bezieht sich auf den zweckgerichteten Behaviorismus, der aus Tolmans ursprünglichem Ziel der Identifizierung der komplexen kognitiven Mechanismen und Zwecke, die das Verhalten steuern, entstanden ist. ⓘ
Es wurde auch vorgeschlagen, dass die Spiking-Aktivität der Hippocampus-Neuronen räumlich assoziiert ist, und es wurde vermutet, dass sich die Mechanismen des Gedächtnisses und der Planung beide aus den Mechanismen der Navigation entwickelt haben und dass ihre neuronalen Algorithmen im Grunde die gleichen sind. ⓘ
In vielen Studien wurden bildgebende Verfahren wie die funktionelle Magnetresonanztomographie (fMRI) eingesetzt, und es wurde eine funktionelle Rolle bei Annäherungs-/Vermeidungskonflikten festgestellt. Es wurde festgestellt, dass der vordere Hippocampus an der Entscheidungsfindung bei der Verarbeitung von Annäherungs-/Vermeidungskonflikten beteiligt ist. Es wird vermutet, dass die Funktionen des Gedächtnisses, der räumlichen Wahrnehmung und der Konfliktverarbeitung zusammenwirken und sich nicht gegenseitig ausschließen. ⓘ
Die Rolle des Gedächtnisses
Psychologen und Neurowissenschaftler sind sich allgemein einig, dass der Hippocampus eine wichtige Rolle bei der Bildung neuer Erinnerungen an erlebte Ereignisse (episodisches oder autobiografisches Gedächtnis) spielt. Ein Teil dieser Funktion ist die Beteiligung des Hippocampus an der Erkennung neuer Ereignisse, Orte und Reize. Einige Forscher betrachten den Hippocampus als Teil eines größeren Gedächtnissystems im medialen Temporallappen, das für das allgemeine deklarative Gedächtnis verantwortlich ist (Erinnerungen, die explizit verbalisiert werden können - dazu gehört z. B. neben dem episodischen Gedächtnis auch das Gedächtnis für Fakten). Der Hippocampus kodiert auch emotionale Zusammenhänge aus der Amygdala. Dies ist einer der Gründe, warum die Rückkehr an einen Ort, an dem ein emotionales Ereignis stattgefunden hat, diese Emotion hervorrufen kann. Es besteht eine tiefe emotionale Verbindung zwischen episodischen Erinnerungen und Orten. ⓘ
Aufgrund der bilateralen Symmetrie verfügt das Gehirn über einen Hippocampus in jeder Gehirnhälfte. Wenn der Hippocampus nur in einer Hemisphäre geschädigt ist und die Struktur in der anderen Hemisphäre intakt bleibt, kann das Gehirn eine nahezu normale Gedächtnisfunktion beibehalten. Eine schwere Schädigung des Hippocampus in beiden Hemisphären führt zu tiefgreifenden Schwierigkeiten bei der Bildung neuer Erinnerungen (anterograde Amnesie) und beeinträchtigt häufig auch Erinnerungen, die vor der Schädigung gebildet wurden (retrograde Amnesie). Obwohl der retrograde Effekt normalerweise viele Jahre vor der Hirnschädigung zurückreicht, bleiben in einigen Fällen ältere Erinnerungen erhalten. Diese Beibehaltung älterer Erinnerungen führt zu der Vorstellung, dass die Konsolidierung im Laufe der Zeit die Übertragung von Erinnerungen aus dem Hippocampus in andere Teile des Gehirns beinhaltet. Experimente mit intrahippocampaler Transplantation von Hippocampuszellen bei Primaten mit neurotoxischen Läsionen des Hippocampus haben gezeigt, dass der Hippocampus für die Bildung und den Abruf, nicht aber für die Speicherung von Erinnerungen erforderlich ist. Es hat sich gezeigt, dass eine Verringerung des Volumens verschiedener Teile des Hippocampus bei Menschen zu spezifischen Gedächtnisbeeinträchtigungen führt. Insbesondere die Effizienz der verbalen Gedächtnisleistung hängt mit den vorderen Teilen des rechten und linken Hippocampus zusammen. Der rechte Kopf des Hippocampus ist stärker an den exekutiven Funktionen und der Regulierung während des Abrufs verbaler Erinnerungen beteiligt. Der hintere Teil des linken Hippocampus ist in der Regel eng mit der verbalen Gedächtnisleistung verbunden. ⓘ
Eine Schädigung des Hippocampus beeinträchtigt einige Arten von Gedächtnisleistungen nicht, wie z. B. die Fähigkeit, neue Fähigkeiten zu erlernen (z. B. ein Musikinstrument zu spielen oder bestimmte Rätsel zu lösen). Diese Tatsache deutet darauf hin, dass solche Fähigkeiten von anderen Gedächtnisarten (prozedurales Gedächtnis) und anderen Gehirnregionen abhängen. Darüber hinaus zeigen Amnesiepatienten häufig ein "implizites" Gedächtnis für Erfahrungen, auch wenn sie diese nicht bewusst wahrnehmen. So können Patienten, die erraten sollen, welches von zwei Gesichtern sie zuletzt gesehen haben, in den meisten Fällen die richtige Antwort geben, obwohl sie angeben, keines der beiden Gesichter jemals zuvor gesehen zu haben. Einige Forscher unterscheiden zwischen dem bewussten Erinnern, das vom Hippocampus abhängt, und der Vertrautheit, die von Teilen des medialen Temporallappens abhängt. ⓘ
Wenn Ratten einem intensiven Lernerlebnis ausgesetzt sind, können sie sich selbst nach einer einzigen Trainingseinheit ein Leben lang an dieses Ereignis erinnern. Die Erinnerung an ein solches Ereignis wird offenbar zunächst im Hippocampus gespeichert, aber diese Speicherung ist nur vorübergehend. Ein Großteil der Langzeitspeicherung des Gedächtnisses scheint im anterioren cingulären Kortex stattzufinden. Als ein solch intensives Lernereignis experimentell angewandt wurde, traten im neuronalen Genom des Hippocampus der Ratten eine Stunde und 24 Stunden nach dem Training mehr als 5.000 unterschiedlich methylierte DNA-Regionen auf. Diese Veränderungen im Methylierungsmuster traten bei vielen Genen auf, die herunterreguliert wurden, oft aufgrund der Bildung neuer 5-Methylcytosin-Stellen in CpG-reichen Regionen des Genoms. Darüber hinaus wurden viele andere Gene hochreguliert, was wahrscheinlich oft auf die Entfernung von Methylgruppen von bereits vorhandenen 5-Methylcytosinen (5mC) in der DNA zurückzuführen ist. Die Demethylierung von 5mC kann von mehreren Proteinen durchgeführt werden, die zusammenarbeiten, darunter TET-Enzyme sowie Enzyme des DNA-Basen-Exzisionsreparaturwegs (siehe Epigenetik bei Lernen und Gedächtnis). ⓘ

Studien an sich frei bewegenden Ratten und Mäusen haben gezeigt, dass viele Neuronen im Hippocampus als Ortszellen fungieren, die sich in Ortsfeldern gruppieren und Aktionspotenziale ausstoßen, wenn das Tier einen bestimmten Ort passiert. Diese ortsbezogene neuronale Aktivität im Hippocampus wurde auch bei Affen beobachtet, die in einem Stuhl gefesselt durch einen Raum bewegt wurden. Die Ortszellen feuerten jedoch möglicherweise in Abhängigkeit davon, wohin der Affe blickte, und nicht von seinem tatsächlichen Standort im Raum. Über viele Jahre hinweg wurden zahlreiche Studien über die Reaktionen von Nagetieren auf den Ort durchgeführt, die eine große Menge an Informationen lieferten. Reaktionen von Ortszellen werden von Pyramidenzellen im Hippocampus und von Körnerzellen im Gyrus dentatus gezeigt. Andere Zellen, die einen geringeren Anteil ausmachen, sind hemmende Interneuronen, und diese zeigen oft ortsabhängige Variationen in ihrer Feuerungsrate, die viel schwächer sind. Die Repräsentation weist, wenn überhaupt, nur eine geringe räumliche Topografie auf; im Allgemeinen haben nebeneinander liegende Zellen im Hippocampus unkorrelierte räumliche Feuermuster. Die Ortszellen sind in der Regel fast stumm, wenn sich die Ratte außerhalb des Ortsfeldes bewegt, erreichen aber anhaltende Raten von bis zu 40 Hz, wenn sich die Ratte in der Nähe des Zentrums befindet. Neuronale Aktivität, die von 30 bis 40 zufällig ausgewählten Ortszellen abgetastet wird, enthält genügend Informationen, um den Standort einer Ratte mit hoher Zuverlässigkeit zu rekonstruieren. Die Größe der Ortsfelder variiert in einem Gradienten entlang der Länge des Hippocampus, wobei die Zellen am dorsalen Ende die kleinsten Felder aufweisen, die Zellen in der Nähe des Zentrums größere Felder, und die Zellen an der ventralen Spitze Felder, die die gesamte Umgebung abdecken. In einigen Fällen hängt die Feuerrate der Hippocampuszellen nicht nur vom Ort ab, sondern auch von der Richtung, in die sich die Ratte bewegt, dem Ziel, auf das sie zusteuert, oder anderen aufgabenbezogenen Variablen. Das Feuern von Ortszellen ist zeitlich auf lokale Thetawellen abgestimmt, ein Prozess, der als Phasenpräzession bezeichnet wird. ⓘ
Beim Menschen wurden Zellen mit ortsspezifischen Feuermustern in einer Studie an Patienten mit arzneimittelresistenter Epilepsie entdeckt. Sie unterzogen sich einem invasiven Verfahren, um die Quelle ihrer Anfälle im Hinblick auf eine chirurgische Resektion zu lokalisieren. Den Patienten wurden diagnostische Elektroden in den Hippocampus implantiert, und sie bewegten sich anschließend mit Hilfe eines Computers in einer Stadt der virtuellen Realität. Ähnliche Studien zur Bildgebung des Gehirns bei der Navigation haben gezeigt, dass der Hippocampus aktiv ist. Eine Studie wurde an Taxifahrern durchgeführt. Londons Taxifahrer müssen die Standorte zahlreicher Orte und die schnellsten Routen zwischen ihnen kennen, um einen strengen Test namens "The Knowledge" (Das Wissen) zu bestehen und damit eine Lizenz zum Fahren zu erhalten. Eine Studie hat gezeigt, dass der hintere Teil des Hippocampus bei diesen Fahrern größer ist als bei der Allgemeinbevölkerung, und dass eine positive Korrelation zwischen der Dauer der Tätigkeit als Fahrer und der Zunahme des Volumens dieses Teils besteht. Es wurde auch festgestellt, dass das Gesamtvolumen des Hippocampus unverändert blieb, da die Vergrößerung des hinteren Teils auf Kosten des vorderen Teils ging, der eine relative Abnahme der Größe aufwies. Es wurden keine nachteiligen Auswirkungen dieser Ungleichheit der Hippocampus-Proportionen berichtet. Eine andere Studie zeigte bei blinden Personen gegenteilige Ergebnisse. Im Vergleich zu sehenden Personen war der vordere Teil des rechten Hippocampus größer und der hintere Teil kleiner. ⓘ
Es gibt mehrere Navigationszellen im Gehirn, die entweder im Hippocampus selbst liegen oder eng mit ihm verbunden sind, wie die Geschwindigkeitszellen im medialen entorhinalen Kortex. Zusammen bilden diese Zellen ein Netzwerk, das als räumliches Gedächtnis dient. Die ersten dieser Zellen, die in den 1970er Jahren entdeckt wurden, waren die Ortszellen, die zu der Idee führten, dass der Hippocampus eine neuronale Repräsentation der Umgebung in einer kognitiven Karte liefert. Wenn der Hippocampus gestört ist, ist die Orientierung beeinträchtigt; die Menschen können sich nur schwer daran erinnern, wie sie an einen Ort gelangt sind und wie sie weitergehen sollen. Sich zu verirren ist ein häufiges Symptom der Amnesie. Studien mit Tieren haben gezeigt, dass ein intakter Hippocampus für das anfängliche Lernen und langfristige Behalten einiger Aufgaben des räumlichen Gedächtnisses erforderlich ist, insbesondere solcher, bei denen man den Weg zu einem versteckten Ziel finden muss. Seit der Entdeckung der Ortszellen im Nagetiergehirn wurden weitere Zellen entdeckt, die sich entweder im Hippocampus oder im entorhinalen Kortex befinden. Diese wurden als Kopfrichtungszellen, Gitterzellen und Grenzzellen bezeichnet. Es wird vermutet, dass die Geschwindigkeitszellen den Hippocampus-Gitterzellen Input liefern. ⓘ
Rolle bei der Verarbeitung von Annäherungs-/Vermeidungskonflikten
Ein Annäherungs-Vermeidungs-Konflikt tritt auf, wenn eine Situation präsentiert wird, die entweder belohnend oder bestrafend sein kann, und die darauf folgende Entscheidungsfindung wurde mit Angst in Verbindung gebracht. fMRT-Ergebnisse aus Studien zur Annäherungs-Vermeidungs-Entscheidungsfindung ergaben Hinweise auf eine funktionelle Rolle, die weder durch das Langzeitgedächtnis noch durch räumliche Kognition erklärt werden kann. Insgesamt zeigten die Ergebnisse, dass der anteriore Hippocampus empfindlich auf Konflikte reagiert und dass er möglicherweise Teil eines größeren kortikalen und subkortikalen Netzwerks ist, das für die Entscheidungsfindung unter unsicheren Bedingungen wichtig ist. ⓘ
In einer Übersichtsarbeit wird auf eine Reihe von Studien verwiesen, die die Beteiligung des Hippocampus an Konfliktaufgaben zeigen. Die Autoren weisen darauf hin, dass eine Herausforderung darin besteht, zu verstehen, wie die Konfliktverarbeitung mit den Funktionen der räumlichen Navigation und des Gedächtnisses zusammenhängt und dass sich diese Funktionen nicht gegenseitig ausschließen müssen. ⓘ
Elektroenzephalographie

Der Hippocampus weist zwei Hauptaktivitätsmodi" auf, die jeweils mit einem bestimmten Muster neuronaler Populationsaktivität und elektrischen Aktivitätswellen verbunden sind, die mit einem Elektroenzephalogramm (EEG) gemessen werden. Diese Modi sind nach den mit ihnen verbundenen EEG-Mustern benannt: Theta und große unregelmäßige Aktivität (LIA). Die im Folgenden beschriebenen Hauptmerkmale beziehen sich auf die Ratte, die das am besten untersuchte Tier ist. ⓘ
Der Theta-Modus tritt bei aktivem, wachem Verhalten (insbesondere bei der Fortbewegung) und auch im REM-Schlaf (Träumen) auf. Im Theta-Modus wird das EEG von großen regelmäßigen Wellen mit einem Frequenzbereich von 6 bis 9 Hz dominiert, und die Hauptgruppen der Hippocampus-Neuronen (Pyramidenzellen und Körnerzellen) zeigen eine spärliche Populationsaktivität, was bedeutet, dass in jedem kurzen Zeitintervall die große Mehrheit der Zellen still ist, während die kleine verbleibende Fraktion mit relativ hoher Rate feuert, bis zu 50 Spikes in einer Sekunde für die aktivsten von ihnen. Eine aktive Zelle bleibt in der Regel eine halbe Sekunde bis einige Sekunden lang aktiv. Im Laufe des Verhaltens der Ratte verstummen die aktiven Zellen und neue Zellen werden aktiv, aber der Gesamtanteil der aktiven Zellen bleibt mehr oder weniger konstant. In vielen Situationen wird die Zellaktivität weitgehend durch die räumliche Position des Tieres bestimmt, aber auch andere Verhaltensvariablen beeinflussen sie eindeutig. ⓘ
Der LIA-Modus tritt während des Slow-Wave-Schlafs (ohne Träume) auf, aber auch in Phasen der Wachheit, z. B. beim Ruhen oder Essen. Im LIA-Modus wird das EEG von scharfen Wellen dominiert, die zufällig getaktete große Ausschläge des EEG-Signals sind und 25-50 Millisekunden dauern. Scharfe Wellen werden häufig in Gruppen erzeugt, wobei die Gruppen bis zu 5 oder mehr einzelne scharfe Wellen enthalten und bis zu 500 ms dauern. Die Spiking-Aktivität der Neuronen im Hippocampus ist in hohem Maße mit der Aktivität der scharfen Wellen korreliert. Die meisten Neuronen verringern ihre Feuerrate zwischen scharfen Wellen; während einer scharfen Welle kommt es jedoch bei bis zu 10 % der Hippocampus-Population zu einem dramatischen Anstieg der Feuerrate ⓘ
Diese beiden Aktivitätsmodi des Hippocampus können sowohl bei Primaten als auch bei Ratten beobachtet werden, mit der Ausnahme, dass es schwierig war, eine robuste Theta-Rhythmik im Hippocampus von Primaten zu erkennen. Es gibt jedoch qualitativ ähnliche scharfe Wellen und ähnliche zustandsabhängige Veränderungen in der neuronalen Populationsaktivität. ⓘ
Theta-Rhythmus

Die zugrundeliegenden Ströme, die die Theta-Welle erzeugen, werden hauptsächlich von dicht gepackten neuronalen Schichten des entorhinalen Kortex, CA3, und den Dendriten von Pyramidenzellen erzeugt. Die Thetawelle ist eines der größten Signale im EEG und wird als hippocampaler Theta-Rhythmus bezeichnet. In manchen Situationen wird das EEG von regelmäßigen Wellen bei 3 bis 10 Hz dominiert, die oft viele Sekunden lang anhalten. Diese spiegeln unterschwellige Membranpotenziale wider und modulieren stark die Spikes der Hippocampus-Neuronen und synchronisieren sich im Hippocampus in einem Wanderwellenmuster. Der trisynaptische Schaltkreis ist ein Relais der Neurotransmission im Hippocampus, das mit vielen Hirnregionen interagiert. Studien an Nagetieren haben ergeben, dass der trisynaptische Schaltkreis den Theta-Rhythmus im Hippocampus erzeugt. ⓘ
Die Theta-Rhythmik ist bei Kaninchen und Nagetieren sehr deutlich und auch bei Katzen und Hunden eindeutig vorhanden. Ob Theta auch bei Primaten zu beobachten ist, ist noch nicht klar. Bei Ratten (den am besten untersuchten Tieren) tritt Theta vor allem unter zwei Bedingungen auf: erstens, wenn ein Tier läuft oder auf andere Weise aktiv mit seiner Umgebung interagiert, und zweitens während des REM-Schlafs. Die Funktion von Theta ist noch nicht überzeugend erklärt worden, obwohl zahlreiche Theorien vorgeschlagen wurden. Die populärste Hypothese ist die, dass sie mit Lernen und Gedächtnis zusammenhängt. Ein Beispiel wäre die Phase, in der Theta-Rhythmen zum Zeitpunkt der Stimulation eines Neurons die Wirkung dieser Stimulation auf seine Synapsen prägen. Gemeint ist damit, dass Theta-Rhythmen diejenigen Aspekte des Lernens und des Gedächtnisses beeinflussen können, die von der synaptischen Plastizität abhängen. Es ist bekannt, dass Läsionen des medialen Septums - des zentralen Knotens des Theta-Systems - schwere Gedächtnisstörungen verursachen. Das mediale Septum ist jedoch nicht nur für die Steuerung des Thetasystems zuständig, sondern auch die Hauptquelle der cholinergen Projektionen zum Hippocampus. Es ist nicht erwiesen, dass Läsionen des Septums ihre Wirkung speziell durch die Ausschaltung des Theta-Rhythmus entfalten. ⓘ
Scharfe Wellen
Im Schlaf oder in Ruhe, wenn ein Tier nicht mit seiner Umgebung beschäftigt ist, zeigt das EEG des Hippocampus ein Muster unregelmäßiger langsamer Wellen, deren Amplitude etwas größer ist als die der Thetawellen. Dieses Muster wird gelegentlich von großen Ausschlägen, den so genannten scharfen Wellen, unterbrochen. Diese Ereignisse sind mit Spike-Aktivitätsstößen von 50 bis 100 Millisekunden Dauer in den Pyramidenzellen von CA3 und CA1 verbunden. Sie sind auch mit kurzlebigen hochfrequenten EEG-Oszillationen, den so genannten "Ripples", verbunden, deren Frequenzen bei Ratten im Bereich von 150 bis 200 Hz liegen, und die zusammen als "sharp waves" und "Ripples" bezeichnet werden. Scharfe Wellen treten am häufigsten während des Schlafs auf, wenn sie mit einer durchschnittlichen Rate von etwa 1 pro Sekunde (bei Ratten), aber in einem sehr unregelmäßigen zeitlichen Muster auftreten. Scharfe Wellen treten weniger häufig während inaktiver Wachphasen auf und sind in der Regel kleiner. Scharfe Wellen sind auch bei Menschen und Affen beobachtet worden. Bei Makaken sind die scharfen Wellen robust, treten aber nicht so häufig auf wie bei Ratten. ⓘ
Einer der interessantesten Aspekte der scharfen Wellen ist, dass sie mit dem Gedächtnis in Verbindung zu stehen scheinen. Wilson und McNaughton 1994 sowie zahlreiche spätere Studien berichteten, dass Hippocampus-Ortszellen, die überlappende räumliche Feuerungsfelder haben (und daher oft fast gleichzeitig feuern), dazu neigen, im Schlaf nach der Verhaltenssitzung korrelierte Aktivität zu zeigen. Diese Verstärkung der Korrelation, die gemeinhin als Reaktivierung bezeichnet wird, tritt vor allem während scharfer Wellen auf. Es wurde vorgeschlagen, dass scharfe Wellen tatsächlich Reaktivierungen von neuronalen Aktivitätsmustern sind, die während des Verhaltens gespeichert wurden, angetrieben durch die Stärkung synaptischer Verbindungen innerhalb des Hippocampus. Diese Idee ist ein Schlüsselelement der von Buzsáki und anderen vertretenen Theorie des "zweistufigen Gedächtnisses", die besagt, dass Erinnerungen während des Verhaltens im Hippocampus gespeichert und später während des Schlafs in den Neocortex übertragen werden. Scharfe Wellen werden in der Hebbian-Theorie als anhaltend wiederholte Stimulationen postsynaptischer Zellen durch präsynaptische Zellen betrachtet, die synaptische Veränderungen in den kortikalen Zielen der hippocampalen Ausgabestrecken bewirken sollen. Die Unterdrückung von scharfen Wellen und Ripples im Schlaf oder während der Unbeweglichkeit kann Erinnerungen auf der Verhaltensebene beeinträchtigen. Dennoch kann der neu gebildete CA1-Ortszellencode auch nach einem Schlaf mit unterdrückten scharfen Wellen und Ripples bei räumlich nicht anspruchsvollen Aufgaben wieder auftauchen. ⓘ
Langfristige Potenzierung
Mindestens seit Ramon y Cajal (1852-1934) haben Psychologen spekuliert, dass das Gehirn Erinnerungen speichert, indem es die Stärke der Verbindungen zwischen gleichzeitig aktiven Neuronen verändert. Diese Idee wurde 1949 von Donald Hebb formuliert, blieb aber viele Jahre lang unerklärt. 1973 beschrieben Tim Bliss und Terje Lømo ein Phänomen im Hippocampus von Kaninchen, das Hebbs Spezifikationen zu erfüllen schien: eine Veränderung der synaptischen Reaktionsfähigkeit, die durch eine kurze, starke Aktivierung ausgelöst wird und über Stunden, Tage oder länger anhält. Dieses Phänomen wurde bald als Langzeitpotenzierung (LTP) bezeichnet. Als ein möglicher Mechanismus für das Langzeitgedächtnis wurde die LTP seither intensiv untersucht, und man hat viel darüber gelernt. Die Komplexität und Vielfalt der intrazellulären Signalkaskaden, die LTP auslösen können, verhindern jedoch ein umfassenderes Verständnis. ⓘ
Der Hippocampus ist aufgrund seiner dicht gepackten und scharf abgegrenzten Neuronenschichten ein besonders günstiger Ort für die Untersuchung von LTP, aber ähnliche Arten von aktivitätsabhängigen synaptischen Veränderungen wurden auch in vielen anderen Hirnregionen beobachtet. Die am besten untersuchte Form der LTP wurde in CA1 des Hippocampus beobachtet und tritt an Synapsen auf, die an dendritischen Dornen enden und den Neurotransmitter Glutamat verwenden. Die synaptischen Veränderungen hängen von einem speziellen Typ von Glutamatrezeptor ab, dem N-Methyl-D-Aspartat (NMDA)-Rezeptor, einem Zelloberflächenrezeptor, der die besondere Eigenschaft hat, den Eintritt von Kalzium in den postsynaptischen Stachel nur dann zuzulassen, wenn präsynaptische Aktivierung und postsynaptische Depolarisation gleichzeitig auftreten. Medikamente, die mit NMDA-Rezeptoren interferieren, blockieren die LTP und haben erhebliche Auswirkungen auf einige Arten von Gedächtnis, insbesondere das räumliche Gedächtnis. Genetisch veränderte Mäuse, bei denen der LTP-Mechanismus ausgeschaltet ist, weisen im Allgemeinen ebenfalls schwere Gedächtnisdefizite auf. ⓘ
Störungen
Altern
Altersbedingte Erkrankungen wie die Alzheimer-Krankheit und andere Formen der Demenz (bei denen eine Störung des Hippocampus eines der frühesten Anzeichen ist) haben schwerwiegende Auswirkungen auf viele Arten der Wahrnehmung, einschließlich des Gedächtnisses. Selbst das normale Altern geht mit einer allmählichen Abnahme einiger Gedächtnisarten einher, darunter das episodische Gedächtnis und das Arbeitsgedächtnis (oder Kurzzeitgedächtnis). Da man davon ausgeht, dass der Hippocampus eine zentrale Rolle für das Gedächtnis spielt, hat man sich intensiv mit der Möglichkeit beschäftigt, dass altersbedingte Gedächtnisverluste durch eine Verschlechterung des Hippocampus verursacht werden könnten. Einige frühe Studien berichteten über einen beträchtlichen Verlust von Neuronen im Hippocampus älterer Menschen, aber spätere Studien, die präzisere Techniken verwendeten, stellten nur minimale Unterschiede fest. In ähnlicher Weise haben einige MRT-Studien über eine Schrumpfung des Hippocampus bei älteren Menschen berichtet, andere Studien konnten diesen Befund jedoch nicht reproduzieren. Es besteht jedoch ein zuverlässiger Zusammenhang zwischen der Größe des Hippocampus und der Gedächtnisleistung, so dass bei einer altersbedingten Schrumpfung auch die Gedächtnisleistung beeinträchtigt wird. Es gibt auch Berichte darüber, dass Gedächtnisaufgaben bei älteren Menschen tendenziell zu einer geringeren Aktivierung des Hippocampus führen als bei jungen Menschen. Darüber hinaus ergab eine 2011 veröffentlichte randomisierte Kontrollstudie, dass aerobes Training die Größe des Hippocampus bei Erwachsenen im Alter von 55 bis 80 Jahren erhöhen und auch das räumliche Gedächtnis verbessern kann. ⓘ
Stress
Der Hippocampus enthält eine hohe Anzahl von Glukokortikoidrezeptoren, die ihn anfälliger für Langzeitstress machen als die meisten anderen Gehirnbereiche. Es gibt Hinweise darauf, dass Menschen, die schwerem, lang anhaltendem traumatischem Stress ausgesetzt waren, eine Atrophie des Hippocampus aufweisen, die stärker ist als die anderer Teile des Gehirns. Diese Auswirkungen zeigen sich bei posttraumatischen Belastungsstörungen und können zu der bei Schizophrenie und schweren Depressionen beobachteten Hippocampus-Atrophie beitragen. Das anteriore Hippocampusvolumen bei Kindern ist positiv mit dem elterlichen Familieneinkommen korreliert, und es wird angenommen, dass diese Korrelation durch einkommensbezogenen Stress vermittelt wird. In einer neueren Studie wurde auch eine Atrophie als Folge von Depressionen festgestellt, die jedoch mit Antidepressiva gestoppt werden kann, auch wenn diese bei der Linderung anderer Symptome nicht wirksam sind. ⓘ
Chronischer Stress, der zu einem erhöhten Spiegel von Glukokortikoiden, insbesondere von Cortisol, führt, gilt als Ursache für die neuronale Atrophie im Hippocampus. Diese Atrophie führt zu einer Verkleinerung des Hippocampusvolumens, die auch beim Cushing-Syndrom zu beobachten ist. Die höheren Cortisolwerte beim Cushing-Syndrom sind in der Regel auf die Einnahme von Medikamenten zur Behandlung anderer Erkrankungen zurückzuführen. Der Verlust von Neuronen ist auch eine Folge der gestörten Neurogenese. Ein weiterer Faktor, der zu einem geringeren Hippocampus-Volumen beiträgt, ist die dendritische Retraktion, bei der die Dendriten als Reaktion auf die erhöhten Glukokortikoide in ihrer Länge verkürzt und in ihrer Anzahl reduziert werden. Diese dendritische Retraktion ist reversibel. Nach einer Behandlung mit Medikamenten zur Senkung des Cortisolspiegels beim Cushing-Syndrom wird das Volumen des Hippocampus um bis zu 10 % wiederhergestellt. Diese Veränderung ist auf die Neubildung der Dendriten zurückzuführen. Diese Wiederherstellung der Dendriten kann auch erfolgen, wenn der Stress beseitigt wird. Es gibt jedoch Belege dafür, dass Stress, der kurz nach der Geburt auftritt, die Funktion des Hippocampus in einer Weise beeinträchtigen kann, die ein Leben lang anhält. ⓘ
Bei der Ratte wurden auch geschlechtsspezifische Reaktionen auf Stress nachgewiesen, die sich auf den Hippocampus auswirken. Chronischer Stress führte bei männlichen Ratten zu einer dendritischen Retraktion und einem Zellverlust in der CA3-Region, während dies bei weiblichen Ratten nicht der Fall war. Man nimmt an, dass dies auf die neuroprotektiven Eierstockhormone zurückzuführen ist. Bei Ratten nehmen DNA-Schäden im Hippocampus unter Stressbedingungen zu. ⓘ
Epilepsie


Der Hippocampus ist eine der wenigen Hirnregionen, in denen neue Neuronen gebildet werden. Dieser Prozess der Neurogenese ist auf den Gyrus dentatus beschränkt. Die Produktion neuer Nervenzellen kann durch Bewegung positiv oder durch epileptische Anfälle negativ beeinflusst werden. ⓘ
Anfälle bei Temporallappenepilepsie können die normale Entwicklung neuer Neuronen beeinträchtigen und Gewebeschäden verursachen. Die Sklerose des Hippocampus, einschließlich der Ammonshornsklerose, die spezifisch für den mesialen Temporallappen ist, ist die häufigste Art dieser Gewebeschäden. Es ist jedoch noch nicht klar, ob die Epilepsie in der Regel durch Anomalien des Hippocampus verursacht wird oder ob der Hippocampus durch kumulative Auswirkungen von Anfällen geschädigt wird. In Versuchen, bei denen wiederholte Anfälle bei Tieren künstlich ausgelöst werden, kommt es jedoch häufig zu einer Schädigung des Hippocampus. Dies könnte eine Folge der Konzentration von erregbaren Glutamatrezeptoren im Hippocampus sein. Übererregbarkeit kann zu Zytotoxizität und Zelltod führen. Möglicherweise hat es auch damit zu tun, dass der Hippocampus ein Ort ist, an dem während des gesamten Lebens neue Neuronen gebildet werden, und dass es bei diesem Prozess zu Anomalien kommt. ⓘ
Schizophrenie
Die Ursachen der Schizophrenie sind nicht eindeutig geklärt, aber es wurde über zahlreiche Anomalien der Gehirnstruktur berichtet. Die am gründlichsten untersuchten Veränderungen betreffen die Großhirnrinde, aber auch Auswirkungen auf den Hippocampus sind beschrieben worden. In vielen Berichten wurde eine Verkleinerung des Hippocampus bei Menschen mit Schizophrenie festgestellt. Der linke Hippocampus scheint stärker betroffen zu sein als der rechte. Es wird weitgehend angenommen, dass die festgestellten Veränderungen das Ergebnis einer abnormalen Entwicklung sind. Es ist unklar, ob die Veränderungen im Hippocampus bei der Entstehung der psychotischen Symptome, die das wichtigste Merkmal der Schizophrenie sind, eine Rolle spielen. Auf der Grundlage tierexperimenteller Arbeiten wurde die Vermutung geäußert, dass eine Funktionsstörung des Hippocampus zu einer veränderten Dopaminfreisetzung in den Basalganglien führen könnte, wodurch die Informationsintegration im präfrontalen Kortex indirekt beeinträchtigt wird. Es wurde auch vorgeschlagen, dass eine Dysfunktion des Hippocampus für die häufig beobachteten Störungen des Langzeitgedächtnisses verantwortlich sein könnte. ⓘ
In MRT-Studien wurden bei Menschen mit Schizophrenie ein kleineres Gehirnvolumen und größere Ventrikel festgestellt - die Forscher wissen jedoch nicht, ob die Schrumpfung auf die Schizophrenie oder auf die Medikamente zurückzuführen ist. Das Volumen des Hippocampus und des Thalamus ist nachweislich verringert, während das Volumen des Globus pallidus vergrößert ist. Die kortikalen Muster sind verändert, und es wurde eine Verringerung des Volumens und der Dicke des Kortex, insbesondere im Frontal- und Temporallappen, festgestellt. Es wurde ferner vorgeschlagen, dass viele der beobachteten Veränderungen bereits zu Beginn der Erkrankung vorhanden sind, was die Theorie einer abnormalen Neuroentwicklung untermauert. ⓘ
Der Hippocampus wird als zentral für die Pathologie der Schizophrenie angesehen, sowohl was die neuronalen als auch die physiologischen Auswirkungen betrifft. Es ist allgemein anerkannt, dass der Schizophrenie eine abnorme synaptische Konnektivität zugrunde liegt. Viele Studien haben eine Störung der synaptischen Schaltkreise im Hippocampus und deren Auswirkungen auf den präfrontalen Kortex festgestellt. Es hat sich gezeigt, dass die glutamatergen Bahnen weitgehend betroffen sind. Das Unterfeld CA1 scheint von den anderen Unterfeldern am wenigsten betroffen zu sein, und CA4 und das Subiculum wurden an anderer Stelle als die am stärksten betroffenen Bereiche genannt. Der Bericht kommt zu dem Schluss, dass die Pathologie auf genetische Ursachen, eine fehlerhafte Neuroentwicklung oder eine abnorme neuronale Plastizität zurückzuführen sein könnte. Ferner wurde festgestellt, dass Schizophrenie nicht auf eine bekannte neurodegenerative Störung zurückzuführen ist. Oxidative DNA-Schäden sind im Hippocampus älterer Patienten mit chronischer Schizophrenie deutlich erhöht. ⓘ
Vorübergehende globale Amnesie
Die transiente globale Amnesie ist ein dramatischer, plötzlicher, vorübergehender, nahezu vollständiger Verlust des Kurzzeitgedächtnisses. Es wurden verschiedene Ursachen vermutet, darunter Ischämie, Epilepsie, Migräne und eine Störung des zerebralen venösen Blutflusses, die zu einer Ischämie von Strukturen wie dem Hippocampus führt, die am Gedächtnis beteiligt sind. ⓘ
Ein wissenschaftlicher Beweis für eine Ursache liegt nicht vor. Diffusionsgewichtete MRT-Studien, die 12 bis 24 Stunden nach einem Anfall durchgeführt wurden, haben jedoch gezeigt, dass es im Hippocampus kleine punktförmige Läsionen gibt. Diese Ergebnisse deuten darauf hin, dass die CA1-Neuronen durch metabolischen Stress anfällig geworden sind. ⓘ
PTSD
Einige Studien zeigen einen Zusammenhang zwischen einem verringerten Hippocampusvolumen und einer posttraumatischen Belastungsstörung (PTSD). Eine Studie an Vietnamkriegsveteranen mit PTBS zeigte eine Verringerung des Hippocampusvolumens um 20 % im Vergleich zu Veteranen, die keine derartigen Symptome aufwiesen. Dieser Befund konnte bei chronischen PTBS-Patienten, die 1988 bei einem Flugzeugabsturz bei einer Flugshow traumatisiert wurden (Ramstein, Deutschland), nicht wiederholt werden. Auch die Zwillingsbrüder von Vietnamveteranen mit PTBS, die nicht im Krieg waren, hatten einen kleineren Hippocampus als andere Kontrollpersonen, was Fragen über die Art des Zusammenhangs aufwirft. Eine Studie aus dem Jahr 2016 bekräftigte die Theorie, dass ein kleinerer Hippocampus das Risiko für eine posttraumatische Belastungsstörung erhöht, während ein größerer Hippocampus die Wahrscheinlichkeit einer wirksamen Behandlung erhöht. ⓘ
Mikrozephalie
Eine Hippocampus-Atrophie wurde bei Mikrozephalie-Patienten und in Mausmodellen mit WDR62-Mutationen beschrieben, die menschliche Punktmutationen rekapitulieren und eine Beeinträchtigung der Hippocampus-Entwicklung und Neurogenese zeigen. ⓘ
Andere Tiere
Andere Säugetiere
Der Hippocampus hat bei allen Säugetieren ein ähnliches Aussehen, von den Einhufern wie dem Ameisenigel bis hin zu Primaten wie dem Menschen. Das Verhältnis zwischen der Größe des Hippocampus und der Körpergröße nimmt im Allgemeinen zu und ist bei Primaten etwa doppelt so groß wie beim Ameisenigel. Es nimmt jedoch nicht annähernd so schnell zu wie das Verhältnis zwischen Neokortex und Körpergröße. Daher nimmt der Hippocampus bei Nagetieren einen viel größeren Teil des Kortikalismantels ein als bei Primaten. Beim erwachsenen Menschen beträgt das Volumen des Hippocampus auf jeder Seite des Gehirns etwa 3,0 bis 3,5 cm3 im Vergleich zu 320 bis 420 cm3 für das Volumen des Neocortex. ⓘ
Es besteht auch eine allgemeine Beziehung zwischen der Größe des Hippocampus und dem räumlichen Gedächtnis. Vergleicht man ähnliche Spezies miteinander, so haben diejenigen, die eine größere Kapazität für das räumliche Gedächtnis haben, tendenziell auch ein größeres Hippocampusvolumen. Diese Beziehung erstreckt sich auch auf geschlechtsspezifische Unterschiede; bei Arten, bei denen Männchen und Weibchen starke Unterschiede in der Fähigkeit zum räumlichen Gedächtnis aufweisen, sind auch entsprechende Unterschiede im Hippocampusvolumen zu beobachten. ⓘ
Andere Wirbeltiere
Nicht-Säugetierarten haben keine Gehirnstruktur, die dem Hippocampus der Säugetiere ähnelt, aber sie haben eine, die als homolog zu ihm angesehen wird. Der Hippocampus ist, wie bereits erwähnt, im Wesentlichen ein Teil des Allokortex. Nur Säugetiere haben einen voll entwickelten Kortex, aber die Struktur, aus der er sich entwickelt hat, das so genannte Pallium, ist bei allen Wirbeltieren vorhanden, selbst bei den primitivsten wie dem Neunauge oder dem Schleimaal. Das Pallium wird in der Regel in drei Zonen unterteilt: medial, lateral und dorsal. Das mediale Pallium bildet den Vorläufer des Hippocampus. Optisch ähnelt es dem Hippocampus nicht, da die Schichten nicht S-förmig verformt oder vom Gyrus dentatus umschlossen sind, aber die Homologie wird durch starke chemische und funktionelle Ähnlichkeiten deutlich. Es gibt inzwischen Hinweise darauf, dass diese hippocampusähnlichen Strukturen bei Vögeln, Reptilien und Fischen an der räumlichen Wahrnehmung beteiligt sind. ⓘ
Vögel
Bei Vögeln ist die Entsprechung so gut belegt, dass die meisten Anatomen die mediale Pallialzone als "Vogel-Hippocampus" bezeichnen. Zahlreiche Vogelarten verfügen über ein ausgeprägtes räumliches Vorstellungsvermögen, insbesondere diejenigen, die Nahrung als Cache anlegen. Es gibt Hinweise darauf, dass Vögel, die Nahrung verstecken, einen größeren Hippocampus haben als andere Vogelarten und dass eine Schädigung des Hippocampus zu Beeinträchtigungen des räumlichen Gedächtnisses führt. ⓘ
Fische
Bei Fischen ist die Geschichte etwas komplexer. Bei den Teleost-Fischen (die die große Mehrheit der existierenden Arten ausmachen) ist das Vorderhirn im Vergleich zu anderen Wirbeltieren verzerrt: Die meisten Neuroanatomen glauben, dass das Vorderhirn der Teleost-Fische im Wesentlichen umgedreht ist, wie eine Socke, die von innen nach außen gestülpt ist, so dass Strukturen, die bei den meisten Wirbeltieren im Inneren neben den Ventrikeln liegen, bei den Teleost-Fischen außen zu finden sind und umgekehrt. Dies hat unter anderem zur Folge, dass man annimmt, dass das mediale Pallium (Hippocampuszone) eines typischen Wirbeltiers dem lateralen Pallium eines typischen Fisches entspricht. Bei mehreren Fischarten (insbesondere bei Goldfischen) wurde experimentell nachgewiesen, dass sie über ein ausgeprägtes räumliches Gedächtnis verfügen und sogar "kognitive Karten" der von ihnen bewohnten Gebiete erstellen. Es gibt Hinweise darauf, dass eine Schädigung des lateralen Palliums das räumliche Gedächtnis beeinträchtigt. Es ist noch nicht bekannt, ob das mediale Pallium eine ähnliche Rolle bei noch primitiveren Wirbeltieren wie Haien und Rochen oder sogar Neunaugen und Schleimaalen spielt. ⓘ
Insekten und Mollusken
Einige Insektenarten und Weichtiere wie der Oktopus verfügen ebenfalls über ausgeprägte räumliche Lern- und Navigationsfähigkeiten, doch scheinen diese anders zu funktionieren als das räumliche System der Säugetiere, so dass es bisher keinen guten Grund gibt, einen gemeinsamen evolutionären Ursprung anzunehmen; auch die Ähnlichkeit der Gehirnstruktur reicht nicht aus, um bei diesen Arten etwas zu finden, das einem "Hippocampus" ähnelt. Einige haben jedoch vorgeschlagen, dass die Pilzkörper der Insekten eine ähnliche Funktion wie der Hippocampus haben könnten. ⓘ
Zusätzliche Bilder
Hippocampus grün hervorgehoben auf transversalen T1-MRT-Bildern ⓘ
Elektrische Aktivität
Während der Lokomotion und im REM-Schlaf ist die Aktivität im Hippocampus gering. In Wachzuständen ohne Lokomotion und Non-REM-Schlaf gibt es dagegen oft synchrone Aktivität großer Gruppen von Neuronen, die das extrazelluläre elektrische Potential (Feldpotential) im Hippocampus prägt. Charakteristisch sind sägezahnförmige Verläufe (englisch sharp wave) mit Perioden von einigen 100 ms, denen im oder kurz vor dem Maximum der Polarisation kurze Wellenpakete (ripple) überlagert sind. Synonyme Abkürzungen für diese Kombination sind SWR und SPW-R. Die Frequenz der Rippel, 100 bis über 200 Hz, ist von Art zu Art verschieden. Ein Rippel-Ereignis tritt fast immer in CA1 und CA3 und meist in beiden Hemisphären zeitgleich auf, wobei die Rippel selbst nicht synchron sind. ⓘ
Neuropathologische Aspekte
Beim Menschen können verschiedene Erkrankungen zu einer Veränderung des Hippocampus führen. Allen voran können Abbauprozesse bei Demenzerkrankungen diese Hirnstruktur schädigen. Darüber hinaus spielt der Hippocampus eine wichtige Rolle bei der Entstehung von Epilepsieerkrankungen. Die Temporallappenepilepsie ist häufig mit einer mesialen temporalen Sklerose verbunden, die mittels bildgebender Verfahren (Magnetresonanztomographie) diagnostiziert werden kann. Die epilepsiechirurgische einseitige Entfernung der Hippokampusformation stellt eine Möglichkeit zur Behandlung von medikamentös unbeherrschbaren Anfällen dar. Rauschtrinken während der Adoleszenz steht im Verdacht, die Ausbildung des Hippocampus nachhaltig zu beeinträchtigen, was im Erwachsenenalter zu Vergesslichkeit und mangelnder räumlicher Orientierung führen kann. ⓘ
Neurogenese im Hippocampus
Der Gyrus dentatus des Hippocampus ist neben dem Bulbus olfactorius (bzw. der subventrikulären Zone) eine der beiden Strukturen im gesunden Säugetiergehirn, die zeitlebens neue Nervenzellen bilden. Diese Neurogenese von glutamatergen Körnerzellen wurde 1965 von Altman und Das an Ratten entdeckt und widerspricht dem zuvor über Jahrzehnte bestandenen Dogma, die Neuronen des Gehirns wären von der Geburt an vollständig. Trotzdem erregte die hippocampale Neurogenese erst seit den 1990er Jahren wissenschaftliche Aufmerksamkeit, als mithilfe der BrdU-Markierung sich teilender Zellen gezeigt werden konnte, dass Einflüsse wie Stress, Aktivierung des NMDA-Rezeptors, Laufen und reiche Umwelt die Teilungsrate der Zellen und/oder ihre Überlebensrate verändern können. Zahlreiche weitere Studien haben seitdem gezeigt, dass viele Neurotransmitter, Wachstumsfaktoren, Arzneistoffe, Drogen und Umweltfaktoren (darunter auch Lerntraining) die Neurogenese beeinflussen können. Da sich nur ein kleiner Teil der neu gebildeten Zellen zu Neuronen ausdifferenziert, ist es nötig, zwischen den Begriffen Zellproliferation (Mitose von neuronalen Stammzellen) und Neurogenese zu unterscheiden. Über Nagetiere hinaus wurde die Neurogenese im Hippocampus in dieser Zeit auch bei anderen Säugetieren gefunden, darunter 1998 auch beim Menschen. ⓘ
Die Funktion der hippocampalen Neurogenese ist noch unklar. Erst seit 2002 ist es möglich, die Zellproliferation durch starke, fokussierte Röntgenstrahlen zu unterbinden und damit aussagekräftige Experimente durchzuführen. Die Ergebnisse dieser Studien sind jedoch bislang uneinheitlich; so geschädigte Tiere zeigen Defizite (aber keinen vollständigen Ausfall) in einigen, aber nicht allen räumlichen Lernparadigmata. Andererseits wurde bei Jugendlichen, die aufgrund eines Hirntumors mit Röntgenstrahlung behandelt wurden, eine fortschreitende und unheilbare anterograde Amnesie beobachtet. Simulationsstudien mit künstlichen neuronalen Netzen deuten auf unterschiedliche mögliche Funktionen der Neurogenese hin: Stabilisierung des Hippocampus gegen äußere Einflüsse, Vermeidung katastrophaler Interferenz, leichteres Vergessen früher gelernter Muster. Zu beachten ist dabei, dass eine neu entstandene Zelle sich erst im Laufe von etwa vier Wochen zum Neuron differenziert, also lange nach dem Ereignis, welches die Teilung angeregt hatte. Es wurde gezeigt, dass neue Neuronen in der Zeitspanne von vier bis 28 Tagen nach Teilung die Lernfähigkeit beeinflussen. ⓘ



