Acetylcholin
 | |
| Klinische Daten | |
|---|---|
| Andere Namen | ACh |
| Physiologische Daten | |
| Ausgangstextilien | Motoneuronen, parasympathisches Nervensystem, Gehirn |
| Ziel-Gewebe | Skelettmuskeln, Gehirn, viele andere Organe |
| Rezeptoren | nikotinisch, muskarinisch |
| Agonisten | Nikotin, Muscarin, Cholinesterase-Hemmer |
| Antagonisten | Tubocurarin, Atropin |
| Vorläufer | Cholin, Acetyl-CoA |
| Biosynthese | Cholin-Acetyltransferase |
| Stoffwechsel | Acetylcholinesterase |
| Bezeichner | |
IUPAC-Bezeichnung
| |
| CAS-Nummer | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Chemische und physikalische Daten | |
| Formel | C7H16NO2 |
| Molekulare Masse | 146,210 g-mol-1 |
Acetylcholin (ACh) ist eine organische Chemikalie, die im Gehirn und im Körper vieler Tierarten (einschließlich des Menschen) als Neurotransmitter fungiert. Sein Name leitet sich von seiner chemischen Struktur ab: Es ist ein Ester aus Essigsäure und Cholin. Teile des Körpers, die Acetylcholin verwenden oder von ihm beeinflusst werden, werden als cholinergisch bezeichnet. Substanzen, die die Gesamtaktivität des cholinergen Systems erhöhen oder verringern, werden als Cholinergika bzw. Anticholinergika bezeichnet. ⓘ
Acetylcholin ist der Neurotransmitter, der an der neuromuskulären Verbindung verwendet wird - mit anderen Worten, es ist die Chemikalie, die die Motoneuronen des Nervensystems freisetzen, um die Muskeln zu aktivieren. Diese Eigenschaft bedeutet, dass Medikamente, die das cholinerge System beeinträchtigen, sehr gefährliche Auswirkungen haben können, die von Lähmungen bis zu Krämpfen reichen. Acetylcholin ist auch ein Neurotransmitter im autonomen Nervensystem, sowohl als interner Transmitter für das sympathische Nervensystem als auch als Endprodukt, das vom parasympathischen Nervensystem freigesetzt wird. Acetylcholin ist der primäre Neurotransmitter des parasympathischen Nervensystems. ⓘ
Im Gehirn fungiert Acetylcholin als Neurotransmitter und als Neuromodulator. Im Gehirn gibt es eine Reihe von cholinergen Bereichen, die jeweils unterschiedliche Funktionen haben; sie spielen beispielsweise eine wichtige Rolle bei Erregung, Aufmerksamkeit, Gedächtnis und Motivation. ⓘ
Acetylcholin ist auch in Zellen nicht-neuralen Ursprungs und in Mikroben nachgewiesen worden. Kürzlich wurden Enzyme, die mit seiner Synthese, seinem Abbau und seiner zellulären Aufnahme zusammenhängen, bis zu den frühen Ursprüngen der einzelligen Eukaryoten zurückverfolgt. Der Protisten-Erreger Acanthamoeba spp. hat das Vorhandensein von ACh nachgewiesen, das über ein membranständiges M1-Muscarinrezeptor-Homolog Wachstums- und Proliferations-Signale liefert. ⓘ
Zum Teil wegen seiner muskelaktivierenden Funktion, aber auch wegen seiner Funktionen im autonomen Nervensystem und im Gehirn, üben viele wichtige Medikamente ihre Wirkung über eine Veränderung der cholinergen Übertragung aus. Zahlreiche Gifte und Toxine, die von Pflanzen, Tieren und Bakterien produziert werden, sowie chemische Nervenkampfstoffe wie Sarin verursachen Schäden, indem sie durch ihren Einfluss auf die neuromuskuläre Verbindung die Muskeln inaktivieren oder hyperaktivieren. Medikamente, die auf muskarinische Acetylcholinrezeptoren wirken, wie z. B. Atropin, können in großen Mengen giftig sein, aber in kleineren Dosen werden sie häufig zur Behandlung bestimmter Herzerkrankungen und Augenprobleme eingesetzt. Scopolamin, das hauptsächlich auf muskarinische Rezeptoren im Gehirn wirkt, kann Delirium, Halluzinationen und Amnesie verursachen. Die süchtig machenden Eigenschaften von Nikotin beruhen auf seiner Wirkung auf nikotinische Acetylcholinrezeptoren im Gehirn. ⓘ
| Strukturformel ⓘ | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Gegenion (meist Chlorid) nicht mitgezeichnet | ||||||||||
| Allgemeines | ||||||||||
| Freiname | Acetylcholin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C7H16NO2 | |||||||||
| Kurzbeschreibung |
weißes, kristallines Pulver oder farblose Kristalle, sehr hygroskopisch (Chlorid) | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code |
S01EB09 | |||||||||
| Wirkstoffklasse | ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | ||||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt |
149–152 °C (Chlorid) | |||||||||
| Löslichkeit |
sehr leicht löslich in Wasser, leicht löslich in Ethanol, schwer löslich in Dichlormethan (Chlorid) | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten |
2500 mg·kg−1 (LD50, Ratte, oral, Chlorid) | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Acetylcholin (ACh) ist einer der wichtigsten Neurotransmitter in vielen Organismen, so auch im Menschen. Die quartäre Ammoniumverbindung Acetylcholin ist ein Ester der Essigsäure und des einwertigen Aminoalkohols Cholin. ⓘ
Chemie
Acetylcholin ist ein Cholinmolekül, das am Sauerstoffatom acetyliert wurde. Aufgrund der geladenen Ammoniumgruppe durchdringt Acetylcholin keine Lipidmembranen. Wird das Molekül von außen zugeführt, verbleibt es daher im Extrazellulärraum und passiert nicht die Blut-Hirn-Schranke. ⓘ
Biosynthese und Metabolismus
Acetylcholin wird in bestimmten Neuronen durch das Enzym Cholin-Acetyltransferase aus den Verbindungen Cholin und Acetyl-CoA synthetisiert. Cholinerge Neuronen sind in der Lage, ACh zu produzieren. Ein Beispiel für einen zentralen cholinergen Bereich ist der Nucleus basalis von Meynert im basalen Vorderhirn. Das Enzym Acetylcholinesterase wandelt Acetylcholin in die inaktiven Metaboliten Cholin und Acetat um. Dieses Enzym ist im synaptischen Spalt reichlich vorhanden, und seine Rolle bei der raschen Beseitigung von freiem Acetylcholin aus der Synapse ist für eine ordnungsgemäße Muskelfunktion unerlässlich. Bestimmte Neurotoxine hemmen die Acetylcholinesterase und führen so zu einem Überschuss an Acetylcholin an der neuromuskulären Verbindung, was zu einer Lähmung der Muskeln führt, die für die Atmung benötigt werden, und den Herzschlag stoppt. ⓘ

Acetylcholin wird durch das Enzym Cholinacetyltransferase aus Acetyl-CoA und Cholin gebildet. ⓘ
Das fertige ACh wird aus dem Cytosol, über einen Protonen/Acetylcholin-Antiporter in der Vesikelmembran, in die neurosekretorischen Speichervesikel aufgenommen. In jedem Vesikel sind 5.000 bis 10.000 Acetylcholinmoleküle enthalten. Pro Synapse gibt es etwa eine Million Speichervesikel. ⓘ
Bereitstellung der Ausgangsmoleküle für die Acetylcholinbildung
Cholin kann aus dem synaptischen Spalt über einen Natrium-Cholin-Symporter wieder in die Synapse aufgenommen werden und ist ein Abbauprodukt des zuletzt ausgeschütteten Acetylcholins. Die Verfügbarkeit und Wiederaufnahme von Cholin stellt dabei den geschwindigkeitslimitierenden Schritt für die ACh-Synthese dar, weil es von der Nervenzelle nicht selbst gebildet werden kann. ⓘ
Pyruvat ist das Endprodukt der Glykolyse im Cytosol jeder Zelle. Das Enzym Pyruvat-Dehydrogenase katalysiert die Umsetzung von Pyruvat zu Acetyl-Coenzym A. Da Acetyl-CoA die innere Mitochondrienmembran nicht passieren kann, wird es in den Citratzyklus eingespeist und durch Reaktion mit Oxalacetat (Katalyse durch Citrat-Synthase) in Citrat umgewandelt. Das Citrat durchquert die Mitochondrienmembran und wird durch die Citrat-Lyase wieder in Acetyl-CoA und Oxalacetat gespalten. Acetyl-CoA steht somit für die Acetylcholinbildung zur Verfügung. ⓘ
Funktionen

Acetylcholin wirkt sowohl im zentralen Nervensystem (ZNS) als auch im peripheren Nervensystem (PNS). Im ZNS unterstützen cholinerge Projektionen aus dem basalen Vorderhirn zur Großhirnrinde und zum Hippocampus die kognitiven Funktionen dieser Zielgebiete. Im PNS aktiviert Acetylcholin die Muskeln und ist ein wichtiger Neurotransmitter im autonomen Nervensystem. ⓘ
Zelluläre Wirkungen

Wie viele andere biologisch aktive Substanzen entfaltet Acetylcholin seine Wirkung durch Bindung an und Aktivierung von Rezeptoren, die sich auf der Zelloberfläche befinden. Es gibt zwei Hauptklassen von Acetylcholinrezeptoren: nikotinische und muskarinische. Sie sind nach Chemikalien benannt, die selektiv jeden Rezeptortyp aktivieren können, ohne den anderen zu aktivieren: Muscarin ist eine Verbindung, die in dem Pilz Amanita muscaria vorkommt; Nikotin ist in Tabak enthalten. ⓘ
Nikotin-Acetylcholin-Rezeptoren sind ligandengesteuerte Ionenkanäle, die für Natrium-, Kalium- und Kalzium-Ionen durchlässig sind. Mit anderen Worten, es handelt sich um in Zellmembranen eingebettete Ionenkanäle, die von einem geschlossenen in einen offenen Zustand übergehen können, wenn Acetylcholin an sie bindet; im offenen Zustand lassen sie Ionen passieren. Es gibt zwei Haupttypen von Nikotinrezeptoren, den Muskeltyp und den neuronalen Typ. Der Muskeltyp kann selektiv durch Curare blockiert werden, der neuronale Typ durch Hexamethonium. Die Rezeptoren des Muskeltyps befinden sich hauptsächlich auf den Muskelzellen, wie im Folgenden näher beschrieben. Neuronale Rezeptoren befinden sich in den autonomen Ganglien (sowohl im Sympathikus als auch im Parasympathikus) und im zentralen Nervensystem. ⓘ
Muskarinische Acetylcholinrezeptoren haben einen komplexeren Mechanismus und wirken über einen längeren Zeitraum auf die Zielzellen. Bei Säugetieren wurden fünf Subtypen von Muscarinrezeptoren identifiziert, die als M1 bis M5 bezeichnet werden. Alle funktionieren als G-Protein-gekoppelte Rezeptoren, was bedeutet, dass sie ihre Wirkung über ein Second-Messenger-System ausüben. Die Subtypen M1, M3 und M5 sind Gq-gekoppelt; sie erhöhen den intrazellulären IP3- und Kalziumspiegel durch Aktivierung der Phospholipase C. Ihre Wirkung auf die Zielzellen ist normalerweise erregend. Die Subtypen M2 und M4 sind Gi/Go-gekoppelt; sie senken den intrazellulären cAMP-Spiegel durch Hemmung der Adenylatcyclase. Ihre Wirkung auf die Zielzellen ist in der Regel hemmend. Muscarinische Acetylcholinrezeptoren finden sich sowohl im zentralen Nervensystem als auch im peripheren Nervensystem des Herzens, der Lunge, des oberen Magen-Darm-Trakts und der Schweißdrüsen. ⓘ
Neuromuskuläre Kreuzung
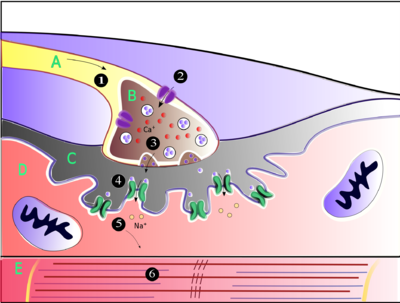
Acetylcholin ist die Substanz, die das Nervensystem verwendet, um die Skelettmuskeln, eine Art quergestreifter Muskeln, zu aktivieren. Dies sind die Muskeln, die für alle Arten von willkürlichen Bewegungen verwendet werden, im Gegensatz zum glatten Muskelgewebe, das an einer Reihe von unwillkürlichen Aktivitäten beteiligt ist, wie z. B. der Bewegung von Nahrung durch den Magen-Darm-Trakt und der Verengung von Blutgefäßen. Die Skelettmuskeln werden direkt von Motoneuronen gesteuert, die sich im Rückenmark oder in einigen wenigen Fällen im Hirnstamm befinden. Diese motorischen Neuronen senden ihre Axone durch motorische Nerven, aus denen sie austreten, um sich mit den Muskelfasern an einer speziellen Art von Synapse, der neuromuskulären Verbindung, zu verbinden. ⓘ
Wenn ein Motoneuron ein Aktionspotenzial erzeugt, wandert es schnell entlang des Nervs, bis es die neuromuskuläre Verbindung erreicht, wo es einen elektrochemischen Prozess auslöst, der die Freisetzung von Acetylcholin in den Raum zwischen dem präsynaptischen Terminal und der Muskelfaser bewirkt. Die Acetylcholinmoleküle binden dann an nikotinische Ionenkanalrezeptoren auf der Muskelzellmembran, wodurch die Ionenkanäle geöffnet werden. Daraufhin strömen Natriumionen in die Muskelzelle und setzen eine Reihe von Schritten in Gang, die schließlich zur Muskelkontraktion führen. ⓘ
Faktoren, die die Freisetzung von Acetylcholin vermindern (und damit die Kalziumkanäle vom P-Typ beeinträchtigen):
- Antibiotika (Clindamycin, Polymyxin)
- Magnesium: antagonisiert Kalziumkanäle vom P-Typ
- Hypokalzämie
- Antikonvulsiva
- Diuretika (Furosemid)
- Eaton-Lambert-Syndrom: hemmt Kalziumkanäle vom P-Typ
- Myasthenie gravis
- Botulinumtoxin: hemmt SNARE-Proteine ⓘ
Kalziumkanalblocker (Nifedipin, Diltiazem) haben keinen Einfluss auf P-Kanäle. Diese Medikamente wirken auf Kalziumkanäle vom L-Typ. ⓘ
Autonomes Nervensystem
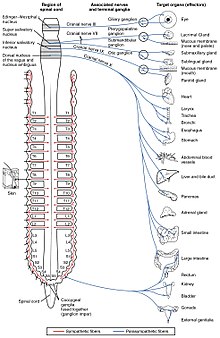
Das autonome Nervensystem steuert eine Vielzahl von unwillkürlichen und unbewussten Körperfunktionen. Seine Hauptzweige sind der Sympathikus und der Parasympathikus. Allgemein gesagt besteht die Funktion des Sympathikus darin, den Körper für Aktionen zu mobilisieren; der häufig verwendete Ausdruck dafür ist Kampf oder Flucht. Die Funktion des parasympathischen Nervensystems besteht darin, den Körper in einen Zustand zu versetzen, der Ruhe, Regeneration, Verdauung und Fortpflanzung begünstigt; man spricht oft von "Ruhe und Verdauung" oder "Ernährung und Fortpflanzung". Beide oben genannten Systeme nutzen Acetylcholin, allerdings auf unterschiedliche Weise. ⓘ
Schematisch betrachtet sind der Sympathikus und der Parasympathikus im Wesentlichen gleich aufgebaut: Präganglionäre Neuronen im Zentralnervensystem senden Projektionen an Neuronen in den autonomen Ganglien, die wiederum Ausgangsprojektionen an praktisch alle Gewebe des Körpers senden. In beiden Zweigen verwenden die internen Verbindungen, die Projektionen vom Zentralnervensystem zu den autonomen Ganglien, Acetylcholin als Neurotransmitter, um die Ganglienneuronen zu innervieren (oder zu erregen). Im parasympathischen Nervensystem setzen die Ausgangsverbindungen, die Projektionen von Ganglionneuronen zu Geweben, die nicht zum Nervensystem gehören, ebenfalls Acetylcholin frei, wirken aber auf Muscarinrezeptoren. Im sympathischen Nervensystem setzen die Ausgangsverbindungen hauptsächlich Noradrenalin frei, obwohl Acetylcholin an einigen Stellen freigesetzt wird, z. B. bei der sudomotorischen Innervation der Schweißdrüsen. ⓘ
Direkte vaskuläre Wirkungen
Acetylcholin im Serum übt eine direkte Wirkung auf den Gefäßtonus aus, indem es an Muscarinrezeptoren auf dem Gefäßendothel bindet. Diese Zellen reagieren mit einer erhöhten Produktion von Stickstoffmonoxid, das der umgebenden glatten Muskulatur signalisiert, sich zu entspannen, was zu einer Gefäßerweiterung führt. ⓘ
Zentrales Nervensystem
Im zentralen Nervensystem hat ACh eine Vielzahl von Auswirkungen auf Plastizität, Erregung und Belohnung. ACh spielt eine wichtige Rolle bei der Steigerung der Wachheit nach dem Aufwachen, bei der Aufrechterhaltung der Aufmerksamkeit und beim Lernen und Gedächtnis. ⓘ
Es ist erwiesen, dass eine Schädigung des cholinergen (Acetylcholin produzierenden) Systems im Gehirn mit den Gedächtnisdefiziten im Zusammenhang mit der Alzheimer-Krankheit in Verbindung steht. ACh fördert nachweislich auch den REM-Schlaf. ⓘ
Im Hirnstamm stammt Acetylcholin aus dem Nucleus pedunculopontinus und dem Nucleus laterodorsalis tegmentalis, die zusammen als mesopontiner Tegmentum-Bereich oder pontomesencephalotegmentaler Komplex bekannt sind. Im basalen Vorderhirn entspringt er dem Nucleus basalis Meynert und dem Nucleus septalis medialis:
- Der pontomesencephalotegmentale Komplex wirkt hauptsächlich auf M1-Rezeptoren im Hirnstamm, in den tiefen Kleinhirnkernen, in den pontinen Kernen, im Locus coeruleus, im Nucleus raphe, im Nucleus reticularis lateralis und in der inferioren Olive. Er projiziert auch in den Thalamus, das Tectum, die Basalganglien und das basale Vorderhirn.
- Der Nucleus basalis von Meynert wirkt hauptsächlich auf M1-Rezeptoren im Neokortex.
- Der Nucleus septalis medialis wirkt vor allem auf M1-Rezeptoren im Hippocampus und in Teilen der Großhirnrinde. ⓘ
Darüber hinaus wirkt ACh als wichtiger interner Transmitter im Striatum, das zu den Basalganglien gehört. Es wird von cholinergen Interneuronen freigesetzt. Beim Menschen, bei nicht-menschlichen Primaten und bei Nagetieren reagieren diese Interneuronen auf auffällige Umweltreize mit Reaktionen, die zeitlich mit den Reaktionen der dopaminergen Neuronen der Substantia nigra abgestimmt sind. ⓘ
Gedächtnis
Acetylcholin wurde auf verschiedene Weise mit Lernen und Gedächtnis in Verbindung gebracht. Das Anticholinergikum Scopolamin beeinträchtigt die Aufnahme neuer Informationen bei Mensch und Tier. Bei Tieren beeinträchtigt die Unterbrechung der Acetylcholinzufuhr zum Neokortex das Erlernen einfacher Unterscheidungsaufgaben, vergleichbar mit dem Erwerb von Sachinformationen, und die Unterbrechung der Acetylcholinzufuhr zum Hippocampus und den angrenzenden kortikalen Bereichen führt zu Vergesslichkeit, vergleichbar mit der anterograden Amnesie beim Menschen. ⓘ
Krankheiten und Störungen
Myasthenie gravis
Bei der Alzheimerschen Krankheit entsteht durch Absterben von hauptsächlich Acetylcholin produzierenden Nervenzellen ein Mangel an Acetylcholin. Diesen Mangel versucht man medikamentös auszugleichen, indem man mit Acetylcholinesterasehemmern dieses Acetylcholin abbauende Enzym hemmt, um dadurch die Acetylcholin-Konzentration an den Synapsen zu erhöhen. Einen anderen Weg geht man über die Verabreichung von Präkursor-Proteinen wie z. B. Deanol und Meclophenoxat, um so den Aufmerksamkeitsgrad zu erhöhen. ⓘ
Die vermehrte Ansammlung von Acetylcholin durch einen reduzierten Abbau der Substanz verursacht eine cholinerge Krise. ⓘ
Bei der Muskelschwäche Myasthenia gravis, einer schweren Autoimmunkrankheit, werden Antikörper produziert, welche die Acetylcholinrezeptoren in Muskelzellen zerstören und damit die Muskeltätigkeit schwächen. Das kann so weit gehen, dass die Patienten die Augen nicht mehr offen halten können. ⓘ
Die Krankheit Myasthenia gravis, die durch Muskelschwäche und Müdigkeit gekennzeichnet ist, tritt auf, wenn der Körper in unangemessener Weise Antikörper gegen Acetylcholin-Nikotin-Rezeptoren produziert und so die ordnungsgemäße Acetylcholin-Signalübertragung hemmt. Mit der Zeit wird die motorische Endplatte zerstört. Medikamente, die die Acetylcholinesterase kompetitiv hemmen (z. B. Neostigmin, Physostigmin oder vor allem Pyridostigmin), sind bei der Behandlung der Symptome dieser Störung wirksam. Sie geben dem endogen freigesetzten Acetylcholin mehr Zeit, mit seinem jeweiligen Rezeptor zu interagieren, bevor es von der Acetylcholinesterase im synaptischen Spalt (dem Raum zwischen Nerv und Muskel) inaktiviert wird. ⓘ
Pharmakologie
Die Blockierung, Verhinderung oder Nachahmung der Wirkung von Acetylcholin wird in der Medizin vielfältig eingesetzt. Medikamente, die auf das Acetylcholin-System wirken, sind entweder Agonisten an den Rezeptoren, die das System stimulieren, oder Antagonisten, die es hemmen. Acetylcholinrezeptor-Agonisten und -Antagonisten können entweder direkt auf die Rezeptoren einwirken oder ihre Wirkung indirekt entfalten, z. B. durch Beeinflussung des Enzyms Acetylcholinesterase, das den Rezeptor-Liganden abbaut. Agonisten erhöhen den Grad der Rezeptoraktivierung, Antagonisten verringern ihn. ⓘ
Acetylcholin selbst hat als intravenös zu verabreichendes Medikament keinen therapeutischen Wert, da es vielseitig wirkt (nicht selektiv) und schnell durch Cholinesterase inaktiviert wird. Es wird jedoch in Form von Augentropfen verwendet, um bei Kataraktoperationen eine Verengung der Pupille zu bewirken, was eine rasche Erholung nach der Operation erleichtert. ⓘ
Nikotinrezeptoren
Nikotin bindet an nikotinische Acetylcholinrezeptoren und aktiviert sie, wodurch es die Wirkung von Acetylcholin an diesen Rezeptoren nachahmt. ACh öffnet nach der Bindung einen Na+-Kanal, so dass Na+ in die Zelle fließt. Dies führt zu einer Depolarisation und damit zu einem erregenden postsynaptischen Potenzial. ACh wirkt also erregend auf den Skelettmuskel; die elektrische Reaktion ist schnell und kurzlebig. Curare sind Pfeilgifte, die an Nikotinrezeptoren wirken und zur Entwicklung klinisch nützlicher Therapien verwendet wurden. ⓘ
Muscarinrezeptoren
Muscarinrezeptoren bilden G-Protein-gekoppelte Rezeptorkomplexe in den Zellmembranen von Neuronen und anderen Zellen. Atropin ist ein nicht-selektiver kompetitiver Antagonist zu Acetylcholin an Muscarinrezeptoren. ⓘ
Cholinesterase-Hemmer
Viele ACh-Rezeptor-Agonisten wirken indirekt durch Hemmung des Enzyms Acetylcholinesterase. Die daraus resultierende Anhäufung von Acetylcholin führt zu einer kontinuierlichen Stimulierung der Muskeln, Drüsen und des zentralen Nervensystems, was bei hohen Dosen zu tödlichen Krämpfen führen kann. ⓘ
Sie sind Beispiele für Enzyminhibitoren und verstärken die Wirkung von Acetylcholin, indem sie dessen Abbau verzögern; einige wurden als Nervenkampfstoffe (Sarin und VX-Nervengas) oder Pestizide (Organophosphate und Carbamate) eingesetzt. Viele von Pflanzen und Tieren produzierte Toxine und Gifte enthalten ebenfalls Cholinesterasehemmer. In der klinischen Anwendung werden sie in niedrigen Dosen verabreicht, um die Wirkung von Muskelrelaxantien umzukehren, Myasthenia gravis zu behandeln und Symptome der Alzheimer-Krankheit (Rivastigmin, das die cholinerge Aktivität im Gehirn erhöht) zu behandeln. ⓘ
Synthesehemmer
Organische Quecksilberverbindungen wie Methylquecksilber haben eine hohe Affinität zu Sulfhydrylgruppen, was zu einer Funktionsstörung des Enzyms Cholin-Acetyltransferase führt. Diese Hemmung kann zu einem Mangel an Acetylcholin führen, der sich auf die motorischen Funktionen auswirken kann. ⓘ
Hemmende Substanzen
Botulinumtoxin (Botox) wirkt, indem es die Freisetzung von Acetylcholin unterdrückt, während das Gift der Schwarzen Witwe (Alpha-Latrotoxin) die umgekehrte Wirkung hat. Die ACh-Hemmung führt zu Lähmungen. Wenn man von einer Schwarzen Witwe gebissen wird, wird der ACh-Vorrat aufgebraucht und die Muskeln beginnen zu kontrahieren. Wenn der Vorrat erschöpft ist, kommt es zu Lähmungen. ⓘ
Vergleichende Biologie und Evolution
Acetylcholin wird von Organismen in allen Lebensbereichen für eine Vielzahl von Zwecken verwendet. Man geht davon aus, dass Cholin, ein Vorläufer von Acetylcholin, von Einzellern schon vor Milliarden von Jahren für die Synthese von Zellmembranphospholipiden verwendet wurde. Nach der Entwicklung von Cholintransportern ebnete die Fülle an intrazellulärem Cholin den Weg für die Aufnahme von Cholin in andere Synthesewege, einschließlich der Acetylcholinproduktion. Acetylcholin wird von Bakterien, Pilzen und einer Vielzahl anderer Tiere verwendet. Viele der Verwendungen von Acetylcholin beruhen auf seiner Wirkung auf Ionenkanäle über GPCRs wie Membranproteine. ⓘ
Die beiden Haupttypen von Acetylcholinrezeptoren, die muskarinischen und die nikotinischen Rezeptoren, haben sich konvergent entwickelt, um auf Acetylcholin zu reagieren. Das bedeutet, dass sich diese Rezeptoren nicht aus einem gemeinsamen Homologen entwickelt haben, sondern aus verschiedenen Rezeptorfamilien. Es wird geschätzt, dass die Familie der Nikotinrezeptoren mehr als 2,5 Milliarden Jahre alt ist. Ebenso geht man davon aus, dass sich die Muscarinrezeptoren vor mindestens 0,5 Milliarden Jahren von anderen GPCRs abgespalten haben. Bei beiden Rezeptorgruppen haben sich zahlreiche Subtypen mit einzigartigen Ligandenaffinitäten und Signalmechanismen entwickelt. Die Vielfalt der Rezeptortypen ermöglicht es Acetylcholin, unterschiedliche Reaktionen hervorzurufen, je nachdem, welche Rezeptortypen aktiviert werden, und ermöglicht es Acetylcholin, physiologische Prozesse dynamisch zu regulieren. ACh-Rezeptoren sind sowohl in der Sequenz als auch in der Struktur mit 5-HT3- (Serotonin-), GABA- und Glycin-Rezeptoren verwandt, was stark darauf hindeutet, dass sie einen gemeinsamen evolutionären Ursprung haben. ⓘ
Geschichte
Im Jahr 1867 löste Adolf von Baeyer die Strukturen von Cholin und Acetylcholin auf und synthetisierte beide, wobei er letzteres in seiner Studie als "Acetylneurin" bezeichnete. Cholin ist eine Vorstufe von Acetylcholin. Aus diesem Grund stellten Frederick Walker Mott und William Dobinson Halliburton 1899 fest, dass Cholininjektionen den Blutdruck von Tieren senken. Acetylcholin wurde erstmals 1906 als biologisch aktiv erkannt, als Reid Hunt (1870-1948) und René de M. Taveau feststellten, dass es den Blutdruck in außergewöhnlich geringen Dosen senkte. ⓘ
1914 war Arthur J. Ewins der erste, der Acetylcholin aus der Natur extrahierte. Er identifizierte es auf Anfrage von Henry Hallett Dale als blutdrucksenkende Verunreinigung einiger Mutterkorn-Extrakte aus Claviceps purpurea. Später, im Jahr 1914, beschrieb Dale die Wirkungen von Acetylcholin an verschiedenen Arten von peripheren Synapsen und stellte fest, dass Acetylcholin den Blutdruck von Katzen durch subkutane Injektionen sogar in Dosen von einem Nanogramm senkte. ⓘ
Das Konzept der Neurotransmitter war bis 1921 unbekannt, als Otto Loewi während seiner Tätigkeit als Professor an der Universität Graz feststellte, dass der Vagusnerv eine Substanz absondert, die den Herzmuskel hemmt. Er nannte ihn Vagusstoff, stellte fest, dass es sich um ein strukturelles Analogon von Cholin handelte und vermutete, dass es sich um Acetylcholin handelte. Im Jahr 1926 folgerten Loewi und E. Navratil, dass es sich bei der Verbindung wahrscheinlich um Acetylcholin handelt, da Vagusstoff und synthetisches Acetylcholin ihre Aktivität in ähnlicher Weise verloren, wenn sie mit Gewebelysaten in Berührung kamen, die Acetylcholin abbauende Enzyme enthielten (heute als Cholinesterasen bekannt). Diese Schlussfolgerung wurde allgemein akzeptiert. Spätere Studien bestätigten die Funktion von Acetylcholin als Neurotransmitter. ⓘ
1936 erhielten H. H. Dale und O. Loewi gemeinsam den Nobelpreis für Physiologie oder Medizin für ihre Studien über Acetylcholin und Nervenimpulse. ⓘ
Erstmals synthetisch dargestellt wurde der Stoff 1867 von Adolf Baeyer, mit dessen Substanz der Amerikaner Reid Hunt (1870–1948) im Tierversuch Muskelkontraktionen auslösen konnte. ⓘ
Siehe auch
- Ann Silber
- Acetylcholinesterase
- Neuromuskuläre Kreuzung
- Nicotinischer Acetylcholin-Rezeptor
- Muscarinischer Acetylcholinrezeptor ⓘ
Allgemeine Bibliographie
- Brenner GM, Stevens CW (2006). Pharmacology (2nd ed.). Philadelphia PA: W. B. Saunders. ISBN 1-4160-2984-2.
- Kanadischer Apothekerverband (2000). Kompendium der Arzneimittel und Spezialitäten (25. Aufl.). Toronto ON: Webcom. ISBN 0-919115-76-4.
- Carlson NR (2001). Physiologie des Verhaltens (7. Aufl.). Needham Heights MA: Allyn and Bacon. ISBN 0-205-30840-6.
- Gershon MD (1998). Das zweite Gehirn. New York NY: HarperCollins. ISBN 0-06-018252-0.
- Siegal A, Sapru HN (2006). "Ch. 15". Essential Neuroscience (Revised 1st ed.). Philadelphia: Lippincott, Williams & Wilkins. pp. 255-267.
- Hasselmo ME (Februar 1995). "Neuromodulation und kortikale Funktion: Modellierung der physiologischen Grundlage des Verhaltens". Behav. Brain Res. 67 (1): 1–27. doi:10.1016/0166-4328(94)00113-T. PMID 7748496. S2CID 17594590. als PDF
- Yu AJ, Dayan P (Mai 2005). "Ungewissheit, Neuromodulation und Aufmerksamkeit". Neuron. 46 (4): 681–92. doi:10.1016/j.neuron.2005.04.026. PMID 15944135. S2CID 15980355. als PDF ⓘ
Acetylcholin in Tier- und Pflanzengiften
Der Anteil an Acetylcholin beträgt im Gift der Hornisse (Vespa crabro) etwa sechs Prozent des Trockengewichts und liegt damit in der höchsten Konzentration vor, die bisher bei einem Lebewesen gefunden wurde. Der Stich der Hornisse wird aufgrund dieser hohen Konzentration als besonders schmerzhaft empfunden. Dabei ist der Stich nicht giftiger als bei anderen Wespen oder bei Bienen (Bienengift), deren Gift jedoch kein Acetylcholin enthält. Auch im Gift der Brennnesseln sowie der Feuerfische und anderer Skorpionfische ist Acetylcholin für die schmerzhafte Wirkung verantwortlich. ⓘ
Verwendung
In der Augenheilkunde wird Acetylcholin zur Verengung und Reposition der präoperativ erweiterten Pupille nach Extraktion der Linse bei Kataraktoperationen, Iridektomie, perforierender Keratoplastik und anderen Eingriffen am vorderen Augenabschnitt verwendet, wenn hierfür eine sehr schnelle und komplette Miosis notwendig ist. ⓘ
Acetylcholin darf laut EG-Kosmetikrichtlinie nicht als Bestandteil in kosmetischen Mitteln enthalten sein. ⓘ