Katecholamine
| Katecholamine ⓘ |
|---|
 Epinephrin (Adrenalin) |
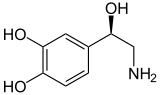 Noradrenalin (Norepinephrin) |
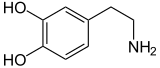 Dopamin |

Ein Katecholamin (/ˌkætəˈkoʊləmiːn/; abgekürzt CA) ist ein Monoamin-Neurotransmitter, eine organische Verbindung, die ein Katechol (Benzol mit zwei nebeneinander liegenden Hydroxyl-Seitengruppen) und eine Amin-Seitenkette aufweist. ⓘ
Catechol kann entweder ein freies Molekül oder ein Substituent eines größeren Moleküls sein, wobei es eine 1,2-Dihydroxybenzolgruppe darstellt. ⓘ
Catecholamine leiten sich von der Aminosäure Tyrosin ab, die sowohl aus Nahrungsmitteln als auch durch Synthese aus Phenylalanin gewonnen wird. Katecholamine sind wasserlöslich und werden im Blutkreislauf zu 50 % an Plasmaproteine gebunden. ⓘ
Zu den Katecholaminen gehören Epinephrin (Adrenalin), Norepinephrin (Noradrenalin) und Dopamin. Die Freisetzung der Hormone Epinephrin und Norepinephrin aus dem Nebennierenmark der Nebennieren ist Teil der Kampf-oder-Flucht-Reaktion. ⓘ
Tyrosin wird aus Phenylalanin durch Hydroxylierung durch das Enzym Phenylalanin-Hydroxylase gebildet. Tyrosin wird auch direkt aus Nahrungsprotein aufgenommen. Katecholamin-produzierende Zellen wandeln Tyrosin durch mehrere Reaktionen seriell in L-DOPA und dann in Dopamin um. Je nach Zelltyp kann Dopamin weiter zu Noradrenalin oder sogar weiter zu Adrenalin umgewandelt werden. ⓘ
Verschiedene Stimulanzien (z. B. eine Reihe substituierter Amphetamine) sind Analoga von Katecholaminen. ⓘ
Katecholamine (auch Catecholamine oder Brenzcatechinamine) sind eine biologisch und medizinisch wichtige Gruppe chemischer Stoffe, die das Dopamin und seine Derivate umfasst. Die Bezeichnung ist ein Trivialname und leitet sich von dem diesen Stoffen gemeinsamen Molekülbestandteil Brenzcatechin (1,2-Dihydroxybenzol, englische Bezeichnung ist Catechol (Kurzform von Pyrocatechol), nach IUPAC wird es auch 1,2-Dihydroxybenzen oder Benzen-1,2-diol genannt) und der ihnen gemeinsamen Aminogruppe ab. Katecholamine kommen in der Natur vor, werden aber auch künstlich hergestellt. Die wichtigsten natürlichen Katecholamine sind Dopamin, Noradrenalin und Adrenalin. Sie treten als Überträger von Nervenimpulsen (Neurotransmitter) im Zentralnervensystem und vegetativen Nervensystem auf und wirken unter anderem bei der Kampf-oder-Flucht-Reaktion des Körpers mit. Noradrenalin und Adrenalin sind zusätzlich Hormone. Alle drei werden auch als Arzneistoffe verwendet. Therapeutisch wichtig sind ferner die künstlich hergestellten Katecholamine Isoprenalin, Dobutamin, Dopexamin und α-Methylnoradrenalin. Alle Katecholamine wirken über G-Protein-gekoppelte Rezeptoren, entweder durch Adrenozeptoren oder Dopamin-Rezeptoren. ⓘ
Struktur
Katecholamine haben die typische Struktur eines Benzolrings mit zwei Hydroxylgruppen, einer dazwischenliegenden Ethylkette und einer endständigen Amingruppe. Phenylethanolamine wie Norepinephrin haben eine Hydroxylgruppe an der Ethylkette. ⓘ
Herstellung und Abbau
Biosynthesewege von Katecholaminen und Spurenaminen im menschlichen Gehirn
L-Phenylalanin wird durch ein Enzym der aromatischen Aminosäure-Hydroxylase (AAAH) in L-Tyrosin umgewandelt (Phenylalanin-4-Hydroxylase), wobei molekularer Sauerstoff (O2) und Tetrahydrobiopterin als Kofaktoren dienen. L-Tyrosin wird durch ein anderes AAAH-Enzym (Tyrosin-3-Hydroxylase) in L-DOPA umgewandelt, wobei Tetrahydrobiopterin, O2 und Eisen (Fe2+) als Kofaktoren dienen. L-DOPA wird durch das Enzym Aromatische L-Aminosäure-Decarboxylase (AADC) in Dopamin umgewandelt, wobei Pyridoxalphosphat als Cofaktor dient. Dopamin selbst wird auch als Vorstufe für die Synthese der Neurotransmitter Noradrenalin und Adrenalin verwendet. Dopamin wird durch das Enzym Dopamin-β-Hydroxylase (DBH) in Noradrenalin umgewandelt, wobei O2 und L-Ascorbinsäure als Kofaktoren wirken. Norepinephrin wird durch das Enzym Phenylethanolamin-N-Methyltransferase (PNMT) mit S-Adenosyl-L-Methionin als Kofaktor in Epinephrin umgewandelt. ⓘ |
Standort
Katecholamine werden hauptsächlich von den chromaffinen Zellen des Nebennierenmarks und den postganglionären Fasern des sympathischen Nervensystems produziert. Dopamin, das als Neurotransmitter im zentralen Nervensystem wirkt, wird größtenteils in neuronalen Zellkörpern in zwei Bereichen des Hirnstamms produziert: im ventralen tegmentalen Bereich und in der Substantia nigra, wobei letztere neuromelaninpigmentierte Neuronen enthält. Die ebenfalls mit Neuromelanin pigmentierten Zellkörper des Locus coeruleus produzieren Noradrenalin. Epinephrin wird im menschlichen Gehirn in kleinen Gruppen von Neuronen produziert, die sein synthetisierendes Enzym, die Phenylethanolamin-N-Methyltransferase, exprimieren; diese Neuronen projizieren aus einem Kern, der an die Area postrema angrenzt (ventrolateral), und aus einem Kern in der dorsalen Region des Solitärtrakts. ⓘ
Biosynthese
Dopamin ist das erste Katecholamin, das aus DOPA synthetisiert wird. Norepinephrin und Epinephrin wiederum entstehen durch weitere metabolische Modifikation von Dopamin. Das Enzym Dopaminhydroxylase benötigt Kupfer als Cofaktor (nicht im Diagramm dargestellt) und die DOPA-Decarboxylase benötigt PLP (nicht im Diagramm dargestellt). Der geschwindigkeitsbeschränkende Schritt der Katecholamin-Biosynthese über den vorherrschenden Stoffwechselweg ist die Hydroxylierung von L-Tyrosin zu L-DOPA. ⓘ
Die Katecholamin-Synthese wird durch Alpha-Methyl-p-Tyrosin (AMPT) gehemmt, das die Tyrosin-Hydroxylase hemmt. ⓘ
Die Aminosäuren Phenylalanin und Tyrosin sind Vorstufen von Katecholaminen. Beide Aminosäuren finden sich in hohen Konzentrationen im Blutplasma und im Gehirn. Bei Säugetieren kann Tyrosin durch das Enzym Phenylalaninhydroxylase, das in großen Mengen in der Leber vorkommt, aus dem mit der Nahrung aufgenommenen Phenylalanin gebildet werden. Unzureichende Mengen an Phenylalaninhydroxylase führen zu Phenylketonurie, einer Stoffwechselstörung, die zu intellektuellen Defiziten führt, sofern sie nicht durch diätetische Maßnahmen behandelt wird. Man geht davon aus, dass die Katecholaminsynthese mit Tyrosin beginnt. Das Enzym Tyrosinhydroxylase (TH) wandelt die Aminosäure L-Tyrosin in 3,4-Dihydroxyphenylalanin (L-DOPA) um. Die Hydroxylierung von L-Tyrosin durch TH führt zur Bildung des DA-Vorläufers L-DOPA, der durch die aromatische L-Aminosäure-Decarboxylase (AADC; siehe Cooper et al., 2002) zum Transmitter Dopamin metabolisiert wird. Dieser Schritt erfolgt so schnell, dass es schwierig ist, L-DOPA im Gehirn zu messen, ohne vorher die AADC zu hemmen. In Neuronen, die DA als Transmitter verwenden, ist die Decarboxylierung von L-DOPA zu Dopamin der letzte Schritt bei der Bildung des Transmitters; in Neuronen, die Noradrenalin oder Adrenalin als Transmitter verwenden, ist jedoch auch das Enzym Dopamin-β-Hydroxylase (DBH) vorhanden, das Dopamin in Noradrenalin umwandelt. In noch anderen Neuronen, in denen Epinephrin der Transmitter ist, wandelt ein drittes Enzym, die Phenylethanolamin-N-Methyltransferase (PNMT), Norepinephrin in Epinephrin um. Eine Zelle, die Epinephrin als Transmitter verwendet, enthält also vier Enzyme (TH, AADC, DBH und PNMT), während Norepinephrin-Neuronen nur drei Enzyme (ohne PNMT) und Dopamin-Zellen nur zwei (TH und AADC) enthalten. ⓘ
Abbau
Katecholamine haben eine Halbwertszeit von wenigen Minuten, wenn sie im Blut zirkulieren. Sie können entweder durch Methylierung durch Catechol-O-Methyltransferasen (COMT) oder durch Desaminierung durch Monoaminoxidasen (MAO) abgebaut werden. ⓘ
MAOIs binden an die MAO und hindern sie so am Abbau von Katecholaminen und anderen Monoaminen. ⓘ
Der Katabolismus von Katecholaminen wird durch zwei Hauptenzyme vermittelt: die Katechol-O-Methyltransferase (COMT), die im synaptischen Spalt und im Zytosol der Zelle vorkommt, und die Monoaminoxidase (MAO), die sich in der Mitochondrienmembran befindet. Beide Enzyme benötigen Kofaktoren: COMT verwendet Mg2+ als Kofaktor, während MAO FAD verwendet. Der erste Schritt des katabolischen Prozesses wird entweder durch MAO oder COMT vermittelt, was vom Gewebe und dem Ort der Katecholamine abhängt (der Abbau von Katecholaminen im synaptischen Spalt wird z. B. durch COMT vermittelt, da MAO ein mitochondriales Enzym ist). An den nächsten katabolischen Schritten des Stoffwechselwegs sind Alkoholdehydrogenase, Aldehyddehydrogenase und Aldehydreduktase beteiligt. Das Endprodukt von Epinephrin und Norepinephrin ist Vanillylmandelsäure (VMA), die mit dem Urin ausgeschieden wird. Der Dopaminabbau führt zur Bildung von Homovanillinsäure (HVA). ⓘ
Funktion
Modalität
Zwei Katecholamine, Noradrenalin und Dopamin, wirken als Neuromodulatoren im zentralen Nervensystem und als Hormone im Blutkreislauf. Das Katecholamin Norepinephrin ist ein Neuromodulator des peripheren sympathischen Nervensystems, kommt aber auch im Blut vor (meist durch "Spillover" aus den Synapsen des sympathischen Systems). ⓘ
Hohe Katecholaminwerte im Blut werden mit Stress in Verbindung gebracht, der durch psychologische Reaktionen oder Umweltstressoren wie hohe Schallpegel, intensives Licht oder niedrige Blutzuckerwerte ausgelöst werden kann. ⓘ
Extrem hohe Katecholaminwerte (auch als Katecholamintoxizität bezeichnet) können bei einem Trauma des Zentralnervensystems auftreten, und zwar aufgrund der Stimulation oder Schädigung von Kernen im Hirnstamm, insbesondere von Kernen, die das sympathische Nervensystem beeinflussen. In der Notfallmedizin ist dieses Ereignis allgemein als "Katecholamin-Dump" bekannt. ⓘ
Extrem hohe Katecholaminwerte können auch durch neuroendokrine Tumore im Nebennierenmark verursacht werden, eine behandelbare Erkrankung, die als Phäochromozytom bezeichnet wird. ⓘ
Ein hoher Katecholaminspiegel kann auch durch einen Mangel an Monoaminoxidase A (MAO-A) verursacht werden, der als Brunner-Syndrom bekannt ist. Da MAO-A eines der Enzyme ist, die für den Abbau dieser Neurotransmitter verantwortlich sind, erhöht sein Mangel die Bioverfügbarkeit dieser Neurotransmitter erheblich. Es tritt ohne Phäochromozytom, neuroendokrine Tumore und Karzinoid-Syndrom auf, ähnelt aber dem Karzinoid-Syndrom mit Symptomen wie Gesichtsrötung und Aggressivität. ⓘ
Eine akute Porphyrie kann einen erhöhten Katecholaminspiegel verursachen. ⓘ
Auswirkungen
Katecholamine verursachen allgemeine physiologische Veränderungen, die den Körper auf körperliche Aktivität vorbereiten (die Kampf-oder-Flucht-Reaktion). Zu den typischen Wirkungen gehören ein Anstieg der Herzfrequenz, des Blutdrucks und des Blutzuckerspiegels sowie eine allgemeine Reaktion des sympathischen Nervensystems. Einige Medikamente, wie Tolcapon (ein zentraler COMT-Hemmer), erhöhen den Spiegel aller Katecholamine. Erhöhte Katecholamine können bei Patienten auch eine erhöhte Atemfrequenz (Tachypnoe) verursachen. ⓘ
Katecholamin wird nach seinem Abbau in den Urin ausgeschieden, und seine Sekretionsmenge kann zur Diagnose von Krankheiten gemessen werden, die mit dem Katecholaminspiegel im Körper in Zusammenhang stehen. Die Untersuchung des Urins auf Katecholamin wird zum Nachweis von Phäochromozytomen verwendet. ⓘ
Funktion in Pflanzen
"Sie wurden in 44 Pflanzenfamilien gefunden, aber es wurde keine wesentliche Stoffwechselfunktion für sie festgestellt. Sie sind Vorläufer der Benzo[c]phenanthridin-Alkaloide, die die aktiven Hauptbestandteile vieler Heilpflanzenextrakte sind. Den CAs wird eine mögliche Schutzfunktion gegen Insektenfraß, Verletzungen und Stickstoffentgiftung zugeschrieben. Es hat sich gezeigt, dass sie das Wachstum von Pflanzengewebe, die somatische Embryogenese aus In-vitro-Kulturen und die Blüte fördern. CAs hemmen die Indol-3-Essigsäure-Oxidation und fördern die Ethylen-Biosynthese. Es hat sich auch gezeigt, dass sie verschiedene Wirkungen von Gibberellinen synergistisch verstärken. ⓘ
Prüfung auf Katecholamine
Katecholamine werden von Zellen in Geweben verschiedener Systeme des menschlichen Körpers ausgeschieden, vor allem vom Nerven- und vom Hormonsystem. Die Nebennieren sezernieren bestimmte Katecholamine ins Blut, wenn der Mensch körperlich oder geistig gestresst ist, und dies ist normalerweise eine gesunde physiologische Reaktion. Ein akuter oder chronischer Überschuss an zirkulierenden Katecholaminen kann jedoch den Blutdruck und die Herzfrequenz auf sehr hohe Werte ansteigen lassen und schließlich gefährliche Auswirkungen haben. Tests auf fraktionierte freie Metanephrine im Plasma oder auf Metanephrine im Urin werden zur Bestätigung oder zum Ausschluss bestimmter Krankheiten eingesetzt, wenn der Arzt Anzeichen von Bluthochdruck und Tachykardie feststellt, die nicht angemessen auf eine Behandlung ansprechen. Mit jedem dieser Tests wird die Menge an Adrenalin- und Noradrenalin-Metaboliten gemessen, die jeweils als Metanephrin und Normetanephrin bezeichnet werden. ⓘ
Es werden auch Bluttests durchgeführt, um die Menge der im Körper vorhandenen Katecholamine zu analysieren. ⓘ
Katecholamintests werden durchgeführt, um seltene Tumore an der Nebenniere oder im Nervensystem zu erkennen. Katecholamintests liefern Informationen zu Tumoren wie dem Phäocromozytom, dem Paragangliom und dem Neuroblastom. ⓘ
Die aus dem Nebennierenmark und aus den sympathischen Nerven freigesetzten Katecholamine Noradrenalin und Adrenalin werden zu etwa 1 % unverändert im Harn ausgeschieden. 80–85 % der Katecholaminausscheidung erfolgen als Vanillinmandelsäure und ca. 15 % als Metanephrine. ⓘ
Bei Verdacht auf Phäochromozytom ist die Bestimmung von freien Metanephrinen im Harn notwendig, da diese Tumoren meist große Mengen Noradrenalin produzieren. Die Bestimmung der Metanephrine erfolgt dabei im Urin, der über 24 Stunden gesammelt wurde. Zusätzlich wird meist eine Bestimmung im Blutserum vorgenommen. ⓘ
Forschungsgeschichte
Den Katecholaminen sind in der Forschung einige Prioritäten zuzuordnen. Adrenalin war das erste Hormon, das aus einer endokrinen Drüse extrahiert, rein dargestellt, in seiner Struktur einschließlich der Stereochemie geklärt und künstlich synthetisiert wurde. Es war außerdem neben dem Acetylcholin der erstentdeckte Neurotransmitter (bei Amphibien). Die Katecholamine waren die ersten Neurotransmitter im Zentralnervensystem, deren Bahnen sichtbar gemacht wurden, zum Beispiel durch Immunhistochemie. Bei Forschungen über die Wirkung des Adrenalins (und des Glucagons) wurde das cyclische Adenosinmonophosphat als second messenger entdeckt. Es folgte die Entdeckung der G-Proteine. Ein Adrenozeptor, nämlich der β2-Adrenozeptor, war der erste Hormon- oder Neurotransmitterrezeptor, dessen Gen kloniert wurde. ⓘ
Physiologie
Wirkungen
Grobe Einteilung im niedrigen und mittleren Dosisbereich:
- Adrenalin
- steigert Blutdruck, Herzfrequenz und Bronchodilatation.
- Noradrenalin
- steigert vor allem den Blutdruck, nicht so sehr die Herzfrequenz.
- Isoprenalin
- steigert vor allem die Herzfrequenz, nicht so sehr den Blutdruck.
- Dopamin
- steigert die Muskelverkrampfungsfähigkeit (positiv inotrop).
- Dobutamin
- steigert die Muskelverkrampfungsfähigkeit (positiv inotrop). ⓘ
Nebenwirkungen
- Alle führen in höherer Dosis zu Herzrhythmusstörungen (arrhythmogen).
- Alle sind in hoher Dosis giftig für das Herz-Kreislauf-System (kardiotoxisch).
- Noradrenalin wirkt in hoher Dosis kreislaufzentralisierend. ⓘ
Katecholamine in der Therapie
Die Katecholamine Adrenalin, Noradrenalin, Dobutamin stehen auch als Medikamente zur Verfügung. Sie werden in der Intensiv- und Notfallmedizin verabreicht. Indikationen sind unter anderem die Herz-Lungen-Wiederbelebung (Reanimation), Schockzustände und schwere allergische Reaktionen. ⓘ
Katecholamine sind stark wirksam und werden meist intravenös gegeben. Eine alternative Verabreichungsform bei der Reanimation stellt die endotracheale Gabe von Adrenalin dar. Dies ist dann sinnvoll, wenn ein Endotrachealtubus, aber kein intravenöser Zugang zur Verfügung steht. Die Resorptionsgeschwindigkeit ist vergleichbar, die Dosis muss jedoch angepasst werden. Die endotracheale Applikation ist der intravenösen deutlich unterlegen. So lässt sich die Resorptionsgeschwindigkeit nicht zuverlässig bestimmen, es kann zu Depotbildungen kommen, die nach der Wiederkehr einer spontanen Blutzirkulation noch zu Herzrhythmusstörungen führen. In den 2005er Richtlinien des ERC wurde daher die endobronchiale Gabe nur noch im Ausnahmefall empfohlen (und nicht wie früher als Regelmaßnahme). Seit den Guidelines 2010 wird die endotracheale Gabe in den aktuellen Leitlinien nicht mehr empfohlen. Der Wirkungseintritt ist mit der venösen Gabe zwar vergleichbar, Wirkungsdauer und Wirkdosis sind jedoch schlecht steuerbar. Untersuchungen haben gezeigt, dass der intraossäre Gefäßzugang effektiv, in der Handhabung einfach und häufig ohne Komplikationen zu etablieren ist. Alle gängigen Notfallmedikamente können über einen intraossären Zugang appliziert werden. ⓘ
Bei der Katecholaminanwendung zur Kreislaufstabilisierung in der Intensivmedizin ist auf eine sehr gleichmäßige Zufuhr in den Körper zu achten, da sonst erhebliche Druck- und Herzfrequenzspitzen, bzw. (bei Unterbrechung der Zufuhr) Blutdruck- und Herzfrequenzabfälle auftreten können. Die gleichmäßig langsame Zufuhr wird üblicherweise mit Spritzenpumpen durchgeführt. Eine invasive Blutdruckmessung über einen arteriellen Zugang und EKG-Überwachung ist unabdingbar, da diese Stoffe ein erhebliches arrhythmogenes Potential haben (d. h. Herzrhythmusstörungen bis hin zum Kammerflimmern auslösen können). Bei der Anwendung kann es zu Herzinfarkten und Hirnblutungen durch zu hohen Blutdruck kommen. ⓘ
Die Wirksamkeit der Katecholamine beim kardiogenen Schock ist bisher nicht eindeutig belegt. Auch sonst beruht der Einsatz der Katecholamine in der Intensivmedizin meist lediglich auf Erfahrung. Randomisierte Vergleichsstudien fehlen, da die Katecholamine bereits vor der verbreiteten Akzeptanz der Kriterien der wissenschaftlichen, nachweisorientierten Medizin zur Verfügung standen und ihre Anwendung oft als einziger Weg erscheint, das Überleben zu sichern, weshalb sich viele Studienarten aus ethischen Gründen verbieten. ⓘ
