Knochenmark
| Knochenmark ⓘ | |
|---|---|
 Ein Schnitt durch das Knochenmarkgewebe (Preußischblau gefärbt) | |
| Einzelheiten | |
| System | Hämatopoetisches System Immunsystem Lymphatisches System |
| Bezeichner | |
| Lateinisch | Knochenmark (Medulla ossium) |
| Anatomische Terminologie (Bearbeiten auf Wikidata) | |
Das Knochenmark ist ein halbfestes Gewebe, das sich in den schwammigen (auch als Spongiosa bezeichneten) Teilen des Knochens befindet. Bei Vögeln und Säugetieren ist das Knochenmark der wichtigste Ort für die Produktion neuer Blutzellen (oder Hämatopoese). Es setzt sich aus hämatopoetischen Zellen, Knochenmark-Fettgewebe und unterstützenden Stromazellen zusammen. Beim erwachsenen Menschen befindet sich das Knochenmark hauptsächlich in den Rippen, den Wirbeln, dem Brustbein und den Beckenknochen. Das Knochenmark macht bei gesunden erwachsenen Menschen etwa 5 % der gesamten Körpermasse aus, so dass ein 73 kg schwerer Mann etwa 3,7 kg Knochenmark besitzt. ⓘ
Das menschliche Knochenmark produziert täglich etwa 500 Milliarden Blutzellen, die über durchlässige Gefäßsinusoide in der Markhöhle in den Körperkreislauf gelangen. Alle Arten von blutbildenden Zellen, einschließlich der myeloischen und lymphoiden Abstammungslinien, werden im Knochenmark gebildet; lymphoide Zellen müssen jedoch in andere lymphoide Organe (z. B. Thymus) wandern, um ihre Reifung abzuschließen. ⓘ
Knochenmarktransplantationen können zur Behandlung schwerer Erkrankungen des Knochenmarks, einschließlich bestimmter Krebsarten wie Leukämie, durchgeführt werden. Mehrere Arten von Stammzellen sind mit dem Knochenmark verwandt. Aus hämatopoetischen Stammzellen im Knochenmark können Zellen der hämatopoetischen Linie entstehen, und aus mesenchymalen Stammzellen, die aus der Primärkultur des Knochenmarkstromas isoliert werden können, können Knochen-, Fett- und Knorpelgewebe entstehen. ⓘ
Das Knochenmark (lateinisch Medulla ossium) ist ein in größeren Knochen von Wirbeltieren enthaltenes Binde- und Stammzellgewebe, das unter anderem der Blutbildung (Bildung von Blutzellen) dient. ⓘ
Das Rückenmark (lateinisch Medulla spinalis) ist kein Knochenmark, sondern besteht als Bestandteil des zentralen Nervensystems aus empfindlichem Nervengewebe. ⓘ

Struktur
Die Zusammensetzung des Knochenmarks ist dynamisch, da sich die Mischung aus zellulären und nichtzellulären Bestandteilen (Bindegewebe) mit dem Alter und als Reaktion auf systemische Faktoren verändert. Beim Menschen wird das Knochenmark umgangssprachlich als "rotes" oder "gelbes" Knochenmark (lateinisch: medulla ossium rubra bzw. lateinisch: medulla ossium flava) bezeichnet, je nachdem, wie hoch der Anteil hämatopoetischer Zellen gegenüber Fettzellen ist. Die genauen Mechanismen, die der Regulierung des Knochenmarks zugrunde liegen, sind zwar nicht bekannt, aber die Veränderungen in der Zusammensetzung erfolgen nach stereotypen Mustern. So enthalten die Knochen eines Neugeborenen ausschließlich hämatopoetisch aktives "rotes" Knochenmark, und mit zunehmendem Alter findet eine Umwandlung in "gelbes" Knochenmark statt. Bei Erwachsenen findet sich rotes Knochenmark vor allem im zentralen Skelett, z. B. im Becken, im Brustbein, im Schädel, in den Rippen, in den Wirbeln und in den Schulterblättern, und in unterschiedlichem Maße in den proximalen epiphysären Enden der langen Knochen wie dem Oberschenkelknochen und dem Oberarmknochen. Bei chronischer Hypoxie kann der Körper gelbes Mark wieder in rotes Mark umwandeln, um die Produktion von Blutzellen zu erhöhen. ⓘ
Nur im roten Knochenmark (lat. Medulla ossium rubra) finden sich die blutbildenden Zellen. Es handelt sich um etwa 400 Gramm, von denen jeweils 180 Gramm an der Erythropoese, der Erzeugung der Erythrozyten, und der Leukopoese, der Erzeugung der Leukozyten beteiligt sind. Die übrigen 40 Gramm entfallen auf Zellen, die Thrombozyten produzieren. ⓘ
Hämatopoetische Komponenten
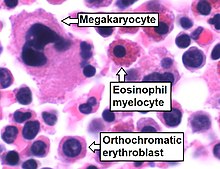
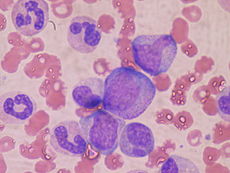
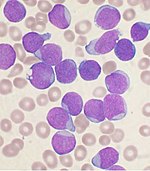
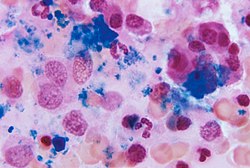
Auf zellulärer Ebene umfasst die wichtigste funktionelle Komponente des Knochenmarks die Vorläuferzellen, die dazu bestimmt sind, zu Blut- und Lymphoidzellen heranzureifen. Das menschliche Knochenmark produziert etwa 500 Milliarden Blutzellen pro Tag. Das Knochenmark enthält hämatopoetische Stammzellen, aus denen die drei Klassen von Blutzellen entstehen, die im Blutkreislauf vorkommen: weiße Blutkörperchen (Leukozyten), rote Blutkörperchen (Erythrozyten) und Blutplättchen (Thrombozyten). ⓘ
| Gruppe | Zelltyp | Durchschnittliche Anteil |
Referenz Bereich |
|---|---|---|---|
| Myelopoetische Zellen |
Myeloblasten | 0.9 | 0.2–1.5 |
| Promyelozyten | 3.3% | 2.1–4.1 | |
| Neutrophile Myelozyten | 12.7% | 8.2–15.7 | |
| Eosinophile Myelozyten | 0.8% | 0.2–1.3 | |
| Neutrophile Metamyelozyten | 15.9% | 9.6–24.6 | |
| Eosinophile Metamyelozyten | 1.2% | 0.4–2.2 | |
| Neutrophile Bandzellen | 12.4% | 9.5–15.3 | |
| Eosinophile Bandzellen | 0.9% | 0.2–2.4 | |
| Segmentierte Neutrophile | 7.4% | 6.0–12.0 | |
| Segmentierte Eosinophile | 0.5% | 0.0–1.3 | |
| Segmentierte Basophile und Mastzellen | 0.1% | 0.0–0.2 | |
| Erythropoetische Zellen Zellen |
Pronormoblasten | 0.6% | 0.2–1.3 |
| Basophile Normoblasten | 1.4% | 0.5–2.4 | |
| Polychromatische Normoblasten | 21.6% | 17.9–29.2 | |
| Orthochromatischer Normoblast | 2.0% | 0.4–4.6 | |
| Andere Zell Arten |
Megakaryozyten | < 0.1% | 0.0-0.4 |
| Plasmazellen | 1.3% | 0.4-3.9 | |
| Retikuläre Zellen | 0.3% | 0.0-0.9 | |
| Lymphozyten | 16.2% | 11.1-23.2 | |
| Monozyten | 0.3% | 0.0-0.8 |
Stroma
Das Stroma des Knochenmarks umfasst alle Gewebe, die nicht direkt an der primären Funktion des Knochenmarks, der Hämatopoese, beteiligt sind. Stromazellen können indirekt an der Hämatopoese beteiligt sein, indem sie eine Mikroumgebung bereitstellen, die die Funktion und Differenzierung der blutbildenden Zellen beeinflusst. So erzeugen sie beispielsweise koloniestimulierende Faktoren, die einen erheblichen Einfluss auf die Hämatopoese haben. Zu den Zelltypen, die das Knochenmarkstroma bilden, gehören:
- Fibroblasten (retikuläres Bindegewebe)
- Makrophagen, die insbesondere zur Produktion roter Blutkörperchen beitragen, da sie Eisen für die Hämoglobinproduktion liefern.
- Adipozyten (Fettzellen)
- Osteoblasten (bauen Knochen auf)
- Osteoklasten (Knochenabbau)
- Endothelzellen, die die Sinusoide bilden. Diese stammen von endothelialen Stammzellen ab, die auch im Knochenmark vorhanden sind. ⓘ
Funktion
Mesenchymale Stammzellen
Das Knochenmarkstroma enthält mesenchymale Stammzellen (MSCs), die auch als Knochenmarkstromazellen bezeichnet werden. Es handelt sich um multipotente Stammzellen, die sich in eine Vielzahl von Zelltypen differenzieren können. Es ist erwiesen, dass sich MSCs in vitro oder in vivo in Osteoblasten, Chondrozyten, Myozyten, Knochenmark-Adipozyten und Beta-Pankreas-Inselzellen differenzieren können. ⓘ
Knochenmarkbarriere
Die Blutgefäße des Knochenmarks bilden eine Barriere, die verhindert, dass unreife Blutzellen das Knochenmark verlassen. Nur reife Blutzellen enthalten die Membranproteine wie Aquaporin und Glycophorin, die erforderlich sind, um sich an das Endothel der Blutgefäße anzuheften und diese zu passieren. Hämatopoetische Stammzellen können auch die Knochenmarkschranke überwinden und können daher aus Blut gewonnen werden. ⓘ
Die Rolle des Lymphsystems
Das rote Knochenmark ist ein Schlüsselelement des lymphatischen Systems, da es zu den primären lymphatischen Organen gehört, die aus unreifen hämatopoetischen Vorläuferzellen Lymphozyten bilden. Das Knochenmark und der Thymus sind die primären lymphatischen Gewebe, die an der Produktion und frühen Selektion von Lymphozyten beteiligt sind. Darüber hinaus hat das Knochenmark eine ventilartige Funktion, um den Rückfluss von Lymphflüssigkeit in das Lymphsystem zu verhindern. ⓘ
Aus Lymphozyten-Stammzellen entstehen Lymphoblasten. ⓘ
Aus diesen gehen zum einen Pro-T-Lymphozyten hervor, die in undifferenziertem Zustand das Knochenmark durchlaufen. Sie siedeln sich im Thymus an und dort erfolgt ihre weitere Entwicklung zu T-Lymphozyten. ⓘ
Kompartimentierung
Eine biologische Kompartimentierung ist im Knochenmark insofern erkennbar, als bestimmte Zelltypen dazu neigen, sich in bestimmten Bereichen zu sammeln. So sammeln sich beispielsweise Erythrozyten, Makrophagen und ihre Vorläufer in der Nähe von Blutgefäßen, während sich Granulozyten an den Rändern des Knochenmarks sammeln. ⓘ
Als Nahrung
Tierisches Knochenmark wird seit Jahrtausenden weltweit in der Küche verwendet, beispielsweise für das berühmte Mailänder Ossobuco. ⓘ
Klinische Bedeutung
Krankheit
Die normale Architektur des Knochenmarks kann durch aplastische Anämie, bösartige Erkrankungen wie das Multiple Myelom oder Infektionen wie Tuberkulose geschädigt oder verdrängt werden, was zu einem Rückgang der Produktion von Blutzellen und Blutplättchen führt. Das Knochenmark kann auch von verschiedenen Formen der Leukämie betroffen sein, die die hämatologischen Vorläuferzellen angreifen. Darüber hinaus werden bei einer Strahlen- oder Chemotherapie viele der sich schnell teilenden Zellen des Knochenmarks abgetötet, was zu einer Schwächung des Immunsystems führt. Viele der Symptome einer Strahlenvergiftung sind auf die Schädigung der Knochenmarkzellen zurückzuführen. ⓘ
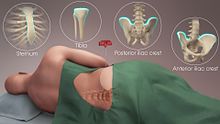
Zur Diagnose von Krankheiten, die das Knochenmark betreffen, wird manchmal eine Knochenmarkspunktion durchgeführt. Dabei wird in der Regel unter Vollnarkose oder örtlicher Betäubung mit einer Hohlnadel eine Probe des roten Knochenmarks aus dem Beckenkamm entnommen. ⓘ
Anwendung von Stammzellen in der Therapie
Stammzellen aus dem Knochenmark haben ein breites Anwendungsspektrum in der regenerativen Medizin. ⓘ
Bildgebung
Die medizinische Bildgebung kann eine begrenzte Menge an Informationen über das Knochenmark liefern. Röntgenstrahlen auf Normalfilm durchdringen Weichgewebe wie das Knochenmark und ermöglichen keine Visualisierung, obwohl Veränderungen in der Struktur des zugehörigen Knochens erkannt werden können. Die CT-Bildgebung bietet eine etwas bessere Möglichkeit zur Beurteilung der Knochenmarkshöhle, allerdings mit geringer Sensitivität und Spezifität. Das normale fetthaltige "gelbe" Knochenmark erwachsener Röhrenknochen beispielsweise hat eine geringe Dichte (-30 bis -100 Hounsfield-Einheiten) und liegt zwischen subkutanem Fett und Weichteilgewebe. Gewebe mit erhöhter zellulärer Zusammensetzung, wie z. B. normales "rotes" Knochenmark oder Krebszellen in der Markhöhle, weisen eine unterschiedlich hohe Dichte auf. ⓘ
Die MRT ist empfindlicher und spezifischer für die Beurteilung der Knochenzusammensetzung. Die MRT ermöglicht die Beurteilung der durchschnittlichen molekularen Zusammensetzung des Weichgewebes und liefert somit Informationen über den relativen Fettgehalt des Knochenmarks. Beim erwachsenen Menschen ist das "gelbe" Fettmark das dominierende Gewebe in den Knochen, insbesondere im (peripheren) appendikulären Skelett. Da Fettmoleküle eine hohe T1-Relaxivität aufweisen, zeigen T1-gewichtete Bildgebungssequenzen "gelbes" Fettmark als hell (hyperintens). Außerdem verliert normales Fettmark bei Fettsättigungssequenzen ähnlich wie subkutanes Fett an Signal. ⓘ
Wenn "gelbes" Fettmark durch Gewebe mit stärkerer zellulärer Zusammensetzung ersetzt wird, zeigt sich diese Veränderung in Form einer verminderten Helligkeit auf T1-gewichteten Sequenzen. Sowohl normales "rotes" Knochenmark als auch pathologische Knochenmarksläsionen (z. B. Krebs) sind auf T1-gewichteten Sequenzen dunkler als "gelbes" Knochenmark, können aber oft durch Vergleich mit der MR-Signalintensität benachbarter Weichteile unterschieden werden. Normales "rotes" Knochenmark ist auf T1-gewichteten Sequenzen in der Regel gleich oder heller als Skelettmuskel oder Bandscheibe. ⓘ
Fettmarkveränderungen, das Gegenteil einer Hyperplasie des roten Marks, können bei normaler Alterung auftreten, aber auch bei bestimmten Behandlungen wie einer Strahlentherapie. Eine diffuse T1-Hypointensität des Knochenmarks ohne Kontrastmittelanreicherung oder kortikale Diskontinuität deutet auf eine Umwandlung des roten Marks oder eine Myelofibrose hin. Falsch normales Knochenmark auf T1 kann bei diffusem multiplem Myelom oder leukämischer Infiltration auftreten, wenn das Wasser-Fett-Verhältnis nicht ausreichend verändert ist, wie es bei Tumoren niedrigeren Grades oder zu Beginn des Krankheitsprozesses der Fall sein kann. ⓘ
Histologie
Bei der Knochenmarkuntersuchung handelt es sich um die pathologische Analyse von Knochenmarksproben, die durch Biopsie oder Knochenmarkaspiration gewonnen wurden. Die Knochenmarkuntersuchung wird bei der Diagnose einer Reihe von Erkrankungen eingesetzt, darunter Leukämie, multiples Myelom, Anämie und Panzytopenie. Das Knochenmark produziert die zellulären Bestandteile des Blutes, darunter Blutplättchen, rote Blutkörperchen und weiße Blutkörperchen. Während viele Informationen durch die Untersuchung des Blutes selbst (durch Phlebotomie aus einer Vene entnommen) gewonnen werden können, ist es manchmal notwendig, die Quelle der Blutzellen im Knochenmark zu untersuchen, um mehr Informationen über die Hämatopoese zu erhalten; dies ist die Aufgabe der Knochenmarkaspiration und -biopsie. ⓘ
Das Verhältnis zwischen myeloischen und erythroiden Zellen ist wichtig für die Funktion des Knochenmarks, aber auch für Erkrankungen des Knochenmarks und des peripheren Blutes wie Leukämie und Anämie. Das normale Verhältnis von myeloischen zu erythroiden Zellen beträgt etwa 3:1; dieses Verhältnis kann bei myeloischen Leukämien zunehmen, bei Polyzythämien abnehmen und sich bei Thalassämie umkehren. ⓘ
Spende und Transplantation

Bei einer Knochenmarktransplantation werden einem Menschen blutbildende Stammzellen entnommen und einem anderen Menschen (allogen) oder demselben Menschen zu einem späteren Zeitpunkt (autolog) infundiert. Wenn Spender und Empfänger kompatibel sind, wandern die infundierten Zellen in das Knochenmark und leiten die Blutzellproduktion ein. Die Transplantation von einer Person auf eine andere wird zur Behandlung schwerer Knochenmarkskrankheiten wie angeborener Defekte, Autoimmunerkrankungen oder bösartiger Erkrankungen durchgeführt. Das körpereigene Knochenmark des Patienten wird zunächst durch Medikamente oder Bestrahlung abgetötet, und dann werden die neuen Stammzellen eingebracht. Bei Krebserkrankungen wird vor einer Strahlen- oder Chemotherapie manchmal ein Teil der blutbildenden Stammzellen des Patienten entnommen und nach Abschluss der Therapie wieder zugeführt, um das Immunsystem wiederherzustellen. ⓘ
Stammzellen aus dem Knochenmark können in Nervenzellen umgewandelt werden, um neurologische Erkrankungen zu behandeln, und können möglicherweise auch für die Behandlung anderer Krankheiten, wie z. B. entzündliche Darmerkrankungen, verwendet werden. Im Jahr 2013 schlugen Wissenschaftler im Anschluss an eine klinische Studie vor, dass die Knochenmarktransplantation in Verbindung mit antiretroviralen Medikamenten zur Behandlung von HIV eingesetzt werden könnte; später stellte sich jedoch heraus, dass das HIV in den Körpern der Testpersonen verblieb. ⓘ
Gewinnung
Die Stammzellen werden in der Regel direkt aus dem roten Knochenmark im Beckenkamm entnommen, häufig unter Vollnarkose. Der Eingriff ist minimalinvasiv und muss nicht genäht werden. Je nach dem Gesundheitszustand des Spenders und seiner Reaktion auf den Eingriff kann die eigentliche Entnahme ambulant erfolgen oder einen Erholungsaufenthalt von 1-2 Tagen im Krankenhaus erfordern. ⓘ
Eine weitere Möglichkeit besteht darin, bestimmte Medikamente zu verabreichen, die die Freisetzung von Stammzellen aus dem Knochenmark in das zirkulierende Blut anregen. Ein intravenöser Katheter wird in den Arm des Spenders eingeführt, und die Stammzellen werden dann aus dem Blut gefiltert. Dieses Verfahren ist ähnlich wie bei der Blut- oder Thrombozytenspende. Bei Erwachsenen kann das Knochenmark auch aus dem Brustbein entnommen werden, während bei Säuglingen häufig das Schienbein verwendet wird. Bei Neugeborenen können die Stammzellen aus der Nabelschnur entnommen werden. ⓘ
Persistente Viren
Mithilfe der quantitativen Polymerase-Kettenreaktion (qPCR) und des Next-Generation-Sequencing (NGS) wurden maximal fünf DNA-Viren pro Person identifiziert. Darunter befanden sich mehrere Herpesviren, das Hepatitis-B-Virus, das Merkelzell-Polyomavirus und das humane Papillomavirus 31. Angesichts der Reaktivierung und/oder des onkogenen Potenzials dieser Viren sind weitere Studien über ihre Auswirkungen auf hämatopoetische und maligne Erkrankungen erforderlich. ⓘ
Fossile Überlieferung

Der früheste versteinerte Nachweis von Knochenmark wurde 2014 in Eusthenopteron entdeckt, einem Lappenfisch, der im Devon vor etwa 370 Millionen Jahren lebte. Wissenschaftler der Universität Uppsala und der Europäischen Synchrotronstrahlungsanlage untersuchten mit Hilfe der Röntgensynchrotron-Mikrotomografie das versteinerte Innere des Oberarmknochens des Skeletts und fanden organisierte röhrenförmige Strukturen, die dem Knochenmark moderner Wirbeltiere ähneln. Eusthenopteron ist eng mit den frühen Tetrapoden verwandt, die sich schließlich zu den heutigen landlebenden Säugetieren und Eidechsen entwickelten. ⓘ
Anatomischer Aufbau
Die inneren Hohlräume der Knochen sind mit einer feinen Schicht von Bindegewebe, dem Endost, überzogen; von ihr ausgehend werden die Hohlräume mit retikulärem Bindegewebe durchzogen. Dieses Gewebe wird mittels Blutgefäßen ernährt, die in den Knochen eintreten (Vasa nutriciae) und sich dort zu langgestreckten Kavernen (Sinusoide) weiten. Die Wände dieser Kavernen werden von einem besonderen Gewebe gebildet, das zwar wie ein Epithel aussieht, aber aus Retikulumzellen gebildet wurde. ⓘ
Aufgabe dieses Gewebes ist nicht nur die Versorgung des dahinter liegenden Gewebes, wie es jede Kapillarwand leistet, sondern zusätzlich auch, den dahinter produzierten Blutzellen eine Möglichkeit zu bieten, in das Blut überzutreten. Granulozyten, Monozyten und Thrombozyten werden dabei aktiv tätig, doch die Erythrozyten sind dazu nicht in der Lage, da es offensichtlich keine dauerhaften Lücken in der Aderwand gibt, die dafür geeignet wären. Deswegen vermutet man, dass die Retikulo-Endothelzellen auseinanderweichen, wenn Erythrozyten in die Blutbahn abgegeben werden sollen. Zusätzlich müssen sich die Erythrozyten dabei vermutlich stark verformen, so dass dieser Vorgang zugleich einen Funktionstest für die fertigen roten Blutkörperchen darstellen würde. ⓘ
Im Knochenmark finden sich keine Lymphgefäße. ⓘ
Weißes Knochenmark (Gallertiges Knochenmark)
Bei dieser Variante des gelben Knochenmarks sind die Fetteinlagerungen durch Wasser ersetzt, daher das gallertartige Aussehen. Weißes Knochenmark kann nicht mehr zu rotem Knochenmark rückgewandelt werden, es ist also eine irreversibel degenerierte Form des Marks. Diese Variante tritt meist im hohen Alter oder bei Schwerkranken auf. ⓘ
Blutbildung

Im Knochenmark findet Blutbildung statt. Obwohl Forscher lange Zeit diskutierten, ob die verschiedenen Blutzellen aus einer, zwei oder drei verschiedenen Stammzellen gebildet werden, scheint es heute so, als ob eine einzige Stammzelle der Ursprung aller Blutzellen ist: der Hämozytoblast. Durch Teilung entstehen aus ihm zwei Zellen: ein neuer Hämozytoblast und eine Vorläuferzelle, die der Beginn der Entwicklungsreihen Erythropoese, Granulopoese, Lymphopoese, Thrombozytopoese und Monozytopoese ist, an deren Ende jeweils die verschiedenen Blutzellarten stehen. Die Faktoren, die zu den unterschiedlichen Formen führen, sind bisher weitgehend unbekannt; nur dass eine Gruppe von Wirkstoffen, die Poetine, daran beteiligt ist, gilt als sicher. ⓘ
Hämozytoblasten kommen nicht nur im Knochenmark vor, sondern finden sich auch in geringem Umfang im Blut. Beim Erwachsenen teilen sich diese Zellen nur noch selten. ⓘ
Erythropoese
Wenn aus dem oben beschriebenen Teilungsvorgang ein Proerythroblast hervorgeht, werden neue Erythrozyten produziert (Erythropoese). Dabei reift das Blutkörperchen in vier bis fünf Tagen vom Proerythroblast über den Erythroblast (auch Makroblast genannt) und dem Normoblast, der seinen Zellkern ausstößt, zum Retikulozyt. In ihm sind noch Reste der RNA zu erkennen, die netzförmig die Zelle durchziehen (Substantia granulofilamentosa). Etwa 0,8 % dieser Retikulozyten gelangen bereits in die Blutbahn, obwohl sie erst die letzte Vorstufe zum normalen roten Blutkörperchen darstellen. Nach einem bis zwei Tagen sind auch die letzten Reste der RNA verschwunden, nun ist der Erythrozyt reif und wird in die Blutbahn ausgestoßen. ⓘ
Aus jedem Proerythroblasten gehen in vier bis fünf Teilungsschritten 16 bis 32 Erythrozyten hervor. Davon sind normalerweise 10 % bis 15 % fehlgebildet und gehen zugrunde. ⓘ
Granulopoese
Bei der Granulopoese (Syn. Granulozytopoese) entwickeln sich die Vorläuferzellen zu Myeloblasten, die sich wiederum in Promyelozyten weiter entwickeln. Von dieser Stufe stammen wahrscheinlich nicht nur die Granulozyten ab, sondern auch die Monozyten (siehe weiter unten: Monozytopoese). ⓘ
Metamyelozyten sind der direkte Vorläufer der drei Granulozytenarten und sind die nächste Stufe der Entwicklung. Bis der Promyelozyt sich so weit entwickelt hat, vergehen vier bis sieben Tage, bis zu den reifen Endstadien der Granulozyten werden weitere vier bis sechs Tage vergehen. Aus einem Promyelozyten entstehen 16 reife Granulozyten. ⓘ
Die Teilung des Promyelozyten führt zur ersten, noch unreifen Form der Granulozyten, die jetzt noch einen unsegmentierten Zellkern besitzen (stabkerniger Granulozyt). In den nächsten Tagen entstehen drei bis vier Einschnürungen, die den Zellkern in Segmente teilen, die aber untereinander verbunden sind; der Zellkern wird nicht etwa zerteilt. Sobald diese Segmentierung abgeschlossen ist, gilt der Granulozyt als reif (segmentkerniger Granulozyt) und wird in die Blutbahn geschleust. ⓘ
Monozytopoese
Wie der Granulozyt stammt auch der Monozyt vom Promyelozyten ab; zumindest wird die Vermutung durch enzymhistochemische Untersuchungen nahegelegt. Sie werden ohne weitere Reifung aus dem Knochenmark ausgeschleust, können sich aber an anderen Stellen des Körpers in andere Zellarten des Retikulo-Endothelialen Systems, wahrscheinlich auch in Mastzellen, umwandeln. ⓘ
Thrombozytopoese
Thrombozyten (Blutplättchen) sind Abschnürungen aus dem Plasma der Megakaryozyten (Knochenmarksriesenzellen), die sich bei diesem Vorgang verbrauchen. Dabei vereinigen sich die Trennwände von Teilen des Plasmalemmas zu trennenden Wänden und Spalten. So wird der entstehende Thrombozyt mit einer Membran umgeben, bis er sich schließlich abschnürt. ⓘ
Erkrankungen des Knochenmarks
Beispiele für Knochenmarkserkrankungen sind Knochenmarködem, Leukämie, Myelodysplastisches Syndrom, Neuroblastom, Osteomyelitis und Strahlenkrankheit. ⓘ
Schädigende Medikamentenwirkstoffe
Die meisten Zytostatika wie z. B. Chlorambucil, Melphalan, Busulfan, Tioguanin, Cyclophosphamid, Ifosfamid, Imatinib, Trofosfamid, Carmustin, Lomustin, Mitobronitol, Vinblastin, Vindesin, Cisplatin, Etoposid und Teniposid sowie Biguanide, Chloramphenicol, Clozapin, Hydantoin und Pyrazinamid wirken knochenmarksschädigend. ⓘ
Viele weitere Wirkstoffgruppen wie zum Beispiel die Sulfonamide, beeinträchtigen die Bildung von Leukozyten und Thrombozyten, ohne in dieser Aufzählung enthalten zu sein. Siehe hierzu Leukopenie und Thrombopenie. ⓘ
Knochenmarködem
Als Knochenmarködem oder Knochenmarködem-Syndrom (KMÖS), wird eine schmerzhafte Erkrankung meist des Oberschenkelknochens (Femurkondyls) unmittelbar über dem Kniegelenk, seltener der Hüfte oder noch seltener auch anderer Knochen bezeichnet, deren Ursache bislang nicht geklärt wurde. Der Begriff Transiente Osteoporose, auch transitorische Osteoporose wird im angloamerikanischen Sprachraum oft für das Knochenmarködem verwendet. Die Transiente Osteoporose ist eine zeitlich begrenzte Form des Knochenmarködems, welche nie chronisch wird. Das klassische Leitsymptom der transienten Osteoporose ist ein spontaner stechender Schmerz im Bereich der Kniegelenke oder der Hüftgelenke. Während im Röntgenbild oft kein krankhafter Befund sichtbar ist, kann die Diagnose mit der Magnetresonanztomographie (MRT) meist zuverlässig gestellt werden. Die transiente Osteoporose betrifft Männer im mittleren Lebensalter, und deutlich seltener Frauen, sie wird bei unbekannter Ätiologie auch als idiopathisches Knochenmarködemsyndrom (KMÖS) bezeichnet. ⓘ
Knochenmarkspende
Eine Knochenmarkspende ist eine Methode zur Gewinnung von Blutstammzellen. Diese werden benötigt, wenn jemand zum Beispiel an Leukämie (Blutkrebs) erkrankt ist oder an anderen bösartigen Erkrankungen des blutbildenden Systems leidet. Eine Transplantation der Blutstammzellen bietet in diesem Fall eine Heilungschance. Da die Knochenmarkspende in diesem Sinne nur eine Methode zur Gewinnung von Blutstammzellen ist, spricht man heute häufig allgemein von Blutstammzellspende, wobei die Knochenmarkspende im eigentlichen Sinn als Entnahme von Blutstammzellen durch Punktionen im Begriff der Blutstammzellspende mit enthalten ist. ⓘ