Mastzelle

Mastzellen (Mastozyten) sind Zellen der körpereigenen Abwehr, die Botenstoffe, unter anderem Histamin und Heparin, gespeichert haben. Sie sind 20–30 µm groß. ⓘ
Paul Ehrlich entdeckte sie und nannte sie „Mastzellen“, wohl deshalb, weil er fälschlicherweise annahm, die Zellen hätten die Fähigkeit zur Phagozytose. Die in ihr gespeicherten Granula erzeugt die Zelle jedoch selbst. Eine andere Version besagt, Ehrlich habe angenommen, diese Zellen benutzen ihre fetthaltigen Granula dazu, umgebende Zellen zu füttern oder zu „mästen“. ⓘ
Die manchmal auch als Blutmastzellen bezeichneten basophilen Granulozyten unterscheiden sich von den eigentlichen Mastzellen. Letztere kommen über den ganzen Körper verteilt im interstitiellen Bindegewebe vor, am häufigsten jedoch in der Submucosa von Darm und Atemwegen und in der Lederhaut (Corium), in der Nähe von Gefäßen und Nerven. ⓘ
Die Mastzelle spielt eine wichtige Rolle bei der Allergie vom Typ 1 (IgE-vermittelte Allergien wie z. B. Asthma, allergische Rhinitis, systemische Anaphylaxie): Beim ersten Kontakt mit einem Allergen bleibt der Betroffene zunächst völlig symptomfrei, es wird jedoch die Bildung von spezifischen IgE-Antikörpern durch die Plasmazellen ausgelöst, die gegen das spezielle Allergen gerichtet sind. Die massenhaft produzierten IgE-Antikörper setzen sich mit dem Fußteil (Fc-Teil = Fragment crystallizable) auf der Oberfläche von Mastzellen fest, die überall im Körper, vor allem in den Schleimhäuten, vorkommen und sensibilisieren sie für die Reaktion auf das Allergen. Erst beim zweiten Kontakt mit dem Allergen kommt es zur allergischen Reaktion, wenn die Allergene an je zwei benachbarte IgE-Antikörper auf den Mastzellen binden und diese so miteinander vernetzt werden. Dadurch werden die Mastzellen angeregt, ihre Granula im Vorgang der Exozytose zu entleeren und das darin enthaltene Histamin freizusetzen (Degranulation). Histamin ist ein Botenstoff, der an Rezeptoren der umgebenden Gewebszellen bindet und in wenigen Sekunden heftige Wirkungen hervorruft. Diesen Vorgang bezeichnet man als allergische Sofortreaktion (Immunantwort), da die allergischen Symptome innerhalb von Sekunden bis Minuten auftreten. Das schnelle Eintreten der Symptome liegt an der unmittelbar einsetzenden Reaktion des umliegenden Gewebes auf die sezernierten Substanzen: Gefäße erweitern sich, Flüssigkeit lagert sich ein (Quaddelbildung) etc. Die zahlreich in der Nähe von Gefäßen positionierten Mastzellen warten aktiv auf IgE. ⓘ
Es gibt darüber hinaus auch eine nicht-immunologische Degranulation von Mastzellen. Dies bedeutet, dass ebenfalls eine Freisetzungsreaktion (wie im obigen Absatz beschrieben) stattfindet, also Histamin, Heparin und andere Mediatoren durch Mastzellen abgegeben werden, dies jedoch ohne Beteiligung von Antikörpern. Bestimmte molekulare Strukturen, z. B. von Medikamenten, sind in der Lage, die nichtimmunologische Mastzelldegranulation auszulösen. ⓘ
Im Alter nimmt die Mastzellanzahl zu, es wird daher vermutet, dass Mastzellen und ihre Inhaltsstoffe zum Alterungsprozess beitragen. Neben der oben genannten Rolle in der Auslösung allergischer Symptome ist die Mastzelle auch bei anderen Erkrankungen wie der Urtikaria und der Mastozytose von zentraler Bedeutung. Die physiologischen Funktionen von Mastzellen liegen vor allem in der Abwehr von Bakterien und Parasiten sowie im Schutz vor Tiergiften. ⓘ
| Mastzelle ⓘ | |
|---|---|
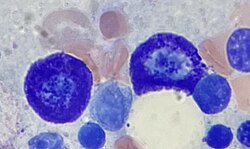 Zwei Mastzellen im Knochenmark | |
| Einzelheiten | |
| System | Immunsystem |
| Bezeichner | |
| Lateinisch | Mastozytus |
| Anatomische Begriffe der Mikroanatomie [Bearbeiten auf Wikidata] | |
Aufbau


Mastzellen sind den basophilen Granulozyten (einer Klasse von weißen Blutkörperchen) im Blut sehr ähnlich. Beide sind granulierte Zellen, die Histamin und Heparin, ein Antikoagulans, enthalten. Ihre Zellkerne unterscheiden sich dadurch, dass der basophile Zellkern lappig ist, während der Kern der Mastzellen rund ist. Die Fc-Region des Immunglobulins E (IgE) wird an Mastzellen und Basophile gebunden, und wenn die Paratope des IgE an ein Antigen binden, setzen die Zellen Histamin und andere Entzündungsmediatoren frei. Diese Ähnlichkeiten haben viele zu der Vermutung veranlasst, dass es sich bei den Mastzellen um Basophile handelt, die sich im Gewebe "eingenistet" haben. Außerdem haben sie einen gemeinsamen Vorläufer im Knochenmark, der das CD34-Molekül exprimiert. Basophile verlassen das Knochenmark bereits ausgereift, während die Mastzelle in unreifem Zustand zirkuliert und erst an einem bestimmten Ort im Gewebe ausreift. Der Ort, an dem sich eine unreife Mastzelle ansiedelt, bestimmt wahrscheinlich ihre genauen Eigenschaften. Die erste In-vitro-Differenzierung und das Wachstum einer reinen Population von Mausmastzellen wurde mit konditioniertem Medium aus Concanavalin A-stimulierten Splenozyten durchgeführt. Später wurde entdeckt, dass das von T-Zellen stammende Interleukin 3 die Komponente im konditionierten Medium ist, die für die Differenzierung und das Wachstum der Mastzellen erforderlich ist. ⓘ
Mastzellen bei Nagetieren werden klassischerweise in zwei Subtypen unterteilt: Mastzellen vom Bindegewebstyp und Mastzellen der Schleimhaut. Die Aktivitäten der letzteren sind von T-Zellen abhängig. ⓘ
Mastzellen sind in den meisten Geweben vorhanden, die typischerweise Blutgefäße, Nerven und Lymphgefäße umgeben, und treten besonders an den Grenzen zwischen der Außenwelt und dem inneren Milieu auf, wie z. B. in der Haut, den Schleimhäuten der Lunge und des Verdauungstrakts sowie in Mund, Bindehaut und Nase. ⓘ
Funktion

Mastzellen spielen eine Schlüsselrolle im Entzündungsprozess. Wenn eine Mastzelle aktiviert wird, kann sie entweder selektiv (piecemeal degranulation) oder schnell (anaphylaktische degranulation) "Mediatoren", d. h. entzündungsauslösende Verbindungen, aus Speichergranula in die lokale Mikroumgebung freisetzen. Mastzellen können durch Allergene über die Vernetzung mit Immunglobulin-E-Rezeptoren (z. B. FcεRI), durch physische Verletzungen über Mustererkennungsrezeptoren für schadensassoziierte molekulare Muster (DAMPs), durch mikrobielle Krankheitserreger über Mustererkennungsrezeptoren für pathogenassoziierte molekulare Muster (PAMPs) und durch verschiedene Verbindungen über ihre assoziierten G-Protein-gekoppelten Rezeptoren (z. B. Morphin über Opioidrezeptoren) oder ligandengesteuerte Ionenkanäle zur Degranulation angeregt werden. Komplementproteine können Membranrezeptoren auf Mastzellen aktivieren, um ebenfalls verschiedene Funktionen auszuüben. ⓘ
Mastzellen exprimieren einen Rezeptor mit hoher Affinität (FcεRI) für die Fc-Region von IgE, dem am wenigsten verbreiteten Vertreter der Antikörper. Dieser Rezeptor hat eine so hohe Affinität, dass die Bindung von IgE-Molekülen im Wesentlichen irreversibel ist. Infolgedessen werden Mastzellen mit IgE beschichtet, das von Plasmazellen (den antikörperproduzierenden Zellen des Immunsystems) produziert wird. IgE-Antikörper sind in der Regel spezifisch für ein bestimmtes Antigen. ⓘ
Bei allergischen Reaktionen bleiben Mastzellen inaktiv, bis ein Allergen an das bereits auf der Zelle aufgebrachte IgE bindet. Andere Membranaktivierungsereignisse können Mastzellen entweder für die anschließende Degranulation vorbereiten oder in Synergie mit der FcεRI-Signaltransduktion wirken. Im Allgemeinen handelt es sich bei Allergenen um Proteine oder Polysaccharide. Das Allergen bindet an die Antigenbindungsstellen, die sich an den variablen Regionen der an die Mastzellenoberfläche gebundenen IgE-Moleküle befinden. Offenbar ist die Bindung von zwei oder mehr IgE-Molekülen (Quervernetzung) erforderlich, um die Mastzelle zu aktivieren. Die Anhäufung der intrazellulären Domänen der zellgebundenen Fc-Rezeptoren, die mit den vernetzten IgE-Molekülen assoziiert sind, bewirkt eine komplexe Abfolge von Reaktionen innerhalb der Mastzelle, die zu ihrer Aktivierung führen. Obwohl diese Reaktion im Zusammenhang mit Allergien am besten verstanden wird, scheint sie sich als Abwehrsystem gegen Parasiten und Bakterien entwickelt zu haben. ⓘ
Mastzellen-Mediatoren
Ein einzigartiger, stimulusspezifischer Satz von Mastzellmediatoren wird durch Degranulation nach Aktivierung von Zelloberflächenrezeptoren auf Mastzellen freigesetzt. Beispiele für Mediatoren, die während der Mastzelldegranulation in die extrazelluläre Umgebung freigesetzt werden, sind
- Serinproteasen, wie Tryptase und Chymase
- Histamin (2-5 Pikogramm pro Mastzelle)
- Serotonin
- Proteoglykane, hauptsächlich Heparin (gerinnungshemmend) und einige Chondroitinsulfat-Proteoglykane
- Adenosintriphosphat (ATP)
- lysosomale Enzyme
- β-Hexosaminidase
- β-Glucuronidase
- Arylsulfatasen
- neu gebildete Lipidmediatoren (Eicosanoide):
- Thromboxan
- Prostaglandin D2
- Leukotrien C4
- Plättchen-aktivierender Faktor
- Zytokine
- TNF-α
- Basis-Fibroblasten-Wachstumsfaktor
- Interleukin-4
- Stammzellfaktor
- Chemokine, wie der eosinophile chemotaktische Faktor
- reaktive Sauerstoffspezies ⓘ

Histamin erweitert die postkapillaren Venolen, aktiviert das Endothel und erhöht die Durchlässigkeit der Blutgefäße. Dies führt zu lokalen Ödemen (Schwellungen), Wärme, Rötung und der Anziehung anderer Entzündungszellen an den Ort der Freisetzung. Außerdem depolarisiert es die Nervenenden (was zu Juckreiz oder Schmerzen führt). Anzeichen einer Histaminfreisetzung auf der Haut sind die "Flare and wheal"-Reaktion. Die Beule und Rötung unmittelbar nach einem Mückenstich sind ein gutes Beispiel für diese Reaktion, die Sekunden nach dem Angriff eines Allergens auf die Mastzellen auftritt. ⓘ
Die anderen physiologischen Aktivitäten der Mastzellen sind weit weniger bekannt. Mehrere Indizien deuten darauf hin, dass Mastzellen eine recht grundlegende Rolle bei der angeborenen Immunität spielen: Sie sind in der Lage, eine Vielzahl wichtiger Zytokine und anderer Entzündungsmediatoren wie TNF-α zu produzieren; sie exprimieren mehrere "Mustererkennungsrezeptoren", von denen man annimmt, dass sie an der Erkennung breiter Klassen von Krankheitserregern beteiligt sind; und Mäuse ohne Mastzellen scheinen viel anfälliger für eine Vielzahl von Infektionen zu sein. ⓘ
Die Granula der Mastzellen enthalten eine Vielzahl bioaktiver Chemikalien. Es hat sich gezeigt, dass diese Granula in einem Prozess der Transgranulation über Mastzellpseudopodien auf benachbarte Zellen des Immunsystems und auf Neuronen übertragen werden. ⓘ
Im Nervensystem
Im Gegensatz zu anderen hämatopoetischen Zellen des Immunsystems kommen Mastzellen natürlicherweise im menschlichen Gehirn vor, wo sie mit dem Neuroimmunsystem interagieren. Im Gehirn befinden sich Mastzellen in einer Reihe von Strukturen, die viszerale sensorische (z. B. Schmerz) oder neuroendokrine Funktionen vermitteln oder entlang der Blut-Liquor-Schranke liegen, darunter Hypophysenstiel, Zirbeldrüse, Thalamus und Hypothalamus, Area postrema, Plexus choroideus und in der Duraschicht der Hirnhaut in der Nähe von meningealen Nozizeptoren. Mastzellen erfüllen im Körper und im Zentralnervensystem dieselben allgemeinen Funktionen, wie z. B. die Bewirkung oder Regulierung von allergischen Reaktionen, angeborener und adaptiver Immunität, Autoimmunität und Entzündung. Systemübergreifend dienen Mastzellen als Haupteffektorzelle, über die Krankheitserreger die Darm-Hirn-Achse beeinflussen können. ⓘ
Im Darm
Im Magen-Darm-Trakt befinden sich die Mastzellen der Schleimhäute in unmittelbarer Nähe von sensorischen Nervenfasern, die in beide Richtungen kommunizieren. Wenn diese Mastzellen zunächst degranulieren, setzen sie Mediatoren frei (z. B. Histamin, Tryptase und Serotonin), die die Membranexpression von Nozizeptoren (d. h. TRPV1) an viszeralen affektiven Neuronen aktivieren, sensibilisieren und hochregulieren, TRPV1) auf viszeralen afferenten Neuronen über ihre Rezeptoren (HRH1, HRH2, HRH3, PAR2, 5-HT3) aktivieren, sensibilisieren und deren Membranexpression regulieren; dies wiederum führt zu neurogenen Entzündungen, viszeraler Überempfindlichkeit und Darmdysmotilität (d. h. beeinträchtigter Peristaltik). Durch die neuronale Aktivierung werden Neuropeptide (Substanz P und Calcitonin-Gen-verwandtes Peptid) an Mastzellen signalisiert, wo sie an die entsprechenden Rezeptoren binden und die Degranulation einer Reihe von Mediatoren (β-Hexosaminidase, Zytokine, Chemokine, PGD2, Leukotriene und Eoxine) auslösen. ⓘ
Physiologie

Struktur des hochaffinen IgE-Rezeptors, FcεR1
FcεR1 ist ein hochaffiner IgE-Rezeptor, der auf der Oberfläche der Mastzelle exprimiert wird. FcεR1 ist ein Tetramer, das aus einer Alpha-(α)-Kette, einer Beta-(β)-Kette und zwei identischen, disulfidverknüpften Gamma-(γ)-Ketten besteht. Die Bindungsstelle für das IgE wird durch den extrazellulären Teil der α-Kette gebildet, der zwei Ig-ähnliche Domänen enthält. Eine Transmembrandomäne enthält einen Asparaginsäurerest, die andere einen kurzen zytoplasmatischen Schwanz. Die β-Kette enthält in der zytoplasmatischen Region ein einziges auf Immuntyrosin basierendes Aktivierungsmotiv ITAM. Jede γ-Kette hat ein ITAM in der zytoplasmatischen Region. Die Signalkaskade des Rezeptors wird ausgelöst, wenn die ITAMs der β- und γ-Ketten durch Tyrosin phosphoryliert werden. Dieses Signal ist für die Aktivierung von Mastzellen erforderlich. Den T-Helferzellen vom Typ 2 (Th2) und vielen anderen Zelltypen fehlt die β-Kette, so dass die Signalübertragung nur über die γ-Kette erfolgt. Dies ist darauf zurückzuführen, dass die α-Kette Retentionssignale des endoplasmatischen Retikulums enthält, die bewirken, dass die α-Ketten im ER abgebaut bleiben. Der Zusammenbau der α-Kette mit den kotransfizierten β- und γ-Ketten maskiert die ER-Retention und ermöglicht den Export des α-β-γ-Komplexes in den Golgi-Apparat zur Plasmamembran bei Ratten. Beim Menschen wird nur der γ-Komplex benötigt, um die ER-Retention der α-Kette auszugleichen. ⓘ
Allergen-Prozess
Allergen-vermittelte FcεR1-Vernetzungssignale sind dem Signalereignis, das zur Antigenbindung an Lymphozyten führt, sehr ähnlich. Die Lyn-Tyrosinkinase ist mit dem zytoplasmatischen Ende der FcεR1-β-Kette verbunden. Das Antigen vernetzt die FcεR1-Moleküle, und die Lyn-Tyrosinkinase phosphoryliert die ITAMs in der FcεR1 β- und γ-Kette im Zytoplasma. Nach der Phosphorylierung wird die Syk-Tyrosinkinase zu den ITAMs an den γ-Ketten rekrutiert. Dies führt zu einer Aktivierung der Syk-Tyrosinkinase und damit zu einer Phosphorylierung. Syk fungiert als signalverstärkende Kinaseaktivität, da sie auf mehrere Proteine abzielt und deren Aktivierung bewirkt. Diese vom Antigen stimulierte Phosphorylierung bewirkt die Aktivierung anderer Proteine in der FcεR1-vermittelten Signalkaskade. ⓘ
Degranulation und Verschmelzung
Ein wichtiges Adaptorprotein, das durch den Syk-Phosphorylierungsschritt aktiviert wird, ist der Linker für die Aktivierung von T-Zellen (LAT). LAT kann durch Phosphorylierung modifiziert werden, um neue Bindungsstellen zu schaffen. Die Phospholipase C gamma (PLCγ) wird phosphoryliert, sobald sie an LAT gebunden ist, und katalysiert dann den Abbau von Phosphatidylinositolbisphosphat zu Inositoltrisphosphat (IP3) und Diacyglycerin (DAG). IP3 erhöht den Kalziumspiegel, und DAG aktiviert die Proteinkinase C (PKC). Dies ist jedoch nicht der einzige Weg, auf dem PKC gebildet wird. Die Tyrosinkinase FYN phosphoryliert das Grb2-assoziierte Bindungsprotein 2 (Gab2), das sich an die Phosphoinositid-3-Kinase bindet, die wiederum die PKC aktiviert. PKC führt zur Aktivierung der Myosin-Leichtketten-Phosphorylierungs-Granula-Bewegungen, wodurch die Aktin-Myosin-Komplexe zerlegt werden, damit die Granula mit der Plasmamembran in Kontakt kommen können. Das Mastzellgranulat kann nun mit der Plasmamembran verschmelzen. Dieser Prozess wird durch den löslichen N-Ethylmaleimid-empfindlichen Fusionsanlagerungsprotein-Rezeptor SNARE-Komplex vermittelt. Verschiedene SNARE-Proteine interagieren und bilden unterschiedliche Komplexe, die die Fusion katalysieren. Rab3-Guanosintriphosphatasen und Rab-assoziierte Kinasen und Phosphatasen regulieren die Granulummembranfusion in ruhenden Mastzellen. ⓘ
MRGPRX2-Mastzellenrezeptor
Der humane mastzellspezifische G-Protein-gekoppelte Rezeptor MRGPRX2 spielt eine Schlüsselrolle bei der Erkennung von pathogenassoziierten molekularen Mustern (PAMPs) und der Auslösung einer antibakteriellen Reaktion. MRGPRX2 ist in der Lage, an das kompetenzstimulierende Peptid (CSP) 1 zu binden - ein Quorum-Sensing-Molekül (QSM), das von Gram-positiven Bakterien produziert wird. Dies führt zu einer Signaltransduktion an ein G-Protein und zur Aktivierung der Mastzelle. Die Aktivierung der Mastzellen induziert die Freisetzung von antibakteriellen Mediatoren wie ROS, TNF-α und PRGD2, die die Rekrutierung anderer Immunzellen einleiten, um das Bakterienwachstum und die Biofilmbildung zu hemmen. ⓘ
Der MRGPRX2-Rezeptor ist ein mögliches therapeutisches Ziel und kann mit dem Agonisten 48/80 pharmakologisch aktiviert werden, um bakterielle Infektionen zu bekämpfen. Es wird auch vermutet, dass andere QSMs und sogar gramnegative bakterielle Signale diesen Rezeptor aktivieren können. Dies könnte insbesondere bei chronischen Bartonella-Infektionen der Fall sein, bei denen die Symptomatik beim Menschen eindeutig darauf hindeutet, dass diese Patienten alle ein Mastzellenaktivierungssyndrom haben, das auf das Vorhandensein eines noch nicht definierten Quorum-Sensing-Moleküls (basales Histamin selbst?) zurückzuführen ist. Diese Patienten neigen zu Nahrungsmittelunverträglichkeiten, die durch einen anderen, weniger spezifischen Weg als den IgE-Rezeptorweg ausgelöst werden: sicherlich den MRGPRX2-Weg. Diese Patienten zeigen auch zyklische Hautreizungen und Dermographismus, jedes Mal, wenn das Bakterium seinen versteckten intrazellulären Standort verlässt. ⓘ
Enzyme
| Enzym | Funktion ⓘ |
|---|---|
| Lyn-Tyrosin-Kinase | Phosphoryliert die ITAMs in der FcεR1 β- und γ-Kette im Zytoplasma. Es bewirkt, dass die Syk-Tyrosinkinase an die ITAMS auf den γ-Ketten rekrutiert wird. Dadurch wird die Syk-Tyrosinkinase aktiviert und phosphoryliert |
| Syk-Tyrosinkinase | Zielt auf mehrere Proteine und bewirkt deren Aktivierung |
| Phospholipase C | Katalysiert Phosphatidylinositol-4,5-bisphosphat |
| Inositol-Trisphosphat | Erhöht den Kalziumspiegel |
| Diacylglycerin | Aktiviert die Proteinkinase C |
| FYN | Phosphoryliert GAB2 |
| GAB2 | Bindet an Phosphoinositid-3-Kinase |
| Phosphoinositid-3-Kinase | Aktiviert die Proteinkinase C |
| Proteinkinase C | Aktiviert die Phosphorylierung der leichten Myosin-Kette Granulatbewegungen, die die Aktin-Myosin-Komplexe abbauen |
| Rab-assoziierte Kinasen und Phosphatasen | Regulierung der Zellkörnchenmembranfusion in ruhenden Mastzellen |
Klinische Bedeutung
Parasitäre Infektionen
Mastzellen werden als Reaktion auf eine Infektion mit pathogenen Parasiten, wie z. B. bestimmten Helminthen und Protozoen, durch IgE-Signale aktiviert. ⓘ
Störungen der Mastzellaktivierung
Mastzellaktivierungsstörungen (MCAD) sind ein Spektrum von Immunstörungen, die in keinem Zusammenhang mit einer pathogenen Infektion stehen und ähnliche Symptome aufweisen, die durch sezernierte Mastzellzwischenprodukte entstehen, sich aber in ihrer Pathophysiologie, ihrem Behandlungsansatz und ihren charakteristischen Symptomen leicht unterscheiden. Die Klassifizierung der Mastzellaktivierungsstörungen wurde 2010 festgelegt. ⓘ
Allergische Erkrankungen
Allergien werden durch IgE-Signale vermittelt, die die Mastzelldegranulation auslösen. In jüngster Zeit geht man davon aus, dass auch IgE-unabhängige "pseudoallergische" Reaktionen über die Aktivierung von Mastzellen durch den MRGPRX2-Rezeptor vermittelt werden (z. B. durch Medikamente wie Muskelrelaxantien, Opioide, Icatibant und Fluorchinolone). ⓘ
Viele Formen von Haut- und Schleimhautallergien werden zu einem großen Teil durch Mastzellen vermittelt; sie spielen eine zentrale Rolle bei Asthma, Ekzemen, Juckreiz (aus verschiedenen Gründen), allergischer Rhinitis und allergischer Konjunktivitis. Antihistaminika wirken durch Blockierung der Histaminwirkung an den Nervenenden. Medikamente auf Cromoglicat-Basis (Natriumcromoglicat, Nedocromil) blockieren einen Kalziumkanal, der für die Mastzelldegranulation wichtig ist, stabilisieren die Zelle und verhindern die Freisetzung von Histamin und verwandten Mediatoren. Leukotrien-Antagonisten (wie Montelukast und Zafirlukast) blockieren die Wirkung von Leukotrien-Mediatoren und werden zunehmend bei allergischen Erkrankungen eingesetzt. ⓘ
Kalzium löst die Sekretion von Histamin aus Mastzellen aus, nachdem diese zuvor Natriumfluorid ausgesetzt waren. Der Sekretionsprozess kann in einen Fluoridaktivierungsschritt und einen Calcium-induzierten Sekretionsschritt unterteilt werden. Es wurde beobachtet, dass der Fluorid-Aktivierungsschritt von einem Anstieg der zyklischen Adenosinmonophosphat (cAMP)-Spiegel in den Zellen begleitet wird. Die erreichten hohen cAMP-Konzentrationen bleiben während der Histaminfreisetzung bestehen. Es wurde ferner festgestellt, dass Katecholamine die fluoridinduzierte Histaminfreisetzung nicht wesentlich verändern. Es wurde auch bestätigt, dass der zweite, aber nicht der erste Schritt der durch Natriumfluorid induzierten Histaminausschüttung durch Theophyllin gehemmt wird. Die Vasodilatation und die erhöhte Permeabilität der Kapillaren sind auf die beiden Rezeptortypen H1 und H2 zurückzuführen. ⓘ
Die Stimulierung von Histamin aktiviert eine histamin(H2)-empfindliche Adenylatzyklase der Sauerstoffzellen, und es kommt zu einem raschen Anstieg des zellulären [cAMP], der an der Aktivierung des H+-Transports und anderen damit verbundenen Veränderungen der Sauerstoffzellen beteiligt ist. ⓘ
Anaphylaxie
Bei der Anaphylaxie (einer schweren systemischen Reaktion auf Allergene wie Nüsse, Bienenstiche oder Medikamente) führt die körpereigene Degranulation der Mastzellen zu einer Vasodilatation und, falls schwerwiegend, zu Symptomen eines lebensbedrohlichen Schocks. ⓘ
Histamin ist eine gefäßerweiternde Substanz, die bei Anaphylaxie freigesetzt wird. ⓘ
Autoimmunität
Mastzellen können an der Pathologie im Zusammenhang mit autoimmunen, entzündlichen Erkrankungen der Gelenke beteiligt sein. Sie sind nachweislich an der Rekrutierung von Entzündungszellen in den Gelenken (z. B. rheumatoide Arthritis) und der Haut (z. B. bullöses Pemphigoid) beteiligt, und diese Aktivität ist von Antikörpern und Komplementkomponenten abhängig. ⓘ
Mastozytose und klonale Störungen
Mastozytose ist eine seltene klonale Mastzellerkrankung, bei der zu viele Mastzellen (Mastozyten) und CD34+-Mastzellvorläufer vorhanden sind. Mutationen in c-Kit werden mit Mastozytose in Verbindung gebracht. ⓘ
Neoplastische Erkrankungen
Mastozytome oder Mastzelltumore können übermäßige Mengen von Degranulationsprodukten absondern. Sie treten häufig bei Hunden und Katzen auf. Andere neoplastische Erkrankungen, die mit Mastzellen in Verbindung gebracht werden, sind Mastzellsarkome und Mastzellleukämie. ⓘ
Mastzellen-Aktivierungssyndrom
Das Mastzellaktivierungssyndrom (MCAS) ist eine idiopathische Immunstörung, bei der es zu einer wiederkehrenden und übermäßigen Mastzelldegranulation kommt und die ähnliche Symptome wie andere Mastzellaktivierungsstörungen aufweist. Die Diagnose des Syndroms wird anhand von vier Kriterien gestellt, die das Ansprechen auf die Behandlung, die Symptome, eine Differenzialdiagnose und Biomarker der Mastzelldegranulation umfassen. ⓘ
Geschichte
Mastzellen wurden erstmals 1878 von Paul Ehrlich in seiner Doktorarbeit aufgrund ihrer einzigartigen Färbemerkmale und großen Granula beschrieben. Diese Körnchen führten ihn auch zu der irrigen Annahme, dass sie zur Ernährung des umliegenden Gewebes dienten, weshalb er sie Mastzellen nannte. Heute werden sie als Teil des Immunsystems betrachtet. ⓘ
Forschung
Autismus
Forschungen über einen immunologischen Beitrag zum Autismus deuten darauf hin, dass Kinder mit Autismus-Spektrum-Störungen (ASD) "allergieähnliche" Probleme aufweisen können, ohne dass erhöhte Serum-IgE-Werte und chronische Urtikaria vorliegen, was auf eine nichtallergische Aktivierung der Mastzellen als Reaktion auf Umwelt- und Stressauslöser hindeutet. Diese Mastzellenaktivierung könnte zur Entzündung des Gehirns und zu neurologischen Entwicklungsproblemen beitragen. ⓘ
Histologische Färbung
Toluidinblau: eine der gebräuchlichsten Färbungen für saure Mucopolysaccharide und Glykoaminoglykane, Bestandteile der Mastzellgranula. ⓘ
Bismarckbraun: färbt die Mastzellgranula braun. ⓘ
Oberflächenmarker: Zelloberflächenmarker von Mastzellen wurden von Henneberg ausführlich erörtert. Er behauptet, dass Mastzellen versehentlich in die Isolate von Stamm- oder Vorläuferzellen aufgenommen werden können, da ein Teil von ihnen positiv für das CD34-Antigen ist. Zu den klassischen Mastzellmarkern gehören der hochaffine IgE-Rezeptor, CD117 (c-Kit) und CD203c (für die meisten Mastzellpopulationen). Die Expression einiger Moleküle kann sich im Verlauf der Mastzellaktivierung ändern. ⓘ