Metastase
| Metastasierung ⓘ | |
|---|---|
| Andere Bezeichnungen | metastatische Erkrankung |
 | |
| Illustration einer hämatogenen Metastase | |
| Aussprache |
|
| Fachgebiet | Onkologie |
Unter Metastasierung versteht man die Ausbreitung eines Krankheitserregers von einem ursprünglichen oder primären Ort zu einem anderen oder sekundären Ort im Körper des Wirts; der Begriff wird in der Regel im Zusammenhang mit der Metastasierung durch einen Krebstumor verwendet. Die neuen pathologischen Stellen sind also Metastasen (Mets). Sie wird im Allgemeinen von der Krebsinvasion unterschieden, bei der es sich um die direkte Ausbreitung und das Eindringen von Krebszellen in benachbarte Gewebe handelt. ⓘ
Krebs entsteht, wenn die Zellen genetisch so verändert sind, dass sie sich schnell und unbegrenzt vermehren. Diese unkontrollierte Vermehrung durch Mitose führt zu einem heterogenen Primärtumor. Die Zellen, aus denen der Tumor besteht, durchlaufen schließlich eine Metaplasie, gefolgt von einer Dysplasie und einer Anaplasie, was zu einem bösartigen Phänotyp führt. Diese Bösartigkeit ermöglicht eine Invasion in den Blutkreislauf, gefolgt von einer Invasion an einen zweiten Ort der Tumorentstehung. ⓘ
Einige Krebszellen, die als zirkulierende Tumorzellen bezeichnet werden, sind in der Lage, die Wände von Lymph- oder Blutgefäßen zu durchdringen und über den Blutkreislauf zu anderen Stellen und Geweben im Körper zu gelangen. Dieser Vorgang wird als lymphatische bzw. hämatogene Ausbreitung bezeichnet. Nachdem die Tumorzellen an einer anderen Stelle zur Ruhe gekommen sind, dringen sie erneut in das Gefäß oder die Gefäßwände ein, vermehren sich weiter und bilden schließlich einen weiteren klinisch nachweisbaren Tumor. Dieser neue Tumor wird als metastasierender (oder sekundärer) Tumor bezeichnet. Die Metastasierung ist eines der charakteristischen Merkmale von Krebs und unterscheidet ihn von gutartigen Tumoren. Die meisten Krebsarten können metastasieren, wenn auch in unterschiedlichem Ausmaß. Das Basalzellkarzinom beispielsweise metastasiert selten. ⓘ
Wenn Tumorzellen metastasieren, wird der neue Tumor als sekundärer oder metastasierender Tumor bezeichnet, und seine Zellen ähneln denen des ursprünglichen oder primären Tumors. Das heißt, wenn Brustkrebs in die Lunge metastasiert, besteht der sekundäre Tumor aus abnormen Brustzellen, nicht aus abnormen Lungenzellen. Der Tumor in der Lunge wird dann als metastasierender Brustkrebs und nicht als Lungenkrebs bezeichnet. Die Metastasierung ist ein Schlüsselelement in Krebsstadiensystemen wie dem TNM-Stadiensystem, wo sie das "M" darstellt. In der allgemeinen Stadieneinteilung wird ein Krebs aufgrund von Metastasen in Stadium IV eingestuft. Die Möglichkeiten einer kurativen Behandlung sind stark eingeschränkt oder oft ganz ausgeschlossen, wenn ein Krebs Metastasen gebildet hat. ⓘ
| Klassifikation nach ICD-10 | |
|---|---|
| C77 | Sekundäre und nicht näher bezeichnete bösartige Neubildung der Lymphknoten |
| C78 | Sekundäre bösartige Neubildung der Atmungs- und Verdauungsorgane |
| C79 | Sekundäre bösartige Neubildung an sonstigen Lokalisationen |
| ICD-10 online (WHO-Version 2019) | |
Als Metastase (altgriechisch μετάστασις metástasis, „Wanderung, Verlagerung“) wird in der Medizin die Absiedelung eines krankhaften Geschehens in einem vom Ursprungsherd der Krankheit entfernten Körperteil bezeichnet. Meistens erfolgt eine solche Verschleppung, etwa von Tumorzellen („Geschwulstkeimen“), über das Blut oder die Lymphe im Zusammenhang mit einer Krebserkrankung. ⓘ
- In der Onkologie wird die Absiedelung eines bösartigen soliden Tumors in entferntem Gewebe als Metastase (auch Geschwulstmetastase) bezeichnet. Man spricht auch von einer Tochtergeschwulst oder Filia, Plural Filiae (lat. filia bedeutet „Tochter“). Bei bösartigen Erkrankungen des Blutes und Lymphsystems (Maligne Lymphome) spricht man nicht von Metastasen, da die Krebszellen aus Immunzellen hervorgehen, die kein Gewebe bilden und von Natur aus mobil sind. Man bezeichnet daher die verschiedenen Ansammlungen von Lymphom-Zellen als Manifestationen, weil sich die Krebserkrankung dort zeigt.
- Seltener wird die Bezeichnung Metastase auch für die septische Streuung von Krankheitserregern benutzt, also für die Absiedelung von einem Infektionsherd bei einer Infektionserkrankung. Beispiel: die Streuung einer Endokarditis in zahlreiche Organe. ⓘ
Hier wird nur der Begriff Metastase im engeren Sinne von Geschwulstmetastase behandelt. ⓘ

Anzeichen und Symptome

Zunächst werden nahe gelegene Lymphknoten früh befallen. Die Lunge, die Leber, das Gehirn und die Knochen sind die häufigsten Metastasierungsorte bei soliden Tumoren. ⓘ
- Bei Lymphknotenmetastasen ist ein häufiges Symptom die Lymphadenopathie
- Lungenmetastasen: Husten, Bluthusten und Dyspnoe (Kurzatmigkeit)
- Lebermetastasen: Hepatomegalie (vergrößerte Leber), Übelkeit und Gelbsucht
- Knochenmetastasen: Knochenschmerzen,[1]Bruch der betroffenen Knochen
- Hirnmetastasen: neurologische Symptome wie Kopfschmerzen, Krampfanfälle und Schwindel ⓘ
Obwohl Krebs im fortgeschrittenen Stadium Schmerzen verursachen kann, sind diese oft nicht das erste Symptom. ⓘ
Manche Patienten zeigen jedoch keinerlei Symptome. Wenn ein Organ metastasiert ist, beginnt es zu schrumpfen, bis die Lymphknoten platzen oder eine Lyse stattfindet. ⓘ
Pathophysiologie
Metastasierende Tumore sind in den späten Stadien von Krebserkrankungen sehr häufig. Die Ausbreitung der Metastasen kann über das Blut oder die Lymphbahnen oder über beide Wege erfolgen. Die häufigsten Orte für Metastasen sind die Lunge, die Leber, das Gehirn und die Knochen. ⓘ
Derzeit gibt es drei Haupttheorien zur Erklärung des Metastasierungsweges von Krebs: die Hypothese des epithelial-mesenchymalen Übergangs (EMT) und des mesenchymal-epithelialen Übergangs (MET) (1), die Krebsstammzellenhypothese (2) und die Makrophagen-Krebszellen-Fusionshybridhypothese (3). Es wurden auch einige neue Hypothesen vorgeschlagen, z. B. dass Krebszellen unter der Einwirkung bestimmter biochemischer und/oder physikalischer Stressfaktoren eine Kernausstoßung mit anschließender Makrophagenverschlingung und -fusion erfahren können, wobei Krebsfusionszellen (CFCs) entstehen. ⓘ
Beteiligte Faktoren
Bei der Metastasierung handelt es sich um eine komplexe Abfolge von Schritten, bei denen Krebszellen den ursprünglichen Tumorort verlassen und über den Blutkreislauf, das Lymphsystem oder durch direkte Ausbreitung in andere Teile des Körpers wandern. Dazu lösen sich die bösartigen Zellen vom Primärtumor und heften sich an die Proteine der umgebenden extrazellulären Matrix (ECM), die den Tumor von den angrenzenden Geweben trennt, und bauen sie ab. Durch den Abbau dieser Proteine sind die Krebszellen in der Lage, die ECM zu durchbrechen und zu entkommen. Die Lage der Metastasen ist nicht immer zufällig, da verschiedene Krebsarten dazu neigen, sich in bestimmten Organen und Geweben schneller auszubreiten, als es der statistische Zufall erwarten lässt. Brustkrebs zum Beispiel neigt dazu, in den Knochen und in der Lunge zu metastasieren. Diese Spezifität scheint durch lösliche Signalmoleküle wie Chemokine und den transformierenden Wachstumsfaktor beta vermittelt zu werden. Der Körper wehrt sich gegen die Metastasierung durch eine Reihe von Mechanismen, die auf eine Klasse von Proteinen zurückzuführen sind, die als Metastasenunterdrücker bekannt sind und von denen etwa ein Dutzend bekannt sind. ⓘ
Menschliche Zellen weisen verschiedene Arten der Bewegung auf: kollektive Motilität, mesenchymale Bewegung und amöboide Bewegung. Krebszellen wechseln oft opportunistisch zwischen den verschiedenen Bewegungsarten hin und her. Einige Krebsforscher hoffen, Behandlungen zu finden, die die Ausbreitung von Krebs stoppen oder zumindest verlangsamen können, indem sie einen notwendigen Schritt in einer oder mehreren Bewegungsarten irgendwie blockieren. ⓘ
An allen Schritten der Metastasierungskaskade sind eine Reihe physikalischer Prozesse beteiligt. Die Zellwanderung erfordert die Erzeugung von Kräften, und wenn Krebszellen durch das Gefäßsystem wandern, müssen sich physische Lücken in den Blutgefäßen bilden. Neben den Kräften ist auch die Regulierung verschiedener Arten von Zell-Zell- und Zell-Matrix-Adhäsionen während der Metastasierung von entscheidender Bedeutung. ⓘ
Die Metastasierungsschritte werden von verschiedenen Zelltypen, wie den Blutgefäßzellen (Endothelzellen), Immunzellen oder Stromazellen, entscheidend reguliert. Das Wachstum eines neuen Netzwerks von Blutgefäßen, die so genannte Tumorangiogenese, ist ein entscheidendes Merkmal von Krebs. Es wurde daher vorgeschlagen, dass Angiogenesehemmer das Wachstum von Metastasen verhindern könnten. Es hat sich gezeigt, dass endotheliale Vorläuferzellen einen starken Einfluss auf die Metastasierung und Angiogenese haben. Endotheliale Vorläuferzellen sind wichtig für das Tumorwachstum, die Angiogenese und die Metastasierung und können mit dem Inhibitor of DNA Binding 1 (ID1) markiert werden. Diese neuartige Entdeckung ermöglichte es den Forschern, endotheliale Vorläuferzellen vom Knochenmark über das Blut bis hin zum Tumorstroma und sogar in die Tumorgefäße zu verfolgen. Die Aufnahme von endothelialen Vorläuferzellen in die Tumorgefäße deutet darauf hin, dass dieser Zelltyp bei der Entwicklung von Blutgefäßen in einem Tumor und bei der Metastasierung eine wichtige Rolle spielt. Darüber hinaus kann die Entfernung endothelialer Vorläuferzellen im Knochenmark zu einer deutlichen Verringerung des Tumorwachstums und der Entwicklung von Blutgefäßen führen. Daher sind endotheliale Vorläuferzellen wichtig für die Tumorbiologie und stellen neue therapeutische Ziele dar. Das Immunsystem ist in der Regel bei Krebs dereguliert und beeinflusst viele Stadien der Tumorprogression, einschließlich der Metastasierung. ⓘ
Auch die epigenetische Regulierung spielt eine wichtige Rolle für das metastatische Wachstum von gestreuten Tumorzellen. Metastasen weisen im Vergleich zu entsprechenden Primärtumoren Veränderungen in den Histonmodifikationen auf, wie z. B. H3K4-Methylierung und H3K9-Methylierung. Diese epigenetischen Veränderungen in Metastasen könnten die Vermehrung und das Überleben der gestreuten Tumorzellen in entfernten Organen ermöglichen. ⓘ
Eine aktuelle Studie zeigt, dass PKC-iota die Invasion von Melanomzellen durch die Aktivierung von Vimentin während der EMT fördert. Die Hemmung oder Ausschaltung von PKC-iota führte in metastatischen Melanomzellen zu einem Anstieg der E-Cadherin- und RhoA-Spiegel bei gleichzeitiger Abnahme von Gesamt-Vimentin, phosphoryliertem Vimentin (S39) und Par6. Diese Ergebnisse deuten darauf hin, dass PKC-ι an Signalwegen beteiligt ist, die die EMT in Melanomen hochregulieren und dadurch die Metastasierung direkt fördern. ⓘ
In jüngster Zeit deutet eine Reihe von viel beachteten Experimenten darauf hin, dass die durch Exosomen-Vesikel vermittelte Kooption des interzellulären Cross-Talks ein entscheidender Faktor ist, der an allen Schritten der Invasions-Metastasierungs-Kaskade beteiligt ist. ⓘ
Wege
Die Metastasierung erfolgt über die folgenden vier Wege: ⓘ
Transkoelomisch
Die Ausbreitung eines bösartigen Tumors in Körperhöhlen kann durch das Eindringen in die Oberfläche des Peritoneal-, Pleura-, Perikard- oder Subarachnoidalraums erfolgen. Ovarialtumoren können sich beispielsweise transperitoneal auf die Leberoberfläche ausbreiten. ⓘ
Lymphatische Ausbreitung
Die lymphatische Ausbreitung ermöglicht den Transport von Tumorzellen in regionale Lymphknoten in der Nähe des Primärtumors und schließlich in andere Teile des Körpers. Dies wird als nodale Beteiligung, positive Knoten oder regionale Erkrankung bezeichnet. "Positive Knoten" ist ein Begriff, der von Fachärzten verwendet wird, um regionale Lymphknoten zu beschreiben, die positiv auf Malignität getestet wurden. Es ist gängige medizinische Praxis, mindestens einen Lymphknoten in der Nähe eines Tumors durch eine Biopsie zu untersuchen, wenn eine Operation zur Untersuchung oder Entfernung eines Tumors durchgeführt wird. Dieser Lymphknoten wird dann als Sentinel-Lymphknoten bezeichnet. Die lymphatische Ausbreitung ist der häufigste Weg der Erstmetastasierung von Karzinomen. Bei Sarkomen ist eine Metastasierung über diesen Weg dagegen eher selten. Eine lokalisierte Ausbreitung in regionale Lymphknoten in der Nähe des Primärtumors wird normalerweise nicht als Metastase gewertet, obwohl dies ein Zeichen für ein schlechteres Ergebnis ist. Das Lymphsystem entwässert schließlich aus dem Ductus thoracicus und dem rechten Lymphgang in das systemische Venensystem am Venenwinkel und in die Brachiocephalusvenen, und daher können sich diese metastatischen Zellen schließlich auch über den hämatogenen Weg ausbreiten. ⓘ

Hämatogene Ausbreitung
Dies ist der typische Metastasierungsweg für Sarkome, aber auch für bestimmte Karzinome wie Nierenzellkarzinome, die von der Niere ausgehen, und follikuläre Schilddrüsenkarzinome ist dies der bevorzugte Weg. Aufgrund ihrer dünneren Wände werden Venen häufiger befallen als Arterien, und die Metastasierung folgt tendenziell dem Muster des venösen Flusses. Das heißt, die hämatogene Ausbreitung folgt oft unterschiedlichen Mustern, die von der Lage des Primärtumors abhängen. So breitet sich beispielsweise Darmkrebs hauptsächlich über die Pfortader in die Leber aus. ⓘ
Kanälchenförmige Ausbreitung
Einige Tumoren, insbesondere Karzinome, können entlang anatomischer Kanalräume metastasieren. Zu diesen Räumen gehören beispielsweise die Gallengänge, das Harnsystem, die Atemwege und der Subarachnoidalraum. Der Prozess ist ähnlich wie bei der transkoelomischen Ausbreitung. Oft bleibt jedoch unklar, ob es sich bei gleichzeitig diagnostizierten Tumoren eines kanalikulären Systems um einen einzigen metastatischen Prozess oder um unabhängige Tumoren handelt, die durch denselben Erreger verursacht werden (Feldkanzerisierung). ⓘ
Organspezifische Ziele

Bestimmte Tumoren neigen dazu, sich in bestimmten Organen anzusiedeln. Dies wurde erstmals 1889 von Stephen Paget als "seed and soil"-Theorie diskutiert. Die Neigung einer metastatischen Zelle, sich in einem bestimmten Organ auszubreiten, wird als "Organotropismus" bezeichnet. Prostatakrebs zum Beispiel metastasiert in der Regel in die Knochen. In ähnlicher Weise neigt Dickdarmkrebs dazu, in die Leber zu metastasieren. Magenkrebs metastasiert bei Frauen häufig in den Eierstock und wird dann als Krukenberg-Tumor bezeichnet. ⓘ
Nach der Theorie von "Saat und Boden" ist es für Krebszellen schwierig, außerhalb ihres Ursprungsgebiets zu überleben, so dass sie einen Ort mit ähnlichen Merkmalen finden müssen, um zu metastasieren. So metastasieren beispielsweise Brusttumorzellen, die Kalziumionen aus der Muttermilch aufnehmen, in das Knochengewebe, wo sie Kalziumionen aus den Knochen aufnehmen können. Das bösartige Melanom breitet sich im Gehirn aus, vermutlich weil Nervengewebe und Melanozyten im Embryo aus derselben Zelllinie hervorgehen. ⓘ
1928 stellte James Ewing die Theorie von "Saat und Boden" in Frage und schlug vor, dass die Metastasierung ausschließlich auf anatomischem und mechanischem Weg erfolgt. Diese Hypothese wurde in jüngster Zeit herangezogen, um mehrere Hypothesen über den Lebenszyklus zirkulierender Tumorzellen (CTCs) aufzustellen und zu postulieren, dass die Ausbreitungsmuster durch eine "Filter- und Fluss"-Perspektive besser verstanden werden könnten. Aktuelle Erkenntnisse deuten jedoch darauf hin, dass der Primärtumor organotrope Metastasen diktieren kann, indem er die Bildung prämetastatischer Nischen an entfernten Stellen induziert, in die sich die eindringenden metastatischen Zellen einnisten und ansiedeln können. Es hat sich gezeigt, dass von Tumoren abgesonderte Exosomenvesikel an prämetastatische Stellen wandern, wo sie pro-metastatische Prozesse wie die Angiogenese aktivieren und den Immunkontext verändern, um eine günstige Mikroumgebung für das sekundäre Tumorwachstum zu schaffen. ⓘ
Metastasierung und Primärkrebs
Man geht davon aus, dass eine Metastase immer mit einer primären Krebserkrankung einhergeht und als solche ein Tumor ist, der von einer oder mehreren Krebszellen in einem anderen Teil des Körpers ausgeht. Bei mehr als 10 % der Patienten, die sich in onkologischen Abteilungen vorstellen, werden jedoch Metastasen festgestellt, ohne dass ein Primärtumor vorliegt. In diesen Fällen bezeichnen die Ärzte den Primärtumor als "unbekannt" oder "okkult", und der Patient wird als Krebs unbekannten Ursprungs (CUP) oder unbekannter Primärtumor (UPT) bezeichnet. Man schätzt, dass 3 % aller Krebserkrankungen einen unbekannten primären Ursprung haben. Studien haben gezeigt, dass, wenn eine einfache Befragung keinen Aufschluss über den Ursprung des Krebses gibt (Husten von Blut - "wahrscheinlich Lunge", Urinieren von Blut - "wahrscheinlich Blase"), auch eine komplexe Bildgebung nichts bringt. In einigen dieser Fälle kann später ein Primärtumor auftreten. ⓘ
Mit Hilfe der Immunhistochemie können Pathologen viele dieser Metastasen identifizieren. Bei der Bildgebung des angegebenen Bereichs wird jedoch nur gelegentlich ein Primärtumor entdeckt. In seltenen Fällen (z. B. beim Melanom) wird selbst bei der Autopsie kein Primärtumor gefunden. Es wird daher angenommen, dass sich manche Primärtumore vollständig zurückbilden können, aber ihre Metastasen zurücklassen. In anderen Fällen kann der Tumor einfach zu klein sein und/oder sich an einer ungewöhnlichen Stelle befinden, um diagnostiziert zu werden. ⓘ
Diagnose

Die Zellen in einem metastatischen Tumor ähneln denen des Primärtumors. Wenn das Krebsgewebe unter dem Mikroskop untersucht wird, um den Zelltyp zu bestimmen, kann der Arzt in der Regel feststellen, ob dieser Zelltyp normalerweise in dem Teil des Körpers vorkommt, aus dem die Gewebeprobe entnommen wurde. ⓘ
Brustkrebszellen sehen beispielsweise gleich aus, unabhängig davon, ob sie in der Brust vorkommen oder sich in einem anderen Teil des Körpers ausgebreitet haben. Wenn also eine Gewebeprobe, die von einem Tumor in der Lunge entnommen wurde, Zellen enthält, die wie Brustzellen aussehen, stellt der Arzt fest, dass es sich bei dem Lungentumor um einen Sekundärtumor handelt. Dennoch kann die Bestimmung des Primärtumors oft sehr schwierig sein, und der Pathologe muss unter Umständen mehrere ergänzende Techniken anwenden, wie z. B. Immunhistochemie, FISH (fluoreszierende In-situ-Hybridisierung) und andere. Trotz des Einsatzes dieser Techniken bleibt der Primärtumor in einigen Fällen unerkannt. ⓘ
Metastasierende Krebserkrankungen können gleichzeitig mit dem Primärtumor oder erst Monate oder Jahre später entdeckt werden. Wenn bei einem Patienten, der in der Vergangenheit wegen Krebs behandelt wurde, ein zweiter Tumor gefunden wird, handelt es sich häufiger um eine Metastase als um einen anderen Primärtumor. ⓘ
Früher ging man davon aus, dass die meisten Krebszellen ein geringes Metastasierungspotenzial haben und dass es seltene Zellen gibt, die durch die Entwicklung somatischer Mutationen die Fähigkeit zur Metastasierung entwickeln. Nach dieser Theorie ist die Diagnose von metastasierenden Krebsarten erst nach dem Auftreten von Metastasen möglich. Mit den herkömmlichen Mitteln der Krebsdiagnose (z. B. einer Biopsie) würde nur eine Teilpopulation der Krebszellen untersucht und höchstwahrscheinlich keine Proben aus der Teilpopulation mit Metastasierungspotenzial entnommen. ⓘ
Die Theorie der somatischen Mutation bei der Entstehung von Metastasen hat sich bei menschlichen Krebserkrankungen nicht bestätigt. Vielmehr scheint es, dass der genetische Zustand des Primärtumors die Fähigkeit des Krebses zur Metastasierung widerspiegelt. Beim Vergleich der Genexpression zwischen primären und metastasierenden Adenokarzinomen wurde eine Untergruppe von Genen identifiziert, deren Expression Primärtumore von metastasierenden Tumoren unterscheiden kann, die so genannte "metastatische Signatur". Zu den hochregulierten Genen in der Signatur gehören: SNRPF, HNRPAB, DHPS und Securin. Eine Herabregulierung von Aktin, Myosin und MHC-Klasse II wurde ebenfalls mit der Signatur in Verbindung gebracht. Darüber hinaus wurde die mit Metastasen assoziierte Expression dieser Gene auch in einigen Primärtumoren beobachtet, was darauf hindeutet, dass Zellen mit dem Potenzial zur Metastasierung bereits bei der Diagnose des Primärtumors identifiziert werden können. Kürzlich wurde eine Form der genetischen Instabilität bei Krebs, die so genannte Chromosomeninstabilität (CIN), als eine treibende Kraft für die Metastasierung identifiziert. In aggressiven Krebszellen gelangen lose DNA-Fragmente von instabilen Chromosomen in das Zytosol, was zu einer chronischen Aktivierung angeborener Immunwege führt, die von den Krebszellen zur Ausbreitung in entfernte Organe genutzt werden. ⓘ
Die Ausprägung dieser metastatischen Signatur wurde mit einer schlechten Prognose in Verbindung gebracht und hat sich bei verschiedenen Krebsarten als konsistent erwiesen. Es hat sich gezeigt, dass die Prognose bei Personen, deren Primärtumoren die metastatische Signatur aufweisen, schlechter ist. Außerdem zeigte sich, dass die Expression dieser metastasenassoziierten Gene nicht nur für Adenokarzinome, sondern auch für andere Krebsarten gilt. Metastasen von Brustkrebs, Medulloblastom und Prostatakrebs wiesen alle ähnliche Expressionsmuster dieser Metastasen-assoziierten Gene auf. ⓘ
Die Identifizierung dieser Metastasen-assoziierten Signatur verspricht, Zellen mit Metastasierungspotenzial im Primärtumor zu identifizieren und die Prognose dieser metastasierungsassoziierten Krebsarten zu verbessern. Darüber hinaus bietet die Identifizierung der Gene, deren Expression bei der Metastasierung verändert ist, potenzielle Angriffspunkte zur Hemmung der Metastasierung. ⓘ
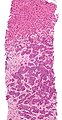
Mikroskopische Aufnahme eines Schilddrüsenkrebses (papilläres Schilddrüsenkarzinom) in einem Lymphknoten des Halses. H&E-Färbung
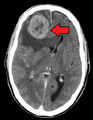
Durch Leberbiopsie nachgewiesene Metastase (Tumor (Adenokarzinom) in den unteren zwei Dritteln des Bildes). H&E-Färbung.
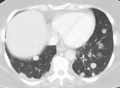
Metastasen von der Lunge in die Bauchspeicheldrüse ⓘ
Behandlung
Die Behandlung und das Überleben hängen weitgehend davon ab, ob ein Krebs lokalisiert bleibt oder sich auf andere Stellen im Körper ausbreitet oder nicht. Wenn der Krebs in andere Gewebe oder Organe metastasiert, erhöht sich die Sterbewahrscheinlichkeit des Patienten in der Regel drastisch. Einige Krebsarten - wie einige Formen von Leukämie, Blutkrebs oder bösartige Erkrankungen des Gehirns - können tödlich sein, ohne sich auszubreiten. ⓘ
Wenn ein Krebs bereits Metastasen gebildet hat, kann er mit Radiochirurgie, Chemotherapie, Strahlentherapie, biologischer Therapie, Hormontherapie, Operation oder einer Kombination dieser Maßnahmen ("multimodale Therapie") behandelt werden. Die Wahl der Behandlung hängt von vielen Faktoren ab, u. a. von der Art des primären Krebses, der Größe und Lage der Metastasen, dem Alter und dem allgemeinen Gesundheitszustand des Patienten sowie den zuvor verwendeten Behandlungsarten. Bei Patienten, bei denen eine CUP diagnostiziert wurde, ist es oft möglich, die Krankheit auch dann zu behandeln, wenn der Primärtumor nicht gefunden werden kann. ⓘ
Die derzeitigen Behandlungen sind nur selten in der Lage, metastasierenden Krebs zu heilen, obwohl einige Tumoren, wie Hodenkrebs und Schilddrüsenkrebs, in der Regel heilbar sind. ⓘ
Die Palliativmedizin, die darauf abzielt, die Lebensqualität von Menschen mit schweren Erkrankungen zu verbessern, wurde als Teil der Behandlungsprogramme für Metastasen empfohlen. Die Ergebnisse einer systematischen Überprüfung der Literatur zur Strahlentherapie bei Hirnmetastasen ergaben, dass es nur wenige Belege für die vergleichende Wirksamkeit und patientenzentrierte Ergebnisse zur Lebensqualität, zum funktionellen Status und zu kognitiven Auswirkungen gibt. ⓘ
Forschung
Obwohl allgemein angenommen wird, dass die Metastasierung das Ergebnis der Wanderung von Tumorzellen ist, gibt es eine Hypothese, die besagt, dass einige Metastasen das Ergebnis von Entzündungsprozessen durch abnorme Immunzellen sind. Das Vorhandensein von Metastasen bei fehlenden Primärtumoren deutet auch darauf hin, dass die Metastasierung nicht immer durch bösartige Zellen verursacht wird, die den Primärtumor verlassen. ⓘ
Die von Sarnas Team durchgeführten Untersuchungen haben gezeigt, dass stark pigmentierte Melanomzellen einen Elastizitätsmodul von 4,93 haben, während er bei nicht pigmentierten Zellen nur 0,98 beträgt. In einem weiteren Experiment stellten sie fest, dass die Elastizität von Melanomzellen für ihre Metastasierung und ihr Wachstum wichtig ist: Nicht pigmentierte Tumore waren größer als pigmentierte und konnten sich viel leichter ausbreiten. Sie zeigten, dass es in Melanomtumoren sowohl pigmentierte als auch nicht-pigmentierte Zellen gibt, so dass sie sowohl arzneimittelresistent als auch metastasierend sein können. ⓘ
Geschichte
Im März 2014 entdeckten Forscher das älteste vollständige Beispiel eines Menschen mit metastasierendem Krebs. Die Tumore hatten sich in einem 3.000 Jahre alten Skelett entwickelt, das 2013 in einem Grab im Sudan gefunden wurde, das auf das Jahr 1200 v. Chr. zurückgeht. Das Skelett wurde mit Hilfe von Röntgenaufnahmen und einem Rasterelektronenmikroskop untersucht. Diese Ergebnisse wurden in der Zeitschrift Public Library of Science veröffentlicht. ⓘ
Etymologie
Metastase ist ein griechisches Wort und bedeutet "Verschiebung", von μετά, meta, "nächst", und στάσις, stasis, "Platzierung". ⓘ
Bedeutung
Die Fähigkeit eines Tumors zur Metastasierung (Bildung von Metastasen) verschlechtert die Heilungschancen einer Krebserkrankung erheblich. Schon sehr kleine Tumoren können metastasieren, z. B. ein Brustkrebs von einem Zentimeter Durchmesser in 20 % aller Fälle. Durchschnittlich werden bei 30 % aller Patienten mit Malignomen Metastasen schon bei der Erstdiagnose festgestellt. Bei weiteren 30 % findet man sie erst im weiteren Behandlungsverlauf. Bei Vorliegen von sichtbaren Fernmetastasen sind in der Regel zahlreiche Mikrometastasen vorhanden, was die Prognose erheblich verschlechtert. ⓘ
Entstehung
Metastasen entstehen, indem sich Krebszellen vom ursprünglichen Tumor ablösen, mit dem Blut oder mit der Lymphe wandern und sich in anderen Körperteilen wieder ansiedeln und vermehren. Je nach dem Ausbreitungsweg heißen sie hämatogene (Blut) oder lymphogene (Lymphe) Metastasen. Ob Krebszellen metastasieren, hängt nach neuesten Forschungsergebnissen von ihrer Fähigkeit ab, embryonale Transkriptionsfaktoren einzuleiten. ⓘ
Invasion
Voraussetzung für die Metastasierung ist, dass der Krebs invasiv wächst, d. h. in angrenzende Strukturen hinein mit Durchbruch in Blut- oder Lymphgefäße. Gutartige Tumoren metastasieren definitionsgemäß niemals. Aber auch nicht jeder invasiv wachsende Tumor verursacht Metastasen. Wenn ein solcher Tumor keine Metastasen bildet, bezeichnet man ihn als semimaligne („halb bösartig“). Dies ist beispielsweise bei Basalzellenkrebs der Fall. ⓘ
Solange ein Tumor keine Metastasen bildet, bezieht sich der Begriff Invasion auf sein Wachstum in umgebendes Gewebe hinein. Normalerweise wird in diesem Sinne zwischen Invasion und Metastasierung (Metastasenbildung) unterschieden. Man kann aber auch das Eindringen der Metastasen in andere Regionen des Körpers als Invasion bezeichnen und den Begriff in diesem Sinne weiter fassen. ⓘ
Die Fähigkeit, körpereigene Sperren wie die Basalmembran oder die Blut-Hirn-Schranke zu durchdringen, ein Blut- oder Lymphgefäß aktiv aufzusuchen (Chemotaxis), in das Gefäß einzudringen, sich während der Wanderung im Blut gegen das körpereigene Immunsystem zu wehren, andernorts das Gefäß zu verlassen und sich schließlich zu vermehren, wird als Invasivität bezeichnet. Sie ist eine aktive Leistung maligner Krebszellen, und zwar abhängig von den jeweiligen genetischen Besonderheiten des individuellen Tumors. Nur etwa 0,01 % aller im Blut zirkulierenden Krebszellen schaffen es schließlich, eine metastatische Kolonie zu bilden. ⓘ
Die biochemischen Vorgänge, die bestimmte Zellen zur Metastasierung befähigen und andere nicht, sind Gegenstand intensiver Forschung. Es konnte z. B. gezeigt werden, dass die verminderte Expression von Cadherinen („Klebemolekülen“) auf ihrer Zellmembran die Tumorzellen beweglicher macht. Für die Anheftung der Zellen im Zielgebiet sollen andere Membranstrukturen, die sogenannten Integrine, eine Rolle spielen. Es sind bereits Onkogene und Tumorsuppressorgene identifiziert worden, deren Expression die Metastasierungstendenz erhöhen bzw. senken kann. ⓘ
Darüber hinaus zeigen erste Untersuchungen, dass die in Palmöl enthaltene Palmitinsäure die Metastasierung fördern kann. Auch besitzen metastasierte Krebszellen spezielle Fettrezeptoren, um sich abseits des Tumors mit Nahrung versorgen zu können. Dies konnte für Eierstock-, Blasen – und Lungenkrebs nachgewiesen werden. Es sind jedoch noch klinische Studien nötig, um letztendlich sagen zu können, dass auch eine palmitinsäurearme Ernährung den Metastasierungsprozess verlangsamt. ⓘ
Passiv (etwa durch Biopsienadeln) abgelöste und verschleppte Tumorzellen verursachen nur sehr selten Metastasen. ⓘ
Im Blut zirkulierende Krebszellen
Neuere Diagnoseverfahren wie die Liquid Biopsy belegen die Wichtigkeit der zirkulierenden Tumorzellen epithelialen Ursprungs (CETC, circulating epithelial tumor cells). In der adjuvanten Situation, das heißt nach der operativen Entfernung des Primärtumors, werden verschiedene Chemotherapieverfahren eingesetzt, um die restlichen im Körper verbliebenen und im Blut zirkulierenden Tumorzellen zu vernichten. Im Jahr 2005 zeigten Gianni Bonadonna und Kollegen, dass ca. 50 % der Chemotherapien zu keinen wesentlich erhöhten Lebensverlängerungen bei den Patienten geführt haben. Dieses Ergebnis kann darauf zurückgeführt werden, dass bei der Auswahl der Chemotherapeutika auf eine Biopsie des Primärtumors zurückgegriffen wird. Einige Wissenschaftler nehmen mittlerweile an, dass die Auswahl der nach den S3-Leitlinien zur Verfügung stehenden Therapeutika mittels Chemosensitivitätstests (In-vitro-Bluttests, bei denen die Absterberate der Tumorzellen unter Zugabe der Therapeutika in einer Blutprobe vor Verabreichung getestet werden) die Wirkungswahrscheinlichkeit der Therapeutika stark verbessern könnte. ⓘ
Organotropie
Der erste Zielort für Metastasen liegt in der Regel stromabwärts, also für Tumoren der Körperwand und Extremitäten in der Lunge und im Gehirn, für Tumoren des Darmes in der Leber (denn das vom Darm kommende Blut fließt zunächst in die Leber und dann erst zum Herzen zurück). Die Lymphgefäße führen zu Lymphknoten, die meist in räumlicher Nähe zum Tumor liegen, für den Brustkrebs z. B. in der Achselhöhle. Es ist aber durchaus möglich, dass ein erster Zielort übersprungen wird. Manche Tumorarten metastasieren in ganz spezifische Organe, etwa Lungenkrebs in die Nebennieren, offenbar infolge von Oberflächeneigenschaften der Krebszellen. Dieser Zielmechanismus (Organotropie, homing tumors) ist noch nicht völlig verstanden. ⓘ
Knochenabbau und Angiogenese
Bei osteoklastischen Knochenmetastasen beeinflussen die Tumorzellen die körpereigenen Osteoklasten so, dass diese vermehrt Knochenhartsubstanz abbauen, um das weitere Wachstum der Metastase zu ermöglichen. Nach heutigem Wissensstand sind metastasierende Krebszellen im Gegensatz zu anderen Zellen außerdem dazu in der Lage, umgebende Blutgefäße zum Aussprossen zu veranlassen (Angiogenese). Nur deswegen kann die neue Metastase mit Blut versorgt werden. Tumoren ohne angiogenetische Fähigkeit werden nicht größer als 0,3 mm. ⓘ
Einteilung von Metastasen
Man unterscheidet gemäß der TNM-Klassifikation lokale Metastasen, regionäre Metastasen und Fernmetastasen:
- Lokale Metastasen entstehen in unmittelbarer Nähe des Primärtumors durch Verschleppung von bösartigen Tumorzellen in das umgebende Gewebe, auch über Organgrenzen hinweg. Solche durch direkten Kontakt mit dem Tumor entstehenden Metastasen werden auch als Kontakt- oder Abklatschmetastasen bezeichnet. Diese Verschleppung kann auch über Stichkanäle oder Schnitte in Tumorgewebe begünstigt werden, man spricht dann von Impfmetastasen. ⓘ
- Regionäre Metastasen entstehen in der Regel, wenn Tumorzellverbände in die Lymphgefäße abschilfern und sich in den organ- und lagespezifischen Lymphknoten festsetzen. Die Erfassung von regionären Lymphknotenmetastasen erfolgt in der TNM-Klassifikation durch die N-Kategorie. Bei regionären Lymphknotenmetastasen spricht man auch von lymphogenen Metastasen. ⓘ
- Fernmetastasen entstehen analog dazu, wenn Tumorzellverbände in Venen abschilfern und in entfernten Organen absiedeln oder durch Abtropfung oder Abklatschung von Tumorzellen in Körperhöhlen. Klassisches Beispiel für eine Abtropfmetastase ist der Krukenberg-Tumor eines Siegelringkarzinoms des Magens mit zumeist beidseitigen Fernmetastasen an den Ovarien. Fernmetastasen über den Blutweg werden hämatogene Metastasen genannt. Die Erfassung von Fernmetastasen erfolgt in der TNM-Klassifikationen durch die M-Kategorie. ⓘ
Je nach Lokalisation und histologischem Typ metastasieren maligne Tumoren in unterschiedlichem Maße lymphogen und hämatogen. Lymphogene Metastasierung kann durch den Wachstumsfaktor VEGF-C vermittelt werden. Auch die Lokalisation von Fernmetastasen ist in großem Maße abhängig von Histologie und Lokalisation des Primärtumors. Nach dem gegenwärtigen Kenntnisstand können Fernmetastasen selbst keine Metastasen bilden. Sie entstehen offensichtlich ausschließlich aus Zellen des Primärtumors. ⓘ
Ist ein ganzes Organ, beziehungsweise eine Körperhöhle diffus von Tumorzellen durchsetzt, bezeichnet man dies als Karzinose (oder Karzinomatose). Beispiel: Bauchfellkarzinose bei Darmkrebs. ⓘ
Lokalisation von Fernmetastasen


Verschiedene Organe haben verschiedene bevorzugte Lokalisationen der Fernmetastasen. In der Regel wird dabei der Pfortader- vom Cava-Typ unterschieden.
- Zum Pfortadertyp zählen die malignen Tumoren der Organe des Verdauungstrakts (untere Speiseröhre, Magen, Bauchspeicheldrüse, Dünn- und Dickdarm, oberer Mastdarm), welche bevorzugt in die Leber metastasieren, weil ihr venöses Blut über die Pfortader erst in die Leber und dann in die Vena cava inferior gelangt. Alternativ können lymphogene und Abklatschmetastasen am Peritoneum vorkommen. Das Maximalbild zahlreicher Peritonealmetastasen wird Peritonealkarzinose genannt. Streng genommen handelt es sich dabei nur um Metastasen eines Karzinoms, die allerdings die weitaus größte Gruppe maligner gastrointestinaler Tumoren ausmachen. Beim Pfortadertyp können Metastasen auch in denselben Organen vorkommen wie beim Cava-Typ (siehe unten). Es handelt sich dann in der Regel um sekundäre Metastasen, die von einer Lebermetastase ausgehen und nicht vom Primärtumor.
- Die meisten anderen Krebsarten gehören zum Cava-Typ. Sie metastasieren am ehesten in Skelett, Gehirn und Lunge, aber auch in die Leber und Milz. ⓘ
Einige Tumoren haben ihren ersten Metastasierungsort typischerweise im Knochen, so Prostata (Lendenwirbel- und Beckenbereich), Brustdrüse (Wirbelsäule), Nieren. ⓘ
Verschiedene Tumoren metastasieren auch häufig in die Haut, es handelt sich dabei vor allem um Metastasen des malignen Melanoms sowie anderer Hauttumoren. Auch Lymphome befallen häufig die Haut, allerdings bezeichnet man diesen Befall durch eine Systemerkrankung nicht als Metastase. ⓘ
Fast niemals von Metastasen betroffen sind Herz, Milz und Nieren. Das ist eine erstaunliche Tatsache, weil diese Organe einen hohen Blutdurchfluss haben. Warum sie seltener befallen werden, ist nicht sicher geklärt. Ebenfalls eher selten sind Metastasen in anderen Organen wie Bauchspeicheldrüse, Magen, Darm (außer durch lokales Wachstum), Schilddrüse, Thymus und Nebenniere. ⓘ
Untersuchungsmethoden
Bei Krebserkrankungen werden neben dem Primärtumor in der Regel die Lymphknoten der Abflussbahn und „suspekte“ Lymphknoten aus der vorhergehenden Diagnostik (körperliche Untersuchung, Computertomografie, Magnetresonanztomografie) mit entnommen und histopathologisch auf regionäre Metastasen untersucht. Bei unklarer Lymphabflussbahn, z. B. bei Hauttumoren, wird über das Einspritzen radioaktiv markierter Farbe der Sentinel-Knoten („Wächterknoten“) mittels Geigerzähler und Farbmarkierung operativ aufgesucht. Lymphknotenmetastasen verschlechtern die Prognose und führen bei kurativem Ansatz zu einer aggressiveren Therapie. ⓘ
Zur Lokalisation von Fernmetastasen werden bei gesichertem Primärtumor im Sinne eines Stagings routinemäßig folgende Untersuchungen veranlasst:
- Skelettszintigrafie zum Auffinden von osteoklastischen oder osteoblastischen Knochenmetastasen. Osteoklastische Metastasen zerstören Knochengewebe, osteoblastische regen über Zytokine ein lokales Knochenwachstum an (z. B. bei Prostatakarzinomen und Osteosarkomen).
- Computertomografie oder Magnetresonanztomografie der Bauch-, Thorax- und Schädelhöhle zum Auffinden von Leber-, Peritoneal-, Lungen- und Hirnmetastasen. Bei gastrointestinalen Tumoren wird dabei gleichzeitig der Befall lokoregionärer Lymphknoten im Bauchraum, bei Lungenkrebs der lokoregionären Lymphknoten im Brustraum untersucht.
- Lebersonografie zur Suche nach Lebermetastasen. ⓘ
Bei HNO-Tumoren gehört daneben zur Metastasensuche die Panendoskopie. Bei gynäkologischen und urologischen Tumoren ist ein lokoregionäres Tumorwachstum in umliegende Organe besonders häufig, deshalb ist die wichtigste Staginguntersuchung die Computertomografie des kleinen Beckens. ⓘ
- ↑ National Cancer Institute: Metastatic Cancer: Questions and Answers. Abgerufen am<rc-c2d-number> 2008-11-01</rc-c2d-number>