Leukämie
| Leukämie ⓘ | |
|---|---|
| Andere Namen | Leukämie |
 | |
| Ein mit Wright gefärbter Knochenmarkabstrich von einer Person mit akuter B-Zell-Lymphoblasten-Leukämie. | |
| Aussprache |
|
| Fachgebiet | Hämatologie und Onkologie |
| Symptome | Blutungen, Blutergüsse, Müdigkeit, Fieber, erhöhtes Risiko für Infektionen |
| Häufiges Auftreten | Alle Altersgruppen, am häufigsten in den 60er und 70er Jahren. Er ist der häufigste bösartige Krebs bei Kindern, aber die Heilungsraten sind bei ihnen auch höher. |
| Ursachen | Vererbung und Umweltfaktoren |
| Risikofaktoren | Rauchen, Familienanamnese, ionisierende Strahlung, bestimmte Chemikalien, frühere Chemotherapie, Down-Syndrom. |
| Diagnostische Methode | Blutuntersuchungen, Knochenmarksbiopsie |
| Behandlung | Chemotherapie, Strahlentherapie, gezielte Therapie, Knochenmarktransplantation, unterstützende Behandlung |
| Prognose | Fünf-Jahres-Überlebensrate 57 % (U.S.A.) |
| Häufigkeit | 2,3 Millionen (2015) |
| Todesfälle | 353,500 (2015) |
Leukämie (auch Leukämie, ausgesprochen /luːˈkiːmiːə/ loo-KEE-mee-ə) ist eine Gruppe von Blutkrebsarten, die in der Regel im Knochenmark beginnen und zu einer hohen Anzahl abnormaler Blutzellen führen. Diese Blutzellen sind nicht voll entwickelt und werden Blasten oder Leukämiezellen genannt. Zu den Symptomen können Blutungen und Blutergüsse, Knochenschmerzen, Müdigkeit, Fieber und ein erhöhtes Infektionsrisiko gehören. Diese Symptome sind auf einen Mangel an normalen Blutzellen zurückzuführen. Die Diagnose wird in der Regel durch Bluttests oder eine Knochenmarksbiopsie gestellt. ⓘ
Die genaue Ursache der Leukämie ist unbekannt. Man geht davon aus, dass eine Kombination aus genetischen Faktoren und (nicht erblichen) Umweltfaktoren eine Rolle spielt. Zu den Risikofaktoren gehören Rauchen, ionisierende Strahlung, bestimmte Chemikalien (wie Benzol), frühere Chemotherapie und das Down-Syndrom. Menschen, in deren Familie Leukämie vorkommt, haben ebenfalls ein höheres Risiko. Es gibt vier Haupttypen von Leukämie - die akute lymphatische Leukämie (ALL), die akute myeloische Leukämie (AML), die chronische lymphatische Leukämie (CLL) und die chronische myeloische Leukämie (CML) - sowie eine Reihe von weniger häufigen Formen. Leukämien und Lymphome gehören beide zu einer breiteren Gruppe von Tumoren, die das Blut, das Knochenmark und das lymphatische System befallen, den so genannten Tumoren des blutbildenden und lymphatischen Gewebes. ⓘ
Die Behandlung kann eine Kombination aus Chemotherapie, Strahlentherapie, zielgerichteter Therapie und Knochenmarktransplantation umfassen, zusätzlich zur unterstützenden und palliativen Pflege, falls erforderlich. Bestimmte Leukämiearten können mit einer abwartenden Haltung behandelt werden. Der Erfolg der Behandlung hängt von der Art der Leukämie und dem Alter des Patienten ab. In den Industrieländern haben sich die Ergebnisse verbessert. In den Vereinigten Staaten liegt die Fünfjahresüberlebensrate bei 65 %. Bei Kindern unter 15 Jahren in den Ländern der ersten Welt liegt die Fünfjahresüberlebensrate bei über 60 % oder sogar 90 %, je nach Art der Leukämie. Bei Kindern mit akuter Leukämie, die nach fünf Jahren krebsfrei sind, ist es unwahrscheinlich, dass der Krebs zurückkehrt. ⓘ
Im Jahr 2015 erkrankten weltweit 2,3 Millionen Menschen an Leukämie und 353 500 starben daran. Im Jahr 2012 erkrankten 352.000 Menschen neu daran. Sie ist die häufigste Krebsart bei Kindern, wobei drei Viertel der Leukämiefälle bei Kindern dem akuten lymphatischen Typ angehören. Über 90 % aller Leukämien werden jedoch bei Erwachsenen diagnostiziert, wobei CLL und AML bei Erwachsenen am häufigsten vorkommen. Sie treten häufiger in den Industrieländern auf. ⓘ
Einteilung
| Zelltyp | Akut | Chronisch ⓘ |
|---|---|---|
| Lymphozytäre Leukämie (oder "lymphoblastisch") |
Akute lymphoblastische Leukämie (ALL) |
Chronische lymphatische Leukämie (CLL) |
| Myeloische Leukämie ("myeloisch" oder "nicht-lymphozytär") |
Akute myeloische Leukämie (AML oder myeloblastisch) |
Chronische myeloische Leukämie (CML) |
Allgemeine Klassifizierung
Klinisch und pathologisch wird die Leukämie in verschiedene große Gruppen unterteilt. Die erste Unterteilung ist die in akute und chronische Formen:
- Die akute Leukämie ist durch eine rasche Zunahme der Zahl unreifer Blutzellen gekennzeichnet. Durch die daraus resultierende Überfüllung ist das Knochenmark nicht mehr in der Lage, gesunde Blutzellen zu produzieren, was zu einem niedrigen Hämoglobin- und Blutplättchenwert führt. Bei akuter Leukämie ist eine sofortige Behandlung erforderlich, da sich die bösartigen Zellen schnell vermehren und ansammeln und dann in den Blutkreislauf übergehen und sich auf andere Organe des Körpers ausbreiten. Die akute Leukämie ist die häufigste Form der Leukämie bei Kindern.
- Die chronische Leukämie ist durch eine übermäßige Ansammlung von relativ reifen, aber dennoch abnormen weißen Blutkörperchen gekennzeichnet. In der Regel dauert es Monate oder Jahre, bis die Krankheit fortschreitet, und die Zellen werden mit einer viel höheren Rate als normal produziert, was zu vielen abnormalen weißen Blutkörperchen führt. Während die akute Leukämie sofort behandelt werden muss, werden chronische Formen manchmal einige Zeit vor der Behandlung überwacht, um eine maximale Wirksamkeit der Therapie zu gewährleisten. Chronische Leukämie tritt meist bei älteren Menschen auf, kann aber in jeder Altersgruppe vorkommen. ⓘ
Außerdem werden die Krankheiten danach unterteilt, welche Art von Blutzellen betroffen ist. So werden Leukämien in lymphoblastische oder lymphozytäre Leukämien und myeloische oder myelogene Leukämien unterteilt:
- Bei lymphoblastischen oder lymphozytären Leukämien findet die krebsartige Veränderung in einer Art von Knochenmarkzellen statt, aus denen sich normalerweise Lymphozyten, also Zellen des Immunsystems zur Infektionsbekämpfung, bilden. Die meisten lymphozytären Leukämien betreffen einen bestimmten Subtyp von Lymphozyten, die B-Zellen.
- Bei myeloischen oder myelogenen Leukämien findet die krebsartige Veränderung in einer Art von Knochenmarkzellen statt, aus denen normalerweise rote Blutkörperchen, einige andere Arten von weißen Zellen und Blutplättchen gebildet werden. ⓘ
Kombiniert man diese beiden Klassifizierungen, ergeben sich insgesamt vier Hauptkategorien. Innerhalb jeder dieser Hauptkategorien gibt es in der Regel mehrere Unterkategorien. Schließlich gibt es noch einige seltenere Typen, die in der Regel nicht in dieses Klassifizierungsschema fallen. ⓘ
Spezifische Typen
- Die akute lymphoblastische Leukämie (ALL) ist die häufigste Leukämieart bei Kleinkindern. Sie betrifft auch Erwachsene, insbesondere über 65 Jahre. Zu den Standardbehandlungen gehören Chemotherapie und Strahlentherapie. Zu den Subtypen gehören die akute lymphatische Leukämie der Vorstufe B, die akute lymphatische Leukämie der Vorstufe T, die Burkitt-Leukämie und die akute biphenotypische Leukämie. Die meisten Fälle von ALL treten bei Kindern auf, 80 % der Todesfälle durch ALL treten jedoch bei Erwachsenen auf.
- Die chronische lymphatische Leukämie (CLL) betrifft am häufigsten Erwachsene über 55 Jahre. Manchmal tritt sie auch bei jüngeren Erwachsenen auf, aber fast nie bei Kindern. Zwei Drittel der betroffenen Personen sind Männer. Die Fünfjahresüberlebensrate liegt bei 85 %. Die Krankheit ist nicht heilbar, aber es gibt viele wirksame Behandlungsmöglichkeiten. Eine Unterform ist die prolymphozytäre B-Zell-Leukämie, eine aggressivere Krankheit.
- Die akute myeloische Leukämie (AML) tritt bei Erwachsenen weitaus häufiger auf als bei Kindern, und zwar bei Männern häufiger als bei Frauen. Sie wird mit Chemotherapie behandelt. Die Fünfjahresüberlebensrate liegt bei 20 %. Zu den Subtypen der AML gehören die akute promyelozytäre Leukämie, die akute myeloblastische Leukämie und die akute megakaryoblastische Leukämie.
- Die chronische myeloische Leukämie (CML) tritt vor allem bei Erwachsenen auf; eine sehr geringe Zahl von Kindern erkrankt ebenfalls an dieser Krankheit. Sie wird mit Imatinib (Glivec in Europa, Glivec in den Vereinigten Staaten) oder anderen Medikamenten behandelt. Die Fünfjahresüberlebensrate liegt bei 90 %. Eine Unterform ist die chronische myelomonozytäre Leukämie.
- Die Haarzellenleukämie (HCL) wird manchmal als Untergruppe der chronischen lymphatischen Leukämie betrachtet, lässt sich aber nicht genau in diese Kategorie einordnen. Etwa 80 % der Betroffenen sind erwachsene Männer. Es wurden keine Fälle bei Kindern gemeldet. HCL ist unheilbar, aber gut behandelbar. Die Überlebensrate beträgt 96 % bis 100 % nach zehn Jahren.
- Die prolymphozytäre T-Zell-Leukämie (T-PLL) ist eine sehr seltene und aggressive Leukämie bei Erwachsenen; es werden etwas mehr Männer als Frauen mit dieser Krankheit diagnostiziert. Trotz ihrer allgemeinen Seltenheit ist sie die häufigste Form der reifen T-Zell-Leukämie; fast alle anderen Leukämien betreffen B-Zellen. Sie ist schwer zu behandeln, und die mediane Überlebenszeit wird in Monaten gemessen.
- Die großkörnige lymphatische Leukämie kann entweder T-Zellen oder NK-Zellen betreffen; wie die Haarzellenleukämie, die ausschließlich B-Zellen betrifft, ist sie eine seltene und indolente (nicht aggressive) Leukämie.
- Die adulte T-Zell-Leukämie wird durch das humane T-lymphotrope Virus (HTLV) verursacht, ein Virus, das dem HIV ähnelt. Wie HIV infiziert HTLV CD4+ T-Zellen und vermehrt sich in ihnen; im Gegensatz zu HIV zerstört es sie jedoch nicht. Stattdessen "immortalisiert" HTLV die infizierten T-Zellen und verleiht ihnen die Fähigkeit, sich abnormal zu vermehren. Das humane T-Zell-Lymphotropie-Virus Typ I und II (HTLV-I/II) ist in bestimmten Regionen der Welt endemisch.
- Klonale Eosinophilie (auch klonale Hypereosinophilie genannt) ist eine Gruppe von Blutkrankheiten, die durch das Wachstum von Eosinophilen im Knochenmark, Blut und/oder anderen Geweben gekennzeichnet sind. Sie können präkanzerös oder krebsartig sein. Bei klonalen Eosinophilien handelt es sich um einen "Klon" von Eosinophilen, d. h. um eine Gruppe genetisch identischer Eosinophiler, die alle aus derselben mutierten Vorläuferzelle hervorgegangen sind. Diese Erkrankungen können sich zu einer chronischen eosinophilen Leukämie entwickeln oder mit verschiedenen Formen von myeloischen Neoplasmen, lymphoiden Neoplasmen, Myelofibrose oder dem myelodysplastischen Syndrom einhergehen. ⓘ
Prä-Leukämie
- Bei der transienten myeloproliferativen Erkrankung, die auch als transiente Leukämie bezeichnet wird, handelt es sich um die abnorme Proliferation eines Klons von nicht krebsartigen Megakaryoblasten. Die Krankheit beschränkt sich auf Personen mit Down-Syndrom oder genetischen Veränderungen, die denen des Down-Syndroms ähneln, entwickelt sich bei einem Baby während der Schwangerschaft oder kurz nach der Geburt und verschwindet innerhalb von 3 Monaten oder entwickelt sich in ~10 % der Fälle zu einer akuten megakaryoblastischen Leukämie. Die transiente myeloische Leukämie ist ein präleukämischer Zustand. ⓘ
Anzeichen und Symptome

Die häufigsten Symptome bei Kindern sind leichte Blutergüsse, blasse Haut, Fieber und eine vergrößerte Milz oder Leber. ⓘ
Die Schädigung des Knochenmarks durch die Verdrängung der normalen Knochenmarkzellen durch eine größere Anzahl unreifer weißer Blutkörperchen führt zu einem Mangel an Blutplättchen, die für die Blutgerinnung wichtig sind. Das bedeutet, dass Menschen mit Leukämie leicht blaue Flecken bekommen, übermäßig stark bluten oder stechende Blutungen (Petechien) entwickeln können. ⓘ
Die weißen Blutkörperchen, die an der Bekämpfung von Krankheitserregern beteiligt sind, können unterdrückt werden oder nicht mehr richtig funktionieren. Dies kann dazu führen, dass das Immunsystem des Betroffenen nicht mehr in der Lage ist, eine einfache Infektion zu bekämpfen, oder dass es beginnt, andere Körperzellen anzugreifen. Da die Leukämie das Immunsystem daran hindert, normal zu arbeiten, kommt es bei manchen Menschen zu häufigen Infektionen, die von entzündeten Mandeln, wunden Stellen im Mund oder Durchfall bis hin zu lebensbedrohlichen Lungenentzündungen oder opportunistischen Infektionen reichen. ⓘ
Schließlich führt der Mangel an roten Blutkörperchen zu einer Anämie, die zu Atemnot und Blässe führen kann. ⓘ
Bei manchen Menschen treten weitere Symptome auf, wie Fieber, Schüttelfrost, Nachtschweiß, Schwäche in den Gliedmaßen, Müdigkeit und andere übliche grippeähnliche Symptome. Manche Menschen leiden unter Übelkeit oder einem Völlegefühl aufgrund einer vergrößerten Leber und Milz, was zu einer ungewollten Gewichtsabnahme führen kann. Die von der Krankheit betroffenen Blasten können sich zusammenballen und in der Leber oder in den Lymphknoten anschwellen, was Schmerzen verursacht und zu Übelkeit führt. ⓘ
Wenn die leukämischen Zellen in das zentrale Nervensystem eindringen, können neurologische Symptome (vor allem Kopfschmerzen) auftreten. Ungewöhnliche neurologische Symptome wie Migräne, Krampfanfälle oder Koma können als Folge des Drucks auf den Hirnstamm auftreten. Alle mit Leukämie verbundenen Symptome können auch auf andere Krankheiten zurückgeführt werden. Daher wird Leukämie immer durch medizinische Tests diagnostiziert. ⓘ
Das Wort Leukämie, das "weißes Blut" bedeutet, leitet sich von der charakteristischen hohen Anzahl weißer Blutkörperchen ab, die bei den meisten Betroffenen vor der Behandlung vorhanden ist. Die hohe Anzahl weißer Blutkörperchen wird deutlich, wenn eine Blutprobe unter dem Mikroskop betrachtet wird, wobei die zusätzlichen weißen Blutkörperchen häufig unreif oder funktionsgestört sind. Die übermäßige Anzahl von Zellen kann auch den Spiegel anderer Zellen beeinträchtigen, was zu einem weiteren schädlichen Ungleichgewicht im Blutbild führt. ⓘ
Bei manchen Menschen, bei denen Leukämie diagnostiziert wurde, sind die hohen Werte der weißen Blutkörperchen bei einem normalen Blutbild nicht sichtbar. Dieser weniger häufige Zustand wird als Aleukämie bezeichnet. Das Knochenmark enthält immer noch krebsartige weiße Blutkörperchen, die die normale Produktion von Blutzellen stören, aber sie verbleiben im Knochenmark und gelangen nicht in den Blutkreislauf, wo sie bei einer Blutuntersuchung sichtbar wären. Bei einer Person mit Aleukämie kann die Anzahl der weißen Blutkörperchen im Blutkreislauf normal oder niedrig sein. Aleukämie kann bei jeder der vier Hauptleukämiearten auftreten und ist besonders häufig bei der Haarzellenleukämie. ⓘ
Ursachen
Für keine der verschiedenen Leukämiearten gibt es eine einzige bekannte Ursache. Die wenigen bekannten Ursachen, die im Allgemeinen keine Faktoren sind, auf die der Durchschnittsbürger Einfluss nehmen kann, machen relativ wenige Fälle aus. Die Ursache für die meisten Leukämiefälle ist unbekannt. Die verschiedenen Leukämien haben wahrscheinlich unterschiedliche Ursachen. ⓘ
Leukämie entsteht, wie andere Krebsarten auch, durch Mutationen in der DNA. Bestimmte Mutationen können Leukämie auslösen, indem sie Onkogene aktivieren oder Tumorsuppressorgene deaktivieren und dadurch die Regulierung des Zelltods, der Differenzierung oder der Zellteilung stören. Diese Mutationen können spontan oder als Folge einer Exposition gegenüber Strahlung oder krebserregenden Substanzen auftreten. ⓘ
Bei Erwachsenen sind die bekannten Ursachen natürliche und künstliche ionisierende Strahlung und einige Chemikalien, insbesondere Benzol und alkylierende Chemotherapeutika für frühere bösartige Erkrankungen. Der Tabakkonsum ist mit einem geringen Anstieg des Risikos verbunden, bei Erwachsenen eine akute myeloische Leukämie zu entwickeln. Kohorten- und Fall-Kontroll-Studien haben die Exposition gegenüber einigen Petrochemikalien und Haarfärbemitteln mit der Entwicklung einiger Leukämieformen in Verbindung gebracht. Die Ernährung hat nur sehr begrenzte oder gar keine Auswirkungen, obwohl der Verzehr von mehr Gemüse einen kleinen Schutz bieten kann. ⓘ
Auch Viren wurden mit einigen Formen von Leukämie in Verbindung gebracht. So verursacht beispielsweise das humane T-Lymphotropie-Virus (HTLV-1) die adulte T-Zellen-Leukämie. ⓘ
Es wurden einige wenige Fälle von mütterlich-fötaler Übertragung (ein Baby bekommt Leukämie, weil seine Mutter während der Schwangerschaft an Leukämie erkrankt war) gemeldet. Bei Kindern von Müttern, die Fruchtbarkeitsmedikamente zur Auslösung des Eisprungs verwenden, ist die Wahrscheinlichkeit, dass sie im Laufe ihrer Kindheit an Leukämie erkranken, mehr als doppelt so hoch wie bei anderen Kindern. ⓘ
Leukämien entstehen durch genetische Veränderungen von unreifen blutbildenden Vorläuferzellen, sodass diese sich einerseits nicht mehr vollständig zu funktionstüchtigen Blutzellen weiterentwickeln können und andererseits unkontrolliert vermehren (siehe auch Krebsentstehung). Es genügt bereits die Veränderung einer einzigen Vorläuferzelle, die durch das anschließende unkontrollierte Wachstum die gesunden Bestandteile des blutbildenden Systems zurückdrängen kann. ⓘ
Die Auslöser dieser genetischen Veränderungen sind noch nicht geklärt. Gerade bei akuten Formen sind die Ursachen meist unklar und können nicht in einen kausalen Zusammenhang mit pathogenen Faktoren gebracht werden. Diskutiert werden die nachfolgenden potentiell auslösenden Faktoren:
- Chemikalien, zum Beispiel Benzol,
- vorangegangene Behandlung mit Zytostatika (insbesondere Alkylanzien) aufgrund einer anderen Erkrankung (beispielsweise eines soliden Tumors),
- ionisierende Strahlung,
- diverse Viren,
- genetische Vorbelastung.
- Auch psychogene Faktoren werden diskutiert. ⓘ
Strahlung
Hohe Dosen von Sr-90-Emissionen aus Kernreaktorunfällen, die auch als Knochensucher bezeichnet werden, erhöhen das Risiko von Knochenkrebs und Leukämie bei Tieren, und es wird angenommen, dass dies auch bei Menschen der Fall ist. ⓘ
Genetische Bedingungen
Manche Menschen haben eine genetische Veranlagung, an Leukämie zu erkranken. Diese Veranlagung wird durch Familienanamnesen und Zwillingsstudien nachgewiesen. Die betroffenen Personen können ein einzelnes Gen oder mehrere Gene gemeinsam haben. In einigen Fällen neigen Familien dazu, dieselbe Art von Leukämie zu entwickeln wie andere Familienmitglieder; in anderen Familien können die Betroffenen verschiedene Formen von Leukämie oder verwandten Blutkrebsarten entwickeln. ⓘ
Zusätzlich zu diesen genetischen Problemen haben Menschen mit Chromosomenanomalien oder bestimmten anderen genetischen Bedingungen ein höheres Leukämierisiko. So haben beispielsweise Menschen mit Down-Syndrom ein deutlich erhöhtes Risiko, an einer akuten Leukämie (insbesondere einer akuten myeloischen Leukämie) zu erkranken, und Fanconi-Anämie ist ein Risikofaktor für die Entwicklung einer akuten myeloischen Leukämie. Eine Mutation im SPRED1-Gen wurde mit einer Veranlagung für Leukämie im Kindesalter in Verbindung gebracht. ⓘ
Die chronische myeloische Leukämie ist mit einer genetischen Anomalie, der so genannten Philadelphia-Translokation, verbunden. 95 % der CML-Patienten tragen die Philadelphia-Mutation in sich, obwohl diese nicht nur bei der CML auftritt, sondern auch bei Menschen mit anderen Leukämiearten beobachtet werden kann. ⓘ
Nichtionisierende Strahlung
Ob nichtionisierende Strahlung Leukämie verursacht oder nicht, wird seit mehreren Jahrzehnten untersucht. Die Expertenarbeitsgruppe der International Agency for Research on Cancer hat alle Daten über statische und extrem niederfrequente elektromagnetische Energie, die in der Natur und bei der Erzeugung, Übertragung und Nutzung elektrischer Energie vorkommt, eingehend geprüft. Sie kam zu dem Schluss, dass es begrenzte Hinweise darauf gibt, dass hohe Werte von ELF-Magnetfeldern (aber nicht von elektrischen Feldern) einige Fälle von Leukämie bei Kindern verursachen könnten. Für einen Zusammenhang mit Leukämie oder einer anderen Form von bösartigem Tumor bei Erwachsenen wurden keine Beweise erbracht. Da eine Exposition gegenüber ELF-Feldern dieser Stärke relativ selten ist, kommt die Weltgesundheitsorganisation zu dem Schluss, dass eine ELF-Exposition, falls sie sich später als ursächlich erweisen sollte, weltweit nur 100 bis 2400 Fälle pro Jahr verursachen würde, was 0,2 bis 4,9 % der gesamten Leukämieinzidenz im Kindesalter für dieses Jahr entspricht (etwa 0,03 bis 0,9 % aller Leukämien). ⓘ
Mögliche Ursachen der Leukämie bei Kindern
In Deutschland erkranken jährlich 1800 Kinder neu an Krebs, davon rund ein Drittel an Leukämie. Auch hier sind die Ursachen weitgehend unbekannt. ⓘ
Eine Fallkontrollstudie zeigte ein etwa zwanzigfach erhöhtes Leukämierisiko für Menschen mit einem Down-Syndrom im Vergleich zur Normalbevölkerung. ⓘ
Es gibt Hinweise, dass Umweltfaktoren (ionisierende sowie nichtionisierende Strahlung sowie Pestizide) potenzielle Risikofaktoren sein können und ein „gut trainiertes kindliches Immunsystem“ einen schützenden Effekt hat. Bei einer Untersuchung von Kindern der Stadt Basra im Südirak wurde ein Anstieg der Leukämierate um rund das Doppelte von 1993 bis 2007 festgestellt. Als mögliche Auslöser kommen unter anderem Benzol, das durch brennende Ölfelder und improvisierte Tankstellen (Kanisterbetankung) in die Umwelt gelangte, oder auch Geschosse aus abgereichertem Uran in Frage. ⓘ
Die vermutete Ursache Radioaktivität für den Leukämiecluster Elbmarsch bei Hamburg ist umstritten. Ungeklärt ist auch der Einfluss radioaktiver Emissionen auf die temporäre Leukämiehäufung um Jülich. ⓘ
Ein kausaler Zusammenhang mit Impfungen konnte bei einer populationsbasierten Fall-Kontroll-Studie nicht gezeigt werden. Es gibt im Gegenteil eher Hinweise darauf, dass eine frühe Impfung innerhalb des ersten Lebensjahres das Erkrankungsrisiko bei Kindern senkt. ⓘ
Diagnose
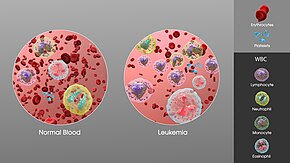
Die Diagnose basiert in der Regel auf wiederholten vollständigen Blutbildern und einer Knochenmarkuntersuchung nach Beobachtung der Symptome. Manchmal zeigen Bluttests nicht, dass eine Person an Leukämie erkrankt ist, insbesondere in den frühen Stadien der Krankheit oder während der Remission. In bestimmten Situationen kann eine Lymphknotenbiopsie durchgeführt werden, um bestimmte Leukämiearten zu diagnostizieren. ⓘ
Nach der Diagnose können blutchemische Untersuchungen durchgeführt werden, um den Grad der Leber- und Nierenschädigung oder die Auswirkungen der Chemotherapie auf die Person festzustellen. Bei Verdacht auf andere leukämiebedingte Schäden können Ärzte Röntgen-, MRT- oder Ultraschalluntersuchungen durchführen. Diese können möglicherweise die Auswirkungen der Leukämie auf Körperteile wie Knochen (Röntgen), das Gehirn (MRT) oder Nieren, Milz und Leber (Ultraschall) zeigen. CT-Scans können zur Überprüfung der Lymphknoten im Brustkorb eingesetzt werden, was jedoch eher selten ist. ⓘ
Trotz der Anwendung dieser Methoden zur Diagnose von Leukämie werden viele Menschen nicht diagnostiziert, weil viele der Symptome vage und unspezifisch sind und auf andere Krankheiten hindeuten können. Aus diesem Grund schätzt die Amerikanische Krebsgesellschaft, dass mindestens ein Fünftel der Menschen mit Leukämie noch nicht diagnostiziert wurde. ⓘ
Behandlung
Grundlage der Behandlung von Leukämien ist die Therapie mit Zytostatika. Weitere Behandlungsprinzipien sind die Hochdosistherapie mit autologer Stammzelltransplantation und die allogene Knochenmark- bzw. Stammzelltransplantation. Dazu wird ähnlich wie bei einer Bluttransfusion ein passender Knochenmarkspender benötigt. Untergeordnete Bedeutung hat die prophylaktische oder therapeutische Strahlentherapie. In den letzten Jahren haben sich neue Therapiemöglichkeiten durch die Anwendung von monoklonalen Antikörpern und neue spezifisch in die Krankheitsprozesse eingreifende Medikamente wie Imatinib und Dasatinib (zwei Tyrosinkinase-Inhibitoren) bei der CML und der Philadelphia-Chromosom-positiven ALL oder ATRA bei der Promyelozyten-Leukämie eröffnet. In der Therapie der Leukämien bestehen zwischen den einzelnen Formen erhebliche Unterschiede, die Einzelheiten der Therapie sind in den entsprechenden Artikeln dargestellt. Eine spezifische Gefährdung durch eine während der Therapie auftretende Neutropenie sind fieberhafte Infektionen, die entsprechend mit Antibiotika behandelt werden müssen. ⓘ
In den letzten Jahren gab es auch immer weitere Fortschritte der Gentherapie, die nun auf langfristige Therapieerfolge hoffen lassen. Einige Forschungsgruppen arbeiten zum Beispiel daran, T-Zellen von Leukämiepatienten durch Einschleusen bestimmter Gene so zu manipulieren, dass sie auch noch Jahre später Krebszellen eliminieren. Einige Patienten mit ALL oder CLL blieben durch diese Therapie langzeitig in Remission. ⓘ
Am 1. November 2013 erteilten die USA und am 29. Juli 2014 die europäischen Behörden einem bei Roche entwickelten Wirkstoff die Zulassung. Bei Patienten mit der chronischen lymphatischen Leukämie (CLL) ist schon nach wenigen Therapietagen mit dem Wirkstoff Obinutuzumab (alter Wirkstoffname war Afutuzumab) in Kombination mit dem milden Chemotherapeutikum Chlorambucil ein Rückgang der Blutkrebszellen feststellbar. Nach Abschluss der Therapie waren bei über 20 % der Patienten keine Krankheitszeichen mehr vorhanden. ⓘ
Die meisten Leukämieformen werden mit Medikamenten behandelt, die in der Regel zu einer Chemotherapie mit mehreren Wirkstoffen kombiniert werden. Einige werden auch mit einer Strahlentherapie behandelt. In einigen Fällen ist eine Knochenmarktransplantation wirksam. ⓘ
Akute Lymphoblastie
Die Behandlung der ALL zielt auf die Kontrolle des Knochenmarks und der systemischen (Ganzkörper-) Erkrankung ab. Darüber hinaus muss die Behandlung verhindern, dass sich die leukämischen Zellen auf andere Bereiche, insbesondere das zentrale Nervensystem (ZNS), ausbreiten, z. B. durch monatliche Lumbalpunktionen. Im Allgemeinen gliedert sich die ALL-Behandlung in mehrere Phasen:
- Induktionschemotherapie, um eine Remission des Knochenmarks zu erreichen. Bei Erwachsenen umfassen die Standardinduktionspläne Prednison, Vincristin und ein Anthrazyklin; andere Medikamentenpläne können L-Asparaginase oder Cyclophosphamid umfassen. Bei Kindern mit Niedrigrisiko-ALL besteht die Standardtherapie im ersten Monat der Behandlung in der Regel aus drei Medikamenten (Prednison, L-Asparaginase und Vincristin).
- Konsolidierungstherapie oder Intensivierungstherapie zur Beseitigung verbleibender Leukämiezellen. Es gibt viele verschiedene Ansätze für eine Konsolidierungstherapie, aber in der Regel handelt es sich um eine hochdosierte Behandlung mit mehreren Medikamenten, die einige Monate lang durchgeführt wird. Patienten mit einer ALL mit niedrigem bis mittlerem Risiko erhalten eine Therapie mit Antimetaboliten wie Methotrexat und 6-Mercaptopurin (6-MP). Menschen mit hohem Risiko erhalten höhere Dosen dieser Medikamente sowie zusätzliche Medikamente.
- ZNS-Prophylaxe (vorbeugende Therapie), um bei Hochrisikopersonen die Ausbreitung des Krebses auf das Gehirn und das Nervensystem zu verhindern. Die Standardprophylaxe kann eine Bestrahlung des Kopfes und/oder direkt in die Wirbelsäule verabreichte Medikamente umfassen.
- Erhaltungsbehandlungen mit Chemotherapeutika, um ein Wiederauftreten der Krankheit zu verhindern, wenn eine Remission erreicht wurde. Die Erhaltungstherapie umfasst in der Regel niedrigere Medikamentendosen und kann bis zu drei Jahre lang fortgesetzt werden.
- Bei Hochrisikopatienten oder Rezidivpatienten kann alternativ auch eine allogene Knochenmarktransplantation in Frage kommen. ⓘ
Chronische lymphozytäre
Entscheidung über die Behandlung
Hämatologen richten sich bei der Behandlung der CLL sowohl nach dem Stadium als auch nach den Symptomen der einzelnen Patienten. Eine große Gruppe von CLL-Patienten leidet an einer niedriggradigen Erkrankung, bei der eine Behandlung nicht sinnvoll ist. Menschen mit CLL-bedingten Komplikationen oder einer weiter fortgeschrittenen Erkrankung profitieren häufig von einer Behandlung. Im Allgemeinen sind die Indikationen für eine Behandlung folgende:
- Sinkender Hämoglobin- oder Thrombozytenwert
- Fortschreiten der Erkrankung in ein höheres Stadium
- Schmerzhafte, krankheitsbedingte Vergrößerung von Lymphknoten oder Milz
- Eine Zunahme der Lymphozytenproduktion ⓘ
Behandlungsansatz
Die meisten CLL-Fälle sind mit den derzeitigen Behandlungen nicht heilbar, so dass die Behandlung darauf ausgerichtet ist, die Krankheit über viele Jahre hinweg zu unterdrücken, anstatt sie zu heilen. Der primäre chemotherapeutische Plan ist eine Kombinationschemotherapie mit Chlorambucil oder Cyclophosphamid und einem Kortikosteroid wie Prednison oder Prednisolon. Der Einsatz eines Kortikosteroids hat den zusätzlichen Vorteil, dass es einige damit verbundene Autoimmunerkrankungen wie die immunhämolytische Anämie oder die immunvermittelte Thrombozytopenie unterdrückt. In resistenten Fällen können Einzelbehandlungen mit Nukleosidpräparaten wie Fludarabin, Pentostatin oder Cladribin erfolgreich sein. Jüngere und gesündere Menschen können sich für eine allogene oder autologe Knochenmarktransplantation entscheiden, in der Hoffnung auf eine dauerhafte Heilung. ⓘ
Akute myeloische
Viele verschiedene Krebsmedikamente sind für die Behandlung der AML wirksam. Die Behandlungen variieren je nach Alter der Betroffenen und je nach spezifischem Subtyp der AML. Insgesamt besteht die Strategie darin, das Knochenmark und die systemische (Ganzkörper-) Erkrankung zu kontrollieren und gleichzeitig eine spezifische Behandlung für das zentrale Nervensystem (ZNS) anzubieten, falls dieses betroffen ist. ⓘ
Im Allgemeinen setzen die meisten Onkologen in der Anfangsphase, der Induktionsphase der Chemotherapie, auf Kombinationen von Medikamenten. Eine solche Kombinationschemotherapie bietet in der Regel den Vorteil einer frühen Remission und eines geringeren Risikos einer Krankheitsresistenz. Konsolidierungs- und Erhaltungstherapien sollen ein Wiederauftreten der Krankheit verhindern. Bei der Konsolidierungsbehandlung wird häufig die Induktionschemotherapie wiederholt oder die Chemotherapie durch zusätzliche Medikamente intensiviert. Im Gegensatz dazu werden bei der Erhaltungstherapie niedrigere Medikamentendosen als in der Einleitungsphase verabreicht. ⓘ
Chronisch myeloische
Es gibt viele Behandlungsmöglichkeiten für CML, aber die Standardbehandlung für neu diagnostizierte Patienten ist die Therapie mit Imatinib (Glivec). Im Vergleich zu den meisten Krebsmedikamenten hat es relativ wenige Nebenwirkungen und kann zu Hause oral eingenommen werden. Mit diesem Medikament gelingt es mehr als 90 % der Patienten, die Krankheit für mindestens fünf Jahre unter Kontrolle zu halten, so dass die CML zu einer chronischen, kontrollierbaren Erkrankung wird. ⓘ
In einem fortgeschrittenen, unkontrollierten Stadium, wenn die Person Imatinib nicht verträgt oder wenn sie eine dauerhafte Heilung anstrebt, kann eine allogene Knochenmarktransplantation durchgeführt werden. Dieses Verfahren umfasst eine hochdosierte Chemotherapie und Bestrahlung, gefolgt von einer Infusion von Knochenmark eines kompatiblen Spenders. Ungefähr 30 % der Betroffenen sterben an diesem Verfahren. ⓘ
Haarige Zellen
Entscheidung über die Behandlung
Menschen mit Haarzellenleukämie, die symptomfrei sind, werden normalerweise nicht sofort behandelt. Eine Behandlung wird im Allgemeinen als notwendig erachtet, wenn die Person Anzeichen und Symptome wie niedrige Blutzellzahlen (z. B. die Zahl der infektionsbekämpfenden Neutrophilen unter 1,0 K/µl), häufige Infektionen, unerklärliche Blutergüsse, Anämie oder eine Müdigkeit zeigt, die so stark ist, dass sie das tägliche Leben der Person beeinträchtigt. ⓘ
Typischer Behandlungsansatz
Menschen, die eine Behandlung benötigen, erhalten in der Regel entweder eine Woche lang Cladribin, das täglich per intravenöser Infusion oder durch eine einfache Injektion unter die Haut verabreicht wird, oder sechs Monate lang Pentostatin, das alle vier Wochen per intravenöser Infusion verabreicht wird. In den meisten Fällen führt eine einzige Behandlungsrunde zu einer anhaltenden Remission. ⓘ
Weitere Behandlungsmöglichkeiten sind Rituximab-Infusionen oder die Selbstinjektion von Interferon-alpha. In begrenzten Fällen kann eine Splenektomie (Entfernung der Milz) sinnvoll sein. Diese Behandlungen werden in der Regel nicht als Erstbehandlung eingesetzt, da ihre Erfolgsraten niedriger sind als die von Cladribin oder Pentostatin. ⓘ
Prolymphozytäre T-Zellen
Die meisten Menschen mit prolymphozytärer T-Zell-Leukämie, einer seltenen und aggressiven Leukämie mit einer mittleren Überlebenszeit von weniger als einem Jahr, benötigen eine sofortige Behandlung. ⓘ
Die prolymphozytäre T-Zell-Leukämie ist schwer zu behandeln und spricht auf die meisten verfügbaren Chemotherapeutika nicht an. Viele verschiedene Behandlungen wurden ausprobiert, mit begrenztem Erfolg bei bestimmten Patienten: Purinanaloga (Pentostatin, Fludarabin, Cladribin), Chlorambucil und verschiedene Formen der Kombinationschemotherapie (Cyclophosphamid, Doxorubicin, Vincristin, Prednison CHOP, Cyclophosphamid, Vincristin, Prednison [COP], Vincristin, Doxorubicin, Prednison, Etoposid, Cyclophosphamid, Bleomycin VAPEC-B). Alemtuzumab (Campath), ein monoklonaler Antikörper, der die weißen Blutkörperchen angreift, wurde bei der Behandlung mit größerem Erfolg eingesetzt als die bisherigen Optionen. ⓘ
Einige Patienten, die erfolgreich auf die Behandlung ansprechen, unterziehen sich auch einer Stammzellentransplantation, um das Ansprechen zu konsolidieren. ⓘ
Juvenile myelomonozytäre Erkrankung
Die Behandlung der juvenilen myelomonozytären Leukämie kann Splenektomie, Chemotherapie und Knochenmarktransplantation umfassen. ⓘ
Zähne
Vor zahnärztlichen Eingriffen wird empfohlen, den Arzt des Betroffenen zu konsultieren. Zahnbehandlungen werden vor einer Chemo- oder Strahlentherapie empfohlen. Personen in Remission können wie üblich behandelt werden. ⓘ
Prognose
Der Erfolg der Behandlung hängt von der Art der Leukämie und dem Alter des Patienten ab. In den Industrieländern haben sich die Ergebnisse verbessert. Die durchschnittliche Fünfjahresüberlebensrate liegt in den Vereinigten Staaten bei 65 %. Bei Kindern unter 15 Jahren ist die Fünfjahresüberlebensrate höher (60 bis 85 %), je nach Art der Leukämie. Bei Kindern mit akuter Leukämie, die nach fünf Jahren krebsfrei sind, ist es unwahrscheinlich, dass der Krebs zurückkehrt. ⓘ
Die Behandlungsergebnisse hängen davon ab, ob es sich um eine akute oder chronische Leukämie handelt, vom spezifischen Typ der abnormen weißen Blutkörperchen, vom Vorhandensein und Schweregrad einer Anämie oder Thrombozytopenie, vom Grad der Gewebeanomalie, vom Vorhandensein von Metastasen und Lymphknoten- und Knochenmarkinfiltration, von der Verfügbarkeit von Therapien und von den Fähigkeiten des Behandlungsteams. Die Behandlungsergebnisse können besser sein, wenn die Patienten in größeren Zentren mit mehr Erfahrung behandelt werden. ⓘ
Epidemiologie
Im Jahr 2010 starben weltweit etwa 281 500 Menschen an Leukämie. Im Jahr 2000 erkrankten weltweit etwa 256.000 Kinder und Erwachsene an einer Form von Leukämie, und 209.000 starben daran. Dies entspricht etwa 3 % der fast sieben Millionen krebsbedingten Todesfälle in jenem Jahr und etwa 0,35 % aller Todesfälle aus jeglicher Ursache. Von den sechzehn verglichenen Körperstellen war Leukämie die zwölfthäufigste Klasse neoplastischer Erkrankungen und die elfthäufigste Ursache für krebsbedingte Todesfälle. Leukämie tritt häufiger in den Industrieländern auf. ⓘ
Vereinigte Staaten
In den Vereinigten Staaten sind etwa 245 000 Menschen an einer Form von Leukämie erkrankt, einschließlich derjenigen, die eine Remission oder Heilung erreicht haben. Die Raten sind zwischen 1975 und 2011 bei Kindern um 0,7 % pro Jahr gestiegen. Im Jahr 2008 wurden in den USA etwa 44.270 neue Leukämiefälle diagnostiziert. Dies entspricht 2,9 % aller Krebserkrankungen (ohne einfache Basalzell- und Plattenepithelkarzinome) in den Vereinigten Staaten und 30,4 % aller Blutkrebserkrankungen. ⓘ
Von den Kindern, die an einer Krebsart erkrankt sind, leidet etwa ein Drittel an einer Leukämie, am häufigsten an akuter lymphatischer Leukämie. Eine Leukämieart ist die zweithäufigste Krebsart bei Säuglingen (unter 12 Monaten) und die häufigste Krebsart bei älteren Kindern. Bei Jungen ist die Wahrscheinlichkeit, an Leukämie zu erkranken, etwas höher als bei Mädchen, und bei weißen amerikanischen Kindern ist die Wahrscheinlichkeit, an Leukämie zu erkranken, fast doppelt so hoch wie bei schwarzen amerikanischen Kindern. Nur etwa 3 % der Krebsdiagnosen bei Erwachsenen entfallen auf Leukämien, aber da Krebs bei Erwachsenen viel häufiger vorkommt, werden mehr als 90 % aller Leukämien bei Erwachsenen diagnostiziert. ⓘ
Die Rasse ist in den Vereinigten Staaten ein Risikofaktor. Hispanoamerikaner, insbesondere die unter 20-Jährigen, haben das höchste Leukämierisiko, während Weiße, amerikanische Ureinwohner, asiatische Amerikaner und Alaska Natives ein höheres Risiko haben als Afroamerikaner. ⓘ
Bei mehr Männern als Frauen wird Leukämie diagnostiziert und sie sterben an der Krankheit. Etwa 30 Prozent mehr Männer als Frauen haben Leukämie. ⓘ
UK
Insgesamt ist Leukämie die elfthäufigste Krebserkrankung im Vereinigten Königreich (2011 wurde die Krankheit bei rund 8 600 Menschen diagnostiziert), und sie ist die neunthäufigste Krebstodesursache (2012 starben rund 4 800 Menschen). ⓘ
Geschichte

Die Leukämie wurde erstmals von dem Anatomen und Chirurgen Alfred-Armand-Louis-Marie Velpeau im Jahr 1827 beschrieben. Eine ausführlichere Beschreibung lieferte der Pathologe Rudolf Virchow im Jahr 1845. Etwa zehn Jahre nach Virchows Erkenntnissen stellte der Pathologe Franz Ernst Christian Neumann fest, dass das Knochenmark eines an Leukämie erkrankten Verstorbenen "schmutzig grün-gelb" gefärbt war, im Gegensatz zum normalen Rot. Dieser Befund erlaubte Neumann die Schlussfolgerung, dass ein Knochenmarksproblem für das abnorme Blut von Leukämiekranken verantwortlich war. ⓘ
Um 1900 betrachtete man Leukämie als eine Familie von Krankheiten und nicht mehr als eine einzelne Krankheit. 1947 glaubte der Bostoner Pathologe Sidney Farber aufgrund früherer Experimente, dass Aminopterin, ein Folsäureimitator, Leukämie bei Kindern möglicherweise heilen könnte. Die meisten der getesteten Kinder mit ALL zeigten Anzeichen einer Verbesserung ihres Knochenmarks, aber keines von ihnen wurde tatsächlich geheilt. Dies führte jedoch zu weiteren Experimenten. ⓘ
1962 versuchten die Forscher Emil J. Freireich, Jr. und Emil Frei III mit einer kombinierten Chemotherapie, Leukämie zu heilen. Die Versuche waren erfolgreich, und einige Menschen überlebten noch lange nach den Versuchen. ⓘ
Etymologie
Als Virchow eine abnorm hohe Anzahl weißer Blutkörperchen in einer Blutprobe eines Menschen beobachtete, nannte er diesen Zustand Leukämie, die er aus den beiden griechischen Wörtern leukos (λευκός), was "weiß" bedeutet, und haima (αἷμα), was "Blut" bedeutet, zusammensetzte. ⓘ
Gesellschaft und Kultur
Susan Sontag zufolge wurde Leukämie in der Belletristik des 20. Jahrhunderts häufig romantisiert und als eine Krankheit dargestellt, die mit Freude endet und sauber ist, deren schöne, unschuldige und sanfte Opfer jung oder zur falschen Zeit sterben. Als solche war sie der kulturelle Nachfolger der Tuberkulose, die diese kulturelle Position bis zu ihrer Entdeckung als Infektionskrankheit innehatte. Der Liebesroman Love Story von 1970 ist ein Beispiel für diese Romantisierung der Leukämie. ⓘ
In den Vereinigten Staaten werden jährlich etwa 5,4 Milliarden Dollar für die Behandlung ausgegeben. ⓘ
Forschungsrichtungen
Die Ursachen, die Häufigkeit, die Diagnose, die Behandlung und die Prognose von Leukämie werden in großem Umfang erforscht. Hunderte von klinischen Studien sind derzeit in Planung oder werden bereits durchgeführt. Die Studien können sich auf wirksame Behandlungsmethoden, bessere Wege zur Behandlung der Krankheit, die Verbesserung der Lebensqualität der Betroffenen oder eine angemessene Betreuung in der Remission oder nach der Heilung konzentrieren. ⓘ
Im Allgemeinen gibt es zwei Arten der Leukämieforschung: klinische oder translationale Forschung und Grundlagenforschung. Die klinische/translationale Forschung konzentriert sich auf die Untersuchung der Krankheit in einer definierten und allgemein sofort anwendbaren Weise, z. B. die Prüfung eines neuen Medikaments an Menschen. Im Gegensatz dazu untersucht die Grundlagenforschung den Krankheitsprozess aus der Ferne, z. B. um festzustellen, ob ein mutmaßliches Karzinogen in isolierten Zellen im Labor leukämische Veränderungen hervorrufen kann oder wie sich die DNA in Leukämiezellen im Verlauf der Krankheit verändert. Die Ergebnisse von Studien der Grundlagenforschung sind im Allgemeinen für die Betroffenen nicht unmittelbar von Nutzen. ⓘ
Derzeit wird eine Behandlung durch Gentherapie angestrebt. Bei einem solchen Ansatz werden gentechnisch veränderte T-Zellen, so genannte chimäre Antigenrezeptor-T-Zellen (CAR-T-Zellen), eingesetzt, um Krebszellen anzugreifen. Im Jahr 2011, ein Jahr nach der Behandlung, waren zwei der drei Patienten mit fortgeschrittener chronischer lymphatischer Leukämie frei von Krebs, und 2013 waren drei von fünf Patienten mit akuter lymphatischer Leukämie fünf Monate bis zwei Jahre lang in Remission. Nachfolgende Studien mit einer Vielzahl von CAR-T-Typen sind weiterhin vielversprechend. Im Jahr 2018 sind zwei CAR-T-Therapien von der Food and Drug Administration zugelassen worden. Die CAR-T-Behandlung hat erhebliche Nebenwirkungen, und der Verlust des Antigens, gegen das die CAR-T-Zellen gerichtet sind, ist ein häufiger Mechanismus für einen Rückfall. Die Stammzellen, die verschiedene Leukämiearten verursachen, werden ebenfalls erforscht. ⓘ
Schwangerschaft
Leukämie tritt nur selten in Verbindung mit einer Schwangerschaft auf und betrifft nur etwa 1 von 10.000 schwangeren Frauen. Wie sie behandelt wird, hängt in erster Linie von der Art der Leukämie ab. Fast alle Leukämien, die bei schwangeren Frauen auftreten, sind akute Leukämien. Akute Leukämien erfordern in der Regel eine rasche, aggressive Behandlung, trotz des erheblichen Risikos eines Schwangerschaftsverlusts und von Geburtsfehlern, insbesondere wenn die Chemotherapie im entwicklungsmäßig empfindlichen ersten Trimester verabreicht wird. Die chronische myeloische Leukämie kann mit relativer Sicherheit zu jedem Zeitpunkt der Schwangerschaft mit Interferon-alpha-Hormonen behandelt werden. Die Behandlung chronischer lymphatischer Leukämien, die bei Schwangeren selten sind, kann oft bis nach dem Ende der Schwangerschaft verschoben werden. ⓘ
Chromosomale Translokationen bei menschlichen Leukämien
Reziproke Translokationen sind für Leukämien und Lymphome typisch, bei soliden Tumoren die Ausnahme. Generell betrachtet sind Translokationen ein Charakteristikum von ca. drei Prozent aller Tumoren. Bei insgesamt 14.000 verschiedenen karyotypischen Veränderungen bei Tumoren sind über 100 wiederkehrende Translokationen beschrieben worden (Stand 1991). Chromosomale Veränderungen bei hämatologischen Erkrankungen sind häufig und vielfältig. Ein tabellarischer Überblick soll einen Eindruck von der Vielfalt der Phänomene geben. Dabei werden zunächst Chromosomen-Translokationen und sodann Chromosomen-Deletionen angeführt. Der weitere Artikel gliedert sich in drei Teile. Zunächst werden die chromosomalen Veränderungen bei myeloischen Leukämien besprochen. Im darauffolgenden Abschnitt werden die lymphatischen Leukämien dargestellt und eine beispielhafte Bruchpunkt-Untersuchung vorgestellt. Zum Abschluss wird noch kurz auf das Burkitt-Lymphom eingegangen. ⓘ
| Onkogene bei Leukämien – Translokationen ⓘ | ||||
|---|---|---|---|---|
| Protein-Klasse | Onkogen | Translokation | Tumor | Häufigkeit |
| Tyrosin-Kinasen | c-abl/bcr | t(9;22)(q34;q11) | CML | 95 % |
| c-abl/bcr | t(9;22)(q34;q11) | ALL | 10 % | |
| axl | t(;)(;) | CML | ? % | |
| TF | myc/Ig-Gene | t(8;14)(q24;q32) | BL | 100 % |
| pre-B-ALL | 10 % | |||
| T-ALL | 10 % | |||
| E2A/PBX | t(1;19)(q23;p13) | pre-B-ALL | 10 % | |
| E2A/HLF | t(17;19)(q22;p13) | pre-B-ALL | 10 % | |
| Tal-1/TCR | t(1;14)(p32;q11) | T-ALL | 20 % | |
| Tal-1/SIL | t(1;)(p32;) | T-ALL | 20 % | |
| Tal-2/TCR | t(7;9)(q35;p13) | T-ALL | 10 % | |
| Lyl-1/TCR | t(7;19)(q35;p13) | T-ALL | 5 % | |
| Ttg-1/TCR | t(11;14)(pls;q11) | T-ALL | 10 % | |
| Ttg-2/TCR | t(11;14)(p13;q11) | T-ALL | −10 % | |
| HD-Gene: | Hox-11/TCR | t(10;14)(q24;q11) | T-ALL | 7 % |
| HRX | t(11q23) | Multilinage | ?% | |
| Rezeptoren: | RARA/PML | t(15;17)(q21;q21) | PML | 100 % |
| bcl-Gene: | bcl-1/Ig | t(11;14)(q32;q21) | CentroCyt | 30 % |
| CLL | 3 % | |||
| bcl-2/Ig | t(14;18)(q13;q32) | Foll | ||
| Diff | 20 % | |||
| CLL | 5 % | |||
| bcl-3/Ig | t(14;19)(q32;q13) | CLL | ||
| Andere: | DEK/CAN | t(6;9)(p23;q34) | AML/MDS | |
| SET/CAN | t(;)(;) | AML,MDS | ||
| MLL | t(11q23) | AML,ALL | ||
| TAN-1 | t(7;9)(q34;q34.3) | T-ALL | 42 % | |
| AML-1 | t(8;21) | AML | ||
| IL-3 | t(5;14)(q31;q32) pre-B-ALL | |||
Die folgende Tabelle gibt einen Überblick über die chromosomalen Deletionen bei verschiedenen menschlichen Leukämien. ⓘ
| Onkogene bei Leukämien – Deletionen ⓘ | ||
|---|---|---|
| Proteinklasse | Tumor | Häufigkeit |
| ras-Gene | AML | 50 % |
| ALL | 15 % | |
| CML | 5 % | |
| p53 | CML | 20 % |
| AML | 3–7 % | |
| pre B-ALL | 2 % | |
| T-ALL | 2 % | |
| BL | 30 % | |
| CLL | 15 % | |
| RB-1 | Ph1+-ALL | 30 % |
| AML | 3 % | |
| AMML | 25 % | |
| T-ALL | 20 % | |
| WT-1 | AML | 20 % |
Translokationen bei chronischer myeloischer Leukämie (CML)
Bei der chronischen myeloischen Leukämie kommt es in 95 Prozent aller bisher untersuchten Fälle durch eine chromosomale Translokation zu einer Fusion des c-abl-Gens auf dem Chromosom 9q34 mit dem bcr-Gen auf dem Chromosom 22q11 mit dem Ergebnis eines alterierten Chromosoms, des Philadelphia-Chromosoms, und der Expression eines chimärischen Proteins, des abl/bcr-Produkts, das in drei Varianten als p190, p210 und p230 vorkommt und Tyrosinkinaseaktivität aufweist. Das Fusionsprotein resultiert in einer konstitutiven Aktivierung der abl-Tyrosinkinase und stimuliert vielfältige Signalwege, z. B. p21 Ras, PI3 Kinase, Jun, myc. ⓘ
Translokationen bei akuter myeloischer Leukämie (AML)
Bei den akuten myeloischen Leukämien findet sich eine Vielzahl unterschiedlicher Mutationen. Bei der AML finden sich in bis zu 50 Prozent der untersuchten Fälle Mutationen im N-ras-Lokus, in ca. fünf Prozent der untersuchten Fälle Mutationen in p53, in weniger als drei Prozent der untersuchten Fälle Mutationen im RB-1-Gen und in ca. 20 Prozent Veränderungen im WT-1-Lokus. Vereinzelt sind Fusionen von SET/CAN-, DEK/CAN-, MLL- und AML-1-Genen beschrieben worden. Im Folgenden werden die beteiligten Onkogene näher charakterisiert. ⓘ
Translokationen bei anderen myeloischen Leukämien
Bei der akuten myelomonocytischen Leukämie (AMML) finden sich häufig Mutationen im RB-1 Lokus. Eine Besonderheit bei den AML stellt die Promyelozytenleukämie dar, bei der in mehr als 95 Prozent der untersuchten Fälle eine Translokation t(15;17) (q21;q21) beschrieben ist mit dem Ergebnis einer Fusion von PML und RARa. Das Humane Trithorax-Homolog findet sich auf dem Chromosom 11q23. Die HRX-Translokationen findet sich bei biphänotypischen Leukämien. Trithorax ist ALL-1. ⓘ
Translokationen bei T-Zell-Leukämien
Die folgende Tabelle gibt eine Übersicht über das Vorkommen von Translokationen bei akuten T-Zell-Leukämien. ⓘ
| Translokationen bei T-Zell-Leukämien ⓘ | ||||
|---|---|---|---|---|
| t(8;14)(q24;q11) | c-myc | 8q24 | TCR-alpha/delta | 14q11 |
| t(7;19)(q35;p13) | TCR-beta | 7q35 | Lyl-1 | 19p13 |
| t(1;14)(p32;q11) | Tal-1(Scl,Tcl-5) | 1p32 | TCR-alpha/delta | 14q11 |
| t(7;9)(q35;q34) | TCR-beta | 7q35 | Tal-2 | 9q34 |
| t(11;14)(pl5;q11) | Rhom-1(Ttg-1) | 11p15 | TCR-alpha/delta | 14q11 |
| t(11;14)(p13;q11) | Rhom-2(Ttg-2) | 11p13 | TCR-alpha/delta | 14q11 |
| t(7;11)(q35;p13) | TCR-beta | 7q35 | Rhom-2 | 11p13 |
| t(10;14)(q24;q11) | Hox-11(Tcl-3) | 10q24 | TCR-alpha/delta | 14q11 |
| t(7;10)(q35;q24) | TCR-beta | 7q35 | Hox-11 | 10q24 |
| t(7;9)(q34;q34.3) | TCR-beta | 7q34 | Tan-1 | 9q34.3 |
Alle betroffenen protoonkogenen Transkriptionsfaktoren (c-myc, Lyl-1, Tal-1,2) sind helix-loop-helix-Proteine; Rhom-1,2 (Ttg-1,2) sind LIM-Domaine-Proteine, Hox-11 (Tcl-3) ist ein Homeoboxgen und Tan-1 ein notch-Homolog. Involviert sind jeweils immer TCR-beta oder TCR-alpha/delta. Vergleichsweise konsistente Mutationen in T-ALLs finden sich auch bei p53 Jonveaux und im RB-Lokus Ahuja und Ginsberg, allerdings ohne Translokationen in den Bereich rearrangierender Loci. Untersucht man die verschiedenen Loci, so findet man folgende Verteilung der translozierenden Regionen. ⓘ
In die TCR-alpha/delta-Region = 14q11 translozieren:
| Chromosomale Lokalisation TCR-alpha/delta-translozierender Onkogene ⓘ | |
|---|---|
| c-myc | 8q24 |
| Tal-1 | 1p32 |
| Rhom-1 | 11p15 |
| Rhom-2 | 11p13 |
| Hox-11 | 10q24 |
In die TCR-beta-Region = 7q35 translozieren:
| Chromosomale Lokalisation TCR-beta-translozierender Onkogene ⓘ | |
|---|---|
| Lyl-1 | 19p13 |
| Tal-2 | 9q34 |
| Rhom-2 | 11p13 |
| Hox-11 | 10q24 |
| Tan-1 | 9q34.3 |
Die aufgelisteten Translokationen bei T-ALL haben eine Reihe von Gemeinsamkeiten. Es sind jeweils zwei typische codierende Regionen betroffen: TCR-Gene und Transkriptionsfaktoren. Stets ist das betroffene Allel des TCR als Strukturgen zerstört und das betroffene Allel des Transkriptionsfaktors als Strukturgen intakt, in seiner Regulation aber gestört. Meistens sind die betroffenen Transkriptionsfaktoren zelllinienfremde Gene. Üblicherweise wird ihre Funktion im Rahmen der Zelldifferenzierung vermutet. Im Bereich von 11p13 sind die Bruchpunkte unabhängig vom translozierenden Partnerchromosom in einem kleinen Bereich geclustert. Außerdem finden die Translokationen bei unreifen Zellen statt, so dass man schlussfolgern muss, dass eine aberrante Expression von an der Zelldifferenzierung von nichtlymphatischem Gewebe beteiligten Transkriptionsfaktoren in primitivem lymphoidem Gewebe einen wesentlichen Anteil an der malignen Transformation haben kann. ⓘ
Verwandte Erkrankungen
- Seltenere, mit der CML verwandte chronische myeloproliferative Erkrankungen, die jedoch vorwiegend andere Blutzellen als die Leukozyten betreffen, sind die:
- Polycythaemia vera (PV) – hier steht die Vermehrung der roten Blutzellen im Vordergrund. Es sind meist auch die anderen Zellreihen, also die Leukozyten und die Thrombozyten, betroffen.
- essentielle Thrombozythämie (ET) – hier steht die Vermehrung der Blutplättchen und deren eventuell eingeschränkte Funktion im Vordergrund.
- Auch bei den myelodysplastischen Syndromen liegt eine Fehlfunktion der blutbildenden Stammzellen vor. Im Gegensatz zu den Leukämien findet jedoch keine unkontrollierte Vermehrung ebendieser statt. ⓘ
