Hashimoto-Thyreoiditis
| Hashimoto-Thyreoiditis ⓘ | |
|---|---|
| Andere Bezeichnungen | Chronische lymphozytäre Thyreoiditis, Autoimmunthyreoiditis, Struma lymphomatosa, Hashimoto-Krankheit |
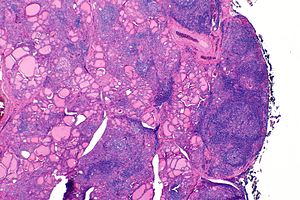 | |
| Die Schilddrüse eines Patienten mit Hashimoto-Thyreoiditis, wie sie unter einem Mikroskop bei geringer Vergrößerung zu sehen ist | |
| Fachgebiet | Endokrinologie |
| Symptome | Schmerzloser Kropf, Gewichtszunahme, Müdigkeitsgefühl, Verstopfung, Depression, trockene Haut, Haarausfall |
| Komplikationen | Schilddrüsenlymphom. |
| Übliches Auftreten | 30-50 Jahre alt |
| Ursachen | Genetische und umweltbedingte Faktoren. |
| Risikofaktoren | Familienanamnese, andere Autoimmunerkrankung |
| Diagnostische Methode | TSH, T4, Anti-Schilddrüsen-Autoantikörper |
| Differentialdiagnose | Morbus Basedow, nicht toxischer Knotenstruma |
| Behandlung | Levothyroxin, Operation |
| Häufigkeit | 5% irgendwann |
Die Hashimoto-Thyreoiditis, auch bekannt als chronische lymphozytäre Thyreoiditis und Hashimoto-Krankheit, ist eine Autoimmunerkrankung, bei der die Schilddrüse nach und nach zerstört wird. Zu Beginn werden die Symptome möglicherweise nicht bemerkt. Mit der Zeit kann sich die Schilddrüse vergrößern und einen schmerzlosen Kropf bilden. Manche Menschen entwickeln schließlich eine Schilddrüsenunterfunktion, die mit Gewichtszunahme, Müdigkeit, Verstopfung, Depressionen, Haarausfall und allgemeinen Schmerzen einhergeht. Nach vielen Jahren verkleinert sich die Schilddrüse in der Regel wieder. Zu den möglichen Komplikationen gehören Schilddrüsenlymphome. Da unbehandelte Hashimoto-Patienten häufig eine Schilddrüsenunterfunktion entwickeln, können weitere Komplikationen wie hoher Cholesterinspiegel, Herzerkrankungen, Herzinsuffizienz, hoher Blutdruck, Myxödeme und mögliche Schwangerschaftsprobleme auftreten. ⓘ
Es wird angenommen, dass die Hashimoto-Thyreoiditis auf eine Kombination von genetischen und umweltbedingten Faktoren zurückzuführen ist. Zu den Risikofaktoren gehören eine familiäre Vorbelastung und eine andere Autoimmunerkrankung. Die Diagnose wird durch Bluttests auf TSH, T4 und antithyreotoxische Autoantikörper bestätigt. Andere Erkrankungen, die ähnliche Symptome hervorrufen können, sind der Morbus Basedow und der nicht toxische Knotenstruma. ⓘ
Die Hashimoto-Thyreoiditis wird in der Regel mit Levothyroxin behandelt. Liegt keine Schilddrüsenunterfunktion vor, empfehlen manche Ärzte keine Behandlung, während andere versuchen, die Größe des Kropfs zu verringern. Die Betroffenen sollten den Verzehr großer Mengen an Jod vermeiden; insbesondere während der Schwangerschaft ist jedoch eine ausreichende Jodzufuhr erforderlich. Ein chirurgischer Eingriff zur Behandlung des Kropfes ist selten erforderlich. ⓘ
Von der Hashimoto-Thyreoiditis sind etwa 5 % der Weißen irgendwann in ihrem Leben betroffen. Sie beginnt in der Regel zwischen dem 30. und 50. Lebensjahr und tritt bei Frauen wesentlich häufiger auf als bei Männern. Die Häufigkeit der Erkrankung scheint zuzunehmen. Sie wurde erstmals 1912 von dem japanischen Arzt Hakaru Hashimoto beschrieben. Im Jahr 1957 wurde sie als Autoimmunerkrankung anerkannt. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| E06.3 | Hashimoto-Thyreoiditis Hashitoxikose (transitorisch) Lymphozytäre Thyreoiditis Struma lymphomatosa (Hashimoto) |
| ICD-10 online (WHO-Version 2019) | |
Die Hashimoto-Thyreoiditis (Synonyme: Hashimoto-Thyroiditis, Struma lymphomatosa Hashimoto, (chronische) lymphozytäre Thyreoiditis, Ord-Thyreoiditis, Hashimoto-Krankheit) ist eine Autoimmunerkrankung, die zu einer chronischen Entzündung der Schilddrüse führt. Bei dieser Erkrankung wird Schilddrüsengewebe infolge eines fehlgeleiteten Immunprozesses durch T-Lymphozyten zerstört. Darüber hinaus ist eine Antikörperbildung gegen schilddrüsenspezifische Antigene nachweisbar. Die Erkrankung führt auf Dauer zu einer Schilddrüsenunterfunktion, wobei sich zu Beginn – bedingt durch die Zerstörung des Schilddrüsengewebes – auch Phasen der Überfunktion zeigen können. Der Krankheitsverlauf ist bei den meisten Erkrankten leicht und bei einigen mittelschwer oder schwer. Die Symptome sind vielfältig und – gerade am Beginn der Erkrankung – schwierig einzuordnen. Die Hashimoto-Thyreoiditis ist derzeit nicht heilbar; sie kann nicht ursächlich behandelt werden. Wenn die Schilddrüse wegen ihrer chronischen Entzündung nicht mehr ausreichend Schilddrüsenhormone herstellen kann, muss die Unterfunktion durch eine Substitution therapiert werden: der Erkrankte nimmt täglich orale Schilddrüsenhormone ein. ⓘ
Symptome und Krankheitsverlauf
Viele Symptome werden der Entwicklung der Hashimoto-Thyreoiditis zugeschrieben. Zu den häufigsten Symptomen gehören: Müdigkeit, Gewichtszunahme, blasses oder geschwollenes Gesicht, Kältegefühl, Gelenk- und Muskelschmerzen, Verstopfung, trockenes und dünner werdendes Haar, starker Menstruationsfluss oder unregelmäßige Perioden, Depressionen, Panikzustände, verlangsamter Herzschlag sowie Probleme beim Schwangerwerden und Fehlgeburten. ⓘ
Die Hashimoto-Krankheit tritt bei Frauen etwa siebenmal häufiger auf als bei Männern. Sie kann bei Teenagern und jungen Frauen auftreten, tritt aber häufiger im mittleren Alter auf, insbesondere bei Männern. Menschen, die an Morbus Hashimoto erkranken, haben oft Familienmitglieder, die an Schilddrüsen- oder anderen Autoimmunkrankheiten leiden, und manchmal haben sie selbst andere Autoimmunkrankheiten. ⓘ
Die Schilddrüse kann bei der Hashimoto-Thyreoiditis fest, groß und lappig werden, aber die Veränderungen der Schilddrüse können auch nicht tastbar sein. Die Vergrößerung der Schilddrüse ist eher auf eine lymphozytäre Infiltration und Fibrose als auf eine Gewebehypertrophie zurückzuführen. Während ihre Rolle bei der anfänglichen Zerstörung der Follikel unklar ist, sind Antikörper gegen Schilddrüsenperoxidase oder Thyreoglobulin von Bedeutung, da sie als Marker für den Nachweis der Krankheit und ihres Schweregrades dienen. Man geht davon aus, dass sie die sekundären Produkte der T-Zell-vermittelten Zerstörung der Drüse sind. ⓘ
Charakteristisch ist auch das Eindringen von Leukozyten, hauptsächlich T-Lymphozyten, in das Schilddrüsengewebe. Eine seltene, aber schwerwiegende Komplikation ist das Schilddrüsenlymphom, in der Regel ein Non-Hodgkin-Lymphom vom B-Zell-Typ. ⓘ
Symptome
Aufgrund der möglichen anfänglichen Hyperthyreose (Schilddrüsenüberfunktion) können für eine gewisse Zeit folgende Symptome und Befunde auftreten: Nervosität, Abgeschlagenheit, Schwäche, vermehrtes Schwitzen, Wärmeintoleranz, Tremor, Überaktivität, Palpitationen, veränderter Appetit (meist gesteigert), verändertes Gewicht (meist Gewichtsabnahme), Zyklusstörungen, Tachykardie und Herzrhythmusstörungen, arterielle Hypertonie, warm-feuchte und weiche Haut, Hyperreflexie, Muskelschwäche. ⓘ
Langfristig folgt schließlich das Einsetzen der Hypothyreose (Schilddrüsenunterfunktion) mit folgenden Symptomen und Befunden: Müdigkeit und Schwäche, Abgeschlagenheit, Schläfrigkeit, mentale Beeinträchtigung, Konzentrationsschwierigkeiten und Gedächtnisschwäche, Depression, Kältegefühl und Kälteintoleranz, kalte Gliedmaßen, Heiserkeit, trockene Haut, raue Haut, verminderte Schweißneigung, Gewichtszunahme, Appetitlosigkeit, Verstopfung, Zyklusstörungen, verminderte Fruchtbarkeit, Gelenkschmerzen, Missempfindungen (Parästhesien), beeinträchtigtes Hörvermögen, Luftnot, verlangsamte Bewegungen, verlangsamtes Sprechen, Bradykardie, Myxödem, verzögerte Reflexe, diffuser Haarausfall, periphere Ödeme, Ergüsse in serösen Höhlen, Karpaltunnelsyndrom. ⓘ
Zu den allgemeinen Symptomen der veränderten Stoffwechsellage kommen bei einem Teil der Patienten noch spezifische Veränderungen wie Struma oder endokrine Orbitopathie, selten auch eine schmerzhafte Schilddrüse. ⓘ
Assoziierte Erkrankungen
Die Hashimoto-Thyreoiditis ist mit einer Reihe anderer Erkrankungen assoziiert. Das heißt, diese anderen Erkrankungen treten unabhängig von einer etwaigen Behandlung überzufällig häufig bei Hashimoto-Patienten auf. Eine ursächlicher Zusammenhang ist mit solch einer Assoziation aber nicht notwendigerweise gegeben. Zu den assoziierten Erkrankungen zählen der Morbus Basedow und das B-Zell-Lymphom der Schilddrüse, Depressionen und die Hashimoto-Enzephalopathie. Schwache Assoziationen finden sich mit dem papillären Schilddrüsenkarzinom und mit Brustkrebs. Die Hashimoto-Thyreoiditis ist darüber hinaus als Autoimmunerkrankung mit anderen Autoimmunerkrankungen assoziiert; hierzu zählen im Falle der Hashimoto-Thyreoiditis insbesondere die polyendokrinen Autoimmunerkrankungen (Vitiligo, perniziöse Anämie bei Autoimmungastritis, Morbus Addison, Alopecia areata, Diabetes mellitus Typ I), die Zöliakie, die rheumatoide Arthritis und andere Erkrankungen des rheumatischen Formenkreises, Autoimmunhepatitis, primär biliäre Zirrhose, Dermatitis herpetiformis, Autoimmunthrombozytopenie, Systemischer Lupus erythematodes, Sjögren-Syndrom oder die Nesselsucht. ⓘ
Krankheitsverlauf
Der Krankheitsverlauf ist bei einem Großteil der Erkrankten leicht, doch sind auch mittelschwere und schwere Verläufe bekannt. Die Symptome sind vielfältig und – gerade am Beginn der Erkrankung – schwierig einzuordnen. Die Vielzahl und Variabilität der Symptome sowie der schleichende Verlauf erschweren die Diagnose. ⓘ
Symptome einer Unterfunktion können bereits bei subklinischen (noch als euthyreot geltenden) Wertekonstellationen auftreten, weil der individuelle Wertespielraum in der Regel sehr viel kleiner ist als das auf statistischen Auswertungen beruhende, interindividuelle Referenzwertspektrum. Selbst subklinische Wertekonstellationen können daher bereits eine Minderung der Lebensqualität nach sich ziehen. ⓘ
In extrem seltenen Fällen geht mit der Krankheit die Hashimoto-Enzephalopathie einher mit neurologischen Symptomen wie epileptischen Anfällen oder psychiatrischen Symptomen wie Halluzinationen. ⓘ
Risikofaktoren
Die starke genetische Komponente wird in Studien an eineiigen Zwillingen mit einer Konkordanz von 38-55 % bestätigt, wobei die Konkordanz der zirkulierenden Schilddrüsenantikörper unabhängig von der klinischen Präsentation noch höher ist (bis zu 80 % bei eineiigen Zwillingen). Beide Ergebnisse wurden bei zweieiigen Zwillingen nicht in ähnlichem Ausmaß beobachtet, was stark für eine hohe genetische Ätiologie spricht. ⓘ
Medikamente, die die Schilddrüsenfunktion beeinflussen
Bestimmte Medikamente oder Drogen werden mit einer Veränderung und Beeinträchtigung der Schilddrüsenfunktion in Verbindung gebracht. Bei diesen Medikamenten gibt es zwei Hauptmechanismen der Beeinflussung, die sie haben können. ⓘ
Einer der Störungsmechanismen besteht darin, dass ein Medikament die Serumtransferproteine der Schilddrüsenhormone verändert. Östrogen, Tamoxifen, Heroin, Methadon, Clofibrat, 5-Fluoruracil, Mitotan und Perphenazin erhöhen alle die Konzentration von schilddrüsenbindendem Globulin (TBG). Androgene, anabole Steroide wie Danazol, Glukokortikoide und langsam freisetzende Nikotinsäure senken die TBG-Konzentration. Furosemid, Fenoflenac, Mefenaminsäure, Salicylate, Phenytoin, Diazepam, Sulfonylharnstoffe, freie Fettsäuren und Heparin beeinträchtigen die Bindung des Schilddrüsenhormons an TBG und/oder Transthyretin. ⓘ
Der andere Mechanismus, über den Medikamente die Schilddrüsenfunktion beeinträchtigen können, ist die Veränderung des extra-thryoidalen Stoffwechsels des Schilddrüsenhormons. Propylthiouracil, Glukokortikoide, Propanolol, ionisierte Kontrastmittel, Amiodaron und Clomipramin hemmen alle die Umwandlung von T4 und T3. Phenobarbital, Rifampin, Phenytoin und Carbamazepin erhöhen den hepatischen Stoffwechsel. Cholestryamin, Colestipol, Aluminiumhydroxid, Eisensulfat und Sucralfat schließlich sind allesamt Medikamente, die die T4-Resorption verringern oder die Ausscheidung erhöhen. ⓘ
HLA-Gene
Der erste Genort, der mit Autoimmunerkrankungen der Schilddrüse in Verbindung gebracht wurde, war die Region des Haupthistokompatibilitätskomplexes (MHC) auf Chromosom 6p21. Sie kodiert für HLAs. Bestimmte HLA-Allele haben eine höhere Affinität zu autoantigenen Schilddrüsenpeptiden und können zur Entstehung von Autoimmunerkrankungen der Schilddrüse beitragen. Insbesondere bei der Hashimoto-Krankheit wurde eine abweichende Expression von HLA II auf den Thyreozyten nachgewiesen. Sie können Schilddrüsenautoantigene präsentieren und eine autoimmune Schilddrüsenerkrankung auslösen. Die Anfälligkeitsallele sind bei der Hashimoto-Krankheit nicht einheitlich. Bei Kaukasiern werden verschiedene Allele mit der Krankheit in Verbindung gebracht, darunter DR3, DR5 und DQ7. ⓘ
CTLA-4-Gene
Dieses Gen ist das zweite wichtige immunregulatorische Gen, das mit der Autoimmunerkrankung der Schilddrüse in Verbindung gebracht wird. Polymorphismen im CTLA-4-Gen können zu einer verminderten Hemmung der T-Zell-Proliferation beitragen und die Anfälligkeit für Autoimmunreaktionen erhöhen. CTLA-4 ist ein wichtiges Gen für die Anfälligkeit für Autoantikörper in der Schilddrüse. Eine Kopplung der CTLA-4-Region mit dem Vorhandensein von Schilddrüsen-Autoantikörpern wurde durch eine Ganzgenom-Kopplungsanalyse nachgewiesen. CTLA-4 wurde als wichtigster Locus für Schilddrüsenautoantikörper bestätigt. ⓘ
Protein-Tyrosin-Phosphatase-Nicht-Rezeptor-Typ 22-Gen
PTPN22 ist das jüngst identifizierte immunregulatorische Gen, das mit Autoimmunerkrankungen der Schilddrüse in Verbindung gebracht wird. Es befindet sich auf Chromosom 1p13 und wird in Lymphozyten exprimiert. Es wirkt als negativer Regulator der T-Zell-Aktivierung. Mutationen in diesem Gen sind ein Risikofaktor für viele Autoimmunkrankheiten. Eine schwächere T-Zell-Signalisierung kann zu einer beeinträchtigten thymischen Deletion autoreaktiver T-Zellen führen, und eine erhöhte PTPN22-Funktion kann zu einer Hemmung regulatorischer T-Zellen führen, die vor Autoimmunität schützen. ⓘ
Immunbezogene Gene
IFN-γ fördert die zellvermittelte Zytotoxizität gegen die Schilddrüse Mutationen, die eine erhöhte Produktion von IFN-γ verursachen, wurden mit dem Schweregrad der Hypothyreose in Verbindung gebracht. Schwere Hypothyreose ist mit Mutationen verbunden, die zu einer geringeren Produktion von IL-4 (Th2-Zytokin, das die zellvermittelte Autoimmunität unterdrückt), einer geringeren Sekretion von TGF-β (Inhibitor der Zytokinproduktion) und Mutationen von FoxP3, einem wesentlichen Regulationsfaktor für die Entwicklung der Tregs, führen. Die Entwicklung der Hashimoto-Krankheit wurde mit einer Mutation des Gens für TNF-α (Stimulator der IFN-γ-Produktion) in Verbindung gebracht, die eine höhere Konzentration dieses Gens verursacht. ⓘ
Vermeidbare Umweltfaktoren, darunter eine hohe Jodzufuhr, Selenmangel, Infektionskrankheiten und bestimmte Medikamente, wurden mit der Entwicklung von Autoimmunerkrankungen der Schilddrüse bei genetisch prädisponierten Personen in Verbindung gebracht. ⓘ
Jod
Eine übermäßige Jodzufuhr ist ein bekannter Umweltfaktor, der eine Autoimmunität der Schilddrüse auslösen kann. Eine höhere Prävalenz von Schilddrüsenautoantikörpern findet sich in Gebieten mit höherer Jodversorgung. Es wurden mehrere Mechanismen vorgeschlagen, durch die Jod die Autoimmunität der Schilddrüse fördern kann. Die Jod-Exposition führt zu einer stärkeren Jodierung des Thyreoglobulins, was seine Immunogenität durch die Schaffung neuer jodhaltiger Epitope oder die Freilegung kryptischer Epitope erhöht. Dies kann die Präsentation durch APC erleichtern, die Bindungsaffinität des T-Zell-Rezeptors erhöhen und spezifische T-Zellen aktivieren. ⓘ
Es hat sich gezeigt, dass die Jod-Exposition den Gehalt an reaktiven Sauerstoffspezies erhöht. Sie verstärken die Expression des intrazellulären Adhäsionsmoleküls 1 auf den follikulären Schilddrüsenzellen, was die immunkompetenten Zellen in die Schilddrüse locken könnte. ⓘ
Jod ist für Schilddrüsenzellen toxisch, da hochreaktive Sauerstoffspezies an Membranlipide und -proteine binden können. Dies führt zu einer Schädigung der Thyreozyten und zur Freisetzung von Autoantigenen. Jod fördert auch die Apoptose der Follikelzellen und hat einen Einfluss auf die Immunzellen (verstärkte Reifung dendritischer Zellen, erhöhte Anzahl von T-Zellen, stimulierte B-Zell-Immunglobulinproduktion). ⓘ
Daten aus der dänischen Untersuchung über Jodzufuhr und Schilddrüsenerkrankungen zeigen, dass in zwei Kohorten (Männer, Frauen) mit mäßigem und leichtem Jodmangel die Spiegel von Schilddrüsenperoxidase- und Thyreoglobulin-Antikörpern bei Frauen höher sind und die Prävalenzraten beider Antikörper mit dem Alter zunehmen. ⓘ
Geschlecht
In einer Studie an gesunden dänischen Zwillingen, die in drei Gruppen eingeteilt wurden (eineiige und zweieiige Zwillingspaare gleichen Geschlechts und Zwillingspaare anderen Geschlechts), wurde geschätzt, dass der genetische Beitrag zur Anfälligkeit für Schilddrüsenperoxidase-Antikörper bei Männern 61 % und bei Frauen 72 % beträgt, und der Beitrag zur Anfälligkeit für Thyreoglobulin-Antikörper bei Männern 39 % und bei Frauen 75 %. ⓘ
Der hohe Frauenanteil bei der Autoimmunität der Schilddrüse könnte mit dem X-Chromosom zusammenhängen. Es enthält geschlechts- und immunbezogene Gene, die für die Immuntoleranz verantwortlich sind. Eine höhere Inzidenz der Autoimmunität der Schilddrüse wurde bei Patienten mit einer höheren Rate an X-Chromosom-Monosomie in den peripheren weißen Blutkörperchen festgestellt. ⓘ
Ein weiterer möglicher Mechanismus könnte eine verzerrte Inaktivierung des X-Chromosoms sein, die dazu führt, dass X-gebundene Selbstantigene der Präsentation im Thymus entgehen und die T-Zell-Toleranz verloren geht. ⓘ
Das Vorliegen anderer Autoimmunerkrankungen ist ein Risikofaktor für die Entwicklung einer Hashimoto-Thyreoiditis, und das Gegenteil ist ebenfalls der Fall. Zu den Autoimmunerkrankungen, die am häufigsten mit der Hashimoto-Thyreoiditis in Verbindung gebracht werden, gehören Zöliakie, Typ-1-Diabetes, Vitiligo und Alopezie. ⓘ
Die beteiligten Gene variieren in den verschiedenen ethnischen Gruppen, und die Inzidenz ist bei Menschen mit Chromosomenstörungen, einschließlich Turner-, Down- und Klinefelter-Syndromen, die in der Regel mit Autoantikörpern gegen Thyreoglobulin und Thyreoperoxidase einhergehen, erhöht. Die fortschreitende Verarmung dieser Zellen als zytotoxische Immunantwort führt zu einem höheren Grad der primären Hypothyreose mit niedrigen T3/T4-Werten und kompensatorischen TSH-Anstiegen. ⓘ
Pathophysiologie
Es wurden mehrere Mechanismen für die Entstehung der Hashimoto-Thyreoiditis vorgeschlagen. ⓘ
Es können verschiedene Autoantikörper gegen Schilddrüsenperoxidase, Thyreoglobulin und TSH-Rezeptoren vorhanden sein, obwohl bei einem kleinen Prozentsatz der Betroffenen keiner dieser Antikörper vorhanden sein kann. Wie aus verschiedenen Zwillingsstudien hervorgeht, kann auch ein Teil der Bevölkerung diese Antikörper aufweisen, ohne eine Hashimoto-Thyreoiditis zu entwickeln. Dennoch ist die antikörperabhängige, zellvermittelte Zytotoxizität ein wesentlicher Faktor für die apoptotischen Folgen der Hashimoto-Thyreoiditis. Die Aktivierung zytotoxischer T-Lymphozyten (CD8+ T-Zellen) als Reaktion auf die zellvermittelte Immunantwort der Helfer-T-Lymphozyten (CD4+ T-Zellen) ist für die Zerstörung der Thyreozyten von zentraler Bedeutung. Wie für Typ-IV-Hypersensitivitäten charakteristisch, ist die Rekrutierung von Makrophagen ein weiterer Effekt der Aktivierung von T-Helfer-Lymphozyten, wobei Lymphozyten der Th1-Achse im Schilddrüsengewebe entzündliche Zytokine produzieren, die die Makrophagenaktivierung und die Migration in die Schilddrüse zur direkten Wirkung fördern. ⓘ
Grobe morphologische Veränderungen innerhalb der Schilddrüse zeigen sich in einer allgemeinen Vergrößerung, die weitaus knotiger und unregelmäßiger ist als diffusere Muster (wie bei der Hyperthyreose). Während die Kapsel intakt ist und sich die Drüse selbst noch vom umliegenden Gewebe abgrenzt, kann die mikroskopische Untersuchung einen aufschlussreicheren Hinweis auf das Ausmaß der Schädigung liefern. ⓘ
Histologisch zeigt sich die Überempfindlichkeit als diffuse parenchymale Infiltration durch Lymphozyten, insbesondere Plasma-B-Zellen, die häufig als sekundäre lymphoide Follikel (Keimzentren, nicht zu verwechseln mit den normalerweise vorhandenen kolloidgefüllten Follikeln, die die Schilddrüse bilden) zu sehen sind. Die Atrophie der Kolloidkörper wird von Hürthle-Zellen ausgekleidet, Zellen mit stark eosinophilem, körnigem Zytoplasma, einer Metaplasie der normalen quaderförmigen Zellen, die die Auskleidung der Schilddrüsenfollikel bilden. Eine schwere Schilddrüsenatrophie zeigt sich häufig mit dichteren fibrotischen Bändern aus Kollagen, die innerhalb der Schilddrüsenkapsel verbleiben. ⓘ
Diagnose


Diagnostisch relevant sind:
- Thyreoperoxidase-Antikörper (Antikörper gegen Thyreoperoxidase = Thyroidperoxidase) (TPO-AK), auch Mikrosomale Antikörper (MAK) genannt
- Antikörper gegen Thyreoglobulin (Tg-AK bzw. TAK) ⓘ
Im weit überwiegenden Teil der Fälle sind die TPO-Antikörper erhöht (mit oder ohne Erhöhung der Tg-AK). In einem weitaus geringeren Teil der Fälle sind nur die Tg-Antikörper (stärker) erhöht. In sehr seltenen Fällen liegt eine Hashimoto-Thyreoiditis vor, ohne dass die genannten Antikörper nachweisbar sind. Die Diagnose wird dann anhand anderer Kriterien (Struma ohne andere Erklärung oder lymphozytäre Infiltration in der Schilddrüsenpunktion) gestellt. ⓘ
Für eine Beurteilung der Stoffwechsellage der Schilddrüse sind folgende Hormonwerte relevant:
- TSH (Thyroidea-Stimulierendes Hormon)
- T3 (Trijodthyronin), bzw. freies T3 (= fT3)
- T4 (Levothyroxin = L-Thyroxin = Tetrajodthyronin), bzw. freies T4 (= fT4) ⓘ
Eine Schilddrüsendiagnostik, die sich ausschließlich auf den TSH-Wert stützt, ist zur Erkennung einer Hashimoto-Thyreoiditis meist nicht aussagekräftig genug, denn auch ein normwertiger TSH-Spiegel oder normwertige freie T3- und T4-Werte sind keine Ausschlusskriterien für eine Hashimoto-Thyreoiditis. ⓘ
Sehr wichtig für die Diagnose ist zudem ein Sonogramm der Schilddrüse. Typischerweise erscheint die Schilddrüse im Ultraschallbild inhomogen und echoarm, was auf die laufende Zerstörung hinweist. Zudem kann die im Doppler-Sonogramm erkennbare verstärkte Durchblutung ein Hinweis auf eine Entzündung sein. Auch die Größe der Schilddrüse kann im Sonogramm beurteilt werden. Da die hypertrophe Form der Hashimoto-Thyreoiditis mit einer Struma einhergehen kann, sind Größen über ca. 18 ml (Frauen) bzw. ca. 25 ml (Männer) Gesamtvolumen als auffällig anzusehen. Kleine Schilddrüsen mit einer Größe unter 6 ml (Frauen) bzw. 8 ml (Männer) sind hingegen typisch für die atrophische Verlaufsform (Ord-Thyreoiditis), wobei einschränkend angemerkt werden muss, dass diese Größenangaben – je nach Autor – stark schwanken und Gegenstand der Diskussion sind. In Deutschland ist die sogenannte atrophische Verlaufsform mit schrumpfender Schilddrüse weitaus häufiger als die hypertrophe Form mit Kropfbildung (Struma). ⓘ
Insbesondere zu Beginn der Erkrankung kann die Unterscheidung zwischen Hashimoto-Thyreoiditis und Morbus Basedow (eine Autoimmunerkrankung, die zur Überproduktion von Schilddrüsenhormonen führt) schwierig sein, da auch bei Hashimoto anfängliche Überfunktionsschübe vorliegen können und bei Morbus Basedow TPO-Ak und Tg-Ak positiv sein können. Gegebenenfalls kann eine Schilddrüsenszintigraphie Klarheit bringen, da sie bei Morbus Basedow einen erhöhten Uptake des Radiopharmakons zeigt, bei der Hashimoto-Thyreoiditis dagegen einen verminderten. ⓘ
Endgültige Sicherheit bringt die histologische (feingeweblich-mikroskopische) Untersuchung von Schilddrüsengewebe, das mittels einer Feinnadelpunktion gewonnen wurde. Bei der Hashimoto-Thyreoiditis erkennt man neben anderen Kriterien vor allem ein dichtes Infiltrat von Lymphozyten und auch Lymphfollikel (siehe Abbildung), die Ausdruck der entzündlichen Vorgänge sind. ⓘ

Die Diagnose wird in der Regel durch den Nachweis erhöhter Werte von Antithyreoid-Peroxidase-Antikörpern im Serum gestellt, aber auch eine seronegative (ohne zirkulierende Autoantikörper) Thyreoiditis ist möglich. ⓘ
Angesichts der relativ unspezifischen Symptome der anfänglichen Hypothyreose wird die Hashimoto-Thyreoiditis häufig als Depression, Zyklothymie, prämenstruelles Syndrom, chronisches Müdigkeitssyndrom, Fibromyalgie und seltener als erektile Dysfunktion oder Angststörung fehldiagnostiziert. Bei der groben Untersuchung zeigt sich häufig eine harte Struma, die sich nicht schmerzhaft anfühlt; andere Symptome, die bei einer Hypothyreose auftreten, wie z. B. ein periorbitales Myxödem, hängen vom aktuellen Stand der Reaktion ab, insbesondere angesichts der in der Regel schrittweisen Entwicklung einer klinisch relevanten Hypothyreose. Die Bestimmung des schilddrüsenstimulierenden Hormons (TSH), des freien T3, des freien T4 und der Antithyreoglobulin-Antikörper (Anti-Tg), der Antithyreoidea-Peroxidase-Antikörper (Anti-TPO oder TPOAb) und der antimikrosomalen Antikörper kann helfen, eine genaue Diagnose zu stellen. Bei einer früheren Beurteilung der Person kann es zu erhöhten Thyreoglobulinwerten aufgrund einer vorübergehenden Thyreotoxikose kommen, da eine Entzündung in der Schilddrüse die Integrität der Schilddrüsenfollikel, die Thyreoglobulin speichern, beeinträchtigt; die TSH-Sekretion aus dem Hypophysenvorderlappen steigt als Reaktion auf eine Abnahme der negativen Rückkopplungshemmung, die auf eine Abnahme der Schilddrüsenhormone im Serum zurückzuführen ist. In der Regel ist T4 der bevorzugte Schilddrüsenhormontest für Hypothyreose. Man geht davon aus, dass diese Exposition des Körpers gegenüber erheblichen Mengen zuvor isolierter Schilddrüsenenzyme zur Verschlimmerung des Toleranzabbaus beiträgt, was zu den ausgeprägteren Symptomen führt, die im späteren Verlauf der Krankheit auftreten. Die lymphozytäre Infiltration des thyreozytenassoziierten Gewebes führt häufig zu dem histologisch bedeutsamen Befund der Entwicklung von Keimzentren innerhalb der Schilddrüse. ⓘ
Tritt das Hashimoto-Syndrom als Manie auf, wird es nach Ashok Prasad, dem Psychiater, der es erstmals beschrieb, als Prasad-Syndrom bezeichnet. ⓘ
Diagnosekriterien
Für die Diagnostik einer Hashimoto-Thyreoiditis wurden unterschiedliche Kriteriensysteme entwickelt, die aber inhaltlich ähnlich sind. ⓘ
Nach den Kriterien der Japan Thyroid Association wird folgendermaßen entschieden:
| Klasse | Kriterien ⓘ |
|---|---|
| Klinische Zeichen (A) | Vergrößerte Schilddrüse (Struma) ohne andere erklärende Ursache (z. B. Jodmangel, Morbus Basedow oder Schilddrüsenautonomie) |
| Laborbefunde (B) | positive MAK- bzw. TPO-Antikörper positive Tg-Antikörper lymphozytäre Infiltration in der punktionszytologischen Untersuchung |
- Definitive Diagnose: A + mind. ein Kriterium aus B erfüllt
- Verdachtsdiagnose 1: Hypothyreose ohne andere erklärbare Ursache
- Verdachtsdiagnose 2: Antikörper ohne Schilddrüsenfunktionsstörung oder Struma
- Mögliche Diagnose: Hypoechogene und/oder inhomogene Struktur in der Schilddrüsensonographie ⓘ
Behandlung
Die Hashimoto-Thyreoiditis als Autoimmunprozess ist derzeit nicht heilbar und wird auch nicht ursächlich behandelt. Wenn die Schilddrüse aufgrund der chronischen Entzündung nicht mehr ausreichend Schilddrüsenhormone herstellen kann, muss die Unterfunktion durch (einschleichende) Substitution therapiert werden. ⓘ
Die Substitution erfolgt durch tägliche orale Einnahme der Schilddrüsenhormone. Wegen des hohen physiologischen Hormonspiegels in den frühen Morgenstunden wird empfohlen, die Tablette am Morgen ca. 30 Minuten vor der ersten Mahlzeit einzunehmen. Dafür stehen unterschiedliche Möglichkeiten zur Verfügung: die alleinige Einnahme von Thyroxin (T4, Levothyroxin), wenn die Umwandlung von T4 zu T3 im Körper nicht gestört ist, oder eine Kombination aus T4 und T3 entweder als Kombinationspräparat mit festem T4/T3-Verhältnis oder mit frei dosierbaren Einzelpräparaten. ⓘ
Der TSH-Wert und eventuell auch die Hormonspiegel fT3 und fT4 müssen regelmäßig überprüft werden, da sich im Laufe der Erkrankung Veränderungen einstellen können, die eine Dosisanpassung erfordern. Zusätzlich sollte die Schilddrüse in regelmäßigen Abständen (alle 6 bis 12 Monate) sonografisch kontrolliert werden. ⓘ
Die erfolgreiche Einstellung dauert oft mehrere Monate bis zu 2 Jahre. Je länger eine Unterfunktion bereits andauert und je schwerer sie ist, desto langwieriger ist es in der Regel, einen befriedigenden Hormonstatus und Wohlbefinden zu erreichen. Da auch Schwankungen oder Schübe zum Krankheitsbild gehören können, ist bei der Dosisfindung teilweise viel Geduld erforderlich. ⓘ
Die Substitutionstherapie ist in der Regel lebenslang erforderlich. Bei einer guten Einstellung ist der Patient meist beschwerdefrei und die Lebenserwartung nicht vermindert. Bei schweren Verläufen können die Beschwerden trotz Hormontherapie bestehen bleiben. ⓘ
Bei L-Thyroxin können sich bereits geringe Dosisänderungen (z. B. von 12,5 μg) bemerkbar machen (geringe therapeutische Breite). Daher sollte möglichst kein Wechsel auf ein Präparat eines anderen Herstellers erfolgen, da nicht gewährleistet ist, dass die aufgenommene Wirkstoffmenge vergleichbar ist (Bioverfügbarkeit). Deshalb findet sich L-Thyroxin auch auf der Substitutionsausschlussliste. ⓘ
Es gibt zwar Studien, die darauf hindeuten, dass sich eine Supplementierung mit dem Spurenelement Selen positiv auf den Immunprozess auswirkt. Für eine damit einhergehende positive Wirkung auf die Schilddrüse fehlen jedoch aussagekräftige Belege. ⓘ
Behandlungsfehler ⓘ
Jod in Tablettenform hingegen sollte bei einer Hashimoto-Thyreoiditis nicht zusätzlich eingenommen werden, da ein Jodüberschuss die Entzündung der Schilddrüse fördern kann. Daneben können getrocknete Algen und Seetang einen hohen Jodgehalt aufweisen, sodass es bereits bei kleinen Portionen zu einer hohen Jodzufuhr kommen kann. Ansonsten gelten die in der Nahrung enthaltenen Jodmengen als unbedenklich. ⓘ
Steuerung des Hormonspiegels
Eine durch Hashimoto-Thyreoiditis verursachte Schilddrüsenunterfunktion wird mit Schilddrüsenhormon-Ersatzpräparaten wie Levothyroxin, Triiodthyronin oder Schilddrüsenextrakt behandelt. Eine Tablette, die einmal täglich eingenommen wird, hält den Schilddrüsenhormonspiegel im Allgemeinen normal. In den meisten Fällen muss die Behandlung für den Rest des Lebens eingenommen werden. Wenn die Hypothyreose durch eine Hashimoto-Thyreoiditis verursacht wird, kann empfohlen werden, den TSH-Wert unter 3,0 mIU/l zu halten. ⓘ
Prognose
Eine offene, symptomatische Schilddrüsenfehlfunktion ist die häufigste Komplikation. Etwa 5 % der Menschen mit subklinischer Hypothyreose und chronischer Autoimmunthyreoiditis entwickeln jedes Jahr eine Schilddrüseninsuffizienz. Manchmal kommt es zu vorübergehenden Phasen der Thyreotoxikose (Überfunktion der Schilddrüse), und selten kann die Krankheit zu einer vollständigen Hyperthyreose (Morbus Basedow) mit aktiver Orbitopathie (hervortretende, entzündete Augen) fortschreiten. Seltene Fälle von fibröser Autoimmunthyreoiditis treten mit schwerer Kurzatmigkeit und Schluckbeschwerden auf und ähneln aggressiven Schilddrüsentumoren, aber diese Symptome bessern sich immer mit einer Operation oder einer Kortikosteroidtherapie. Obwohl das primäre B-Zell-Lymphom der Schilddrüse weniger als eine von 1000 Personen betrifft, ist es wahrscheinlicher, dass es bei Personen mit langjähriger Autoimmunthyreoiditis auftritt, da das Risiko, ein primäres Schilddrüsenlymphom zu entwickeln, bei Patienten mit Hashimoto-Thyreoiditis um das 67- bis 80-fache erhöht ist. ⓘ
Epidemiologie
Die Hashimoto-Thyreoiditis ist eine der häufigsten Autoimmunerkrankungen des Menschen und die häufigste Ursache der primären Schilddrüsenunterfunktion. Eine US-amerikanische Erhebung aus dem Jahr 2003 fand bei 10 % der Probanden einer Bevölkerungsstichprobe erhöhte Antikörper, bei 4,3 % subklinische und bei 0,3 % klinisch manifeste Hypothyreosen. Eine neuere Studie fand 10 % klinische und subklinische Hypothyreosen. Lehrbüchern zufolge liegt die Erkrankungshäufigkeit der mit einer Hashimoto-Thyreoiditis häufig einhergehenden Schilddrüsenunterfunktion in Westeuropa bei 1–2 %; subklinische Verläufe sind jedoch häufiger und liegen im Bereich von 6–8 %. Frauen erkranken deutlich häufiger als Männer (Verhältnis 2:1 bis 5:1). Es finden sich familiäre Häufungen, d. h., es wird nur die Veranlagung für Hashimoto vererbt. Beobachtungen zeigen, dass die Hashimoto-Thyreoiditis in zeitlichem Zusammenhang mit hormonellen Umstellungen (Pubertät, Entbindung, Wechseljahre) und Belastungssituationen entstehen kann. ⓘ
Persönliche charakteristische Trends
Insgesamt sind bis zu 2 % der Allgemeinbevölkerung von der Hashimoto-Thyreoiditis betroffen. Etwa 5 % der Kaukasier entwickeln irgendwann in ihrem Leben die Hashimoto-Thyreoiditis. In den USA erkrankt die afroamerikanische Bevölkerung seltener, aber die damit verbundene Sterblichkeit ist höher. Auch in der asiatischen Bevölkerung ist die Krankheit weniger häufig. Etwa 1,0 bis 1,5 von 1000 Menschen haben diese Krankheit zu irgendeinem Zeitpunkt. Sie tritt bei Frauen 8 bis 15 Mal häufiger auf als bei Männern. Einige Untersuchungen deuten auf einen Zusammenhang mit der Rolle der Plazenta als Erklärung für den Geschlechtsunterschied hin. Obwohl die Krankheit in jedem Alter auftreten kann, auch bei Kindern, wird sie am häufigsten bei Frauen im Alter zwischen 30 und 60 Jahren beobachtet. Die höchste Prävalenz wurde in einer Studie bei den älteren Mitgliedern der Gemeinschaft festgestellt. ⓘ
Bei Personen, die bereits an einer Autoimmunerkrankung leiden, ist das Risiko, an Hashimoto zu erkranken, größer, da die Krankheiten in der Regel nebeneinander auftreten. Zu den häufigsten Krankheiten, die gleichzeitig mit Hashimoto auftreten, gehören Zöliakie, Multiple Sklerose, Typ-1-Diabetes, Vitiligo und rheumatoide Arthritis. ⓘ
Eine angeborene Hypothyreose betrifft 1 von 3500-4000 Neugeborenen bei der Geburt und ist eine Variante der geistigen Behinderung, die bei frühzeitiger Erkennung behandelt werden kann, aber oft schwer zu diagnostizieren ist, da die Symptome in jungen Jahren minimal sind. Die angeborene Hypothyreose wird im Allgemeinen durch Defekte der Schilddrüse verursacht, aber in den meisten Fällen in Europa, Asien und Afrika kann die Jodzufuhr eine Hypothyreose bei Neugeborenen verursachen. ⓘ
Geografischer Einfluss von Ernährungstrends
Das Risiko einer Bevölkerung, an Schilddrüsenerkrankungen zu erkranken, hängt davon ab, ob die Ernährung eine hohe oder niedrige Jodzufuhr aufweist. In Regionen mit hoher Jodzufuhr und bei Menschen, die genetisch anfällig sind, treten Schilddrüsenerkrankungen häufiger auf. Die Geografie spielt eine große Rolle dabei, welche Regionen Zugang zu jodarmer oder jodreicher Ernährung haben. Der Jodgehalt von Wasser und Salz sollte streng überwacht werden, um gefährdete Bevölkerungsgruppen vor der Entwicklung einer Hypothyreose zu schützen. ⓘ
Die geografischen Trends der Hypothyreose sind weltweit unterschiedlich, da die Krankheit an verschiedenen Orten unterschiedlich definiert und die Fälle unterschiedlich gemeldet werden. Populationen, die weit verstreut oder schlecht definiert sind, können die Daten in unerwarteter Weise verzerren. ⓘ
Die Jodmangelerkrankung (IDD) wird durch eine Erhöhung des Jodgehalts in der Ernährung bekämpft. Wenn sich die Ernährung einer Person drastisch ändert, steigt das Risiko, dass sie eine Schilddrüsenunterfunktion und andere Schilddrüsenerkrankungen entwickelt. Die Bekämpfung von IDD mit einer hohen Salzzufuhr sollte sorgfältig und vorsichtig erfolgen, da das Risiko für Hashimoto steigen kann. Wenn man seine Ernährung umstellt, ist es wichtig, dass ein Arzt sicherstellt, dass die Ernährungsumstellung die beste Option ist, da die Empfehlungen von Person zu Person variieren können. ⓘ
Säkulare Trends
Die säkularen Trends der Hypothyreose zeigen, wie sich die Krankheit im Laufe der Zeit aufgrund von Veränderungen in der Technologie und den Behandlungsmöglichkeiten verändert hat. Obwohl sich die Ultraschalltechnologie und die Behandlungsmöglichkeiten verbessert haben, ist die Inzidenz der Hypothyreose nach Daten, die sich auf die USA und Europa konzentrieren, gestiegen. Zwischen 1993 und 2001 lag die Häufigkeit der Erkrankung pro 1000 Frauen zwischen 3,9 und 4,89. Zwischen 1994 und 2001 stieg die Krankheit pro 1000 Männer von 0,65 auf 1,01. ⓘ
Änderungen in der Definition der Hypothyreose und der Behandlungsmöglichkeiten verändern die Inzidenz und Prävalenz der Krankheit insgesamt. Die Behandlung mit Levothyroxin ist individuell und ermöglicht es daher, die Krankheit mit der Zeit besser in den Griff zu bekommen, sie kann jedoch nicht geheilt werden. ⓘ
Geschichte
Die Hashimoto-Thyreoiditis, auch bekannt als Morbus Hashimoto, ist nach dem japanischen Arzt Hakaru Hashimoto (1881-1934) von der medizinischen Fakultät der Universität Kyushu benannt, der die Symptome von Personen mit Struma lymphomatosa, einer starken Infiltration von Lymphozyten innerhalb der Schilddrüse, erstmals 1912 in der deutschen Zeitschrift Archiv für Klinische Chirurgie beschrieb. Dieser Artikel umfasste 30 Seiten und 5 Abbildungen, die alle die histologischen Veränderungen im Schilddrüsengewebe beschrieben. Außerdem wurden alle Ergebnisse seiner ersten Studie an vier Frauen erhoben. Diese Ergebnisse erklärten die bei diesen Frauen beobachteten pathologischen Merkmale, insbesondere die Infiltration von Lymphoid- und Plasmazellen sowie die Bildung von Lymphfollikeln mit Keimzentren, Fibrose, degenerierten Schilddrüsenepithelzellen und Leukozyten im Lumen. Er beschrieb diese Merkmale, die histologisch denen der Mikulic-Krankheit ähneln. Als er diese Merkmale bei dieser neuen Krankheit entdeckte, nannte er sie, wie oben erwähnt, Struma lymphomatosa. Diese Krankheit betonte die Infiltration mit lymphatischen Zellen und die Bildung von lymphatischen Follikeln mit Keimzentren, was beides zuvor noch nie berichtet worden war. ⓘ
Trotz der Entdeckung und Veröffentlichung durch Dr. Hashimoto wurde die Krankheit leider nicht als etwas anerkannt, das sich von der Reidel-Thyreoiditis unterscheidet, die zu dieser Zeit in Europa eine häufige Erkrankung war. Obwohl viele weitere Artikel von anderen Forschern veröffentlicht wurden, wurde die Hashimoto-Struma lymphomatosa erst in den frühen 1900er Jahren als Frühphase der Reidel-Thyreoiditis anerkannt. Erst 1931 wurde die Krankheit als eigenständige Krankheit anerkannt, als die Forscher Allen Graham et al. aus Cleveland über die Symptome und das Erscheinungsbild in derselben detaillierten Weise wie Hakaru berichteten. ⓘ
1956 konnten Dr. Rose und Dr. Witebsky zeigen, dass die Immunisierung bestimmter Nagetiere mit Schilddrüsenextrakten anderer Nagetiere der Krankheit ähnelte, die Hakaru und andere Forscher zu beschreiben versuchten. Diese Ärzte konnten auch Anti-Thyroglobulin-Antikörper in Blutserumproben derselben Tiere nachweisen. ⓘ
Später im selben Jahr konnten Forscher des Middlesex-Krankenhauses in London Experimente am Menschen an Patienten durchführen, die ähnliche Symptome aufwiesen. Sie reinigten Anti-Thyroglobulin-Antikörper aus deren Serum und konnten daraus schließen, dass diese Kranken eine immunologische Reaktion auf menschliches Thyroglobulin haben. Aufgrund dieser Daten wurde vorgeschlagen, dass es sich bei der Hashimoto-Struma um eine Autoimmunerkrankung der Schilddrüse handeln könnte. ⓘ
Im Jahr 1957 wurde sie als Autoimmunerkrankung anerkannt und war die erste organspezifische Autoimmunerkrankung, die identifiziert wurde. ⓘ
Nach dieser Anerkennung veröffentlichten dieselben Forscher vom Middlesex Hospital 1962 einen Artikel in der Zeitschrift Lancet, der ein Porträt von Hakaru Hashimoto enthielt. Von diesem Zeitpunkt an wurde die Krankheit sehr viel bekannter, und die Hashimoto-Krankheit wurde immer häufiger in Lehrbüchern erwähnt. ⓘ
Seit diesen Entdeckungen konnte eine Reihe von Autoimmunkrankheiten entdeckt werden, von denen mehrere mit schilddrüsenspezifischen Antikörpern zu tun haben. ⓘ
Schwangerschaft
Schwangere Frauen, bei denen ein positiver Befund für Hashimoto-Thyreoiditis vorliegt, können eine verminderte Schilddrüsenfunktion haben oder die Drüse kann ganz ausfallen. Wenn eine Frau TPOAb-positiv ist, können Ärzte sie über die Risiken für sich und ihr Kind informieren, wenn die Krankheit unbehandelt bleibt. "Schilddrüsenperoxidase-Antikörper (TPOAb) werden bei 10 % der schwangeren Frauen nachgewiesen", was ein Risiko für diese Schwangerschaften darstellt. Frauen mit einer Schilddrüsenunterfunktion, die nicht stabilisiert wurde, haben ein höheres Risiko für ein Kind mit niedrigem Geburtsgewicht, neonataler Atemnot, Hydrocephalus, Hypospadie, Fehlgeburt und Frühgeburt. Die Embryotransplantationsrate und die Erfolgsaussichten einer Schwangerschaft verbessern sich, wenn das Hashimoto-Syndrom behandelt wird. Es wird empfohlen, schwangere Frauen nur zu behandeln, wenn sie während der gesamten Schwangerschaft TPOAb-positiv sind, und alle schwangeren Frauen auf ihre Schilddrüsenwerte zu untersuchen. Eine enge Zusammenarbeit zwischen Endokrinologen und Geburtshelfern kommt der Frau und dem Kind zugute. Die Endocrine Society empfiehlt ein Screening bei schwangeren Frauen, bei denen ein hohes Risiko für eine Autoimmunerkrankung der Schilddrüse besteht. ⓘ
Ein Test auf Schilddrüsenperoxid-Antikörper wird für Frauen empfohlen, die schon einmal schwanger waren, unabhängig vom Ausgang der Schwangerschaft. "Frühere Schwangerschaften spielen eine wichtige Rolle bei der Entwicklung einer autoimmunen Hypothyreose bei prämenopausalen Frauen, und die Anzahl früherer Schwangerschaften sollte bei der Bewertung des Risikos einer Hypothyreose bei jungen Frauen berücksichtigt werden. ⓘ
Hormonelle Veränderungen und die Expression wichtiger immunmodulatorischer Moleküle durch den Trophoblasten führen zu Immunsuppression und fetaler Toleranz. Hauptakteure bei der Regulierung der Immunantwort sind Tregs. Sowohl zellvermittelte als auch humorale Immunantworten werden abgeschwächt, was zu Immuntoleranz und Unterdrückung der Autoimmunität führt. Es wurde berichtet, dass während der Schwangerschaft die Spiegel von Schilddrüsenperoxidase und Thyreoglobulin-Antikörpern abnehmen. Nach der Geburt nehmen die Tregs rasch ab, und die Immunreaktionen werden wiederhergestellt. Dies kann zum Auftreten oder zur Verschlimmerung der Autoimmunerkrankung der Schilddrüse führen. Bei bis zu 50 % der Frauen mit Schilddrüsenperoxidase-Antikörpern in der Frühschwangerschaft verschlimmert sich die Autoimmunität der Schilddrüse in der Zeit nach der Geburt in Form einer postpartalen Thyreoiditis. Bei Frauen mit postpartaler Thyreoiditis wurde eine höhere Sekretion von IFN-γ und IL-4 sowie eine niedrigere Plasmakortisolkonzentration während der Schwangerschaft festgestellt als bei gesunden Frauen. Dies deutet darauf hin, dass eine schwächere Immunsuppression während der Schwangerschaft zur postpartalen Schilddrüsenfunktionsstörung beitragen könnte. ⓘ
Fötaler Mikrochimärismus
Mehrere Jahre nach der Entbindung können die chimären männlichen Zellen im mütterlichen peripheren Blut, in der Schilddrüse, der Lunge, der Haut oder den Lymphknoten nachgewiesen werden. Die fetalen Immunzellen in der mütterlichen Schilddrüse können aktiviert werden und als Auslöser fungieren, der die Autoimmunerkrankung der Schilddrüse einleiten oder verschlimmern kann. Bei Hashimoto-Patientinnen wurden fetale mikrochimäre Zellen in der Schilddrüse in deutlich höherer Zahl nachgewiesen als bei gesunden Frauen. ⓘ
Ursachen
Die genauen Wirkfaktoren, die zum Ausbruch einer Hashimoto-Thyreoiditis führen können, sind noch nicht hinreichend geklärt. Zur Debatte stehen neben einer familiären (genetischen) Vorbelastung auch Stress, schwer verlaufende Viruserkrankungen (wie Pfeiffer-Drüsenfieber, Gürtelrose), Dysfunktionen der Nebennierenrinde, Mikrochimerismus und Umwelteinwirkungen. Überzufällig häufig findet sich die Hashimoto-Thyreoiditis beim PCO-Syndrom. Debattiert wird zurzeit über die Bedeutung einer übermäßigen Jodzufuhr für den Ausbruch der Krankheit. Als relativ sicher kann gelten, dass sie, genau wie Morbus Basedow, durch sehr hohe Joddosen (Jodexzess) ausgelöst werden kann (z. B. durch jodhaltige Kontrastmittel). Mögliche Gefahren, die von einer Jodierung der Nahrungsmittel (als Folge der Futtermitteljodierung bei Nutztieren und der Kochsalzjodierung) ausgehen, werden diskutiert (vgl. Jodmangel, Jodunverträglichkeit). ⓘ