Leishmaniose
| Leishmaniose ⓘ | |
|---|---|
| Andere Namen | Leishmaniose |
 | |
| Kutane Leishmaniose an der Hand eines mittelamerikanischen Erwachsenen | |
| Aussprache |
|
| Fachgebiet | Ansteckende Krankheit |
| Symptome | Hautgeschwüre, Fieber, niedrige rote Blutkörperchen, vergrößerte Leber |
| Auslöser | Leishmanien-Parasiten, die durch Sandmücken übertragen werden |
| Vorbeugung | Moskitonetze, Insektizide |
| Häufigkeit | 4-12 Millionen |
| Todesfälle | 24,200 (2015) |
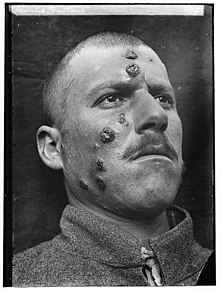
Bei der Leishmaniose handelt es sich um ein breites Spektrum klinischer Erscheinungen, die durch Parasiten der Trypanosomen-Gattung Leishmania verursacht werden. Sie wird in der Regel durch den Stich von Phlebotomus- und Lutzomyia-Sandmücken übertragen und tritt am häufigsten in den Tropen und Subtropen Afrikas, Asiens, Amerikas und Südeuropas auf. Die Krankheit kann auf drei Arten auftreten: kutan, mukokutan oder viszeral. Die kutane Form beginnt mit Hautgeschwüren, während die mukokutane Form mit Geschwüren der Haut, des Mundes und der Nase auftritt. Die viszerale Form beginnt mit Hautgeschwüren und zeigt später Fieber, eine niedrige Anzahl roter Blutkörperchen sowie eine vergrößerte Milz und Leber. ⓘ
Infektionen beim Menschen werden durch mehr als 20 Leishmanienarten verursacht. Zu den Risikofaktoren gehören Armut, Unterernährung, Entwaldung und Verstädterung. Alle drei Arten können durch den mikroskopischen Nachweis der Parasiten diagnostiziert werden. Zusätzlich kann die viszerale Erkrankung durch Bluttests diagnostiziert werden. ⓘ
Die Leishmaniose kann teilweise verhindert werden, indem man unter mit Insektiziden behandelten Netzen schläft. Weitere Maßnahmen sind das Versprühen von Insektiziden zur Abtötung von Sandmücken und die frühzeitige Behandlung von Erkrankten, um eine weitere Ausbreitung zu verhindern. Die erforderliche Behandlung richtet sich nach dem Ort, an dem die Krankheit erworben wurde, nach der Leishmanienart und nach der Art der Infektion. Zu den möglichen Medikamenten, die bei viszeralen Erkrankungen eingesetzt werden, gehören liposomales Amphotericin B, eine Kombination aus fünfwertigen Antimonialen und Paromomycin sowie Miltefosin. Bei Erkrankungen der Haut können Paromomycin, Fluconazol oder Pentamidin wirksam sein. ⓘ
In rund 98 Ländern sind derzeit etwa 4 bis 12 Millionen Menschen infiziert. Jedes Jahr gibt es etwa 2 Millionen neue Fälle und zwischen 20 und 50 Tausend Todesfälle. Etwa 200 Millionen Menschen in Asien, Afrika, Süd- und Mittelamerika und Südeuropa leben in Gebieten, in denen die Krankheit weit verbreitet ist. Die Weltgesundheitsorganisation hat Rabatte auf einige Medikamente zur Behandlung der Krankheit erhalten. Sie wird als vernachlässigte Tropenkrankheit eingestuft. Die Krankheit kann auch bei einer Reihe anderer Tiere auftreten, darunter Hunde und Nagetiere. ⓘ
Leishmaniose oder Leishmaniase (fachsprachlich auch lateinisch Leishmaniosis und Leishmaniasis) ist eine weltweit bei Mensch und Tier vorkommende Infektionserkrankung, die durch obligat intrazelluläre protozoische Parasiten der Gattung Leishmania hervorgerufen wird. Ihr Verbreitungsgebiet sind die Tropen, besonders Peru, Kolumbien und das östliche Afrika, aber auch der Mittelmeerraum und Asien. Seit Mitte der 1980er Jahre treten die Sandmücken, welche die Leishmaniose übertragen, möglicherweise durch Klimawandel, auch zunehmend in Deutschland auf. Es gibt in Deutschland verstärkt Fälle von Leishmaniose bei Tieren und vereinzelt auch bei Menschen, die Deutschland nie verlassen haben. ⓘ
Entdeckt wurde der Krankheitserreger Leishmania donovani 1900 von William B. Leishman und Charles Donovan. ⓘ

Anzeichen und Symptome

Die Symptome der Leishmaniose sind Hautgeschwüre, die Wochen bis Monate nach dem Stich einer infizierten Sandmücke ausbrechen. ⓘ
Die Leishmaniose kann in die folgenden Arten unterteilt werden:
- Die kutane Leishmaniose ist die häufigste Form, bei der an den Einstichstellen eine offene Wunde entsteht, die in einigen Monaten bis anderthalb Jahren abheilt und eine unangenehm aussehende Narbe hinterlässt. Die diffuse kutane Leishmaniose verursacht ausgedehnte Hautläsionen, die der Lepra ähneln und möglicherweise nicht von selbst abheilen.
- Die mukokutane Leishmaniose verursacht sowohl Haut- als auch Schleimhautgeschwüre, die vor allem Nase und Mund schädigen.
- Die viszerale Leishmaniose oder Kala-Azar ("schwarzes Fieber") ist die schwerste Form und verläuft in der Regel tödlich, wenn sie nicht behandelt wird. Weitere Folgen, die einige Monate bis Jahre nach der Infektion auftreten können, sind Fieber, Schädigung von Milz und Leber sowie Anämie. ⓘ
Die Leishmaniose gilt als eine der klassischen Ursachen für eine stark vergrößerte (und damit tastbare) Milz; das Organ, das bei der Untersuchung des Bauches normalerweise nicht tastbar ist, kann in schweren Fällen sogar größer als die Leber werden. ⓘ
Ursache

Die Leishmaniose wird durch den Stich infizierter weiblicher phlebotominer Sandmücken übertragen, die die Protozoen Leishmania übertragen können. (1) Die Sandmücken injizieren das infektiöse Stadium, die metazyklischen Promastigoten, bei Blutmahlzeiten. (2) Metazyklische Promastigoten in der Einstichwunde werden von Makrophagen phagozytiert und (3) verwandeln sich in Amastigoten. (4) Amastigoten vermehren sich in infizierten Zellen und befallen verschiedene Gewebe, zum Teil abhängig vom Wirt, zum Teil davon, um welche Leishmanienart es sich handelt. Diese unterschiedlichen Gewebespezifitäten sind die Ursache für die unterschiedlichen klinischen Erscheinungsformen der verschiedenen Leishmaniose-Formen. (5,6) Sandmücken infizieren sich bei Blutmahlzeiten infizierter Wirte, wenn sie mit Amastigoten infizierte Makrophagen aufnehmen. (7) Im Mitteldarm der Sandfliege differenzieren sich die Parasiten zu Promastigoten, (8) die sich vermehren, zu metazyklischen Promastigoten differenzieren und in den Rüssel wandern. ⓘ
Die Genome von drei Leishmania-Arten (L. major, L. infantum und L. braziliensis) wurden sequenziert, und dies hat viele Informationen über die Biologie des Parasiten geliefert. So weiß man zum Beispiel, dass proteincodierende Gene bei Leishmania als große polycistronische Einheiten in einer Kopf-zu-Kopf- oder Schwanz-zu-Schwanz-Anordnung organisiert sind; die RNA-Polymerase II transkribiert lange polycistronische Botschaften in Abwesenheit definierter RNA-pol-II-Promotoren, und Leishmania weist einzigartige Merkmale in Bezug auf die Regulierung der Genexpression als Reaktion auf Veränderungen in der Umwelt auf. Die neuen Erkenntnisse aus diesen Studien könnten dazu beitragen, neue Angriffspunkte für dringend benötigte Medikamente zu finden und die Entwicklung von Impfstoffen zu unterstützen. ⓘ
Vektor
Obwohl in der Literatur meist nur eine Gattung (Lutzomyia) erwähnt wird, die Leishmanien in der Neuen Welt auf den Menschen überträgt, schlug eine Studie von Galati aus dem Jahr 2003 eine neue Klassifizierung für die Sandmücken der Neuen Welt vor, die mehrere Untergattungen auf die Ebene der Gattungen erhebt. Anderswo auf der Welt gilt die Gattung Phlebotomus als Überträger der Leishmaniose. ⓘ
Mögliche nicht-menschliche Reservoirs
Es wurden einige Fälle von Infektionen nicht-menschlicher Tiere mit Leishmania-Arten, die den Menschen infizieren, beobachtet. In einer Studie wurde L. major in zwölf von einundneunzig Kotproben wild lebender Westlicher Flachlandgorillas nachgewiesen, und in einer Studie an zweiundfünfzig in Zoos in einem Leishmaniose-Endemiegebiet gehaltenen nichtmenschlichen Primaten erwiesen sich acht von ihnen (alle drei Schimpansen, drei Goldene Löwentamarine, ein Büschelkapuziner und ein angolanischer Talapoin) als infiziert mit L. infantum infiziert und in der Lage, Sandfliegen der Art Lutzomyia longipalpis zu infizieren, obwohl "die in dieser Studie beobachtete Parasitenbelastung in infizierten Sandfliegen als gering angesehen wurde". ⓘ
Organismen
Die viszerale Erkrankung wird in der Regel durch Leishmania donovani, L. infantum oder L. chagasi verursacht, gelegentlich können diese Arten jedoch auch andere Krankheitsformen auslösen. Die kutane Form der Krankheit wird durch mehr als 15 Leishmanienarten verursacht. ⓘ
Risikofaktoren
Zu den Risikofaktoren gehören Unterernährung, Abholzung, fehlende sanitäre Einrichtungen, ein unterdrücktes Immunsystem und Verstädterung. ⓘ
Klinik, Diagnostik

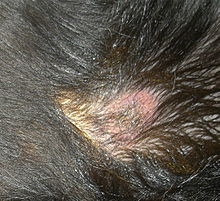

Infolge der Tatsache, dass Leishmanien nahezu alle Organsysteme des Körpers befallen können, kann sich die Krankheit sehr vielfältig darstellen. Einem Großteil der erkrankten Hunde ist jedoch das Auftreten von Störungen der Haut gemein. Anhand der Verteilung dieser Störung können Rückschlüsse auf die Prognose der Erkrankung gezogen werden:
- Symmetrischer Haarverlust und Schuppenbildung: mit 60 % der Fälle häufigstes Krankheitsbild, das vorwiegend Tiere mit intaktem Immunsystem entwickeln; beginnend am Kopf verbreitet sich die Erkrankung am gesamten restlichen Körper (sekundäre Sebadenitis).
- Hautgeschwüre über Knochenvorsprüngen, an Schwanzspitze und Ohren und im Haut-Schleimhaut-Übergang: betrifft 20 % der befallenen Tiere und deutet auf eine geschwächte Immunabwehr hin. Die Symptome werden einerseits direkt durch die Parasiten hervorgerufen, können aber auch indirekt über eine von Immunkomplexen hervorgerufene Vaskulitis verursacht werden.
- Knötchenbildung in der Haut: In die Haut eingewanderte Makrophagen führen zur Ausbildung der Knötchen; weitere Abwehrzellen sind nur geringfügig beteiligt. Die Erkrankung tritt bei etwa 12 % der Patienten auf und weist auf eine ungenügende Immunabwehr hin.
- Generalisierte Hautdegeneration mit Pustelbildung im Bereich des Körperstammes: mit 4 % die seltenste Form. Die Pusteln sind mit einer nichteitrigen Flüssigkeit und einigen Parasiten gefüllt. Die Pathogenese dieser Form ist nicht geklärt und es gibt keinen Hinweis auf einen Zusammenhang mit der Immunkompetenz des erkrankten Tieres.
- Re- oder intermittierendes Fieber mit zwei Spitzen pro Tag (doppelgipfliges Fieber) ist ein Hinweis auf eine viszerale Leishmaniose.
Neben den beschriebenen Störungen kann die Haut weitere Symptome wie übermäßige Verhornung, Krallenverkrümmung, Nagelbettentzündung und Pigmentverlust im Nasen-Maulbereich ausbilden. Auch die Schleimhäute können betroffen sein. ⓘ
Bei Katzen dominieren geschwürige und knotige Hautveränderungen das klinische Bild. Sie treten in 3/4 der Fälle auf. Bei über einem Drittel der erkrankten Katzen kommt es zu Augenerkrankungen, Anämien und Nierenschädigungen. ⓘ
Neben der Erkrankung der Haut sind häufig gleichfalls die inneren Organe betroffen (viszerale Leishmaniose). Je nach Organbeteiligung ist die Ausbildung von Leberentzündungen, Darmentzündungen, Nierenversagen, Blutgefäßentzündungen, Knochenmarkentzündungen, Gelenkentzündungen, Nervenentzündungen und Muskelentzündungen möglich. ⓘ
Infolge des sich ausgesprochen vielfältig darstellenden Krankheitsbildes kann die Diagnosefindung schwierig sein, zumal die Krankheit in den meisten Teilen Deutschlands nicht endemisch ist und daher oft nicht zur Routinediagnostik gehört. Zudem besteht kein sicherer Test für die Krankheit. ⓘ
Die Diagnosestellung beruht neben dem direkten Parasitennachweis vor allem auf Untersuchungen zur Immunantwort des Wirtes. Ein direkter Nachweis der Leishmanien kann mittels zytologischer oder histologischer Untersuchungen erfolgen, bei welchen Zellen des Knochenmarks, der Lymphknoten oder der Haut mikroskopisch untersucht werden, was eine direkte Identifizierung der sich meist intrazellulär befindenden Leishmanien ermöglicht. Als weitere Untersuchung bietet sich als gentechnische Methode die PCR an, welche bei Proben aus dem Knochenmark eine Sensitivität und Spezifität von fast 100 Prozent aufweist. ⓘ
Unter den indirekten Nachweisverfahren hat die serologische Bestimmung von Antikörpern mittels Immunfluoreszenz-Test oder ELISA die weiteste Verbreitung gefunden. Obwohl auch hier Sensitivität und Spezifität mit etwa 80 Prozent recht hoch sind, können falsch negative Ergebnisse bei frisch infizierten Tieren, welche noch keine Antikörper entwickelt haben, auftreten. Dieses Problem besteht gleichfalls beim Intrakutantest, der aber unter Umständen eine Aussage über die Schwere des Krankheitsverlaufes ermöglicht. Ferner besteht die Möglichkeit eines Stimulationstests der mononukleären Zellen des Blutes. ⓘ
Die Leishmaniose wird im hämatologischen Labor durch direkten Nachweis der Amastigoten (Leishman-Donovan-Körperchen) diagnostiziert. Buffy-Coat-Präparate aus peripherem Blut oder Aspirate aus Knochenmark, Milz, Lymphknoten oder Hautläsionen sollten auf einen Objektträger gestrichen werden, um einen dünnen Ausstrich zu erhalten, und 20 Minuten lang mit Leishman- oder Giemsa-Färbung (pH 7,2) gefärbt werden. Amastigoten finden sich in Blut- und Milzmonozyten oder, seltener, in zirkulierenden Neutrophilen und in aspirierten Gewebemakrophagen. Es handelt sich um kleine, runde Körper von 2-4 μm Durchmesser mit undeutlichem Zytoplasma, einem Zellkern und einem kleinen, stäbchenförmigen Kinetoplasten. Gelegentlich kann man Amastigoten frei zwischen Zellen liegen sehen. Die Entnahme von Gewebeproben ist jedoch oft schmerzhaft für den Patienten und die Identifizierung der infizierten Zellen kann schwierig sein. Daher wurden andere indirekte immunologische Diagnosemethoden entwickelt, darunter der Enzymimmunoassay, antigenbeschichtete Dipsticks und der direkte Agglutinationstest. Obwohl diese Tests leicht verfügbar sind, stellen sie aufgrund ihrer unzureichenden Sensitivität und Spezifität nicht die Standarddiagnose dar. ⓘ
Für den Nachweis von Leishmania-DNA stehen mehrere verschiedene Polymerase-Kettenreaktionstests (PCR) zur Verfügung. Mit diesem Test ist endlich ein spezifisches und empfindliches Diagnoseverfahren möglich. Die empfindlichsten PCR-Tests verwenden die im Parasiten vorkommende Minikreis-Kinetoplast-DNA. Die Kinetoplast-DNA enthält in ihren Maxikreisen (~25-50 pro Parasit) Sequenzen für mitochondriale Proteine und in ihren Minikreisen (~10'000 pro Parasit) des Kinetoplasten Leit-RNA. Mit dieser spezifischen Methode kann man Leishmanien auch bei einer sehr geringen Parasitenbelastung nachweisen. Wenn es darum geht, eine bestimmte Leishmanienart zu diagnostizieren und nicht nur nachzuweisen, haben sich andere PCR-Methoden als besser erwiesen. ⓘ
Die meisten Formen der Krankheit werden nur von nicht-menschlichen Tieren übertragen, aber einige können auch von Mensch zu Mensch weitergegeben werden. Infektionen beim Menschen werden von etwa 21 der 30 Arten verursacht, die Säugetiere infizieren. Die verschiedenen Arten sehen gleich aus, können aber durch Isoenzym-Analyse, DNA-Sequenzanalyse oder monoklonale Antikörper unterschieden werden. ⓘ
Vorbeugung
- Verwenden Sie Insektenschutzmittel auf exponierter Haut und unter den Enden von Ärmeln und Hosenbeinen. Befolgen Sie die Anweisungen auf dem Etikett des Repellents. Die wirksamsten Repellentien sind im Allgemeinen solche, die die Chemikalie DEET (N,N-Diethylmetatoluamid) enthalten.
- Die Leishmaniose kann teilweise durch die Verwendung von mit Insektiziden behandelten Netzen oder Insektenschutzmitteln während des Schlafs verhindert werden. Um einen guten Schutz gegen Sandmücken zu bieten, sind feine Maschenweiten von 0,6 mm oder weniger erforderlich, während ein Moskitonetz mit 1,2 mm Maschenweite die Zahl der Sandmückenstiche nur begrenzt reduzieren kann. Feinere Maschenweiten haben den Nachteil, dass sie teurer sind und die Luftzirkulation beeinträchtigen, was zu Überhitzung führen kann. Viele Angriffe von Phlebotominen-Sandmücken erfolgen bei Sonnenuntergang und nicht in der Nacht, so dass es auch sinnvoll sein kann, Netze über Türen und Fenstern anzubringen oder Insektenschutzmittel zu verwenden.
- Verwendung von mit Insektiziden imprägnierten Hundehalsbändern und Behandlung oder Keulung infizierter Hunde.
- Besprühen von Häusern und Tierheimen mit Insektiziden. ⓘ
Behandlung

Die Behandlung richtet sich danach, wo die Krankheit erworben wurde, nach der Leishmanienart und der Art der Infektion. Bei der viszeralen Leishmaniose in Indien, Südamerika und im Mittelmeerraum ist liposomales Amphotericin B die empfohlene Behandlung und wird häufig als Einzeldosis verabreicht. Die Heilungsrate mit einer Einzeldosis Amphotericin liegt Berichten zufolge bei 95 %. In Indien sind fast alle Infektionen resistent gegen pentavalente Antimonials. In Afrika wird eine Kombination aus pentavalenten Antimonialen und Paromomycin empfohlen. Diese können jedoch erhebliche Nebenwirkungen haben. Miltefosin, ein orales Medikament, ist sowohl gegen viszerale als auch kutane Leishmaniose wirksam. Die Nebenwirkungen sind im Allgemeinen gering, allerdings kann es Geburtsfehler verursachen, wenn es innerhalb von 3 Monaten vor einer Schwangerschaft eingenommen wird. Bei L. major oder L. braziliensis scheint es nicht zu wirken. ⓘ
Die Erkenntnisse über die Behandlung der kutanen Leishmaniose sind dürftig. Bei kutaner Leishmaniose kann eine Reihe von topischen Behandlungen eingesetzt werden. Welche Behandlungen wirksam sind, hängt vom Erregerstamm ab, wobei topisches Paromomycin bei L. major, L. tropica, L. mexicana, L. panamensis und L. braziliensis wirksam ist. Pentamidin ist bei L. guyanensis wirksam. Orales Fluconazol oder Itraconazol scheint bei L. major und L. tropica wirksam zu sein. Für den Einsatz von Wärmetherapie bei kutaner Leishmaniose gibt es nur begrenzte Belege (Stand 2015). ⓘ
Es gibt keine Studien zur Wirkung von oralen Nahrungsergänzungsmitteln bei viszeraler Leishmaniose, die mit einer medikamentösen Therapie gegen Leishmaniose behandelt wird. ⓘ
Miltefosin (Handelsname Impavido), welches als 2. Wahl-Therapie statt Liposomalem Amphotericin B eingesetzt wird, hat sich in Studien als wirksam gegen Leishmanien gezeigt. Miltefosin ist in Deutschland zur Behandlung der Leishmaniose des Menschen zugelassen, für Hunde in Südeuropa und in der Schweiz. ⓘ
Epidemiologie


Von den 200 Ländern und Gebieten, die der WHO Bericht erstatten, sind 97 Länder und Gebiete endemisch für Leishmaniose. Die Gebiete, in denen die Leishmaniose vorkommt, reichen von den Regenwäldern in Mittel- und Südamerika bis zu den Wüsten in Westasien und im Nahen Osten. Weltweit sind bis zu 12 Millionen Menschen betroffen, wobei jedes Jahr 1,5 bis 2,0 Millionen neue Fälle auftreten. Die viszerale Form der Leishmaniose hat eine geschätzte Inzidenz von 500.000 neuen Fälle. Im Jahr 2014 traten mehr als 90 % der der WHO gemeldeten neuen Fälle in sechs Ländern auf: Brasilien, Äthiopien, Indien, Somalia, Südsudan und Sudan. Im Jahr 2010 verursachte die Krankheit etwa 52.000 Todesfälle, gegenüber 87.000 im Jahr 1990. In den verschiedenen Regionen der Welt treten unterschiedliche Formen der Krankheit auf. Die kutane Erkrankung ist in Afghanistan, Algerien, Brasilien, Kolumbien und Iran am häufigsten, die mukokutane Erkrankung in Bolivien, Brasilien und Peru und die viszerale Erkrankung in Bangladesch, Brasilien, Äthiopien, Indien und Sudan. ⓘ
Die Leishmaniose kommt in weiten Teilen Amerikas von Nordargentinien bis Südtexas vor, allerdings nicht in Uruguay oder Chile. Kürzlich wurde nachgewiesen, dass sie sich nach Nordtexas und Oklahoma ausbreitet, und eine weitere Ausbreitung nach Norden könnte durch den Klimawandel begünstigt werden, da mehr Lebensraum für Vektoren- und Reservoirarten für die Leishmaniose geeignet wird. Die Leishmaniose ist in Lateinamerika auch als papalomoyo, papa lo moyo, úlcera de los chicleros und chiclera bekannt. Im Jahr 2004 infizierten sich schätzungsweise 3 400 Soldaten der kolumbianischen Armee, die in den Dschungeln im Süden des Landes (insbesondere in den Departements Meta und Guaviare) operierten, mit Leishmaniose. Angeblich trug dazu bei, dass viele der betroffenen Soldaten das offiziell zur Verfügung gestellte Insektenschutzmittel wegen seines störenden Geruchs nicht benutzten. Im Laufe des Jahres 2004 wurden in ganz Kolumbien fast 13.000 Fälle von Leishmaniose registriert, und im Februar 2005 wurden etwa 360 neue Fälle von Leishmaniose bei Soldaten gemeldet. ⓘ
Die Krankheit ist in weiten Teilen Asiens und im Nahen Osten verbreitet. In Afghanistan tritt die Leishmaniose häufig in Kabul auf, was zum Teil auf schlechte sanitäre Verhältnisse und nicht entsorgte Abfälle auf den Straßen zurückzuführen ist, die den Parasiten übertragenden Sandfliegen ein günstiges Umfeld bieten. In Kabul wurde die Zahl der Infizierten auf mindestens 200.000 geschätzt, in drei weiteren Städten (Herat, Kandahar und Mazar-i-Sharif) waren es nach WHO-Angaben aus dem Jahr 2002 etwa 70.000. Kabul gilt als das größte Zentrum der kutanen Leishmaniose in der Welt, mit etwa 67.500 Fällen im Jahr 2004. Auch in Afrika, vor allem im Osten und Norden, treten Fälle von Leishmaniose auf. Die Leishmaniose gilt auch in einigen Teilen des südlichen Westeuropas als endemisch und breitet sich in den letzten Jahren nach Norden aus. So wurde beispielsweise aus Madrid, Spanien, zwischen 2010 und 2012 ein Ausbruch der kutanen und viszeralen Leishmaniose gemeldet. ⓘ
Die Leishmaniose ist vor allem eine Krankheit der Entwicklungsländer und in den Industrieländern nur in wenigen Fällen bekannt, meist wenn Truppen außerhalb ihrer Heimatländer stationiert sind. Seit dem Golfkrieg 1990 wurde von den in Saudi-Arabien und im Irak stationierten US-Truppen Leishmaniose gemeldet, einschließlich viszeraler Leishmaniose. Im September 2005 erkrankten mindestens vier niederländische Marinesoldaten, die in Mazar-i-Sharif, Afghanistan, stationiert waren, an der Krankheit und wurden anschließend zur Behandlung in ihr Heimatland zurückgebracht. ⓘ
Geschichte
Beschreibungen von auffälligen Läsionen, die der kutanen Leishmaniose ähneln, finden sich auf Tafeln von König Aschurbanipal aus dem siebten Jahrhundert v. Chr., von denen einige möglicherweise auf noch frühere Texte aus der Zeit zwischen 1500 und 2500 v. Chr. zurückgehen. Persische Ärzte, darunter Avicenna im 10. Jahrhundert n. Chr., gaben ausführliche Beschreibungen der so genannten "balkh sore". Im Jahr 1756 gab Alexander Russell nach der Untersuchung eines türkischen Patienten eine der detailliertesten klinischen Beschreibungen der Krankheit. Ärzte auf dem indischen Subkontinent bezeichneten sie als Kala-Azar (ausgesprochen kālā āzār, der Urdu-, Hindi- und Hindustani-Ausdruck für "schwarzes Fieber", wobei kālā schwarz und āzār Fieber oder Krankheit bedeutet). Auf dem amerikanischen Kontinent finden sich Hinweise auf die kutane Form der Krankheit in Ecuador und Peru in präinkaischen Töpferwaren, auf denen Hautläsionen und entstellte Gesichter dargestellt sind, die auf das erste Jahrhundert n. Chr. zurückgehen. In einigen Texten aus dem 15. und 16. Jahrhundert aus der Zeit der Inka und der spanischen Kolonialherren wird die "Tal-Krankheit", die "Anden-Krankheit" oder die "weiße Lepra" erwähnt, bei der es sich wahrscheinlich um die kutane Form handelt. ⓘ
Es bleibt unklar, wer den Organismus zuerst entdeckte. David Douglas Cunningham, Oberstabsarzt der britischen Armee in Indien, hat ihn möglicherweise 1885 gesehen, ohne ihn mit der Krankheit in Verbindung bringen zu können. Peter Borovsky, ein in Taschkent tätiger russischer Militärchirurg, untersuchte die Ätiologie der "orientalischen Wunde", die lokal als "sart sore" bekannt ist, und veröffentlichte 1898 die erste genaue Beschreibung des Erregers, beschrieb korrekt die Beziehung des Parasiten zum Wirtsgewebe und ordnete ihn korrekt den Protozoen zu. Da seine Ergebnisse jedoch auf Russisch in einer Zeitschrift mit geringer Auflage veröffentlicht wurden, fanden sie zu seinen Lebzeiten keine internationale Anerkennung. 1901 identifizierte Leishman bestimmte Organismen in Abstrichen aus der Milz eines Patienten, der am "Dum-Dum-Fieber" (Dum Dum ist ein Gebiet in der Nähe von Kalkutta) gestorben war, und schlug sie als Trypanosomen vor, die zum ersten Mal in Indien gefunden wurden. Einige Monate später bestätigte Kapitän Charles Donovan (1863-1951) die Entdeckung der so genannten Leishman-Donovan-Körper in Abstrichen von Menschen in Madras in Südindien. Es war jedoch Ronald Ross, der vorschlug, dass es sich bei den Leishman-Donovan-Körpern um die intrazellulären Stadien eines neuen Parasiten handelt, den er Leishmania donovani nannte. Der Zusammenhang mit der Krankheit Kala-Azar wurde erstmals von Charles Donovan vorgeschlagen und durch Charles Bentleys Entdeckung von L. donovani bei Kala-Azar-Patienten schlüssig nachgewiesen. Die Übertragung durch die Sandmücke wurde von Lionel Napier und Ernest Struthers an der School of Tropical Medicine in Kalkutta vermutet und später von seinen Kollegen nachgewiesen. Die Krankheit wurde zu einem großen Problem für die alliierten Truppen, die während des Zweiten Weltkriegs in Sizilien kämpften; die Forschungen von Leonard Goodwin zeigten dann, dass Pentostam eine wirksame Behandlung war. ⓘ
Bei der inneren Leishmaniose oder viszeralen Leishmaniose (auch Dum-Dum-Fieber, Schwarzes Fieber oder Kala-Azar) sind die inneren Organe (lateinisch viscera: Eingeweide) befallen. Es kommt zu einer eine Leberschwellung begleitenden Milzschwellung (tropische Splenomegalie). Die Erreger sind Leishmania donovani (die von Leishman und Donovan entdeckte Flagellatenart), in Europa Leishmania infantum. Diese Erkrankung hat sich vermutlich ursprünglich von Ostafrika über den vorderen Orient bis nach Indien ausgebreitet. ⓘ
Paläomediziner um Albert R. Zink konnten in altägyptischen Mumien erst ab dem Mittleren Reich die mitochondriale DNA von Leishmania donovani nachweisen. Die innere Leishmaniose wurde früher auch als Ponos (bei Hippokrates Πόνος) und „Rippkuchen“ bezeichnet. ⓘ
1977 wurde in Indien (Nordbihar) eine große Epidemie mit ca. 70.000 erkrankten Personen beobachtet. Der Begriff Kala-Azar stammt aus dem Hindi, bezieht sich auf die braunschwarze Pigmentierung der trockenen Haut bei dieser Erkrankung, und bedeutet „schwarze Krankheit“ oder „schwarze Haut“. Die viszerale Leishmaniose ist allerdings nicht auf Indien und China beschränkt. Sie tritt auch in Europa auf, z. B. im Mittelmeerraum von Portugal bis in die Türkei, und ist auch in Südamerika (dort besonders in Brasilien) vertreten. ⓘ
In der Histologie sind die typisch schiffchenförmigen Leishmanien in einem Makrophagen zu erkennen. Ohne Therapie enden ca. 95 % der Krankheitsfälle tödlich. Als erstes orales Therapeutikum wurde im Dezember 2004 in Deutschland der Wirkstoff Miltefosin zugelassen. ⓘ
Gesellschaft und Kultur
Das Institut für Eine-Welt-Gesundheit hat das Medikament Paromomycin für die Behandlung der Leishmaniose wieder eingeführt, was zu seiner Zulassung als Arzneimittel für seltene Krankheiten führte. Auch die Drugs for Neglected Diseases Initiative unterstützt aktiv die Suche nach neuen Therapeutika. Eine Behandlung mit Paromomycin kostet etwa 10 US-Dollar. Das Medikament war ursprünglich in den 1960er Jahren identifiziert worden, wurde aber aufgegeben, weil es nicht rentabel war, da die Krankheit hauptsächlich arme Menschen betrifft. Die indische Regierung gab Paromomycin im August 2006 zum Verkauf frei. ⓘ
Bis 2012 hatte die Weltgesundheitsorganisation erfolgreich mit den Herstellern verhandelt, um die Kosten für liposomales Amphotericin B auf 18 US-Dollar pro Ampulle zu senken, aber für die Behandlung werden mehrere Ampullen benötigt, und es muss bei einer stabilen, kühlen Temperatur gelagert werden. ⓘ
Prophylaxe
Ein wesentlicher Bestandteil der Bekämpfung der Leishmaniose ist die Prophylaxe einer Infektion. Der klassische Weg ist hierbei, den Vektor (Krankheitsüberträger) vom Stich am Wirt abzuhalten (Repellenzwirkung). Gute Erfolge werden hierbei mit Pyrethroiden wie Permethrin oder Deltamethrin erzielt. ⓘ
Seit dem 14. März 2011 ist europaweit der Impfstoff Canileish zugelassen, der bei Hunden, die negativ auf Leishmanien getestet wurden, das Risiko einer Infektion und Erkrankung nach dem Kontakt mit Leishmanien verringern soll. Seit 2019 gibt es mit LetiFend einen weiteren Impfstoff, der mit einer einmaligen Anwendung einen einjährigen Schutz verspricht. ⓘ

Im Jahr 2017 gab es noch keinen Leishmaniose-Impfstoff für Menschen. Die Forschung zur Herstellung eines Impfstoffs für den Menschen ist im Gange. ⓘ
Derzeit gibt es einige wirksame Leishmaniose-Impfstoffe für Hunde. Es wird auch erwogen, dass die Leishmaniose durch Maßnahmen des öffentlichen Gesundheitswesens auch ohne Impfstoff kontrolliert oder beseitigt werden kann. ⓘ
Übertragung
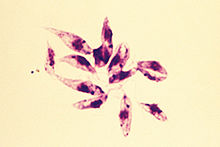
Sandmücken (aus der Familie der Schmetterlingsmücken) übertragen die Infektion. In den 1950er-Jahren dezimierte der Einsatz von Insektiziden (hauptsächlich DDT) gegen malariaübertragende Anophelesmücken auch die Sandmücken (Phlebotominae) stark. Inzwischen haben sich die Sandmückenpopulationen wieder auf das ursprüngliche Niveau vermehrt, sodass im Mittelmeerraum die Zahlen der Leishmaniose-Erkrankungen von Mensch und Tier zunehmen. ⓘ
Die zunehmende Ausbreitung der Sandmücke in Richtung Norden wird mit der globalen Erwärmung sowie der zunehmenden Globalisierung in Verbindung gebracht. Das zur Goethe-Universität Frankfurt und der Senckenberg-Gesellschaft für Naturforschung gehörende Biodiversität- und Klima-Forschungszentrum (BiK-F) hat im Sommer 2014 bei Gießen anhand einer Sandmücke der Art Phlebotomus mascittii den bisher nördlichsten Nachweis einer Sandmücke geführt. ⓘ
Leishmaniose ist in 98 Staaten endemisch und verursacht jährlich etwa 1 Million kutane Infektionen und 50.000 bis 90.000 viszerale Infektionen. ⓘ
Die Infektionsrate von Hunden mit Leishmaniose ist insbesondere im Mittelmeerraum stellenweise sehr hoch: In Andalusien sind bis zu 42 % der Hunde infiziert, auf Sizilien bis zu 80 %. Die Infektionsrate bei Menschen und Hunden hängt von der lokalen Sandmückenpopulation, deren Durchseuchung und Stechgewohnheiten ab. ⓘ
Formen der menschlichen Leishmaniose
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| B55.- | Leishmaniose |
| B55.0 | Viszerale Leishmaniose |
| B55.1 | Kutane Leishmaniose |
| B55.2 | Mukokutane Leishmaniose |
| B55.9 | Leishmaniose, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Es gibt viele Krankheitsbilder, die der geografischen Verbreitung der jeweiligen Leishmania-Arten zuzuordnen sind. Sie reichen vom lokal begrenzten, oft spontan ausheilenden Solitärulkus bis zur tödlich endenden Allgemeinerkrankung. Weltweit unterscheidet man drei Leishmanioseformen. ⓘ
Schleimhautleishmaniose (mukokutane Leishmaniose)
Die mukokutane Leishmaniose ist unter verschiedenen Namen (u. a. Uta oder Espundia) in Südamerika bekannt. Sie befällt neben der Haut auch die Schleimhaut (lateinisch mucus: Schleim). Der Erreger ist L. brasiliensis und wird ebenfalls durch die Schmetterlingsmücke übertragen. Klinisch zeigt sich eine schwer verlaufende, destruierende Hautläsion, die nicht spontan abheilt. ⓘ
Veterinärmedizin
Leishmaniose kommt im Bereich der Haustiere bevorzugt beim Haushund vor. Sie gehört zu den durch Vektoren übertragenen Krankheiten (Companion Vector-borne Diseases, CVBD). Für Katzen, Nager, Rinder und Hauspferd existieren ebenfalls Beschreibungen der Erkrankung. Die Leishmaniose der Meerschweinchen wird durch den wirtsspezifischen Erreger Leishmania enriettii verursacht und tritt nur in Südamerika auf. ⓘ
Ätiologie
Hunde und Nager scheinen das Hauptreservoir des Erregers zu sein. Die Übertragung auf Menschen oder andere Säugetiere entspricht wahrscheinlich nicht dem ursprünglichen Wirtsspektrum der Leishmanien. Zur Entwicklung benötigt der Parasit zwei Wirte. Zum einen handelt es sich hierbei um ein Stechinsekt (Phlebotomus sp. oder Lutzomyia sp.), in dessen Blut sich die etwa 10 bis 15 µm (Mikrometer) lange, begeißelte und promastigote Form entwickelt und vermehrt. Wirbeltiere einschließlich des Menschen tragen dagegen die mit 2 bis 5 µm Länge wesentlich kürzere amastigote (unbegeißelte) Form in sich, welche sich bevorzugt im Zellinneren von Makrophagen – besonders im Bereich des retikuloendothelialen Systems – ansiedeln. Dies gelingt ihnen aufgrund ihrer Fähigkeit, den Säuregehalt der Phagosomen zu neutralisieren und freie Sauerstoffradikale im Makrophageninneren abzufangen. Hier findet auch ihre Vermehrung durch Zellteilung statt. ⓘ
Die Einteilung der Parasiten erfolgt anhand ihrer Morphologie, des bewirtenden Insektes, der Art der ausgelösten Krankheitssymptome und serologischen Tests. Daneben werden Zymodeme nach der Ähnlichkeit der im Parasiten aktiven Enzyme sowie Schizodeme nach speziellen DNA-Fragment-Mustern (RFLP-Mustern) auf den Kinetoplasten unterschieden. ⓘ
Therapie der viszeralen Leishmaniose
Häufig ist eine vollständige Heilung der Erkrankung nicht möglich. Die therapeutischen Ansätze konzentrieren sich daher – neben der Erregerelimination – vor allem auf eine Stärkung der körpereigenen zellulären Abwehr. ⓘ
Pentamidin
Pentamidin ist Ende der 1930er Jahre in Großbritannien als Mittel gegen die Schlafkrankheit entwickelt worden. Trotz häufiger Nebenwirkungen hat es nach wie vor seinen Platz in der Therapie der Leishmaniose. Es wird als 2. Wahl-Therapie statt Amphotericin B (vorzugsweise L-AmB) intravenös verabreicht. ⓘ
N-Methylglucamin-Antimonat
N-Methylglucamin-Antimonat (Handelsname Glucantime) gilt derzeit als Mittel der Wahl in der Behandlung der Leishmaniose. Durch das Medikament werden im Parasiten ablaufende Glykolyse- und Fettsäureabbauvorgänge gehemmt. Die abgestorbenen Leishmanien stimulieren ihrerseits die zelluläre Abwehr. Das Medikament wird nicht im Darm resorbiert und wird daher per Injektion an 20 bis 30 aufeinanderfolgenden Tagen verabreicht. Als Nebenwirkungen sind schmerzhafte Schwellungen im Bereich der Injektion beschrieben, außerdem kann es zur Ausbildung von Magen-Darm-Beschwerden kommen. ⓘ
Natriumstibogluconat
Natriumstibogluconat (Handelsname: Pentostam) kann (als 2. Wahl-Therapie statt Amphotericin B) bei allen Formen der menschlichen Leishmaniose eingesetzt werden. Seine Wirkung beruht auf dem Abtöten der Amastigoten, der zugrunde liegende molekulare Prozess ist aber noch unbekannt. Die empfohlene Dosierung liegt bei täglich 20 mg Sb pro kg Körpergewicht (NSG enthält 100 mg Sb/ml) über eine Behandlungsdauer von 28 Tagen hinweg, wobei die Injektion intravenös oder intramuskulär erfolgen kann. Nebenwirkungen können unter anderem Übelkeit, Kopfschmerzen, Erbrechen, Arthralgien, Myalgien und Anorexie sein. Die intramuskuläre Injektion ist darüber hinaus sehr schmerzhaft. Bei schweren Nieren-, Herz- und Lebererkrankungen darf NGS nicht verwendet werden. ⓘ
Allopurinol
Der aus der Therapie der Gicht bekannte Wirkstoff Allopurinol hemmt die Synthese von Purinen im Wirtsorganismus. Da Leishmanien nicht in der Lage sind, diese Purine selbst herzustellen, und daher auf eine Versorgung über den Wirt angewiesen sind, werden sie in ihrer Entwicklung gehemmt. Die Verabreichung erfolgt oral und wird meist mit einem anderen Medikament kombiniert, da Allopurinol lediglich parasitostatisch wirkt. ⓘ
Antibiotika
Bei Auftreten von Resistenzen gegen eine Kombinationstherapie oder einen der oben genannten Wirkstoffe besteht die Möglichkeit des Einsatzes der Antimykotika und Antibiotika (Liposomales) Amphotericin B (auch als Mittel 1. Wahl) oder Aminosidin. ⓘ
Vom Institute for OneWorld Health wurde das Aminoglykosid-Antibiotikum Paromomycin in klinischen Studien erfolgreich gegen viszerale Leishmaniose getestet. In Indien liegt für diese Indikation inzwischen eine Zulassung vor. ⓘ
Weitere Wirkstoffe
Fallberichte schildern den erfolgreichen Einsatz der Antimykotika Ketoconazol und Amphotericin B in Lipidform sowie des Anthelmintikums Levamisol, der von Studien bisher aber nicht bestätigt wurde. ⓘ
Beim Hund konnte in einer Studie mit einer einmonatigen Gabe von Domperidon eine klinische Verbesserung, eine Verbesserung der zellulären Immunität und bei vielen Tieren auch eine Verminderung der Antikörper-Titer erzielt werden. ⓘ
Immuntherapie
Zur Stärkung der körpereigenen Abwehr kann der Einsatz von rekombinatem Interferon eine therapeutische Option sein, da hierbei die Differenzierung von Lymphozyten zu T1-Helferzellen gefördert wird. ⓘ
Forschung
Der britische Parasitologe Ralph Lainson machte in den 1960er Jahren zunächst im damaligen British Honduras (heute Belize) und später an der Wellcome Trust Parasitology Unit im Evandro Chagas Institute in Belém, Brasilien, zahlreiche Entdeckungen, die wesentlich zum Verständnis der Leishmaniose beitrugen. Der 1987 entdeckte Leishmania (Viannia) lainsoni wurde nach ihm benannt. ⓘ
Seit dem 7. September 2011 gibt es das World-Community-Grid-Projekt Drug Search for Leishmaniasis, das sich zum Ziel gesetzt hat, neue Medikamente gegen resistente Stämme der Krankheit zu finden. ⓘ
Weitere durch Ektoparasiten übertragene Krankheiten
- Borreliose
- Babesiose
- Canine Ehrlichiose
- Dirofilariose
- Rickettsiose
- Anaplasmose ⓘ