Gelbfieber
| Gelbfieber ⓘ | |
|---|---|
| Andere Namen | Gelbfieber, Gelbe Pest, Bronze-John |
 | |
| TEM-Mikroskopische Aufnahme des Gelbfiebervirus (234.000fache Vergrößerung) | |
| Spezialgebiet | Ansteckende Krankheit |
| Symptome | Fieber, Schüttelfrost, Muskelschmerzen, Kopfschmerzen, gelbe Haut |
| Komplikationen | Leberversagen, Blutungen |
| Gewöhnlicher Ausbruch | 3-6 Tage nach der Exposition |
| Dauer | 3-4 Tage |
| Verursacht | Gelbfiebervirus, das durch Stechmücken übertragen wird |
| Diagnostische Methode | Bluttest |
| Vorbeugung | Impfung gegen Gelbfieber |
| Behandlung | Unterstützende Behandlung |
| Häufigkeit | ~127.000 schwere Fälle (2013) |
| Todesfälle | ~45,000 (2013) |
Gelbfieber ist eine Viruserkrankung von meist kurzer Dauer. In den meisten Fällen treten Symptome wie Fieber, Schüttelfrost, Appetitlosigkeit, Übelkeit, Muskelschmerzen - insbesondere im Rücken - und Kopfschmerzen auf. Die Symptome bessern sich in der Regel innerhalb von fünf Tagen. Bei etwa 15 % der Menschen kehrt das Fieber innerhalb eines Tages nach der Besserung zurück, es treten Bauchschmerzen auf, und die Leber wird geschädigt, was zu einer gelben Haut führt. In diesem Fall ist das Risiko von Blutungen und Nierenproblemen erhöht. ⓘ
Die Krankheit wird durch das Gelbfiebervirus verursacht und durch den Stich einer infizierten Stechmücke übertragen. Es infiziert nur Menschen, andere Primaten und verschiedene Arten von Stechmücken. In Städten wird es vor allem durch Aedes aegypti verbreitet, eine Mückenart, die in den Tropen und Subtropen verbreitet ist. Bei dem Virus handelt es sich um ein RNA-Virus der Gattung Flavivirus. Die Krankheit kann schwer von anderen Krankheiten zu unterscheiden sein, vor allem im Anfangsstadium. Um einen Verdachtsfall zu bestätigen, muss eine Blutprobe mittels Polymerase-Kettenreaktion untersucht werden. ⓘ
Es gibt einen sicheren und wirksamen Impfstoff gegen Gelbfieber, und einige Länder schreiben Impfungen für Reisende vor. Zu den weiteren Maßnahmen zur Verhinderung einer Ansteckung gehört die Reduzierung der Population der übertragenden Mücken. In Gebieten, in denen Gelbfieber weit verbreitet ist, sind eine frühzeitige Diagnose der Fälle und die Immunisierung großer Teile der Bevölkerung wichtig, um Ausbrüche zu verhindern. Sobald eine Person infiziert ist, erfolgt die Behandlung symptomatisch; es gibt keine spezifischen Maßnahmen gegen das Virus. Bis zur Hälfte der schwer Erkrankten stirbt. ⓘ
Im Jahr 2013 führte das Gelbfieber weltweit zu etwa 127.050 schweren Infektionen und 45.000 Todesfällen, wobei fast 90 Prozent davon in Afrika auftraten. Fast eine Milliarde Menschen leben in einem Gebiet der Welt, in dem die Krankheit weit verbreitet ist. Sie ist in den tropischen Gebieten der Kontinente Südamerika und Afrika verbreitet, nicht aber in Asien. Seit den 1980er Jahren nimmt die Zahl der Gelbfieberfälle zu. Dies ist vermutlich darauf zurückzuführen, dass immer weniger Menschen immun sind, dass mehr Menschen in Städten leben, dass Menschen häufig umziehen und dass das sich ändernde Klima den Lebensraum für Stechmücken vergrößert. ⓘ
Die Krankheit stammt ursprünglich aus Afrika und verbreitete sich ab dem 15. Jahrhundert durch den europäischen Handel mit versklavten Afrikanern aus Subsahara-Afrika auf dem amerikanischen Kontinent. Seit dem 17. Jahrhundert kam es in Amerika, Afrika und Europa zu mehreren größeren Ausbrüchen der Krankheit. Im 18. und 19. Jahrhundert galt Gelbfieber als eine der gefährlichsten Infektionskrankheiten; zahlreiche Epidemien wüteten in den großen Städten der USA und in anderen Teilen der Welt. ⓘ
Im Jahr 1927 wurde das Gelbfiebervirus als erstes Virus beim Menschen isoliert. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| A95 | Gelbfieber |
| ICD-10 online (WHO-Version 2019) | |
Das Gelbfieber, auch Ochropyra oder Schwarzes Erbrechen (in älteren Texten auch Siamesische Krankheit und Dschungelfieber) genannt, ist eine Infektionskrankheit, die durch das Gelbfieber-Virus verursacht wird. Bei dem Virus handelt es sich um ein 40 bis 50 Nanometer großes, behülltes RNA-Virus mit positiver Polarität aus der Familie der Flaviviren. ⓘ
Die Krankheit äußert sich in den meisten Fällen mit Fieber, Übelkeit und Schmerzen und klingt nach einigen Tagen wieder ab. Manchmal kommt es zu schweren, mitunter tödlich endenden Verläufen mit Leberschädigung, Entwicklung einer Gelbsucht (als Ausdruck einer Hepatitis, daher der Name der Krankheit) und Störung der Blutgerinnung (verstärkter Blutungsneigung, hämorrhagische Diathese). Das Gelbfieber zählt deswegen zu den sogenannten Hämorrhagischen Fiebern. Die WHO schätzt, dass jährlich 200.000 Personen erkranken und 30.000 Personen an Gelbfieber sterben; schätzungsweise 90 % der Infektionen entfallen auf den afrikanischen Kontinent. ⓘ
Krankheitserscheinungen
Gelbfieber hat eine Inkubationszeit von drei bis sechs Tagen, nach der es zu einem plötzlichen Fieberanstieg auf über 39 °C (und manchmal auch über 40 °C) kommt. Die meisten Fälle verlaufen mild, die Infektion äußert sich dann nur in einer kurzen Fieberkrankheit mit Kopfschmerzen, Schüttelfrost, Rückenschmerzen, Appetitlosigkeit, Übelkeit und Erbrechen. Die Infektion kann in leichten Fällen nach drei bis vier Tagen wieder abklingen. ⓘ
In ungefähr 15 % der Fälle manifestiert sich eine zweite Phase der Krankheit mit einer Wiederkehr des Fiebers, bei der eine kurzfristige Verbesserung des Gesundheitszustandes möglich ist. Ähnlich wie z. B. beim Typhus abdominalis lässt sich während dieses erneuten Fieberanstieges eine sog. „relative Bradykardie“ beobachten. Normalerweise steigt bei einer Erhöhung der Körperkerntemperatur um 1 °C der Herzschlag um ca. 10 Schläge pro Minute. Das Ausbleiben dieses Anstieges wird beim Gelbfieber als „Faget-Zeichen“ bezeichnet. ⓘ
Die zweite Phase wird begleitet von einer Gelbsucht infolge der Leberschädigung sowie Schmerzen im Unterleib. Als Zeichen einer erhöhten Blutungsneigung und Empfindlichkeit der Kapillargefäße tritt bei Druckbelastung der Haut das Phänomen der „Spanischen Flagge“ auf. Blutungen der Mundschleimhaut, der Augenbindehäute und der Nasenschleimhaut (Nasenbluten) sind charakteristisch. Massive Blutungen im Magen-Darm-Trakt können zu blutigem Stuhlgang und blutigem Erbrechen führen, wobei das Blut durch den Kontakt mit der Magensäure schwarz gefärbt ist; daher auch der historische Name „Vomito negro“ (Schwarzes Erbrechen) und die Einteilung in die Hämorrhagischen Fieber. Diese zweite Phase, auch toxische Phase genannt, endet in 20 % aller Fälle tödlich. Wird die Infektion überstanden, besteht lebenslange Immunität und normalerweise werden keine bleibenden Organschäden davongetragen. ⓘ
Die Sterblichkeitsrate unter denjenigen, die eine Gelbsucht entwickeln, liegt bei 20 bis 50 %, während die allgemeine Sterblichkeitsrate etwa 3 bis 7,5 % beträgt. In schweren Fällen kann die Sterblichkeitsrate mehr als 50 % betragen. ⓘ
Das Überleben der Infektion verleiht lebenslange Immunität und führt normalerweise nicht zu dauerhaften Organschäden. ⓘ
Komplikation
Gelbfieber kann bei 20 bis 50 % der schwer Erkrankten zum Tod führen. Gelbsucht, Müdigkeit, Herzrhythmusstörungen, Krampfanfälle und innere Blutungen können ebenfalls als Komplikationen von Gelbfieber während der Genesungszeit auftreten. ⓘ
Ursache
| Gelbfieber-Virus ⓘ | |
|---|---|

| |
| Struktur und Genom des Flavivirus | |
| Klassifizierung des Virus | |
| (ohne Rangfolge): | Virus |
| Reich: | Riboviren |
| Königreich: | Orthornaviren |
| Phylum: | Kitrinoviricota |
| Klasse: | Flasuviricetes |
| Ordnung: | Amarillovirales |
| Familie: | Flaviviridae |
| Gattung: | Flavivirus |
| Spezies: | Gelbfieber-Virus
|
Gelbfieber wird durch das Gelbfiebervirus verursacht, ein umhülltes RNA-Virus mit einer Größe von 40-50 nm, die Typusart und der Namensgeber der Familie der Flaviviridae. Es war die erste Krankheit, deren Übertragbarkeit durch gefiltertes menschliches Serum und die Übertragung durch Moskitos von dem amerikanischen Arzt Walter Reed um 1900 nachgewiesen wurde. Die einzelsträngige Positivsensor-RNA ist etwa 10 862 Nukleotide lang und hat einen einzigen offenen Leserahmen, der für ein Polyprotein kodiert, das von Wirtsproteasen in drei Strukturproteine (C, prM, E) und sieben Nichtstrukturproteine (NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5) zerlegt wird; die Aufzählung entspricht der Anordnung der proteinkodierenden Gene im Genom. Die minimale 3'UTR-Region des Gelbfiebervirus (YFV) ist erforderlich, um die 5'-3'-Exonuklease XRN1 des Wirts abzuwürgen. Die UTR enthält die PKS3-Pseudoknotenstruktur, die als molekulares Signal zum Abwürgen der Exonuklease dient und die einzige virale Voraussetzung für die Produktion subgenomischer Flavivirus-RNA (sfRNA) darstellt. Die sfRNAs sind das Ergebnis eines unvollständigen Abbaus des viralen Genoms durch die Exonuklease und sind für die virale Pathogenität von Bedeutung. Gelbfieber gehört zu der Gruppe der hämorrhagischen Fieber. ⓘ
Die Viren infizieren unter anderem Monozyten, Makrophagen, Schwann-Zellen und dendritische Zellen. Sie heften sich über spezifische Rezeptoren an die Zelloberflächen und werden von einem endosomalen Vesikel aufgenommen. Im Inneren des Endosoms führt der gesunkene pH-Wert zur Fusion der endosomalen Membran mit der Virushülle. Das Kapsid gelangt in das Zytosol, zerfällt und setzt das Genom frei. Sowohl die Rezeptorbindung als auch die Membranfusion werden durch das Protein E katalysiert, das bei niedrigem pH-Wert seine Konformation ändert und eine Umstrukturierung der 90 Homodimere zu 60 Homotrimeren bewirkt. ⓘ
Nach dem Eindringen in die Wirtszelle wird das virale Genom im rauen endoplasmatischen Retikulum (ER) und in den sogenannten Vesikelpaketen repliziert. Im ER entsteht zunächst eine unreife Form des Viruspartikels, dessen M-Protein noch nicht in seine reife Form gespalten ist, daher als Vorläufer M (prM) bezeichnet wird und einen Komplex mit dem Protein E bildet. Die unreifen Partikel werden im Golgi-Apparat durch das Wirtsprotein Furin prozessiert, das prM zu M spaltet. Dadurch wird E aus dem Komplex freigesetzt, das nun seinen Platz im reifen, infektiösen Virionu einnehmen kann. ⓘ

Übertragung


Das Gelbfiebervirus wird hauptsächlich durch den Stich der Gelbfiebermücke Aedes aegypti übertragen, aber auch andere, meist Aedes-Mücken wie die Tigermücke (Aedes albopictus) können als Überträger für dieses Virus dienen. Wie andere Arboviren, die von Stechmücken übertragen werden, wird das Gelbfiebervirus von einer weiblichen Stechmücke aufgenommen, wenn sie das Blut eines infizierten Menschen oder eines anderen Primaten zu sich nimmt. Die Viren gelangen in den Magen der Stechmücke, und wenn die Viruskonzentration hoch genug ist, können die Virionen Epithelzellen infizieren und sich dort vermehren. Von dort gelangen sie in das Hämocoel (das Blutsystem der Mücken) und von dort in die Speicheldrüsen. Wenn die Mücke das nächste Mal Blut saugt, injiziert sie ihren Speichel in die Wunde, und das Virus gelangt in den Blutkreislauf der gestochenen Person. Die transovarielle und transstadiale Übertragung des Gelbfiebervirus innerhalb von A. aegypti, d. h. die Übertragung von einer weiblichen Mücke auf ihre Eier und dann auf die Larven, ist angezeigt. Diese Infektion von Vektoren ohne vorherige Blutmahlzeit scheint bei einzelnen, plötzlichen Ausbrüchen der Krankheit eine Rolle zu spielen. ⓘ
Es gibt drei epidemiologisch unterschiedliche Infektionszyklen, in denen das Virus von Stechmücken auf Menschen oder andere Primaten übertragen wird. Am "urbanen Zyklus" ist nur die Gelbfiebermücke A. aegypti beteiligt. Sie ist gut an städtische Gebiete angepasst und kann auch andere Krankheiten übertragen, darunter Zika-Fieber, Dengue-Fieber und Chikungunya. Der städtische Zyklus ist für die großen Gelbfieberausbrüche in Afrika verantwortlich. Mit Ausnahme eines Ausbruchs in Bolivien im Jahr 1999 gibt es diesen urbanen Zyklus in Südamerika nicht mehr. ⓘ
Neben dem städtischen Zyklus gibt es sowohl in Afrika als auch in Südamerika einen sylvatischen Zyklus (Wald- oder Dschungelzyklus), bei dem Aedes africanus (in Afrika) oder Stechmücken der Gattung Haemagogus und Sabethes (in Südamerika) als Vektoren dienen. Im Dschungel infizieren die Stechmücken vor allem nichtmenschliche Primaten; bei afrikanischen Primaten verläuft die Krankheit meist asymptomatisch. In Südamerika ist der sylvatische Zyklus derzeit der einzige Weg, auf dem sich Menschen infizieren können, was die geringe Häufigkeit von Gelbfieberfällen auf dem Kontinent erklärt. Menschen, die sich im Dschungel infizieren, können das Virus in städtische Gebiete tragen, wo A. aegypti als Überträger fungiert. Aufgrund dieses sylvatischen Zyklus kann Gelbfieber nur durch die Ausrottung der Mücken, die als Überträger dienen, ausgerottet werden. ⓘ
In Afrika gibt es zwischen dem Dschungel- und dem Stadtzyklus einen dritten Infektionszyklus, der als "Savannenzyklus" oder Zwischenzyklus bekannt ist. Daran sind verschiedene Stechmücken der Gattung Aedes beteiligt. In den letzten Jahren war dies die häufigste Form der Übertragung von Gelbfieber in Afrika. ⓘ
Es besteht die Sorge, dass sich das Gelbfieber nach Südostasien ausbreitet, wo sein Überträger A. aegypti bereits vorkommt. ⓘ
Pathogenese
Eine Infektion mit dem Gelbfiebervirus führt in erster Linie zu einer Schädigung von Epithelzellen (Schleimhäute, Gefäße) und Muskelzellen des Herzens. Nach der Übertragung des Erregers durch eine Mücke vermehren sich die Viren zunächst in Lymphknoten und infizieren insbesondere dendritische Zellen. Von dort verbreiten sich die Viren über eine Virämie auf den gesamten Organismus und erreichen so auch die Leber. Hier infizieren die Viren die Leberzellen, sehr wahrscheinlich indirekt über Kupffersche Zellen, was zur eosinophilen Degradation dieser Zellen und zur Ausschüttung von Zytokinen führt. Die mikroskopisch sichtbaren Ansammlungen von Pigment in Kupfferschen Zellen beim Gelbfieber werden auch als „Villela-Körperchen“ bezeichnet. Bei einem tödlichen Verlauf folgt ein kardiovaskulärer Schock und Multiorganversagen mit stark erhöhten Zytokin-Werten (ein sogenannter Zytokinsturm). Histologisch sind in Leberzellen eosinophile Einschlusskörperchen („Councilman-Körperchen“) sichtbar, gelegentlich auch Einschlüsse im Zellkern („Torres-Körperchen“). ⓘ
Der Tod kann eintreten, wenn ein Zytokinsturm, ein Schock und ein multiples Organversagen folgen. ⓘ
Diagnose
Die Diagnose des Gelbfiebers wird in den meisten Fällen klinisch gestellt und basiert auf der Symptomatik und der Reiseanamnese. Leichte Fälle der Krankheit können nur virologisch bestätigt werden. Da auch milde Fälle von Gelbfieber erheblich zu regionalen Ausbrüchen beitragen können, wird jeder Verdachtsfall von Gelbfieber (mit Symptomen wie Fieber, Schmerzen, Übelkeit und Erbrechen 6-10 Tage nach Verlassen des betroffenen Gebiets) ernsthaft behandelt. ⓘ
Besteht der Verdacht auf Gelbfieber, kann das Virus erst 6-10 Tage nach der Erkrankung bestätigt werden. Eine direkte Bestätigung kann durch die reverse Transkriptions-Polymerase-Kettenreaktion erfolgen, bei der das Genom des Virus vervielfältigt wird. Ein weiterer direkter Ansatz ist die Isolierung des Virus und sein Wachstum in einer Zellkultur unter Verwendung von Blutplasma; dies kann 1-4 Wochen dauern. ⓘ
Serologisch kann ein Enzymimmunoassay in der akuten Phase der Krankheit mit spezifischem IgM gegen Gelbfieber oder ein Anstieg des spezifischen IgG-Titers (im Vergleich zu einer früheren Probe) Gelbfieber bestätigen. Zusammen mit klinischen Symptomen gilt der Nachweis von IgM oder ein vierfacher Anstieg des IgG-Titers als ausreichender Hinweis auf Gelbfieber. Da diese Tests mit anderen Flaviviren wie dem Dengue-Virus kreuzreagieren können, lässt sich mit diesen indirekten Methoden eine Gelbfieberinfektion nicht eindeutig nachweisen. ⓘ
Eine Leberbiopsie kann Entzündungen und Nekrosen der Hepatozyten nachweisen und virale Antigene nachweisen. Wegen der Blutungsneigung von Gelbfieberpatienten ist eine Biopsie nur post mortem ratsam, um die Todesursache zu bestätigen. ⓘ
Bei der Differentialdiagnose müssen Infektionen mit Gelbfieber von anderen fieberhaften Erkrankungen wie Malaria unterschieden werden. Andere virale hämorrhagische Fieber wie das Ebola-Virus, das Lassa-Virus, das Marburg-Virus und das Junin-Virus müssen als Ursache ausgeschlossen werden. ⓘ
Vorbeugung
Die persönliche Vorbeugung gegen Gelbfieber umfasst die Impfung und das Vermeiden von Mückenstichen in Gebieten, in denen Gelbfieber endemisch ist. Zu den institutionellen Maßnahmen zur Gelbfieberprävention gehören Impfprogramme und Maßnahmen zur Mückenbekämpfung. Programme zur Verteilung von Moskitonetzen für den Hausgebrauch führen zu einem Rückgang der Fälle von Malaria und Gelbfieber. Für den Aufenthalt im Freien wird die Verwendung von EPA-registrierten Insektenschutzmitteln empfohlen. Schon ein kurzer Aufenthalt im Freien reicht für einen potenziellen Mückenstich aus. Langärmelige Kleidung, lange Hosen und Socken sind zur Vorbeugung nützlich. Die Anwendung von Larviziden auf Wasserbehälter kann dazu beitragen, potenzielle Mückenbrutstätten zu beseitigen. EPA-registrierte Insektizidsprays verringern die Übertragung von Gelbfieber.
- Verwenden Sie im Freien Insektenschutzmittel, die DEET, Picaridin, Ethylbutylacetylaminopropionat (IR3535) oder Zitronen-Eukalyptusöl enthalten, auf der Haut.
- Mücken können durch dünne Kleidung hindurch stechen, daher bietet das Besprühen der Kleidung mit einem Repellent, das Permethrin oder ein anderes von der EPA zugelassenes Repellent enthält, zusätzlichen Schutz. Mit Permethrin behandelte Kleidung ist im Handel erhältlich. Mückenabwehrmittel, die Permethrin enthalten, sind nicht für die direkte Anwendung auf der Haut zugelassen.
- Die Hauptstichzeit für viele Mückenarten ist die Abend- bis Morgendämmerung. A. aegypti, eine der Mückenarten, die das Gelbfiebervirus übertragen, ernährt sich jedoch tagsüber. Der Aufenthalt in Unterkünften mit abgeschirmten oder klimatisierten Zimmern verringert ebenfalls das Risiko von Mückenstichen, insbesondere während der Hauptstichzeiten. ⓘ
Impfung


Die Impfung wird für Reisende in die betroffenen Gebiete empfohlen, da nicht einheimische Personen bei einer Infektion zu schwereren Erkrankungen neigen. Der Schutz beginnt bei 95 % der Menschen am 10. Tag nach der Verabreichung des Impfstoffs und hält Berichten zufolge mindestens 10 Jahre lang an. Die Weltgesundheitsorganisation (WHO) erklärt nun, dass eine einzige Impfstoffdosis ausreicht, um eine lebenslange Immunität gegen die Gelbfieberkrankheit zu verleihen. Der abgeschwächte Lebendimpfstoff Stamm 17D wurde im Jahr 1937 von Max Theiler entwickelt. Die WHO empfiehlt eine Routineimpfung für Menschen, die in den betroffenen Gebieten leben, zwischen dem 9. und 12. ⓘ
Bis zu einer von vier Personen leidet unter Fieber, Schmerzen und lokalen Schmerzen und Rötungen an der Injektionsstelle. In seltenen Fällen (weniger als einer von 200.000 bis 300.000) kann die Impfung eine Gelbfieberimpfstoff-assoziierte viszerotrope Krankheit verursachen, die in 60 % der Fälle tödlich verläuft. Sie ist wahrscheinlich auf die genetische Morphologie des Immunsystems zurückzuführen. Eine weitere mögliche Nebenwirkung ist eine Infektion des Nervensystems, die in einem von 200.000 bis 300.000 Fällen auftritt und eine Gelbfieber-impfstoffassoziierte neurotrope Krankheit verursacht, die zu einer Meningoenzephalitis führen kann und in weniger als 5 % der Fälle tödlich verläuft. ⓘ
Im Rahmen der 2006 von der WHO gestarteten Gelbfieber-Initiative wurden mehr als 105 Millionen Menschen in 14 Ländern Westafrikas geimpft. Im Jahr 2015 wurden keine Ausbrüche gemeldet. Die Kampagne wurde von der GAVI-Allianz und Regierungsorganisationen in Europa und Afrika unterstützt. Nach Angaben der WHO kann die Massenimpfung das Gelbfieber wegen der großen Zahl infizierter Mücken in den städtischen Gebieten der Zielländer nicht ausrotten, aber sie wird die Zahl der Infizierten deutlich verringern. ⓘ
Die Nachfrage nach Gelbfieberimpfstoff hat weiter zugenommen, da immer mehr Länder die Gelbfieberimpfung als Teil ihrer Routineimpfprogramme einführen. Die jüngsten Gelbfieberausbrüche in Angola (2015), der Demokratischen Republik Kongo (2016), Uganda (2016) und kürzlich in Nigeria und Brasilien (2017) haben die Nachfrage weiter erhöht und gleichzeitig das weltweite Impfstoffangebot verknappt. Um empfängliche Bevölkerungsgruppen in präventiven Massenimpfkampagnen bei Ausbrüchen zu impfen, wird daher die fraktionierte Verabreichung des Impfstoffs als dosisschonende Strategie erwogen, um die begrenzten Impfstoffvorräte zu maximieren. Bei der fraktionierten Gelbfieberimpfung wird eine reduzierte Impfstoffdosis verabreicht, die gemäß den Empfehlungen des Herstellers rekonstituiert wurde. Die erste praktische Anwendung der fraktionierten Gelbfieberimpfung war die Reaktion auf einen großen Gelbfieberausbruch in der Demokratischen Republik Kongo Mitte 2016. ⓘ
Im März 2017 startete die WHO in Brasilien eine Impfkampagne mit 3,5 Millionen Dosen aus einem Notvorrat. Im März 2017 empfahl die WHO die Impfung für Reisende in bestimmte Teile Brasiliens. Im März 2018 änderte Brasilien seine Politik und kündigte an, alle 77,5 Millionen derzeit ungeimpften Bürger bis April 2019 zu impfen. ⓘ
Obligatorische Impfung
Einige Länder in Asien gelten als potenziell gelbfiebergefährdet, da dort sowohl Stechmücken, die Gelbfieber übertragen können, als auch empfängliche Affen vorkommen. In Asien kommt die Krankheit bisher nicht vor. Um eine Einschleppung des Virus zu verhindern, verlangen einige Länder von ausländischen Besuchern, die durch Gelbfiebergebiete gereist sind, eine vorherige Impfung. Die Impfung muss durch ein Impfzertifikat nachgewiesen werden, das 10 Tage nach der Impfung gültig ist und 10 Jahre lang gültig bleibt. Obwohl die WHO am 17. Mai 2013 darauf hinwies, dass spätere Auffrischungsimpfungen unnötig sind, kann es sein, dass ein älteres (als 10 Jahre) Zertifikat nicht an allen Grenzposten in allen betroffenen Ländern akzeptiert wird. Eine Liste der Länder, die eine Gelbfieberimpfung verlangen, wird von der WHO veröffentlicht. Wenn die Impfung aus irgendeinem Grund nicht durchgeführt werden kann, ist möglicherweise eine Befreiung möglich. In diesem Fall ist eine Ausnahmegenehmigung erforderlich, die von einer von der WHO anerkannten Impfstelle ausgestellt wird. Obwohl 32 von 44 Ländern, in denen Gelbfieber endemisch auftritt, Impfprogramme haben, sind in vielen dieser Länder weniger als 50 % der Bevölkerung geimpft. ⓘ
Vektorkontrolle

Neben Impfungen ist die Kontrolle der Gelbfiebermücke (Aedes aegypti) von großer Bedeutung, besonders da dieselbe Mücke neben Gelbfieber auch weitere Krankheiten wie Dengue- und Chikungunyafieber übertragen kann. Die Gelbfiebermücke brütet bevorzugt in Wasseransammlungen, die von Bewohnern in Gebieten mit prekärer Trinkwasserversorgung selbst angelegt wurden oder die sich in Hausmüll ansammeln; insbesondere in Reifen, aber auch in alten Dosen und Plastikgefäßen. Besonders in der Nähe urbaner Zentren von Entwicklungsländern sind diese Bedingungen oft anzutreffen und bilden ein ausgezeichnetes Habitat für die Gelbfiebermücke. Bei der Bekämpfung der Mücke werden zwei Strategien verfolgt: Einerseits werden Maßnahmen zur Abtötung der sich entwickelnden Larven ergriffen. Dabei werden neben Maßnahmen zur Verminderung der Larvengewässer vor allem Larvizide, larvenfressende Fische und Ruderfußkrebse (Copepoda) eingesetzt, welche direkt die Anzahl der Larven und somit indirekt die Anzahl der krankheitsübertragenden Mücken dezimiert. In Vietnam werden seit mehreren Jahren Ruderfußkrebse der Gattung Mesocyclops zur Bekämpfung des Denguefiebers eingesetzt (Gelbfieber kommt in Asien nicht vor), wobei die Ausführung der Maßnahmen monatlich überprüft wird. Dies führte dazu, dass in den betroffenen Gebieten seit 2001 kein Fall von Dengue-Fieber mehr auftrat; eine ähnliche Maßnahme ist wahrscheinlich auch gegen Gelbfieber effektiv, weil beide Maßnahmen auf denselben Organismus zielen. Als chemisches Larvizid wird vorwiegend Pyriproxyfen empfohlen, da es für Menschen ungefährlich ist und bereits in kleinen Mengen wirksam ist. ⓘ
Andererseits werden neben den Larven auch die erwachsenen Gelbfiebermücken bekämpft. Dabei werden Vorhänge und Abdeckungen von Wasserbehältern mit Insektizid behandelt und es kann Insektizid in den Innenräumen versprüht werden, was aber von der WHO nicht empfohlen wird. Wie gegen den Überträger der Malariakrankheit, die Anopheles-Mücke, werden auch gegen Gelbfiebermücken insektizidbehandelte Moskitonetze mit Erfolg eingesetzt. ⓘ
Behandlung
Für Gelbfieber existiert wie für alle von Flaviviren ausgelösten Krankheiten keine ursächliche Therapie. Wenn möglich, ist eine Einweisung in ein Krankenhaus (Hospitalisierung) vorzunehmen und aufgrund des in manchen Fällen sich schnell verschlechternden Krankheitszustandes ist eine intensivmedizinische Überwachung angebracht. Verschiedene Methoden zur akuten Behandlung der Krankheit zeigten in Studien wenig Erfolg, so ist eine passive Immunisierung nach dem Erscheinen von Symptomen wahrscheinlich ohne Effekt. Auch Ribavirin und andere antivirale Medikamente zeigten genauso wie Behandlungen mit Interferonen keine positiven Wirkungen in Gelbfieberpatienten. Eine symptomatische Behandlung umfasst Maßnahmen zur Rehydratation und Gabe von Mitteln wie Paracetamol zur Schmerzlinderung. Auf Acetylsalicylsäure (z. B. Aspirin) sollte aufgrund seiner gerinnungshemmenden Wirkung verzichtet werden, da diese im Falle von inneren Blutungen, die bei Gelbfieber auftreten können, verheerend ist. ⓘ
Epidemiologie
Gelbfieber ist in tropischen und subtropischen Gebieten Südamerikas und Afrikas verbreitet. Weltweit leben etwa 600 Millionen Menschen in endemischen Gebieten. Die WHO schätzt, dass jedes Jahr weltweit 200.000 Fälle von Gelbfieber auftreten. Bei etwa 15 % der mit Gelbfieber infizierten Menschen entwickelt sich eine schwere Form der Krankheit, und bis zur Hälfte von ihnen stirbt daran, da es keine Heilung für Gelbfieber gibt. ⓘ
Afrika

Schätzungsweise 90 % der Gelbfieberinfektionen treten auf dem afrikanischen Kontinent auf. Im Jahr 2016 kam es in Angola zu einem großen Ausbruch, der sich auf die Nachbarländer ausbreitete, bevor er durch eine massive Impfkampagne eingedämmt werden konnte. Im März und April 2016 wurden in China 11 importierte Fälle des Angola-Genotyps bei nicht geimpften chinesischen Staatsbürgern gemeldet, das erste Auftreten der Krankheit in Asien in der Geschichte. ⓘ
Durch phylogenetische Analysen wurden sieben Genotypen von Gelbfieberviren identifiziert, von denen angenommen wird, dass sie unterschiedlich an den Menschen und an den Vektor A. aegypti angepasst sind. Fünf Genotypen (Angola, Zentral-/Ostafrika, Ostafrika, Westafrika I und Westafrika II) kommen nur in Afrika vor. Der Genotyp Westafrika I ist in Nigeria und der umliegenden Region zu finden. Der westafrikanische Genotyp I scheint besonders infektiös zu sein, da er häufig mit großen Ausbrüchen in Verbindung gebracht wird. Die drei außerhalb von Nigeria und Angola gefundenen Genotypen kommen in Gebieten vor, in denen Ausbrüche selten sind. Zwei Ausbrüche in Kenia (1992-1993) und im Sudan (2003 und 2005) betrafen den ostafrikanischen Genotyp, der in den vergangenen 40 Jahren unentdeckt geblieben war. ⓘ
Südamerika

In Südamerika wurden zwei Genotypen identifiziert (südamerikanische Genotypen I und II). Ausgehend von einer phylogenetischen Analyse scheinen diese beiden Genotypen ihren Ursprung in Westafrika zu haben und wurden zuerst nach Brasilien eingeschleppt. Das Einschleppungsdatum des afrikanischen Vorgängergenotyps, aus dem die südamerikanischen Genotypen hervorgingen, scheint 1822 zu sein (95 % Konfidenzintervall 1701 bis 1911). Aus den historischen Aufzeichnungen geht hervor, dass zwischen 1685 und 1690 in Recife, Brasilien, ein Ausbruch des Gelbfiebers stattfand. Die Krankheit scheint verschwunden zu sein, der nächste Ausbruch ereignete sich im Jahr 1849. Sie wurde wahrscheinlich mit dem Sklavenhandel aus Afrika eingeschleppt. Der Genotyp I wurde in fünf Subkladen unterteilt, A bis E. ⓘ
Ende 2016 kam es im brasilianischen Bundesstaat Minas Gerais zu einem großen Ausbruch, der als Wald- oder Dschungel-Epizootie bezeichnet wurde. Es begann mit einem Ausbruch bei braunen Brüllaffen, die als Sentinel-Spezies für Gelbfieber dienen, und breitete sich dann auf Männer aus, die im Dschungel arbeiteten. Es gab keine Fälle, die durch die A. aegypti-Mücke, die sich in Städten schnell ausbreiten kann, auf Menschen übertragen wurden. Im April 2017 bewegte sich der Ausbruch im Dschungel weiter in Richtung der brasilianischen Küste, wo die meisten Menschen nicht geimpft waren. Ende Mai schien der Ausbruch rückläufig zu sein, nachdem mehr als 3.000 Verdachtsfälle, 758 bestätigte Fälle und 264 Todesfälle als Gelbfieber bestätigt worden waren. Das Gesundheitsministerium startete eine Impfkampagne und war besorgt über die Ausbreitung während der Karnevalszeit im Februar und März. Die CDC gab eine Warnmeldung der Stufe 2 heraus (erhöhte Vorsichtsmaßnahmen treffen). ⓘ
Eine Bayes'sche Analyse der Genotypen I und II hat gezeigt, dass der Genotyp I für praktisch alle aktuellen Infektionen in Brasilien, Kolumbien, Venezuela sowie Trinidad und Tobago verantwortlich ist, während der Genotyp II für alle Fälle in Peru verantwortlich ist. Der Genotyp I entstand in der nordbrasilianischen Region um 1908 (95 % höchstes posteriores Dichteintervall [HPD]: 1870-1936). Der Genotyp II entstand 1920 in Peru (95 % HPD: 1867-1958). Die geschätzte Mutationsrate für beide Genotypen betrug etwa 5 × 10-4 Substitutionen/Stelle/Jahr, ähnlich wie bei anderen RNA-Viren. ⓘ
Asien
Der Hauptvektor (A. aegypti) kommt auch in den tropischen und subtropischen Regionen Asiens, des Pazifiks und Australiens vor, aber Gelbfieber ist dort nie aufgetreten, bis durch Flugreisen 11 Fälle des Gelbfieberausbruchs 2016 in Angola und der DR Kongo in Afrika eingeschleppt wurden. Zu den vorgeschlagenen Erklärungen gehören:
- Dass die Mückenstämme im Osten weniger in der Lage sind, das Gelbfiebervirus zu übertragen.
- Dass die Bevölkerung aufgrund anderer Krankheiten, die durch verwandte Viren verursacht werden (z. B. Dengue), immun ist.
- dass die Krankheit nie eingeschleppt wurde, weil der Schiffsverkehr unzureichend war.
Aber keine dieser Erklärungen wird als zufriedenstellend angesehen. Ein weiterer Vorschlag ist das Fehlen eines Sklavenhandels nach Asien in der Größenordnung des Sklavenhandels nach Amerika. Durch den transatlantischen Sklavenhandel wurde das Gelbfieber wahrscheinlich aus Afrika in die westliche Hemisphäre eingeschleppt. ⓘ
Geschichte
Frühgeschichte
Der evolutionäre Ursprung des Gelbfiebers liegt höchstwahrscheinlich in Afrika, wo die Krankheit von nichtmenschlichen Primaten auf den Menschen übertragen wurde. Man nimmt an, dass das Virus in Ost- oder Zentralafrika entstanden ist und sich von dort nach Westafrika ausgebreitet hat. Da das Virus in Afrika endemisch war, hatten die lokalen Bevölkerungen eine gewisse Immunität dagegen entwickelt. Bei einem Gelbfieberausbruch in einer afrikanischen Gemeinde, in der sich Kolonisten aufhielten, starben die meisten Europäer, während die einheimischen Afrikaner in der Regel nicht-tödliche Symptome entwickelten, die einer Grippe ähnelten. Dieses Phänomen, bei dem bestimmte Bevölkerungsgruppen aufgrund einer längeren Exposition in ihrer Kindheit eine Immunität gegen Gelbfieber entwickeln, wird als erworbene Immunität bezeichnet. Das Virus und der Überträger A. aegypti wurden wahrscheinlich mit dem Sklavenhandel aus Afrika nach Nord- und Südamerika gebracht, der Teil des kolumbianischen Austauschs nach der europäischen Entdeckung und Kolonialisierung war. ⓘ
Der erste definitive Ausbruch von Gelbfieber in der Neuen Welt erfolgte 1647 auf der Insel Barbados. Einen Ausbruch verzeichneten spanische Kolonisten 1648 auf der Halbinsel Yucatán, wo die indigene Maya-Bevölkerung die Krankheit xekik ("Bluterbrechen") nannte. In Brasilien kam es 1685 zu einer ersten Epidemie in Recife. Die erste Erwähnung der Krankheit unter dem Namen "Gelbfieber" stammt aus dem Jahr 1744.
- (John Mitchell) (1805) (Mitchell's account of the Yellow Fever in Virginia in 1741-2) Archived 2017-02-23 at the Wayback Machine, The Philadelphia Medical Museum, 1 (1) : 1-20.
- (John Mitchell) (1814) "Account of the Yellow fever which prevailed in Virginia in the years 1737, 1741, and 1742, in a letter to the late Cadwallader Colden, Esq. of New York, from the late John Mitchell, M.D.F.R.S. of Virginia," Archived 2017-02-23 at the Wayback Machine American Medical and Philosophical Register, 4 : 181-215. Der Begriff "Gelbfieber" erscheint auf S. 186. Auf S. 188 erwähnt Mitchell, dass "... die Staupe das war, was man in Amerika allgemein als Gelbfieber bezeichnet". Auf den Seiten 191-192 stellt er jedoch fest: "... ich werde die Ursache der Gelbfärbung betrachten, die bei dieser Staupe so auffällig ist, dass sie den Namen Gelbfieber erhalten hat." ⓘ
Dr. Mitchell stellte jedoch eine falsche Diagnose für die von ihm beobachtete und behandelte Krankheit, bei der es sich wahrscheinlich um die Weilsche Krankheit oder Hepatitis handelte. Siehe: Jarcho S (1957). "John Mitchell, Benjamin Rush und das Gelbfieber". Bulletin of the History of Medicine. 31 (2): 132-136. PMID 13426674.</ref> McNeill argumentiert, dass die durch die Einführung von Zuckerplantagen verursachte ökologische Störung die Bedingungen für die Vermehrung von Moskitos und Viren und die nachfolgenden Gelbfieberausbrüche schuf. Die Abholzung der Wälder reduzierte die Populationen von insektenfressenden Vögeln und anderen Lebewesen, die sich von Mücken und deren Eiern ernährten. ⓘ

In der Kolonialzeit und während der napoleonischen Kriege waren die Westindischen Inseln als besonders gefährlicher Einsatzort für Soldaten bekannt, da das Gelbfieber in dieser Region endemisch war. Die Sterblichkeitsrate in den britischen Garnisonen auf Jamaika war siebenmal so hoch wie in den Garnisonen in Kanada, hauptsächlich aufgrund von Gelbfieber und anderen tropischen Krankheiten. Sowohl die englischen als auch die französischen Streitkräfte, die dort stationiert waren, wurden von der "Gelbfieberkrankheit" schwer getroffen. In dem Bestreben, die Kontrolle über den lukrativen Zuckerhandel in Saint-Domingue (Hispaniola) zurückzuerlangen und Frankreichs Reich in der Neuen Welt wiederzuerlangen, schickte Napoleon eine Armee unter dem Kommando seines Schwagers General Charles Leclerc nach Saint-Domingue, um nach einem Sklavenaufstand die Kontrolle zu übernehmen. Der Historiker J. R. McNeill geht davon aus, dass diese Truppen während der Kämpfe etwa 35 000 bis 45 000 Opfer des Gelbfiebers zu beklagen hatten. Nur ein Drittel der französischen Truppen überlebte bis zum Rückzug und der Rückkehr nach Frankreich. Napoleon gab die Insel und seine Pläne für Nordamerika auf und verkaufte 1803 die Louisiana Purchase an die USA. Im Jahr 1804 rief Haiti seine Unabhängigkeit als zweite Republik der westlichen Hemisphäre aus. Es ist umstritten, ob die Zahl der durch Krankheiten verursachten Todesfälle während der haitianischen Revolution übertrieben war. ⓘ
Obwohl das Gelbfieber vor allem in tropischen Klimazonen auftritt, blieben auch die nördlichen Vereinigten Staaten nicht von der Krankheit verschont. Der erste Ausbruch im englischsprachigen Nordamerika ereignete sich im Jahr 1668 in New York City. Englische Kolonisten in Philadelphia und Franzosen im Mississippi-Tal verzeichneten 1669 größere Ausbrüche, und im 18. und 19. Jahrhundert gab es weitere Gelbfieberepidemien in Philadelphia, Baltimore und New York City. Die Krankheit verbreitete sich von New Orleans aus mit Dampfschiffen und forderte insgesamt etwa 100 000 bis 150 000 Todesopfer. Bei der Gelbfieberepidemie von 1793 in Philadelphia, der damaligen Hauptstadt der Vereinigten Staaten, starben mehrere tausend Menschen, mehr als 9 % der Bevölkerung. Einer dieser Todesopfer war James Hutchinson, ein Arzt, der bei der Behandlung der Bevölkerung der Stadt half. Die nationale Regierung floh aus der Stadt nach Trenton, New Jersey, darunter auch Präsident George Washington. ⓘ
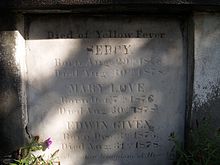
Die Stadt New Orleans im Süden des Landes wurde im 19. Jahrhundert von großen Epidemien heimgesucht, vor allem 1833 und 1853. Im Jahr 1873 kam es sowohl in New Orleans als auch in Shreveport, Louisiana, zu einer großen Epidemie. Die Einwohner nannten die Krankheit "Yellow Jack". Städtische Epidemien traten in den Vereinigten Staaten bis 1905 auf, wobei der letzte Ausbruch New Orleans betraf. ⓘ
Im 18. und 19. Jahrhundert kam es auf dem amerikanischen Kontinent zu mindestens 25 größeren Ausbrüchen, darunter besonders schwerwiegende in Cartagena, Chile, im Jahr 1741, in Kuba 1762 und 1900, in Santo Domingo 1803 und in Memphis, Tennessee, im Jahr 1878. ⓘ
Jahrhunderts führte das Gelbfieber in der Karibik zu ernsten Gesundheitsproblemen" und beunruhigte die US-Marine, da zahlreiche Todesfälle und Krankheiten die Marineoperationen beeinträchtigten und die Moral zerstörten. Eine dieser Episoden begann im April 1822, als die Fregatte USS Macedonian Boston verließ und Teil des Westindien-Geschwaders von Commodore James Biddle wurde. Was alle nicht wussten, war, dass sie im Begriff waren, sich auf eine Kreuzfahrt in die Katastrophe zu begeben, und dass sich ihr Auftrag als "eine Fahrt durch die Hölle" erweisen würde. Der Marineminister Smith Thompson hatte das Geschwader beauftragt, die Handelsschifffahrt der Vereinigten Staaten zu bewachen und die Piraterie zu bekämpfen. Während ihres Einsatzes vom 26. Mai bis zum 3. August 1822 starben 76 Offiziere und Männer der Macedonian, darunter John Cadle, Chirurg der USN. Vierundsiebzig dieser Todesfälle wurden dem Gelbfieber zugeschrieben. Biddle berichtete, dass weitere 52 seiner Besatzung auf der Krankenliste standen. In ihrem Bericht an den Marineminister gaben Biddle und Surgeon's Mate Charles Chase als Ursache "Fieber" an. Als Folge dieses Verlustes sah sich Biddle gezwungen, sein Geschwader vorzeitig in die Marinewerft von Norfolk zurückzuholen. Nach der Ankunft wurde die Besatzung der Macedonian medizinisch versorgt und auf Craney Island, Virginia, unter Quarantäne gestellt. ⓘ

1853 brach in Cloutierville, Louisiana, im Spätsommer das Gelbfieber aus, an dem innerhalb kurzer Zeit 68 der 91 Einwohner starben. Ein örtlicher Arzt kam zu dem Schluss, dass ein nicht näher spezifizierter Krankheitserreger in einem Paket aus New Orleans eingetroffen war. Im Jahr 1854 starben 650 Einwohner von Savannah, Georgia, an Gelbfieber. Im Jahr 1858 starben in der St. Matthew's German Evangelical Lutheran Church in Charleston, South Carolina, 308 Menschen an Gelbfieber, wodurch sich die Gemeinde um die Hälfte reduzierte. Im Juni 1855 erreichte ein Schiff mit mit dem Virus infizierten Personen Hampton Roads im Südosten Virginias. Die Krankheit breitete sich schnell in der Gemeinde aus und kostete schließlich über 3 000 Menschen das Leben, vor allem Bewohner von Norfolk und Portsmouth. Im Jahr 1873 fielen in Shreveport, Louisiana, innerhalb von 80 Tagen 759 Bürger einer Gelbfieberepidemie zum Opfer, über 400 weitere erlagen schließlich der Krankheit. Die Gesamtzahl der Todesopfer von August bis November belief sich auf etwa 1.200. ⓘ
Im Jahr 1878 starben etwa 20.000 Menschen an einer weit verbreiteten Epidemie im Mississippi-Tal. In jenem Jahr gab es in Memphis ungewöhnlich viel Regen, was zu einer Zunahme der Mückenpopulation führte. Die Folge war eine große Gelbfieberepidemie. Der Dampfer John D. Porter nahm Menschen, die aus Memphis flohen, in der Hoffnung, der Seuche zu entkommen, mit nach Norden, aber die Passagiere durften nicht von Bord gehen, da sie eine Verbreitung des Gelbfiebers befürchteten. Das Schiff fuhr die nächsten zwei Monate auf dem Mississippi umher, bevor es seine Passagiere ausladen konnte. ⓘ
Auch in Südeuropa kam es zu größeren Ausbrüchen. In Gibraltar starben 1804, 1814 und 1828 viele Menschen an der Seuche. In Barcelona kamen bei einem Ausbruch im Jahr 1821 mehrere tausend Bürger ums Leben. Der Herzog von Richelieu entsandte 30 000 französische Soldaten an die spanisch-französische Grenze in den Pyrenäen, um einen Cordon sanitaire zu errichten, der ein Übergreifen der Epidemie von Spanien auf Frankreich verhindern sollte. ⓘ
Ursachen und Übertragung



Ezekiel Stone Wiggins, bekannt als der Prophet von Ottawa, schlug vor, dass die Ursache für eine Gelbfieberepidemie in Jacksonville, Florida, im Jahr 1888 astrologisch bedingt war.
Die Planeten befanden sich auf einer Linie mit der Sonne und der Erde, was neben Wirbelstürmen, Erdbeben usw. auch eine dichtere Atmosphäre zur Folge hatte, die mehr Kohlenstoff enthielt und Mikroben hervorbrachte. Der Mars hatte eine ungewöhnlich dichte Atmosphäre, aber seine Bewohner waren wahrscheinlich durch ihre neu entdeckten Kanäle vor dem Fieber geschützt, die vielleicht dazu dienten, Kohlenstoff zu absorbieren und die Krankheit zu verhindern. ⓘ
1848 schlug Josiah C. Nott vor, dass Gelbfieber durch Insekten wie Motten oder Stechmücken übertragen wird, wobei er sich auf das Übertragungsmuster der Krankheit stützte. Carlos Finlay, ein kubanischer Arzt und Wissenschaftler, schlug 1881 vor, dass Gelbfieber durch bereits infizierte Moskitos übertragen werden könnte und nicht, wie lange angenommen, durch direkten Kontakt von Mensch zu Mensch. Da die Verluste durch Gelbfieber im Spanisch-Amerikanischen Krieg in den 1890er Jahren extrem hoch waren, begannen Armeeärzte mit einem Team unter der Leitung von Walter Reed, bestehend aus den Ärzten James Carroll, Aristides Agramonte und Jesse William Lazear, mit Forschungsexperimenten. Sie bewiesen erfolgreich Finlays "Moskito-Hypothese". Das Gelbfieber war das erste Virus, das nachweislich durch Moskitos übertragen wurde. Der Arzt William Gorgas wandte diese Erkenntnisse an und rottete das Gelbfieber in Havanna aus. Auch beim Bau des Panamakanals setzte er sich gegen das Gelbfieber ein. Ein früherer Versuch der Franzosen, den Kanal zu bauen, war zum Teil an der hohen Sterblichkeitsrate durch Gelbfieber und Malaria gescheitert, an der viele Arbeiter starben. ⓘ
Obwohl Reed in den Geschichtsbüchern der Vereinigten Staaten das Verdienst zugeschrieben wird, das Gelbfieber "besiegt" zu haben, hatte er Finlay die Entdeckung des Gelbfiebervektors und dessen Bekämpfung zu verdanken. Reed zitierte Finlays Arbeiten häufig in seinen eigenen Artikeln und zollte ihm auch in seiner persönlichen Korrespondenz Anerkennung für seine Entdeckung. Die Anerkennung von Finlays Arbeit war eine der wichtigsten und weitreichendsten Auswirkungen der Gelbfieberkommission der US-Armee von 1900. Durch die Anwendung der von Finlay vorgeschlagenen Methoden konnten die Regierung und die Armee der Vereinigten Staaten das Gelbfieber in Kuba und später in Panama ausrotten und so die Fertigstellung des Panamakanals ermöglichen. Während Reed auf den Forschungen von Finlay aufbaute, stellt der Historiker François Delaporte fest, dass die Gelbfieberforschung ein umstrittenes Thema war. Wissenschaftler, darunter auch Finlay und Reed, wurden erfolgreich, indem sie auf der Arbeit weniger prominenter Wissenschaftler aufbauten, ohne ihnen immer die ihnen gebührende Anerkennung zukommen zu lassen. Reeds Forschungen waren für den Kampf gegen das Gelbfieber von entscheidender Bedeutung. Ihm wird auch zugeschrieben, dass er bei seinen Experimenten in Kuba zum ersten Mal eine Art medizinisches Einverständnisformular verwendete, um sicherzustellen, dass die Teilnehmer wussten, dass sie mit der Teilnahme an den Versuchen ein Risiko eingingen. ⓘ
Wie Kuba und Panama führte auch Brasilien eine äußerst erfolgreiche Hygienekampagne gegen Moskitos und Gelbfieber durch. Die 1903 begonnene Kampagne unter der Leitung von Oswaldo Cruz, dem damaligen Generaldirektor für öffentliche Gesundheit, führte nicht nur zur Ausrottung der Krankheit, sondern auch zur Umgestaltung der Landschaft brasilianischer Städte wie Rio de Janeiro. Während der Regenzeit kam es in Rio de Janeiro regelmäßig zu Überschwemmungen, da das Wasser aus der Bucht, die die Stadt umgibt, in die engen Straßen Rio de Janeiros floss. In Verbindung mit den schlechten Entwässerungssystemen in ganz Rio führte dies zu sumpfigen Verhältnissen in den Stadtvierteln. Pfützen aus stehendem Wasser standen das ganze Jahr über in den Straßen der Stadt und erwiesen sich als fruchtbarer Boden für krankheitsübertragende Moskitos. Unter der Leitung von Cruz arbeiteten daher Einheiten des öffentlichen Gesundheitswesens, die als "Moskito-Inspektoren" bekannt waren, hart daran, das Gelbfieber in ganz Rio zu bekämpfen, indem sie sprühten, Ratten vernichteten, die Entwässerung verbesserten und unhygienische Wohnungen zerstörten. Die Sanierungs- und Renovierungskampagnen der Stadt veränderten schließlich die Stadtteile von Rio de Janeiro. Die armen Bewohner wurden aus dem Stadtzentrum in die Vororte oder in die Städte am Stadtrand verdrängt. In späteren Jahren lebten die ärmsten Einwohner Rios in Favelas. ⓘ

In den Jahren 1920-1923 unternahm das International Health Board der Rockefeller Foundation eine teure und erfolgreiche Kampagne zur Ausrottung des Gelbfiebers in Mexiko. Der Erfolg verschaffte dem IHB den Respekt der mexikanischen Bundesregierung. Die Ausrottung des Gelbfiebers stärkte die Beziehungen zwischen den USA und Mexiko, die in den Jahren zuvor nicht besonders gut gewesen waren. Die Ausrottung des Gelbfiebers war auch ein wichtiger Schritt zu einer besseren globalen Gesundheit. ⓘ
Im Jahr 1927 isolierten Wissenschaftler das Gelbfiebervirus in Westafrika. Daraufhin wurden in den 1930er Jahren zwei Impfstoffe entwickelt. Max Theiler war federführend bei der Fertigstellung des Gelbfieberimpfstoffs 17D im Jahr 1937, wofür er später den Nobelpreis für Physiologie oder Medizin erhielt. Dieser Impfstoff, 17D, ist immer noch in Gebrauch, obwohl neuere Impfstoffe, die auf Vero-Zellen basieren, in der Entwicklung sind (Stand 2018). ⓘ
Aktueller Stand
Durch Vektorkontrolle und strenge Impfprogramme konnte der städtische Gelbfieberzyklus in Südamerika nahezu ausgerottet werden. Seit 1943 ist nur ein einziger städtischer Ausbruch in Santa Cruz de la Sierra, Bolivien, aufgetreten. Seit den 1980er Jahren steigt die Zahl der Gelbfieberfälle jedoch wieder an, und A. aegypti ist in die städtischen Zentren Südamerikas zurückgekehrt. Dies ist zum Teil auf die begrenzte Verfügbarkeit von Insektiziden sowie auf die durch den Klimawandel verursachte Verlagerung von Lebensräumen zurückzuführen. Es liegt auch daran, dass das Vektorkontrollprogramm aufgegeben wurde. Obwohl noch kein neuer urbaner Zyklus etabliert wurde, glauben Wissenschaftler, dass dies jederzeit wieder passieren könnte. Bei einem Ausbruch in Paraguay im Jahr 2008 ging man davon aus, dass es sich um einen städtischen Zyklus handelte, was sich jedoch letztlich nicht bewahrheitete. ⓘ
In Afrika haben sich die Programme zur Ausrottung des Virus hauptsächlich auf Impfungen gestützt. Diese Programme waren weitgehend erfolglos, da sie den sylvatischen Zyklus mit wildlebenden Primaten nicht durchbrechen konnten. Da nur wenige Länder regelmäßige Impfprogramme eingeführt haben, wurden die Maßnahmen zur Bekämpfung des Gelbfiebers vernachlässigt, was eine weitere Ausbreitung des Virus wahrscheinlicher macht. ⓘ
Forschung
Im Hamstermodell des Gelbfiebers ist die frühzeitige Verabreichung des Virostatikums Ribavirin eine wirksame Behandlung vieler pathologischer Merkmale der Krankheit. Eine Ribavirin-Behandlung in den ersten fünf Tagen nach der Virusinfektion verbesserte die Überlebensraten, verringerte die Gewebeschäden in Leber und Milz, verhinderte die hepatozelluläre Steatose und normalisierte die Werte der Alanin-Aminotransferase, eines Markers für Leberschäden. Der Wirkmechanismus von Ribavirin bei der Verringerung der Leberpathologie bei einer Infektion mit dem Gelbfiebervirus ähnelt möglicherweise seiner Wirkung bei der Behandlung von Hepatitis C, einem verwandten Virus. Da Ribavirin das Überleben in einem virulenten Rhesusmodell der Gelbfieberinfektion nicht verbessern konnte, war es zuvor als mögliche Therapie ausgeschlossen worden. Bei Stechmücken mit dem Wolbachia-Stamm wMel wurde die Infektion reduziert. ⓘ
Gelbfieber wurde von mehreren Ländern als potenzielle biologische Waffe erforscht. ⓘ
Potentielle biologische Waffe
Gelbfieber wurde von verschiedenen Regierungen, darunter auch der amerikanischen und möglicherweise der nordkoreanischen Regierung, als potentielle biologische Waffe untersucht. Das Programm der amerikanischen Regierung wurde 1969 offiziell eingestellt. Im Zweiten Weltkrieg wurde ein Versuch unternommen, sämtliche amerikanische Armeeangehörige gegen Gelbfieber zu impfen, da sich die japanische Armee 1939 Gelbfieberviren beschaffen wollte, wovon die amerikanischen Geheimdienste wussten. Zu diesem Zeitpunkt war in den USA noch keine Gelbfieberimpfung von der FDA freigegeben worden und so wurde eine nicht anerkannte Impfung verwendet, was dazu führte, dass 330.000 Personen mit dem Hepatitis-B-Virus infiziert wurden (es handelt sich dabei um den größten Ausbruch dieser Viruserkrankung überhaupt). Weiterhin wurde 1975 ein Großversuch der WHO in Indien, der mit amerikanischen Geldern durchgeführt wurde und bei dem die Bekämpfung der Gelbfiebermücke hätte untersucht werden sollen, von der indischen Regierung gestoppt, da indische Wissenschaftler befürchtet hatten, die amerikanische Regierung untersuche eigentlich die Möglichkeit, Gelbfieber als biologische Waffe zu benutzen. Auch wird befürchtet, dass Terroristen das Gelbfiebervirus als biologische Waffe einsetzen könnten. ⓘ
Meldepflicht
Gelbfieber ist in Österreich gemäß § 1 Abs. 1 Nummer 1 Epidemiegesetz 1950 bei Verdacht, Erkrankung und Tod anzeigepflichtig. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz). ⓘ
In der Schweiz besteht Meldepflicht bei klinischem Verdacht, Todesfall sowie dem positiven und negativen Infektionsnachweis für den Erreger Gelbfieber-Virus durch den behandelnden Arzt bzw. das untersuchende Labor. Dies ergibt sich aus dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 bzw. Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. ⓘ
In Deutschland ist Gelbfieber gemäß § 6 Infektionsschutzgesetz (IfSG) bei Verdacht auf ein virusbedingtes hämorrhagisches Fieber bzw. gemäß § 7 IfSG bei Nachweis des Krankheitserregers Gelbfiebervirus seitens des Arztes bzw. des Labors namentlich meldepflichtig. Diese Meldepflicht wendet sich an Ärzte usw. ⓘ