Nitrile
Ein Nitril ist eine organische Verbindung, die eine funktionelle Gruppe -C≡N aufweist. Die Vorsilbe Cyano- wird in der Fachliteratur austauschbar mit dem Begriff Nitril verwendet. Nitrile kommen in vielen nützlichen Verbindungen vor, darunter Methylcyanoacrylat, das in Sekundenkleber verwendet wird, und Nitrilkautschuk, ein nitrilhaltiges Polymer, das in latexfreien Labor- und medizinischen Handschuhen eingesetzt wird. Nitrilkautschuk ist auch als Dichtungsmaterial für Kraftfahrzeuge und andere Anwendungen weit verbreitet, da es gegen Kraftstoffe und Öle beständig ist. Organische Verbindungen, die mehrere Nitrilgruppen enthalten, werden als Cyanocarbone bezeichnet. ⓘ
Anorganische Verbindungen, die die -C≡N-Gruppe enthalten, werden nicht als Nitrile, sondern als Cyanide bezeichnet. Obwohl sowohl Nitrile als auch Cyanide von Cyanidsalzen abgeleitet werden können, sind die meisten Nitrile nicht annähernd so giftig. ⓘ
Nitrile sind eine Gruppe chemischer Verbindungen mit der allgemeinen Formel R–C≡N. Die funktionelle Gruppe aus Kohlenstoff und dreifach gebundenem Stickstoff wird als Nitril- oder Cyanogruppe bezeichnet. Die Nitrile leiten sich formal von der Blausäure (HCN) durch Austausch des Wasserstoffatoms gegen einen organischen Rest ab. Die Isomere mit der Formel R–N≡C nennt man Isonitrile. ⓘ
Nitril-Polymere sind chemisch sehr beständig und haben gummiähnliche Eigenschaften, weshalb sie z. B. für Schutzhandschuhe verwendet werden. ⓘ
Struktur und grundlegende Eigenschaften
Die N-C-C-Geometrie ist bei Nitrilen linear, was auf die sp-Hybridisierung des dreifach gebundenen Kohlenstoffs zurückzuführen ist. Der C-N-Abstand ist mit 1,16 Å kurz, was mit einer Dreifachbindung übereinstimmt. Nitrile sind polar, wie die hohen Dipolmomente zeigen. Als Flüssigkeiten haben sie hohe relative Permittivitäten, oft im 30er-Bereich. ⓘ
Geschichte
Die erste Verbindung der homologen Reihe der Nitrile, das Nitril der Ameisensäure, die Blausäure, wurde erstmals 1782 von C. W. Scheele synthetisiert. Im Jahr 1811 gelang es J. L. Gay-Lussac, die sehr giftige und flüchtige Säure in reiner Form herzustellen. Um 1832 wurde Benzonitril, das Nitril der Benzoesäure, von Friedrich Wöhler und Justus von Liebig hergestellt, aber aufgrund der geringen Ausbeute bei der Synthese wurden weder physikalische noch chemische Eigenschaften bestimmt noch eine Struktur vorgeschlagen. 1834 synthetisierte Théophile-Jules Pelouze Propionitril und vermutete, dass es sich um einen Ether aus Propionalkohol und Blausäure handelt. Die Synthese von Benzonitril durch Hermann Fehling im Jahr 1844 durch Erhitzen von Ammoniumbenzoat war die erste Methode, die eine ausreichende Menge der Substanz für die chemische Forschung lieferte. Fehling bestimmte die Struktur, indem er seine Ergebnisse mit der bereits bekannten Synthese von Blausäure durch Erhitzen von Ammoniumformiat verglich. Er prägte den Namen "Nitril" für die neu gefundene Substanz, der zum Namen für diese Gruppe von Verbindungen wurde. ⓘ
Synthese
Die wichtigsten industriellen Verfahren zur Herstellung von Nitrilen sind die Ammoxidation und die Hydrocyanierung. Beide Wege sind insofern umweltfreundlich, als sie keine stöchiometrischen Mengen an Salzen erzeugen. ⓘ
Ammoxidation
Bei der Ammoxidation wird ein Kohlenwasserstoff in Gegenwart von Ammoniak teilweise oxidiert. Diese Umwandlung wird in großem Maßstab für Acrylnitril praktiziert:
- CH3CH=CH2 + 3⁄2 O2 + NH3 → NCCH=CH2 + 3 H2O
Bei der Herstellung von Acrylnitril entsteht als Nebenprodukt Acetonitril. Im industriellen Maßstab werden verschiedene Derivate von Benzonitril, Phthalonitril und Isobutyronitril durch Ammoxidation hergestellt. Der Prozess wird durch Metalloxide katalysiert und läuft vermutlich über das Imin ab. ⓘ
Hydrocyanierung
Die Hydrocyanierung ist eine industrielle Methode zur Herstellung von Nitrilen aus Cyanwasserstoff und Alkenen. Das Verfahren erfordert homogene Katalysatoren. Ein Beispiel für die Hydrocyanierung ist die Herstellung von Adiponitril, einem Vorprodukt von Nylon-6,6 aus 1,3-Butadien:
- CH2=CH-CH=CH2 + 2 HCN → NC(CH2)4CN ⓘ
Aus organischen Halogeniden und Cyanidsalzen
Zwei Salzmetathese-Reaktionen sind für Reaktionen im Labormaßstab beliebt. Bei der Kolbe-Nitril-Synthese werden Alkylhalogenide mit Alkalimetallcyaniden nukleophil aliphatisch substituiert. Arylnitrile werden mit der Rosenmund-von-Braun-Synthese hergestellt. ⓘ
Cyanohydrine

Die Cyanohydrine sind eine besondere Klasse von Nitrilen. Sie entstehen klassischerweise durch die Addition von Alkalimetallcyaniden an Aldehyde in der Cyanhydrinreaktion. Aufgrund der Polarität des organischen Carbonyls erfordert diese Reaktion im Gegensatz zur Hydrocyanierung von Alkenen keinen Katalysator. O-Silylcyanohydrine werden durch Addition von Trimethylsilylcyanid in Gegenwart eines Katalysators erzeugt (Silylcyanierung). Cyanohydrine werden auch durch Transcyanohydrin-Reaktionen hergestellt, z. B. mit Acetoncyanohydrin als HCN-Quelle. ⓘ
Dehydratisierung von Amiden
Nitrile können durch Dehydratisierung von primären Amiden hergestellt werden. Gängige Reagenzien hierfür sind Phosphorpentoxid (P2O5) und Thionylchlorid (SOCl2). Bei einer verwandten Dehydratisierung entstehen aus sekundären Amiden Nitrile durch den von Braun'schen Amidabbau. In diesem Fall wird eine C-N-Bindung gespalten. ⓘ
Aus Aldehyden und Oximen
Die Umwandlung von Aldehyden in Nitrile über Aldoxime ist ein beliebter Laborweg. Aldehyde reagieren leicht mit Hydroxylaminsalzen, manchmal schon bei Umgebungstemperaturen, und ergeben Aldoxime. Diese können durch einfaches Erhitzen zu Nitrilen dehydriert werden, wobei eine breite Palette von Reagenzien hilfreich sein kann, darunter Triethylamin/Schwefeldioxid, Zeolithe oder Sulfurylchlorid. Die verwandte Hydroxylamin-O-Sulfonsäure reagiert in ähnlicher Weise. ⓘ
In speziellen Fällen kann die Van-Leusen-Reaktion eingesetzt werden. Biokatalysatoren wie die aliphatische Aldoxim-Dehydratase sind ebenfalls wirksam. ⓘ
Sandmeyer-Reaktion
Aromatische Nitrile werden häufig im Labor aus Anilin über Diazoniumverbindungen hergestellt. Dies ist die Sandmeyer-Reaktion. Sie erfordert Übergangsmetallcyanide.
- ArN+
2 + CuCN → ArCN + N2 + Cu+ ⓘ
Andere Methoden
- Eine kommerzielle Quelle für die Cyanidgruppe ist Diethylaluminiumcyanid Et2AlCN, das aus Triethylaluminium und HCN hergestellt werden kann. Es wurde für die nukleophile Addition an Ketone verwendet. Für ein Beispiel seiner Verwendung siehe: Kuwajima-Taxol-Totalsynthese
- Cyanid-Ionen erleichtern die Kupplung von Dibromiden. Die Reaktion von α,α′-Dibromoadipinsäure mit Natriumcyanid in Ethanol ergibt das Cyanocyclobutan:

- In der sogenannten Franchimont-Reaktion (die 1872 von dem belgischen Doktoranden Antoine Paul Nicolas Franchimont (1844-1919) entwickelt wurde) wird eine α-Bromcarbonsäure nach Hydrolyse der Cyanogruppe und Decarboxylierung dimerisiert
- Aromatische Nitrile können durch Basenhydrolyse von Trichlormethyl-Arylketiminen (RC(CCl3)=NH) in der Houben-Fischer-Synthese hergestellt werden
- Nitrile können aus primären Aminen durch Oxidation gewonnen werden. Übliche Methoden sind die Verwendung von Kaliumpersulfat, Trichlorisocyanursäure oder die anodische Elektrosynthese.
- α-Aminosäuren bilden Nitrile und Kohlendioxid durch verschiedene Methoden der oxidativen Decarboxylierung. Henry Drysdale Dakin entdeckte diese Oxidation im Jahr 1916.
- Aus Arylcarbonsäuren (Letts-Nitril-Synthese) ⓘ
Reaktionen
Nitrilgruppen in organischen Verbindungen können je nach Reaktanten oder Bedingungen eine Vielzahl von Reaktionen eingehen. Eine Nitrilgruppe kann hydrolysiert, reduziert oder als Cyanidion aus einem Molekül herausgeschleudert werden. ⓘ
Hydrolyse
Die Hydrolyse von Nitrilen RCN verläuft in verschiedenen Schritten unter Säure- oder Basenbehandlung, wobei zunächst Carboxamide RC(=O)NH2 und dann Carbonsäuren RCOOH entstehen. Die Hydrolyse von Nitrilen zu Carbonsäuren ist effizient. In Säure oder Base lauten die Gleichgewichtsgleichungen wie folgt:
- RCN + 2H2O + HCl → RCO2H + NH4Cl
- RCN + H2O + NaOH → RCO2Na + NH3 ⓘ
Streng genommen werden diese Reaktionen durch eine Säure oder eine Base vermittelt (und nicht katalysiert), da ein Äquivalent der Säure bzw. der Base zur Bildung des Ammonium- bzw. Carboxylatsalzes verbraucht wird. ⓘ
Kinetische Untersuchungen zeigen, dass die Geschwindigkeitskonstante zweiter Ordnung für die durch Hydroxid-Ionen katalysierte Hydrolyse von Acetonitril zu Acetamid 1,6 × 10-6 M-1 s-1 beträgt, was langsamer ist als die Hydrolyse des Amids zum Carboxylat (7,4 × 10-5 M-1 s-1). Bei der Hydrolyse durch eine Base entsteht also das Carboxylat (oder das mit dem Carboxylat verunreinigte Amid). Andererseits erfordert die säurekatalysierte Reaktion eine sorgfältige Kontrolle der Temperatur und des Verhältnisses der Reagenzien, um die Bildung von Polymeren zu vermeiden, was durch den exothermen Charakter der Hydrolyse gefördert wird. Das klassische Verfahren zur Umwandlung eines Nitrils in das entsprechende primäre Amid erfordert die Zugabe des Nitrils zu kalter konzentrierter Schwefelsäure. Die weitere Umwandlung in die Carbonsäure wird durch die niedrige Temperatur und die geringe Wasserkonzentration behindert.
- RCN + H2O → RC(O)NH2 ⓘ
Zwei Enzymfamilien katalysieren die Hydrolyse von Nitrilen. Nitrilasen hydrolysieren Nitrile zu Carbonsäuren:
- RCN + 2 H2O → RCO2H + NH3
Nitrilhydratasen sind Metalloenzyme, die Nitrile zu Amiden hydrolysieren.
- RCN + H2O → RC(O)NH2
Diese Enzyme werden kommerziell zur Herstellung von Acrylamid verwendet. ⓘ
Die "wasserfreie Hydratisierung" von Nitrilen zu Amiden wurde unter Verwendung eines Oxims als Wasserquelle nachgewiesen:
- RCN + R'C(H)=NOH → RC(O)NH2 + R'CN ⓘ
Reduktion
Nitrile lassen sich an verschiedenen Metallkatalysatoren hydrieren. Bei der Reaktion kann je nach den Bedingungen entweder das primäre Amin (RCH2NH2) oder das tertiäre Amin ((RCH2)3N) entstehen. Bei herkömmlichen organischen Reduktionen wird das Nitril durch Behandlung mit Lithiumaluminiumhydrid zum Amin reduziert. Die Reduktion zum Imin mit anschließender Hydrolyse zum Aldehyd erfolgt bei der Stephen-Aldehydsynthese, bei der Zinnchlorid in Säure verwendet wird. ⓘ
Alkylierung
Alkylnitrile sind ausreichend sauer, um Nitrilanionen zu bilden, die eine Vielzahl von elektrophilen Verbindungen alkylieren. Der Schlüssel zu dieser außergewöhnlichen Nukleophilie ist der geringe sterische Bedarf der CN-Einheit in Verbindung mit ihrer induktiven Stabilisierung. Aufgrund dieser Eigenschaften eignen sich Nitrile ideal für die Schaffung neuer Kohlenstoff-Kohlenstoff-Bindungen in sterisch anspruchsvollen Umgebungen zur Verwendung in Synthesen der medizinischen Chemie. Jüngste Entwicklungen haben gezeigt, dass die Art des Metallgegenions eine unterschiedliche Koordination entweder mit dem Nitrilstickstoff oder dem benachbarten nukleophilen Kohlenstoff bewirkt, was oft zu tiefgreifenden Unterschieden in der Reaktivität und Stereochemie führt. ⓘ
Nucleophile
Das Kohlenstoffzentrum eines Nitrils ist elektrophil und daher anfällig für nukleophile Additionsreaktionen:
- mit einer zinkorganischen Verbindung in der Blaise-Reaktion
- mit Alkoholen in der Pinner-Reaktion.
- mit Aminen, z. B. bei der Reaktion des Amins Sarcosin mit Cyanamid zur Bildung von Kreatin
- Nitrile reagieren in der Friedel-Crafts-Acylierung in der Houben-Hoesch-Reaktion zu Ketonen ⓘ
Verschiedene Methoden und Verbindungen
- Bei der reduktiven Decyanierung wird die Nitrilgruppe durch ein Proton ersetzt. Decyanierungen können durch Auflösen von Metallreduktion (z. B. HMPA und Kaliummetall in tert-Butanol) oder durch Schmelzen eines Nitrils in KOH durchgeführt werden. In ähnlicher Weise können α-Aminonitrile mit anderen Reduktionsmitteln wie Lithiumaluminiumhydrid decyaniert werden.
- Nitrile reagieren in Gegenwart von Basen in der Thorpe-Reaktion in einer nukleophilen Addition selbst.
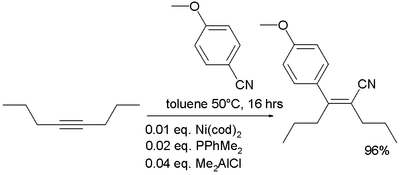
- In der metallorganischen Chemie sind Nitrile dafür bekannt, dass sie bei der Carbocyanierung an Alkine addieren:
Komplexierung
Nitrile sind Vorläufer für Übergangsmetall-Nitrilkomplexe, die als Reagenzien und Katalysatoren dienen. Beispiele sind [Cu(MeCN)4]+ und PdCl2(PhCN)2). ⓘ

Nitril-Derivate
Organische Cyanamide
Cyanamide sind N-Cyanverbindungen mit der allgemeinen Struktur R1R2N-CN und mit dem anorganischen Cyanamid verwandt. ⓘ
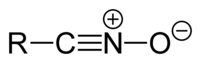
Nitriloxide
Nitriloxide haben die allgemeine Struktur R-CNO oder Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{R-C{\equiv}\overset{\oplus}{N}-O^\ominus <span title="Aus: Englische Wikipedia, Abschnitt "Nitrile oxides"" class="plainlinks">[https://en.wikipedia.org/wiki/Nitrile#Nitrile_oxides <span style="color:#dddddd">ⓘ</span>]</span>}}
Vorkommen und Anwendungen
Nitrile kommen in der Natur in einer Vielzahl von pflanzlichen und tierischen Quellen vor. Über 120 natürlich vorkommende Nitrile wurden aus terrestrischen und marinen Quellen isoliert. Nitrile werden häufig in Obstkernen, insbesondere in Mandeln, und beim Kochen von Brassica-Pflanzen (wie Kohl, Rosenkohl und Blumenkohl) gefunden, die durch Hydrolyse Nitrile freisetzen. Mandelonitril, ein Cyanhydrin, das beim Verzehr von Mandeln oder bestimmten Obstkernen entsteht, setzt Blausäure frei und ist für die Toxizität der cyanogenen Glykoside verantwortlich. ⓘ
Derzeit sind über 30 nitrilhaltige Arzneimittel für eine Vielzahl von medizinischen Indikationen auf dem Markt und mehr als 20 weitere nitrilhaltige Wirkstoffe befinden sich in der klinischen Entwicklung. Die Nitrilgruppe ist recht robust und wird in den meisten Fällen nicht leicht verstoffwechselt, sondern geht unverändert durch den Körper. Die Arten von Arzneimitteln, die Nitrile enthalten, sind vielfältig und reichen von Vildagliptin, einem Antidiabetikum, bis zu Anastrozol, dem Goldstandard in der Behandlung von Brustkrebs. In vielen Fällen ahmt das Nitril die Funktionalität von Enzymsubstraten nach, während in anderen Fällen das Nitril die Wasserlöslichkeit erhöht oder die Anfälligkeit für den oxidativen Stoffwechsel in der Leber verringert. Die funktionelle Nitrilgruppe ist in mehreren Arzneimitteln enthalten. ⓘ
Struktur von Citalopram, einem Antidepressivum aus der Klasse der selektiven Serotonin-Wiederaufnahme-Hemmer (SSRI).
Struktur von Letrozol, einem oralen nichtsteroidalen Aromatasehemmer für die Behandlung bestimmter Brustkrebsarten. ⓘ
Nomenklatur
nach IUPAC: Butannitril (blau markiertes C-Atom zählt zur Hauptkette),
formal auch Propancarbonitril (blau markiertes C-Atom zählt zum Substituenten) ⓘ
Ist das Nitril die funktionelle Gruppe höchster Rangordnung, so wird die Endung "-nitril" an den Namen der Ausgangsverbindung angehängt, die Benennung erfolgt als „Alkannitril“. Das dreifach gebundene Kohlenstoffatom wird, wie immer, für die Benennung des Grundgerüsts mitgezählt. Alternativ kann (analog zu -carbonsäure), die Endung "-carbonitril" verwendet werden, hier wird das Kohlenstoffatom nicht zum Grundgerüst gezählt. ⓘ
Ist die Nitrilfunktion nicht von höchster Rangordnung im Molekül, so wird die Vorsilbe „Cyan-“ mit entsprechender Positionsbezeichnung verwendet. Auch hier wird das dreifach gebundene Kohlenstoffatom nicht zum Grundgerüst gezählt. ⓘ
Entsprechend ihrer Verwandtschaft mit den Carbonsäuren (der Nitrilkohlenstoff hat die gleiche Oxidationsstufe wie der Carboxylkohlenstoff) werden viele Nitrile trivial als „Carboxylonitrile“ bezeichnet, beispielsweise Acetonitril, Propionitril, Butyronitril oder Mandelonitril. ⓘ
Herstellung
Enantioselektive Synthese chiraler Nitrile
Die enantioselektive Synthese von Nitrilen findet zunehmende Beachtung, weil sterisch einheitliche chirale Nitrile als Arzneistoffe (Vildagliptin, Saxagliptin) angewandt werden. ⓘ
Verwendung

Besonders Adiponitril und Acrylnitril sind als Zwischenprodukte der Kunststoffherstellung von praktischer Bedeutung. ⓘ
Eine wichtige Bedeutung von Nitrilen liegt darin, dass man in einer chemischen Synthese diese Gruppe leicht einführen und dann in andere funktionelle Gruppen (Aminosäuren oder Amine) umwandeln kann. Das Verfahren zur Herstellung von α-Aminosäuren aus Aldehyden, bei der Nitrile als Zwischenprodukte auftreten, ist als Strecker-Synthese bekannt. ⓘ
Acetonitril findet als Lösungsmittel Verwendung. ⓘ
Bei medizinischen Untersuchungshandschuhen sind solche aus Nitrilkautschuk aufgrund der fehlenden Allergiegefahr denen aus Latex überlegen. Als Material für Schutzhandschuhe besticht besonders die gute chemische Beständigkeit. ⓘ