Phenol
|
| |||
|
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugte IUPAC-Bezeichnung
Phenol | |||
| Systematische IUPAC-Bezeichnung
Benzenol | |||
| Andere Bezeichnungen
Karbolsäure
Phenylsäure Hydroxybenzol Phenolsäure | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C6H6O | ||
| Molare Masse | 94,113 g/mol | ||
| Erscheinungsbild | Transparenter kristalliner Feststoff | ||
| Geruch | Süß und teerig | ||
| Dichte | 1,07 g/cm3 | ||
| Schmelzpunkt | 40,5 °C (104,9 °F; 313,6 K) | ||
| Siedepunkt | 181,7 °C (359,1 °F; 454,8 K) | ||
Löslichkeit in Wasser
|
8,3 g/100 mL (20 °C) | ||
| log P | 1.48 | ||
| Dampfdruck | 0,4 mmHg (20 °C) | ||
| Azidität (pKa) |
| ||
| Konjugierte Base | Phenoxyd | ||
| UV-vis (λmax) | 270,75 nm | ||
Dipolmoment
|
1.224 D | ||
| Pharmakologie | |||
ATC-Code
|
C05BB05 (WER) D08AE03 (WER), N01BX03 (WER), R02AA19 (WER) | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
  
| ||
Gefahrensätze
|
H301, H311, H314, H331, H341, H373 | ||
Sicherheitshinweise
|
P261, P280, P301+P310, P305+P351+P338, P310 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 79 °C (174 °F; 352 K) | ||
| Explosionsgrenzen | 1.8–8.6% | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (Mittlere Dosis)
|
| ||
LDLo (niedrigste veröffentlichte Dosis)
|
| ||
LC50 (mittlere Konzentration)
|
| ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
TWA 5 ppm (19 mg/m3) [Haut] | ||
REL (Empfohlen)
|
| ||
IDLH (Unmittelbare Gefahr)
|
250 ppm | ||
| Sicherheitsdatenblatt (SDS) | [1] | ||
| Verwandte Verbindungen | |||
Verwandte Verbindungen
|
Thiophenol Natriumphenoxid | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Phenol (auch Karbolsäure genannt) ist eine aromatische organische Verbindung mit der Summenformel C6H5OH. Es handelt sich um einen weißen, kristallinen Feststoff, der flüchtig ist. Das Molekül besteht aus einer Phenylgruppe (-C6H5), die an eine Hydroxygruppe (-OH) gebunden ist. Es ist leicht sauer und erfordert einen vorsichtigen Umgang, da es Verätzungen verursachen kann. ⓘ
Phenol wurde zunächst aus Steinkohlenteer gewonnen, wird aber heute in großem Umfang (etwa 7 Mrd. kg/Jahr) aus Erdölrohstoffen hergestellt. Phenol ist ein wichtiger industrieller Rohstoff, da es ein Vorprodukt für viele Materialien und nützliche Verbindungen ist. Es wird hauptsächlich zur Synthese von Kunststoffen und verwandten Materialien verwendet. Phenol und seine chemischen Derivate sind für die Herstellung von Polycarbonaten, Epoxiden, Bakelit, Nylon, Waschmitteln, Herbiziden wie Phenoxyherbiziden und zahlreichen Arzneimitteln unerlässlich. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phenol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H6O | ||||||||||||||||||
| Kurzbeschreibung |
farblose, hygroskopische, nadelförmige Kristalle mit durchdringendem Geruch | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 94,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,07 g·cm−3 | ||||||||||||||||||
| Schmelzpunkt |
41 °C | ||||||||||||||||||
| Siedepunkt |
182 °C | ||||||||||||||||||
| Dampfdruck |
0,2 hPa (20 °C) | ||||||||||||||||||
| pKS-Wert |
9,99 | ||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (84 g·l−1 bei 20 °C) | ||||||||||||||||||
| Brechungsindex |
1,5408 (41 °C) | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Toxikologische Daten |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Eigenschaften
Phenol ist eine organische Verbindung, die gut in Wasser löslich ist, wobei sich etwa 84,2 g in 1000 mL (0,895 M) auflösen. Homogene Mischungen von Phenol und Wasser mit einem Massenverhältnis von Phenol zu Wasser von ~2,6 und mehr sind möglich. Das Natriumsalz des Phenols, Natriumphenoxid, ist wesentlich besser wasserlöslich. ⓘ

Säuregehalt
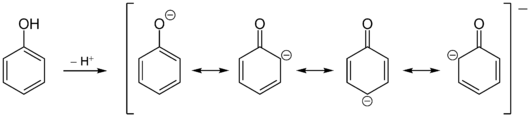
Phenol ist eine schwache Säure. In wässriger Lösung liegt es im pH-Bereich von ca. 8 - 12 mit dem Phenolat-Anion C6H5O- (auch Phenoxid genannt) im Gleichgewicht:
- C6H5OH ⇌ C6H5O- + H+ ⓘ

Phenol ist saurer als aliphatische Alkohole. Der unterschiedliche pKa-Wert wird auf die Resonanzstabilisierung des Phenoxidanions zurückgeführt. Auf diese Weise wird die negative Ladung des Sauerstoffs über das pi-System auf die ortho- und para-Kohlenstoffatome verlagert. Eine alternative Erklärung bezieht das Sigma-System mit ein und postuliert, dass der vorherrschende Effekt die Induktion durch die elektronegativeren sp2-hybridisierten Kohlenstoffe ist; der vergleichsweise stärkere induktive Entzug der Elektronendichte durch das sp2-System im Vergleich zu einem sp3-System ermöglicht eine starke Stabilisierung des Oxyanions. Für die zweite Erklärung spricht, dass der pKa des Enols von Aceton in Wasser 10,9 beträgt und damit nur geringfügig weniger sauer ist als Phenol (pKa 10,0). Die größere Anzahl von Resonanzstrukturen, die dem Phenoxid im Vergleich zum Aceton-Enolat zur Verfügung steht, scheint also nur wenig zu seiner Stabilisierung beizutragen. Die Situation ändert sich jedoch, wenn Solvatationseffekte ausgeschlossen werden. Ein kürzlich durchgeführter In-silico-Vergleich der Gasphasen-Aziditäten der Vinylogue von Phenol und Cyclohexanol in Konformationen, die eine Resonanzstabilisierung zulassen bzw. ausschließen, führt zu der Schlussfolgerung, dass etwa 1⁄3 der erhöhten Azidität von Phenol auf induktive Effekte zurückzuführen ist, während der verbleibende Unterschied auf Resonanz zurückzuführen ist. ⓘ
Wasserstoffbrückenbindung
In Tetrachlorkohlenstoff- und Alkan-Lösungsmitteln geht Phenol Wasserstoffbrückenbindungen mit einem breiten Spektrum von Lewis-Basen wie Pyridin, Diethylether und Diethylsulfid ein. Die Enthalpien der Adduktbildung und die -OH-IR-Frequenzverschiebungen, die die Adduktbildung begleiten, wurden untersucht. Phenol wird als harte Säure eingestuft, was mit dem C/E-Verhältnis des ECW-Modells mit EA = 2,27 und CA = 1,07 vereinbar ist. Die relative Akzeptorstärke von Phenol gegenüber einer Reihe von Basen im Vergleich zu anderen Lewis-Säuren kann durch C-B-Plots veranschaulicht werden. ⓘ
Phenoxid-Anion
Das Phenoxidanion ist ein starkes Nukleophil mit einer Nukleophilie, die mit der von Carbanionen oder tertiären Aminen vergleichbar ist. Es kann sowohl an seinen Sauerstoff- als auch an seinen Kohlenstoffstellen als ambidentes Nukleophil reagieren (siehe HSAB-Theorie). Im Allgemeinen wird der Sauerstoffangriff von Phenoxidanionen kinetisch begünstigt, während der Kohlenstoffangriff thermodynamisch bevorzugt wird (siehe Thermodynamische versus kinetische Reaktionskontrolle). Ein gemischter Sauerstoff-/Kohlenstoffangriff und damit ein Verlust an Selektivität wird in der Regel beobachtet, wenn die Reaktionsgeschwindigkeit die Diffusionskontrolle erreicht. ⓘ
Tautomerie

Phenol weist eine Keto-Enol-Tautomerie mit seinem instabilen Keto-Tautomeren Cyclohexadienon auf, aber nur ein winziger Teil des Phenols liegt in der Keto-Form vor. Die Gleichgewichtskonstante für die Enolisierung beträgt etwa 10-13, was bedeutet, dass nur eines von zehn Billionen Molekülen zu jedem Zeitpunkt in der Ketoform vorliegt. Die geringe Stabilisierung, die durch den Austausch einer C=C-Bindung gegen eine C=O-Bindung erzielt wird, wird durch die große Destabilisierung, die durch den Verlust der Aromatizität entsteht, mehr als ausgeglichen. Phenol liegt daher im Wesentlichen vollständig in der Enolform vor. 4, 4' Substituiertes Cyclohexadienon kann unter sauren Bedingungen eine Dienon-Phenol-Umlagerung erfahren und stabiles 3,4-disubstituiertes Phenol bilden. ⓘ
Phenoxide sind durch Aromatizität stabilisierte Enolate. Unter normalen Umständen ist das Phenoxid an der Sauerstoffposition reaktiver, aber die Sauerstoffposition ist ein "hartes" Nukleophil, während die alpha-Kohlenstoffpositionen eher "weich" sind. ⓘ
Reaktionen


Phenol ist gegenüber der elektrophilen aromatischen Substitution sehr reaktiv. Die verstärkte Nucleophilie ist auf die Spende von pi-Elektronendichte von O in den Ring zurückzuführen. Viele Gruppen können durch Halogenierung, Acylierung, Sulfonierung und ähnliche Verfahren an den Ring gebunden werden. Der Ring von Phenol ist so stark aktiviert, dass Bromierung und Chlorierung leicht zu einer Polysubstitution führen. Phenol reagiert mit verdünnter Salpetersäure bei Raumtemperatur zu einer Mischung aus 2-Nitrophenol und 4-Nitrophenol, während mit konzentrierter Salpetersäure zusätzliche Nitrogruppen eingeführt werden, z. B. zu 2,4,6-Trinitrophenol. ⓘ
Wässrige Lösungen von Phenol sind schwach sauer und färben sich mit blauem Lackmus leicht rot. Phenol wird durch Natriumhydroxid unter Bildung von Natriumphenolat oder Phenolat neutralisiert. Da es jedoch schwächer als Kohlensäure ist, kann es nicht durch Natriumbicarbonat oder Natriumcarbonat neutralisiert werden, wodurch Kohlendioxid freigesetzt wird.
- C6H5OH + NaOH → C6H5ONa + H2O ⓘ
Wenn ein Gemisch aus Phenol und Benzoylchlorid in Gegenwart von verdünnter Natriumhydroxidlösung geschüttelt wird, bildet sich Phenylbenzoat. Dies ist ein Beispiel für die Schotten-Baumann-Reaktion:
- C6H5COCl + HOC6H5 → C6H5CO2C6H5 + HCl ⓘ
Phenol wird zu Benzol reduziert, wenn es mit Zinkstaub destilliert wird oder wenn sein Dampf bei 400 °C über Zinkgranulat geleitet wird:
- C6H5OH + Zn → C6H6 + ZnO ⓘ
Bei der Behandlung von Phenol mit Diazomethan in Gegenwart von Bortrifluorid (BF3) erhält man Anisol als Hauptprodukt und Stickstoffgas als Nebenprodukt.
- C6H5OH + CH2N2 → C6H5OCH3 + N2 ⓘ
Bei der Reaktion von Phenol mit Eisen(III)-chloridlösung entsteht eine intensiv violett-purpurne Lösung. ⓘ
Chemische Eigenschaften
Die Hydroxygruppe des Phenols reagiert im Vergleich zu Alkoholen stärker sauer; daher ist Phenol eine schwache organische Säure. Die Ursache ist die Mesomeriestabilisierung der korrespondierenden Base des Phenolations. Die negative Ladung kann in den Ring delokalisiert werden. ⓘ
Im Gegensatz zu Alkoholen gehen Phenole nur bei hohen Temperaturen und Anwesenheit spezieller Katalysatoren nukleophile Substitutionsreaktionen unter Ersatz der Hydroxygruppe durch andere Nukleophile ein. Die Hydroxy-Funktion zeigt, besonders im deprotonierten Zustand, einen ausgeprägten +M-Effekt. Daneben zeigt sie einen −I-Effekt. Da dieser aber deutlich kleiner ist als der +M-Effekt, wird Phenol sehr leicht elektrophil angegriffen. Der Angriff erfolgt bevorzugt in ortho- und para-Position zur Hydroxygruppe. Wegen des elektronenschiebenden Charakters der Hydroxygruppe ist Phenol etwa tausendmal reaktiver als Benzol. Die Bevorzugung des ortho- bzw. para-Angriffs von Elektrophilen lässt sich einerseits durch Betrachtung der Grenzstrukturen des Phenolat-Anions verstehen. Die negative Ladung wird in den aromatischen Ring auf die ortho- und para-Positionen delokalisiert. Da Elektrophile bevorzugt elektronenreiche Positionen angreifen, kommt es zu der beobachteten Regioselektivität. Andererseits ist der bei der Substitution als Zwischenstufe entstehende σ-Komplex (Carbeniumion) in ortho- und para-Position mesomeriestabilisierter als in meta-Position, da mehr energiearme Grenzstrukturen möglich sind und die Delokalisierung der Elektronen somit ausgeprägter ist. Die Substitution in para-Position ist zusätzlich bevorzugt, da es dort nicht zu sterischen Wechselwirkungen des angreifenden Elektrophils mit den freien Elektronenpaaren des Sauerstoffs kommt. ⓘ
Die Keto-Enol-Tautomerie liegt wegen der Ausbildung des thermodynamisch günstigen aromatischen Systems vollständig auf der Enol-Seite. ⓘ
Eine technisch bedeutende nukleophile Substitutionsreaktion ist die Darstellung von Anilin aus Phenol bei 250 °C und Anwesenheit eines Oxid-Katalysators (Aluminium-, Silicium- oder Magnesiumoxid, auch Borsäure) als „Halcon-Prozess“. ⓘ
Phenol setzt sich durch katalytische Hydrierung zu Cyclohexanol um. ⓘ
Herstellung
Aufgrund der kommerziellen Bedeutung von Phenol wurden viele Verfahren zu seiner Herstellung entwickelt, wobei das Cumol-Verfahren die vorherrschende Technologie ist. ⓘ
Cumol-Verfahren
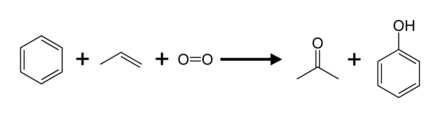
95 % der Produktion (2003) entfallen auf das Cumol-Verfahren, auch Hock-Verfahren genannt. Dabei handelt es sich um die partielle Oxidation von Cumol (Isopropylbenzol) über die Hock-Umlagerung: Im Vergleich zu den meisten anderen Verfahren arbeitet das Cumol-Verfahren unter relativ milden Bedingungen und mit relativ preiswerten Rohstoffen. Damit das Verfahren wirtschaftlich ist, müssen sowohl Phenol als auch das Nebenprodukt Aceton gefragt sein. Im Jahr 2010 lag die weltweite Nachfrage nach Aceton bei rund 6,7 Millionen Tonnen, wovon 83 Prozent mit Aceton aus dem Cumol-Verfahren gedeckt wurden. ⓘ
Ein zum Cumolverfahren analoger Weg beginnt mit Cyclohexylbenzol. Es wird zu einem Hydroperoxid oxidiert, ähnlich wie bei der Herstellung von Cumolhydroperoxid. Über die Hock-Umlagerung spaltet sich das Cyclohexylbenzolhydroperoxid zu Phenol und Cyclohexanon. Cyclohexanon ist ein wichtiges Vorprodukt für einige Nylone. ⓘ
Oxidation von Benzol und Toluol
Die direkte Oxidation von Benzol zu Phenol ist theoretisch möglich und von großem Interesse, wurde aber noch nicht kommerziell genutzt:
- C6H6 + O → C6H5OH
Distickstoffoxid ist ein potenziell "grünes" Oxidationsmittel, das ein stärkeres Oxidationsmittel als O2 ist. Die Wege zur Erzeugung von Distickstoffmonoxid sind jedoch nicht konkurrenzfähig. ⓘ
Bei einer Elektrosynthese mit Wechselstrom wird Phenol aus Benzol gewonnen. ⓘ
Die von Dow Chemical entwickelte Oxidation von Toluol beinhaltet eine kupferkatalysierte Reaktion von geschmolzenem Natriumbenzoat mit Luft:
- C6H5CH3 + 2 O2 → C6H5OH + CO2 + H2O
Es wird vorgeschlagen, dass die Reaktion über die Bildung von Benzyoylsalicylat verläuft. ⓘ
Ältere Methoden
Frühe Methoden beruhten auf der Extraktion von Phenol aus Kohlenderivaten oder der Hydrolyse von Benzolderivaten. ⓘ
Hydrolyse von Benzolsulfonsäure
Eine frühe kommerzielle Methode, die von Bayer und Monsanto in den frühen 1900er Jahren entwickelt wurde, beginnt mit der Reaktion einer starken Base mit Benzolsulfonsäure. Die Umwandlung wird durch diese idealisierte Gleichung dargestellt:
- C6H5SO3H + 2 NaOH → C6H5OH + Na2SO3 + H2O ⓘ
Hydrolyse von Chlorbenzol
Chlorbenzol kann mit Hilfe von Basen (Dow-Verfahren) oder Dampf (Raschig-Hooker-Verfahren) zu Phenol hydrolysiert werden:
- C6H5Cl + NaOH → C6H5OH + NaCl
- C6H5Cl + H2O → C6H5OH + HCl
Diese Methoden leiden unter den Kosten für das Chlorbenzol und der Notwendigkeit, das Chlorid-Nebenprodukt zu entsorgen. ⓘ
Pyrolyse von Kohle
Phenol ist ebenfalls ein verwertbares Nebenprodukt der Kohlepyrolyse. Beim Lummus-Verfahren wird die Oxidation von Toluol zu Benzoesäure separat durchgeführt. ⓘ
Verschiedene Methoden
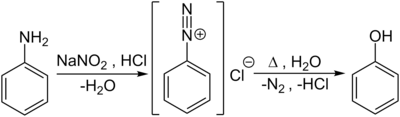
Phenyldiazoniumsalze hydrolysieren zu Phenol. Die Methode ist kommerziell uninteressant, da das Ausgangsmaterial teuer ist.
Salicylsäure decarboxyliert zu Phenol. ⓘ
Verwendungen

Phenol wird hauptsächlich als Ausgangsstoff zur Herstellung von Kunststoffen verwendet. Dabei spielt die Herstellung von Phenoplasten die wichtigste Rolle. Phenol wird auch zu Caprolactam umgesetzt, einem Stoff zur Herstellung von Polyamiden. Die Umsetzung zu Bisphenol A liefert einen wichtigen Ausgangsstoff zur Herstellung von Epoxidharzen. ⓘ
Aus Phenol wird das Arzneimittel Acetylsalicylsäure hergestellt. In der Mikroskopie wird Phenol zur Konservierung und zur Gram-Färbung verwendet. ⓘ
Früher wurde eine Lösung von 22 Promille Phenol pro Liter Wasser als Desinfektionsmittel eingesetzt, sogenanntes Karbolwasser oder Karbollösung. Wegen der Giftigkeit und auftretenden Hautirritationen wurde Karbolwasser bald nach der Entdeckung anderer Desinfektionsmittel nicht mehr verwendet. Von dieser Verwendung leitet sich die Bezeichnung von (jungen) Krankenschwestern als Karbolmäuschen ab. ⓘ
Die wichtigsten Verwendungszwecke von Phenol, auf die zwei Drittel der Produktion entfallen, sind die Umwandlung in Vorprodukte für Kunststoffe. Durch Kondensation mit Aceton entsteht Bisphenol-A, ein wichtiges Vorprodukt für Polycarbonate und Epoxidharze. Durch Kondensation von Phenol, Alkylphenolen oder Diphenolen mit Formaldehyd entstehen Phenolharze, ein berühmtes Beispiel dafür ist Bakelit. Durch partielle Hydrierung von Phenol entsteht Cyclohexanon, ein Vorprodukt von Nylon. Nichtionische Detergenzien werden durch Alkylierung von Phenol zu Alkylphenolen, z. B. Nonylphenol, hergestellt, die dann einer Ethoxylierung unterzogen werden. ⓘ
Phenol ist auch ein vielseitiger Ausgangsstoff für eine Vielzahl von Arzneimitteln, vor allem für Aspirin, aber auch für viele Herbizide und pharmazeutische Wirkstoffe. ⓘ
Phenol ist ein Bestandteil der Flüssig-Flüssig-Phenol-Chloroform-Extraktionstechnik, die in der Molekularbiologie zur Gewinnung von Nukleinsäuren aus Gewebe- oder Zellkulturproben verwendet wird. Je nach dem pH-Wert der Lösung kann entweder DNA oder RNA extrahiert werden. ⓘ
Medizinische
Phenol wird häufig als Antiseptikum verwendet. Seine Verwendung wurde von Joseph Lister begründet (siehe Abschnitt Geschichte). ⓘ
Von den frühen 1900er bis in die 1970er Jahre wurde es zur Herstellung von Karbolseife verwendet. Konzentrierte Phenolflüssigkeiten werden häufig zur dauerhaften Behandlung eingewachsener Zehen- und Fingernägel verwendet, ein Verfahren, das als chemische Matrixektomie bekannt ist. Das Verfahren wurde erstmals von Otto Boll im Jahr 1945 beschrieben. Seitdem ist es die bevorzugte Chemikalie für chemische Matrixektomien, die von Podologen durchgeführt werden. ⓘ
Konzentriertes flüssiges Phenol kann topisch als Lokalanästhetikum bei otologischen Eingriffen wie der Myringotomie und dem Legen von Paukenröhrchen als Alternative zur Vollnarkose oder anderen Lokalanästhetika verwendet werden. Es hat auch hämostatische und antiseptische Eigenschaften, die es ideal für diese Anwendung machen. ⓘ
Phenolspray, in der Regel mit 1,4 % Phenol als Wirkstoff, wird medizinisch zur Behandlung von Halsentzündungen eingesetzt. Es ist der Wirkstoff in einigen oralen Analgetika wie Chloraseptic Spray, TCP und Carmex. ⓘ
Nischenanwendungen
Phenol ist so preiswert, dass es viele kleine Verwendungszwecke anlockt. Es ist Bestandteil von industriellen Abbeizmitteln, die in der Luftfahrtindustrie zur Entfernung von Epoxid-, Polyurethan- und anderen chemisch resistenten Beschichtungen verwendet werden. ⓘ
Phenolderivate wurden bei der Herstellung von Kosmetika wie Sonnenschutzmitteln, Haarfärbemitteln und Hautaufhellungsmitteln verwendet. Aufgrund von Sicherheitsbedenken ist die Verwendung von Phenol in kosmetischen Produkten in der Europäischen Union und in Kanada jedoch verboten. ⓘ
Geschichte
Phenol wurde 1834 von Friedlieb Ferdinand Runge entdeckt, der es (in unreiner Form) aus Steinkohlenteer extrahierte. Runge nannte Phenol "Karbolsäure" (Kohleölsäure). Steinkohlenteer blieb bis zur Entwicklung der petrochemischen Industrie die wichtigste Quelle. Im Jahr 1841 gewann der französische Chemiker Auguste Laurent Phenol in reiner Form. ⓘ
1836 prägte Auguste Laurent den Namen "phène" für Benzol; dies ist die Wurzel des Wortes "Phenol" und "Phenyl". Im Jahr 1843 prägte der französische Chemiker Charles Gerhardt den Namen "phénol". ⓘ
Die antiseptischen Eigenschaften von Phenol wurden von Sir Joseph Lister (1827-1912) in seiner bahnbrechenden Technik der antiseptischen Chirurgie genutzt. Lister entschied, dass die Wunden selbst gründlich gereinigt werden mussten. Anschließend bedeckte er die Wunden mit einem Stück Lappen oder Fussel, der mit Phenol oder Karbolsäure, wie er es nannte, getränkt war. Die durch den ständigen Kontakt mit Phenol verursachte Hautreizung führte schließlich zur Einführung aseptischer (keimfreier) Techniken in der Chirurgie. ⓘ
Joseph Lister war Student am University College London unter Robert Liston und stieg später zum Chirurgen am Glasgow Royal Infirmary auf. Lister experimentierte mit Tüchern, die mit Karbolsäure überzogen waren, nachdem er die Arbeiten und Experimente seines Zeitgenossen Louis Pasteur zur Sterilisierung verschiedener biologischer Medien studiert hatte. Lister wurde inspiriert, einen Weg zu finden, lebende Wunden zu sterilisieren, was mit der für Pasteurs Experimente erforderlichen Hitze nicht möglich war. Bei der Untersuchung von Pasteurs Forschungen begann Lister, seine Theorie zu formulieren: dass die Patienten durch Keime getötet wurden. Er stellte die Theorie auf, dass es zu keiner Infektion kommen würde, wenn die Keime abgetötet oder verhindert werden könnten. Lister kam zu dem Schluss, dass man die Mikroorganismen, die eine Infektion verursachen, mit einer Chemikalie zerstören könnte. ⓘ
In der Zwischenzeit experimentierten Beamte in Carlisle, England, mit einer Abwasserbehandlung, bei der Karbolsäure verwendet wurde, um den Geruch von Abwasserbecken zu reduzieren. Da Lister von diesen Entwicklungen gehört hatte und zuvor selbst mit anderen Chemikalien zu antiseptischen Zwecken experimentiert hatte, ohne viel Erfolg zu haben, beschloss er, Karbolsäure als Wundantiseptikum zu testen. Seine erste Chance hatte er am 12. August 1865, als er einen Patienten erhielt: einen elfjährigen Jungen mit einem Schienbeinbruch, der die Haut seines Unterschenkels durchbohrt hatte. Normalerweise wäre eine Amputation die einzige Lösung gewesen. Lister entschied sich jedoch für einen Versuch mit Karbolsäure. Nachdem er den Knochen gerichtet und das Bein mit Schienen gestützt hatte, tränkte Lister saubere Baumwolltücher in unverdünnter Karbolsäure und legte sie auf die Wunde, die er mit einer Lage Zinnfolie abdeckte, und ließ sie vier Tage lang liegen. Als er die Wunde überprüfte, war Lister angenehm überrascht, dass er keine Anzeichen einer Infektion fand, sondern nur eine Rötung in der Nähe der Wundränder, die auf eine leichte Verbrennung durch die Karbolsäure zurückzuführen war. Nachdem er frische Verbände mit verdünnter Karbolsäure angelegt hatte, konnte der Junge nach etwa sechs Wochen Behandlung wieder nach Hause gehen. ⓘ
Bis zum 16. März 1867, als die ersten Ergebnisse von Listers Arbeit in der Zeitschrift Lancet veröffentlicht wurden, hatte er insgesamt elf Patienten mit seiner neuen antiseptischen Methode behandelt. Davon war nur einer gestorben, und zwar an einer Komplikation, die nichts mit Listers Wundbehandlungsmethode zu tun hatte. Nun war es zum ersten Mal möglich, dass Patienten mit komplizierten Brüchen das Krankenhaus mit intakten Gliedmaßen verlassen konnten.
- - Richard Hollingham, Blut und Gedärme: Eine Geschichte der Chirurgie, S. 62 ⓘ
Bevor antiseptische Operationen im Krankenhaus eingeführt wurden, gab es sechzehn Todesfälle bei fünfunddreißig chirurgischen Fällen. Fast jeder zweite Patient starb. Nach der Einführung der antiseptischen Chirurgie im Sommer 1865 gab es nur noch sechs Todesfälle in vierzig Fällen. Die Sterblichkeitsrate war von fast 50 Prozent auf etwa 15 Prozent gesunken. Eine bemerkenswerte Leistung
- - Richard Hollingham, Blut und Gedärme: Eine Geschichte der Chirurgie, S. 63 ⓘ
Phenol war der Hauptbestandteil des Carbolic Smoke Ball, eines unwirksamen Mittels, das im 19. Jahrhundert in London als Schutz gegen Grippe und andere Krankheiten vermarktet wurde und Gegenstand des berühmten Rechtsstreits Carlill v Carbolic Smoke Ball Company war. ⓘ
Zweiter Weltkrieg
Die weiter unten beschriebene toxische Wirkung von Phenol auf das zentrale Nervensystem führt sowohl bei Menschen als auch bei Tieren zu einem plötzlichen Zusammenbruch und Bewusstseinsverlust; aufgrund der vom zentralen Nervensystem gesteuerten motorischen Aktivität geht diesen Symptomen ein Zustand der Verkrampfung voraus. Die Injektion von Phenol wurde während des Zweiten Weltkriegs von den Nationalsozialisten als Mittel zur Hinrichtung einzelner Personen eingesetzt. Ursprünglich wurde es von den Nazis 1939 im Rahmen des Euthanasieprogramms Aktion T4 eingesetzt. Die Deutschen lernten, dass die Vernichtung kleinerer Gruppen durch die Injektion von Phenol in jedes einzelne Opfer wirtschaftlicher war. Tausende von Menschen erhielten Phenol-Injektionen. Auch Maximilian Kolbe wurde mit einer Phenol-Injektion getötet, nachdem er zwei Wochen der Dehydrierung und des Hungers in Auschwitz überlebt hatte, als er sich freiwillig bereit erklärte, anstelle eines Fremden zu sterben. Ungefähr ein Gramm reicht aus, um den Tod herbeizuführen. ⓘ
Vorkommen
Phenol ist ein normales Stoffwechselprodukt, das in Mengen von bis zu 40 mg/l im menschlichen Urin ausgeschieden wird. ⓘ
Im Schläfendrüsensekret männlicher Elefanten wurden während der Musth Phenol und 4-Methylphenol nachgewiesen. ⓘ
Es ist auch eine der chemischen Verbindungen, die im Castoreum gefunden werden. Diese Verbindung wird mit den Pflanzen aufgenommen, die der Biber frisst. ⓘ
Vorkommen in Whisky
Phenol ist ein messbarer Bestandteil des Aromas und des Geschmacks des charakteristischen Islay Scotch Whisky, im Allgemeinen ~30 ppm, kann aber in der gemälzten Gerste, die zur Herstellung von Whisky verwendet wird, über 160 ppm betragen. Diese Menge unterscheidet sich von der Menge im Destillat und ist vermutlich höher als diese. ⓘ
Biologischer Abbau
Cryptanaerobacter phenolicus ist eine Bakterienart, die Benzoat aus Phenol über 4-Hydroxybenzoat produziert. Rhodococcus phenolicus ist eine Bakterienart, die Phenol als einzige Kohlenstoffquelle abbauen kann. ⓘ
Sicherheitshinweise
Phenol wirkt sowohl lokal als auch systemisch stark toxisch; bei dermaler Exposition besitzt es eine reizende bis ätzende Wirkung auf Schleimhäute, Haut und Augen. Die Augen können Schäden in Form einer Trübung der Hornhaut, Schwellungen und Verwachsung der Lider bis zur Erblindung erleiden. Hautkontakt führt zuerst zu Hautrötung, später zu einer Weißverfärbung; längere Einwirkungszeit verursacht eine Dunkelfärbung bis zur Bildung von Nekrosen. ⓘ
Phenol wird vorwiegend über die Haut resorbiert, aber auch inhalative oder orale Aufnahme ist möglich. Im menschlichen Organismus schädigt die Substanz akut Nieren, Blut, Zentralnerven- und Herz-Kreislauf-System. Bei chronischer Exposition sind auch gastrointestinale und nervale Störungen, weiterhin Schädigung von Leber, Nieren und Hautveränderungen bekannt. Bei Inhalation wurden als Vergiftungssymptome Schwindel, Kopfschmerz und Störungen der Ohren, Erbrechen, Schlaflosigkeit und Nierenreizung beschrieben. Die Aufnahme hoher Mengen führte innerhalb weniger Stunden zu massiven Nierenfunktionsstörungen bis zu akutem Nierenversagen. Orale Aufnahme bewirkt Verätzungen im Mund, Rachen, Speiseröhre und Magen; weiterhin sind Schluckstörungen und Störungen im Magen-Darm-Trakt bekannt. ⓘ
Die Toxizität wird auf reaktive Metaboliten des Phenol zurückgeführt, die an die DNA und andere Makromoleküle binden und dabei Brüche in den Chromosomen und mutagene Effekte auslösen können. Eine orale Dosis ab 1 g kann vereinzelt für einen Menschen tödlich sein; individuell wurden aber auch wesentlich höhere Dosen überlebt. Der orale LDLo-Wert für den Menschen liegt zwischen 140 und 1400 mg/kg Körpergewicht; bei Kindern beträgt die orale minimale letale Dosis 10 mg/kg Körpergewicht. ⓘ
Phenol wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Phenol waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und anderer gefahrenbezogener Bedenken sowie der möglichen Gefahr durch mutagene Eigenschaften. Die Neubewertung fand ab 2015 statt und wurde von Dänemark durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht. ⓘ
Verätzungen der Haut können durch Waschen mit Polyethylenglykol, Isopropylalkohol oder vielleicht sogar mit reichlich Wasser dekontaminiert werden. Die kontaminierte Kleidung muss ausgezogen werden, und bei größeren Spritzern ist eine sofortige Behandlung im Krankenhaus erforderlich. Dies ist besonders wichtig, wenn das Phenol mit Chloroform gemischt ist (ein in der Molekularbiologie häufig verwendetes Gemisch zur Reinigung von DNA und RNA). Phenol ist auch ein Reproduktionstoxin, das ein erhöhtes Risiko für Fehlgeburten und ein niedriges Geburtsgewicht verursacht, was auf eine verzögerte Entwicklung im Mutterleib hinweist. ⓘ
Phenole
Der Begriff Phenol wird auch für alle Verbindungen verwendet, die einen sechsgliedrigen aromatischen Ring enthalten, der direkt an eine Hydroxylgruppe (-OH) gebunden ist. Phenole sind also eine Klasse von organischen Verbindungen, von denen das in diesem Artikel behandelte Phenol das einfachste Mitglied ist. ⓘ
Nomenklatur
Der systematische IUPAC-Name lautet Benzenol. Die heutzutage bevorzugte IUPAC-Bezeichnung ist jedoch Phenol. ⓘ
Gewinnung und Darstellung
Phenole sind nicht durch elektrophile aromatische Substitution darzustellen, da ein entsprechendes Sauerstoff-Elektrophil nicht zugänglich ist. ⓘ
Herstellung aus nachwachsenden Rohstoffen
Seit längerer Zeit wird an Möglichkeiten geforscht, Phenol aus nachwachsenden Rohstoffen und insbesondere aus Lignin herzustellen. Dazu eignen sich verschiedene Pyrolysevarianten mit anschließender Produktaufbereitung. Allerdings wird aktuell geschätzt, dass erst in den 2040er Jahre eine solche Phenolproduktion kommerzialisiert wird. ⓘ
Herstellung im Labor
Im Labormaßstab werden Phenole auch durch Verkochen von Diazoniumsalzen, welche durch die Diazotierung von aromatischen Aminoverbindungen – hier von Anilin – mit Salpetriger Säure in der Kälte entstehen, hergestellt:
Eine weitere Darstellungsmöglichkeit besteht im Zusammenschmelzen des Natriumsalzes der Benzolsulfonsäure mit Alkalihydroxid in einer nucleophilen aromatischen Substitution nach Additions-Eliminierungs-Mechanismus (ipso-Substitution):
Im Sinne einer radikalischen Substitution kann Benzol in der Fenton-Reaktion zu Phenol umgesetzt werden. Die Baeyer-Villiger-Oxidation von Acetophenon liefert Essigsäurephenylester, welches nach Verseifung Phenol freisetzt. ⓘ
Historische Beschreibung
„Karbolsäure (Steinkohlenteerkreosot, acidum phenylicum, acidum carbolicum). Eine Substanz, die für die Farbenindustrie und Medizin (als Desinfektionsmittel) eine außerordentliche Bedeutung erlangt hat. Der Handelsname ist immer noch Karbolsäure, während der wissenschaftliche Name jetzt Phenol ist; diese Substanz besitzt zwar die Eigenschaften einer schwachen Säure und ist imstande, sich mit Basen zu verbinden, wird deshalb auch Phenylsäure oder Phensäure genannt, zugleich aber und in noch höherem Grade spielt sie die Rolle eines Alkohols, daher auch der Name Phenylalkohol, den man in Phenol gekürzt hat. Man gewinnt die Karbolsäure hauptsächlich aus dem Steinkohlenteer und dem Braunkohlenteer, im Holzteer sind nur äußerst geringe Mengen davon enthalten, denn das Kreosot des Holzteers besteht nicht, wie man eine Zeit lang glaubte, aus Phenol, sondern aus dem strukturell ähnlichen Kresol, sowie noch einigen anderen Stoffen. Um die Karbolsäure zu gewinnen, behandelt man den zwischen 150 und 200 °C übergehenden Teil des Teers mit Natronlauge, welche sich mit der Karbolsäure und dem Kresol, das auch im Steinkohlenteer enthalten ist, verbindet, trennt diese Lösung von den übrigen Teerbestandteilen und zersetzt sie mit einer Säure. Man destilliert dann das abgeschiedene ölige Produkt und fängt das, was über 190 °C übergeht, besonders auf; letzteres wird als rohes Kresol, das, was unter 190 °C übergeht, als rohe Karbolsäure verkauft. Beide Substanzen sind in diesem Zustande noch braune, sehr übel riechende, ölige Flüssigkeiten. Diese rohe Karbolsäure (acidum carbolicum crudum) wird teils weiter gereinigt, teils wird sie zur Konservierung von Holz und zum Desinfizieren von Abtrittgruben verwendet.“









![{\displaystyle \mathrm {C_{6}H_{5}OH\ +\ NH_{3}\ {\xrightarrow[{Kat.}]{250^{\circ }C}}\ C_{6}H_{5}NH_{2}\ +\ H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee2fee96963f62879e3117c093e3eb5dca2a51fe)