Chloroform
|
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugte IUPAC-Bezeichnung
Trichlormethan | |||
| Andere Bezeichnungen
Chloroform
Methantrichlorid Methyltrichlorid Methenyltrichlorid Methenylchlorid TCM Freon 20 Kältemittel-20 R-20 UN 1888 | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
CHCl3 | ||
| Molekulare Masse | 119,37 g-mol-1 | ||
| Erscheinungsbild | Farblose Flüssigkeit | ||
| Geruch | Irreführend angenehmer, ätherischer Geruch, der zu olfaktorischer Ermüdung führt | ||
| Dichte | 1,564 g/cm3 (-20 °C) 1,489 g/cm3 (25 °C) 1,394 g/cm3 (60 °C) | ||
| Schmelzpunkt | -63,5 °C (-82,3 °F; 209,7 K) | ||
| Siedepunkt | 61,15 °C (142,07 °F; 334,30 K) zersetzt sich bei 450 °C | ||
Löslichkeit in Wasser
|
10,62 g/L (0 °C) 8,09 g/L (20 °C) 7,32 g/L (60 °C) | ||
| Löslichkeit | Löslich in Benzol Mischbar in Diethylether, Ölen, Ligroin, Alkohol, CCl4, CS2 | ||
| Löslichkeit in Aceton | ≥ 100 g/L (19 °C) | ||
| Löslichkeit in Dimethylsulfoxid | ≥ 100 g/L (19 °C) | ||
| Dampfdruck | 0,62 kPa (-40 °C) 7,89 kPa (0 °C) 25,9 kPa (25 °C) 313 kPa (100 °C) 2,26 MPa (200 °C) | ||
Henry'sches Gesetz
Konstante (kH) |
3,67 L-atm/mol (24 °C) | ||
| Säuregehalt (pKa) | 15.7 (20 °C) | ||
| UV-vis (λmax) | 250 nm, 260 nm, 280 nm | ||
Magnetische Suszeptibilität (χ)
|
-59,30-10-6 cm3/mol | ||
| Thermische Leitfähigkeit | 0,13 W/m-K (20 °C) | ||
Brechungsindex (nD)
|
1.4459 (20 °C) | ||
| Viskosität | 0,563 cP (20 °C) | ||
| Struktur | |||
Molekulare Form
|
Tetraedrisch | ||
Dipolmoment
|
1.15 D | ||
| Thermochemie | |||
Wärmekapazität (C)
|
114,25 J/mol-K | ||
Std. molare
Entropie (S |
202,9 J/mol-K | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-134,3 kJ/mol | ||
Gibbssche freie Energie (ΔfG˚)
|
-71,1 kJ/mol | ||
Std. Bildungsenthalpie
Verbrennung (ΔcH⦵298) |
473,21 kJ/mol | ||
| Pharmakologie | |||
ATC-Code
|
N01AB02 (WHO) | ||
| Gefahren | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Hauptgefahren
|
Karzinogen - Reproduktionstoxizität - Spezifische Zielorgan-Toxizität (STOT) | ||
| GHS-Kennzeichnung: | |||
Piktogramme
|
 
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H302, H315, H319, H331, H336, H351, H361d, H372 | ||
Sicherheitshinweise
|
P201, P202, P235, P260, P264, P270, P271, P280, P281, P301+P330+P331, P302+P352, P304+P340, P305+P351+P338, P308+P313, P310, P311, P314, P332+P313, P337+P313, P362, P403+P233, P405, P501 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | Nicht brennbar | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (Mittlere Dosis)
|
704 mg/kg (Maus, dermal) | ||
LC50 (mittlere Konzentration)
|
9.617 ppm (Ratte, 4 Std.) | ||
LCLo (niedrigste veröffentlichte)
|
20.000 ppm (Meerschweinchen, 2 Std.) 7.056 ppm (Katze, 4 Std.) 25.000 ppm (Mensch, 5 min) | ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
50 ppm (240 mg/m3) | ||
REL (Empfohlen)
|
Ca ST 2 ppm (9,78 mg/m3) [60-minütig] | ||
IDLH (Unmittelbare Gefahr)
|
500 ppm | ||
| Sicherheitsdatenblatt (SDS) | [1] | ||
Sofern nicht anders angegeben, gelten die Daten für Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Chloroform, auch Trichlormethan genannt, ist eine organische Verbindung mit der Formel CHCl3. Es handelt sich um eine farblose, stark riechende, dichte Flüssigkeit, die in großem Maßstab als Vorprodukt für PTFE hergestellt wird. Es ist auch ein Vorprodukt für verschiedene Kältemittel. Es ist eines der vier Chlormethane und ein Trihalogenmethan. Es ist ein starkes Anästhetikum, Euphorisierungsmittel, Anxiolytikum und Sedativum, wenn es inhaliert oder eingenommen wird. ⓘ
Chloroform (systematische Bezeichnung Trichlormethan) ist ein chlorierter Kohlenwasserstoff mit der Summenformel CHCl3. ⓘ
Struktur
Das Molekül hat eine tetraedrische Molekülgeometrie mit C3v-Symmetrie. ⓘ
Natürliches Vorkommen
Der weltweite Gesamtfluss von Chloroform durch die Umwelt beträgt etwa 660000 Tonnen pro Jahr, und etwa 90 % der Emissionen sind natürlichen Ursprungs. Viele Algenarten produzieren Chloroform, und es wird angenommen, dass Pilze im Boden Chloroform produzieren. Es wird auch angenommen, dass abiotische Prozesse zur natürlichen Chloroformproduktion in Böden beitragen, obwohl der Mechanismus noch unklar ist. ⓘ
Chloroform verflüchtigt sich leicht aus dem Boden und Oberflächenwasser und wird in der Luft zu Phosgen, Dichlormethan, Formylchlorid, Kohlenmonoxid, Kohlendioxid und Chlorwasserstoff abgebaut. Seine Halbwertszeit in der Luft liegt zwischen 55 und 620 Tagen. Die biologische Zersetzung in Wasser und Boden ist langsam. Chloroform akkumuliert in Wasserorganismen nicht signifikant. ⓘ
Geschichte
Chloroform wurde um 1831 von mehreren Forschern unabhängig voneinander synthetisiert:
- Moldenhawer, ein deutscher Apotheker aus Frankfurt an der Oder, scheint Chloroform 1830 durch Mischen von Chlorkalk mit Ethanol hergestellt zu haben; er verwechselte es jedoch mit Chloräther (1,2-Dichlorethan).
- Samuel Guthrie, ein US-amerikanischer Arzt aus Sackets Harbor, New York, scheint 1831 ebenfalls Chloroform hergestellt zu haben, indem er Chlorkalk mit Ethanol umsetzte und dessen narkotisierende Eigenschaften feststellte; er glaubte jedoch auch, Chloräther hergestellt zu haben.
- Justus von Liebig führte die alkalische Spaltung von Chloral durch.
- Eugène Soubeiran gewann die Verbindung durch die Einwirkung von Chlorbleiche auf Ethanol und Aceton.
- Im Jahr 1834 bestimmte der französische Chemiker Jean-Baptiste Dumas die empirische Formel von Chloroform und gab ihm einen Namen. Im Jahr 1835 stellte Dumas die Substanz durch alkalische Spaltung von Trichloressigsäure her. Regnault stellte Chloroform durch Chlorierung von Chlormethan her.
- 1842 entdeckte Robert Mortimer Glover in London die betäubenden Eigenschaften von Chloroform bei Versuchstieren.
- 1847 wies der schottische Geburtshelfer James Y. Simpson als erster die betäubende Wirkung von Chloroform am Menschen nach, das von dem örtlichen Apotheker William Flockhart von Duncan, Flockhart and Company zur Verfügung gestellt wurde, und trug dazu bei, die Droge für den Einsatz in der Medizin zu popularisieren. In den 1850er Jahren wurde Chloroform auf kommerzieller Basis hergestellt, in Großbritannien bis 1895 etwa 750.000 Dosen pro Woche, und zwar nach dem Liebig-Verfahren, das seine Bedeutung bis in die 1960er Jahre behielt. Heute wird Chloroform - ebenso wie Dichlormethan - ausschließlich und in großem Umfang durch die Chlorierung von Methan und Chlormethan hergestellt. ⓘ
Herstellung
Industriell wird Chloroform durch Erhitzen von Chlor mit Methan oder Chlormethan auf 400–500 °C erzeugt. Bei dieser Temperatur wird schrittweise radikalisch substituiert bis hin zum Tetrachlormethan:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{CH4 + Cl2 -> CH3Cl + HCl <span title="Aus: Deutsche Wikipedia, Abschnitt "Herstellung"" class="plainlinks">[https://de.wikipedia.org/wiki/Chloroform#Herstellung <span style="color:#dddddd">ⓘ</span>]</span>}}
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{CH3Cl + Cl2 -> CH2Cl2 + HCl <span title="Aus: Deutsche Wikipedia, Abschnitt "Herstellung"" class="plainlinks">[https://de.wikipedia.org/wiki/Chloroform#Herstellung <span style="color:#dddddd">ⓘ</span>]</span>}}
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{CH2Cl2 + Cl2 -> CHCl3 + HCl <span title="Aus: Deutsche Wikipedia, Abschnitt "Herstellung"" class="plainlinks">[https://de.wikipedia.org/wiki/Chloroform#Herstellung <span style="color:#dddddd">ⓘ</span>]</span>}}
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{CHCl3 + Cl2 -> CCl4 + HCl <span title="Aus: Deutsche Wikipedia, Abschnitt "Herstellung"" class="plainlinks">[https://de.wikipedia.org/wiki/Chloroform#Herstellung <span style="color:#dddddd">ⓘ</span>]</span>}}
Dabei reagiert Methan mit Chlor unter Bildung von Chlorwasserstoff zunächst zu Chlormethan, dann weiter zu Dichlormethan, Trichlormethan und schließlich zu Tetrachlormethan. Das Ergebnis des Prozesses ist eine Mischung der vier Chlormethane, welche durch Destillation getrennt werden können. Industriell hergestelltes Chloroform technischer Reinheit enthält zudem Brom- und Ethanderivate (z. B. Bromchlormethan, Bromdichlormethan, 1,2-Dichlorethan) als Verunreinigung sowie Ethanol (< 1 %) oder Pentene (< 0,1 %), die als Stabilisator künstlich zugefügt werden, um das beim Lagern an Luft und Licht entstehende Phosgen abzufangen. ⓘ
Alternativ kann Chloroform durch Photochlorierung von Methan erhalten werden. Im Labor kann Chloroform durch die Reaktion von Natriumhypochlorit mit Aceton, eine Haloform-Reaktion, dargestellt werden. ⓘ
Deuterochloroform
Deuteriertes Chloroform ist ein Isotopolog des Chloroforms mit einem einzigen Deuteriumatom. CDCl3 ist ein in der NMR-Spektroskopie häufig verwendetes Lösungsmittel. Deuterochloroform wird durch die Haloform-Reaktion hergestellt, die Reaktion von Aceton (oder Ethanol) mit Natriumhypochlorit oder Calciumhypochlorit. Das Haloform-Verfahren ist heute für die Herstellung von gewöhnlichem Chloroform überholt. Deuterochloroform kann durch die Reaktion von Natriumdeuteroxid mit Chloralhydrat hergestellt werden. ⓘ
Unbeabsichtigte Bildung von Chloroform
Die Haloformreaktion kann auch unbeabsichtigt im Haushalt auftreten. Beim Bleichen mit Hypochlorit entstehen in Nebenreaktionen halogenierte Verbindungen; Chloroform ist das Hauptnebenprodukt. Natriumhypochloritlösung (Chlorbleiche) gemischt mit haushaltsüblichen Flüssigkeiten wie Aceton, Methylethylketon, Ethanol oder Isopropylalkohol kann neben anderen Verbindungen wie Chloraceton oder Dichloraceton auch etwas Chloroform erzeugen. ⓘ
Verwendungen
Die in der Größenordnung wichtigste Reaktion von Chloroform ist die mit Fluorwasserstoff zur Herstellung von Monochlordifluormethan (FCKW-22), einem Vorprodukt für die Herstellung von Polytetrafluorethylen (Teflon):
- CHCl3 + 2 HF → CHClF2 + 2 HCl
Die Reaktion wird in Gegenwart einer katalytischen Menge von gemischten Antimonhalogeniden durchgeführt. Chlordifluormethan wird dann in Tetrafluorethylen umgewandelt, dem wichtigsten Vorprodukt von Teflon. Vor dem Montrealer Protokoll war Chlordifluormethan (als R-22 bezeichnet) auch ein beliebtes Kältemittel. ⓘ
Lösungsmittel
Der an den Kohlenstoff des Chloroforms gebundene Wasserstoff ist an der Wasserstoffbrückenbindung beteiligt. Weltweit wird Chloroform auch in Pestizidformulierungen, als Lösungsmittel für Fette, Öle, Kautschuk, Alkaloide, Wachse, Guttapercha und Harze, als Reinigungsmittel, zur Begasung von Getreide, in Feuerlöschern und in der Gummiindustrie verwendet. CDCl3 ist ein häufig verwendetes Lösungsmittel in der NMR-Spektroskopie. ⓘ
Lewis-Säure
In Lösungsmitteln wie CCl4 und Alkanen geht Chloroform Wasserstoffbrückenbindungen mit einer Vielzahl von Lewis-Basen ein. HCCl3 wird als harte Säure eingestuft, und das ECW-Modell gibt seine Säureparameter mit EA = 1,56 und CA = 0,44 an. ⓘ
Reagenz
Als Reagenz dient Chloroform als Quelle für die Dichlorkohlenstoffgruppe :CCl2. Es reagiert mit wässrigem Natriumhydroxid in der Regel in Gegenwart eines Phasentransferkatalysators, um Dichlorkohlenstoff :CCl2 zu erzeugen. Dieses Reagenz bewirkt eine ortho-Formylierung von aktivierten aromatischen Ringen wie Phenolen, wobei Arylaldehyde in einer Reaktion entstehen, die als Reimer-Tiemann-Reaktion bekannt ist. Alternativ kann das Carben auch von einem Alken eingefangen werden, um ein Cyclopropanderivat zu bilden. Bei der Kharasch-Addition bildet Chloroform neben den Alkenen das freie Radikal CHCl2. ⓘ
Anästhetikum

Die anästhetischen Eigenschaften von Chloroform wurden erstmals 1842 in einer Dissertation von Robert Mortimer Glover beschrieben, die in jenem Jahr mit der Goldmedaille der Harveian Society ausgezeichnet wurde. Glover unternahm auch praktische Versuche an Hunden, um seine Theorien zu beweisen. Glover verfeinerte seine Theorien weiter und legte sie im Sommer 1847 in seiner Doktorarbeit an der Universität von Edinburgh vor. Der schottische Geburtshelfer James Young Simpson gehörte zu den Personen, die die Dissertation lesen mussten, behauptete aber später, die Arbeit nie gelesen zu haben und unabhängig davon zu seinen Schlussfolgerungen gekommen zu sein. ⓘ
Am 4. November 1847 entdeckte Simpson erstmals die betäubende Wirkung von Chloroform beim Menschen. Er und zwei Kollegen unterhielten sich, indem sie die Wirkung verschiedener Substanzen ausprobierten, und entdeckten so das Potenzial von Chloroform für medizinische Verfahren. ⓘ
Wenige Tage später wurde Francis Brodie Imlach bei einer zahnärztlichen Behandlung in Edinburgh der erste Mensch, der Chloroform in einem klinischen Kontext an einem Patienten verwendete. ⓘ
Im Mai 1848 hielt Robert Halliday Gunning vor der Medico-Chirurgical Society of Edinburgh einen Vortrag über eine Reihe von Laborexperimenten an Kaninchen, die Glovers Ergebnisse bestätigten und Simpsons Behauptungen über seine Originalität widerlegten. Der Ritterschlag für Simpson und die massive Medienberichterstattung über die Wunder des Chloroforms sorgten dafür, dass Simpsons Ansehen hoch blieb, während die Laborexperimente, die die Gefahren des Chloroforms bewiesen, weitgehend ignoriert wurden. Gunning, der zu einer der reichsten Personen Großbritanniens wurde, stiftete etwa 13 Universitätsstipendien, die er auf den Namen anderer Wissenschaftler statt auf seinen eigenen Namen ausstellte. Er hielt Simpson für einen Scharlatan, aber einer dieser Preise trägt den Namen Simpson Prize for Obstetrics. Dies ist jedoch wahrscheinlich ein seltsames umgekehrtes Kompliment, da jeder Simpson-Preis in der breiteren Öffentlichkeit wohl ein Preis für Anästhesie sein sollte. Indem er ihn nicht so nannte, brüskierte er Simpson, während er ihn gleichzeitig zu ehren schien. ⓘ
Die Verwendung von Chloroform in der Chirurgie verbreitete sich in der Folgezeit in Europa rasch. In den 1850er Jahren wurde Chloroform von dem Arzt John Snow bei der Geburt der letzten beiden Kinder von Königin Victoria eingesetzt. In den Vereinigten Staaten begann Chloroform zu Beginn des 20. Jahrhunderts, Äther als Narkosemittel zu ersetzen; es wurde jedoch schnell zugunsten von Äther aufgegeben, als man seine Toxizität entdeckte, insbesondere seine Neigung, tödliche Herzrhythmusstörungen zu verursachen, die mit dem so genannten "plötzlichen Schnüffeltod" vergleichbar sind. Einige Menschen benutzten Chloroform als Freizeitdroge oder für Selbstmordversuche. Ein möglicher Wirkmechanismus von Chloroform besteht darin, dass es die Bewegung von Kaliumionen durch bestimmte Arten von Kaliumkanälen in den Nervenzellen erhöht. Chloroform konnte auch mit anderen Narkosemitteln gemischt werden, z. B. mit Äther, um eine C.E.-Mischung herzustellen, oder mit Äther und Alkohol, um eine A.C.E.-Mischung herzustellen. ⓘ
Im Jahr 1848 starb Hannah Greener, ein 15-jähriges Mädchen, dem ein infizierter Zehennagel entfernt wurde, nachdem ihr das Narkosemittel verabreicht worden war. Ihre Autopsie zur Feststellung der Todesursache wurde von John Fife mit Unterstützung von Robert Mortimer Glover durchgeführt. Mehrere körperlich fitte Patienten starben, nachdem sie das Mittel eingeatmet hatten. Im Jahr 1848 entwickelte John Snow jedoch einen Inhalator, der die Dosierung regulierte und so die Zahl der Todesfälle erfolgreich reduzierte. ⓘ
Die Gegner und Befürworter von Chloroform stritten sich vor allem über die Frage, ob die Komplikationen ausschließlich auf die Atemstörung zurückzuführen waren oder ob Chloroform eine spezifische Wirkung auf das Herz hatte. Zwischen 1864 und 1910 untersuchten zahlreiche Kommissionen in Großbritannien Chloroform, kamen aber zu keinem eindeutigen Ergebnis. Erst 1911 wies Levy in Tierversuchen nach, dass Chloroform Herzflimmern verursachen kann. Die Vorbehalte gegen Chloroform konnten seine steigende Popularität nicht aufhalten. Zwischen etwa 1865 und 1920 wurde Chloroform bei 80 bis 95 % aller Narkosen im Vereinigten Königreich und in den deutschsprachigen Ländern verwendet. In den Vereinigten Staaten hingegen war die Begeisterung für die Chloroformnarkose geringer. In Deutschland wurden die ersten umfassenden Erhebungen über die Sterblichkeitsrate bei Anästhesien zwischen 1890 und 1897 von Gurlt durchgeführt. Killian trug 1934 alle bis dahin erstellten Statistiken zusammen und stellte fest, dass die Wahrscheinlichkeit, tödliche Komplikationen zu erleiden, unter Äther zwischen 1:14.000 und 1:28.000 lag, während sie unter Chloroform zwischen 1:3.000 und 1:6.000 lag. Das Aufkommen der Gasanästhesie mit Lachgas, verbesserte Geräte zur Verabreichung von Anästhetika und die Entdeckung von Hexobarbital im Jahr 1932 führten zu einem allmählichen Rückgang der Chloroformnarkose. ⓘ
Kriminelle Verwendung
Chloroform soll von Kriminellen verwendet worden sein, um Opfer zu betäuben, zu benommen oder sogar zu ermorden. Joseph Harris wurde 1894 angeklagt, Chloroform für Raubüberfälle verwendet zu haben. Der Serienmörder H. H. Holmes verwendete eine Überdosis Chloroform, um seine weiblichen Opfer zu töten. Im September 1900 wurde Chloroform in den Mord an dem amerikanischen Geschäftsmann William Marsh Rice verwickelt, dem Namensgeber der heute als Rice University bekannten Einrichtung. Chloroform wurde als Faktor bei dem mutmaßlichen Mord an einer Frau im Jahr 1991 angesehen, die im Schlaf erstickt wurde. Im Jahr 2002 wurde die 13-jährige Kacie Woody mit Chloroform betäubt, als sie von David Fuller entführt wurde und während der Zeit, in der er sie in seiner Gewalt hatte, bevor er sie erschoss. Im Jahr 2007 gestand ein Mann, Elektroschocker und Chloroform für sexuelle Übergriffe auf Minderjährige eingesetzt zu haben. ⓘ
Die Verwendung von Chloroform als Betäubungsmittel ist inzwischen weithin bekannt und grenzt an ein Klischee, da Krimiautoren immer wieder Kriminelle mit Chloroform getränkte Lappen verwenden lassen, um ihre Opfer bewusstlos zu machen. Es ist jedoch nahezu unmöglich, jemanden mit Chloroform auf diese Weise bewusstlos zu machen. Es dauert mindestens fünf Minuten, bis eine Person durch das Einatmen eines mit Chloroform getränkten Gegenstandes bewusstlos wird. In den meisten Kriminalfällen, in denen Chloroform zum Einsatz kommt, wird auch eine andere Droge wie Alkohol oder Diazepam verabreicht, oder es wird festgestellt, dass das Opfer an der Verabreichung von Chloroform beteiligt war. Nachdem eine Person durch die Inhalation von Chloroform das Bewusstsein verloren hat, muss ein kontinuierliches Volumen verabreicht und das Kinn gestützt werden, um zu verhindern, dass die Zunge die Atemwege blockiert - ein schwieriges Verfahren, das in der Regel die Fähigkeiten eines Anästhesisten erfordert. Als unmittelbare Folge des kriminellen Rufs, den Chloroform erlangt hatte, bot die medizinische Fachzeitschrift The Lancet 1865 demjenigen, der "augenblickliche Empfindungslosigkeit", d. h. sofortigen Bewusstseinsverlust, unter Verwendung von Chloroform nachweisen konnte, einen "dauerhaften wissenschaftlichen Ruf" an. ⓘ
Sicherheit
Exposition
Chloroform entsteht bekanntlich als Nebenprodukt bei der Chlorung von Wasser zusammen mit einer Reihe anderer Desinfektionsnebenprodukte und ist daher häufig in kommunalem Leitungswasser und in Schwimmbädern vorhanden. Die gemeldeten Werte variieren beträchtlich, liegen aber im Allgemeinen unter der geltenden Gesundheitsnorm für Gesamttrihalogenmethane von 100μg/L. Nichtsdestotrotz wird das Vorhandensein von Chloroform in Trinkwasser in jeder Konzentration von einigen als umstritten angesehen. ⓘ
In der Vergangenheit war die Exposition gegenüber Chloroform möglicherweise höher, da es häufig als Anästhetikum, als Bestandteil von Hustensäften und als Bestandteil von Tabakrauch verwendet wurde, wo früher DDT als Begasungsmittel eingesetzt wurde. ⓘ
Pharmakologie
Es wird von Säugetieren nach oraler, inhalativer oder dermaler Aufnahme gut absorbiert, verstoffwechselt und schnell wieder ausgeschieden. Versehentliche Spritzer in die Augen haben Reizungen verursacht. Eine längere Exposition der Haut kann zur Entwicklung von Wunden infolge von Entfettung führen. Die Ausscheidung erfolgt hauptsächlich über die Lunge in Form von Chloroform und Kohlendioxid; weniger als 1 % wird mit dem Urin ausgeschieden. ⓘ
Chloroform wird in der Leber durch die Cytochrom-P-450-Enzyme metabolisiert, und zwar durch Oxidation zu Chlormethanol und durch Reduktion zum freien Dichlormethylradikal. Andere Metaboliten von Chloroform sind Salzsäure und Digluathionyldithiocarbonat, wobei Kohlendioxid das vorherrschende Endprodukt des Metabolismus ist. ⓘ
Wie die meisten anderen Allgemeinanästhetika und sedativ-hypnotischen Drogen ist Chloroform ein positiver allosterischer Modulator für den GABAA-Rezeptor. Chloroform bewirkt eine Depression des zentralen Nervensystems (ZNS), die schließlich zu einem tiefen Koma und einer Depression des Atemzentrums führt. Bei der Einnahme von Chloroform werden ähnliche Symptome wie bei der Inhalation beobachtet. Schwere Erkrankungen traten nach der Einnahme von 7,5 g (0,26 oz) auf. Die mittlere tödliche orale Dosis für einen Erwachsenen wird auf 45 g (1,6 oz) geschätzt. ⓘ
Die Verwendung von Chloroform als Anästhetikum wurde eingestellt, da es zu Todesfällen aufgrund von Atemversagen und Herzrhythmusstörungen führte. Nach einer Chloroform-induzierten Anästhesie kam es bei einigen Patienten zu Übelkeit, Erbrechen, Hyperthermie, Gelbsucht und Koma aufgrund einer Leberfunktionsstörung. Bei der Autopsie wurden Lebernekrosen und -degenerationen festgestellt. ⓘ
Chloroform hat bei Mäusen Lebertumore und bei Mäusen und Ratten Nierentumore ausgelöst. Es wird angenommen, dass die Hepatotoxizität und Nephrotoxizität von Chloroform hauptsächlich auf Phosgen zurückzuführen ist. ⓘ
Umwandlung in Phosgen
Chloroform wandelt sich an der Luft langsam in das extrem giftige Phosgen (COCl2) um und setzt dabei HCl frei. ⓘ
- 2 CHCl3 + O2 → 2 COCl2 + 2 HCl
Um Unfälle zu vermeiden, wird handelsübliches Chloroform mit Ethanol oder Amylen stabilisiert, aber Proben, die zurückgewonnen oder getrocknet wurden, enthalten keinen Stabilisator mehr. Amylen hat sich als unwirksam erwiesen, und das Phosgen kann die Analyten in den Proben, die Lipide und die Nukleinsäuren, die in Chloroform gelöst oder mit Chloroform extrahiert wurden, beeinträchtigen. Phosgen und HCl können aus Chloroform durch Waschen mit gesättigten wässrigen Karbonatlösungen, wie Natriumbikarbonat, entfernt werden. Dieses Verfahren ist einfach und führt zu unbedenklichen Produkten. Phosgen reagiert mit Wasser unter Bildung von Kohlendioxid und HCl, und das Carbonatsalz neutralisiert die entstehende Säure. ⓘ
Verdächtige Proben können mit Hilfe von Filterpapier (behandelt mit 5 % Diphenylamin, 5 % Dimethylaminobenzaldehyd in Ethanol und anschließend getrocknet), das sich in Phosgendampf gelb färbt, auf Phosgen getestet werden. Es gibt mehrere kolorimetrische und fluorometrische Reagenzien für Phosgen, und es kann auch mit Massenspektrometrie quantifiziert werden. ⓘ
Verordnung
Chloroform steht im Verdacht, Krebs zu verursachen (d. h. möglicherweise krebserregend, IARC-Gruppe 2B), wie aus den Monographien der Internationalen Agentur für Krebsforschung (IARC) hervorgeht. [PDF] ⓘ
Es ist in den Vereinigten Staaten als extrem gefährliche Substanz eingestuft, wie in Abschnitt 302 des U.S. Emergency Planning and Community Right-to-Know Act (42 U.S.C. 11002) definiert, und unterliegt strengen Meldepflichten für Einrichtungen, die es in erheblichen Mengen herstellen, lagern oder verwenden. ⓘ
Bioremediation von Chloroform
Einige anaerobe Bakterien nutzen Chloroform für ihre Atmung, die so genannte Organohalogenid-Atmung, und wandeln es in Dichlormethan um. ⓘ
Eigenschaften
Physikalische Eigenschaften
Trichlormethan ist eine farblose, nicht entflammbare, flüchtige Flüssigkeit von süßlichem Geruch. Der Schmelzpunkt liegt bei −63 °C, der Siedepunkt unter Normaldruck bei 61 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,20772, B = 1233,129 und C = −40,953 im Temperaturbereich von 215 bis 334 K und mit A = 4,56992, B = 1486,455 und C = −8,612 im Temperaturbereich von 334,4 bis 527 K. Es hat eine größere Dichte als Wasser und ist nur wenig darin löslich. Die Mischbarkeit mit Wasser ist begrenzt. Mit steigender Temperatur sinkt die Löslichkeit von Chloroform in Wasser bzw. steigt die Löslichkeit von Wasser in Chloroform. ⓘ
ⓘLöslichkeiten zwischen Chloroform und Wasser Temperatur (in °C) 0 9,5 19,6 29,5 39,3 49,2 59,2 Chloroform in Wasser (Massenanteil in %) 1,02 0,93 0,82 0,79 0,74 0,77 0,79 Wasser in Chloroform (Massenanteil in %) 0,0365 0,0527 0,0661 0,0841 0,1108 0,1353 0,1672
Die Verbindung bildet mit einer Reihe von Lösungsmitteln azeotrop siedende Gemische. Die azeotropen Zusammensetzungen und Siedepunkte finden sich in der folgenden Tabelle. Keine Azeotrope werden mit n-Pentan, n-Heptan, Cyclohexan, Benzol, Toluol, n-Propanol, i-Butanol, Tetrachlorkohlenstoff, Diethylether, 1,4-Dioxan, n-Butylacetat, Essigsäure, Acetonitril, Nitrobenzol, Schwefelkohlenstoff und Pyridin gebildet. ⓘ
| Azeotrope mit verschiedenen Lösungsmitteln ⓘ | ||||||||||||
| Lösungsmittel | Wasser | Methanol | Ethanol | 2-Propanol | Aceton | 2-Butanon | ||||||
| Gehalt Chloroform | in w% | 97 | 87 | 93 | 96 | 78 | 17 | |||||
| Siedepunkt | in °C | 56 | 53 | 59 | 61 | 64 | 80 | |||||
| Lösungsmittel | Diisopropylether | Tetrahydrofuran | Methylacetat | Ethylacetat | n-Hexan | |||||||
| Gehalt Chloroform | in w% | 36 | 66 | 77 | 28 | 83 | ||||||
| Siedepunkt | in °C | 71 | 73 | 65 | 78 | 60 | ||||||
Reaktion mit Aceton
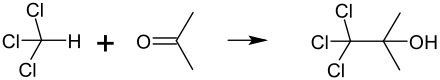
Aceton und Chloroform dürfen nicht in höheren Konzentrationen gemischt werden, weil es in Gegenwart von Spuren basisch reagierender Stoffe zu einer sehr heftigen Reaktion kommen kann, bei der 1,1,1-Trichlor-2-methyl-2-propanol (|α,α,α‐Trichlor‐tert‐Butanol) entsteht. Auch aus diesem Grund sollen im Labor chlorierte und nicht chlorierte Lösemittelabfälle getrennt gesammelt werden. ⓘ
Verwendung
Chloroform wird in erster Linie als Lösungsmittel und zur Herstellung von Fluorchlorkohlenwasserstoffen (FCKW) verwendet. ⓘ
Mit alkoholischem Kali und Ammoniak entsteht beim Erhitzen Kaliumcyanid. Bei Verwendung primärer Amine statt Ammoniak erhält man Isonitrile. Mit dieser von August Wilhelm von Hofmann entdeckten Reaktion lassen sich primäre Amine auch qualitativ nachweisen, denn die Isonitrile geben sich durch einen starken und üblen Geruch zu erkennen. ⓘ
In der chemischen Synthese wird es zur Herstellung von Dichlorcarben (in Gegenwart von Basen) verwendet. Durch Friedel-Crafts-Alkylierung mit Benzol erhält man Triphenylmethan. ⓘ
Bei der Bestimmung der mikrobiellen Biomasse in Bodenproben mittels Chloroform-Fumigation-Extraktion wird ausgenutzt, dass Chloroform Zelllyse verursacht. ⓘ
Chloroform wird zur Bestimmung von der Iodzahl nach Hanuš benutzt, und zur Bestimmung der Peroxidzahl nach Wheeler als Eisessig-Chloroform Gemisch. ⓘ
Sicherheitshinweise
Die Dämpfe von Chloroform verursachen Bewusstlosigkeit und senken die Schmerzempfindung. Bereits Anfang 1848 gab es den ersten Bericht über eine tödlich verlaufene Narkoseeinleitung mit Chloroform. Im Jahr 1850 waren mindestens 11 Chloroformtodesfälle bekannt. Wegen der toxischen Wirkung auf Herz, Leber und andere innere Organe wird Chloroform seit Anfang des 20. Jahrhunderts kaum noch und heute nicht mehr als Narkosemittel angewendet. Es steht außerdem unter Verdacht, krebserregend zu sein. ⓘ
Rechtsbestimmungen
Die Anwendung von Chloroform ist bei Lebensmittel liefernden Tieren gemäß der EU-Rückstandshöchstmengen-Verordnung für Lebensmittel tierischen Ursprungs in der Europäischen Union generell verboten. ⓘ
Deuterochloroform

Deuteriertes Chloroform (Summenformel: CDCl3, CAS-Nr.: 865-49-6), auch Deuterochloroform genannt, findet in der Kernresonanzspektroskopie (NMR) als Lösungsmittel Verwendung. ⓘ
Die Synthese erfolgt durch Umsetzung des Calciumsalzes der Trichloressigsäure mit schwerem Wasser. ⓘ
Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(Cl_3CCO_2)_2 Ca + D_2O -> 2 Cl_3CD + CaCO_3 + CO_2 <span title="Aus: Deutsche Wikipedia, Abschnitt "Deuterochloroform"" class="plainlinks">[https://de.wikipedia.org/wiki/Chloroform#Deuterochloroform <span style="color:#dddddd">ⓘ</span>]</span>}}
Die physikalischen Eigenschaften unterscheiden sich geringfügig von der nichtdeuterierten Verbindung:
- Schmelzpunkt: −64 °C
- Siedepunkt: 60,9 °C
- Dichte: 1,500 g/ml (25 °C)
- Brechungsindex: 1,444 (20 °C) ⓘ