Hydrazin
|
| |||
|
| |||
 Hydrazin-Hydrat
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Systematischer IUPAC-Name
Hydrazin | |||
| Andere Namen
Diamin;
Diazan; Tetrahydridodinstickstoff (N-N); Diamidogen
| |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| 3DMet | |||
Beilstein-Referenz
|
878137 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin Referenz
|
190 | ||
| KEGG | |||
| MeSH | Hydrazin | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 2029 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
N 2H 4 | ||
| Molekulare Masse | 32,0452 g-mol-1 | ||
| Erscheinungsbild | Farblose, rauchende, ölige Flüssigkeit | ||
| Geruch | Ammoniakartig | ||
| Dichte | 1,021 g-cm-3 | ||
| Schmelzpunkt | 2 °C; 35 °F; 275 K | ||
| Siedepunkt | 114 °C; 237 °F; 387 K | ||
Löslichkeit in Wasser
|
mischbar | ||
| log P | 0.67 | ||
| Dampfdruck | 1 kPa (bei 30,7 °C) | ||
| Acidität (pKa) | 8,10 (N2H5+) | ||
| Basizität (pKb) | 5.90 | ||
| Konjugierte Säure | Hydrazinium | ||
Brechungsindex (nD)
|
1,46044 (bei 22 °C) | ||
| Viskosität | 0,876 cP | ||
| Struktur | |||
Molekulare Form
|
Dreieckig-pyramidal bei N | ||
Dipolmoment
|
1.85 D | ||
| Thermochemie | |||
Std. molare
Entropie (S |
121,52 J-K-1-mol-1 | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
50,63 kJ-mol-1 | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
    
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H226, H301, H311, H314, H317, H331, H350, H410 | ||
Sicherheitshinweise
|
P201, P261, P273, P280, P301+P310, P305+P351+P338 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 52 °C (126 °F; 325 K) | ||
Selbstentzündung
temperatur |
24 bis 270 °C (75 bis 518 °F; 297 bis 543 K) | ||
| Explosionsgrenzen | 1.8–99.99% | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (mittlere Dosis)
|
59-60 mg/kg (oral bei Ratten, Mäusen) | ||
LC50 (mittlere Konzentration)
|
260 ppm (Ratte, 4 Std.) 630 ppm (Ratte, 1 Std.) 570 ppm (Ratte, 4 Std.) 252 ppm (Maus, 4 Std.) | ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
TWA 1 ppm (1,3 mg/m3) [Haut] | ||
REL (Empfohlen)
|
Ca C 0,03 ppm (0,04 mg/m3) [2 Stunden] | ||
IDLH (Unmittelbare Gefahr)
|
Ca [50 ppm] | ||
| Sicherheitsdatenblatt (SDS) | ICSC 0281 | ||
| Verwandte Verbindungen | |||
Andere Anionen
|
Tetrafluorhydrazin Wasserstoffsuperoxyd Diphosphan Diphosphor-Tetraiodid | ||
Sonstige Kationen
|
Organische Hydrazine | ||
Verwandte binäre Azane
|
Ammoniak Triazane | ||
Verwandte Verbindungen
|
Diazen Triazen Tetrazen Diphosphen | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Stoffe in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Hydrazin ist eine anorganische Verbindung mit der chemischen Formel N2H4. Es ist ein einfaches Stickstoffhydrid und eine farblose, brennbare Flüssigkeit mit einem ammoniakartigen Geruch. ⓘ
Hydrazin ist hochgiftig, es sei denn, es wird in Lösung, z. B. als Hydrazinhydrat (NH2NH2 - xH2O), verwendet. Im Jahr 2015 belief sich der Weltmarkt für Hydrazinhydrat auf 350 Millionen US-Dollar. Hydrazin wird hauptsächlich als Schaumbildner bei der Herstellung von Polymerschäumen verwendet, aber auch als Vorprodukt für Polymerisationskatalysatoren, Pharmazeutika und Agrochemikalien sowie als langfristig lagerfähiger Treibstoff für den Antrieb von Raumfahrzeugen im Weltraum. ⓘ
Im Jahr 2015 wurden etwa zwei Millionen Tonnen Hydrazinhydrat in Schaumtreibmitteln verwendet. Außerdem wird Hydrazin in verschiedenen Raketentreibstoffen und zur Herstellung von Gasvorläufern für Airbags verwendet. Hydrazin wird sowohl in nuklearen als auch in konventionellen Dampfkreisläufen von Kraftwerken als Sauerstofffänger eingesetzt, um die Konzentration von gelöstem Sauerstoff zu kontrollieren und so die Korrosion zu verringern. ⓘ
Hydrazine beziehen sich auf eine Klasse organischer Stoffe, die durch Ersetzen eines oder mehrerer Wasserstoffatome in Hydrazin durch eine organische Gruppe entstehen. ⓘ
Verwendungen
Gaserzeuger und Treibstoffe
Hydrazin wird hauptsächlich als Vorprodukt für Treibmittel verwendet. Zu den spezifischen Verbindungen gehören Azodicarbonamid und Azobisisobutyronitril, die 100-200 ml Gas pro Gramm Vorprodukt erzeugen. In einer verwandten Anwendung wird Natriumazid, das gasbildende Mittel in Airbags, aus Hydrazin durch Reaktion mit Natriumnitrit hergestellt. ⓘ
Hydrazin wird auch als langfristig speicherbarer Treibstoff an Bord von Raumfahrzeugen verwendet, wie z. B. bei der Dawn-Mission zu Ceres und Vesta, und um die Konzentration von gelöstem Sauerstoff im Wasser zu verringern und den pH-Wert von Wasser zu kontrollieren, das in großen Industriekesseln verwendet wird. Der F-16-Kampfjet, der Eurofighter Typhoon, das Space Shuttle und das Spionageflugzeug U-2 verwenden Hydrazin als Treibstoff für ihre Hilfstriebwerke. ⓘ
Vorläufer von Pestiziden und Arzneimitteln

Hydrazin ist ein Ausgangsstoff für verschiedene Arzneimittel und Pestizide. Diese Anwendungen beinhalten häufig die Umwandlung von Hydrazin in heterozyklische Ringe wie Pyrazole und Pyridazine. Beispiele für vermarktete bioaktive Hydrazinderivate sind Cefazolin, Rizatriptan, Anastrozol, Fluconazol, Metazachlor, Metamitron, Metribuzin, Paclobutrazol, Diclobutrazol, Propiconazol, Hydrazinsulfat, Diimid, Triadimefon und Dibenzoylhydrazin. ⓘ
Hydrazinverbindungen können als Wirkstoffe in Mischung mit oder in Kombination mit anderen landwirtschaftlichen Chemikalien wie Insektiziden, Mitiziden, Nematiziden, Fungiziden, antiviralen Mitteln, Lockstoffen, Herbiziden oder Pflanzenwachstumsregulatoren wirksam sein. ⓘ
Kleiner Maßstab, Nische und Forschung
Der italienische Katalysatorhersteller Acta (Chemieunternehmen) hat vorgeschlagen, Hydrazin als Alternative zu Wasserstoff in Brennstoffzellen zu verwenden. Der Hauptvorteil der Verwendung von Hydrazin besteht darin, dass über 200 mW/cm2 mehr als bei einer vergleichbaren Wasserstoffzelle erzeugt werden können, ohne dass teure Platinkatalysatoren verwendet werden müssen. Da der Brennstoff bei Raumtemperatur flüssig ist, lässt er sich leichter handhaben und lagern als Wasserstoff. Wenn das Hydrazin in einem Tank mit einem doppelt gebundenen Kohlenstoff-Sauerstoff-Carbonyl gelagert wird, reagiert der Brennstoff und bildet einen sicheren Feststoff namens Hydrazon. Wenn man den Tank dann mit warmem Wasser spült, wird das flüssige Hydrazinhydrat freigesetzt. Hydrazin hat eine höhere elektromotorische Kraft von 1,56 V im Vergleich zu 1,23 V bei Wasserstoff. Hydrazin zerfällt in der Zelle zu Stickstoff und Wasserstoff, der sich mit Sauerstoff verbindet und Wasser freisetzt. Hydrazin wurde in von der Allis-Chalmers Corp. hergestellten Brennstoffzellen verwendet, von denen einige in den 1960er Jahren Weltraumsatelliten mit Strom versorgten. ⓘ
Ein Gemisch aus 63 % Hydrazin, 32 % Hydrazinnitrat und 5 % Wasser ist ein Standardtreibstoff für experimentelle Flüssigtreibstoffartillerie mit Großladung. Das oben genannte Treibstoffgemisch ist eines der berechenbarsten und stabilsten, mit einem flachen Druckprofil während des Abschusses. Fehlzündungen sind in der Regel auf eine unzureichende Zündung zurückzuführen. Die Bewegung des Geschosses nach einer Fehlzündung führt zu einer großen Blase mit einer größeren Zündfläche, und die höhere Gasproduktion verursacht einen sehr hohen Druck, der manchmal zu katastrophalen Rohrbrüchen (d. h. Explosionen) führt. Von Januar bis Juni 1991 untersuchte das U.S. Army Research Laboratory die frühen Programme für Flüssigtreibstoffkanonen mit Großladung auf ihre mögliche Relevanz für das Programm für elektrothermische chemische Antriebe. ⓘ
Die United States Air Force (USAF) verwendet regelmäßig H-70, ein Gemisch aus 70 % Hydrazin und 30 % Wasser, bei Einsätzen mit dem Kampfflugzeug General Dynamics F-16 "Fighting Falcon" und dem Aufklärungsflugzeug Lockheed U-2 "Dragon Lady". Die einstrahlige F-16 nutzt Hydrazin zum Betrieb ihrer Notstromversorgung (Emergency Power Unit, EPU), die im Falle eines Triebwerksausfalls elektrische und hydraulische Notstromversorgung bereitstellt. Das Notstromaggregat wird automatisch oder manuell durch den Piloten aktiviert, wenn der Hydraulikdruck oder die elektrische Energie ausfällt, um die Notsteuerung zu übernehmen. Das einstrahlige Triebwerk der U-2 verwendet Hydrazin für das Notstartsystem (Emergency Starting System, ESS), das eine äußerst zuverlässige Methode zum Wiederanlassen des Triebwerks im Flug im Falle eines Strömungsabrisses darstellt. ⓘ

Raketentreibstoff

Hydrazin wurde erstmals während des Zweiten Weltkriegs als Bestandteil von Raketentreibstoffen verwendet. Ein Gemisch von 30 Gewichtsprozent mit 57 Prozent Methanol (in der deutschen Luftwaffe M-Stoff genannt) und 13 Prozent Wasser wurde von den Deutschen C-Stoff genannt. Das Gemisch wurde zum Antrieb des raketengetriebenen Jagdflugzeugs Messerschmitt Me 163B verwendet, bei dem das deutsche Hochtestperoxid T-Stoff als Oxidationsmittel eingesetzt wurde. Ungemischtes Hydrazin wurde von den Deutschen als B-Stoff bezeichnet, eine Bezeichnung, die später auch für den Ethanol/Wasser-Treibstoff für die V-2-Rakete verwendet wurde. ⓘ
Hydrazin wird als Monotreibstoff mit geringer Leistung für die Manövriertriebwerke von Raumfahrzeugen verwendet und diente zum Antrieb der Hilfstriebwerke (APUs) des Space Shuttle. Darüber hinaus werden hydrazinbetriebene Monotreibstoff-Raketentriebwerke häufig für den Endabstieg von Raumfahrzeugen verwendet. Solche Triebwerke wurden in den 1970er Jahren bei den Landegeräten des Viking-Programms sowie bei den Marslandegeräten Phoenix (Mai 2008), Curiosity (August 2012) und Perseverance (Februar 2021) eingesetzt. ⓘ
Ein Gemisch aus Hydrazin und roter rauchender Salpetersäure wurde im sowjetischen Raumfahrtprogramm verwendet, wo es wegen seiner Gefährlichkeit als Teufelsgift bezeichnet wurde. ⓘ
In allen Hydrazin-Monotreibstofftriebwerken wird das Hydrazin über einen Katalysator wie Iridiummetall geleitet, das von Aluminiumoxid mit großer Oberfläche getragen wird, wodurch es gemäß den folgenden Reaktionen in Ammoniak, Stickstoffgas und Wasserstoffgas zerfällt:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{4NH3 + N2H4 -> 3 N2 + 8 H2 <span title="Aus: Englische Wikipedia, Abschnitt "Rocket fuel"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrazine#Rocket_fuel <span style="color:#dddddd">ⓘ</span>]</span>}}
Die ersten beiden Reaktionen sind extrem exotherm (die Katalysatorkammer kann in wenigen Millisekunden 800 °C erreichen) und erzeugen große Mengen an heißem Gas aus einem kleinen Flüssigkeitsvolumen, was Hydrazin zu einem recht effizienten Triebwerkstreibstoff mit einem spezifischen Vakuumimpuls von etwa 220 Sekunden macht. Reaktion 2 ist die am stärksten exotherme Reaktion, erzeugt aber eine geringere Anzahl von Molekülen als Reaktion 1. Reaktion 3 ist endotherm und kehrt die Wirkung von Reaktion 2 in die gleiche Wirkung zurück wie Reaktion 1 allein (niedrigere Temperatur, größere Anzahl von Molekülen). Die Struktur des Katalysators beeinflusst den Anteil des NH3, der in Reaktion 3 dissoziiert wird; eine höhere Temperatur ist für Raketentriebwerke wünschenswert, während mehr Moleküle wünschenswert sind, wenn die Reaktionen größere Gasmengen erzeugen sollen. ⓘ
Da Hydrazin unterhalb von 2 °C ein Feststoff ist, eignet es sich nicht als Allzweck-Raketentreibstoff für militärische Anwendungen. Andere Varianten von Hydrazin, die als Raketentreibstoff verwendet werden, sind Monomethylhydrazin, (CH3)NH(NH2), auch bekannt als MMH (mp: -52 °C), und unsymmetrisches Dimethylhydrazin, (CH3)2N(NH2), auch bekannt als UDMH (mp: -57 °C). Diese Derivate werden in Zweikomponenten-Raketentreibstoffen verwendet, oft zusammen mit Distickstofftetroxid, N2O4. Ein 50:50-Gemisch aus Hydrazin und UDMH wurde in den Titan-II-ICBMs verwendet und ist als Aerozine 50 bekannt. Diese Reaktionen sind extrem exotherm, und die Verbrennung ist auch hypergolisch (sie beginnt ohne äußere Zündung zu brennen). ⓘ
In der Luft- und Raumfahrtindustrie gibt es derzeit Bemühungen, Hydrazin und andere hochgiftige Stoffe zu ersetzen. Zu den vielversprechenden Alternativen gehören Hydroxylammoniumnitrat, 2-Dimethylaminoethylazid (DMAZ) und energetische ionische Flüssigkeiten. ⓘ
Gefahren am Arbeitsplatz
Gesundheitliche Auswirkungen
Mögliche Expositionswege für Hydrazin sind die Haut, die Augen, das Einatmen und die Einnahme. ⓘ
Die Exposition gegenüber Hydrazin kann Hautreizungen/Kontaktdermatitis und Brennen, Reizungen der Augen/Nase/Rachen, Übelkeit/Erbrechen, Kurzatmigkeit, Lungenödem, Kopfschmerzen, Schwindel, Depression des zentralen Nervensystems, Lethargie, vorübergehende Blindheit, Krampfanfälle und Koma verursachen. Die Exposition kann auch Organschäden an Leber, Nieren und zentralem Nervensystem verursachen. Hydrazin ist nachweislich ein starker Hautsensibilisator mit der Möglichkeit einer Kreuzsensibilisierung auf Hydrazinderivate nach der ersten Exposition. Zusätzlich zu den oben genannten beruflichen Verwendungen ist eine Exposition gegenüber Hydrazin auch in geringen Mengen durch Tabakrauch möglich. ⓘ
Die offiziellen US-Leitlinien zu Hydrazin als Karzinogen sind uneinheitlich, aber im Allgemeinen wird eine potenziell krebserregende Wirkung anerkannt. Das National Institute for Occupational Safety and Health (NIOSH) listet Hydrazin als "potenziell berufsbedingtes Karzinogen" auf. Das National Toxicology Program (NTP) hält es für "wahrscheinlich krebserregend für den Menschen". Die American Conference of Governmental Industrial Hygienists (ACGIH) stuft Hydrazin als "A3-confirmed animal carcinogen with unknown relevance to humans" ein. Die U.S. Environmental Protection Agency (EPA) stuft Hydrazin als "B2 - wahrscheinlich krebserregend für den Menschen aufgrund von Tierversuchen" ein. ⓘ
Die Internationale Agentur für Krebsforschung (IARC) stuft Hydrazin als "2A-wahrscheinlich krebserregend für den Menschen" ein, wobei ein positiver Zusammenhang zwischen Hydrazexposition und Lungenkrebs beobachtet wurde. Auf der Grundlage von Kohorten- und Querschnittsstudien über die berufliche Exposition gegenüber Hydrazin kam ein Ausschuss der National Academies of Sciences, Engineering and Medicine zu dem Schluss, dass es suggestive Hinweise auf einen Zusammenhang zwischen der Exposition gegenüber Hydrazin und Lungenkrebs gibt, wobei es keine ausreichenden Hinweise auf einen Zusammenhang mit Krebs an anderen Stellen gibt. Der Wissenschaftliche Ausschuss der Europäischen Kommission für Grenzwerte berufsbedingter Exposition (SCOEL) stuft Hydrazin als Karzinogen der "Gruppe B - ein genotoxisches Karzinogen" ein. Der vom Ausschuss angeführte genotoxische Mechanismus bezieht sich auf die Reaktion von Hydrazin mit endogenem Formaldehyd und die Bildung eines DNA-Methylierungsmittels. ⓘ
Im Falle eines Notfalls mit Hydrazin-Exposition empfiehlt NIOSH, die kontaminierte Kleidung sofort auszuziehen, die Haut mit Wasser und Seife zu waschen und bei Augenkontakt die Kontaktlinsen herauszunehmen und die Augen mindestens 15 Minuten lang mit Wasser zu spülen. NIOSH empfiehlt außerdem allen Personen, die möglicherweise mit Hydrazin in Berührung gekommen sind, so schnell wie möglich einen Arzt aufzusuchen. Es gibt keine spezifischen Empfehlungen für Laboruntersuchungen oder medizinische Bildgebung nach der Exposition, und die medizinische Untersuchung kann von der Art und Schwere der Symptome abhängen. Die Weltgesundheitsorganisation (WHO) empfiehlt, mögliche Expositionen symptomatisch zu behandeln und dabei besonders auf mögliche Lungen- und Leberschäden zu achten. Bei früheren Fällen von Hydrazin-Exposition hat sich die Behandlung mit Pyridoxin (Vitamin B6) als erfolgreich erwiesen. ⓘ
Grenzwerte für die Exposition am Arbeitsplatz
- Empfohlener NIOSH-Expositionsgrenzwert (REL): 0,03 ppm (0,04 mg/m3) 2-Stunden-Obergrenze
- OSHA Zulässiger Expositionsgrenzwert (PEL): 1 ppm (1,3 mg/m3) 8-stündiger zeitlich gewichteter Durchschnitt
- ACGIH Schwellengrenzwert (TLV): 0,01 ppm (0,013 mg/m3) 8-stündiger zeitlich gewichteter Mittelwert ⓘ
Die Geruchsschwelle für Hydrazin liegt bei 3,7 ppm. Wenn also ein Arbeitnehmer einen ammoniakähnlichen Geruch wahrnimmt, liegt er wahrscheinlich über dem Expositionsgrenzwert. Dieser Geruchsschwellenwert variiert jedoch stark und sollte nicht zur Bestimmung einer potenziell gefährlichen Exposition herangezogen werden. ⓘ
Für das Personal der Luft- und Raumfahrt verwendet die USAF eine vom Toxikologieausschuss der Nationalen Akademie der Wissenschaften entwickelte Notfall-Expositionsrichtlinie, die für nicht routinemäßige Expositionen der allgemeinen Öffentlichkeit verwendet wird und als SPEGL (Short-Term Public Emergency Exposure Guideline) bezeichnet wird. Die SPEGL, die nicht für berufsbedingte Expositionen gilt, ist als akzeptable Spitzenkonzentration für unvorhersehbare, einmalige, kurzfristige Notfallexpositionen der Allgemeinheit definiert und steht für seltene Expositionen im Leben eines Arbeitnehmers. Für Hydrazin liegt der 1-Stunden-SPEGL bei 2 ppm und der 24-Stunden-SPEGL bei 0,08 ppm. ⓘ
Handhabung und medizinische Überwachung
Ein umfassendes Überwachungsprogramm für Hydrazin sollte eine systematische Analyse der biologischen Überwachung, der medizinischen Vorsorgeuntersuchungen und der Informationen über Morbidität und Mortalität umfassen. Die CDC empfiehlt, Überwachungszusammenfassungen und Schulungen für Aufsichtspersonen und Arbeitnehmer anzubieten. Vor dem Einsatz und in regelmäßigen Abständen sollten medizinische Untersuchungen durchgeführt werden, die sich insbesondere auf die möglichen Auswirkungen von Hydrazin auf die Funktion von Augen, Haut, Leber, Nieren, Blut- und Nervensystem sowie Atemwege konzentrieren. ⓘ
Zu den üblichen Schutzmaßnahmen für Hydrazin gehören die Einhausung des Prozesses, die lokale Absaugung und die persönliche Schutzausrüstung (PSA). Zu den Richtlinien für persönliche Schutzausrüstung für Hydrazin gehören undurchlässige Handschuhe und Kleidung, eine Spritzschutzbrille mit indirekter Belüftung, ein Gesichtsschutz und in einigen Fällen ein Atemschutzgerät. Der Einsatz von Atemschutzmasken beim Umgang mit Hydrazin sollte das letzte Mittel sein, um die Exposition der Arbeitnehmer zu kontrollieren. In den Fällen, in denen Atemschutzmasken erforderlich sind, sollten die richtige Auswahl der Atemschutzmaske und ein vollständiges Atemschutzprogramm in Übereinstimmung mit den OSHA-Richtlinien durchgeführt werden. ⓘ
Für das Personal der USAF werden in der Air Force Occupational Safety and Health (AFOSH)-Norm 48-8, Anhang 8, die Überlegungen zur beruflichen Exposition gegenüber Hydrazin in Raketen-, Luft- und Raumfahrtsystemen behandelt. Zu den spezifischen Leitlinien für die Reaktion auf die Exposition gehören obligatorische Notfallduschen und Augenspülstationen sowie ein Verfahren zur Dekontaminierung von Schutzkleidung. Der Leitfaden legt auch die Verantwortlichkeiten und Anforderungen für angemessene PSA, Mitarbeiterschulung, medizinische Überwachung und Notfallmaßnahmen fest. USAF-Stützpunkte, auf denen Hydrazin verwendet werden muss, haben in der Regel spezielle Stützpunktvorschriften, die die lokalen Anforderungen für die sichere Verwendung von Hydrazin und die Notfallmaßnahmen regeln. ⓘ
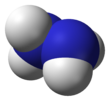
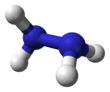
Molekulare Struktur
Jede H2N-N-Untereinheit ist pyramidenförmig. Der Abstand der N-N-Einfachbindung beträgt 1,45 Å (145 pm), und das Molekül nimmt eine Gauche-Konformation an. Die Rotationsbarriere ist doppelt so hoch wie die von Ethan. Diese strukturellen Eigenschaften ähneln denen des gasförmigen Wasserstoffperoxids, das eine "schiefe" antiklinale Konformation annimmt und ebenfalls eine starke Rotationsbarriere aufweist. ⓘ
Synthese und Herstellung
Es wurden verschiedene Wege entwickelt. Der wichtigste Schritt ist die Herstellung der Stickstoff-Stickstoff-Einfachbindung. Die zahlreichen Wege können in solche unterteilt werden, die Chloroxidationsmittel verwenden (und Salz erzeugen), und solche, die dies nicht tun. ⓘ
Oxidation von Ammoniak über Oxaziridine aus Peroxid
Hydrazin kann aus Ammoniak und Wasserstoffperoxid mit einem Ketonkatalysator in einem Verfahren synthetisiert werden, das als Peroxid-Prozess (manchmal auch Pechiney-Ugine-Kuhlmann-Prozess, Atofina-PCUK-Zyklus oder Ketazin-Prozess genannt) bezeichnet wird. Die Nettoreaktion verläuft wie folgt:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{2NH3 + H2O2 -> H2NNH2 + 2H2O <span title="Aus: Englische Wikipedia, Abschnitt "Oxidation of ammonia via oxaziridines from peroxide"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrazine#Oxidation_of_ammonia_via_oxaziridines_from_peroxide <span style="color:#dddddd">ⓘ</span>]</span>}}
Auf diesem Weg kondensieren Keton und Ammoniak zunächst zum Imin, das durch Wasserstoffperoxid zum Oxaziridin oxidiert wird, einem dreigliedrigen Ring mit Kohlenstoff, Sauerstoff und Stickstoff. Anschließend entsteht aus dem Oxaziridin durch Behandlung mit Ammoniak das Hydrazon, bei dem die Stickstoff-Stickstoff-Einfachbindung entsteht. Dieses Hydrazon kondensiert mit einem weiteren Äquivalent des Ketons.
Das resultierende Azin wird hydrolysiert, um Hydrazin zu erhalten und das Keton, Methylethylketon, zu regenerieren:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{ Me(Et)CNNC(Et)Me + 2 H2O -> 2 Me(Et)CO + N2H4 <span title="Aus: Englische Wikipedia, Abschnitt "Oxidation of ammonia via oxaziridines from peroxide"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrazine#Oxidation_of_ammonia_via_oxaziridines_from_peroxide <span style="color:#dddddd">ⓘ</span>]</span> }}
Im Gegensatz zu den meisten anderen Verfahren fällt bei diesem Ansatz kein Salz als Nebenprodukt an. ⓘ
Oxidationen auf Chlorbasis
Das 1907 erstmals vorgestellte Olin-Raschig-Verfahren stellt Hydrazin aus Natriumhypochlorit (dem Wirkstoff vieler Bleichmittel) und Ammoniak her, ohne einen Ketonkatalysator zu verwenden. Dieses Verfahren beruht auf der Reaktion von Monochloramin mit Ammoniak, bei der die Stickstoff-Stickstoff-Einfachbindung sowie ein Chlorwasserstoff-Nebenprodukt entstehen:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{ NH2Cl + NH3 -> H2NNH2 + HCl <span title="Aus: Englische Wikipedia, Abschnitt "Chlorine-based oxidations"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrazine#Chlorine-based_oxidations <span style="color:#dddddd">ⓘ</span>]</span>}}
Ähnlich wie beim Raschig-Verfahren kann anstelle von Ammoniak auch Harnstoff oxidiert werden. Auch hier dient Natriumhypochlorit als Oxidationsmittel. Die Nettoreaktion ist dargestellt:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{(H2N)2CO + NaOCl + 2 NaOH -> N2H4 + H2O + NaCl + Na2CO3 <span title="Aus: Englische Wikipedia, Abschnitt "Chlorine-based oxidations"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrazine#Chlorine-based_oxidations <span style="color:#dddddd">ⓘ</span>]</span>}}
Das Verfahren erzeugt erhebliche Nebenprodukte und wird hauptsächlich in Asien praktiziert. ⓘ
Das Bayer-Ketazin-Verfahren ist der Vorläufer des Peroxid-Verfahrens. Dabei wird Natriumhypochlorit als Oxidationsmittel anstelle von Wasserstoffperoxid verwendet. Wie bei allen auf Hypochlorit basierenden Verfahren entsteht bei dieser Methode ein Äquivalent Salz für jedes Äquivalent Hydrazin. ⓘ
Reaktionen
Säure-Base-Verhalten
Hydrazin bildet ein Monohydrat, das dichter ist (1,032 g/cm3) als das wasserfreie Material. Hydrazin hat basische (alkalische) chemische Eigenschaften, die mit denen von Ammoniak vergleichbar sind:
(bei Ammoniak ) ⓘ
Es ist schwer zu diprotonieren:
Redox-Reaktionen
Im Idealfall entstehen bei der Verbrennung von Hydrazin mit Sauerstoff Stickstoff und Wasser:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{N2H4 + O2 -> N2 + 2H2O <span title="Aus: Englische Wikipedia, Abschnitt "Redox reactions"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrazine#Redox_reactions <span style="color:#dddddd">ⓘ</span>]</span>}}
Bei einem Überschuss an Sauerstoff entstehen Stickstoffoxide, darunter Stickstoffmonoxid und Stickstoffdioxid:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{N2H4 + 3O2 -> 2NO2 + 2H2O <span title="Aus: Englische Wikipedia, Abschnitt "Redox reactions"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrazine#Redox_reactions <span style="color:#dddddd">ⓘ</span>]</span>}}
Die Verbrennungswärme von Hydrazin in Sauerstoff (Luft) beträgt 19,41 MJ/kg (8345 BTU/lb). ⓘ
Hydrazin ist ein geeignetes Reduktionsmittel, da die Nebenprodukte in der Regel Stickstoffgas und Wasser sind. Diese Eigenschaft macht es zu einem nützlichen Antioxidationsmittel, einem Sauerstofffänger und einem Korrosionsschutzmittel in Wasserkesseln und Heizungssystemen. Es wird auch zur Reduktion von Metallsalzen und -oxiden zu reinen Metallen bei der stromlosen Vernickelung und der Plutoniumextraktion aus Kernreaktorabfällen verwendet. Bei einigen farbfotografischen Verfahren wird eine schwache Hydrazinlösung auch als Stabilisierungswaschmittel verwendet, da es Farbstoffkuppler und nicht umgesetzte Silberhalogenide abfängt. Hydrazin ist das gebräuchlichste und wirksamste Reduktionsmittel für die Umwandlung von Graphenoxid (GO) in reduziertes Graphenoxid (rGO) durch hydrothermale Behandlung. ⓘ
Hydrazinium-Salze
Hydrazin kann durch Behandlung mit Mineralsäuren monoprotoniert werden, um verschiedene feste Salze des Hydraziniumkations (N2H5+) zu bilden. Ein gängiges Salz ist Hydraziniumsulfat, [N2H5]HSO4, auch Hydrazinsulfat genannt. Hydrazinsulfat wurde als Mittel zur Behandlung von krebsbedingter Kachexie untersucht, erwies sich jedoch als unwirksam. ⓘ
Durch doppelte Protonierung entsteht das Hydraziniumdikation (H3NNH32+), von dem verschiedene Salze bekannt sind. ⓘ
Organische Chemie
Hydrazine sind Bestandteil zahlreicher organischer Synthesen, die häufig in der Pharmazie von praktischer Bedeutung sind (siehe Abschnitt Anwendungen), aber auch in Textilfarbstoffen und in der Fotografie. ⓘ
Hydrazin wird bei der Wolff-Kishner-Reduktion eingesetzt, einer Reaktion, bei der die Carbonylgruppe eines Ketons über ein Hydrazon-Zwischenprodukt in eine Methylenbrücke (oder ein Aldehyd in eine Methylgruppe) umgewandelt wird. Die Produktion des hochstabilen Distickstoffs aus dem Hydrazinderivat hilft, die Reaktion voranzutreiben. ⓘ
Aufgrund seiner Bifunktionalität mit zwei Aminen ist Hydrazin ein wichtiger Baustein für die Herstellung vieler heterocyclischer Verbindungen durch Kondensation mit einer Reihe von difunktionellen Elektrophilen. Mit 2,4-Pentandion kondensiert es zum 3,5-Dimethylpyrazol. In der Einhorn-Brunner-Reaktion reagieren Hydrazine mit Imiden zu Triazolen. ⓘ
Da N2H4 ein gutes Nukleophil ist, kann es Sulfonylhalogenide und Acylhalogenide angreifen. Das Tosylhydrazin bildet auch Hydrazone, wenn es mit Carbonylgruppen behandelt wird. ⓘ
Hydrazin wird zur Spaltung von N-alkylierten Phthalimidderivaten verwendet. Durch diese Spaltungsreaktion kann das Phthalimidanion als Aminvorläufer in der Gabriel-Synthese verwendet werden. ⓘ
Bildung von Hydrazonen
Ein Beispiel für die Kondensation von Hydrazin mit einer einfachen Carbonylgruppe ist die Reaktion mit Propanon zum Diisopropylidenhydrazin (Acetonazin). Letzteres reagiert weiter mit Hydrazin, um das Hydrazon zu bilden:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{[(CH3)2C=N]2 + N2H4 -> 2 (CH3)2C=NNH2 <span title="Aus: Englische Wikipedia, Abschnitt "Hydrazone formation"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrazine#Hydrazone_formation <span style="color:#dddddd">ⓘ</span>]</span>}}
Das Propanonazin ist ein Zwischenprodukt im Atofina-PCUK-Verfahren. Die direkte Alkylierung von Hydrazinen mit Alkylhalogeniden in Gegenwart von Basen führt zu alkylsubstituierten Hydrazinen, aber die Reaktion ist in der Regel ineffizient, da sich der Substitutionsgrad nur schlecht kontrollieren lässt (wie bei gewöhnlichen Aminen). Die Reduktion von Hydrazonen zu Hydrazinen stellt eine saubere Methode zur Herstellung von 1,1-dialkylierten Hydrazinen dar. ⓘ
In einer verwandten Reaktion reagieren 2-Cyanopyridine mit Hydrazin unter Bildung von Amidhydraziden, die mit 1,2-Diketonen in Triazine umgewandelt werden können. ⓘ
Biochemie
Hydrazin ist das Zwischenprodukt bei der anaeroben Oxidation von Ammoniak (Anammox). Es wird von einigen Hefen und dem Hochseebakterium Anammox (Brocadia anammoxidans) produziert. Die Scheinmorchel produziert das Gift Gyromitrin, ein organisches Derivat von Hydrazin, das durch Stoffwechselprozesse in Monomethylhydrazin umgewandelt wird. Auch der beliebteste Speisepilz Agaricus bisporus produziert organische Hydrazinderivate, darunter Agaritin, ein Hydrazinderivat einer Aminosäure, und Gyromitrin. ⓘ
Geschichte
Der Name "Hydrazin" wurde 1875 von Emil Fischer geprägt, der versuchte, organische Verbindungen herzustellen, die aus monosubstituiertem Hydrazin bestanden. Bereits 1887 hatte Theodor Curtius Hydrazinsulfat durch Behandlung organischer Diazide mit verdünnter Schwefelsäure hergestellt, konnte aber trotz wiederholter Versuche kein reines Hydrazin gewinnen. Reines wasserfreies Hydrazin wurde erstmals von dem niederländischen Chemiker Lobry de Bruyn im Jahr 1895 hergestellt. ⓘ
Herstellung
Im Labor
- Durch Einleiten von Chlor in eine 20%ige Harnstofflösung und anschließender Zugabe von 20%iger Natronlauge. Die Ausbeute liegt bei etwa 50 %.
- Der mechanistische Ablauf ist derselbe wie der der Hofmann-Umlagerung: Zuerst Bildung des Amidat-Ions durch Deprotonierung, dann elektrophile Halogenierung des Amidat-Ions, gefolgt von der zweiten Deprotonierung. Das Chloramidation zerfällt spontan zum Acylnitren und einem Chloridion. Das Acylnitren lagert sich zum Isocyanat um, welches unter Addition von Wasser die unbeständige Carbamidsäure liefert, die dann zu Kohlendioxid und Hydrazin zerfällt. Das entstandene Kohlendioxid wird unter Bildung von Natriumcarbonat von der Natronlauge aufgenommen.
- Harnstoff, Chlor und Natriumhydroxidlösung reagieren zu Hydrazin, Natriumcarbonat und Natriumchlorid. ⓘ
- Das Monohydrat kann ebenfalls aus trockenem Hydraziniumsulfat und Kaliumhydroxid durch Zugabe von Wasser und anschließender Destillation in einer Ausbeute von 25 % der Theorie erhalten werden:
- Zu 99,5 % wasserfreies Hydrazin entsteht bei der fraktionierten Destillation des Monohydrats mit Natriumhydroxid im Stickstoffstrom.
- Eine weitere Möglichkeit zur Herstellung trockenen Hydrazins ist die Freisetzung von Hydrazin aus Hydrazinium-Salzen durch Zugabe der stärkeren Base Ammoniak als Säurebinder:
Eigenschaften
Reines Hydrazin kann beim Erhitzen explosionsartig zu Ammoniak und Stickstoff disproportionieren. Die Reaktion verläuft mit einer Reaktionswärme von −123,3 kJ·mol−1 bzw. −4128 kJ·kg−1 stark exotherm. ⓘ
Konzentrierte Lösungen sind in Verbindung mit Oxidationsmitteln hochexplosiv, teilweise hypergol. Hydrazin kann auch katalytisch zersetzt werden; dies wird in der Technik angewandt, z. B. in Korrektur- oder Nottriebwerken. ⓘ
Die Verbindung bildet mit Wasser ein Azeotrop mit einem Hydrazin-Gehalt von 58,5 %, das bei 120,5 °C siedet. ⓘ
Säure-/Baseverhalten
Hydrazin ist eine zweiwertige Base (pKb1 = 6,07; pKb2 = 15), jedoch schwächer als Ammoniak pKb = 4,75). Es reagiert als zweiwertige Base mit Säuren zu zwei Reihen von Hydraziniumsalzen (Name analog zum Ammonium) mit der allgemeinen Zusammensetzung [H2N–NH3]+X− und [H3N–NH3]2+2X−. Mit Salzsäure bildet sich Hydraziniummonochlorid ([H2N–NH3]Cl) und Hydraziniumdichlorid ([H3N–NH3]Cl2). Mit Schwefelsäure bildet sich Hydraziniumsulfat ([H3N–NH3]SO4) und Dihydraziniumsulfat ([H2N-NH3]2SO4. ⓘ
Gegenüber sehr starken Basen (pKb ≪ 0) fungiert Hydrazin auch als Säure. So kann durch Reaktion von Natriumhydrid oder Natriumamid mit Hydrazin äußerst oxidationsempfindliches Natriumhydrazid erhalten werden, in welchem Hydrazid-Anionen vorliegen (N2H3−). Umgekehrt reagieren Hydrazid-Ionen mit Wasser praktisch vollständig zu Hydroxid-Ionen und Hydrazin. ⓘ
Verwendung
Energielieferant (Brennstoff, Antriebsmittel)
Monotreibmittel für Schubdüsen, Notenergieaggregate und Auftauchsysteme
Hydrazin wird in Korrekturtriebwerken verwendet, wo es katalytisch in einer stark exothermen Reaktion in gasförmigen Stickstoff und Wasserstoff zersetzt wird, zum Beispiel auch bei den Voyager-Sonden. Nach Firmenangaben aus dem Jahr 2018 arbeiten über 500 hydrazinbetriebene Schubdüsen im Weltraum, und auch in der Ariane 5 kommen sie zum Einsatz. ⓘ
In einstrahligen Flugzeugen wie der F-16 wird Hydrazin als Treibstoff für ein Notenergieaggregat mitgeführt. ⓘ
In U-Booten, z. B. in der U-Boot-Klasse 214, wird ein Hydrazinzersetzer als integrale Komponente eines Rettungssystems verwendet, das RESUS (REscue system for SUbmarineS) genannt wird und das mit Hilfe des Stickstoffdrucks auch dann ein Auftauchen des U-Boots ermöglicht, wenn andere Systeme versagt haben. ⓘ
Chemie
Korrosionsinhibitor
Verdünnte Hydrazin-Lösungen werden auch als Reagenzien im Labor sowie zur Deoxigenierung (Befreiung von Sauerstoff) von Kesselspeisewasser in Dampfkraftwerken eingesetzt. Die Verwendung erfolgt sowohl für die Entfernung des Restsauerstoffes nach Speisewasserentgasung, zum Schutz gegen mögliche geringe Sauerstoffeinbrüche im Bereich des Kondensators wie auch für die katalytische Sauerstoffentfernung aus dem Zusatzwasser. Der Vorteil von Hydrazin ist, dass nur Stickstoff und Wasser bei dieser Reaktion entstehen. Neben der Deoxigenierung wird auch eine Anhebung des pH-Wertes im Wasser-Dampf-Kreislauf erreicht. ⓘ
Umweltgefahren

Hydrazin wird als lagerbarer Treibstoff in vielen Raketen, Satelliten und Raumsonden verwendet. Dies kann zu einer erheblichen Umweltgefahr führen, wenn ein Raketenstart misslingt. Hat ein Satellit bereits eine Umlaufbahn erreicht, ist es aufgrund der hohen Geschwindigkeit von mindestens acht Kilometern pro Sekunde und der ungünstigen aerodynamischen Verhältnisse bei den kugelförmigen Tanks praktisch ausgeschlossen, dass diese auf den Erdboden aufschlagen, da sie aufgrund der hohen kinetischen Energie in der Atmosphäre verglühen. Das Hydrazin zersetzt sich dabei. ⓘ
Bei der Challenger-Katastrophe wurde keine Hydrazin-Kontamination festgestellt. Nach einer erfolgreichen Shuttle-Landung war stets eine der ersten Sicherheitsmaßnahmen, den stehenden Orbiter auf austretendes Hydrazin zu untersuchen. Erst wenn dieser Test negativ ausfiel, durften sich weitere Hilfsfahrzeuge, etwa zur Kühlung, dem Shuttle nähern. ⓘ
Bei der Columbia-Katastrophe im Jahre 2003 wurde vor einer möglichen Hydrazin-Kontamination von der NASA in den Medien gewarnt, und tatsächlich wurde ein weitgehend intakter Hydrazin-Tank der Columbia im Jahr 2011 gefunden. ⓘ
Der Abschuss des amerikanischen USA-193-Satelliten wurde in den Medien mit der Gefährdung durch das an Bord befindliche Hydrazin begründet. ⓘ
Sicherheitshinweise
Hydrazin ist sehr giftig, im Tierversuch krebserzeugend und wirkt hochtoxisch auf Wasserorganismen. Hydrazin wird auch über die Haut resorbiert. Hydrazin hat eine Akzeptanzkonzentration von 1,7 ppb und eine Toleranzkonzentration von 17 ppb nach TRGS 910. ⓘ
Die Verwendung von Hydrazin in Wasser-Dampf-Systemen (Dampfkesselanlagen und Fernwärmesystemen) unterliegt bereits seit 1991 strengen Vorschriften, die in der TRGS 608 definiert sind. So ist z. B. die direkte Trinkwassererwärmung bei Fernwärmesystemen, die mit Hydrazin konditioniert sind, nicht zulässig, sondern es muss ein Zweikreissystem installiert werden. ⓘ
Hydrazin ist seit Juni 2011 wegen des Verdachts auf krebserregender Wirkung in die SVHC-Kandidatenliste (Liste besonders besorgniserregender Stoffe) aufgenommen. Dies hat zunächst nur Auswirkungen auf besondere Informationspflichten in der Lieferkette. ⓘ






![{\displaystyle {\ce {N2H4 + H2O -> [N2H5]^+ + OH-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ef02d7cc8519ded31bae36408d7f1461c64195b7)


![{\displaystyle {\ce {[N2H5]+ + H2O -> [N2H6]^2+ + OH-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58d05df88d00c82f17bb6b59cf2a7d07696dc980)


![{\displaystyle {\ce {2 (CH3)2CO + N2H4 -> 2 H2O + [(CH3)2C=N]2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8036d601adcf4a13ee6b912eb05bc55994ab952a)




