Steroide
Ein Steroid ist eine biologisch aktive organische Verbindung mit vier Ringen, die in einer bestimmten Molekülkonfiguration angeordnet sind. Steroide haben zwei biologische Hauptfunktionen: als wichtige Bestandteile von Zellmembranen, die die Membranfluidität verändern, und als Signalmoleküle. Hunderte von Steroiden sind in Pflanzen, Tieren und Pilzen zu finden. Alle Steroide werden in den Zellen aus den Sterolen Lanosterol (Opisthokonten) oder Cycloartenol (Pflanzen) hergestellt. Lanosterin und Cycloartenol entstehen durch die Zyklisierung des Triterpens Squalen. ⓘ
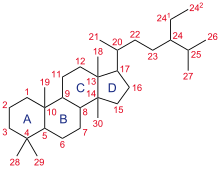
Die Kernstruktur der Steroide besteht in der Regel aus 17 Kohlenstoffatomen, die in vier "verschmolzenen" Ringen gebunden sind: drei sechsgliedrige Cyclohexanringe (Ringe A, B und C in der ersten Abbildung) und ein fünfgliedriger Cyclopentanring (der Ring D). Steroide unterscheiden sich durch die funktionellen Gruppen, die an diesen Vierringkern gebunden sind, und durch den Oxidationszustand der Ringe. Sterole sind Formen von Steroiden mit einer Hydroxygruppe an Position drei und einem von Cholestan abgeleiteten Gerüst. Steroide können auch radikaler modifiziert werden, z. B. durch Veränderung der Ringstruktur, indem einer der Ringe durchtrennt wird. Durch Schneiden des Rings B entstehen Sekosteroide, darunter Vitamin D3. ⓘ
Beispiele sind das Lipid Cholesterin, die Sexualhormone Estradiol und Testosteron und das entzündungshemmende Medikament Dexamethason. ⓘ
Steroide (griechisch στερεοειδές, von στερεός stereós, deutsch ‚fest‘ und dem Adjektivsuffix -id, Latinisierung von altgriechisch -ειδής -eidḗs „[dem Hauptwort] ähnlich“, von εἶδος eîdos „Erscheinung, Gestalt, Art“) sind eine Stoffklasse der Lipide (Moleküle mit lipophilen Gruppen, in der Regel wasserunlöslich). Formal sind die Steroide Derivate des Kohlenwasserstoffs Steran (Cyclopentanoperhydrophenanthren). Steroide gehören zu den Isoprenoiden, genauer zu den Triterpenoiden. ⓘ
Natürliche Steroide kommen in Tieren, Pflanzen und Pilzen vor; viele werden im glatten Endoplasmatischen Retikulum synthetisiert. Ihre biochemischen Aufgaben reichen von der Herstellung von Vitaminen und Sexualhormonen (Androgene beim Mann beziehungsweise Estrogene bei der Frau) über Gallensäure und Krötengifte bis zu den herzaktiven Giften von Digitalis und Oleander. ⓘ
Der Name der Stoffklasse leitet sich ab vom ersten bekannten Steroid, dem Cholesterin. In Tieren und im menschlichen Organismus stellt Cholesterin das wichtigste Steroid dar; Pflanzen enthalten es dagegen nur in geringer Menge. Aus Cholesterin werden Lipoproteine und Steroidhormone aufgebaut, z. B. die Hormone der Nebennierenrinde (Corticosteroide). Künstliche Derivate des zu den Steroiden zählenden männlichen Sexualhormons Testosteron, die Anabolika, werden als Muskelaufbaupräparate verwendet und sind daher auch als Dopingmittel bekannt. ⓘ
Die Totalsynthese von Steroiden gelang zuerst 1939 bei Equilenin und 1948 bei Estron, beides aromatische Steroide. Bei den nicht-aromatischen Steroiden wie Cholesterin, Cortison gelang der Durchbruch unabhängig 1951 den Gruppen von Robert B. Woodward in den USA und Robert Robinson in England. ⓘ
Nomenklatur


Gonan, auch bekannt als Steran oder Cyclopentanoperhydrophenanthren, das einfachste Steroid und der Kern aller Steroide und Sterole, besteht aus siebzehn Kohlenstoffatomen in Kohlenstoff-Kohlenstoff-Bindungen, die vier verschmolzene Ringe in einer dreidimensionalen Form bilden. Die drei Cyclohexanringe (A, B und C in der ersten Abbildung) bilden das Gerüst eines Perhydroderivats des Phenanthrens. Der Ring D hat eine Cyclopentan-Struktur. Wenn die beiden Methylgruppen und die acht Kohlenstoff-Seitenketten (an C-17, wie bei Cholesterin gezeigt) vorhanden sind, spricht man von einem Cholestan-Gerüst des Steroids. Die beiden gebräuchlichen 5α- und 5β-Stereoisomere von Steroiden entstehen aufgrund von Unterschieden in der Seite des weitgehend planaren Ringsystems, an der das Wasserstoffatom (H) an Kohlenstoff 5 gebunden ist, was zu einer Änderung der Steroid-A-Ring-Konformation führt. Durch Isomerisierung an der C-21-Seitenkette entsteht eine parallele Reihe von Verbindungen, die als Isosteroide bezeichnet werden. ⓘ
Beispiele für Steroidstrukturen sind:
Testosteron, das wichtigste männliche Sexualhormon und ein anaboles Steroid
Dexamethason, ein synthetisches Kortikosteroid-Medikament
Progesteron, ein Steroidhormon, das am weiblichen Menstruationszyklus, der Schwangerschaft und der Embryogenese beteiligt ist
β-Sitosterol, ein Pflanzen- oder Phytosterol, mit einer vollständig verzweigten Kohlenwasserstoffseitenkette an C-17 und einer Hydroxylgruppe an C-3 ⓘ
Zusätzlich zu den Ringspaltungen, Expansionen und Kontraktionen (Spaltung und Wiederverschließung zu einem größeren oder kleineren Ring) - alles Variationen im Kohlenstoff-Kohlenstoff-Bindungsgerüst - können Steroide auch variieren:
- in der Reihenfolge der Bindungen innerhalb der Ringe,
- in der Anzahl der Methylgruppen, die an den Ring (und, falls vorhanden, an die markante Seitenkette an C17) gebunden sind,
- in den funktionellen Gruppen, die an die Ringe und die Seitenkette gebunden sind, und
- in der Konfiguration der Gruppen, die an die Ringe und die Kette gebunden sind.
Beispielsweise haben Sterole wie Cholesterin und Lanosterin eine Hydroxylgruppe an der Position C-3, während Testosteron und Progesteron einen Carbonylrest (Oxosubstituenten) an C-3 haben; von diesen hat Lanosterin allein zwei Methylgruppen an C-4 und Cholesterin (mit einer C-5- bis C-6-Doppelbindung) unterscheidet sich von Testosteron und Progesteron (die eine C-4- bis C-5-Doppelbindung haben). ⓘ
 Cholesterin, ein prototypisches tierisches Sterin. Dieses strukturelle Lipid ist eine wichtige Vorstufe der Steroidbiosynthese. |
ⓘ |
Verteilung und Funktion der Arten
Bei Eukaryoten kommen Steroide in Pilzen, Tieren und Pflanzen vor. ⓘ
Pilzliche Steroide
Zu den Pilzsteroiden gehören die Ergosterole, die an der Aufrechterhaltung der Integrität der Zellmembran von Pilzen beteiligt sind. Verschiedene Antimykotika, wie Amphotericin B und Azol-Antimykotika, nutzen diese Information, um pathogene Pilze abzutöten. Pilze können ihren Ergosterol-Gehalt verändern (z. B. durch Funktionsverlust-Mutationen in den Enzymen ERG3 oder ERG6, die zu einer Verarmung an Ergosterol führen, oder durch Mutationen, die den Ergosterol-Gehalt verringern), um eine Resistenz gegen Medikamente zu entwickeln, die auf Ergosterol abzielen. Ergosterin ist vergleichbar mit dem Cholesterin, das in den Zellmembranen von Tieren (einschließlich Menschen) vorkommt, oder den Phytosterinen, die in den Zellmembranen von Pflanzen vorkommen. Alle Pilze enthalten große Mengen an Ergosterin, die im Bereich von zehn bis hundert Milligramm pro 100 Gramm Trockengewicht liegen. Für die Synthese von Ergosterin in Pilzen ist Sauerstoff erforderlich. Ergosterol ist für den Vitamin-D-Gehalt in Pilzen verantwortlich; Ergosterol wird durch Einwirkung von ultraviolettem Licht chemisch in Provitamin D2 umgewandelt. Provitamin D2 bildet spontan Vitamin D2. Allerdings verwenden nicht alle Pilze Ergosterin in ihren Zellmembranen; die pathogene Pilzart Pneumocystis jirovecii beispielsweise tut dies nicht, was wichtige klinische Auswirkungen hat (angesichts des Wirkmechanismus vieler Antimykotika). Beim Pilz Saccharomyces cerevisiae sind andere wichtige Steroide Ergosta-5,7,22,24(28)-tetraen-3β-ol, Zymosterin und Lanosterin. S. cerevisiae verwendet 5,6-Dihydroergosterin anstelle von Ergosterin in seiner Zellmembran. ⓘ
Tierische Steroide
Zu den tierischen Steroiden gehören Verbindungen, die von Wirbeltieren und Insekten stammen, darunter auch Ecdysteroide wie Ecdysteron (das bei einigen Arten die Häutung steuert). Zu den Wirbeltieren gehören Steroidhormone und Cholesterin; letzteres ist ein struktureller Bestandteil von Zellmembranen, der die Fluidität der Zellmembranen mitbestimmt und ein Hauptbestandteil von Plaque ist (der in die Atherosklerose involviert ist). Zu den Steroidhormonen gehören:
- Sexualhormone, die die Geschlechtsunterschiede beeinflussen und die Fortpflanzung unterstützen. Dazu gehören Androgene, Östrogene und Gestagene.
- Kortikosteroide, einschließlich der meisten synthetischen Steroidmedikamente, mit den natürlichen Produktklassen der Glukokortikoide (die viele Aspekte des Stoffwechsels und der Immunfunktion regulieren) und der Mineralokortikoide (die zur Aufrechterhaltung des Blutvolumens beitragen und die renale Ausscheidung von Elektrolyten kontrollieren)
- natürliche und synthetische anabole Steroide, die mit Androgenrezeptoren interagieren, um die Muskel- und Knochensynthese zu steigern. Im allgemeinen Sprachgebrauch bezieht sich der Begriff "Steroide" oft auf anabole Steroide. ⓘ
Pflanzliche Steroide
Zu den pflanzlichen Steroiden gehören die steroidalen Alkaloide der Nachtschattengewächse (Solanaceae) und der Melanthiaceae (insbesondere der Gattung Veratrum), die Herzglykoside, die Phytosterine und die Brassinosteroide (zu denen mehrere Pflanzenhormone gehören). ⓘ
Prokaryonten
In Prokaryonten gibt es Biosynthesewege für das tetrazyklische Steroidgerüst (z. B. in Mykobakterien) - wo sein Ursprung in Eukaryonten vermutet wird - und das häufigere pentazyklische Triterpinoid-Hopanoidgerüst. ⓘ
Arten
Nach Funktion
Die wichtigsten Klassen von Steroidhormonen, mit prominenten Mitgliedern und Beispielen für verwandte Funktionen, sind:
- Kortikosteroide:
- Glukokortikoide:
- Cortisol, ein Glucocorticoid, zu dessen Funktionen die Immunsuppression gehört
- Mineralokortikoide:
- Aldosteron, ein Mineralokortikoid, das über den Wasser- und Elektrolythaushalt zur Regulierung des Blutdrucks beiträgt
- Glukokortikoide:
- Sexualsteroide:
- Gestagene:
- Progesteron, das die zyklischen Veränderungen in der Gebärmutterschleimhaut reguliert und eine Schwangerschaft aufrechterhält
- Androgene:
- Testosteron, das zur Entwicklung und Aufrechterhaltung der männlichen sekundären Geschlechtsmerkmale beiträgt
- Östrogene:
- Gestagene:
Weitere Klassen von Steroiden sind:
- Neurosteroide wie DHEA und Allopregnanolon
- Gallensäuren wie Taurocholsäure
- Aminosteroide neuromuskuläre Blocker (hauptsächlich synthetisch) wie Pancuroniumbromid
- Steroidale Antiandrogene (hauptsächlich synthetisch) wie Cyproteronacetat
- Steroidogenese-Inhibitoren (hauptsächlich exogen) wie Alfatradiol
- Membransterole wie Cholesterin, Ergosterol und verschiedene Phytosterole
- Toxine wie steroidale Saponine und Cardenolide/Herzglykoside ⓘ
sowie die folgende Klasse von Secosteroiden (Steroide mit offenem Ring):
- Vitamin D-Formen wie Ergocalciferol, Cholecalciferol und Calcitriol ⓘ
Nach Struktur
Intaktes Ringsystem
Steroide können auf der Grundlage ihrer chemischen Zusammensetzung klassifiziert werden. Ein Beispiel dafür, wie MeSH diese Klassifizierung vornimmt, finden Sie im MeSH-Katalog von Wikipedia. Beispiele für diese Klassifizierung sind:
| Klasse | Beispiel | Anzahl der Kohlenstoffatome ⓘ |
|---|---|---|
| Cholestane | Cholesterin | 27 |
| Cholane | Cholsäure | 24 |
| Schwangere | Progesteron | 21 |
| Androstane | Testosteron | 19 |
| Östrogene | Estradiol | 18 |
In der Biologie ist es üblich, die oben genannten Steroidklassen nach der Anzahl der vorhandenen Kohlenstoffatome zu benennen, wenn es sich um Hormone handelt: C18-Steroide für die Estrane (meist Östrogene), C19-Steroide für die Androstane (meist Androgene) und C21-Steroide für die Pregnane (meist Kortikosteroide). Die Klassifizierung "17-Ketosteroid" ist auch in der Medizin von Bedeutung. ⓘ
Das Gonan (Steroidkern) ist das tetrazyklische Kohlenwasserstoffmolekül mit 17 Kohlenstoffatomen ohne Alkylseitenketten. ⓘ
Gespaltene, kontrahierte und erweiterte Ringe
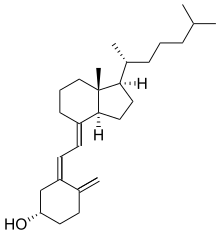
Secosteroide (lateinisch seco, "schneiden") sind eine Unterklasse von Steroidverbindungen, die biosynthetisch oder konzeptionell aus der Spaltung von Stammsteroidringen (im Allgemeinen einem der vier) hervorgehen. Die wichtigsten Secosteroid-Unterklassen werden durch die Steroid-Kohlenstoffatome definiert, an denen diese Spaltung stattgefunden hat. Das prototypische Secosteroid Cholecalciferol, Vitamin D3 (siehe Abbildung), gehört beispielsweise zur Unterklasse der 9,10-Secosteroide und entsteht durch die Spaltung der Kohlenstoffatome C-9 und C-10 des Steroid-B-Rings; 5,6-Secosteroide und 13,14-Steroide sind ähnlich. ⓘ
Norsteroide (nor-, L. norma; in der Chemie "normal", was auf die Entfernung von Kohlenstoff hinweist) und Homosteroide (homo-, griechisch homos; "gleich", was auf die Hinzufügung von Kohlenstoff hinweist) sind strukturelle Unterklassen von Steroiden, die durch biosynthetische Schritte entstehen. Erstere umfassen enzymatische Ringerweiterungs- und -zusammenziehungsreaktionen, letztere werden (biomimetisch) oder (häufiger) durch Ringschlüsse von azyklischen Vorläufern mit mehr (oder weniger) Ringatomen als das Stammsteroidgerüst erreicht. ⓘ
Kombinationen dieser Ringveränderungen sind in der Natur bekannt. So nehmen beispielsweise Schafe, die Maislilien grasen, Cyclopamin (im Bild) und Veratramin auf, zwei Vertreter einer Unterfamilie von Steroiden, bei denen die C- und D-Ringe durch eine biosynthetische Migration des ursprünglichen C-13-Atoms kontrahiert bzw. erweitert werden. Die Einnahme dieser C-nor-D-Homosteroide führt bei Lämmern zu Geburtsfehlern: Cyclopie durch Cyclopamin und Beindeformität durch Veratramin. Ein weiteres C-nor-D-Homosteroid (Nakiterpiosin) wird von okinawanischen Cyanobakterienschwämmen (z. B. Terpios hoshinota) ausgeschieden, was zum Absterben von Korallen aufgrund der Schwarzkorallenerkrankung führt. Steroide vom Nakiterpiosin-Typ wirken gegen den Signalweg, an dem die Smoothened- und Hedgehog-Proteine beteiligt sind, ein Weg, der bei einer Reihe von Krebsarten hyperaktiv ist. ⓘ
Biologische Bedeutung
Steroide und ihre Metaboliten fungieren häufig als Signalmoleküle (die bekanntesten Beispiele sind Steroidhormone), und Steroide und Phospholipide sind Bestandteile von Zellmembranen. Steroide wie Cholesterin verringern die Membranfluidität. Ähnlich wie Lipide sind auch Steroide hochkonzentrierte Energiespeicher. Sie sind jedoch keine typischen Energiequellen; bei Säugetieren werden sie normalerweise verstoffwechselt und ausgeschieden. ⓘ
Steroide spielen bei einer Reihe von Erkrankungen eine entscheidende Rolle, darunter auch bei bösartigen Erkrankungen wie Prostatakrebs, wo die Steroidproduktion innerhalb und außerhalb des Tumors die Aggressivität der Krebszellen fördert. ⓘ
Biosynthese und Stoffwechsel

Die Hunderte von Steroiden, die in Tieren, Pilzen und Pflanzen vorkommen, werden aus Lanosterin (in Tieren und Pilzen; siehe Beispiele oben) oder Cycloartenol (in anderen Eukaryoten) gebildet. Sowohl Lanosterin als auch Cycloartenol entstehen durch Zyklisierung des Triterpenoids Squalen. Lanosterin und Cycloartenol werden manchmal als Protosterole bezeichnet, weil sie als Ausgangsverbindungen für alle anderen Steroide dienen. ⓘ
Die Steroidbiosynthese ist ein anaboler Stoffwechselweg, bei dem Steroide aus einfachen Vorläufersubstanzen hergestellt werden. Bei Tieren wird ein einzigartiger Biosyntheseweg verfolgt (im Vergleich zu vielen anderen Organismen), was diesen Weg zu einem häufigen Ziel für Antibiotika und andere Antiinfektionsmittel macht. Der Steroidstoffwechsel beim Menschen ist auch das Ziel von cholesterinsenkenden Medikamenten wie Statinen. Beim Menschen und anderen Tieren erfolgt die Biosynthese von Steroiden über den Mevalonatweg, der Acetyl-CoA als Bausteine für Dimethylallyldiphosphat (DMAPP) und Isopentenyldiphosphat (IPP) verwendet. ⓘ
In weiteren Schritten konjugieren DMAPP und IPP zu Farnesyldiphosphat (FPP), das wiederum miteinander konjugiert, um das lineare Triterpenoid Squalen zu bilden. Die Squalen-Biosynthese wird durch die Squalen-Synthase katalysiert, die zur Familie der Squalen/Phytoen-Synthasen gehört. Durch anschließende Epoxidierung und Zyklisierung von Squalen entsteht Lanosterin, das der Ausgangspunkt für weitere Modifikationen zu anderen Steroiden ist (Steroidogenese). In anderen Eukaryonten ist das Cyclisierungsprodukt von epoxidiertem Squalen (Oxidosqualen) Cycloartenol. ⓘ
Mevalonat-Stoffwechselweg

Der Mevalonatweg (auch HMG-CoA-Reduktase-Weg genannt) beginnt mit Acetyl-CoA und endet mit Dimethylallyldiphosphat (DMAPP) und Isopentenyldiphosphat (IPP). ⓘ
DMAPP und IPP spenden Isopren-Einheiten, die zusammengesetzt und modifiziert werden, um Terpene und Isoprenoide zu bilden (eine große Klasse von Lipiden, zu denen auch die Carotinoide gehören und die die größte Klasse von pflanzlichen Naturprodukten bilden). In diesem Fall werden die Isopren-Einheiten zu Squalen zusammengefügt und zu einer Reihe von Ringen gefaltet, um Lanosterin zu bilden. Lanosterin kann dann in andere Steroide, wie Cholesterin und Ergosterin, umgewandelt werden. ⓘ
Zwei Medikamentenklassen zielen auf den Mevalonatweg ab: Statine (wie Rosuvastatin), die zur Senkung erhöhter Cholesterinwerte eingesetzt werden, und Bisphosphonate (wie Zoledronat), die zur Behandlung einer Reihe von knochendegenerativen Erkrankungen eingesetzt werden. ⓘ
Steroidogenese
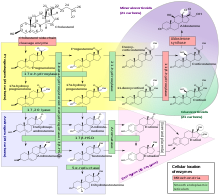
Die Steroidogenese ist der biologische Prozess, durch den Steroide aus Cholesterin gebildet und in andere Steroide umgewandelt werden. Die Wege der Steroidogenese unterscheiden sich von Art zu Art. Die wichtigsten Klassen von Steroidhormonen sind, wie oben erwähnt (mit ihren wichtigsten Mitgliedern und Funktionen), die Gestagene, Kortikosteroide (Kortikoide), Androgene und Östrogene. Die menschliche Steroidogenese dieser Klassen findet an verschiedenen Stellen statt:
- Gestagene sind die Vorläufer aller anderen menschlichen Steroide, und alle menschlichen Gewebe, die Steroide produzieren, müssen zunächst Cholesterin in Pregnenolon umwandeln. Diese Umwandlung ist der ratenlimitierende Schritt der Steroidsynthese, die im Mitochondrium des jeweiligen Gewebes stattfindet.
- Cortisol, Corticosteron, Aldosteron und Testosteron werden in der Nebennierenrinde gebildet.
- Estradiol, Estron und Progesteron werden hauptsächlich in den Eierstöcken gebildet, Estriol in der Plazenta während der Schwangerschaft und Testosteron hauptsächlich in den Hoden (ein Teil des Testosterons wird auch in der Nebennierenrinde produziert).
- Estradiol wird direkt aus Testosteron (bei Männern) oder über den primären Weg DHEA - Androstendion - Estron und sekundär über Testosteron (bei Frauen) umgewandelt.
- Stromazellen produzieren nachweislich Steroide als Reaktion auf Signale, die von Prostatakrebszellen mit Androgenmangel erzeugt werden.
- Einige Neuronen und Glia im zentralen Nervensystem (ZNS) exprimieren die Enzyme, die für die lokale Synthese von Pregnenolon, Progesteron, DHEA und DHEAS erforderlich sind, entweder de novo oder aus peripheren Quellen. ⓘ
| Geschlecht | Sexualhormon | Fortpflanzung Phase |
Blut Produktionsrate |
Keimdrüsen Sekretionsrate |
Stoffwechsel Clearance-Rate |
Referenzbereich (Serumspiegel) | |
|---|---|---|---|---|---|---|---|
| SI-Einheiten | Nicht-SI-Einheiten | ||||||
| Männer | Androstendion | –
|
2,8 mg/Tag | 1,6 mg/Tag | 2200 L/Tag | 2,8-7,3 nmol/L | 80-210 ng/dL |
| Testosteron | –
|
6,5 mg/Tag | 6,2 mg/Tag | 950 L/Tag | 6,9-34,7 nmol/L | 200-1000 ng/dL | |
| Estron | –
|
150 μg/Tag | 110 μg/Tag | 2050 L/Tag | 37-250 pmol/L | 10-70 pg/ml | |
| Estradiol | –
|
60 μg/Tag | 50 μg/Tag | 1600 L/Tag | <37-210 pmol/L | 10-57 pg/ml | |
| Estron-Sulfat | –
|
80 μg/Tag | Unbedeutend | 167 L/Tag | 600-2500 pmol/L | 200-900 pg/ml | |
| Frauen | Androstendion | –
|
3,2 mg/Tag | 2,8 mg/Tag | 2000 L/Tag | 3,1-12,2 nmol/L | 89-350 ng/dL |
| Testosteron | –
|
190 μg/Tag | 60 μg/Tag | 500 L/Tag | 0,7-2,8 nmol/L | 20-81 ng/dL | |
| Estron | Follikuläre Phase | 110 μg/Tag | 80 μg/Tag | 2200 L/Tag | 110-400 pmol/L | 30-110 pg/ml | |
| Lutealphase | 260 μg/Tag | 150 μg/Tag | 2200 L/Tag | 310-660 pmol/L | 80-180 pg/ml | ||
| Postmenopause | 40 μg/Tag | Unbedeutend | 1610 L/Tag | 22-230 pmol/L | 6-60 pg/ml | ||
| Estradiol | Follikuläre Phase | 90 μg/Tag | 80 μg/Tag | 1200 L/Tag | <37-360 pmol/L | 10-98 pg/ml | |
| Lutealphase | 250 μg/Tag | 240 μg/Tag | 1200 L/Tag | 699-1250 pmol/L | 190-341 pg/ml | ||
| Postmenopause | 6 μg/Tag | Unbedeutend | 910 L/Tag | <37-140 pmol/L | 10-38 pg/ml | ||
| Estron-Sulfat | Follikuläre Phase | 100 μg/Tag | Unbedeutend | 146 L/Tag | 700-3600 pmol/L | 250-1300 pg/ml | |
| Lutealphase | 180 μg/Tag | Unbedeutend | 146 L/Tag | 1100-7300 pmol/L | 400-2600 pg/ml | ||
| Progesteron | Follikuläre Phase | 2 mg/Tag | 1,7 mg/Tag | 2100 L/Tag | 0,3-3 nmol/L | 0,1-0,9 ng/ml | |
| Lutealphase | 25 mg/Tag | 24 mg/Tag | 2100 L/Tag | 19-45 nmol/L | 6-14 ng/ml | ||
Anmerkungen und Quellen
Anmerkungen: "Die Konzentration eines Steroids im Blutkreislauf wird durch die Geschwindigkeit bestimmt, mit der es von den Drüsen ausgeschieden wird, durch die Geschwindigkeit, mit der Vorläufer- oder Prähormone in das Steroid umgewandelt werden, und durch die Geschwindigkeit, mit der es von den Geweben extrahiert und metabolisiert wird. Die Sekretionsrate eines Steroids bezieht sich auf die Gesamtausscheidung der Verbindung aus einer Drüse pro Zeiteinheit. Die Sekretionsraten wurden durch die Entnahme von Proben aus dem venösen Ausfluss einer Drüse über einen bestimmten Zeitraum und durch Subtraktion der arteriellen und peripheren venösen Hormonkonzentration ermittelt. Die metabolische Clearance-Rate eines Steroids ist definiert als das Blutvolumen, das pro Zeiteinheit vollständig von dem Hormon abgebaut wurde. Die Produktionsrate eines Steroidhormons bezieht sich auf den Eintritt der Verbindung in das Blut aus allen möglichen Quellen, einschließlich der Sekretion aus Drüsen und der Umwandlung von Prohormonen in das Steroid von Interesse. Im Fließgleichgewicht ist die Menge des Hormons, die aus allen Quellen ins Blut gelangt, gleich der Rate, mit der es abgebaut wird (metabolische Clearance-Rate), multipliziert mit der Blutkonzentration (Produktionsrate = metabolische Clearance-Rate × Konzentration). Wenn der Prohormonstoffwechsel nur wenig zum zirkulierenden Steroidpool beiträgt, entspricht die Produktionsrate ungefähr der Sekretionsrate." Quellen: Siehe Vorlage. | |||||||
Alternative Stoffwechselwege
In Pflanzen und Bakterien verwendet der Nicht-Mevalonat-Stoffwechselweg (MEP-Stoffwechselweg) Pyruvat und Glyceraldehyd-3-Phosphat als Substrate zur Herstellung von IPP und DMAPP. ⓘ
Bei Krankheiten können auch Wege genutzt werden, die bei gesunden Menschen keine Rolle spielen. Beispielsweise führt bei einer Form der kongenitalen Nebennierenhyperplasie ein Mangel im Enzymweg der 21-Hydroxylase zu einem Überschuss an 17α-Hydroxyprogesteron (17-OHP) - dieser pathologische Überschuss an 17-OHP kann wiederum in Dihydrotestosteron (DHT, ein starkes Androgen) umgewandelt werden, unter anderem durch 17,20-Lyase (ein Mitglied der Cytochrom-P450-Enzymfamilie), 5α-Reduktase und 3α-Hydroxysteroid-Dehydrogenase. ⓘ
Katabolismus und Ausscheidung
Steroide werden in erster Linie durch Cytochrom-P450-Oxidase-Enzyme, wie CYP3A4, oxidiert. Bei diesen Reaktionen wird Sauerstoff in den Steroidring eingeführt, so dass das Cholesterin durch andere Enzyme in Gallensäuren aufgespalten werden kann. Diese Säuren können dann von der Leber mit der Galle ausgeschieden werden. Die Expression des Oxidase-Gens kann durch den Steroid-Sensor PXR hochreguliert werden, wenn eine hohe Steroidkonzentration im Blut vorliegt. Steroidhormone, denen die Seitenkette von Cholesterin und Gallensäuren fehlt, werden typischerweise an verschiedenen Ringpositionen hydroxyliert oder an der Position 17 oxidiert, mit Sulfat oder Glucuronsäure konjugiert und mit dem Urin ausgeschieden. ⓘ
Im Menschen werden die Steroide in der Leber durch Hydroxylierung und Konjugation mit Glycin oder Taurin wasserlöslich gemacht und als Gallensäuren über die Galle ins Duodenum (vorderer Teil des Dünndarms) ausgeschieden. ⓘ
Isolierung, Strukturbestimmung und Analysemethoden
Die Isolierung von Steroiden ist je nach Kontext die Isolierung von chemischem Material, das für die chemische Strukturaufklärung, die Derivatisierung oder die Abbauchemie, biologische Tests und andere Forschungszwecke benötigt wird (im Allgemeinen Milligramm bis Gramm, oft aber auch mehr), oder die Isolierung von "analytischen Mengen" der interessierenden Substanz (wobei der Schwerpunkt auf der Identifizierung und Quantifizierung der Substanz liegt (z. B. in biologischem Gewebe oder Flüssigkeit). Die isolierte Menge hängt von der Analysemethode ab, beträgt aber im Allgemeinen weniger als ein Mikrogramm. Die Methoden zur Isolierung der beiden Produktskalen sind unterschiedlich, umfassen jedoch Extraktion, Fällung, Adsorption, Chromatographie und Kristallisation. In beiden Fällen wird die isolierte Substanz bis zur chemischen Homogenität gereinigt; kombinierte Trenn- und Analysemethoden wie LC-MS werden so gewählt, dass sie orthogonal" sind, d. h. dass sie ihre Trennungen auf der Grundlage unterschiedlicher Wechselwirkungsmodi zwischen Substanz und isolierender Matrix durchführen, um eine einzige Spezies in der reinen Probe nachzuweisen. Die Strukturbestimmung bezieht sich auf die Methoden zur Bestimmung der chemischen Struktur eines isolierten reinen Steroids, wobei eine sich ständig weiterentwickelnde Palette chemischer und physikalischer Methoden eingesetzt wird, zu denen auch die NMR und die Kristallographie kleiner Moleküle gehören. Die Analysemethoden überschneiden sich mit den beiden oben genannten Bereichen, wobei der Schwerpunkt auf Analysemethoden liegt, mit denen festgestellt werden kann, ob ein Steroid in einem Gemisch vorhanden ist, und mit denen seine Menge bestimmt werden kann. ⓘ
Chemische Synthese
Der mikrobielle Abbau von Phytosterin-Seitenketten liefert C-19-Steroide, C-22-Steroide und 17-Ketosteroide (d. h. Vorstufen von Nebennierenrindenhormonen und Kontrazeptiva). Die Hinzufügung und Modifizierung funktioneller Gruppen ist der Schlüssel zur Herstellung der großen Vielfalt an Medikamenten, die innerhalb dieser chemischen Klassifizierung verfügbar sind. Diese Modifikationen werden durch konventionelle organische Synthese und/oder Biotransformationstechniken durchgeführt. ⓘ
Vorstufen
Semisynthese
Die Semisynthese von Steroiden beginnt oft mit Vorläufern wie Cholesterin, Phytosterinen oder Sapogeninen. Syntex, ein Unternehmen, das im mexikanischen Barbasco-Handel tätig war, verwendete Dioscorea mexicana zur Herstellung des Sapogenins Diosgenin in den Anfängen der pharmazeutischen Industrie für synthetische Steroide. ⓘ
Totalsynthese
Einige Steroidhormone werden wirtschaftlich nur durch Totalsynthese aus Petrochemikalien gewonnen (z. B. 13-Alkylsteroide). Das Arzneimittel Norgestrel beispielsweise wird aus Methoxy-1-tetralon hergestellt, einem petrochemischen Stoff, der aus Phenol gewonnen wird. ⓘ
Forschungspreise
Eine Reihe von Nobelpreisen wurde für die Steroidforschung verliehen, darunter:
- 1927 (Chemie) Heinrich Otto Wieland - Aufbau der Gallensäuren und Sterole und ihre Verbindung zu den Vitaminen
- 1928 (Chemie) Adolf Otto Reinhold Windaus - Aufbau der Sterine und ihr Zusammenhang mit den Vitaminen
- 1939 (Chemie) Adolf Butenandt und Leopold Ružička - Isolierung und Strukturuntersuchungen von steroiden Sexualhormonen und damit zusammenhängende Untersuchungen an höheren Terpenen
- 1950 (Physiologie oder Medizin) Edward Calvin Kendall, Tadeus Reichstein und Philip Hench - Struktur und biologische Wirkung von Nebennierenhormonen
- 1965 (Chemie) Robert Burns Woodward - Unter anderem für die Synthese von Cholesterin, Cortison und Lanosterin
- 1969 (Chemie) Derek Barton und Odd Hassel - Entwicklung des Konformationskonzepts in der Chemie unter besonderer Berücksichtigung des Steroidkerns
- 1975 (Chemie) Vladimir Prelog - unter anderem für die Entwicklung von Methoden zur Bestimmung des stereochemischen Verlaufs der Cholesterinbiosynthese aus Mevalonsäure über Squalen ⓘ
Struktur
Das Grundgerüst der Steroide ist das Steran. Eine strukturelle Gemeinsamkeit ist der Cyclopentanoperhydrophenanthren-Ring (Ausnahme: Vitamin D). Steroide haben eine starre Molekülgestalt, in der Regel einen relativ hohen Schmelzpunkt und lassen sich gut kristallisieren. Durch die asymmetrischen C-Atome an den Ringverknüpfungen sind zahlreiche Struktur-Isomere möglich, die unterschiedlich gefaltet sind. Nicht alle möglichen Faltungen kommen in der Natur vor. Nach allgemeiner Konvention dient die Position der Methylgruppe am Kohlenstoffatom 10 als Bezugspunkt für die systematische Namensgebung der Isomere: zu der Methylgruppe trans-ständige Substitutienten werden mit dem Index α (Alpha) bezeichnet, cis-ständige mit β (Beta). Bei Gallensäuren z. B. sind die Ringe A und B cis-verknüpft (90° Abwinklung), sie zählen zu den 5β-Androstanen. Steroidhormone sind an dieser Stelle dagegen trans-verknüpft (5α-Androstane). Nebengruppen werden abgekürzt (z. B. „-ol“ = Alkoholgruppe). Die Position von Doppelbindungen wird mit einem Δ (Delta) angegeben. Der systematische Name von Cholesterin ist z. B. Cholest-Δ5-en-3β-ol. ⓘ
Biosynthese der Steroidhormone

Die Biosynthese der Steroide gleicht zunächst in Grundzügen der Biosynthese der Terpene. Ein wichtiger Zwischenschritt führt zu Squalen, einem Triterpen. Lanosterol entsteht durch mehrere zyklische Verknüpfungen. Dieses Steroid mit Sterangrundgerüst liefert unter Abspaltung dreier Methylgruppen, Hydrierung und Isomerisierung Cholesterin. Über drei verschiedene Wege entstehen aus Cholesterin Aldosteron, Testosteron und Cortisol. Dies geschieht in der Nebennierenrinde und in den männlichen und weiblichen Gonaden (Hoden und Ovar). Im Ovar wird zunächst auch Testosteron (männliches Geschlechtshormon) produziert, das dann mit einer Aromatase (Enzym, das den Ring A des Steroidgerüstes zu einem Benzolring dehydriert) zu Estradiol umgebaut wird. Die Enzyme, welche die einzelnen Schritte vom Cholesterin zu den Steroidhormonen katalysieren, können durch Gendefekte gestört sein. Relativ häufig ist der 21-Hydroxylase-Mangel. Dieser führt zu einer Überproduktion von Geschlechtshormonen, da der Weg zum Cortisol und Aldosteron gestört ist. Die Krankheit nennt sich Adrenogenitales Syndrom. ⓘ
Einteilung
- Sterine (Sterole)
- Zoosterine (beispielsweise Cholesterin (Cholesterol))
- Phytosterine (beispielsweise Stigmasterin (Stigmasterol))
- Mycosterine (beispielsweise Ergosterin (Ergosterol))
- Gallensäuren (beispielsweise Cholsäure)
- Steroidhormone
- Glucocorticoide (beispielsweise Cortison, Cortisol)
- Mineralocorticoide (beispielsweise Aldosteron)
- Estrogene (beispielsweise Estron, Estradiol, Estriol)
- Gestagene (beispielsweise Progesteron, Pregnenolon)
- Androgene (beispielsweise Testosteron, Androsteron)
- Ecdysteroide (beispielsweise Ecdyson, Ecdysteron)
- herzwirksame Steroide (Aglykone der Herzglykoside)
- Cardenolide (beispielsweise Digoxigenin, Digitoxigenin, Gitoxigenin, Strophanthidin)
- Bufadienolide (beispielsweise Cillarenin, Hellebrigenin, Uzarigenin)
- Sapogenine (beispielsweise Digitogenin, Diosgenin)
- Steroidalkaloide (beispielsweise Solanidin, Tomatidin) ⓘ









