Azeotrop

Ein Azeotrop (/əˈziːəˌtroʊp/) oder ein Gemisch mit konstantem Erhitzungspunkt ist ein Gemisch aus zwei oder mehr Flüssigkeiten, dessen Anteile durch einfache Destillation nicht verändert werden können. Dies ist der Fall, wenn ein Azeotrop gekocht wird und der Dampf die gleichen Anteile an Bestandteilen aufweist wie das ungekochte Gemisch. Da ihre Zusammensetzung bei der Destillation unverändert bleibt, werden Azeotrope auch (vor allem in älteren Texten) als Gemische mit konstantem Siedepunkt bezeichnet. ⓘ
Einige azeotrope Gemische aus Paaren von Verbindungen sind bekannt, und viele Azeotrope aus drei oder mehr Verbindungen sind ebenfalls bekannt. In einem solchen Fall ist es nicht möglich, die Komponenten durch fraktionierte Destillation zu trennen. Es gibt zwei Arten von Azeotropen: Azeotrope mit minimalem Siedepunkt und Azeotrope mit maximalem Siedepunkt. Eine Lösung, die eine größere positive Abweichung vom Raoult'schen Gesetz aufweist, bildet bei einer bestimmten Zusammensetzung ein minimal siedendes Azeotrop. Ein Ethanol-Wasser-Gemisch (das durch Fermentation von Zuckern gewonnen wird) führt beispielsweise bei der fraktionierten Destillation zu einer Lösung, die höchstens 95 % (nach Volumen) Ethanol enthält. Sobald diese Zusammensetzung erreicht ist, haben die Flüssigkeit und der Dampf die gleiche Zusammensetzung, und es findet keine weitere Trennung statt. Eine Lösung, die eine große negative Abweichung vom Raoultschen Gesetz aufweist, bildet bei einer bestimmten Zusammensetzung ein maximal siedendes Azeotrop. Salpetersäure und Wasser sind ein Beispiel für diese Klasse von Azeotropen. Dieses Azeotrop hat eine ungefähre Zusammensetzung von 68 Massenprozent Salpetersäure und 32 Massenprozent Wasser und einen Siedepunkt von 393,5 K (120,4 °C). ⓘ
Etymologie
Der Begriff Azeotrop leitet sich von den griechischen Wörtern ζέειν (sieden) und τρόπος (drehen) mit der Vorsilbe α- (nein) ab, um die allgemeine Bedeutung "keine Veränderung beim Sieden" zu erhalten. Der Begriff wurde 1911 von dem englischen Chemiker John Wade und Richard William Merriman geprägt. ⓘ
Arten
Positive und negative Azeotrope

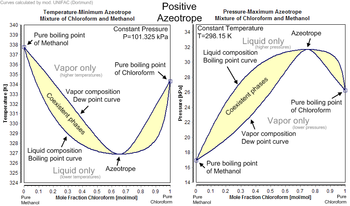
Jedes Azeotrop hat einen charakteristischen Siedepunkt. Der Siedepunkt eines Azeotrops ist entweder niedriger als die Siedetemperaturen aller seiner Bestandteile (positives Azeotrop) oder höher als der Siedepunkt aller seiner Bestandteile (negatives Azeotrop). ⓘ
Der Aufbau des p-v-x-Diagramms, das das azeotrope Verhalten zeigt, ist in der nebenstehenden Abbildung dargestellt ⓘ

Ein bekanntes Beispiel für ein positives Azeotrop ist 95,63 % Ethanol und 4,37 % Wasser (nach Masse), das bei 78,2 °C siedet. Ethanol siedet bei 78,4 °C, Wasser siedet bei 100 °C, aber das Azeotrop siedet bei 78,2 °C, was niedriger ist als jeder seiner Bestandteile. Tatsächlich ist 78,2 °C die Mindesttemperatur, bei der eine Ethanol/Wasser-Lösung bei Atmosphärendruck sieden kann. Im Allgemeinen siedet ein positives Azeotrop bei einer niedrigeren Temperatur als jedes andere Verhältnis seiner Bestandteile. Positive Azeotrope werden auch als minimal siedende Gemische oder Druckmaximum-Azeotrope bezeichnet. ⓘ
Im Allgemeinen siedet ein negatives Azeotrop bei einer höheren Temperatur als jedes andere Verhältnis seiner Bestandteile. Negative Azeotrope werden auch als maximal siedende Gemische oder Druckminimum-Azeotrope bezeichnet. Ein Beispiel für ein negatives Azeotrop ist Salzsäure mit einer Konzentration von 20,2 % und 79,8 % Wasser (nach Masse). Chlorwasserstoff siedet bei -84 °C und Wasser bei 100 °C, aber das Azeotrop siedet bei 110 °C, also höher als jeder seiner Bestandteile. Die Höchsttemperatur, bei der eine Salzsäurelösung sieden kann, beträgt 110 °C. Weitere Beispiele:
- Flusssäure (35,6 %) / Wasser, siedet bei 111,35 °C
- Salpetersäure (68 %) / Wasser, siedet bei 120,2 °C bei 1 atm
- Perchlorsäure (71,6 %) / Wasser, siedet bei 203 °C
- Schwefelsäure (98,3%) / Wasser, siedet bei 338 °C ⓘ
Homogene und heterogene Azeotrope
Sind die Bestandteile eines Gemischs in allen Anteilen vollständig miteinander mischbar, so wird der Azeotroptyp als homogenes Azeotrop bezeichnet. So kann beispielsweise eine beliebige Menge Ethanol mit einer beliebigen Menge Wasser gemischt werden, um eine homogene Lösung zu bilden. ⓘ
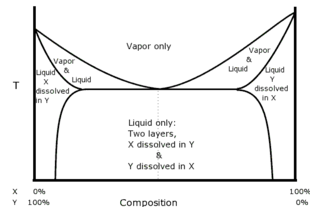
Wenn die Bestandteile nicht vollständig mischbar sind, kann innerhalb der Mischungslücke ein Azeotrop gefunden werden. Diese Art von Azeotrop wird als heterogenes Azeotrop oder Heteroazeotrop bezeichnet. Bei einer heteroazeotropen Destillation gibt es zwei flüssige Phasen. Zum Beispiel bilden Aceton/Methanol/Chloroform ein Azeotrop mit mittlerem Siedepunkt (Sattel-Azeotrop). ⓘ
Werden z. B. gleiche Volumina von Chloroform (Wasserlöslichkeit 0,8 g/100 ml bei 20 °C) und Wasser zusammen geschüttelt und dann stehen gelassen, so trennt sich die Flüssigkeit in zwei Schichten. Die Analyse der Schichten zeigt, dass die obere Schicht überwiegend aus Wasser mit einer geringen Menge an darin gelöstem Chloroform besteht und die untere Schicht überwiegend aus Chloroform mit einer geringen Menge an darin gelöstem Wasser. Erhitzt man die beiden Schichten zusammen, so siedet das Schichtsystem bei 53,3 °C, was niedriger ist als der Siedepunkt von Chloroform (61,2 °C) oder der Siedepunkt von Wasser (100 °C). Der Dampf besteht zu 97,0 % aus Chloroform und zu 3,0 % aus Wasser, unabhängig davon, wie viel von jeder Flüssigkeitsschicht vorhanden ist, sofern beide Schichten tatsächlich vorhanden sind. Wird der Dampf wieder kondensiert, bilden sich die Schichten im Kondensat in einem festen Verhältnis neu, das in diesem Fall 4,4 % des Volumens in der oberen Schicht und 95,6 % in der unteren Schicht beträgt. Ein solches System von Lösungsmitteln wird als Heteroazeotrop bezeichnet. Heteroazeotrope sind immer Gemische mit niedrigem Siedepunkt. ⓘ
Das Diagramm veranschaulicht, wie die verschiedenen Phasen eines Heteroazeotrops zusammenhängen. ⓘ

Anzahl der Bestandteile
Azeotrope, die aus zwei Bestandteilen bestehen, werden als binäre Azeotrope bezeichnet, wie z. B. Diethylether (33 %) / Halothan (66 %), eine Mischung, die früher häufig in der Anästhesie verwendet wurde. Benzol und Hexafluorbenzol bilden zum Beispiel ein doppeltes binäres Azeotrop. ⓘ
Azeotrope, die aus drei Bestandteilen bestehen, werden als ternäre Azeotrope bezeichnet, z. B. Aceton / Methanol / Chloroform. Es sind auch Azeotrope mit mehr als drei Bestandteilen bekannt. ⓘ
Zeotropie
Kombinationen von Lösungsmitteln, die beim Mischen in keinem Verhältnis ein Azeotrop bilden, werden als zeotrop bezeichnet. Azeotrope sind bei der Trennung von zeotropen Gemischen nützlich. Ein Beispiel ist Essigsäure und Wasser, die kein Azeotrop bilden. Trotzdem ist es sehr schwierig, reine Essigsäure (Siedepunkt: 118,1 °C) aus einer Lösung von Essigsäure und Wasser allein durch Destillation zu trennen. Da bei fortschreitenden Destillationen immer weniger Wasser in der Lösung enthalten ist, wird das verbleibende Wasser mit jeder weiteren Destillation weniger wirksam entfernt. Die Destillation der Lösung zu trockener Essigsäure ist daher wirtschaftlich unpraktisch. Ethylacetat bildet jedoch mit Wasser, das bei 70,4 °C siedet, ein Azeotrop. Durch Zugabe von Ethylacetat als Schleppmittel ist es möglich, das Azeotrop abzudestillieren und nahezu reine Essigsäure als Rückstand zurückzulassen. ⓘ
Mechanismus
Bedingung der Existenz
Die Bedingung setzt die Aktivitätskoeffizienten in der flüssigen Phase mit dem Gesamtdruck und den Dampfdrücken der reinen Komponenten in Beziehung. ⓘ

Azeotrope können sich nur bilden, wenn ein Gemisch vom Raoult'schen Gesetz, der Gleichheit der Zusammensetzungen in der flüssigen Phase und in der Dampfphase, im Dampf-Flüssigkeits-Gleichgewicht und vom Dalton'schen Gesetz, der Gleichheit der Drücke, abweicht, da der Gesamtdruck gleich der Summe der Partialdrücke in echten Gemischen ist. ⓘ
Mit anderen Worten: Das Raoultsche Gesetz sagt die Dampfdrücke idealer Gemische in Abhängigkeit vom Zusammensetzungsverhältnis voraus. Einfacher ausgedrückt: Nach dem Raoult'schen Gesetz haften die Moleküle der Bestandteile in gleichem Maße aneinander wie an sich selbst. Eine so genannte positive Abweichung vom Raoult'schen Gesetz ergibt sich, wenn die Bestandteile eine Disaffinität füreinander aufweisen - d. h. X haftet besser an X und Y an Y als X an Y. Da dies dazu führt, dass das Gemisch eine geringere Gesamtaffinität der Moleküle aufweist als die reinen Bestandteile, entweichen sie leichter aus der zusammengeklebten Phase, d. h. der flüssigen Phase, in die Dampfphase. Wenn X stärker an Y haftet als X an X und Y an Y, kommt es zu einer negativen Abweichung vom Raoultschen Gesetz. Da in diesem Fall die Moleküle in der Mischung stärker aneinander haften als in den reinen Bestandteilen, entkommen sie der zusammengeklebten flüssigen Phase nur widerwillig. ⓘ
Wenn die Abweichung groß genug ist, um ein Maximum oder Minimum in der Funktion Dampfdruck/Zusammensetzung zu verursachen, ist es eine mathematische Konsequenz, dass der Dampf an diesem Punkt die gleiche Zusammensetzung wie die Flüssigkeit hat, was zu einem Azeotrop führt. ⓘ
Das nebenstehende Diagramm veranschaulicht den Gesamtdampfdruck von drei hypothetischen Gemischen aus den Bestandteilen X und Y. Die Temperatur wird in der gesamten Darstellung als konstant angenommen. ⓘ
Die mittlere Kurve ist eine gerade Linie, was dem Raoultschen Gesetz für ein ideales Gemisch entspricht. Im Allgemeinen bilden nur Mischungen chemisch ähnlicher Lösungsmittel, wie z. B. n-Hexan mit n-Heptan, nahezu ideale Mischungen, die dem Raoult'schen Gesetz annähernd gehorchen. Die obere Kurve zeigt ein nicht ideales Gemisch mit einer positiven Abweichung vom Raoult'schen Gesetz, bei dem der kombinierte Gesamtdampfdruck der Bestandteile X und Y größer ist als der durch das Raoult'sche Gesetz vorhergesagte. Die obere Kurve weicht so weit ab, dass es einen Punkt auf der Kurve gibt, an dem ihre Tangente horizontal verläuft. Wenn ein Gemisch eine positive Abweichung und einen Punkt aufweist, an dem die Tangente horizontal ist, ist die Zusammensetzung an diesem Punkt ein positives Azeotrop. An diesem Punkt ist der Gesamtdampfdruck am höchsten. Die untere Kurve veranschaulicht ein nicht ideales Gemisch mit einer negativen Abweichung vom Raoult'schen Gesetz, und an dem Punkt, an dem die Tangente zur Kurve horizontal verläuft, liegt ein negatives Azeotrop vor. Dies ist auch der Punkt, an dem der Gesamtdampfdruck minimal ist. ⓘ
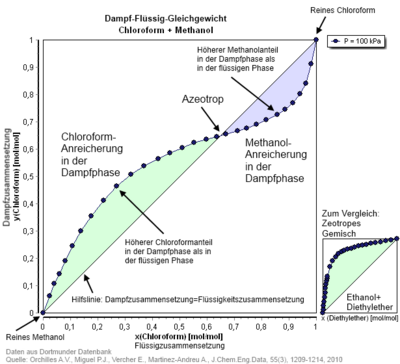
In azeotropen Gemischen berühren sich im p-x-Phasendiagramm die Siede- und die Kondensationskurven der Komponenten im azeotropen Mischungsverhältnis. Im x-y-Diagramm wird die x=y-Linie geschnitten (siehe Abbildung). ⓘ
Azeotrope bilden sich, wenn die Partialdampfdrücke der Komponenten einer Mischflüssigkeit stark von den sich für eine ideale Mischung aus dem Raoultschen Gesetz ergebenden Dampfdrücken abweichen. Zwei Komponenten (z. B. HCl und H2O), die miteinander stärkere Wechselwirkungen als im Reinstoff aufweisen, bilden ein Azeotrop mit Dampfdruckminimum/Siedepunktsmaximum; der Zusammenhalt zwischen einem HCl- und einem H2O-Molekül ist jeweils größer als zwischen zwei H2O-Molekülen oder zwei HCl-Molekülen. Zwei Komponenten, wie Ethanol und Wasser, die untereinander schwächere Wechselwirkungen aufweisen als in den Reinstoffen, bilden ein Azeotrop mit Dampfdruckmaximum bzw. Siedepunktsminimum. Dies tritt typischerweise auf, wenn sich die Komponenten in ihrer Polarität deutlich unterscheiden. ⓘ
Substanzen, die sich sehr ähnlich sind, wie die unterschiedlichen Alkane, bilden keine Azeotrope und können destillativ sauber getrennt werden. Auch Gemische von schwerem und leichtem Wasser lassen sich, über eine Kolonne mit entsprechend vielen Böden, trotz des kleinen Abstandes der Siedepunkte destillativ trennen. ⓘ
Minimal-siedendes oder positives Azeotrop

Das Sieden und die Rekondensation eines Gemischs aus zwei Lösungsmitteln sind chemische Zustandsänderungen; als solche lassen sie sich am besten mit einem Phasendiagramm veranschaulichen. Wenn der Druck konstant gehalten wird, sind die beiden variablen Parameter die Temperatur und die Zusammensetzung. ⓘ
Das Phasendiagramm auf der rechten Seite zeigt ein positives Azeotrop aus den hypothetischen Bestandteilen X und Y. Die untere Kurve veranschaulicht die Siedetemperatur verschiedener Zusammensetzungen. Unterhalb der unteren Kurve befindet sich nur die flüssige Phase im Gleichgewicht. Die obere Kurve zeigt die Zusammensetzung des Dampfes über der Flüssigkeit bei einer bestimmten Temperatur. Oberhalb der oberen Kurve befindet sich nur der Dampf im Gleichgewicht. Zwischen den beiden Kurven befinden sich die flüssige und die dampfförmige Phase gleichzeitig im Gleichgewicht: Erhitzt man beispielsweise ein Gemisch von 25 % X : 75 % Y auf die Temperatur AB, so entsteht Dampf der Zusammensetzung B über der Flüssigkeit der Zusammensetzung A. Das Azeotrop ist der Punkt im Diagramm, an dem sich die beiden Kurven berühren. Die horizontalen und vertikalen Stufen zeigen den Weg der wiederholten Destillationen. Punkt A ist der Siedepunkt eines nicht azeotropen Gemisches. Der Dampf, der sich bei dieser Temperatur abscheidet, hat die Zusammensetzung B. Die Form der Kurven erfordert, dass der Dampf bei B reicher an der Komponente X ist als die Flüssigkeit bei Punkt A. Der Dampf wird physikalisch vom VLE-System (Dampf-Flüssigkeits-Gleichgewicht) getrennt und zu Punkt C abgekühlt, wo er kondensiert. Die entstehende Flüssigkeit (Punkt C) ist nun reicher an X als an Punkt A. Wird die gesammelte Flüssigkeit erneut gekocht, gelangt sie zu Punkt D usw. Der schrittweise Verlauf zeigt, dass eine wiederholte Destillation niemals ein Destillat ergeben kann, das reicher an Bestandteil X ist als das Azeotrop. Man beachte, dass ein Beginn rechts vom Azeotrop-Punkt dazu führt, dass sich derselbe schrittweise Prozess dem Azeotrop-Punkt aus der anderen Richtung nähert. ⓘ
Maximalsiedendes oder negatives Azeotrop
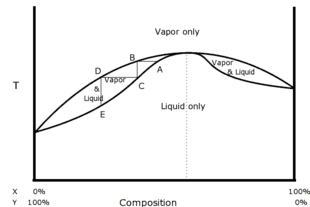
Das Phasendiagramm auf der rechten Seite zeigt ein negatives Azeotrop aus den idealen Bestandteilen X und Y. Die untere Kurve veranschaulicht die Siedetemperatur bei verschiedenen Zusammensetzungen, und auch hier muss das Gemisch unterhalb der unteren Kurve vollständig in flüssiger Phase vorliegen. Die obere Kurve zeigt wiederum die Kondensationstemperatur verschiedener Zusammensetzungen, und auch hier muss das Gemisch oberhalb der oberen Kurve vollständig in der Dampfphase sein. Der hier gezeigte Punkt A ist ein Siedepunkt mit einer Zusammensetzung, die sehr nahe am Azeotrop gewählt wurde. Der Dampf wird bei derselben Temperatur an Punkt B gesammelt. Dieser Dampf wird abgekühlt, kondensiert und an Punkt C gesammelt. Da es sich in diesem Beispiel um ein negatives Azeotrop handelt und nicht um ein positives, ist das Destillat weiter vom Azeotrop entfernt als das ursprüngliche Flüssigkeitsgemisch an Punkt A. Das Destillat ist also ärmer an Bestandteil X und reicher an Bestandteil Y als das ursprüngliche Gemisch. Da durch diesen Prozess ein größerer Anteil von Y aus der Flüssigkeit entfernt wurde als ursprünglich, muss der Rückstand nach der Destillation ärmer an Y und reicher an X sein als vorher. ⓘ
Wäre der Punkt A nicht links, sondern rechts des Azeotrops gewählt worden, so läge das Destillat im Punkt C weiter rechts als A, d. h. das Destillat wäre reicher an X und ärmer an Y als das ursprüngliche Gemisch. Auch in diesem Fall entfernt sich also das Destillat vom Azeotrop und der Rückstand bewegt sich auf dieses zu. Dies ist charakteristisch für negative Azeotrope. Keine noch so starke Destillation kann jedoch bewirken, dass entweder das Destillat oder der Rückstand auf der dem ursprünglichen Gemisch gegenüberliegenden Seite des Azeotrops ankommt. Dies ist charakteristisch für alle Azeotrope. ⓘ
Spuren
Die Spuren in den Phasendiagrammen trennen sich immer dann, wenn sich die Zusammensetzung des Dampfes von der Zusammensetzung der Flüssigkeit bei gleicher Temperatur unterscheidet. Angenommen, die Gesamtzusammensetzung wäre 50/50%. Man könnte diese Zusammensetzung aus 50 % Dampf und 50 % Flüssigkeit herstellen, aber auch aus 83,33 % Dampf (45/55 %) und 16,67 % Flüssigkeit (75/25 %) sowie aus vielen anderen Kombinationen. Der Abstand zwischen den beiden Spuren stellt die Bandbreite der Kombinationen aus Flüssigkeit und Dampf dar, die jede Gesamtzusammensetzung ergeben kann. ⓘ
Abhängigkeit von der Temperatur und dem Druck
Sowohl für die obere als auch für die untere Kurve ist der Temperaturpunkt des Azeotrops die für das Diagramm gewählte konstante Temperatur. Wenn der Umgebungsdruck so geregelt wird, dass er dem Gesamtdampfdruck des azeotropen Gemischs entspricht, siedet das Gemisch bei dieser festen Temperatur. ⓘ
Der Dampfdruck sowohl von reinen Flüssigkeiten als auch von Gemischen ist eine empfindliche Funktion der Temperatur. In der Regel steigt der Dampfdruck einer Flüssigkeit in Abhängigkeit von der Temperatur nahezu exponentiell an. Würde man das Diagramm für eine andere feste Temperatur aufzeichnen, würde sich der Gesamtdampfdruck bei der azeotropen Zusammensetzung sicherlich ändern, aber es ist auch möglich, dass sich die Zusammensetzung, bei der das Azeotrop auftritt, ändert. Dies bedeutet, dass die Zusammensetzung eines Azeotrops durch den Druck beeinflusst wird, bei dem das Gemisch zum Sieden gebracht wird. Normalerweise wird die Destillation bei atmosphärischem Druck durchgeführt, aber mit der richtigen Ausrüstung ist es möglich, die Destillation bei einer Vielzahl von Drücken durchzuführen, sowohl über als auch unter atmosphärischem Druck. ⓘ
Trennung von Bestandteilen
Wenn die beiden Lösungsmittel ein negatives Azeotrop bilden können, führt die Destillation einer beliebigen Mischung dieser Bestandteile dazu, dass der Rückstand näher an der Zusammensetzung am Azeotrop liegt als die ursprüngliche Mischung. Enthält beispielsweise eine Salzsäurelösung weniger als 20,2 % Chlorwasserstoff, so bleibt beim Sieden der Mischung eine Lösung zurück, die reicher an Chlorwasserstoff ist als die ursprüngliche. Enthält die Lösung anfangs mehr als 20,2 % Chlorwasserstoff, so bleibt beim Sieden eine Lösung zurück, die ärmer an Chlorwasserstoff ist als die ursprüngliche Lösung. Wenn eine Salzsäurelösung lange genug siedet, nähert sich die zurückbleibende Lösung dem azeotropen Verhältnis an. Wenn andererseits zwei Lösungsmittel ein positives Azeotrop bilden können, führt die Destillation eines beliebigen Gemischs dieser Bestandteile dazu, dass sich der Rückstand von der Zusammensetzung am Azeotrop entfernt als das ursprüngliche Gemisch. Wird beispielsweise ein 50/50-Gemisch aus Ethanol und Wasser einmal destilliert, so besteht das Destillat zu 80 % aus Ethanol und zu 20 % aus Wasser, was dem azeotropen Gemisch näher kommt als das ursprüngliche, was bedeutet, dass die zurückbleibende Lösung ärmer an Ethanol ist. Die Destillation der 80/20%-Mischung ergibt ein Destillat, das zu 87% aus Ethanol und zu 13% aus Wasser besteht. Weitere wiederholte Destillationen führen zu Mischungen, die sich dem azeotropen Verhältnis von 95,5/4,5 % immer mehr annähern. Keine Anzahl von Destillationen wird jemals zu einem Destillat führen, das das azeotrope Verhältnis überschreitet. Ebenso wird bei der Destillation einer Mischung aus Ethanol und Wasser, die reicher an Ethanol ist als das Azeotrop, das Destillat (entgegen der Intuition) ärmer an Ethanol sein als das Original, aber immer noch reicher als das Azeotrop. ⓘ
Die Destillation ist eines der wichtigsten Instrumente, die Chemiker und Chemieingenieure einsetzen, um Gemische in ihre Bestandteile zu trennen. Da die Destillation die Bestandteile eines Azeotrops nicht trennen kann, ist die Trennung azeotroper Gemische (auch Azeotropspaltung genannt) ein Thema von großem Interesse. Diese Schwierigkeit veranlasste einige frühe Forscher zu der Annahme, dass Azeotrope eigentlich Verbindungen ihrer Bestandteile sind. Es gibt jedoch zwei Gründe für die Annahme, dass dies nicht der Fall ist. Zum einen ist das molare Verhältnis der Bestandteile eines Azeotrops im Allgemeinen nicht das Verhältnis kleiner ganzer Zahlen. So enthält beispielsweise das Azeotrop aus Wasser und Acetonitril 2,253 Mol (oder 9/4 mit einem relativen Fehler von nur 2 %) Acetonitril pro Mol Wasser. Ein zwingenderer Grund für die Annahme, dass Azeotrope keine Verbindungen sind, ist, wie im letzten Abschnitt erörtert, dass die Zusammensetzung eines Azeotrops durch den Druck beeinflusst werden kann. Im Gegensatz dazu besteht eine echte Verbindung, z. B. Kohlendioxid, aus zwei Molen Sauerstoff für jedes Mol Kohlenstoff, unabhängig davon, bei welchem Druck das Gas beobachtet wird. Die Tatsache, dass die azeotrope Zusammensetzung durch den Druck beeinflusst werden kann, deutet auf ein Verfahren hin, mit dem ein solches Gemisch getrennt werden kann. ⓘ
Druckwechsel-Destillation

Ein hypothetisches Azeotrop aus den Bestandteilen X und Y ist in der nebenstehenden Abbildung dargestellt. Zwei Kurvenreihen in einem Phasendiagramm, eine bei einem beliebig gewählten niedrigen Druck und eine weitere bei einem beliebig gewählten, aber höheren Druck. Die Zusammensetzung des Azeotrops unterscheidet sich erheblich zwischen dem Hoch- und dem Niederdruckdiagramm, wobei der Anteil von X im Hochdrucksystem höher ist. Ziel ist es, X in einer möglichst hohen Konzentration abzutrennen, ausgehend von Punkt A. Bei dem niedrigen Druck ist es möglich, durch fortschreitende Destillation ein Destillat an dem Punkt B zu erhalten, der auf der gleichen Seite des Azeotrops liegt wie A. Man beachte, dass aufeinander folgende Destillationsschritte in der Nähe der azeotropen Zusammensetzung nur sehr geringe Unterschiede in der Siedetemperatur aufweisen. Wird dieses Destillat nun dem hohen Druck ausgesetzt, siedet es im Punkt C. Von C aus kann man durch fortschreitende Destillation ein Destillat im Punkt D erreichen, der auf derselben Seite des Hochdruckazeotrops liegt wie C. Wird dieses Destillat dann wieder dem niedrigen Druck ausgesetzt, siedet es im Punkt E, der auf der gegenüberliegenden Seite des Niederdruckazeotrops zu A liegt. ⓘ
Wenn die Lösung im Punkt E gekocht wird, ist das Destillat ärmer an X als der Rückstand im Punkt E. Das bedeutet, dass der Rückstand reicher an X ist als das Destillat im Punkt E. In der Tat kann die fortschreitende Destillation einen Rückstand erzeugen, der so reich an X ist, wie es erforderlich ist. ⓘ
Zusammengefasst:
|
1. Niederdruck-Rektifikation (A nach B) |
|
Es ist zu beachten, dass beide oben genannten Azeotrope vom positiven Typ sind, d. h. vom Typ mit dem niedrigsten Siedepunkt; es ist darauf zu achten, dass die richtige Komponente des Trennungsschritts zurückgehalten wird, d. h. das binäre Phasenhüllkurvendiagramm (Siedepunktskurve) muss richtig abgelesen werden. ⓘ
Ein Gemisch aus 5 % Wasser und 95 % Tetrahydrofuran ist ein Beispiel für ein Azeotrop, das mit Hilfe eines Druckwechsels - in diesem Fall zwischen 1 atm und 8 atm - wirtschaftlich getrennt werden kann. Im Gegensatz dazu wird die Zusammensetzung des bereits erwähnten Azeotrops aus Wasser und Ethanol durch den Druck nicht so stark beeinflusst, dass es sich mit Hilfe von Druckschwankungen leicht trennen lässt. Stattdessen kann ein Schleppmittel hinzugefügt werden, das entweder die azeotrope Zusammensetzung verändert und mit einer der Komponenten nicht mischbar ist, oder es kann eine Extraktivdestillation durchgeführt werden. ⓘ
Azeotrope Destillation
Bei anderen Trennverfahren wird ein zusätzliches Mittel, ein so genannter Schlepper, zugegeben, der die Flüchtigkeit eines der azeotropen Bestandteile stärker beeinflusst als die eines anderen. Wenn ein Schleppmittel zu einem binären Azeotrop hinzugefügt wird, um ein ternäres Azeotrop zu bilden, und das resultierende Gemisch destilliert wird, nennt man diese Methode azeotrope Destillation. Das bekannteste Beispiel ist die Zugabe von Benzol oder Cyclohexan zum Azeotrop Wasser/Ethanol. Mit Cyclohexan als Schleppmittel besteht das ternäre Azeotrop aus 7 % Wasser, 17 % Ethanol und 76 % Cyclohexan und siedet bei 62,1 °C. Dem Wasser/Ethanol-Azeotrop wird gerade so viel Cyclohexan zugesetzt, dass das gesamte Wasser in das ternäre Azeotrop übergeht. Wenn das Gemisch dann gekocht wird, verdampft das Azeotrop und hinterlässt einen Rückstand, der fast vollständig aus dem überschüssigen Ethanol besteht. ⓘ
Trennung durch chemische Wirkung
Eine andere Art von Schleppmittel ist eines, das eine starke chemische Affinität zu einem der Bestandteile hat. Um das Beispiel des Wasser-Ethanol-Azeotrops wieder aufzugreifen, kann die Flüssigkeit mit Kalziumoxid geschüttelt werden, das stark mit Wasser reagiert und die nichtflüchtige Verbindung Kalziumhydroxid bildet. Fast das gesamte Calciumhydroxid kann durch Filtration abgetrennt und das Filtrat redestilliert werden, um 100% reines Ethanol zu erhalten. ⓘ
Ein noch extremeres Beispiel ist das Azeotrop von 1,2 % Wasser mit 98,8 % Diethylether. Ether hält das letzte bisschen Wasser so hartnäckig fest, dass nur ein sehr starkes Trockenmittel wie Natriummetall, das der flüssigen Phase zugesetzt wird, zu einem vollständig trockenen Ether führen kann. ⓘ
Wasserfreies Calciumchlorid wird als Trockenmittel für die Trocknung einer Vielzahl von Lösungsmitteln verwendet, da es kostengünstig ist und mit den meisten nichtwässrigen Lösungsmitteln nicht reagiert. Chloroform ist ein Beispiel für ein Lösungsmittel, das mit Calciumchlorid effektiv getrocknet werden kann. ⓘ
Destillation mit einem gelösten Salz
Wenn ein Salz in einem Lösungsmittel gelöst wird, hat dies immer den Effekt, dass der Siedepunkt des Lösungsmittels erhöht wird, d. h. die Flüchtigkeit des Lösungsmittels wird verringert. Wenn das Salz in einem Bestandteil eines Gemischs leicht löslich ist, in einem anderen jedoch nicht, wird die Flüchtigkeit des Bestandteils, in dem es löslich ist, verringert, während der andere Bestandteil davon unberührt bleibt. Auf diese Weise lässt sich zum Beispiel das Wasser-Ethanol-Azeotrop aufbrechen, indem man Kaliumacetat darin auflöst und das Ergebnis destilliert. ⓘ
Extraktive Destillation
Die extraktive Destillation ähnelt der azeotropen Destillation, mit dem Unterschied, dass in diesem Fall das Schleppmittel weniger flüchtig ist als einer der Bestandteile des Azeotrops. Zum Beispiel kann das Azeotrop aus 20 % Aceton und 80 % Chloroform durch Zugabe von Wasser und Destillation des Ergebnisses aufgebrochen werden. Das Wasser bildet eine separate Schicht, in der sich das Aceton bevorzugt auflöst. Das Ergebnis ist, dass das Destillat reicher an Chloroform ist als das ursprüngliche Azeotrop. ⓘ
Pervaporation und andere Membranverfahren
Bei der Pervaporationsmethode wird eine Membran verwendet, die für einen Bestandteil durchlässiger ist als für einen anderen, um die Bestandteile eines Azeotrops beim Übergang von der flüssigen in die Dampfphase zu trennen. Die Membran wird so angebracht, dass sie zwischen der flüssigen und der Dampfphase liegt. Eine weitere Membranmethode ist die Dampfpermeation, bei der die Bestandteile die Membran vollständig in der Dampfphase passieren. Bei allen Membranverfahren trennt die Membran die Flüssigkeit, die sie durchläuft, in ein Permeat (das, was durchläuft) und ein Retentat (das, was zurückbleibt). Wenn die Membran so gewählt ist, dass sie für einen Bestandteil durchlässiger ist als für einen anderen, dann ist das Permeat reicher an diesem ersten Bestandteil als das Retentat. ⓘ
Eine weitere Möglichkeit, ein azeotropes Ethanol-Wasser-Gemisch zu trennen, ist die Dampfpermeation. Dabei wird das Gemisch verdampft und durch eine Membraneinheit geführt. Die Membran funktioniert wie ein Filter, d. h., deren Poren lassen nur eine Komponente passieren – hier also das Wasser. Treibende Kraft für die Trennung des Gemisches ist ein Druckunterschied zwischen dem Innenraum und dem Außenraum und die Selektivität der Membran. Somit tritt das Wasser durch die Membran durch (Permeat) und das wasserfreie Ethanol bleibt auf der anderen Seite der Membran (Retentat). So kann man Ethanol mit einer Reinheit von bis zu 99,97 % erhalten. ⓘ
Im Unterschied zur Dampfpermeation wird bei der Pervaporation das flüssige Gemisch an der Membran vorbeigeführt. ⓘ
Komplexe Systeme

Die Regeln für positive und negative Azeotrope gelten für alle bisher besprochenen Beispiele, aber es gibt einige Beispiele, die sich nicht in die Kategorien der positiven oder negativen Azeotrope einordnen lassen. Das bekannteste Beispiel ist das ternäre Azeotrop aus 30 % Aceton, 47 % Chloroform und 23 % Methanol, das bei 57,5 °C siedet. Jedes Paar dieser Bestandteile bildet ein binäres Azeotrop, aber Chloroform/Methanol und Aceton/Methanol bilden beide positive Azeotrope, während Chloroform/Aceton ein negatives Azeotrop bildet. Das resultierende ternäre Azeotrop ist weder positiv noch negativ. Sein Siedepunkt liegt zwischen den Siedepunkten von Aceton und Chloroform, so dass es weder einen maximalen noch einen minimalen Siedepunkt hat. Diese Art von System wird als Sattelazeotrop bezeichnet. Nur Systeme mit drei oder mehr Bestandteilen können Sattelazeotrope bilden. ⓘ
Ein seltener Typ eines komplexen binären Azeotrops ist ein System, bei dem sich die Kurven des Siedepunkts und des Kondensationspunkts an zwei Punkten im Phasendiagramm berühren. Ein solches System wird als doppeltes Azeotrop bezeichnet und weist zwei azeotrope Zusammensetzungen und Siedepunkte auf. Ein Beispiel ist Wasser und N-Methylethylendiamin. ⓘ
Physikalische Trennverfahren für Azeotrope
Da azeotrope Gemische aus Bestandteilen mit recht unterschiedlichen Eigenschaften bestehen (s. o.), lassen sie sich meist leicht durch andere gängige Trennmethoden außer Destillation auftrennen. Beispiele wären Chromatographie, Zugabe geeigneter Molekularsiebe oder Trockenmittel wie Magnesiumsulfat, Auskristallisieren einer Komponente bei niedrigen Temperaturen. Durch Druckänderung kann die Zusammensetzung des Azeotropes in die gewünschte Richtung verändert werden. ⓘ
Azeotrope Destillation
Die Bildung von Azeotropen kann genutzt werden, um einen Stoff aus einem Gemisch „herauszuschleppen“. Beispielsweise wird in der chemischen Reaktionstechnik zur Abtrennung von Wasser aus einem Reaktionsgemisch häufig Toluol als Schleppmittel eingesetzt. Toluol bildet mit Wasser ein Minimum-Azeotrop. Im Kondensat entmischen sich die beiden Flüssigkeiten wieder und bilden zwei Phasen. Das Toluol, die obere Phase, wird durch einen Wasserabscheider im Kreislauf der Reaktion wieder zugeführt. Das Wasser wird abgetrennt, und anhand der gebildeten Wassermenge kann der Reaktionsverlauf beobachtet werden. ⓘ