Alkalimetalle
| Alkalimetalle ⓘ | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||
| ↓ Zeitraum | |||||||||||
| 2 | Lithium (Li) 3 | ||||||||||
| 3 | Natrium (Na) 11 | ||||||||||
| 4 | Kalium (K) 19 | ||||||||||
| 5 | Rubidium (Rb) 37 | ||||||||||
| 6 | Cäsium (Cs) 55 | ||||||||||
| 7 | Francium (Fr) 87 | ||||||||||
|
Legende
| |||||||||||
Die Alkalimetalle bestehen aus den chemischen Elementen Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs) und Francium (Fr). Zusammen mit Wasserstoff bilden sie die Gruppe 1, die im s-Block des Periodensystems liegt. Alle Alkalimetalle haben ihr äußerstes Elektron in einem s-Orbital: Diese gemeinsame Elektronenkonfiguration führt dazu, dass sie sehr ähnliche charakteristische Eigenschaften haben. Die Alkalimetalle sind in der Tat das beste Beispiel für Gruppentrends bei den Eigenschaften im Periodensystem, wobei die Elemente ein gut charakterisiertes homologes Verhalten aufweisen. Diese Elementfamilie ist nach ihrem führenden Element auch als Lithiumfamilie bekannt. ⓘ
Die Alkalimetalle sind allesamt glänzende, weiche, bei Standardtemperatur und -druck hochreaktive Metalle, die ihr äußerstes Elektron leicht verlieren und Kationen mit der Ladung +1 bilden. Aufgrund ihrer Weichheit lassen sie sich leicht mit einem Messer schneiden, wobei eine glänzende Oberfläche zum Vorschein kommt, die an der Luft aufgrund der Oxidation durch Luftfeuchtigkeit und Sauerstoff (und im Fall von Lithium durch Stickstoff) schnell anläuft. Aufgrund ihrer hohen Reaktivität müssen sie unter Öl gelagert werden, um eine Reaktion mit der Luft zu verhindern, und kommen in der Natur nur in Form von Salzen und niemals als freie Elemente vor. Cäsium, das fünfte Alkalimetall, ist das reaktivste aller Metalle. Alle Alkalimetalle reagieren mit Wasser, wobei die schwereren Alkalimetalle heftiger reagieren als die leichteren. ⓘ
Alle entdeckten Alkalimetalle kommen in der Natur in ihren Verbindungen vor: Natrium ist in der Reihenfolge der Häufigkeit das häufigste, gefolgt von Kalium, Lithium, Rubidium, Cäsium und schließlich Francium, das wegen seiner extrem hohen Radioaktivität sehr selten ist; Francium kommt in der Natur nur in winzigen Spuren als Zwischenstufe in einigen obskuren Seitenästen der natürlichen Zerfallsketten vor. Es wurden Versuche zur Synthese von Ununennium (Uue) unternommen, das wahrscheinlich das nächste Mitglied der Gruppe sein wird; keiner war erfolgreich. Es ist jedoch möglich, dass Ununennium kein Alkalimetall ist, da relativistische Effekte einen großen Einfluss auf die chemischen Eigenschaften von superschweren Elementen haben; selbst wenn es sich als Alkalimetall erweisen sollte, wird es einige Unterschiede in den physikalischen und chemischen Eigenschaften zu seinen leichteren Homologen aufweisen. ⓘ
Die meisten Alkalimetalle haben viele verschiedene Anwendungen. Eine der bekanntesten Anwendungen der reinen Elemente ist die Verwendung von Rubidium und Cäsium in Atomuhren, von denen die Cäsium-Atomuhr die Grundlage der zweiten ist. Eine häufige Anwendung der Natriumverbindungen ist die Natriumdampflampe, die sehr effizient Licht emittiert. Kochsalz oder Natriumchlorid wird seit dem Altertum verwendet. Lithium wird als Psychopharmakon und als Anode in Lithiumbatterien verwendet. Natrium, Kalium und Lithium sind essentielle Elemente, die in der Biologie eine wichtige Rolle als Elektrolyte spielen. Die anderen Alkalimetalle sind zwar nicht essentiell, haben aber ebenfalls verschiedene Wirkungen auf den Körper, sowohl nützliche als auch schädliche. ⓘ
|
Lage im Periodensystem ⓘ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 1 ⓘ |
| Hauptgruppe | 1 |
| Periode | |
| 2 | 3 Li |
| 3 | 11 Na |
| 4 | 19 K |
| 5 | 37 Rb |
| 6 | 55 Cs |
| 7 | 87 Fr |
Geschichte

Natriumverbindungen sind seit der Antike bekannt; Salz (Natriumchlorid) war ein wichtiger Rohstoff für menschliche Aktivitäten, wie das englische Wort salary beweist, das sich auf salarium bezieht, das Geld, das römischen Soldaten für den Kauf von Salz gezahlt wurde. Obwohl Pottasche schon seit der Antike verwendet wird, wurde sie die meiste Zeit ihrer Geschichte nicht als eine grundsätzlich andere Substanz als Natriummineralsalze verstanden. Georg Ernst Stahl erhielt experimentelle Beweise, die ihn dazu brachten, 1702 den grundlegenden Unterschied zwischen Natrium- und Kaliumsalzen zu vermuten, und Henri-Louis Duhamel du Monceau konnte diesen Unterschied 1736 nachweisen. Die genaue chemische Zusammensetzung von Kalium- und Natriumverbindungen und der Status von Kalium und Natrium als chemische Elemente waren damals noch nicht bekannt, und so nahm Antoine Lavoisier 1789 keines der beiden Alkalien in seine Liste der chemischen Elemente auf. ⓘ
Reines Kalium wurde erstmals 1807 in England von Humphry Davy isoliert, der es aus Kalilauge (KOH, Kaliumhydroxid) durch Elektrolyse des geschmolzenen Salzes mit dem neu erfundenen galvanischen Pfahl gewann. Frühere Versuche, das wässrige Salz zu elektrolysieren, scheiterten an der extremen Reaktivität des Kaliums. Kalium war das erste Metall, das durch Elektrolyse isoliert wurde. Später im selben Jahr berichtete Davy über die Gewinnung von Natrium aus der ähnlichen Substanz Natronlauge (NaOH, Lauge) durch ein ähnliches Verfahren, wobei er nachwies, dass die Elemente und damit die Salze unterschiedlich sind. ⓘ

Petalit (Li Al Si4O10) wurde 1800 von dem brasilianischen Chemiker José Bonifácio de Andrada in einem Bergwerk auf der Insel Utö in Schweden entdeckt. Doch erst 1817 entdeckte Johan August Arfwedson, der damals im Labor des Chemikers Jöns Jacob Berzelius arbeitete, bei der Analyse von Petaliterz ein neues Element. Er stellte fest, dass dieses neue Element Verbindungen bildete, die denen von Natrium und Kalium ähnelten, obwohl sein Karbonat und sein Hydroxid weniger wasserlöslich und alkalischer waren als die anderen Alkalimetalle. Berzelius gab dem unbekannten Stoff den Namen "Lithion/Lithina", abgeleitet vom griechischen Wort λιθoς (lithos, d.h. "Stein"), um auf seine Entdeckung in einem festen Mineral hinzuweisen, im Gegensatz zu Kalium, das in Pflanzenasche entdeckt worden war, und Natrium, das u.a. wegen seines hohen Vorkommens in Tierblut bekannt war. Er nannte das Metall im Inneren des Materials "Lithium". Lithium, Natrium und Kalium waren Teil der Entdeckung der Periodizität, da sie zu einer Reihe von Dreiergruppen von Elementen in derselben Gruppe gehören, die von Johann Wolfgang Döbereiner 1850 mit ähnlichen Eigenschaften festgestellt wurden. ⓘ

Rubidium und Cäsium waren die ersten Elemente, die mit Hilfe des Spektroskops entdeckt wurden, das 1859 von Robert Bunsen und Gustav Kirchhoff erfunden wurde. Im Jahr darauf entdeckten sie Cäsium im Mineralwasser von Bad Dürkheim, Deutschland. Die Entdeckung von Rubidium erfolgte ein Jahr später in Heidelberg, Deutschland, im Mineral Lepidolith. Die Namen Rubidium und Cäsium leiten sich von den auffälligsten Linien in ihren Emissionsspektren ab: eine leuchtend rote Linie für Rubidium (vom lateinischen Wort rubidus, was dunkelrot oder leuchtend rot bedeutet) und eine himmelblaue Linie für Cäsium (abgeleitet vom lateinischen Wort caesius, was himmelblau bedeutet). ⓘ
Um 1865 verfasste John Newlands eine Reihe von Abhandlungen, in denen er die Elemente in der Reihenfolge ihres zunehmenden Atomgewichts und ähnlicher physikalischer und chemischer Eigenschaften auflistete, die in Abständen von acht Jahren wiederkehrten; er verglich diese Periodizität mit den Oktaven in der Musik, bei denen Noten im Abstand einer Oktave ähnliche musikalische Funktionen haben. In seiner Version fasste er alle damals bekannten Alkalimetalle (Lithium bis Cäsium) sowie Kupfer, Silber und Thallium (die die für die Alkalimetalle charakteristische Oxidationsstufe +1 aufweisen) in einer Gruppe zusammen. Seine Tabelle ordnete den Wasserstoff den Halogenen zu. ⓘ

Nach 1869 schlug Dmitri Mendelejew sein Periodensystem vor, das Lithium an die Spitze einer Gruppe mit Natrium, Kalium, Rubidium, Cäsium und Thallium stellte. Zwei Jahre später überarbeitete Mendelejew seine Tabelle, indem er Wasserstoff in Gruppe 1 über Lithium platzierte und Thallium in die Bor-Gruppe verschob. In dieser Version von 1871 wurden Kupfer, Silber und Gold zweimal aufgeführt, einmal als Teil der Gruppe IB und einmal als Teil einer "Gruppe VIII", die die heutigen Gruppen 8 bis 11 umfasste. Nach der Einführung der 18-spaltigen Tabelle wurden die Elemente der Gruppe IB an ihre heutige Position im d-Block verschoben, während die Alkalimetalle in der Gruppe IA verblieben. Später wurde der Name der Gruppe 1988 in Gruppe 1 geändert. Der Trivialname "Alkalimetalle" rührt daher, dass die Hydroxide der Elemente der Gruppe 1 alle starke Laugen sind, wenn sie in Wasser gelöst werden. ⓘ
Es gab mindestens vier irrtümliche und unvollständige Entdeckungen, bevor Marguerite Perey vom Curie-Institut in Paris, Frankreich, 1939 Francium entdeckte, indem sie eine Probe von Actinium-227 reinigte, von dem berichtet wurde, dass es eine Zerfallsenergie von 220 keV hat. Perey bemerkte jedoch Zerfallsteilchen mit einer Energie von weniger als 80 keV. Perey vermutete, dass diese Zerfallsaktivität durch ein bisher nicht identifiziertes Zerfallsprodukt verursacht worden sein könnte, das bei der Reinigung abgetrennt wurde, aber aus dem reinen Actinium-227 wieder auftauchte. Verschiedene Tests schlossen aus, dass es sich bei dem unbekannten Element um Thorium, Radium, Blei, Wismut oder Thallium handeln könnte. Das neue Produkt wies die chemischen Eigenschaften eines Alkalimetalls auf (z. B. Kopräzipitation mit Cäsium-Salzen), was Perey zu der Annahme veranlasste, dass es sich um das Element 87 handelte, das durch den Alphazerfall von Actinium-227 entstand. Perey versuchte daraufhin, das Verhältnis des Beta-Zerfalls zum Alpha-Zerfall von Actinium-227 zu bestimmen. Ihr erster Test ergab eine Alpha-Verzweigung von 0,6 %, eine Zahl, die sie später auf 1 % korrigierte.
- 227
89Ac
223
87Fr
223
88Ra
219
86Rn ⓘ
Das nächste Element unterhalb des Franciums (Eka-Francium) im Periodensystem wäre das Ununennium (Uue), Element 119. Die Synthese von Ununennium wurde erstmals 1985 durch Beschuss eines Einsteinium-254-Targets mit Kalzium-48-Ionen am SuperHILAC-Beschleuniger in Berkeley, Kalifornien, versucht. Es wurden keine Atome gefunden, so dass die Ausbeute bei 300 nb lag. ⓘ
- 254
99Es
+ 48
20Ca
→ 302
119Uue
* → keine Atome ⓘ
Es ist höchst unwahrscheinlich, dass mit dieser Reaktion in naher Zukunft Atome von Ununennium erzeugt werden können, da es äußerst schwierig ist, ausreichende Mengen von Einsteinium-254 herzustellen, das wegen seiner großen Masse, seiner relativ langen Halbwertszeit von 270 Tagen und seiner Verfügbarkeit in signifikanten Mengen von mehreren Mikrogramm für die Produktion von ultraschweren Elementen bevorzugt wird, um ein ausreichend großes Target zu erzeugen, das die Empfindlichkeit des Experiments auf das erforderliche Niveau erhöht; Einsteinium kommt in der Natur nicht vor und wurde bisher nur in Laboratorien hergestellt, und zwar in geringeren Mengen, als sie für eine effektive Synthese überschwerer Elemente erforderlich sind. Da Ununennium jedoch nur das erste Element der Periode 8 im erweiterten Periodensystem ist, könnte es in naher Zukunft durch andere Reaktionen entdeckt werden, und in der Tat läuft in Japan derzeit ein Versuch, es zu synthetisieren. Gegenwärtig ist noch keines der Elemente der Periode 8 entdeckt worden, und es ist auch möglich, dass aufgrund von Tropf-Instabilitäten nur die Elemente der unteren Periode 8, bis etwa Element 128, physikalisch möglich sind. Für die schwereren Alkalimetalle wurden noch keine Syntheseversuche unternommen: Aufgrund ihrer extrem hohen Ordnungszahl wären zu ihrer Herstellung neue, leistungsfähigere Methoden und Technologien erforderlich. ⓘ
Vorkommen
Im Sonnensystem

Die Oddo-Harkins-Regel besagt, dass Elemente mit geraden Ordnungszahlen häufiger vorkommen als Elemente mit ungeraden Ordnungszahlen, mit Ausnahme von Wasserstoff. Diese Regel besagt, dass Elemente mit ungeraden Ordnungszahlen über ein ungepaartes Proton verfügen und es wahrscheinlicher ist, dass sie ein weiteres einfangen, wodurch sich ihre Ordnungszahl erhöht. Bei Elementen mit geraden Ordnungszahlen sind die Protonen gepaart, wobei jedes Mitglied des Paares den Spin des anderen ausgleicht, was die Stabilität erhöht. Alle Alkalimetalle haben ungerade Ordnungszahlen und sind im Sonnensystem nicht so häufig wie die benachbarten Elemente mit geraden Ordnungszahlen (die Edelgase und die Erdalkalimetalle). Die schwereren Alkalimetalle sind auch weniger häufig als die leichteren, da die Alkalimetalle ab Rubidium nur in Supernovae und nicht in der stellaren Nukleosynthese synthetisiert werden können. Lithium ist ebenfalls viel seltener als Natrium und Kalium, da es sowohl in der Urknall-Nukleosynthese als auch in den Sternen schlecht synthetisiert wird: Der Urknall konnte aufgrund des Fehlens eines stabilen Kerns mit 5 oder 8 Nukleonen nur Spurenmengen von Lithium, Beryllium und Bor erzeugen, und die stellare Nukleosynthese konnte diesen Engpass nur durch den Triple-Alpha-Prozess überwinden, bei dem drei Heliumkerne zu Kohlenstoff verschmolzen und diese drei Elemente übersprungen wurden. ⓘ
Auf der Erde

Die Erde entstand aus derselben Materiewolke, aus der auch die Sonne hervorging, aber die Planeten haben während der Entstehung und Entwicklung des Sonnensystems unterschiedliche Zusammensetzungen angenommen. Die natürliche Geschichte der Erde hat wiederum dazu geführt, dass Teile des Planeten unterschiedliche Konzentrationen der Elemente aufweisen. Die Masse der Erde beträgt etwa 5,98×1024 kg. Sie besteht hauptsächlich aus Eisen (32,1 %), Sauerstoff (30,1 %), Silizium (15,1 %), Magnesium (13,9 %), Schwefel (2,9 %), Nickel (1,8 %), Kalzium (1,5 %) und Aluminium (1,4 %); die restlichen 1,2 % bestehen aus Spuren anderer Elemente. Aufgrund der planetarischen Differenzierung wird angenommen, dass die Kernregion hauptsächlich aus Eisen (88,8 %) besteht, mit kleineren Mengen an Nickel (5,8 %), Schwefel (4,5 %) und weniger als 1 % Spurenelementen. ⓘ
Die Alkalimetalle kommen aufgrund ihrer hohen Reaktivität nicht in reiner Form in der Natur vor. Sie sind lithophil und verbleiben daher in der Nähe der Erdoberfläche, da sie sich leicht mit Sauerstoff verbinden und sich so stark mit Siliziumdioxid assoziieren und Minerale mit relativ geringer Dichte bilden, die nicht in den Erdkern absinken. Kalium, Rubidium und Cäsium sind aufgrund ihrer großen Ionenradien ebenfalls unverträgliche Elemente. ⓘ
Natrium und Kalium kommen in der Erde sehr häufig vor, beide gehören zu den zehn häufigsten Elementen in der Erdkruste; Natrium macht, gemessen am Gewicht, etwa 2,6 % der Erdkruste aus und ist damit das sechsthäufigste Element insgesamt und das häufigste Alkalimetall. Kalium macht etwa 1,5 % der Erdkruste aus und ist das siebthäufigste Element. Natrium kommt in vielen verschiedenen Mineralien vor, von denen das häufigste Kochsalz (Natriumchlorid) ist, das in großen Mengen im Meerwasser gelöst vorkommt. Andere feste Vorkommen sind Halit, Amphibol, Kryolith, Nitrat und Zeolith. Viele dieser festen Ablagerungen sind das Ergebnis der Verdunstung alter Meere, die auch heute noch an Orten wie dem Großen Salzsee in Utah und dem Toten Meer stattfindet. Obwohl sie in der Erdkruste fast gleich häufig vorkommen, ist Natrium in den Ozeanen weitaus häufiger als Kalium, zum einen, weil Kalium aufgrund seiner größeren Größe weniger löslich ist, und zum anderen, weil Kalium in den Böden durch Silikate gebunden wird und das, was Kalium auslaugt, von den Pflanzen viel leichter aufgenommen wird als Natrium. ⓘ
Trotz seiner chemischen Ähnlichkeit kommt Lithium aufgrund seiner geringeren Größe normalerweise nicht zusammen mit Natrium oder Kalium vor. Aufgrund seiner relativ geringen Reaktivität kann es im Meerwasser in großen Mengen gefunden werden; man schätzt, dass es im Meerwasser etwa 0,14 bis 0,25 Teile pro Million (ppm) oder 25 mikromolar ist. Aufgrund seiner diagonalen Beziehung zu Magnesium kann es häufig Magnesium in Ferromagnesiummineralien ersetzen, wo seine Konzentration in der Erdkruste etwa 18 ppm beträgt, vergleichbar mit der von Gallium und Niob. Das kommerziell wichtigste Lithiummineral ist Spodumen, das weltweit in großen Vorkommen vorkommt. ⓘ
Rubidium kommt ungefähr so häufig vor wie Zink und häufiger als Kupfer. Es kommt in der Natur in den Mineralien Leucit, Pollucit, Carnallit, Zinnwaldit und Lepidolith vor, obwohl keines dieser Minerale nur Rubidium und keine anderen Alkalimetalle enthält. Cäsium kommt häufiger vor als einige allgemein bekannte Elemente wie Antimon, Cadmium, Zinn und Wolfram, aber viel seltener als Rubidium. ⓘ
Francium-223, das einzige natürlich vorkommende Isotop von Francium, ist das Produkt des Alphazerfalls von Actinium-227 und kann in Spuren in Uranmineralien gefunden werden. Man schätzt, dass in einer bestimmten Uranprobe nur ein Franciumatom auf 1018 Uranatome entfällt. Es wurde errechnet, dass sich in der Erdkruste zu jedem Zeitpunkt höchstens 30 Gramm Francium befinden, was auf seine extrem kurze Halbwertszeit von 22 Minuten zurückzuführen ist. ⓘ
Eigenschaften

Alkalimetalle sind metallisch glänzende, silbrig-weiße weiche Leichtmetalle. Caesium hat bei geringster Verunreinigung einen Goldton. Sie sind mit dem Messer schneidbar. Alkalimetalle haben eine geringe Dichte. Sie reagieren mit vielen Stoffen, so beispielsweise mit Wasser, Luft oder Halogenen teilweise äußerst heftig unter starker Wärmeentwicklung. Insbesondere die schwereren Alkalimetalle können sich an der Luft selbst entzünden. Daher werden sie unter Schutzflüssigkeiten, wie Paraffin oder Petroleum (Lithium, Natrium und Kalium), bzw. unter Luftabschluss in Ampullen (Rubidium und Caesium) aufbewahrt. ⓘ
Als Elemente der ersten Gruppe des Periodensystems besitzen sie nur ein schwach gebundenes s-Elektron, das sie leicht abgeben. Ihre ersten Ionisierungsenergien und ihre Elektronegativitäten sind entsprechend klein. In Verbindungen kommen sie alle fast ausschließlich als einwertige Kationen vor, wenngleich sogar Verbindungen bekannt sind, in denen diese Metalle anionisch vorliegen (z. B. Natride, komplexiert mit sogenannten Kryptanden).
Alkalimetalle und ihre Salze besitzen eine spezifische Flammenfärbung:
- Lithium und seine Salze färben die Flamme rot (671 nm).
- Natrium und seine Salze färben die Flamme gelb (589 nm).
- Kalium und seine Salze färben die Flamme violett (768 und 404 nm).
- Rubidium und seine Salze färben die Flamme rot (780 und 421 nm).
- Caesium und seine Salze färben die Flamme blauviolett (458 nm). ⓘ
Aufgrund dieser Flammenfärbung werden Alkalimetallverbindungen für Feuerwerke benutzt. ⓘ
In der Atomphysik werden Alkalimetalle eingesetzt, da sie sich aufgrund ihrer besonders einfachen elektronischen Struktur besonders leicht mit Lasern kühlen lassen. ⓘ
Physikalische und chemische Eigenschaften
Die physikalischen und chemischen Eigenschaften der Alkalimetalle lassen sich leicht dadurch erklären, dass sie eine ns1-Valenz-Elektronenkonfiguration haben, die zu einer schwachen metallischen Bindung führt. Daher sind alle Alkalimetalle weich und haben niedrige Dichten, Schmelz- und Siedepunkte sowie Sublimations-, Verdampfungs- und Dissoziationswärmen. Sie kristallisieren alle in der kubisch-raumzentrierten Kristallstruktur und haben charakteristische Flammenfarben, da ihr äußeres s-Elektron sehr leicht angeregt wird. Die ns1-Konfiguration führt auch dazu, dass die Alkalimetalle sehr große Atom- und Ionenradien sowie eine sehr hohe thermische und elektrische Leitfähigkeit haben. Die Chemie der Alkalimetalle wird durch den Verlust ihres einsamen Valenzelektrons im äußersten s-Orbital dominiert, wodurch der Oxidationszustand +1 entsteht, da dieses Elektron leicht zu ionisieren ist und die zweite Ionisierungsenergie sehr hoch ist. Die meisten chemischen Vorgänge sind nur bei den ersten fünf Mitgliedern der Gruppe beobachtet worden. Die Chemie von Francium ist aufgrund seiner extremen Radioaktivität nicht gut erforscht; daher ist die Darstellung seiner Eigenschaften hier begrenzt. Das wenige, was über Francium bekannt ist, zeigt, dass es sich erwartungsgemäß sehr ähnlich wie Cäsium verhält. Die physikalischen Eigenschaften von Francium sind noch unklarer, da das Element in seiner Gesamtheit noch nie beobachtet wurde; daher sind alle Daten, die man in der Literatur finden kann, sicherlich spekulative Extrapolationen. ⓘ
| Bezeichnung | Lithium | Natrium | Kalium | Rubidium | Cäsium | Francium ⓘ |
|---|---|---|---|---|---|---|
| Ordnungszahl | 3 | 11 | 19 | 37 | 55 | 87 |
| Standard-Atomgewicht (u) | 6.94(1) | 22.98976928(2) | 39.0983(1) | 85.4678(3) | 132.9054519(2) | [223] |
| Elektronenkonfiguration | [[[Helium|He]]] 2s1 | [[[Neon|Ne]]] 3s1 | [[[Argon|Ar]]] 4s1 | [[[Krypton|Kr]]] 5s1 | [[[Xenon|Xe]]] 6s1 | [[[Radon|Rn]]] 7s1 |
| Schmelzpunkt (°C) | 180.54 | 97.72 | 63.38 | 39.31 | 28.44 | ? |
| Siedepunkt (°C) | 1342 | 883 | 759 | 688 | 671 | ? |
| Dichte (g-cm-3) | 0.534 | 0.968 | 0.89 | 1.532 | 1.93 | ? |
| Schmelzwärme (kJ-mol-1) | 3.00 | 2.60 | 2.321 | 2.19 | 2.09 | ? |
| Verdampfungswärme (kJ-mol-1) | 136 | 97.42 | 79.1 | 69 | 66.1 | ? |
| Bildungswärme eines einatomigen Gases (kJ-mol-1) | 162 | 108 | 89.6 | 82.0 | 78.2 | ? |
| Elektrischer Widerstand bei 25 °C (nΩ-cm) | 94.7 | 48.8 | 73.9 | 131 | 208 | ? |
| Atomarer Radius (pm) | 152 | 186 | 227 | 248 | 265 | ? |
| Ionenradius des hexakoordinierten M+-Ions (pm) | 76 | 102 | 138 | 152 | 167 | ? |
| Erste Ionisierungsenergie (kJ-mol-1) | 520.2 | 495.8 | 418.8 | 403.0 | 375.7 | 392.8 |
| Elektronenaffinität (kJ-mol-1) | 59.62 | 52.87 | 48.38 | 46.89 | 45.51 | ? |
| Enthalpie der Dissoziation von M2 (kJ-mol-1) | 106.5 | 73.6 | 57.3 | 45.6 | 44.77 | ? |
| Pauling-Elektronegativität | 0.98 | 0.93 | 0.82 | 0.82 | 0.79 | ? |
| Allen-Elektronegativität | 0.91 | 0.87 | 0.73 | 0.71 | 0.66 | 0.67 |
| Standard-Elektrodenpotential (E°(M+→M0); V) | −3.04 | −2.71 | −2.93 | −2.98 | −3.03 | ? |
| Farbe des Flammentests Hauptwellenlänge der Emission/Absorption (nm) |
Karminrot 670.8 |
Gelb 589.2 |
Violett 766.5 |
Rotviolett 780.0 |
Blau 455.5 |
? |
Die Alkalimetalle sind einander ähnlicher als alle anderen Elemente der Gruppe. Die Ähnlichkeit ist sogar so groß, dass es recht schwierig ist, Kalium, Rubidium und Cäsium aufgrund ihrer ähnlichen Ionenradien voneinander zu trennen; Lithium und Natrium sind eindeutiger. Wenn man in der Tabelle nach unten geht, zeigen alle bekannten Alkalimetalle zunehmende Atomradien, abnehmende Elektronegativität, zunehmende Reaktivität und abnehmende Schmelz- und Siedepunkte sowie Schmelz- und Verdampfungswärme. Im Allgemeinen nimmt ihre Dichte zu, wenn sie in der Tabelle nach unten wandern, mit der Ausnahme, dass Kalium eine geringere Dichte als Natrium aufweist. Eine der wenigen Eigenschaften der Alkalimetalle, die keinen gleichmäßigen Verlauf aufweist, ist ihr Reduktionspotenzial: Der Wert von Lithium ist anomal, da er negativer ist als der der anderen Metalle. Der Grund dafür ist, dass das Li+-Ion in der Gasphase eine sehr hohe Hydratationsenergie hat: Obwohl das Lithium-Ion die Struktur des Wassers erheblich stört, was zu einer höheren Entropieänderung führt, reicht diese hohe Hydratationsenergie aus, um die Reduktionspotenziale als das elektropositivste Alkalimetall auszuweisen, obwohl es in der Gasphase schwer zu ionisieren ist. ⓘ
Die stabilen Alkalimetalle sind alle silberfarben, mit Ausnahme von Cäsium, das einen blassgoldenen Farbton aufweist: Es ist eines von nur drei Metallen, die eine klare Farbe haben (die anderen beiden sind Kupfer und Gold). Auch die schweren Erdalkalimetalle Kalzium, Strontium und Barium sowie die zweiwertigen Lanthanoide Europium und Ytterbium sind blassgelb, wenn auch weit weniger ausgeprägt als bei Cäsium. Ihr Glanz trübt sich an der Luft durch Oxidation schnell ein. Sie kristallisieren alle in der kubisch-raumzentrierten Kristallstruktur und haben charakteristische Flammenfarben, da ihr äußeres s-Elektron sehr leicht angeregt wird. Diese Flammenfarben sind in der Tat das gebräuchlichste Mittel, um sie zu identifizieren, da alle ihre Salze mit gängigen Ionen löslich sind. ⓘ
Alle Alkalimetalle sind hochreaktiv und kommen in der Natur nicht in elementarer Form vor. Deshalb werden sie in der Regel in Mineralöl oder Kerosin (Paraffinöl) gelagert. Sie reagieren aggressiv mit den Halogenen und bilden die Alkalimetallhalogenide, weiße, ionische, kristalline Verbindungen, die mit Ausnahme von Lithiumfluorid (Li F) alle wasserlöslich sind. Die Alkalimetalle reagieren mit Wasser auch zu stark alkalischen Hydroxiden und sollten daher mit großer Vorsicht behandelt werden. Die schwereren Alkalimetalle reagieren heftiger als die leichteren; so erzeugt beispielsweise Cäsium beim Eintauchen in Wasser eine größere Explosion als Kalium, wenn die gleiche Anzahl von Molen jedes Metalls verwendet wird. Die Alkalimetalle haben die niedrigsten ersten Ionisierungsenergien in ihren jeweiligen Perioden des Periodensystems, weil sie eine geringe effektive Kernladung haben und durch den Verlust eines Elektrons eine Edelgaskonfiguration erreichen können. Die Alkalimetalle reagieren nicht nur mit Wasser, sondern auch mit Protonendonatoren wie Alkoholen und Phenolen, gasförmigem Ammoniak und Alkenen, wobei letztere den phänomenalen Grad ihrer Reaktivität demonstrieren. Durch ihre große Kraft als Reduktionsmittel sind sie sehr nützlich, um andere Metalle aus ihren Oxiden oder Halogeniden zu befreien. ⓘ
Die zweite Ionisierungsenergie aller Alkalimetalle ist sehr hoch, da sie sich in einer vollen Schale befinden, die auch näher am Kern liegt; daher verlieren sie fast immer ein einzelnes Elektron und bilden Kationen. Eine Ausnahme bilden die Alkalide: Es handelt sich dabei um instabile Verbindungen, die Alkalimetalle in der Oxidationsstufe -1 enthalten, was sehr ungewöhnlich ist, da man vor der Entdeckung der Alkalide davon ausging, dass die Alkalimetalle keine Anionen bilden können und in Salzen nur als Kationen auftreten können. Die Anionen der Alkalide haben gefüllte s-Unterschalen, was ihnen genügend Stabilität verleiht, um zu existieren. Es ist bekannt, dass alle stabilen Alkalimetalle mit Ausnahme von Lithium in der Lage sind, Alkalide zu bilden, und die Alkalide sind aufgrund ihrer ungewöhnlichen Stöchiometrie und ihrer niedrigen Ionisierungspotenziale von großem theoretischen Interesse. Alkalide ähneln chemisch den Elektronen, die Salze mit eingefangenen Elektronen sind, die als Anionen wirken. Ein besonders auffälliges Beispiel für ein Alkalid ist das "inverse Natriumhydrid", H+Na- (beide Ionen sind komplexiert), im Gegensatz zum gewöhnlichen Natriumhydrid, Na+H-: Es ist isoliert instabil, da es eine hohe Energie aufweist, die aus der Verschiebung von zwei Elektronen von Wasserstoff zu Natrium resultiert, obwohl mehrere Derivate als metastabil oder stabil vorhergesagt werden. ⓘ
In wässriger Lösung bilden die Alkalimetallionen Wasserionen mit der Formel [M(H2O)n]+, wobei n die Solvatationszahl ist. Ihre Koordinationszahlen und -formen stimmen gut mit den Erwartungen überein, die sich aus ihren Ionenradien ergeben. In wässriger Lösung gehören die Wassermoleküle, die direkt an das Metallion gebunden sind, zur ersten Koordinationssphäre, die auch als erste oder primäre Solvatationsschale bezeichnet wird. Die Bindung zwischen einem Wassermolekül und dem Metallion ist eine dative kovalente Bindung, wobei das Sauerstoffatom beide Elektronen an die Bindung abgibt. Jedes koordinierte Wassermolekül kann durch Wasserstoffbrückenbindungen mit anderen Wassermolekülen verbunden sein. Letztere befinden sich dann in der zweiten Koordinationssphäre. Bei den Alkalimetallkationen ist die zweite Koordinationssphäre jedoch nicht gut definiert, da die +1-Ladung des Kations nicht hoch genug ist, um die Wassermoleküle in der primären Solvatationsschale so stark zu polarisieren, dass sie starke Wasserstoffbrückenbindungen mit den Molekülen in der zweiten Koordinationssphäre eingehen können, wodurch eine stabilere Einheit entsteht. Die Solvatationszahl für Li+ wurde experimentell auf 4 festgelegt, wodurch das tetraedrische [Li(H2O)4]+ gebildet wird: Während für Lithium-Aqua-Ionen Solvatationszahlen von 3 bis 6 gefunden wurden, können Solvatationszahlen unter 4 das Ergebnis der Bildung von Kontakt-Ionenpaaren sein, und die höheren Solvatationszahlen können in Bezug auf Wassermoleküle interpretiert werden, die sich [Li(H2O)4]+ durch eine Fläche des Tetraeders nähern, obwohl molekulardynamische Simulationen auf die Existenz eines oktaedrischen Hexaqua-Ions hindeuten könnten. Wahrscheinlich gibt es auch sechs Wassermoleküle in der primären Solvatationssphäre des Natriumions, die das oktaedrische [Na(H2O)6]+-Ion bilden. Während man früher davon ausging, dass auch die schwereren Alkalimetalle oktaedrische Hexaqua-Ionen bilden, hat man inzwischen herausgefunden, dass Kalium und Rubidium wahrscheinlich die Ionen [K(H2O)8]+ und [Rb(H2O)8]+ bilden, die eine quadratische antiprismatische Struktur aufweisen, und dass Cäsium das 12-koordinierte Ion [Cs(H2O)12]+ bildet. ⓘ
Lithium
Die Chemie des Lithiums unterscheidet sich in einigen Punkten von der der übrigen Gruppe, da das kleine Li+-Kation die Anionen polarisiert und seinen Verbindungen einen eher kovalenten Charakter verleiht. Lithium und Magnesium stehen aufgrund ihrer ähnlichen Atomradien in einem diagonalen Verhältnis zueinander, so dass sie einige Ähnlichkeiten aufweisen. So bildet Lithium beispielsweise ein stabiles Nitrid, eine Eigenschaft, die allen Erdalkalimetallen (der Magnesiumgruppe) gemeinsam ist, die aber bei den Alkalimetallen einzigartig ist. Darüber hinaus bilden nur Lithium und Magnesium in ihren jeweiligen Gruppen metallorganische Verbindungen mit ausgeprägtem kovalentem Charakter (z. B. LiMe und MgMe2). ⓘ
Lithiumfluorid ist das einzige Alkalimetallhalogenid, das in Wasser schwer löslich ist, und Lithiumhydroxid ist das einzige Alkalimetallhydroxid, das nicht zerfließt. Umgekehrt sind Lithiumperchlorat und andere Lithiumsalze mit großen Anionen, die nicht polarisiert werden können, viel stabiler als die entsprechenden Verbindungen der anderen Alkalimetalle, wahrscheinlich weil Li+ eine hohe Solvatationsenergie hat. Dieser Effekt führt auch dazu, dass die meisten einfachen Lithiumsalze in hydratisierter Form vorkommen, da die wasserfreien Formen extrem hygroskopisch sind: So können Salze wie Lithiumchlorid und Lithiumbromid in Luftentfeuchtern und Klimaanlagen verwendet werden. ⓘ
Francium
Auch bei Francium werden aufgrund seines hohen Atomgewichts Unterschiede vorhergesagt, da sich seine Elektronen mit einem beträchtlichen Bruchteil der Lichtgeschwindigkeit bewegen und somit relativistische Effekte stärker zum Tragen kommen. Entgegen dem Trend abnehmender Elektronegativitäten und Ionisierungsenergien der Alkalimetalle werden für Francium aufgrund der relativistischen Stabilisierung der 7s-Elektronen höhere Elektronegativitäten und Ionisierungsenergien als für Cäsium vorhergesagt; außerdem wird erwartet, dass sein Atomradius ungewöhnlich niedrig ist. Entgegen den Erwartungen ist also Cäsium das reaktionsfreudigste der Alkalimetalle, nicht Francium. Alle bekannten physikalischen Eigenschaften von Francium weichen ebenfalls von den eindeutigen Trends von Lithium zu Cäsium ab, wie z. B. die erste Ionisierungsenergie, die Elektronenaffinität und die Polarisierbarkeit der Anionen, obwohl viele Quellen aufgrund des Mangels an bekannten Daten über Francium extrapolierte Werte angeben und dabei ignorieren, dass relativistische Effekte den Trend von Lithium zu Cäsium bei Francium unanwendbar machen. Einige der wenigen Eigenschaften von Francium, die unter Berücksichtigung der Relativitätstheorie vorhergesagt wurden, sind die Elektronenaffinität (47,2 kJ/mol) und die Dissoziationsenthalpie des Fr2-Moleküls (42,1 kJ/mol). Das CsFr-Molekül ist als Cs+Fr- polarisiert, was zeigt, dass die 7s-Unterschale von Francium viel stärker von relativistischen Effekten betroffen ist als die 6s-Unterschale von Cäsium. Außerdem wird erwartet, dass Francium-Superoxid (FrO2) im Gegensatz zu den anderen Alkalimetall-Superoxiden aufgrund der Bindungsbeiträge der 6p-Elektronen von Francium einen signifikanten kovalenten Charakter hat. ⓘ
Kernbestand
| Z |
Alkalimetall |
Stabil |
Zerfälle |
instabil: kursiv ungerade Isotope rosa gefärbt
| ||
|---|---|---|---|---|---|---|
| 3 | Lithium | 2 | — | 7 Li |
6 Li |
|
| 11 | Natrium | 1 | — | 23 Na |
||
| 19 | Kalium | 2 | 1 | 39 K |
41 K |
40 K |
| 37 | Rubidium | 1 | 1 | 85 Rb |
87 Rb |
|
| 55 | Cäsium | 1 | — | 133 Cs |
||
| 87 | Francium | — | — | Keine primordialen Isotope (223 Fr ist ein radiogenes Nuklid) | ||
| Radioaktiv: 40K, t1/2 1,25 × 109 Jahre; 87Rb, t1/2 4,9 × 1010 Jahre; 223Fr, t1/2 22,0 min. | ||||||
Alle Alkalimetalle haben ungerade Ordnungszahlen; daher müssen ihre Isotope entweder ungerade (sowohl Protonen- als auch Neutronenzahl sind ungerade) oder ungerade-gerade (Protonenzahl ist ungerade, aber Neutronenzahl ist gerade) sein. Ungerade Kerne haben eine gerade Massenzahl, während ungerade Kerne eine ungerade Massenzahl haben. Ungerade Primordialnuklide sind selten, da die meisten ungeraden Kerne in Bezug auf den Betazerfall sehr instabil sind, da die Zerfallsprodukte gerade sind und daher aufgrund von Kernpaarungseffekten stärker gebunden sind. ⓘ
Aufgrund der großen Seltenheit der ungeraden Kerne sind fast alle ursprünglichen Isotope der Alkalimetalle ungerade (Ausnahmen sind das leichte stabile Isotop Lithium-6 und das langlebige Radioisotop Kalium-40). Für eine gegebene ungerade Massenzahl kann es nur ein einziges beta-stabiles Nuklid geben, da der Unterschied in der Bindungsenergie zwischen gerade-ungerade und ungerade-gerade nicht mit dem zwischen gerade-gerade und ungerade-ungerade vergleichbar ist, so dass andere Nuklide der gleichen Massenzahl (Isobaren) frei sind, in Richtung des Nuklids mit der niedrigsten Masse zu beta-zerfallen. Eine Auswirkung der Instabilität einer ungeraden Anzahl von Nukleonen ist, dass ungerade Elemente, wie z. B. die Alkalimetalle, dazu neigen, weniger stabile Isotope zu haben als geradzahlige Elemente. Von den 26 monoisotopischen Elementen, die nur ein einziges stabiles Isotop haben, haben alle bis auf eines eine ungerade Ordnungszahl und alle bis auf eines auch eine gerade Anzahl von Neutronen. Beryllium ist aufgrund seiner niedrigen Ordnungszahl die einzige Ausnahme von beiden Regeln. ⓘ
Alle Alkalimetalle außer Lithium und Cäsium haben mindestens ein natürlich vorkommendes Radioisotop: Natrium-22 und Natrium-24 sind kosmogen erzeugte Spurenradioisotope, Kalium-40 und Rubidium-87 haben sehr lange Halbwertszeiten und kommen daher natürlich vor, und alle Isotope des Cäsiums sind radioaktiv. Auch Cäsium wurde zu Beginn des 20. Jahrhunderts für radioaktiv gehalten, obwohl es keine natürlich vorkommenden Radioisotope besitzt. (Francium war damals noch nicht entdeckt worden.) Das natürliche langlebige Radioisotop von Kalium, Kalium-40, macht etwa 0,012 % des natürlichen Kaliums aus, und somit ist natürliches Kalium schwach radioaktiv. Diese natürliche Radioaktivität diente 1925 als Grundlage für die irrtümliche Behauptung, das Element 87 (das nächste Alkalimetall nach Cäsium) entdeckt zu haben. Natürliches Rubidium ist ebenfalls schwach radioaktiv, wobei 27,83 % auf das langlebige Radioisotop Rubidium-87 entfallen. ⓘ
Cäsium-137 mit einer Halbwertszeit von 30,17 Jahren ist neben Strontium-90 eines der beiden wichtigsten mittellebigen Spaltprodukte, die für den größten Teil der Radioaktivität abgebrannter Brennelemente nach mehrjähriger Abkühlung bis zu mehreren hundert Jahren nach der Nutzung verantwortlich sind. Es macht den größten Teil der Radioaktivität aus, die vom Unfall in Tschernobyl übrig geblieben ist. Cäsium-137 unterliegt einem hochenergetischen Betazerfall und wird schließlich zu stabilem Barium-137. Es ist ein starker Emittent von Gammastrahlung. Cäsium-137 hat eine sehr geringe Neutroneneinfangrate und kann auf diese Weise nicht entsorgt werden, sondern muss zerfallen. Cäsium-137 wurde analog zum Tritium als Tracer in hydrologischen Studien verwendet. Geringe Mengen von Cäsium-134 und Cäsium-137 wurden bei fast allen Kernwaffentests und bei einigen nuklearen Unfällen in die Umwelt freigesetzt, vor allem beim Unfall in Goiânia und bei der Katastrophe von Tschernobyl. Seit 2005 ist Cäsium-137 die Hauptstrahlungsquelle in der Zone der Entfremdung um das Kernkraftwerk Tschernobyl. Seine chemischen Eigenschaften als eines der Alkalimetalle machen es zu einem der problematischsten Spaltprodukte mit kurzer bis mittlerer Lebensdauer, da es sich aufgrund der hohen Wasserlöslichkeit seiner Salze in der Natur leicht bewegt und ausbreitet und vom Körper aufgenommen wird, der es mit seinen essenziellen Verwandten Natrium und Kalium verwechselt. ⓘ
Physikalische Eigenschaften
Alle Alkalimetalle kristallisieren in der kubisch-raumzentrierten Struktur. Lediglich Lithium und Natrium kristallisieren in der hexagonal-dichtesten Packung, wenn tiefe Temperaturen vorherrschen. ⓘ
Der Radius der Elementatome sowie der Kationen nimmt mit steigender Massenzahl zu. Viele andere Eigenschaften der Alkalimetalle zeigen einen Trend innerhalb der Gruppe von oben nach unten:
- Abnahme der Härte, Ionisierungsenergie, Elektronegativität, Schmelz- und Siedepunkte,
- Zunahme der Reaktivität, Basizität und Dichte. ⓘ
| Element | Lithium | Natrium | Kalium | Rubidium | Cäsium | Francium ⓘ |
|---|---|---|---|---|---|---|
| Schmelzpunkt (1013 hPa) | 453,69 K (180,54 °C) |
370,87 K (97,72 °C) |
336,53 K (63,38 °C) |
312,46 K (39,31 °C) |
301,59 K (28,44 °C) |
298 K (25 °C) |
| Siedepunkt (1013 hPa) | 1603 K (1330 °C) |
1163 K (890 °C) |
1047 K (774 °C) |
961,2 K (688 °C) |
963,2 K (690 °C) |
950 K (677 °C) |
| Kritischer Punkt |
|
|
|
|
|
|
| Dichte (20 °C, 1013 hPa) | 0,534 g/cm3 | 0,968 g/cm3 | 0,856 g/cm3 | 1,532 g/cm3 | 1,90 g/cm3 | 2,48 g/cm3 |
| Mohshärte | 0,6 | 0,5 | 0,4 | 0,3 | 0,2 | |
| Elektrische Leitfähigkeit | 10,6 · 106 S/m | 21 · 106 S/m | 14,3 · 106 S/m | 7,52 · 106 S/m | 4,76 · 106 S/m | |
| Atommasse | 6,94 u | 22,990 u | 39,098 u | 85,468 u | 132,905 u | 223,020 u |
| Elektronegativität | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
| Struktur | 
|

|

|

|

|

|
| Kristallsystem | kubisch raumzentriert | kubisch raumzentriert | kubisch raumzentriert | kubisch raumzentriert | kubisch raumzentriert | kubisch raumzentriert |
Periodische Tendenzen
Die Alkalimetalle sind einander ähnlicher als alle anderen Elemente der Gruppe. So zeigen alle bekannten Alkalimetalle, wenn man in der Tabelle nach unten geht, einen zunehmenden Atomradius, eine abnehmende Elektronegativität, eine zunehmende Reaktivität und abnehmende Schmelz- und Siedepunkte sowie Schmelz- und Verdampfungswärme. Im Allgemeinen nimmt ihre Dichte zu, wenn sie in der Tabelle nach unten wandern, mit der Ausnahme, dass Kalium eine geringere Dichte als Natrium aufweist. ⓘ
Atomare und ionische Radien

Die Atomradien der Alkalimetalle nehmen in der Gruppe nach unten hin zu. Wenn ein Atom mehr als eine Elektronenhülle hat, wird jedes Elektron aufgrund des Abschirmungseffekts sowohl von den anderen Elektronen abgestoßen als auch vom Kern angezogen. Bei den Alkalimetallen hat das äußerste Elektron nur eine Nettoladung von +1, da ein Teil der Kernladung (die gleich der Ordnungszahl ist) durch die inneren Elektronen aufgehoben wird; die Anzahl der inneren Elektronen eines Alkalimetalls ist immer um eins geringer als die Kernladung. Der einzige Faktor, der den Atomradius der Alkalimetalle beeinflusst, ist also die Anzahl der Elektronenschalen. Da diese Zahl mit der Gruppe zunimmt, muss auch der Atomradius mit der Gruppe zunehmen. ⓘ
Die Ionenradien der Alkalimetalle sind viel kleiner als ihre Atomradien. Dies liegt daran, dass sich das äußerste Elektron der Alkalimetalle in einer anderen Elektronenhülle befindet als die inneren Elektronen. Wenn es entfernt wird, hat das resultierende Atom daher eine Elektronenhülle weniger und ist kleiner. Außerdem hat sich die effektive Kernladung erhöht, so dass die Elektronen stärker zum Kern hingezogen werden und der Ionenradius abnimmt. ⓘ
Erste Ionisierungsenergie
Die erste Ionisierungsenergie eines Elements oder Moleküls ist die Energie, die erforderlich ist, um das am lockersten gebundene Elektron aus einem Mol gasförmiger Atome des Elements oder Moleküls zu entfernen und ein Mol gasförmiger Ionen mit der elektrischen Ladung +1 zu bilden. Die Faktoren, die sich auf die erste Ionisierungsenergie auswirken, sind die Kernladung, der Grad der Abschirmung durch die inneren Elektronen und der Abstand des am lockersten gehaltenen Elektrons vom Kern, der bei den Hauptgruppenelementen immer ein Außenelektron ist. Die ersten beiden Faktoren verändern die effektive Kernladung, die das am weitesten außen liegende Elektron empfindet. Da das äußerste Elektron der Alkalimetalle immer die gleiche effektive Kernladung (+1) empfindet, ist der einzige Faktor, der die erste Ionisierungsenergie beeinflusst, der Abstand des äußersten Elektrons zum Kern. Da dieser Abstand von Gruppe zu Gruppe zunimmt, spürt das äußerste Elektron eine geringere Anziehungskraft des Kerns und die erste Ionisierungsenergie nimmt ab. (Dieser Trend wird bei Francium durch die relativistische Stabilisierung und Kontraktion des 7s-Orbitals durchbrochen, wodurch das Valenzelektron von Francium näher an den Kern heranrückt, als dies bei nichtrelativistischen Berechnungen zu erwarten wäre. Dadurch fühlt sich das äußerste Elektron des Franciums stärker vom Kern angezogen, was seine erste Ionisierungsenergie etwas über die von Cäsium hinaus erhöht). ⓘ
Die zweite Ionisierungsenergie der Alkalimetalle ist viel höher als die erste, da das zweithöchste, lose gehaltene Elektron Teil einer vollständig gefüllten Elektronenhülle ist und daher schwer zu entfernen ist. ⓘ
Reaktivität
Die Reaktivität der Alkalimetalle nimmt in der Gruppe nach unten hin zu. Dies ist das Ergebnis einer Kombination aus zwei Faktoren: der ersten Ionisierungsenergie und der Atomisierungsenergie der Alkalimetalle. Da die erste Ionisierungsenergie der Alkalimetalle mit abnehmender Gruppe abnimmt, ist es für das äußerste Elektron leichter, aus dem Atom entfernt zu werden und an chemischen Reaktionen teilzunehmen, was die Reaktivität mit abnehmender Gruppe erhöht. Die Atomisierungsenergie ist ein Maß für die Stärke der metallischen Bindung eines Elements, die mit zunehmendem Radius der Atome in der Gruppe abnimmt, so dass die Länge der metallischen Bindung zunehmen muss, wodurch sich die delokalisierten Elektronen weiter von der Anziehungskraft der Kerne der schwereren Alkalimetalle entfernen. Addiert man die Atomisierungs- und die erste Ionisierungsenergie, so erhält man eine Größe, die eng mit der Aktivierungsenergie der Reaktion eines Alkalimetalls mit einem anderen Stoff zusammenhängt (aber nicht gleich ist). Diese Größe nimmt mit der Gruppe ab, ebenso wie die Aktivierungsenergie; somit können chemische Reaktionen schneller ablaufen und die Reaktivität nimmt mit der Gruppe zu. ⓘ
Elektronegativität

Die Elektronegativität ist eine chemische Eigenschaft, die die Tendenz eines Atoms oder einer funktionellen Gruppe beschreibt, Elektronen (oder die Elektronendichte) an sich zu binden. Wäre die Bindung zwischen Natrium und Chlor in Natriumchlorid kovalent, würde das gemeinsame Elektronenpaar vom Chlor angezogen werden, da die effektive Kernladung der Außenelektronen beim Chlor +7, beim Natrium jedoch nur +1 beträgt. Das Elektronenpaar wird so nahe an das Chloratom angezogen, dass es praktisch auf das Chloratom übertragen wird (eine Ionenbindung). Ersetzt man jedoch das Natriumatom durch ein Lithiumatom, werden die Elektronen nicht mehr so stark vom Chloratom angezogen wie zuvor, da das Lithiumatom kleiner ist und das Elektronenpaar daher stärker von der näheren effektiven Kernladung des Lithiums angezogen wird. Folglich sind die größeren Alkalimetallatome (weiter unten in der Gruppe) weniger elektronegativ, da das Bindungspaar weniger stark von ihnen angezogen wird. Wie bereits erwähnt, dürfte Francium eine Ausnahme darstellen. ⓘ
Aufgrund der höheren Elektronegativität von Lithium haben einige seiner Verbindungen einen eher kovalenten Charakter. So löst sich beispielsweise Lithiumiodid (Li I) in organischen Lösungsmitteln, eine Eigenschaft der meisten kovalenten Verbindungen. Lithiumfluorid (LiF) ist das einzige Alkalihalogenid, das nicht in Wasser löslich ist, und Lithiumhydroxid (LiOH) ist das einzige Alkalimetallhydroxid, das nicht zerfließend ist. ⓘ
Schmelz- und Siedepunkte
Der Schmelzpunkt eines Stoffes ist der Punkt, an dem er vom festen in den flüssigen Zustand übergeht, während der Siedepunkt eines Stoffes (im flüssigen Zustand) der Punkt ist, an dem der Dampfdruck der Flüssigkeit gleich dem die Flüssigkeit umgebenden Umgebungsdruck ist und die gesamte Flüssigkeit in den gasförmigen Zustand übergeht. Wenn ein Metall auf seinen Schmelzpunkt erhitzt wird, werden die metallischen Bindungen, die die Atome an Ort und Stelle halten, schwächer, so dass sich die Atome bewegen können, und die metallischen Bindungen brechen schließlich am Siedepunkt des Metalls vollständig auf. Die sinkenden Schmelz- und Siedepunkte der Alkalimetalle deuten also darauf hin, dass die Stärke der metallischen Bindungen der Alkalimetalle in der Gruppe abnimmt. Dies liegt daran, dass die Metallatome durch die elektromagnetische Anziehung der positiven Ionen zu den delokalisierten Elektronen zusammengehalten werden. Mit zunehmender Größe der Atome in der Gruppe (weil ihr Atomradius zunimmt) entfernen sich die Kerne der Ionen weiter von den delokalisierten Elektronen, so dass die metallische Bindung schwächer wird und das Metall leichter schmelzen und sieden kann, wodurch der Schmelz- und Siedepunkt sinkt. (Die erhöhte Kernladung ist aufgrund des Abschirmungseffekts kein relevanter Faktor). ⓘ
Dichte
Die Alkalimetalle haben alle die gleiche Kristallstruktur (kubisch-raumzentriert), so dass die einzigen relevanten Faktoren die Anzahl der Atome sind, die in ein bestimmtes Volumen passen, und die Masse eines der Atome, da die Dichte als Masse pro Volumeneinheit definiert ist. Der erste Faktor hängt vom Volumen des Atoms und damit vom Atomradius ab, der in der Gruppe nach unten hin zunimmt; das Volumen eines Alkalimetallatoms nimmt also in der Gruppe nach unten hin zu. Auch die Masse eines Alkalimetallatoms nimmt mit abnehmender Gruppe zu. Die Tendenz der Dichten der Alkalimetalle hängt also von ihren Atomgewichten und Atomradien ab; sind die Zahlen für diese beiden Faktoren bekannt, können die Verhältnisse zwischen den Dichten der Alkalimetalle berechnet werden. Daraus ergibt sich die Tendenz, dass die Dichten der Alkalimetalle in der Tabelle nach unten hin zunehmen, mit einer Ausnahme bei Kalium. Da die Alkalimetalle die geringste Atommasse und den größten Atomradius aller Elemente in ihren Perioden haben, sind sie die Metalle mit der geringsten Dichte im Periodensystem. Lithium, Natrium und Kalium sind die einzigen drei Metalle im Periodensystem, die eine geringere Dichte als Wasser aufweisen: Lithium ist bei Raumtemperatur sogar der am wenigsten dichte bekannte Feststoff. ⓘ
Verbindungen
Die Alkalimetalle bilden mit allen üblicherweise vorkommenden Anionen eine vollständige Reihe von Verbindungen, die die Tendenzen der Gruppe gut veranschaulichen. Diese Verbindungen können so beschrieben werden, dass die Alkalimetalle Elektronen an Akzeptor-Spezies verlieren und monopositive Ionen bilden. Diese Beschreibung ist für Alkalihalogenide am genauesten und wird immer ungenauer, wenn die kationische und anionische Ladung zunimmt und das Anion größer und polarisierbarer wird. So geht beispielsweise die ionische Bindung in der Reihe NaCl, Na2O, Na2S, Na3P, Na3As, Na3Sb, Na3Bi, Na in eine metallische Bindung über. ⓘ
Hydroxide
| Externes Video ⓘ | |
|---|---|
Alle Alkalimetalle reagieren heftig oder explosionsartig mit kaltem Wasser, wobei eine wässrige Lösung eines stark basischen Alkalimetallhydroxids entsteht und Wasserstoffgas freigesetzt wird. Diese Reaktion wird von Gruppe zu Gruppe heftiger: Lithium reagiert gleichmäßig mit Sprudeln, Natrium und Kalium können sich jedoch entzünden, und Rubidium und Cäsium sinken im Wasser und erzeugen so schnell Wasserstoffgas, dass sich im Wasser Schockwellen bilden, die Glasgefäße zerbrechen können. Wenn ein Alkalimetall in Wasser fällt, kommt es zu einer Explosion, die in zwei Stufen abläuft. Zunächst reagiert das Metall mit dem Wasser, wobei es die Wasserstoffbrücken im Wasser aufbricht und Wasserstoffgas erzeugt; bei den reaktionsfreudigeren schwereren Alkalimetallen geschieht dies schneller. Zweitens entzündet die durch den ersten Teil der Reaktion erzeugte Wärme häufig das Wasserstoffgas, wodurch es explosionsartig in die Umgebungsluft verbrennt. Diese sekundäre Wasserstoffgasexplosion erzeugt die sichtbare Flamme über der Wasserschüssel, dem See oder einem anderen Gewässer, nicht die ursprüngliche Reaktion des Metalls mit Wasser (die meist unter Wasser stattfindet). Die Alkalimetallhydroxide sind die basischsten bekannten Hydroxide. ⓘ
Jüngste Forschungsarbeiten legen nahe, dass das explosive Verhalten von Alkalimetallen in Wasser durch eine Coulomb-Explosion und nicht nur durch die schnelle Erzeugung von Wasserstoff selbst bedingt ist. Alle Alkalimetalle schmelzen als Teil der Reaktion mit Wasser. Wassermoleküle ionisieren die blanke Metalloberfläche des flüssigen Metalls, so dass eine positiv geladene Metalloberfläche und negativ geladene Wasserionen zurückbleiben. Durch die Anziehungskraft zwischen den geladenen Metall- und Wasserionen vergrößert sich die Oberfläche rasch, was zu einem exponentiellen Anstieg der Ionisierung führt. Wenn die Abstoßungskräfte innerhalb der Oberfläche des flüssigen Metalls die Kräfte der Oberflächenspannung übersteigen, kommt es zu einer heftigen Explosion. ⓘ
Die Hydroxide selbst sind die basischsten bekannten Hydroxide und reagieren mit Säuren zu Salzen und mit Alkoholen zu oligomeren Alkoxiden. Sie reagieren leicht mit Kohlendioxid unter Bildung von Carbonaten oder Bicarbonaten oder mit Schwefelwasserstoff unter Bildung von Sulfiden oder Bisulfiden und können zur Abtrennung von Thiolen aus Erdöl verwendet werden. Sie reagieren mit amphoteren Oxiden: Die Oxide von Aluminium, Zink, Zinn und Blei reagieren beispielsweise mit den Alkalihydroxiden zu Aluminaten, Zinkaten, Stannaten und Plumbaten. Da Siliciumdioxid sauer ist, können die Alkalihydroxide auch Silikatglas angreifen. ⓘ
Intermetallische Verbindungen

Die Alkalimetalle bilden untereinander und mit den Elementen der Gruppen 2 bis 13 des Periodensystems zahlreiche intermetallische Verbindungen mit unterschiedlicher Stöchiometrie, wie z. B. die Natriumamalgame mit Quecksilber, darunter Na5Hg8 und Na3Hg. Einige von ihnen haben ionische Eigenschaften: So sind beispielsweise die Legierungen mit Gold, dem elektronegativsten aller Metalle, NaAu und KAu metallisch, während RbAu und CsAu Halbleiter sind. NaK ist eine Legierung aus Natrium und Kalium, die sehr nützlich ist, weil sie bei Raumtemperatur flüssig ist, obwohl wegen ihrer extremen Reaktivität gegenüber Wasser und Luft Vorsichtsmaßnahmen zu treffen sind. Das eutektische Gemisch schmilzt bei -12,6 °C. Eine Legierung aus 41 % Cäsium, 47 % Natrium und 12 % Kalium hat mit -78 °C den niedrigsten bekannten Schmelzpunkt aller Metalle und Legierungen. ⓘ
Verbindungen mit den Elementen der Gruppe 13
Die intermetallischen Verbindungen der Alkalimetalle mit den schwereren Elementen der Gruppe 13 (Aluminium, Gallium, Indium und Thallium), wie z. B. NaTl, sind im Gegensatz zu den normalen Legierungen mit den vorgenannten Elementen schlechte Leiter oder Halbleiter, was bedeutet, dass das betreffende Alkalimetall ein Elektron an die beteiligten Zintl-Anionen verloren hat. Während die Elemente der Gruppe 14 und darüber hinaus dazu neigen, diskrete anionische Cluster zu bilden, neigen die Elemente der Gruppe 13 dazu, polymere Ionen mit den Alkalimetallkationen zu bilden, die sich zwischen dem riesigen Ionengitter befinden. NaTl beispielsweise besteht aus einem polymeren Anion (-Tl--)n mit einer kovalenten diamantkubischen Struktur, bei der sich Na+-Ionen zwischen den anionischen Gittern befinden. Die größeren Alkalimetalle können nicht in ähnlicher Weise in ein anionisches Gitter passen und zwingen die schwereren Elemente der Gruppe 13 dazu, anionische Cluster zu bilden. ⓘ
Bor ist ein Sonderfall, denn es ist das einzige Nichtmetall der Gruppe 13. Die Alkalimetallboride sind in der Regel sehr borhaltig und weisen eine beträchtliche Bor-Bor-Bindung mit deltaedrischen Strukturen auf. Sie sind thermisch instabil, da die Alkalimetalle bei hohen Temperaturen einen sehr hohen Dampfdruck haben. Dies macht die Direktsynthese problematisch, da die Alkalimetalle unterhalb von 700 °C nicht mit Bor reagieren, so dass diese in geschlossenen Behältern mit einem Überschuss an Alkalimetall durchgeführt werden muss. Außerdem nimmt die Reaktivität mit Bor in dieser Gruppe ausnahmsweise von Gruppe zu Gruppe ab: Lithium reagiert vollständig bei 700 °C, Natrium jedoch erst bei 900 °C und Kalium erst bei 1200 °C, und die Reaktion erfolgt bei Lithium sofort, während sie bei Kalium Stunden dauert. Rubidium- und Cäsiumboride sind noch nicht einmal charakterisiert worden. Es sind verschiedene Phasen bekannt, wie LiB10, NaB6, NaB15 und KB6. Unter hohem Druck ändert sich die Bor-Bor-Bindung in den Lithiumboriden von der Wade'schen Regel hin zur Bildung von Zintl-Anionen wie beim Rest der Gruppe 13. ⓘ
Verbindungen mit den Elementen der Gruppe 14
Lithium und Natrium reagieren mit Kohlenstoff unter Bildung von Acetyliden, Li2C2 und Na2C2, die auch durch Reaktion des Metalls mit Acetylen erhalten werden können. Kalium, Rubidium und Cäsium reagieren mit Graphit; ihre Atome lagern sich zwischen den hexagonalen Graphitschichten ein und bilden Graphiteinlagerungsverbindungen der Formeln MC60 (dunkelgrau, fast schwarz), MC48 (dunkelgrau, fast schwarz), MC36 (blau), MC24 (stahlblau) und MC8 (bronze) (M = K, Rb oder Cs). Diese Verbindungen sind über 200-mal leitfähiger als reiner Graphit, was darauf schließen lässt, dass das Valenzelektron des Alkalimetalls auf die Graphitschichten übertragen wird (z. B. M+
C-
8). Beim Erhitzen von KC8 führt die Abspaltung von Kaliumatomen nacheinander zur Umwandlung in KC24, KC36, KC48 und schließlich KC60. KC8 ist ein sehr starkes Reduktionsmittel, das pyrophor ist und bei Kontakt mit Wasser explodiert. Während die größeren Alkalimetalle (K, Rb und Cs) zunächst MC8 bilden, bilden die kleineren Metalle zunächst MC6, und zwar erst durch Reaktion der Metalle mit Graphit bei hohen Temperaturen um 500 °C. Abgesehen davon sind die Alkalimetalle so starke Reduktionsmittel, dass sie sogar Buckminsterfulleren zu festen Fulleriden MnC60 reduzieren können; Natrium, Kalium, Rubidium und Cäsium können Fulleride mit n = 2, 3, 4 oder 6 bilden, Rubidium und Cäsium können zusätzlich n = 1 erreichen. ⓘ
Bei der Reaktion der Alkalimetalle mit den schwereren Elementen der Kohlenstoffgruppe (Silicium, Germanium, Zinn und Blei) bilden sich ionische Stoffe mit käfigartigen Strukturen, wie die Silicide M4Si4 (M = K, Rb oder Cs), die M+ und tetraedrische Si4-
4-Ionen enthält. Die Chemie der Alkalimetallgermanide, an denen das Germanid-Ion Ge4- und andere Cluster-(Zintl-)Ionen wie Ge2-
4, Ge4-
9, Ge2-
9 und [(Ge9)2]6-, ist weitgehend analog zu den entsprechenden Siliziden. Alkalimetallstannide sind meist ionisch, manchmal mit dem Stannidion (Sn4-), manchmal mit komplexeren Zintl-Ionen wie Sn4-
9, das in Tetrapotassium-Nonastannid (K4Sn9) vorkommt. Das einatomige Plumbid-Ion (Pb4-) ist unbekannt, und seine Bildung wird als energetisch ungünstig vorhergesagt; Alkalimetallplumbide haben komplexe Zintl-Ionen, wie Pb4-
9. Diese Alkalimetallgermanide, -stannide und -plumbide können durch Reduktion von Germanium, Zinn und Blei mit Natriummetall in flüssigem Ammoniak hergestellt werden. ⓘ
Nitride und Pniktide

Lithium, das leichteste der Alkalimetalle, ist das einzige Alkalimetall, das unter Standardbedingungen mit Stickstoff reagiert, und sein Nitrid ist das einzige stabile Alkalimetallnitrid. Stickstoff ist ein unreaktives Gas, da das Aufbrechen der starken Dreifachbindung im Stickstoffmolekül (N2) viel Energie erfordert. Die Bildung eines Alkalimetallnitrids würde die Ionisierungsenergie des Alkalimetalls (Bildung von M+-Ionen), die zum Brechen der Dreifachbindung in N2 und zur Bildung von N3--Ionen erforderliche Energie verbrauchen, und die gesamte bei der Bildung eines Alkalimetallnitrids freigesetzte Energie stammt aus der Gitterenergie des Alkalimetallnitrids. Die Gitterenergie wird bei kleinen, hochgeladenen Ionen maximiert; die Alkalimetalle bilden keine hochgeladenen Ionen, sondern nur Ionen mit einer Ladung von +1, so dass nur Lithium, das kleinste Alkalimetall, genügend Gitterenergie freisetzen kann, um die Reaktion mit Stickstoff exotherm zu machen und Lithiumnitrid zu bilden. Die Reaktionen der anderen Alkalimetalle mit Stickstoff würden nicht genügend Gitterenergie freisetzen und wären daher endotherm, so dass sie unter Standardbedingungen keine Nitride bilden. Natriumnitrid (Na3N) und Kaliumnitrid (K3N) sind zwar vorhanden, aber extrem instabil, da sie sich leicht in ihre Bestandteile zerlegen, und können nicht durch Reaktion der Elemente untereinander unter Standardbedingungen hergestellt werden. Die sterische Hinderung verbietet die Existenz von Rubidium- oder Cäsiumnitrid. Natrium und Kalium bilden jedoch farblose Azidsalze mit dem linearen N-
3-Anion; aufgrund der großen Größe der Alkalimetallkationen sind sie thermisch so stabil, dass sie vor der Zersetzung schmelzen können. ⓘ
Alle Alkalimetalle reagieren leicht mit Phosphor und Arsen und bilden Phosphide und Arsenide mit der Formel M3Pn (wobei M für ein Alkalimetall und Pn für ein Pntogen - Phosphor, Arsen, Antimon oder Wismut - steht). Dies ist auf die größere Größe der P3- und As3- Ionen zurückzuführen, so dass weniger Gitterenergie für die Bildung der Salze freigesetzt werden muss. Dies sind nicht die einzigen Phosphide und Arsenide der Alkalimetalle: Für Kalium sind zum Beispiel neun verschiedene Phosphide bekannt, mit den Formeln K3P, K4P3, K5P4, KP, K4P6, K3P7, K3P11, KP10.3 und KP15. Während die meisten Metalle Arsenide bilden, bilden nur die Alkali- und Erdalkalimetalle meist ionische Arsenide. Die Struktur von Na3As ist komplex mit ungewöhnlich kurzen Na-Na-Abständen von 328-330 pm, die kürzer sind als bei Natriummetall, was darauf hindeutet, dass selbst bei diesen elektropositiven Metallen die Bindung nicht direkt ionisch sein kann. Es sind auch andere Alkalimetallarsenide bekannt, die nicht der Formel M3As entsprechen, wie z. B. LiAs, das einen metallischen Glanz und elektrische Leitfähigkeit aufweist, was auf das Vorhandensein einer gewissen metallischen Bindung hindeutet. Die Antimonide sind instabil und reaktiv, da das Sb3-Ion ein starkes Reduktionsmittel ist; bei der Reaktion mit Säuren entsteht das giftige und instabile Gas Stibin (SbH3). In der Tat haben sie einige metallische Eigenschaften, und die Alkalimetallantimonide der Stöchiometrie MSb enthalten Antimonatome, die in einer spiralförmigen Zintl-Struktur gebunden sind. Bismutide sind nicht einmal vollständig ionisch; sie sind intermetallische Verbindungen, die teilweise metallische und teilweise ionische Bindungen enthalten. ⓘ
Oxide und Chalkogenide
Alle Alkalimetalle reagieren unter Standardbedingungen heftig mit Sauerstoff. Sie bilden verschiedene Arten von Oxiden, wie z. B. einfache Oxide (mit dem O2- Ion), Peroxide (mit dem O2-
2-Ion, bei dem eine Einfachbindung zwischen den beiden Sauerstoffatomen besteht), Superoxide (mit dem O-
2-Ionen) und viele andere. Lithium verbrennt an der Luft zu Lithiumoxid, während Natrium mit Sauerstoff zu einer Mischung aus Natriumoxid und Natriumperoxid reagiert. Kalium bildet ein Gemisch aus Kaliumperoxid und Kaliumsuperoxid, während Rubidium und Cäsium ausschließlich das Superoxid bilden. Ihre Reaktivität nimmt von Gruppe zu Gruppe zu: Während Lithium, Natrium und Kalium lediglich an der Luft brennen, sind Rubidium und Cäsium pyrophor (entzünden sich spontan an der Luft). ⓘ
Die kleineren Alkalimetalle neigen aufgrund ihrer geringen Größe dazu, die größeren Anionen (das Peroxid und Superoxid) zu polarisieren. Dadurch werden die Elektronen in den komplexeren Anionen zu einem ihrer Sauerstoffatome hingezogen, wodurch ein Oxidion und ein Sauerstoffatom entstehen. Dies führt dazu, dass Lithium bei der Reaktion mit Sauerstoff bei Raumtemperatur ausschließlich das Oxid bildet. Bei den größeren Anionen Natrium und Kalium ist dieser Effekt deutlich schwächer ausgeprägt, so dass sie die weniger stabilen Peroxide bilden. Rubidium und Cäsium, die am Ende der Gruppe stehen, sind so groß, dass sich auch die weniger stabilen Superoxide bilden können. Da bei der Bildung des Superoxids die meiste Energie freigesetzt wird, wird das Superoxid vorzugsweise bei den größeren Alkalimetallen gebildet, wo die komplexeren Anionen nicht polarisiert sind. (Die Oxide und Peroxide für diese Alkalimetalle existieren zwar, bilden sich aber nicht bei der direkten Reaktion des Metalls mit Sauerstoff unter Standardbedingungen). Außerdem trägt die geringe Größe der Li+- und O2-Ionen dazu bei, dass sie eine stabile Ionen-Gitterstruktur bilden. Unter kontrollierten Bedingungen bilden jedoch alle Alkalimetalle, mit Ausnahme von Francium, ihre Oxide, Peroxide und Superoxide. Die Alkalimetallperoxide und -superoxide sind starke Oxidationsmittel. Natriumperoxid und Kaliumsuperoxid reagieren mit Kohlendioxid unter Bildung von Alkalimetallkarbonat und Sauerstoffgas, wodurch sie in Luftreinigern für Unterseeboote eingesetzt werden können; das Vorhandensein von Wasserdampf, der natürlicherweise in der Atemluft vorhanden ist, macht die Entfernung von Kohlendioxid durch Kaliumsuperoxid noch effizienter. Alle stabilen Alkalimetalle mit Ausnahme von Lithium können rote Ozonide (MO3) bilden, indem sie bei niedriger Temperatur mit wasserfreiem Pulverhydroxid und Ozon reagieren: Die Ozonide können anschließend mit flüssigem Ammoniak extrahiert werden. Die Ozonide können anschließend mit flüssigem Ammoniak extrahiert werden. Sie zersetzen sich unter Standardbedingungen langsam zu den Superoxiden und Sauerstoff und werden bei Kontakt mit Wasser sofort zu den Hydroxiden hydrolysiert. Kalium, Rubidium und Cäsium bilden auch Sesquioxide M2O3, die man besser als Peroxid-Disuperoxide [(M+
)
4(O2-
2)(O-
2)
2]. ⓘ
Rubidium und Cäsium können eine Vielzahl von Suboxiden mit den Metallen in formalen Oxidationsstufen unter +1 bilden. Rubidium kann bei der Oxidation an der Luft Rb6O und Rb9O2 (kupferfarben) bilden, während Cäsium eine immense Vielfalt an Oxiden bildet, wie das Ozonid CsO3 und mehrere hell gefärbte Suboxide, wie Cs7O (bronzefarben), Cs4O (rot-violett), Cs11O3 (violett), Cs3O (dunkelgrün), CsO, Cs3O2 sowie Cs7O2. Letzteres kann unter Vakuum erhitzt werden, um Cs2O. ⓘ
Die Alkalimetalle können auch analog mit den schwereren Chalkogenen (Schwefel, Selen, Tellur und Polonium) reagieren, und alle Alkalimetall-Chalkogenide sind bekannt (mit Ausnahme von Francium). Die Reaktion mit einem Überschuss des Chalkogens kann ebenfalls zu niederen Chalkogeniden führen, wobei die Chalkogen-Ionen Ketten der betreffenden Chalkogen-Atome enthalten. So kann beispielsweise Natrium mit Schwefel reagieren und ein Sulfid (Na2S) sowie verschiedene Polysulfide mit der Formel Na2Sx (x von 2 bis 6) bilden, die S2-
x-Ionen enthalten. Aufgrund der Basizität der Se2- und Te2-Ionen sind die Alkalimetallselenide und -telluride in Lösung alkalisch; bei direkter Reaktion mit Selen und Tellur bilden sich neben den Seleniden und Telluriden mit den Se2-
x- und Te2-
x-Ionen. Sie können direkt aus den Elementen in flüssigem Ammoniak oder unter Ausschluss von Luft gewonnen werden und sind farblose, wasserlösliche Verbindungen, die an der Luft schnell wieder zu Selen oder Tellur oxidiert werden. Die Alkalipolonide sind alle ionischen Verbindungen, die das Po2-Ion enthalten; sie sind chemisch sehr stabil und können durch direkte Reaktion der Elemente bei etwa 300-400 °C hergestellt werden. ⓘ
Halogenide, Hydride und Pseudohalogenide
Die Alkalimetalle gehören zu den elektropositiven Elementen des Periodensystems und neigen daher dazu, sich mit den elektronegativen Elementen des Periodensystems, den Halogenen (Fluor, Chlor, Brom, Jod und Astatin), ionisch zu verbinden und Salze zu bilden, die als Alkalihalogenide bekannt sind. Die Reaktion ist sehr heftig und kann manchmal zu Explosionen führen. Alle zwanzig stabilen Alkalimetallhalogenide sind bekannt; die instabilen sind nicht bekannt, mit Ausnahme von Natriumastatid, da Astatin und Francium sehr instabil und selten sind. Das bekannteste der zwanzig ist sicherlich Natriumchlorid, auch bekannt als Kochsalz. Alle stabilen Alkalimetallhalogenide haben die Formel MX, wobei M für ein Alkalimetall und X für ein Halogen steht. Sie sind alle weiße, ionische, kristalline Feststoffe mit hohem Schmelzpunkt. Alle Alkalimetallhalogenide sind in Wasser löslich, mit Ausnahme von Lithiumfluorid (LiF), das aufgrund seiner sehr hohen Gitterenthalpie in Wasser unlöslich ist. Die hohe Gitterenthalpie von Lithiumfluorid ist auf die geringe Größe der Li+- und F- Ionen zurückzuführen, was zu starken elektrostatischen Wechselwirkungen zwischen ihnen führt: Ein ähnlicher Effekt tritt bei Magnesiumfluorid auf, was der diagonalen Beziehung zwischen Lithium und Magnesium entspricht. ⓘ
Die Alkalimetalle reagieren in ähnlicher Weise mit Wasserstoff und bilden ionische Alkalimetallhydride, bei denen das Hydridanion als Pseudohalogenid fungiert: Diese werden häufig als Reduktionsmittel verwendet, wobei Hydride, komplexe Metallhydride oder Wasserstoffgas entstehen. Es sind auch andere Pseudohalogenide bekannt, vor allem die Cyanide. Diese haben die gleiche Struktur wie die entsprechenden Halogenide, mit Ausnahme von Lithiumcyanid, was darauf hindeutet, dass die Cyanid-Ionen frei rotieren können. Ternäre Alkalimetallhalogenidoxide, wie Na3ClO, K3BrO (gelb), Na4Br2O, Na4I2O und K4Br2O, sind ebenfalls bekannt. Die Polyhalogenide sind ziemlich instabil, obwohl die von Rubidium und Cäsium durch die schwache Polarisationskraft dieser extrem großen Kationen stark stabilisiert sind. ⓘ
Koordinationskomplexe
Alkalimetallkationen bilden aufgrund ihrer geringen Ladung von nur +1 und ihrer relativ großen Größe in der Regel keine Koordinationskomplexe mit einfachen Lewis-Basen; so bildet das Li+-Ion die meisten Komplexe und die schwereren Alkalimetallionen immer weniger (Ausnahmen gibt es allerdings bei schwachen Komplexen). Insbesondere Lithium weist eine sehr reiche Koordinationschemie auf, in der es Koordinationszahlen von 1 bis 12 aufweist, wobei die oktaedrische Hexakoordination bevorzugt wird. In wässriger Lösung liegen die Alkalimetallionen als oktaedrische Hexahydratkomplexe ([M(H2O)6)]+) vor, mit Ausnahme des Lithiumions, das aufgrund seiner geringen Größe tetraedrische Tetrahydratkomplexe ([Li(H2O)4)]+) bildet; die Alkalimetalle bilden diese Komplexe, weil ihre Ionen durch elektrostatische Anziehungskräfte zu den polaren Wassermolekülen angezogen werden. Aus diesem Grund werden wasserfreie Salze, die Alkalimetallkationen enthalten, häufig als Trockenmittel verwendet. Alkalimetalle bilden aufgrund elektrostatischer Anziehung auch leicht Komplexe mit Kronenethern (z. B. 12-Krone-4 für Li+, 15-Krone-5 für Na+, 18-Krone-6 für K+ und 21-Krone-7 für Rb+) und Kryptanden. ⓘ
Ammoniaklösungen
Die Alkalimetalle lösen sich langsam in flüssigem Ammoniak und bilden ammoniakalische Lösungen des solvatisierten Metallkations M+ und des solvatisierten Elektrons e-, die unter Bildung von Wasserstoffgas und dem Alkalimetallamid (MNH2, wobei M für ein Alkalimetall steht) reagieren: Dieser Vorgang wurde erstmals 1809 von Humphry Davy beobachtet und 1864 von W. Weyl wiederentdeckt. Der Prozess kann durch einen Katalysator beschleunigt werden. Ähnliche Lösungen bilden die schweren zweiwertigen Erdalkalimetalle Calcium, Strontium, Barium sowie die zweiwertigen Lanthaniden, Europium und Ytterbium. Das Amidsalz ist ziemlich unlöslich und fällt leicht aus, wobei intensiv gefärbte Ammoniaklösungen der Alkalimetalle zurückbleiben. Im Jahr 1907 stellte Charles Krause fest, dass die Farbe auf das Vorhandensein solvatisierter Elektronen zurückzuführen ist, die zur hohen elektrischen Leitfähigkeit dieser Lösungen beitragen. Bei niedrigen Konzentrationen (unter 3 M) ist die Lösung dunkelblau und hat die zehnfache Leitfähigkeit von wässrigem Natriumchlorid; bei höheren Konzentrationen (über 3 M) ist die Lösung kupferfarben und hat ungefähr die Leitfähigkeit von flüssigen Metallen wie Quecksilber. Neben dem Alkalimetallamidsalz und den solvatisierten Elektronen enthalten solche Ammoniaklösungen auch das Alkalimetallkation (M+), das neutrale Alkalimetallatom (M), zweiatomige Alkalimetallmoleküle (M2) und Alkalimetallanionen (M-). Diese sind instabil und gehen schließlich in das thermodynamisch stabilere Alkalimetallamid und Wasserstoffgas über. Solvatisierte Elektronen sind starke Reduktionsmittel und werden häufig in der chemischen Synthese verwendet. ⓘ
Organometallische
Organolithium
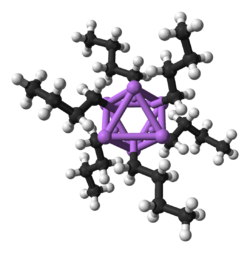
Als kleinstes Alkalimetall bildet Lithium die vielfältigsten und stabilsten metallorganischen Verbindungen, die kovalent gebunden sind. Organolithiumverbindungen sind elektrisch nicht leitende, flüchtige Feststoffe oder Flüssigkeiten, die bei niedrigen Temperaturen schmelzen und zur Bildung von Oligomeren mit der Struktur (RLi)x neigen, wobei R die organische Gruppe ist. Da die elektropositive Natur des Lithiums den größten Teil der Ladungsdichte der Bindung auf das Kohlenstoffatom verlagert, wodurch effektiv ein Carbanion entsteht, sind Organolithiumverbindungen extrem starke Basen und Nukleophile. Als Basen werden häufig Butyllithiumverbindungen verwendet, die im Handel erhältlich sind. Ein Beispiel für eine Organolithiumverbindung ist Methyllithium ((CH3Li)x), das in tetramer (x = 4, tetraedrisch) und hexamer (x = 6, oktaedrisch) Form vorliegt. Organolithiumverbindungen, insbesondere n-Butyllithium, sind nützliche Reagenzien in der organischen Synthese, wie man angesichts der diagonalen Beziehung von Lithium zu Magnesium, das eine wichtige Rolle in der Grignard-Reaktion spielt, erwarten könnte. So können beispielsweise Alkyllithium und Aryllithium zur Synthese von Aldehyden und Ketonen durch Reaktion mit Metallcarbonylen verwendet werden. Bei der Reaktion mit Nickeltetracarbonyl beispielsweise entsteht ein instabiler Acyl-Nickelcarbonyl-Komplex, der dann elektrophil substituiert wird und das gewünschte Aldehyd- (mit H+ als Elektrophil) oder Ketonprodukt (mit einem Alkylhalogenid) ergibt. ⓘ
- LiR + [Ni(CO)4] Li+[RCONi(CO)3]-
- Li+[RCONi(CO)3]- Li+ + RCHO + [(Lösungsmittel)Ni(CO)3]
- Li+[RCONi(CO)3]- Li+ + R'COR + [(Lösungsmittel)Ni(CO)3] ⓘ
Alkyllithium und Aryllithium können auch mit N,N-disubstituierten Amiden reagieren, um Aldehyde und Ketone sowie symmetrische Ketone durch Reaktion mit Kohlenmonoxid zu bilden. Sie zersetzen sich thermisch unter Abspaltung eines β-Wasserstoffs, wobei Alkene und Lithiumhydrid entstehen: Ein anderer Weg ist die Reaktion von Ethern mit Alkyl- und Aryllithium, die als starke Basen wirken. In unpolaren Lösungsmitteln reagieren Aryllithien als die Carbanionen, die sie tatsächlich sind, und verwandeln Kohlendioxid in aromatische Carbonsäuren (ArCO2H) und Arylketone in tertiäre Carbinole (Ar'2C(Ar)OH). Schließlich können sie zur Synthese anderer metallorganischer Verbindungen durch Metall-Halogen-Austausch verwendet werden. ⓘ
Schwere Alkalimetalle
Im Gegensatz zu den Organolithiumverbindungen sind die metallorganischen Verbindungen der schwereren Alkalimetalle überwiegend ionisch. Die Anwendung von Organonatriumverbindungen in der Chemie ist zum Teil durch die Konkurrenz der Organolithiumverbindungen begrenzt, die im Handel erhältlich sind und eine einfachere Reaktivität aufweisen. Die wichtigste Organonatriumverbindung von kommerzieller Bedeutung ist Natriumcyclopentadienid. Natriumtetraphenylborat kann ebenfalls als Organonatriumverbindung eingestuft werden, da das Natrium im festen Zustand an die Arylgruppen gebunden ist. Metallorganische Verbindungen der höheren Alkalimetalle sind noch reaktiver als Organonatriumverbindungen und von begrenztem Nutzen. Ein bemerkenswertes Reagenz ist die Schlosser-Base, ein Gemisch aus n-Butyllithium und Kalium-tert.-butoxid. Dieses Reagenz reagiert mit Propen unter Bildung der Verbindung Allylkalium (KCH2CHCH2). cis-2-Buten und trans-2-Buten sind bei Kontakt mit Alkalimetallen im Gleichgewicht. Während die Isomerisierung mit Lithium und Natrium schnell verläuft, ist sie mit den schwereren Alkalimetallen langsam. Die schwereren Alkalimetalle begünstigen auch die sterisch überfüllte Konformation. Es wurden mehrere Kristallstrukturen von kaliumorganischen Verbindungen veröffentlicht, die belegen, dass sie, wie die Natriumverbindungen, polymer sind. Organonatrium-, Organokalium-, Organorubidium- und Organocäsiumverbindungen sind alle überwiegend ionisch und in unpolaren Lösungsmitteln unlöslich (oder fast unlöslich). ⓘ
Alkyl- und Arylderivate von Natrium und Kalium neigen dazu, mit Luft zu reagieren. Sie bewirken die Spaltung von Ethern, wobei Alkoxide entstehen. Im Gegensatz zu Alkyllithiumverbindungen können Alkylnatrium und Alkylkali nicht durch Reaktion der Metalle mit Alkylhalogeniden hergestellt werden, da eine Wurtz-Kopplung stattfindet:
- RM + R'X → R-R' + MX ⓘ
Sie müssen daher durch Reaktion von Alkylquecksilberverbindungen mit Natrium- oder Kaliummetall in inerten Kohlenwasserstofflösungsmitteln hergestellt werden. Während Methylnatrium Tetramere wie Methyllithium bildet, ist Methylkalium eher ionisch und hat die Nickelarsenidstruktur mit diskreten Methylanionen und Kaliumkationen. ⓘ
Die Alkalimetalle und ihre Hydride reagieren mit sauren Kohlenwasserstoffen, z. B. Cyclopentadienen und endständigen Alkenen, zu Salzen. Verwendet werden flüssiges Ammoniak, Ether oder Kohlenwasserstofflösungsmittel, wobei Tetrahydrofuran das häufigste ist. Die wichtigste dieser Verbindungen ist Natriumcyclopentadienid, NaC5H5, ein wichtiger Vorläufer für viele Cyclopentadienylderivate der Übergangsmetalle. In ähnlicher Weise reagieren die Alkalimetalle mit Cyclooctatetraen in Tetrahydrofuran zu Alkalimetall-Cyclooctatetraeniden; so ist z. B. Dikalium-Cyclooctatetraenid (K2C8H8) ein wichtiger Vorläufer für viele Metall-Cyclooctatetraenyl-Derivate, wie z. B. Uranocen. Die großen und sehr schwach polarisierenden Alkalimetallkationen können große, aromatische, polarisierbare Radikalanionen stabilisieren, wie das dunkelgrüne Natriumnaphthalinid, Na+[C10H8-]-, ein starkes Reduktionsmittel. ⓘ
Repräsentative Reaktionen von Alkalimetallen
Reaktion mit Sauerstoff ⓘ
Bei der Reaktion mit Sauerstoff bilden die Alkalimetalle Oxide, Peroxide, Superoxide und Suboxide. Die ersten drei sind jedoch am häufigsten. Die nachstehende Tabelle zeigt die Arten von Verbindungen, die bei der Reaktion mit Sauerstoff entstehen. Die Verbindung in Klammern steht für das Nebenprodukt der Verbrennung. ⓘ
| Alkalimetall | Oxid | Peroxid | Superoxyd ⓘ |
| Li | Li2O | (Li2O2) | |
| Na | (Na2O) | Na2O2 | |
| K | KO2 | ||
| Rb | RbO2 | ||
| Cs | CsO2 |
Die Alkalimetallperoxide sind ionische Verbindungen, die in Wasser instabil sind. Das Peroxidanion ist nur schwach an das Kation gebunden und wird unter Bildung stärkerer kovalenter Bindungen hydrolysiert.
- Na2O2 + 2H2O → 2NaOH + H2O2
Auch die anderen Sauerstoffverbindungen sind in Wasser instabil.
- 2KO2 + 2H2O → 2KOH + H2O2 + O2
- Li2O + H2O → 2LiOH ⓘ
Reaktion mit Schwefel ⓘ
Mit Schwefel bilden sie Sulfide und Polysulfide.
- 2Na + 1/8S8 → Na2S + 1/8S8 → Na2S2...Na2S7
Da Alkalimetallsulfide im Wesentlichen Salze aus einer schwachen Säure und einer starken Base sind, bilden sie basische Lösungen.
- S2- + H2O → HS- + HO-
- HS- + H2O → H2S + HO- ⓘ
Reaktion mit Stickstoff ⓘ
Lithium ist das einzige Metall, das sich bei Raumtemperatur direkt mit Stickstoff verbindet.
- 3Li + 1/3N2 → Li3N
Li3N kann mit Wasser reagieren und Ammoniak freisetzen.
- Li3N + 3H2O → 3LiOH + NH3 ⓘ
Reaktion mit Wasserstoff ⓘ
Mit Wasserstoff bilden Alkalimetalle Salzhydride, die in Wasser hydrolysieren.
- Na + H2 → NaH (bei hohen Temperaturen)
- NaH + H2O → NaOH + H2 ⓘ
Reaktion mit Kohlenstoff ⓘ
Lithium ist das einzige Metall, das direkt mit Kohlenstoff reagiert und Dilithiumacetylid bildet. Na und K können mit Acetylen unter Bildung von Acetyliden reagieren.
- 2Li + 2C → Li2C2
- Na + C2H2 → NaC2H + 1/2H2 (bei 1500C)
- Na + NaC2H → Na2C2 (bei 2200C) ⓘ
Reaktion mit Wasser ⓘ
Bei der Reaktion mit Wasser bilden sie Hydroxidionen und Wasserstoffgas. Diese Reaktion ist heftig und stark exotherm, und der entstehende Wasserstoff kann sich an der Luft entzünden oder im Falle von Rb und Cs sogar explodieren.
- Na + H2O → NaOH + 1/2H2 ⓘ
Reaktion mit anderen Salzen ⓘ
Die Alkalimetalle sind sehr gute Reduktionsmittel. Sie können Metallkationen, die weniger elektropositiv sind, reduzieren. Titan wird industriell durch die Reduktion von Titantetrachlorid mit Na bei 4000C hergestellt (van Arkel-de Boer-Verfahren).
- TiCl4 + 4Na → 4NaCl + Ti ⓘ
Reaktion mit Organohalogenidverbindungen ⓘ
Alkalimetalle reagieren mit Halogenderivaten, um über die Wurtz-Reaktion Kohlenwasserstoffe zu erzeugen.
- 2CH3-Cl + 2Na → H3C-CH3 + 2NaCl ⓘ
Alkalimetalle in flüssigem Ammoniak ⓘ
Alkalimetalle lösen sich in flüssigem Ammoniak oder anderen Donor-Lösungsmitteln wie aliphatischen Aminen oder Hexamethylphosphoramid auf und ergeben blaue Lösungen. Es wird angenommen, dass diese Lösungen freie Elektronen enthalten.
- Na + xNH3 → Na+ + e(NH3)x-
Aufgrund der Anwesenheit von solvatisierten Elektronen sind diese Lösungen sehr starke Reduktionsmittel, die in der organischen Synthese verwendet werden. ⓘ
Die Reaktion 1) ist als Birch-Reduktion bekannt. Andere Reduktionen, die mit diesen Lösungen durchgeführt werden können, sind:
- S8 + 2e- → S82-
- Fe(CO)5 + 2e- → Fe(CO)42- + CO ⓘ
Erweiterungen

Obwohl Francium das schwerste bisher entdeckte Alkalimetall ist, gibt es einige theoretische Arbeiten zur Vorhersage der physikalischen und chemischen Eigenschaften von hypothetischen schwereren Alkalimetallen. Als erstes Element der Periode 8 wird das noch unentdeckte Element Ununennium (Element 119) als nächstes Alkalimetall nach Francium vorhergesagt, das sich ähnlich wie seine leichteren Verwandten verhält, sich aber auch in einigen Eigenschaften von den leichteren Alkalimetallen unterscheidet. Seine Chemie soll eher der von Kalium oder Rubidium als der von Cäsium oder Francium ähneln. Dies ist ungewöhnlich, da periodische Trends, die relativistische Effekte außer Acht lassen, vorhersagen, dass Ununennium noch reaktiver als Cäsium und Francium ist. Diese geringere Reaktivität ist auf die relativistische Stabilisierung des Valenzelektrons von Ununennium zurückzuführen, wodurch sich die erste Ionisierungsenergie von Ununennium erhöht und die metallischen und ionischen Radien verringert werden; dieser Effekt ist bereits bei Francium zu beobachten. Dabei wird davon ausgegangen, dass sich Ununennium chemisch wie ein Alkalimetall verhält, was zwar wahrscheinlich ist, aber aufgrund relativistischer Effekte möglicherweise nicht zutrifft. Die relativistische Stabilisierung des 8s-Orbitals erhöht auch die Elektronenaffinität von Ununennium weit über die von Cäsium und Francium hinaus; in der Tat wird erwartet, dass Ununennium eine höhere Elektronenaffinität hat als alle Alkalimetalle, die leichter sind als es. Relativistische Effekte führen auch zu einer sehr starken Abnahme der Polarisierbarkeit von Ununennium. Andererseits wird für Ununennium vorhergesagt, dass es den Trend der abnehmenden Schmelzpunkte in der Gruppe fortsetzt und einen Schmelzpunkt zwischen 0 °C und 30 °C haben wird. ⓘ

Die Stabilisierung des Valenzelektrons von Ununennium und die damit einhergehende Verkleinerung des 8s-Orbitals führen dazu, dass sein Atomradius auf 240 pm gesenkt wird, was dem von Rubidium (247 pm) sehr nahe kommt, so dass die Chemie von Ununennium in der Oxidationsstufe +1 der Chemie von Rubidium ähnlicher sein sollte als der von Francium. Andererseits dürfte der Ionenradius des Uue+-Ions größer sein als der von Rb+, da die 7p-Orbitale destabilisiert und damit größer sind als die p-Orbitale der unteren Schalen. Ununennium kann auch die Oxidationsstufe +3 aufweisen, die in keinem anderen Alkalimetall vorkommt, zusätzlich zur Oxidationsstufe +1, die für die anderen Alkalimetalle charakteristisch ist und auch die Hauptoxidationsstufe aller bekannten Alkalimetalle darstellt: Dies ist auf die Destabilisierung und Ausdehnung des 7p3/2-Spinors zurückzuführen, die dazu führt, dass seine äußersten Elektronen eine niedrigere Ionisierungsenergie haben als sonst zu erwarten wäre. In der Tat ist zu erwarten, dass viele Ununennium-Verbindungen aufgrund der Beteiligung der 7p3/2-Elektronen an der Bindung einen starken kovalenten Charakter aufweisen. ⓘ

Für die Vorhersage der Eigenschaften der Alkalimetalle jenseits des Ununenniums wurden nicht so viele Arbeiten durchgeführt. Obwohl eine einfache Extrapolation des Periodensystems (nach dem Aufbauprinzip) das Element 169, Unhexennium, unter Ununennium ansiedeln würde, sagen Dirac-Fock-Berechnungen voraus, dass das nächste Element nach Ununennium mit alkalimetallähnlichen Eigenschaften das Element 165, Unhexpentium, sein könnte, das die Elektronenkonfiguration [Og] 5g18 6f14 7d10 8s2 8p1/22 9s1 haben soll. Dieses Element würde in seinen Eigenschaften zwischen einem Alkalimetall und einem Element der Gruppe 11 liegen, und während seine physikalischen und atomaren Eigenschaften eher denen des Alkalimetalls entsprechen, könnte seine Chemie eher der des Alkalimetalls entsprechen. Weitere Berechnungen zeigen, dass Unhexpentium dem Trend der zunehmenden Ionisierungsenergie über Cäsium hinaus folgt und eine Ionisierungsenergie aufweist, die mit der von Natrium vergleichbar ist, und dass es auch den Trend der abnehmenden Atomradien über Cäsium hinaus fortsetzt und einen Atomradius aufweist, der mit dem von Kalium vergleichbar ist. Die 7d-Elektronen von Unhexpentium können jedoch auch zusammen mit dem 9s-Elektron an chemischen Reaktionen teilnehmen, was möglicherweise Oxidationszustände jenseits von +1 ermöglicht, weshalb Unhexpentium wahrscheinlich als Übergangsmetall gilt. Da es sich bei den Alkali- und Erdalkalimetallen um Elemente des s-Blocks handelt, gelten diese Vorhersagen für die Entwicklung und die Eigenschaften von Ununennium und Unhexpentium in ähnlicher Weise auch für die entsprechenden Erdalkalimetalle Unbinilium (Ubn) und Unhexhexium (Uhh). Unsepttrium, Element 173, könnte ein noch besseres, schwereres Homolog von Ununennium sein; mit einer vorhergesagten Elektronenkonfiguration von [Usb] 6g1 kehrt es zu der alkalimetallähnlichen Situation zurück, dass es ein leicht entfernbares Elektron weit oberhalb einer energetisch geschlossenen p-Schale besitzt, und es wird erwartet, dass es noch reaktiver ist als Cäsium. ⓘ
Die wahrscheinlichen Eigenschaften weiterer Alkalimetalle jenseits von Unsepttrium sind 2019 noch nicht erforscht, und es kann sein, dass es sie gibt oder nicht. Ab der 8. Periode des Periodensystems werden relativistische und Schalenstruktureffekte so stark, dass Extrapolationen von leichteren Verbindungen völlig ungenau werden. Außerdem haben die relativistischen und Schalenstruktureffekte (die die s-Orbitale stabilisieren und die d-, f- und g-Orbitale höherer Schalen destabilisieren und ausdehnen) entgegengesetzte Auswirkungen, was zu noch größeren Unterschieden zwischen relativistischen und nichtrelativistischen Berechnungen der Eigenschaften von Elementen mit so hohen Ordnungszahlen führt. Das Interesse an den chemischen Eigenschaften von Ununennium, Unhexpentium und Unsepttrium rührt daher, dass sie sich in der Nähe der erwarteten Stabilitätsinseln befinden, die bei den Elementen 122 (306Ubb) und 164 (482Uhq) zentriert sind. ⓘ
Pseudo-Alkalimetalle
Viele andere Stoffe ähneln den Alkalimetallen in ihrer Tendenz, monopositive Kationen zu bilden. Analog zu den Pseudohalogenen werden sie manchmal als "Pseudo-Alkalimetalle" bezeichnet. Zu diesen Stoffen gehören einige Elemente und viele weitere mehratomige Ionen; die mehratomigen Ionen ähneln den Alkalimetallen vor allem durch ihre große Größe und ihre schwache Polarisationskraft. ⓘ
Wasserstoff
Das Element Wasserstoff, mit einem Elektron pro neutralem Atom, wird der Einfachheit halber gewöhnlich an die Spitze der Gruppe 1 des Periodensystems gestellt, aber Wasserstoff wird normalerweise nicht als Alkalimetall betrachtet; wenn es als Alkalimetall betrachtet wird, dann wegen seiner atomaren Eigenschaften und nicht wegen seiner chemischen Eigenschaften. Unter typischen Bedingungen liegt reiner Wasserstoff als zweiatomiges Gas vor, das aus zwei Atomen pro Molekül besteht (H2); die Alkalimetalle bilden jedoch nur bei hohen Temperaturen zweiatomige Moleküle (z. B. Dilithium, Li2), wenn sie sich im gasförmigen Zustand befinden. ⓘ
Wasserstoff hat wie die Alkalimetalle ein Valenzelektron und reagiert leicht mit den Halogenen, aber die Ähnlichkeiten enden meist dort, weil ein blankes Proton H+ im Vergleich zu den Alkalimetallkationen sehr klein ist. Seine Platzierung über Lithium ist in erster Linie auf seine Elektronenkonfiguration zurückzuführen. Manchmal wird er aufgrund seiner ähnlichen chemischen Eigenschaften über dem Fluor platziert, obwohl auch hier die Ähnlichkeit nicht absolut ist. ⓘ
Die erste Ionisierungsenergie von Wasserstoff (1312,0 kJ/mol) ist viel höher als die der Alkalimetalle. Da nur ein zusätzliches Elektron benötigt wird, um die äußerste Schale des Wasserstoffatoms aufzufüllen, verhält sich Wasserstoff oft wie ein Halogen, indem er das negative Hydrid-Ion bildet, und wird auf dieser Grundlage gelegentlich als Halogen betrachtet. (Die Alkalimetalle können ebenfalls negative Ionen bilden, die als Alkalide bekannt sind, aber diese sind kaum mehr als Laborkuriositäten, da sie instabil sind). Ein Argument gegen diese Zuordnung ist, dass die Bildung von Hydrid aus Wasserstoff endotherm ist, im Gegensatz zur exothermen Bildung von Halogeniden aus Halogenen. Der Radius des H--Anions passt auch nicht zu dem Trend, dass die Größe der Halogene nach unten hin zunimmt: H- ist in der Tat sehr diffus, da sein einzelnes Proton nicht ohne weiteres beide Elektronen kontrollieren kann. Eine Zeit lang ging man davon aus, dass flüssiger Wasserstoff metallische Eigenschaften aufweisen würde. Dies ist zwar nicht der Fall, aber unter extrem hohem Druck, wie er in den Kernen von Jupiter und Saturn herrscht, wird Wasserstoff metallisch und verhält sich wie ein Alkalimetall; in dieser Phase wird er als metallischer Wasserstoff bezeichnet. Der elektrische Widerstand von flüssigem metallischem Wasserstoff bei 3000 K entspricht in etwa dem von flüssigem Rubidium und Cäsium bei 2000 K bei den jeweiligen Drücken, bei denen sie einen Übergang vom Nichtmetall zum Metall durchlaufen. ⓘ
Die 1s1-Elektronenkonfiguration von Wasserstoff entspricht zwar der der Alkalimetalle (ns1), ist jedoch einzigartig, da es keine 1p-Unterschale gibt. Daher kann er ein Elektron verlieren, um das Hydron H+ zu bilden, oder eines gewinnen, um das Hydridion H- zu bilden. Im ersten Fall ähnelt es oberflächlich betrachtet den Alkalimetallen, im zweiten Fall den Halogenen, aber die Unterschiede, die sich aus dem Fehlen einer 1p-Unterschale ergeben, sind so groß, dass keine der beiden Gruppen gut zu den Eigenschaften von Wasserstoff passt. Gruppe 14 passt auch gut zu den thermodynamischen Eigenschaften wie Ionisierungsenergie und Elektronenaffinität, aber Wasserstoff kann nicht vierwertig sein. Somit ist keine der drei Platzierungen völlig zufriedenstellend, obwohl Gruppe 1 die häufigste Platzierung ist (wenn eine gewählt wird), weil das Hydron bei weitem die wichtigste aller einatomigen Wasserstoffspezies ist, da es die Grundlage der Säure-Basen-Chemie darstellt. Ein Beispiel für die unorthodoxen Eigenschaften des Wasserstoffs, die auf seine ungewöhnliche Elektronenkonfiguration und seine geringe Größe zurückzuführen sind, ist das Wasserstoff-Ion, das sehr klein ist (Radius ca. 150 fm im Vergleich zu den 50-220 pm der meisten anderen Atome und Ionen) und daher in kondensierten Systemen nur in Verbindung mit anderen Atomen oder Molekülen vorkommt. Die Übertragung von Protonen zwischen Chemikalien ist die Grundlage der Säure-Basen-Chemie. Einzigartig ist auch die Fähigkeit des Wasserstoffs, Wasserstoffbrückenbindungen zu bilden, die sich aus der Übertragung von Ladungen, der Elektrostatik und der Korrelation von Elektronen ergeben. Es sind zwar auch analoge Lithiumbindungen bekannt, doch sind diese meist elektrostatisch. Dennoch kann Wasserstoff in einigen Molekülkristallen die gleiche strukturelle Rolle wie die Alkalimetalle einnehmen und steht in enger Beziehung zu den leichtesten Alkalimetallen (insbesondere Lithium). ⓘ
| Gruppe | 1 ⓘ |
| Hauptgruppe | 1 |
| Periode | |
| 1 | 1 H |
Ammonium und Derivate
Das Ammoniumion (NH+
4) hat sehr ähnliche Eigenschaften wie die schwereren Alkalimetalle, es ist ein Alkalimetall-Zwischenprodukt zwischen Kalium und Rubidium und wird oft als enger Verwandter angesehen. So sind beispielsweise die meisten Alkalimetallsalze in Wasser löslich, eine Eigenschaft, die auch Ammoniumsalze aufweisen. Es wird erwartet, dass sich Ammonium stabil wie ein Metall verhält (NH+
4-Ionen in einem Meer von delokalisierten Elektronen) bei sehr hohen Drücken stabil verhalten (wenn auch weniger als der typische Druck, bei dem Übergänge von isolierendem zu metallischem Verhalten auftreten, etwa 100 GPa) und könnte möglicherweise im Inneren der Eisriesen Uranus und Neptun auftreten, was erhebliche Auswirkungen auf deren innere Magnetfelder haben könnte. Es wurde geschätzt, dass der Übergang von einem Gemisch aus Ammoniak- und Dihydrogenmolekülen zu metallischem Ammonium bei einem Druck von knapp unter 25 GPa stattfinden kann. Unter Standardbedingungen kann Ammonium mit Quecksilber ein metallisches Amalgam bilden. ⓘ
Andere "Pseudo-Alkalimetalle" sind die Alkylammoniumkationen, bei denen einige der Wasserstoffatome im Ammoniumkation durch Alkyl- oder Arylgruppen ersetzt sind. Insbesondere die quaternären Ammoniumkationen (NR+
4) sind sehr nützlich, da sie permanent geladen sind, und sie werden oft als Alternative zum teuren Cs+ verwendet, um sehr große und sehr leicht polarisierbare Anionen wie HI-
2. Tetraalkylammoniumhydroxide sind wie die Alkalimetallhydroxide sehr starke Basen, die mit atmosphärischem Kohlendioxid unter Bildung von Carbonaten reagieren. Außerdem kann das Stickstoffatom durch ein Phosphor-, Arsen- oder Antimonatom ersetzt werden (die schwereren nichtmetallischen Pntogene), wodurch ein Phosphonium (PH+
4) oder Arsonium (AsH+
4), das seinerseits in ähnlicher Weise substituiert werden kann; Stibonium (SbH+
4) selbst nicht bekannt ist, sind einige seiner organischen Derivate charakterisiert. ⓘ
Cobaltocen und Derivate
Cobaltocen, Co(C5H5)2, ist ein Metallocen, das Kobalt-Analogon von Ferrocen. Es ist ein dunkelvioletter Feststoff. Cobaltocen hat 19 Valenzelektronen, ein Elektron mehr als normalerweise in Organotransitionsmetallkomplexen, wie z. B. seinem sehr stabilen Verwandten Ferrocen, zu finden ist, was der 18-Elektronen-Regel entspricht. Dieses zusätzliche Elektron besetzt ein Orbital, das in Bezug auf die Co-C-Bindungen antibindend ist. Folglich sind viele chemische Reaktionen von Co(C5H5)2 dadurch gekennzeichnet, dass es dazu neigt, dieses "zusätzliche" Elektron zu verlieren, wodurch ein sehr stabiles 18-Elektronen-Kation entsteht, das als Cobaltocenium bekannt ist. Viele Cobaltocenium-Salze fallen gemeinsam mit Cäsium-Salzen aus, und Cobaltoceniumhydroxid ist eine starke Base, die atmosphärisches Kohlendioxid absorbiert und Cobaltoceniumcarbonat bildet. Wie die Alkalimetalle ist auch Cobaltocen ein starkes Reduktionsmittel, und Decamethylcobaltocen ist aufgrund der kombinierten induktiven Wirkung der zehn Methylgruppen noch stärker. Kobalt kann durch sein schwereres Pendant Rhodium ersetzt werden, um Rhodocen zu erhalten, ein noch stärkeres Reduktionsmittel. Iridocen (mit Iridium) wäre vermutlich noch stärker, ist aber wegen seiner Instabilität nicht sehr gut erforscht. ⓘ
Thallium

Thallium ist das schwerste stabile Element der Gruppe 13 des Periodensystems. Am unteren Ende des Periodensystems ist der Inertpaareffekt aufgrund der relativistischen Stabilisierung des 6s-Orbitals und der mit zunehmender Größe der Atome abnehmenden Bindungsenergie recht stark, so dass die bei der Bildung zweier weiterer Bindungen freigesetzte Energie die hohen Ionisierungsenergien der 6s-Elektronen nicht wert ist. Es weist die Oxidationsstufe +1 auf, die alle bekannten Alkalimetalle aufweisen, und Thalliumverbindungen mit Thallium in der Oxidationsstufe +1 ähneln stöchiometrisch den entsprechenden Kalium- oder Silberverbindungen aufgrund der ähnlichen Ionenradien der Tl+ (164 pm), K+ (152 pm) und Ag+ (129 pm) Ionen. In den Jahren unmittelbar nach seiner Entdeckung wurde es in Kontinentaleuropa (nicht aber in England) zuweilen als Alkalimetall angesehen und in Dmitri Mendelejews Periodensystem von 1869 und Julius Lothar Meyers Periodensystem von 1868 gleich nach Cäsium als sechstes Alkalimetall eingeordnet. (Im Periodensystem von Mendelejew aus dem Jahr 1871 und im Periodensystem von Meyer aus dem Jahr 1870 steht Thallium an seiner jetzigen Position in der Bor-Gruppe und der Platz unter dem Cäsium bleibt frei). Allerdings weist Thallium auch die Oxidationsstufe +3 auf, die kein bekanntes Alkalimetall aufweist (obwohl Ununennium, das unentdeckte siebte Alkalimetall, möglicherweise die Oxidationsstufe +3 aufweisen könnte). Das sechste Alkalimetall wird jetzt als Francium angesehen. Während Tl+ durch den Inertpaareffekt stabilisiert wird, ist dieses inerte Paar von 6s-Elektronen immer noch in der Lage, chemisch zu wirken, so dass diese Elektronen in wässriger Lösung stereochemisch aktiv sind. Darüber hinaus sind die Thalliumhalogenide (mit Ausnahme von TlF) recht unlöslich in Wasser, und TlI hat eine ungewöhnliche Struktur, die auf das Vorhandensein des stereochemisch aktiven inerten Paares im Thallium zurückzuführen ist. ⓘ
Kupfer, Silber und Gold
Die Metalle der Gruppe 11 (oder Münzmetalle), Kupfer, Silber und Gold, werden üblicherweise als Übergangsmetalle eingestuft, da sie Ionen mit unvollständigen d-Schalen bilden können. Physikalisch gesehen haben sie die relativ niedrigen Schmelzpunkte und hohen Elektronegativitätswerte, die mit den Metallen nach dem Übergang in Verbindung gebracht werden. "Die gefüllte d-Unterschale und das freie s-Elektron von Cu, Ag und Au tragen zu ihrer hohen elektrischen und thermischen Leitfähigkeit bei. Bei den Übergangsmetallen links von der Gruppe 11 kommt es zu Wechselwirkungen zwischen den s-Elektronen und der teilweise gefüllten d-Unterschale, die die Elektronenbeweglichkeit verringern." Chemisch gesehen verhalten sich die Metalle der Gruppe 11 in ihrem +1-Valenzzustand wie die Metalle der Hauptgruppe und sind daher in gewisser Weise mit den Alkalimetallen verwandt: Dies ist ein Grund dafür, dass sie früher als "Gruppe IB" bezeichnet wurden, parallel zur "Gruppe IA" der Alkalimetalle. Gelegentlich werden sie auch als Post-Übergangsmetalle bezeichnet. Ihre Spektren sind analog zu denen der Alkalimetalle. Ihre monopositiven Ionen sind paramagnetisch und geben ihren Salzen keine Farbe, wie die der Alkalimetalle. ⓘ
Im Periodensystem von Mendelejew aus dem Jahr 1871 sind Kupfer, Silber und Gold zweimal aufgeführt, einmal in der Gruppe VIII (mit der Eisentriade und den Platingruppenmetallen) und einmal in der Gruppe IB. Die Gruppe IB wurde jedoch in Klammern gesetzt, um darauf hinzuweisen, dass es sich um eine vorläufige Aufstellung handelt. Mendelejews Hauptkriterium für die Gruppenzuordnung war die maximale Oxidationsstufe eines Elements: Auf dieser Grundlage konnten die Elemente der Gruppe 11 nicht in die Gruppe IB eingeordnet werden, da die Existenz von Kupfer(II)- und Gold(III)-Verbindungen zu dieser Zeit bekannt war. Durch den Wegfall der Gruppe IB wäre die Gruppe I jedoch die einzige Hauptgruppe (die Gruppe VIII wurde als Übergangsgruppe bezeichnet), die keine A-B-Verzweigung aufweist. Bald darauf entschied sich die Mehrheit der Chemiker dafür, diese Elemente in die Gruppe IB einzuordnen und sie wegen der daraus resultierenden Symmetrie aus der Gruppe VIII zu entfernen: Dies war die vorherrschende Einteilung bis zur Entstehung des modernen mittelgroßen Periodensystems mit 18 Spalten, das die Alkalimetalle und die Metalle der Gruppe 11 trennt. ⓘ
Die Münzmetalle wurden traditionell als eine Unterabteilung der Alkalimetallgruppe angesehen, da sie die charakteristische s1-Elektronenkonfiguration der Alkalimetalle teilen (Gruppe 1: p6s1; Gruppe 11: d10s1). Die Ähnlichkeiten beschränken sich jedoch weitgehend auf die Stöchiometrien der +1-Verbindungen beider Gruppen und nicht auf ihre chemischen Eigenschaften. Dies ist darauf zurückzuführen, dass die gefüllte d-Unterschale das äußerste s-Elektron viel schwächer abschirmt als die gefüllte p-Unterschale, so dass die Münzmetalle viel höhere erste Ionisierungsenergien und kleinere Ionenradien haben als die entsprechenden Alkalimetalle. Außerdem haben sie höhere Schmelzpunkte, Härten und Dichten sowie geringere Reaktivitäten und Löslichkeiten in flüssigem Ammoniak und weisen in ihren Verbindungen einen stärker kovalenten Charakter auf. Schließlich stehen die Alkalimetalle in der elektrochemischen Reihe ganz oben, während die Münzmetalle fast ganz unten stehen. Die gefüllte d-Schale der Münzmetalle ist viel leichter zu spalten als die gefüllte p-Schale der Alkalimetalle, so dass die zweite und dritte Ionisierungsenergie niedriger ist, was höhere Oxidationsstufen als +1 und eine reichhaltigere Koordinationschemie ermöglicht, was den Metallen der Gruppe 11 einen deutlichen Übergangsmetallcharakter verleiht. Besonders erwähnenswert ist die Bildung ionischer Verbindungen von Gold mit Rubidium und Cäsium, in denen es das Aurid-Ion (Au-) bildet, das auch in flüssiger Ammoniaklösung solvatisiert vorkommt: Hier verhält sich Gold wie ein Pseudohalogen, da seine 5d106s1-Konfiguration ein Elektron weniger aufweist als die quasi geschlossene Schalen-Konfiguration 5d106s2 von Quecksilber. ⓘ
Gewinnung und Isolierung
Die Herstellung von reinen Alkalimetallen ist aufgrund ihrer extremen Reaktivität mit gängigen Stoffen, wie z. B. Wasser, etwas kompliziert. Aus ihren Silikaterzen lassen sich alle stabilen Alkalimetalle auf die gleiche Weise gewinnen: Zunächst werden mit Schwefelsäure das gewünschte Alkalimetallion und Aluminium(III)-Ionen aus dem Erz gelöst (Auslaugung), woraufhin durch basische Fällung die Aluminiumionen aus dem Gemisch entfernt werden, indem sie als Hydroxid ausgefällt werden. Das verbleibende unlösliche Alkalicarbonat wird dann selektiv ausgefällt; das Salz wird dann in Salzsäure gelöst, um das Chlorid zu erzeugen. Anschließend lässt man das Ergebnis verdampfen, und das Alkalimetall kann isoliert werden. Lithium und Natrium werden in der Regel durch Elektrolyse aus ihren flüssigen Chloriden isoliert, wobei in der Regel Kalziumchlorid hinzugefügt wird, um den Schmelzpunkt der Mischung zu senken. Die schwereren Alkalimetalle werden jedoch in der Regel auf andere Weise isoliert, wobei ein Reduktionsmittel (in der Regel Natrium für Kalium und Magnesium oder Kalzium für die schwersten Alkalimetalle) verwendet wird, um das Alkalimetallchlorid zu reduzieren. Das flüssige oder gasförmige Produkt (das Alkalimetall) wird dann zur Reinigung einer fraktionierten Destillation unterzogen. Die meisten Wege zu den reinen Alkalimetallen erfordern aufgrund ihrer hohen Reaktivität den Einsatz der Elektrolyse; einer der wenigen Wege, bei denen dies nicht der Fall ist, ist die Pyrolyse des entsprechenden Alkalimetallazids, bei der das Metall für Natrium, Kalium, Rubidium und Cäsium und das Nitrid für Lithium gewonnen wird. ⓘ
Lithiumsalze müssen aus dem Wasser von Mineralquellen, Soleschwimmbecken und Solevorkommen extrahiert werden. Das Metall wird elektrolytisch aus einer Mischung von geschmolzenem Lithiumchlorid und Kaliumchlorid hergestellt. ⓘ
Natrium kommt vor allem im Meerwasser und im getrockneten Meeresboden vor, wird aber heute durch Elektrolyse von Natriumchlorid hergestellt, indem der Schmelzpunkt der Substanz mit Hilfe einer Downs-Zelle auf unter 700 °C gesenkt wird. Hochreines Natrium kann durch die thermische Zersetzung von Natriumazid gewonnen werden. Kalium kommt in vielen Mineralien vor, z. B. in Sylvit (Kaliumchlorid). Früher wurde Kalium in der Regel durch Elektrolyse von Kaliumchlorid oder Kaliumhydroxid gewonnen, das in Kanada, Russland, Weißrussland, Deutschland, Israel, den Vereinigten Staaten und Jordanien weit verbreitet ist, ähnlich wie Natrium in den späten 1800er und frühen 1900er Jahren. Es kann auch aus Meerwasser gewonnen werden. Diese Verfahren sind jedoch problematisch, da das Kaliummetall dazu neigt, sich in seinem geschmolzenen Chlorid aufzulösen und bei den Betriebstemperaturen stark zu verdampfen, wobei das explosive Superoxid entstehen kann. Daher wird reines Kaliummetall nun durch Reduktion von geschmolzenem Kaliumchlorid mit Natriummetall bei 850 °C hergestellt.
- Na (g) + KCl (l) ⇌ NaCl (l) + K (g)
Obwohl Natrium weniger reaktionsfreudig ist als Kalium, funktioniert dieser Prozess, weil Kalium bei so hohen Temperaturen flüchtiger ist als Natrium und leicht abdestilliert werden kann, so dass sich das Gleichgewicht nach rechts verschiebt und mehr Kaliumgas entsteht, was fast bis zur Vollendung geht. ⓘ
Metalle wie Natrium werden durch Elektrolyse von geschmolzenen Salzen gewonnen. Rb und Cs werden hauptsächlich als Nebenprodukte der Li-Verarbeitung gewonnen. Zur Herstellung von reinem Cäsium werden Cäsium- und Rubidiumerze zerkleinert und zusammen mit Natriummetall auf 650 °C erhitzt, wobei eine Legierung entsteht, die dann durch fraktionierte Destillation abgetrennt werden kann. Da metallisches Cäsium zu reaktiv ist, um es zu handhaben, wird es normalerweise als Cäsiumazid (CsN3) angeboten. Cäsiumhydroxid entsteht, wenn Cäsium aggressiv mit Wasser und Eis reagiert (CsOH). ⓘ
Rubidium ist das 16. häufigste Element in der Erdkruste, allerdings ist es recht selten. Einige Mineralien, die in Nordamerika, Südafrika, Russland und Kanada gefunden werden, enthalten Rubidium. Einige Kaliumminerale (Lepidolith, Biotit, Feldspat, Carnallit) enthalten es zusammen mit Cäsium. Pollucit, Carnallit, Leucit und Lepidolith sind allesamt rubidiumhaltige Mineralien. Als Nebenprodukt der Lithiumgewinnung wird es kommerziell aus Lepidolith gewonnen. Rubidium kommt auch in Kaliumgestein und -sole vor, was ein kommerzielles Angebot darstellt. Der größte Teil des Rubidiums wird heute als Nebenprodukt der Lithiumraffination gewonnen. Rubidium wird in Vakuumröhren als Getter verwendet, ein Material, das sich mit Spurengasen verbindet und diese aus den Röhren entfernt.
In den 1950er- und 1960er-Jahren war ein Nebenprodukt der Kaliumproduktion namens Alkarb für mehrere Jahre eine Hauptquelle für Rubidium. Alkarb enthielt 21 % Rubidium, der Rest war Kalium und ein kleiner Anteil Cäsium. Heute produzieren die größten Cäsiumproduzenten, z. B. die Tanco Mine in Manitoba, Kanada, Rubidium als Nebenprodukt von Pollucit. Eine heute übliche Methode zur Abtrennung von Rubidium von Kalium und Cäsium ist die fraktionierte Kristallisation eines Rubidium- und Cäsium-Alauns (Cs, Rb)Al(SO4)2-12H2O, der nach etwa 30 Umkristallisationen reinen Rubidium-Alaun ergibt. Die begrenzten Anwendungsmöglichkeiten und das Fehlen eines rubidiumreichen Minerals beschränken die Produktion von Rubidiumverbindungen auf 2 bis 4 Tonnen pro Jahr. Cäsium wird jedoch nicht durch die oben beschriebene Reaktion gewonnen. Stattdessen ist der Abbau von Polluciterz die Hauptmethode zur Gewinnung von reinem Cäsium, das hauptsächlich durch drei Methoden aus dem Erz gewonnen wird: Säureaufschluss, alkalische Zersetzung und direkte Reduktion. Beide Metalle werden als Nebenprodukte der Lithiumproduktion gewonnen: Nach 1958, als das Interesse an den thermonuklearen Eigenschaften von Lithium stark zunahm, stieg auch die Produktion von Rubidium und Cäsium entsprechend an. Reine Rubidium- und Cäsiummetalle werden durch Reduktion ihrer Chloride mit Calciummetall bei 750 °C und niedrigem Druck hergestellt. ⓘ
Aufgrund seiner extremen Seltenheit in der Natur wird das meiste Francium durch die Kernreaktion 197Au + 18O → 210Fr + 5 n synthetisiert, wobei Francium-209, Francium-210 und Francium-211 entstehen. Die größte jemals gesammelte Menge an Francium beträgt etwa 300.000 neutrale Atome, die durch die oben beschriebene Kernreaktion hergestellt wurden. Wenn das einzige natürliche Isotop Francium-223 benötigt wird, wird es als Alpha-Tochter von Actinium-227 erzeugt, das seinerseits synthetisch aus der Neutronenbestrahlung von natürlichem Radium-226, einer der Töchter von natürlichem Uran-238, gewonnen wird. ⓘ
Anwendungen

Lithium, Natrium und Kalium haben viele Anwendungen, während Rubidium und Cäsium in akademischen Kontexten sehr nützlich sind, aber noch nicht viele Anwendungen haben. Lithium wird häufig in Lithium-Ionen-Batterien verwendet, und Lithiumoxid kann bei der Verarbeitung von Kieselerde helfen. Lithiumstearat ist ein Verdickungsmittel und kann zur Herstellung von Schmierfetten verwendet werden; es wird aus Lithiumhydroxid hergestellt, das auch zur Absorption von Kohlendioxid in Raumkapseln und U-Booten verwendet wird. Lithiumchlorid wird als Lötmittel für Aluminiumteile verwendet. Metallisches Lithium wird in Legierungen mit Magnesium und Aluminium verwendet, um sehr zähe und leichte Legierungen zu erhalten. ⓘ
Natriumverbindungen haben viele Verwendungszwecke, der bekannteste ist Natriumchlorid als Speisesalz. Natriumsalze von Fettsäuren werden als Seife verwendet. Reines Natriummetall hat ebenfalls viele Verwendungsmöglichkeiten, z. B. in Natriumdampflampen, die im Vergleich zu anderen Beleuchtungsarten sehr effizientes Licht erzeugen, und kann die Oberfläche anderer Metalle glätten. Da es ein starkes Reduktionsmittel ist, wird es häufig verwendet, um viele andere Metalle, wie Titan und Zirkonium, aus ihren Chloriden zu reduzieren. Außerdem ist es aufgrund seines niedrigen Schmelzpunkts, seiner Viskosität und seines Querschnitts für die Neutronenabsorption sehr nützlich als Wärmeaustauschflüssigkeit in schnellen Brutreaktoren. ⓘ
Kaliumverbindungen werden häufig als Düngemittel verwendet, da Kalium ein wichtiges Element für die Pflanzenernährung ist. Kaliumhydroxid ist eine sehr starke Base und wird zur Kontrolle des pH-Werts verschiedener Stoffe verwendet. Kaliumnitrat und Kaliumpermanganat werden häufig als starke Oxidationsmittel eingesetzt. Kaliumsuperoxid wird in Atemschutzmasken verwendet, da es mit Kohlendioxid zu Kaliumcarbonat und Sauerstoffgas reagiert. Reines Kaliummetall wird nicht oft verwendet, aber seine Legierungen mit Natrium können reines Natrium in schnellen Brutreaktoren ersetzen. ⓘ
Rubidium und Cäsium werden häufig in Atomuhren verwendet. Cäsium-Atomuhren sind außerordentlich genau; wäre eine Uhr zur Zeit der Dinosaurier hergestellt worden, würde sie um weniger als vier Sekunden (nach 80 Millionen Jahren) abweichen. Aus diesem Grund werden Cäsiumatome als Definition der Sekunde verwendet. Rubidium-Ionen werden häufig in violetten Feuerwerkskörpern verwendet, und Cäsium wird häufig in Bohrflüssigkeiten in der Erdölindustrie eingesetzt. ⓘ
Francium hat keine kommerziellen Anwendungen, wurde aber u. a. wegen seiner relativ einfachen Atomstruktur in Spektroskopieexperimenten verwendet, was zu mehr Informationen über Energieniveaus und Kopplungskonstanten zwischen subatomaren Teilchen führte. Untersuchungen des Lichts, das von mit einem Laser eingefangenen Francium-210-Ionen ausgesendet wird, haben genaue Daten über die Übergänge zwischen den Energieniveaus der Atome geliefert, die den von der Quantentheorie vorhergesagten entsprechen. ⓘ
Biologische Rolle und Vorsichtsmaßnahmen
Metalle
Reine Alkalimetalle sind mit Luft und Wasser gefährlich reaktionsfreudig und müssen von Hitze, Feuer, Oxidationsmitteln, Säuren, den meisten organischen Verbindungen, Halogenkohlenwasserstoffen, Kunststoffen und Feuchtigkeit ferngehalten werden. Sie reagieren auch mit Kohlendioxid und Tetrachlorkohlenstoff, so dass normale Feuerlöscher bei Alkalimetallbränden kontraproduktiv sind. Einige für Metallbrände konzipierte Trockenpulverlöscher der Klasse D sind wirksam, da sie dem Feuer den Sauerstoff entziehen und das Alkalimetall kühlen. ⓘ
Bei Experimenten werden in der Regel nur kleine Mengen von einigen Gramm in einem Abzug verwendet. Kleine Mengen Lithium können durch Reaktion mit kaltem Wasser beseitigt werden, die schwereren Alkalimetalle sollten jedoch in dem weniger reaktiven Isopropanol gelöst werden. Die Alkalimetalle müssen unter Mineralöl oder einer inerten Atmosphäre gelagert werden. Als inerte Atmosphäre kann Argon oder Stickstoffgas verwendet werden, außer für Lithium, das mit Stickstoff reagiert. Rubidium und Cäsium dürfen nicht an der Luft gelagert werden, auch nicht in Öl, da schon eine kleine Menge Luft, die in das Öl diffundiert, die Bildung des gefährlichen explosiven Peroxids auslösen kann; aus demselben Grund sollte Kalium nicht länger als 6 Monate in Öl unter sauerstoffhaltiger Atmosphäre gelagert werden. ⓘ
Ionen

Die bioanorganische Chemie der Alkalimetallionen ist ausführlich untersucht worden. Für viele Komplexe von Alkalimetallionen in kleinen Peptiden, Nukleinsäurebestandteilen, Kohlenhydraten und Ionophoren wurden Kristallstrukturen im festen Zustand bestimmt. ⓘ
Lithium kommt in der Natur nur in Spuren in biologischen Systemen vor und hat keine bekannte biologische Funktion, hat aber Auswirkungen auf den Körper, wenn es eingenommen wird. Lithiumcarbonat wird in der Psychiatrie als Stimmungsstabilisator zur Behandlung von bipolaren Störungen (manische Depressionen) in Tagesdosen von etwa 0,5 bis 2 Gramm eingesetzt, obwohl es Nebenwirkungen hat. Eine übermäßige Einnahme von Lithium führt unter anderem zu Schläfrigkeit, undeutlicher Sprache und Erbrechen und vergiftet das zentrale Nervensystem, was gefährlich ist, da die zur Behandlung der bipolaren Störung erforderliche Lithiumdosis nur geringfügig unter der toxischen Dosis liegt. Seine Biochemie, die Art und Weise, wie es vom menschlichen Körper verarbeitet wird, sowie Studien an Ratten und Ziegen deuten darauf hin, dass es sich um ein essenzielles Spurenelement handelt, auch wenn die natürliche biologische Funktion von Lithium beim Menschen noch nicht geklärt ist. ⓘ
Natrium und Kalium kommen in allen bekannten biologischen Systemen vor und fungieren im Allgemeinen als Elektrolyte innerhalb und außerhalb der Zellen. Natrium ist ein essentieller Nährstoff, der das Blutvolumen, den Blutdruck, das osmotische Gleichgewicht und den pH-Wert reguliert; der physiologische Mindestbedarf an Natrium beträgt 500 Milligramm pro Tag. Natriumchlorid (auch als Kochsalz bekannt) ist die Hauptnatriumquelle in der Ernährung und wird als Gewürz und Konservierungsmittel verwendet, z. B. für Pökelwaren und Dörrfleisch; der größte Teil stammt aus verarbeiteten Lebensmitteln. Der Referenzwert für Natrium liegt bei 1,5 Gramm pro Tag, aber die meisten Menschen in den Vereinigten Staaten nehmen mehr als 2,3 Gramm pro Tag zu sich, die Mindestmenge, die Bluthochdruck begünstigt; dies wiederum verursacht weltweit 7,6 Millionen vorzeitige Todesfälle. ⓘ
Kalium ist das wichtigste Kation (positives Ion) innerhalb tierischer Zellen, während Natrium das wichtigste Kation außerhalb tierischer Zellen ist. Die Konzentrationsunterschiede dieser geladenen Teilchen bewirken einen Unterschied im elektrischen Potenzial zwischen dem Inneren und dem Äußeren der Zellen, der als Membranpotenzial bezeichnet wird. Das Gleichgewicht zwischen Kalium und Natrium wird durch Ionentransporterproteine in der Zellmembran aufrechterhalten. Das von den Kalium- und Natriumionen erzeugte Zellmembranpotenzial ermöglicht es der Zelle, ein Aktionspotenzial zu erzeugen - eine elektrische Entladung in Form einer "Spitze". Die Fähigkeit der Zellen, elektrische Entladungen zu erzeugen, ist entscheidend für Körperfunktionen wie Neurotransmission, Muskelkontraktion und Herzfunktion. Eine Störung dieses Gleichgewichts kann daher tödlich sein: So kann beispielsweise die Aufnahme großer Mengen von Kaliumverbindungen zu einer Hyperkaliämie führen, die das Herz-Kreislauf-System stark beeinflusst. Kaliumchlorid wird in den Vereinigten Staaten für Hinrichtungen mit der Giftspritze verwendet. ⓘ

Aufgrund ihrer ähnlichen Atomradien ähneln Rubidium und Cäsium im Körper dem Kalium und werden in ähnlicher Weise aufgenommen. Rubidium hat keine bekannte biologische Funktion, kann aber dazu beitragen, den Stoffwechsel anzuregen und, ähnlich wie Cäsium, Kalium im Körper zu ersetzen, was zu Kaliummangel führt. Eine teilweise Substitution ist durchaus möglich und eher ungiftig: Ein 70 kg schwerer Mensch enthält im Durchschnitt 0,36 g Rubidium, und eine Erhöhung dieses Wertes um das 50- bis 100-fache zeigte bei Versuchspersonen keine negativen Auswirkungen. Ratten können eine bis zu 50%ige Substitution von Kalium durch Rubidium überleben. Rubidium (und in viel geringerem Maße Cäsium) können als vorübergehende Heilmittel für Hypokaliämie fungieren; während Rubidium in einigen Systemen Kalium auf angemessene Weise physiologisch ersetzen kann, ist Cäsium dazu nie in der Lage. Es gibt nur sehr wenige Hinweise in Form von Mangelerscheinungen darauf, dass Rubidium bei Ziegen möglicherweise essentiell ist; selbst wenn dies der Fall sein sollte, sind die normalerweise in der Nahrung vorhandenen Spurenmengen mehr als ausreichend. ⓘ
Cäsiumverbindungen werden von den meisten Menschen nur selten angetroffen, aber die meisten Cäsiumverbindungen sind leicht toxisch. Wie Rubidium neigt auch Cäsium dazu, Kalium im Körper zu ersetzen, ist aber wesentlich größer und daher ein schlechterer Ersatz. Ein Überschuss an Cäsium kann zu Hypokaliämie, Herzrhythmusstörungen und akutem Herzstillstand führen, aber solche Mengen sind in natürlichen Quellen normalerweise nicht zu finden. Daher ist Cäsium kein bedeutender chemischer Umweltschadstoff. Der mittlere Wert der tödlichen Dosis (LD50) für Cäsiumchlorid bei Mäusen liegt bei 2,3 g pro Kilogramm, was mit den LD50-Werten von Kaliumchlorid und Natriumchlorid vergleichbar ist. Cäsiumchlorid wurde als alternative Krebstherapie angepriesen, wurde jedoch mit dem Tod von über 50 Patienten in Verbindung gebracht, bei denen es im Rahmen einer wissenschaftlich nicht abgesicherten Krebsbehandlung eingesetzt wurde. ⓘ
Radioisotope von Cäsium erfordern besondere Vorsichtsmaßnahmen: Die unsachgemäße Handhabung von Cäsium-137-Gammastrahlenquellen kann zur Freisetzung dieses Radioisotops und zu Strahlenschäden führen. Der vielleicht bekannteste Fall ist der Unfall von Goiânia im Jahr 1987, bei dem ein unsachgemäß entsorgtes Strahlentherapiesystem aus einer verlassenen Klinik in der brasilianischen Stadt Goiânia auf einem Schrottplatz entsorgt und das glühende Cäsiumsalz an neugierige, ungebildete Käufer verkauft wurde. Dies führte zu vier Todesfällen und schweren Verletzungen durch Strahlenbelastung. Zusammen mit Cäsium-134, Jod-131 und Strontium-90 gehörte Cäsium-137 zu den Isotopen, die durch die Tschernobyl-Katastrophe verbreitet wurden und die größte Gefahr für die Gesundheit darstellen. Radioisotope von Francium wären aufgrund ihrer hohen Zerfallsenergie und kurzen Halbwertszeit vermutlich ebenfalls gefährlich, aber keines wurde in ausreichenden Mengen produziert, um ein ernsthaftes Risiko darzustellen. ⓘ
Etymologie
Der Name der Alkalimetalle leitet sich von dem arabischen Wort القلية / al-qalya für „Pottasche“ ab, die alte Bezeichnung für aus Pflanzenaschen gewonnenes Kaliumcarbonat. Humphry Davy stellte im Jahre 1807 erstmals das Element Kalium durch eine Schmelzflusselektrolyse aus Kaliumhydroxid dar. Letzteres gewann er aus Kaliumcarbonat. In einigen Sprachen spiegelt sich dies im Namen wider. So heißt Kalium beispielsweise im Englischen und Französischen potassium und im Italienischen potassio. ⓘ




















