Wasserstoffbrückenbindung


Eine Wasserstoffbindung (oder H-Bindung) ist eine primär elektrostatische Anziehungskraft zwischen einem Wasserstoffatom (H), das kovalent an ein elektronegativeres "Donor"-Atom oder eine Gruppe gebunden ist, und einem anderen elektronegativen Atom, das ein einsames Elektronenpaar trägt - dem Wasserstoffbindungsakzeptor (Ac). Ein solches interagierendes System wird im Allgemeinen als Dn-H---Ac bezeichnet, wobei die durchgezogene Linie eine polare kovalente Bindung und die gepunktete oder gestrichelte Linie die Wasserstoffbrückenbindung anzeigt. Die häufigsten Donor- und Akzeptoratome sind die Elemente der zweiten Reihe Stickstoff (N), Sauerstoff (O) und Fluor (F). ⓘ
Wasserstoffbrücken können intermolekular (zwischen getrennten Molekülen) oder intramolekular (zwischen Teilen desselben Moleküls) sein. Die Energie einer Wasserstoffbrückenbindung hängt von der Geometrie, der Umgebung und der Art der spezifischen Donor- und Akzeptoratome ab und kann zwischen 1 und 40 kcal/mol variieren. Damit ist sie etwas stärker als eine van-der-Waals-Wechselwirkung und schwächer als vollständig kovalente oder ionische Bindungen. Diese Art von Bindung kann in anorganischen Molekülen wie Wasser und in organischen Molekülen wie DNA und Proteinen auftreten. Wasserstoffbrücken sind dafür verantwortlich, dass Materialien wie Papier und Filzwolle zusammenhalten und dass einzelne Papierblätter zusammenkleben, nachdem sie nass geworden und anschließend getrocknet sind. ⓘ
Die Wasserstoffbrückenbindung ist für viele der ungewöhnlichen physikalischen und chemischen Eigenschaften von N-, O- und F-Verbindungen verantwortlich. Insbesondere ist die intermolekulare Wasserstoffbrückenbindung für den hohen Siedepunkt von Wasser (100 °C) im Vergleich zu den anderen Hydriden der Gruppe 16 verantwortlich, die viel schwächere Wasserstoffbrückenbindungen aufweisen. Intramolekulare Wasserstoffbrückenbindungen sind teilweise für die Sekundär- und Tertiärstrukturen von Proteinen und Nukleinsäuren verantwortlich. Sie spielt auch eine wichtige Rolle bei der Struktur von Polymeren, sowohl synthetischen als auch natürlichen. ⓘ
Bindung

Definitionen und allgemeine Merkmale
Ein Wasserstoffatom, das an ein relativ elektronegatives Atom gebunden ist, ist der Wasserstoffbindungsdonor. C-H-Bindungen nehmen nur dann an Wasserstoffbrückenbindungen teil, wenn das Kohlenstoffatom an elektronegative Substituenten gebunden ist, wie dies bei Chloroform (CHCl3) der Fall ist. Bei einer Wasserstoffbindung wird das elektronegative Atom, das nicht kovalent an den Wasserstoff gebunden ist, als Protonenakzeptor bezeichnet, während das kovalent an den Wasserstoff gebundene Atom als Protonendonor bezeichnet wird. Diese Nomenklatur wird zwar von der IUPAC empfohlen, kann aber irreführend sein, da bei anderen Donor-Akzeptor-Bindungen die Donor/Akzeptor-Zuordnung auf der Quelle des Elektronenpaars beruht (diese Nomenklatur wird von einigen Autoren auch für Wasserstoffbrückenbindungen verwendet). Bei der Wasserstoffbrückenbindung Donor ist das H-Zentrum protisch. Der Donor ist eine Lewis-Base. Wasserstoffbrückenbindungen werden als H--Y-System dargestellt, wobei die Punkte die Wasserstoffbrückenbindung darstellen. Flüssigkeiten, die Wasserstoffbrückenbindungen aufweisen (wie z. B. Wasser), werden als assoziierte Flüssigkeiten bezeichnet. ⓘ


Die Wasserstoffbrückenbindung wird häufig als elektrostatische Dipol-Dipol-Wechselwirkung beschrieben. Sie weist jedoch auch einige Merkmale einer kovalenten Bindung auf: Sie ist gerichtet und stark, erzeugt interatomare Abstände, die kürzer sind als die Summe der van-der-Waals-Radien, und umfasst in der Regel eine begrenzte Anzahl von Wechselwirkungspartnern, was als eine Art von Wertigkeit interpretiert werden kann. Diese kovalenten Eigenschaften sind ausgeprägter, wenn Akzeptoren Wasserstoff von elektronegativeren Donatoren binden. ⓘ
Als Teil einer detaillierteren Liste von Kriterien erkennt die IUPAC-Veröffentlichung an, dass die anziehende Wechselwirkung aus einer Kombination von Elektrostatik (Multipol-Mehrpol- und Multipol-induzierte Multipol-Wechselwirkungen), Kovalenz (Ladungstransfer durch Orbitalüberlappung) und Dispersion (Londoner Kräfte) entstehen kann, und stellt fest, dass die relative Bedeutung der einzelnen Faktoren je nach System variiert. In einer Fußnote zu diesem Kriterium wird jedoch empfohlen, Wechselwirkungen auszuschließen, bei denen die Dispersion die Hauptrolle spielt, wobei insbesondere Ar---CH4 und CH4---CH4 als Beispiele für solche Wechselwirkungen genannt werden, die von der Definition auszuschließen sind. Dennoch beschränken die meisten einführenden Lehrbücher die Definition von Wasserstoffbrückenbindungen immer noch auf den im ersten Absatz beschriebenen "klassischen" Typ von Wasserstoffbrückenbindungen. ⓘ
Schwächere Wasserstoffbrückenbindungen sind für Wasserstoffatome bekannt, die an Elemente wie Schwefel (S) oder Chlor (Cl) gebunden sind; sogar Kohlenstoff (C) kann als Donor dienen, insbesondere wenn der Kohlenstoff oder einer seiner Nachbarn elektronegativ ist (z. B. in Chloroform, Aldehyden und terminalen Acetylenen). Allmählich erkannte man, dass es viele Beispiele für schwächere Wasserstoffbrückenbindungen gibt, bei denen ein anderer Donor als N, O oder F und/oder ein Ac-Akzeptor mit einer Elektronegativität beteiligt ist, die der des Wasserstoffs nahe kommt (und nicht viel elektronegativer ist). Obwohl diese "nicht-traditionellen" Wasserstoffbrückenbindungen oft recht schwach sind (≈1 kcal/mol), sind sie ebenfalls allgegenwärtig und werden zunehmend als wichtige Steuerungselemente bei Rezeptor-Ligand-Wechselwirkungen in der medizinischen Chemie oder bei intra- und intermolekularen Wechselwirkungen in den Materialwissenschaften anerkannt. ⓘ
Die Definition von Wasserstoffbrückenbindungen wurde im Laufe der Zeit schrittweise erweitert, um diese schwächeren attraktiven Wechselwirkungen einzubeziehen. Im Jahr 2011 empfahl eine IUPAC-Arbeitsgruppe eine moderne, evidenzbasierte Definition von Wasserstoffbrückenbindungen, die in der IUPAC-Zeitschrift Pure and Applied Chemistry veröffentlicht wurde. Diese Definition legt fest:
Die Wasserstoffbrückenbindung ist eine attraktive Wechselwirkung zwischen einem Wasserstoffatom eines Moleküls oder eines Molekülfragments X-H, bei dem X elektronegativer ist als H, und einem Atom oder einer Gruppe von Atomen im gleichen oder einem anderen Molekül, bei der es Hinweise auf eine Bindungsbildung gibt. ⓘ
Stärke der Bindung
Die Stärke von Wasserstoffbindungen kann von schwach (1-2 kJ mol-1) bis stark (161,5 kJ mol-1 im Ion HF-
2). Typische Enthalpien in Dampf sind:
- F-H---:F (161,5 kJ/mol oder 38,6 kcal/mol), eindeutig dargestellt durch HF2-, Bifluorid
- O-H---:N (29 kJ/mol oder 6,9 kcal/mol), veranschaulicht durch Wasser-Ammoniak
- O-H---:O (21 kJ/mol oder 5,0 kcal/mol), illustriert Wasser-Wasser, Alkohol-Alkohol
- N-H---:N (13 kJ/mol oder 3,1 kcal/mol), illustriert durch Ammoniak-Ammoniak
- N-H---:O (8 kJ/mol oder 1,9 kcal/mol), veranschaulicht durch Wasser-Amid
- OH+
3---:OH
2 (18 kJ/mol oder 4,3 kcal/mol)
Die Stärke intermolekularer Wasserstoffbrückenbindungen wird am häufigsten durch Messungen von Gleichgewichten zwischen Molekülen mit Donor- und/oder Akzeptoreinheiten, meist in Lösung, ermittelt. Die Stärke intramolekularer Wasserstoffbrückenbindungen kann durch Gleichgewichtsmessungen zwischen Konformeren mit und ohne Wasserstoffbrückenbindungen untersucht werden. Die wichtigste Methode zur Identifizierung von Wasserstoffbrücken auch in komplizierten Molekülen ist die Kristallographie, manchmal auch die NMR-Spektroskopie. Strukturelle Details, insbesondere Abstände zwischen Donor und Akzeptor, die kleiner sind als die Summe der van-der-Waals-Radien, können als Hinweis auf die Stärke der Wasserstoffbrückenbindung gewertet werden. ⓘ
Ein Schema sieht die folgende, etwas willkürliche Klassifizierung vor: 15 bis 40 kcal/mol, 5 bis 15 kcal/mol und >0 bis 5 kcal/mol gelten als stark, mäßig bzw. schwach. ⓘ
Resonanzunterstützte Wasserstoffbrückenbindung
Die resonanzunterstützte Wasserstoffbrückenbindung (gemeinhin als RAHB abgekürzt) ist eine starke Art der Wasserstoffbrückenbindung. Sie ist durch die π-Delokalisierung gekennzeichnet, an der der Wasserstoff beteiligt ist und die durch das elektrostatische Modell allein nicht richtig beschrieben werden kann. Diese Beschreibung der Wasserstoffbrückenbindung wurde vorgeschlagen, um ungewöhnlich kurze Abstände zu beschreiben, die im Allgemeinen zwischen O=C-OH∙∙∙ oder ∙∙∙∙O=C-C=C-OH beobachtet werden. ⓘ
Strukturelle Details
Der X-H-Abstand beträgt typischerweise ≈110 pm, während der H--Y-Abstand ≈160 bis 200 pm beträgt. Die typische Länge einer Wasserstoffbrückenbindung in Wasser beträgt 197 pm. Der ideale Bindungswinkel hängt von der Art des Wasserstoffbindungsdonors ab. Die folgenden Wasserstoffbrückenbindungswinkel zwischen einem Flusssäuredonor und verschiedenen Akzeptoren wurden experimentell bestimmt:
| Akzeptor---Donor | VSEPR-Geometrie | Winkel (°) ⓘ |
|---|---|---|
| HCN---HF | linear | 180 |
| H2CO---HF | trigonal planar | 120 |
| H2O---HF | pyramidal | 46 |
| H2S---HF | pyramidal | 89 |
| SO2---HF | trigonal | 142 |
Spektroskopie
Starke Wasserstoffbrückenbindungen zeigen sich durch Abwärtsverschiebungen im 1H-NMR-Spektrum. Zum Beispiel erscheint das saure Proton im Enol-Tautomeren von Acetylaceton bei δH 15,5, was etwa 10 ppm unter dem Wert eines herkömmlichen Alkohols liegt. ⓘ
Im IR-Spektrum verschiebt die Wasserstoffbrückenbindung die X-H-Streckungsfrequenz zu einer niedrigeren Energie (d. h. die Schwingungsfrequenz nimmt ab). Diese Verschiebung spiegelt eine Schwächung der X-H-Bindung wider. Bestimmte Wasserstoffbrückenbindungen - unechte Wasserstoffbrückenbindungen - zeigen eine Blauverschiebung der X-H-Streckungsfrequenz und eine Abnahme der Bindungslänge. H-Bindungen können auch anhand der Verschiebung der IR-Schwingungsmoden des Akzeptors gemessen werden. Die Amid-I-Mode von Rückgratcarbonylen in α-Helices verschiebt sich zu niedrigeren Frequenzen, wenn sie H-Bindungen mit Hydroxylgruppen der Seitenkette eingehen. ⓘ
Theoretische Überlegungen
Wasserstoffbrückenbindungen sind von anhaltendem theoretischem Interesse. Nach einer modernen Beschreibung umfasst die O:H-O-Bindung sowohl die intermolekulare O:H-Lone-Pair ":" Nichtbindung als auch die intramolekulare polar-kovalente H-O-Bindung in Verbindung mit der O-O-Abstoßungskopplung. ⓘ
Quantenchemische Berechnungen der relevanten interresidualen Potenzialkonstanten (Compliance-Konstanten) ergaben große Unterschiede zwischen einzelnen H-Bindungen desselben Typs. So ist zum Beispiel die zentrale N-H---N-Wasserstoffbindung zwischen Guanin und Cytosin viel stärker als die N-H---N-Bindung zwischen dem Adenin-Thymin-Paar. ⓘ
Theoretisch kann die Bindungsstärke der Wasserstoffbrückenbindungen mit Hilfe des NCI-Index (Index der nicht-kovalenten Wechselwirkungen) bewertet werden, der, wie der Name schon sagt, eine Visualisierung dieser nicht-kovalenten Wechselwirkungen anhand der Elektronendichte des Systems ermöglicht. ⓘ
Aus den Interpretationen der Anisotropien im Compton-Profil von gewöhnlichem Eis geht hervor, dass die Wasserstoffbrückenbindung teilweise kovalent ist. Diese Interpretation wurde jedoch in Frage gestellt. ⓘ
Ganz allgemein kann die Wasserstoffbrückenbindung als ein metrikabhängiges elektrostatisches Skalarfeld zwischen zwei oder mehr intermolekularen Bindungen betrachtet werden. Dies unterscheidet sich geringfügig von den intramolekularen gebundenen Zuständen, wie sie beispielsweise bei kovalenten oder ionischen Bindungen auftreten; dennoch ist die Wasserstoffbrückenbindung im Allgemeinen ein Phänomen des gebundenen Zustands, da die Wechselwirkungsenergie eine negative Nettosumme aufweist. Die ursprüngliche Theorie der Wasserstoffbrückenbindungen, die von Linus Pauling vorgeschlagen wurde, ging davon aus, dass die Wasserstoffbrückenbindungen teilweise kovalent sind. Diese Interpretation blieb umstritten, bis NMR-Techniken die Informationsübertragung zwischen wasserstoffgebundenen Kernen nachwiesen, was nur möglich wäre, wenn die Wasserstoffbrückenbindungen einen kovalenten Charakter hätten. ⓘ
Geschichte
Das Konzept der Wasserstoffbrückenbindungen war einst eine Herausforderung. Linus Pauling schreibt T. S. Moore und T. F. Winmill die erste Erwähnung der Wasserstoffbrückenbindung im Jahr 1912 zu. Moore und Winmill verwendeten die Wasserstoffbrückenbindung, um zu erklären, dass Trimethylammoniumhydroxid eine schwächere Base ist als Tetramethylammoniumhydroxid. Die Beschreibung der Wasserstoffbrückenbindung in ihrem bekannteren Umfeld, dem Wasser, kam einige Jahre später, 1920, von Latimer und Rodebush. In diesem Aufsatz zitieren Latimer und Rodebush die Arbeit eines Kollegen ihres Labors, Maurice Loyal Huggins, mit den Worten: "Mr. Huggins von diesem Laboratorium hat in einer noch unveröffentlichten Arbeit die Idee eines Wasserstoffkerns zwischen zwei Atomen als Theorie in Bezug auf bestimmte organische Verbindungen verwendet." ⓘ
Das Konzept der Wasserstoffbrücken wurde erstmals 1919 von Maurice L. Huggins und 1920 von Wendell Mitchell Latimer und Worth H. Rodebush zur Erklärung der hohen Dielektrizitätskonstante von Wasser beschrieben. ⓘ
Wasserstoffbrücken in kleinen Molekülen
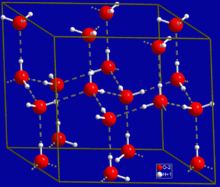

Wasser
Ein allgegenwärtiges Beispiel für eine Wasserstoffbrückenbindung findet sich zwischen Wassermolekülen. In einem einzelnen Wassermolekül gibt es zwei Wasserstoffatome und ein Sauerstoffatom. Der einfachste Fall ist ein Paar von Wassermolekülen mit einer Wasserstoffbrücke zwischen ihnen, das als Wasserdimer bezeichnet und oft als Modellsystem verwendet wird. Wenn mehr Moleküle vorhanden sind, wie es bei flüssigem Wasser der Fall ist, sind mehr Bindungen möglich, da der Sauerstoff eines Wassermoleküls zwei einsame Elektronenpaare besitzt, von denen jedes eine Wasserstoffbindung mit einem Wasserstoff eines anderen Wassermoleküls eingehen kann. Dies kann sich so wiederholen, dass jedes Wassermolekül mit bis zu vier anderen Molekülen eine H-Bindung eingeht, wie in der Abbildung dargestellt (zwei durch seine zwei einsamen Elektronenpaare und zwei durch seine zwei Wasserstoffatome). Wasserstoffbrückenbindungen wirken sich stark auf die Kristallstruktur von Eis aus und tragen zur Bildung eines offenen hexagonalen Gitters bei. Die Dichte von Eis ist geringer als die Dichte von Wasser bei derselben Temperatur; daher schwimmt die feste Phase von Wasser im Gegensatz zu den meisten anderen Substanzen auf der Flüssigkeit. ⓘ
Der hohe Siedepunkt von flüssigem Wasser ist auf die große Anzahl von Wasserstoffbrückenbindungen zurückzuführen, die jedes Molekül im Verhältnis zu seiner geringen Molekülmasse eingehen kann. Aufgrund der Schwierigkeit, diese Bindungen aufzubrechen, hat Wasser einen sehr hohen Siedepunkt, einen hohen Schmelzpunkt und eine hohe Viskosität im Vergleich zu ähnlichen Flüssigkeiten, die nicht durch Wasserstoffbrücken verbunden sind. Wasser ist einzigartig, weil sein Sauerstoffatom zwei einsame Paare und zwei Wasserstoffatome hat, was bedeutet, dass die Gesamtzahl der Bindungen eines Wassermoleküls bis zu vier beträgt. ⓘ
Die Anzahl der von einem Molekül flüssigen Wassers gebildeten Wasserstoffbrücken schwankt mit der Zeit und der Temperatur. Aus TIP4P-Simulationen von flüssigem Wasser bei 25 °C wurde geschätzt, dass jedes Wassermolekül im Durchschnitt an 3,59 Wasserstoffbrückenbindungen beteiligt ist. Bei 100 °C sinkt diese Zahl aufgrund der zunehmenden Molekularbewegung und der geringeren Dichte auf 3,24, während bei 0 °C die durchschnittliche Zahl der Wasserstoffbrückenbindungen auf 3,69 ansteigt. In einer anderen Studie wurde eine viel geringere Anzahl von Wasserstoffbrückenbindungen festgestellt: 2,357 bei 25 °C. Die Unterschiede sind möglicherweise auf die Verwendung einer anderen Methode zur Definition und Zählung der Wasserstoffbrückenbindungen zurückzuführen. ⓘ
Wenn die Bindungsstärken gleichwertiger sind, könnte man stattdessen die Atome zweier interagierender Wassermoleküle in zwei mehratomige Ionen mit entgegengesetzter Ladung aufteilen, nämlich in Hydroxid (OH-) und Hydronium (H3O+). (Hydronium-Ionen sind auch als "Hydroxonium"-Ionen bekannt.) ⓘ
- H-O- H3O+ ⓘ
In reinem Wasser unter Standardtemperatur- und -druckbedingungen ist diese letztere Formulierung nur selten anwendbar; im Durchschnitt gibt etwa eines von 5,5 × 108 Molekülen ein Proton an ein anderes Wassermolekül ab, was dem Wert der Dissoziationskonstante für Wasser unter solchen Bedingungen entspricht. Sie ist ein entscheidender Teil der Einzigartigkeit von Wasser. ⓘ
Da Wasser Wasserstoffbrückenbindungen mit Protonendonatoren und -akzeptoren von gelösten Stoffen bilden kann, kann es die Bildung von inter- oder intramolekularen Wasserstoffbrückenbindungen von gelösten Stoffen konkurrierend hemmen. Folglich sind Wasserstoffbrückenbindungen zwischen oder innerhalb von gelösten Molekülen, die in Wasser gelöst sind, fast immer ungünstiger als Wasserstoffbrückenbindungen zwischen Wasser und den Donatoren und Akzeptoren für Wasserstoffbrückenbindungen an diesen gelösten Stoffen. Wasserstoffbrücken zwischen Wassermolekülen haben eine durchschnittliche Lebensdauer von 10-11 Sekunden, also 10 Pikosekunden. ⓘ
Verzweigte und überkoordinierte Wasserstoffbrückenbindungen in Wasser
Ein einzelnes Wasserstoffatom kann an zwei Wasserstoffbrückenbindungen beteiligt sein, anstatt an einer. Diese Art von Bindung wird als "bifurkiert" (zweigeteilt oder "zweigabelig") bezeichnet. Sie kann z. B. in komplexen natürlichen oder synthetischen organischen Molekülen vorkommen. Es wurde vermutet, dass ein gegabeltes Wasserstoffatom ein wesentlicher Schritt bei der Neuorientierung von Wasser ist.
Wasserstoffbrückenbindungen vom Akzeptor-Typ (die an den einsamen Paaren eines Sauerstoffs enden) bilden mit größerer Wahrscheinlichkeit eine Bifurkation (man nennt sie überkoordinierten Sauerstoff, OCO) als Wasserstoffbrückenbindungen vom Donor-Typ, die an den Wasserstoffatomen desselben Sauerstoffs beginnen. ⓘ
Andere Flüssigkeiten
Fluorwasserstoff zum Beispiel, der drei einsame Paare am F-Atom, aber nur ein H-Atom hat, kann nur zwei Bindungen eingehen (Ammoniak hat das entgegengesetzte Problem: drei Wasserstoffatome, aber nur ein einsames Paar). ⓘ
- H-F---H-F---H-F ⓘ
Weitere Erscheinungsformen von Wasserstoffbrückenbindungen in Lösungsmitteln
- Die Erhöhung des Schmelzpunkts, des Siedepunkts, der Löslichkeit und der Viskosität vieler Verbindungen lässt sich durch das Konzept der Wasserstoffbrückenbindung erklären.
- Negative Azeotropie von Mischungen aus HF und Wasser.
- Die Tatsache, dass Eis eine geringere Dichte hat als flüssiges Wasser, ist auf eine durch Wasserstoffbrücken stabilisierte Kristallstruktur zurückzuführen.
- Dramatisch höhere Siedepunkte von NH3, H2O und HF im Vergleich zu den schwereren Analoga PH3, H2S und HCl, bei denen keine Wasserstoffbrückenbindungen vorhanden sind.
- Viskosität von wasserfreier Phosphorsäure und von Glycerin.
- Dimerbildung bei Carbonsäuren und Hexamerbildung bei Fluorwasserstoff, die sogar in der Gasphase auftreten und zu groben Abweichungen vom idealen Gasgesetz führen.
- Pentamerbildung von Wasser und Alkoholen in apolaren Lösungsmitteln. ⓘ
Wasserstoffbrücken in Polymeren
Die Wasserstoffbrückenbindungen spielen eine wichtige Rolle bei der Bestimmung der dreidimensionalen Strukturen und der Eigenschaften vieler synthetischer und natürlicher Proteine. Im Vergleich zu den C-C-, C-O- und C-N-Bindungen, aus denen die meisten Polymere bestehen, sind Wasserstoffbrückenbindungen viel schwächer, vielleicht 5 %. Daher können Wasserstoffbrückenbindungen durch chemische oder mechanische Mittel gebrochen werden, wobei die Grundstruktur des Polymerrückgrats erhalten bleibt. Diese Hierarchie der Bindungsstärken (kovalente Bindungen sind stärker als Wasserstoffbrückenbindungen, die stärker sind als van der Waals-Kräfte) ist der Schlüssel zum Verständnis der Eigenschaften vieler Materialien. ⓘ
DNA
Wasserstoffbrücken sind verantwortlich für die speziellen Eigenschaften vieler für Lebewesen wichtiger Moleküle:
- Proteine: Stabilisierung von Sekundärstrukturelementen wie α-Helix und β-Faltblatt, sowie der Tertiärstruktur und Quartärstruktur (es treten bei Proteinen zusätzlich auch noch andere Bindungstypen auf).
- RNA: komplementäre Basenpaarung innerhalb von ncRNA-Molekülen oder zwischen RNA- und DNA-Molekülen.
- DNA: komplementäre Basenpaarung innerhalb der Doppelhelix; die beiden DNA-Stränge werden von den Wasserstoffbrückenbindungen zusammengehalten. Sie lassen sich jedoch (beim Kopiervorgang durch Helikasen) lösen („Reißverschluss“-Prinzip).
- Wirkstoffe: Die Bindungsaffinität von Wirkstoffen an ihre Zielstrukturen hängt maßgeblich von den gebildeten Wasserstoffbrücken ab. ⓘ
- ⓘ


Bei diesen Makromolekülen bewirken Bindungen zwischen Teilen desselben Makromoleküls, dass es sich in eine bestimmte Form faltet, was dazu beiträgt, die physiologische oder biochemische Rolle des Moleküls zu bestimmen. Die doppelhelicale Struktur der DNA beispielsweise ist größtenteils auf Wasserstoffbrückenbindungen zwischen ihren Basenpaaren (sowie auf pi-Stapelwechselwirkungen) zurückzuführen, die einen komplementären Strang mit dem anderen verbinden und die Replikation ermöglichen. ⓘ
Proteine
In der Sekundärstruktur von Proteinen bilden sich Wasserstoffbrücken zwischen den Sauerstoffatomen des Rückgrats und den Wasserstoffatomen der Amide. Wenn der Abstand der an einer Wasserstoffbrücke beteiligten Aminosäurereste regelmäßig zwischen den Positionen i und i + 4 liegt, bildet sich eine Alpha-Helix. Wenn der Abstand zwischen den Positionen i und i + 3 geringer ist, bildet sich eine 310-Helix. Wenn zwei Stränge durch Wasserstoffbrückenbindungen verbunden sind, an denen abwechselnde Reste auf jedem beteiligten Strang beteiligt sind, entsteht ein Betafilm. Wasserstoffbrücken spielen auch eine Rolle bei der Bildung der Tertiärstruktur von Proteinen durch die Interaktion von R-Gruppen. (Siehe auch Proteinfaltung). ⓘ
In alpha-helicalen Transmembranproteinen sind bifurkierte H-Bindungssysteme zwischen dem Rückgrat-Amid C=O von Rest i als H-Bindungsakzeptor und zwei H-Bindungsdonatoren von Rest i+4 üblich: dem Rückgrat-Amid N-H und einem Seitenketten-Hydroxyl oder Thiol H+. Die Energiepräferenz des bifurkierten H-Bindungs-Hydroxyl- oder Thiol-Systems beträgt -3,4 kcal/mol bzw. -2,6 kcal/mol. Diese Art der verzweigten H-Bindung bietet einen intrahelicalen H-Bindungspartner für polare Seitenketten wie Serin, Threonin und Cystein innerhalb der hydrophoben Membranumgebung. ⓘ
Die Rolle der Wasserstoffbrückenbindungen bei der Proteinfaltung wurde auch mit der osmolyt-induzierten Proteinstabilisierung in Verbindung gebracht. Schützende Osmolyte wie Trehalose und Sorbit verschieben das Gleichgewicht der Proteinfaltung in Richtung des gefalteten Zustands, und zwar in Abhängigkeit von der Konzentration. Während die vorherrschende Erklärung für die Wirkung von Osmolyten auf entropischen Ausschlussvolumeneffekten beruht, haben Experimente mit Zirkulardichroismus (CD) gezeigt, dass Osmolyte durch einen enthalpischen Effekt wirken. Der molekulare Mechanismus für die Rolle der Osmolyte bei der Proteinstabilisierung ist noch nicht ganz geklärt, obwohl mehrere Mechanismen vorgeschlagen wurden. Computer-Molekulardynamiksimulationen legen nahe, dass Osmolyte Proteine stabilisieren, indem sie die Wasserstoffbrücken in der Proteinhydratationsschicht verändern. ⓘ
Mehrere Studien haben gezeigt, dass Wasserstoffbrücken eine wichtige Rolle für die Stabilität zwischen Untereinheiten in multimeren Proteinen spielen. Eine Studie über Sorbitol-Dehydrogenase zeigte beispielsweise ein wichtiges Wasserstoffbrückenbindungsnetzwerk, das die tetramerische quaternäre Struktur innerhalb der Sorbitol-Dehydrogenase-Proteinfamilie von Säugetieren stabilisiert. ⓘ
Eine unvollständig vor Wasserangriffen geschützte Wasserstoffbrückenbindung des Proteinrückgrats ist ein Dehydron. Dehydrons fördern die Entfernung von Wasser durch Proteine oder Ligandenbindung. Die exogene Dehydratisierung verbessert die elektrostatische Wechselwirkung zwischen den Amid- und Carbonylgruppen, indem sie deren Teilladungen abschirmt. Außerdem stabilisiert die Dehydratisierung die Wasserstoffbrückenbindung durch Destabilisierung des nicht gebundenen Zustands, der aus dehydrierten isolierten Ladungen besteht. ⓘ
Da Wolle eine Proteinfaser ist, wird sie durch Wasserstoffbrückenbindungen zusammengehalten, so dass sie sich beim Dehnen zurückzieht. Durch Waschen bei hohen Temperaturen können die Wasserstoffbrücken jedoch dauerhaft gebrochen werden, und das Kleidungsstück kann seine Form dauerhaft verlieren. ⓘ
Zellulose
Wasserstoffbrücken sind wichtig für die Struktur von Zellulose und daraus abgeleiteten Polymeren, die in der Natur in vielen verschiedenen Formen vorkommen, z. B. in Baumwolle und Flachs. ⓘ
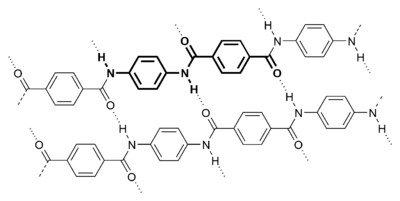

Synthetische Polymere
Viele Polymere werden durch Wasserstoffbrücken innerhalb und zwischen den Ketten verstärkt. Ein gut charakterisiertes Beispiel unter den synthetischen Polymeren ist Nylon, bei dem Wasserstoffbrücken in der Wiederholungseinheit auftreten und eine wichtige Rolle bei der Kristallisation des Materials spielen. Die Bindungen treten zwischen Carbonyl- und Amingruppen in der Amid-Wiederholungseinheit auf. Sie verbinden benachbarte Ketten miteinander und tragen so zur Verstärkung des Materials bei. Besonders ausgeprägt ist dieser Effekt bei Aramidfasern, wo Wasserstoffbrückenbindungen die linearen Ketten seitlich stabilisieren. Die Kettenachsen sind entlang der Faserachse ausgerichtet, was die Fasern extrem steif und fest macht. ⓘ
Aufgrund der Wasserstoffbrückenbindungen reagieren sowohl natürliche als auch synthetische Polymere empfindlich auf die Luftfeuchtigkeit, da Wassermoleküle in die Oberfläche diffundieren und das Netzwerk unterbrechen können. Einige Polymere sind empfindlicher als andere. So sind Nylons empfindlicher als Aramide, und Nylon 6 empfindlicher als Nylon 11. ⓘ
Symmetrische Wasserstoffbrückenbindung
Eine symmetrische Wasserstoffbrückenbindung ist eine besondere Art der Wasserstoffbrückenbindung, bei der das Proton genau auf halber Strecke zwischen zwei identischen Atomen liegt. Die Stärke der Bindung zu jedem dieser Atome ist gleich. Sie ist ein Beispiel für eine dreizentrische Vier-Elektronen-Bindung. Diese Art von Bindung ist viel stärker als eine "normale" Wasserstoffbindung. Die effektive Bindungsordnung beträgt 0,5, so dass ihre Stärke mit der einer kovalenten Bindung vergleichbar ist. Man findet sie in Eis unter hohem Druck und auch in der festen Phase vieler wasserfreier Säuren wie Flusssäure und Ameisensäure unter hohem Druck. Auch das Bifluorid-Ion [F--H--F]- ist ein Beispiel dafür. Die protonierte Form des Protonenschwamms (1,8-Bis(dimethylamino)naphthalin) und seine Derivate weisen aufgrund starker sterischer Beschränkungen ebenfalls symmetrische Wasserstoffbrückenbindungen ([N--H--N]+) auf, wobei im Falle des protonierten Protonenschwamms die Anordnung gebogen ist. ⓘ
Dihydrogenbindung
Die Wasserstoffbindung kann mit der eng verwandten Dihydrogenbindung verglichen werden, bei der es sich ebenfalls um eine intermolekulare Bindungswechselwirkung mit Wasserstoffatomen handelt. Diese Strukturen sind seit einiger Zeit bekannt und kristallographisch gut charakterisiert; ihre Beziehung zur herkömmlichen Wasserstoffbrückenbindung, zur Ionenbindung und zur kovalenten Bindung ist jedoch noch unklar. Im Allgemeinen ist die Wasserstoffbrückenbindung durch einen Protonenakzeptor gekennzeichnet, bei dem es sich um ein einsames Elektronenpaar in nichtmetallischen Atomen (vor allem in Stickstoff- und Chalkogengruppen) handelt. In einigen Fällen können diese Protonenakzeptoren pi-Bindungen oder Metallkomplexe sein. Bei der Dihydrogenbindung hingegen dient ein Metallhydrid als Protonenakzeptor, wodurch eine Wasserstoff-Wasserstoff-Wechselwirkung entsteht. Die Neutronenbeugung hat gezeigt, dass die molekulare Geometrie dieser Komplexe den Wasserstoffbrückenbindungen ähnelt, da die Bindungslänge sehr gut an das System Metallkomplex/Wasserstoffdonor angepasst werden kann. ⓘ
Dynamik mit spektroskopischen Mitteln erforscht
Die Dynamik von Wasserstoffbrückenbindungen in Wasser kann anhand des IR-Spektrums der OH-Streckschwingung untersucht werden. Im Netzwerk der Wasserstoffbrückenbindungen in protischen organischen ionischen plastischen Kristallen (POIPCs), einer Art von Phasenwechselmaterial, das vor dem Schmelzen Festkörper-Phasenübergänge aufweist, kann die Infrarot-Spektroskopie bei variabler Temperatur die Temperaturabhängigkeit der Wasserstoffbrückenbindungen und die Dynamik sowohl der Anionen als auch der Kationen aufzeigen. Die plötzliche Schwächung der Wasserstoffbrückenbindungen während des Festkörper-Phasenübergangs scheint mit dem Auftreten von Orientierungs- oder Rotationsstörungen der Ionen verbunden zu sein. ⓘ
Anwendung auf Arzneimittel
Wasserstoffbrückenbindungen sind ein Schlüssel für die Entwicklung von Arzneimitteln. Nach der Lipinski'schen Fünferregel weisen die meisten oral wirksamen Arzneimittel zwischen fünf und zehn Wasserstoffbrücken auf. Diese Wechselwirkungen bestehen zwischen Stickstoff-Wasserstoff- und Sauerstoff-Wasserstoff-Zentren. Wie bei vielen anderen Faustregeln gibt es auch hier viele Ausnahmen. ⓘ
Intramolekulare Wasserstoffbrückenbindungen

Liegen in einem Molekül mehrere Donatoren/Akzeptoren vor, kann es innerhalb des Moleküls zu Wasserstoffbrückenbindungen kommen, wie etwa bei der Ricinolsäure. Dort ist sowohl eine Hydroxygruppe, als auch eine Carboxygruppe vorhanden. Eigentlich müsste die Hydroxygruppe den Schmelz- bzw. Siedepunkt erhöhen. Allerdings ist der Siedepunkt der Ricinolsäure sogar niedriger als der der Ölsäure, die sich nur durch die fehlende Hydroxygruppe unterscheidet, da die Hydroxygruppe mit der Carboxygruppe eine Wasserstoffbrückenbindung eingeht. Die Carboxygruppe kann also nicht mehr in gleichem Ausmaß intermolekulare Wasserstoffbrückenbindungen eingehen, als wenn die intramolekulare Hydroxygruppe nicht vorhanden wäre. Auch die räumliche Struktur verändert sich; es entstehen aufgrund der Anziehungskräfte zwischen den polaren Gruppen pseudocyclische Strukturen. ⓘ



