Prostatakrebs
| Prostata-Krebs ⓘ | |
|---|---|
| Andere Bezeichnungen | Karzinom der Prostata |
 | |
| Lage der Prostata | |
| Fachgebiet | Onkologie, Urologie |
| Symptome | Keine, Schwierigkeiten beim Wasserlassen, Blut im Urin, Schmerzen im Becken, im Rücken oder beim Urinieren |
| Übliches Auftreten | Alter > 50 Jahre |
| Risikofaktoren | Älteres Alter, Familiengeschichte, Rasse |
| Diagnostische Methode | Gewebebiopsie, medizinische Bildgebung |
| Differentialdiagnose | Gutartige Prostatahyperplasie |
| Behandlung | Aktive Überwachung, Operation, Strahlentherapie, Hormontherapie, Chemotherapie |
| Prognose | 5-Jahres-Überlebensrate 99% (US) |
| Häufigkeit | 1,2 Millionen neue Fälle (2018) |
| Todesfälle | 359,000 (2018) |
Prostatakrebs ist Krebs der Prostata. Die Prostata ist eine Drüse im männlichen Fortpflanzungssystem, die die Harnröhre direkt unterhalb der Blase umgibt. Die meisten Prostatakarzinome sind langsam wachsend. Krebszellen können sich auf andere Bereiche des Körpers ausbreiten, insbesondere auf die Knochen und Lymphknoten. Anfangs kann der Krebs keine Symptome verursachen. In späteren Stadien treten Symptome wie Schmerzen oder Schwierigkeiten beim Wasserlassen, Blut im Urin oder Schmerzen im Becken oder im Rücken auf. Die gutartige Prostatahyperplasie kann ähnliche Symptome hervorrufen. Weitere Spätsymptome sind Müdigkeit, die auf einen niedrigen Gehalt an roten Blutkörperchen zurückzuführen ist. ⓘ
Zu den Faktoren, die das Risiko für Prostatakrebs erhöhen, gehören höheres Alter, familiäre Vorbelastung und Rasse. Etwa 99 % der Fälle treten nach dem 50. Lebensjahr auf. Wenn ein Verwandter ersten Grades an der Krankheit leidet, erhöht sich das Risiko um das Zwei- bis Dreifache. Weitere Faktoren sind eine Ernährung mit einem hohen Anteil an verarbeitetem Fleisch und rotem Fleisch, während das Risiko eines hohen Verzehrs von Milchprodukten nicht eindeutig ist. Es wurde ein Zusammenhang mit Gonorrhoe festgestellt, obwohl die Ursache für diesen Zusammenhang nicht bekannt ist. Ein erhöhtes Risiko wird mit den BRCA-Mutationen in Verbindung gebracht. Die Diagnose wird durch eine Biopsie gestellt. Um festzustellen, ob Metastasen vorhanden sind, kann eine medizinische Bildgebung durchgeführt werden. ⓘ
Das Prostatakrebs-Screening, einschließlich des Tests auf prostataspezifisches Antigen (PSA), erhöht die Krebsentdeckung, aber ob es die Ergebnisse verbessert, ist umstritten. Eine informierte Entscheidungsfindung wird für Personen im Alter von 55 bis 69 Jahren empfohlen. Wenn ein Test durchgeführt wird, ist er eher für Personen mit einer längeren Lebenserwartung geeignet. 5α-Reduktasehemmer scheinen zwar das Risiko für niedriggradigen Krebs zu senken, haben aber keinen Einfluss auf das Risiko für hochgradigen Krebs und werden daher nicht zur Prävention empfohlen. Die Einnahme von Vitaminen oder Mineralstoffen scheint das Risiko nicht zu beeinflussen. ⓘ
In vielen Fällen wird eine aktive Überwachung oder ein abwartendes Verhalten empfohlen. Andere Behandlungen können eine Kombination aus Operation, Strahlentherapie, Hormontherapie oder Chemotherapie umfassen. Tumore, die auf die Prostata beschränkt sind, können heilbar sein. Schmerzmedikamente, Bisphosphonate und gezielte Therapien können unter anderem sinnvoll sein. Die Behandlungsergebnisse hängen vom Alter, vom Gesundheitszustand und davon ab, wie aggressiv und ausgedehnt der Krebs ist. Die meisten Männer mit Prostatakrebs sterben nicht an der Krankheit. In den Vereinigten Staaten liegt die Fünfjahresüberlebensrate bei 98 %. ⓘ
Weltweit ist er die zweithäufigste Krebsart. Er ist die fünfthäufigste Ursache für krebsbedingte Todesfälle bei Männern. Im Jahr 2018 wurde er bei 1,2 Millionen diagnostiziert und verursachte 359.000 Todesfälle. In 84 Ländern war er die häufigste Krebserkrankung bei Männern, wobei er in den Industrieländern am häufigsten auftrat. In den Entwicklungsländern sind die Raten gestiegen. In den 1980er- und 1990er-Jahren stieg die Zahl der Entdeckungen in vielen Gebieten aufgrund der verstärkten PSA-Tests erheblich an. In einer Studie wurde Prostatakrebs bei 30 % bis 70 % der russischen und japanischen Männer über 60 Jahren festgestellt, die an nicht verwandten Ursachen gestorben waren. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| C61 | Bösartige Neubildung der Prostata |
| ICD-10 online (WHO-Version 2019) | |
Die Erkrankung ist im Frühstadium symptomlos. Im fortgeschrittenen Stadium können Beschwerden wie Blasenentleerungsstörungen, Knochenschmerzen und später Gewichtsverlust und Blutarmut auftreten. Wird die Diagnose erst gestellt, wenn bereits Symptome aufgetreten sind, hat häufig schon eine Metastasierung stattgefunden, vorrangig in die lokalen Lymphknoten oder in das Skelett (Knochenmetastasen). ⓘ
Eine Behandlung mit Aussicht auf Heilung ist nur möglich, wenn das entartete Gewebe die Organgrenzen noch nicht überschritten hat und keine Metastasen vorliegen. Da es in der Regel erst bei fortgeschrittener Erkrankung zu Beschwerden kommt, wird in Deutschland eine regelmäßige Früherkennungsuntersuchung für Männer über 45 Jahren (ab dem 41. Lebensjahr für Männer mit positiver Familienanamnese) angeboten, um die Krebsdiagnose möglichst früh in einem noch heilbaren Stadium zu stellen. ⓘ
Das Prostatakarzinom tritt überwiegend bei älteren Männern auf, die eine Symptomatik vielfach nicht mehr erleben würden. So hat sich seit zirka Anfang dieses Jahrtausends das »aktive Beobachten« (siehe unten) als brauchbares Konzept für Männer entwickelt, die sich (zumindest zunächst) keiner invasiven Therapie unterziehen möchten. Die Entscheidung zur Behandlung ist schwierig und vom Einzelfall abhängig. Therapeutische Optionen sind die Operation mit kompletter Entfernung der Prostata (Prostatektomie), die Strahlentherapie, die Hormontherapie und in manchen Fällen die Chemotherapie. In der Erprobungsphase befindet sich noch die therapeutische Hyperthermie („Nanotherapie“). ⓘ
Prostatakrebs ist auch bei Tieren beschrieben; unter den Haustieren ist er beim Hund am häufigsten. ⓘ
Die Prostata

Die Prostata oder Vorsteherdrüse ist eine akzessorische Geschlechtsdrüse aller männlichen Säugetiere einschließlich des Menschen. Sie liegt beim Menschen unterhalb der Harnblase und umkleidet die Harnröhre bis zum Beckenboden. Sie ähnelt beim Mann in Größe und Form einer Kastanie. An die Rückseite der Prostata grenzt der Mastdarm (Rectum). Deswegen kann sie vom Enddarm aus mit den Fingern ertastet und beurteilt werden. Aufgabe der Prostata ist die Abgabe eines Sekrets, das zusammen mit dem der Bläschendrüse, der Bulbourethraldrüse und den aus dem Hoden stammenden Samenzellen das Sperma bildet. Wachstum und Funktion der Vorsteherdrüse werden vorwiegend von dem Geschlechtshormon Testosteron gesteuert. ⓘ
Epidemiologie

Das Prostatakarzinom ist in Deutschland die häufigste diagnostizierte Krebserkrankung des Mannes und steht nach dem Bronchialkarzinom und dem kolorektalen Karzinom an dritter Stelle bei den krebsbedingten Todesursachen der Männer. Rund 26 Prozent aller bei Männern jährlich neu auftretenden Krebserkrankungen betreffen die Prostata. Das entspricht einer altersstandardisierten Inzidenzrate von etwa 99,1 auf 100.000 männliche Personen. Nach einer aktuellen Statistik erkranken in Deutschland 2018 jährlich ca. 65.000 Männer neu an Prostatakrebs. Die beobachtbare, vermeintlich starke Zunahme in den letzten Jahrzehnten ist eher auf verbesserte diagnostische Methoden und eine allgemein höhere Lebenserwartung zurückzuführen als auf eine tatsächliche Zunahme der Fallzahlen. ⓘ
| Jahr | 1980 | 1985 | 1990 | 1995 | 2000 | 2016 | 2018 ⓘ |
|---|---|---|---|---|---|---|---|
| Jährliche Neuerkrankungen in Deutschland |
16.800 | 21.600 | 27.500 | 35.400 | 44.800 | 58.780 | 65.200 |
Die jährliche Mortalität (Gesamtzahl der Todesfälle) liegt um 15.000. Nach einer Übersichtsstudie von 2015 stieg die Rate von „schlafendem“ (latentem) Prostatakrebs bei der Autopsie von Personen, die durch andere Ursachen gestorben waren, von 5 % in der Altersgruppe bis 30 Jahre auf 59 % in der Altersgruppe ab 80 Jahre. Eine ähnliche Übersichtsstudie, ebenfalls von 2015, zeigte auf einer etwas abweichenden Datengrundlage denselben Trend. ⓘ
Es gibt starke geographische und ethnische Unterschiede in der Häufigkeit: Männer schwarzafrikanischen Ursprungs haben die höchste Inzidenzrate, am niedrigsten ist sie bei Asiaten. ⓘ
Die Daten für die weltweiten Erkrankungsraten sind nicht zuverlässig, da sie zum Teil auf Schätzungen beruhen und die diagnostischen Möglichkeiten in den einzelnen Regionen sehr differieren. Die auf Daten der Internationalen Agentur für Krebsforschung (IARC) beruhende Erhebung GLOBOCAN gibt für das Jahr 2002 insgesamt knapp 680.000 Neuerkrankungen und etwa 220.000 Todesfälle an. Hiernach ist die jährliche Inzidenzrate in Zentralasien mit weniger als 3/100.000 Einwohner am niedrigsten, die höchste ist auf dem nordamerikanischen Kontinent mit über 160/100.000 Einwohner zu verzeichnen. ⓘ
Kanada
Prostatakrebs ist die dritthäufigste Krebsart bei kanadischen Männern. Im Jahr 2016 starben etwa 4.000 Männer an Prostatakrebs und bei 21.600 Männern wurde Prostatakrebs diagnostiziert. ⓘ
Europa
In Europa war Prostatakrebs im Jahr 2012 mit 417.000 Fällen die am dritthäufigsten diagnostizierte Krebsart nach Brust- und Dickdarmkrebs. ⓘ
Im Vereinigten Königreich ist Prostatakrebs die zweithäufigste Krebstodesursache nach Lungenkrebs, wo jedes Jahr etwa 35.000 Fälle diagnostiziert werden, von denen etwa 10.000 tödlich enden. ⓘ
Risikofaktoren und protektive Faktoren
Eine Prostatitis (Infektion oder Entzündung) kann das Risiko erhöhen. Insbesondere eine Infektion mit den sexuell übertragbaren Infektionen Chlamydien, Gonorrhö oder Syphilis scheint das Risiko zu erhöhen. ⓘ
Es wurde vorgeschlagen, dass das Papillomavirus eine mögliche Rolle spielt, aber im Jahr 2015 waren die Beweise nicht schlüssig; im Jahr 2018 war das erhöhte Risiko umstritten. ⓘ
Genetik
Die Ursache der Erkrankung ist bisher weitgehend unbekannt. Die genetische Disposition spielt bei der Entstehung der Erkrankung eine Rolle (familiäre Häufung). Daher gelten Männer, deren Väter oder Brüder Prostatakrebs hatten, als Risikopatienten mit etwa doppeltem Erkrankungsrisiko. Diese Männer sollten die üblicherweise erst ab dem fünfzigsten Lebensjahr erforderliche Krebsfrüherkennung durch Kontrolle des prostataspezifischen Antigens bereits ab dem 45. Lebensjahr wahrnehmen. Nun konnte auch in einer Studie gezeigt werden, dass dem beim jungen Mann auftretenden Adenokarzinom der Prostata eine andere Pathophysiologie zugrunde liegt. Es zeigte sich, dass der testosteronbindende Androgenrezeptor eine erhöhte Aktivität aufweist, wodurch eine ganze Reihe von Genen verändert und die Entstehung eines Karzinoms erleichtert wird. ⓘ
Lebensweise
Die großen Unterschiede in der Krankheitshäufigkeit bei verschiedenen Ethnien werden auch auf deren Lebensgewohnheiten zurückgeführt, zumal die Nachkommen von Emigranten nicht das Erkrankungsrisiko ihrer Vorfahren tragen, sondern das des neuen Heimatlandes annehmen. Eine gewisse Rolle wird hierbei der Ernährung zugeschrieben. ⓘ
Wie wichtig dabei die Lebensweise ist, zeigt folgender Zusammenhang: Obgleich weltweit die in Autopsien entdeckten Prostatakarzinome ungefähr gleich häufig auftreten, ist das tatsächliche Auftreten (Inzidenz) von Prostatakrebs von großen geographischen Unterschieden geprägt: Während in den USA jährlich etwa 120 (Weiße) beziehungsweise 200 (Farbige) und in Deutschland 100 von 100.000 Einwohnern an Prostatakrebs erkranken, sind es in Japan nur etwa zwölf von 100.000 Einwohnern. Wenn jedoch Japaner von Japan nach Kalifornien ziehen und „amerikanisiert“ werden, steigt ihr Prostatakrebsrisiko deutlich und nähert sich US-amerikanischem Niveau. Für die deutlich niedrigere Inzidenz werden vor allem die asiatische Ernährung und Lebensweise verantwortlich gemacht. Die aktuelle Studienlage weist auf die Bedeutung einer pflanzenreichen Kost und bestimmter Pflanzenstoffe in Bezug auf die Prävention, das Fortschreiten und das Überleben bei Prostatakrebs hin. ⓘ
Es konnten keine Hinweise darauf gefunden werden, dass die Sterilisation (Vasektomie) das Erkrankungsrisiko erhöht. Doch ein sicherer Einflussfaktor ist der Testosteronspiegel, da die Tumorzellen auf die Stimulation durch Androgene angewiesen sind: Eunuchen entwickeln kein Prostatakarzinom. Im Gegensatz dazu stellen die im fortgeschrittenen Lebensalter häufige gutartige Vergrößerung der Prostata (benigne Prostatahyperplasie) und die Prostataentzündung, ob chronisch oder akut, keine unabhängigen Risikofaktoren dar. Noch widersprüchlich ist die aktuelle Datenlage zur eventuellen Krebsförderung durch erhöhte Spiegel des Gewebshormons IGF-1 (insulinähnlicher Wachstumsfaktor). ⓘ
Nach einer 2003 veröffentlichten Studie soll häufiges Ejakulieren in jüngeren Jahren das Erkrankungsrisiko senken. Australische Wissenschaftler verglichen Daten zu Sexualpraktiken von 1079 Prostatakrebs-Patienten mit denen von 1259 gesunden Männern im Alter zwischen 20 und 50 Jahren. Ihr Ergebnis: Zwanzigjährige, die öfter als viermal pro Woche ejakulieren, senken ihr Risiko für den Prostatakrebs um ein Drittel. Methodisch ist hierbei das Ursache-Wirkungs-Verhältnis nicht geklärt; es könnte sein, dass Männer mit einem gesunden, leistungsfähigen Genitaltrakt öfter ejakulieren und die Gesundheit der Genitalien die eigentliche Ursache ist, weshalb sie später auch nicht so häufig erkranken. Im Gegensatz dazu hatten frühere Studien häufige Sexualkontakte mit einem deutlich erhöhten Risiko für Prostatakrebs in Zusammenhang gebracht. Dies könnte jedoch, nach Ansicht der australischen Forscher, durch die höhere Infektionsgefahr bedingt sein. Betrachtet man die Zahl der Ejakulationen insgesamt, so hätten diese einen schützenden Effekt, weil durch die häufige Bildung von Samenflüssigkeit krebserregende Substanzen aus der Prostata herausgeschwemmt werden. Auch würden die Prostatazellen auf diese Art zum Ausreifen angeregt, was sie für Karzinogene weniger anfällig machen könnte. Eine 2016 veröffentlichte Studie (Datenbasis über 30.000 Männer) zieht ebenfalls den Schluss, dass das Erkrankungsrisiko mit steigender Ejakulationsfrequenz sinkt. Die Autoren räumen aber auch ein, dass sexuell aktive Männer möglicherweise seltener zu Vorsorgeuntersuchungen gehen, so dass potentielle Erkrankungen in dieser Untersuchungsgruppe häufiger unentdeckt bleiben. Für ein gesenktes Erkrankungsrisiko werden verschiedene physiologische Gründe vorgeschlagen. So kann häufiges Ejakulieren die Funktion und Teilungsgeschwindigkeit der randständigen Epithelzellen beeinflussen, so dass eine frühe Tumorgenese behindert wird. ⓘ
Ein weiterer möglicher Risikofaktor ist Sonnenmangel. In Nordamerika und Europa besteht ein auffälliges Nord-Süd-Gefälle bei der Häufigkeit von Prostatakrebs, das sich derzeit nur durch die unterschiedliche Besonnung der männlichen Bevölkerung erklären lässt. Hierfür ist vermutlich Cholecalciferol (Vitamin D3) verantwortlich, das eine chemopräventive Wirkung hat. Der größte Teil des im Körper verfügbaren Cholecalciferols wird durch UV-B-Bestrahlung in der Haut gebildet. Ein Mangel an Vitamin D erhöht signifikant das Risiko für Prostatakrebs. Welche Blutspiegel von Calcidiol, bzw. welche UV-Dosis, optimal sind, ist allerdings noch unklar. Die „Sonnenmangel-Theorie“ ist mit Vorbehalt zu sehen, denn auf der anderen Seite ist wissenschaftlich bewiesen, dass zu viel Besonnung ein Risikofaktor für das Auftreten von Hautkrebs ist. Möglicherweise überwiegen aber die Vorteile der Besonnung. ⓘ
Ernährung
Der 2014 vom WCRF/CUP herausgegebene Bericht kam zu dem Schluss, dass im Gegensatz zur Ernährung die Körpermaße (Körpergröße, sowie Umfang an Körperfett) einen „überzeugenden Einfluss“ auf das Risiko haben, an Prostatakrebs zu erkranken. Die vom WCRF-CUP verwendeten Studien wurden 2016 in einer Metaanalyse untersucht. Hier kamen die Autoren aber zu dem Ergebnis, dass es für einen Zusammenhang zwischen Ernährung, Körpermaßen und körperlicher Aktivität auf das Prostatakrebsrisiko keinen überzeugenden Beweis gebe. Möglicherweise können diese Faktoren das Risiko zwar beeinflussen, große Effekte können aber nicht geschlussfolgert werden. ⓘ
Nach Auffassung des DKFZ-Krebsinformationsdienstes gibt es bislang keine „Diät gegen Prostatakrebs“. Vitamintabletten oder Mineralstoffe würden unter Umständen sogar schaden. Neuere Studien ließen allerdings erkennen, dass Übergewicht möglicherweise das Krankheitsrisiko steigert, zumindest das für eine fortgeschrittene, schwere Erkrankung. Übergewicht werde aber nicht nur durch das bestimmt, was man isst, sondern auch davon, wie viel Energie man verbraucht. ⓘ
2021 kam eine Studie mit rund 47.000 beteiligten Männern zu dem Schluss, dass eine gesunde pflanzenbasierte Ernährung bei jungen Männern das Gesamtrisiko und das Risiko für schweren Prostatakrebs reduzieren kann. ⓘ
Eine pflanzenbasierte Ernährung kann mit einem niedrigerem Risiko für Prostatakrebs einhergehen. Insbesondere bei veganer Ernährung zeigte sich ein konsistenter Zusammenhang mit einem reduzierten Risiko für Prostatakrebs. Für Männer unter 65 kann sich mit einer pflanzenbasierten Ernährung außerdem der Behandlungserfolg verbessern. ⓘ
Fleisch
Gegenstand vieler Kontroversen ist, ob sich das Risiko für das Prostatakarzinom mit dem Genuss von Fleisch, insbesondere rotem Fleisch, erhöht. Es liegen Daten von verschiedenen Fall-Kontroll- und Kohortenstudien Ende der 90er-Jahre vor, die man so schlussfolgern könnte, dass der Verzehr von rotem Fleisch zu einem um mindestens 30 % erhöhten Risiko führt, an Prostatakrebs zu erkranken. In einem ähnlichen Zeitraum wurde außerdem in einer prospektiven Studie an 51.529 Männern in Heilberufen gezeigt, dass sich das Risiko für das metastasierende Prostatakarzinom mit dem Verzehr von rotem Fleisch um 60 % erhöhe (relatives Risiko = 1,6 für das höchste Quintil, verglichen mit dem niedrigsten, 95 %-Konfidenzintervall = 1,0–2,5). Tierische Fette führten zu einem 1,63-fachen Risiko. Offenbar spielen hierbei auch die klassischen Karzinogene wie heterozyklische Amine (HMA) und polyzyklische aromatische Kohlenwasserstoffe (PAH), die beim Braten, Schmoren oder Grillen des Fleisches entstehen, eine Rolle. Hoher Fleischkonsum soll aber nicht nur das Risiko von Prostatakrebs erhöhen, sondern nachweislich auch von Brust- und Darmkrebs. Epidemiologische Zusammenhänge sind auch mit Nieren-, Lungen- und Bauchspeicheldrüsenkrebs nachgewiesen. In einer Kohortenstudie mit etwa 1000 Patienten wurde gezeigt, dass die Wahrscheinlichkeit eines Rezidivs bei bereits operierten Patienten sinkt, wenn sie ihre Ernährung von rotem Fleisch und Eiern auf Geflügel und Fisch umstellen. ⓘ
In späteren Analysen zeichnete sich ein nicht mehr so einheitliches Bild ab. Das World Cancer Research Fund (WCRF) gab 2007 einen Bericht zum Thema „Ernährung, körperliche Aktivität und Krebsprävention: Eine globale Perspektive“ heraus, die Datenlage für Prostatakrebs wurde hierbei zuletzt 2014 aktualisiert (im sogenannten Continuous Update Project, CUP). Hierbei kamen die Autoren über die damals verfügbare Datenlage zu dem Schluss, dass Aussagen über Erkrankungsrisiko und Verzehr an rotem und verarbeitetem Fleisch nur bestenfalls begrenzt zutreffen. Eine 2015 durchgeführte Metaanalyse hat dies bestätigt: Der Verzehr von (rotem) Fleisch führt nicht zu einem erhöhten Risiko, an Prostatakrebs zu erkranken. Auch die Hypothese, dass HMAs und die Art, das Fleisch bei hohen Temperaturen zu erhitzen, Risikofaktoren für Prostatakrebs darstellen, konnte in der Metaanalyse nicht gezeigt werden. Eine 2016 veröffentlichte Metaanalyse zeigte darüber hinaus, dass der erhöhte Verzehr von Geflügelfleisch das Erkrankungsrisiko für letalen Prostatakrebs geringfügig senkt, während ein erhöhter Konsum von Eiern dieses geringfügig erhöht. Außerdem konnte man nach Verzehr von Fisch keinen wesentlichen Effekt beobachten – unabhängig vom Grad oder von Stadium der Erkrankung. ⓘ
Milch
Der World Cancer Research Fund sieht nur eine beschränkte Evidenz dafür, das Milchprodukte Prostatakrebs verursachen. Die Evidenz reicht mit Stand 2018 nicht dafür aus, sich gegen einen Verzehr auszusprechen. ⓘ
Eine im Februar 2020 veröffentlichte Übersichtsarbeit von Walter C. Willett et al. sieht auf der Basis ausgewählter Beobachtungsstudien einen statistischen Zusammenhang von Milchkonsum und dem Auftreten von Prostatakrebs. ⓘ
Eine im Juli 2020 veröffentlichte systematische Übersichtsarbeit schätzt die bisherigen Forschungsergebnisse hingegen als „nicht schlüssig“ ein. Während die Mehrheit der ausgewerteten Studien den statistischen Zusammenhang nahelegen, zeige eine große schwedische Studie aus dem Jahr 2020 keinen Zusammenhang zwischen Milchkonsum und einem erhöhten Risiko für die Entwicklung von Prostatakrebs. Während einige der ausgewerteten Studien eine Korrelation zwischen einem erhöhten Risiko für Prostatakrebs und einem hohen Fettgehalt in der Milch fanden, deuteten andere darauf hin, dass die fettfreien Bestandteile der Milch mit dem höheren Risiko für Prostatakrebs verbunden sein könnten. Die Autoren verweisen darauf, dass Milch und Milchprodukte Bestandteile der westlichen Ernährung sind. Es sei daher möglich, dass das erhöhte Risiko für die Entwicklung von Prostatakrebs nicht insbesondere mit Milch und Milchprodukten zusammenhänge, sondern mit den insgesamt krebserzeugenden Wirkungen der westlichen Ernährung. Derzeit gäbe es keine formellen klinischen Empfehlungen zum Konsum von Milchprodukten für Patienten, bei denen das Risiko einer Prostatakrebsentwicklung besteht oder bei denen in der Vergangenheit Prostatakrebs aufgetreten ist. Ärzte könnten Patienten mit einem höheren Risiko für die Entwicklung von Prostatakrebs trotz der widersprüchlichen Forschungsergebnisse empfehlen, den Konsum von Milch oder Milchprodukten, insbesondere solchen mit hohem Fettgehalt, zu vermeiden oder zu reduzieren. Risiken, Nutzen und Grenzen eines solchen Ernährungsansatzes sollten mit dem Patienten besprochen werden. Wenn beschlossen wird, den Verzehr von Milchprodukten zu unterbinden oder zu begrenzen, sollte der Patient über geeignete Kalzium- und Vitamin D-Supplementierung informiert werden. ⓘ
Eine große epidemiologische Studie aus Japan aus dem Jahr 2021 untersuchte 26.464 Männer und den Zusammenhang von Milchprodukten und Prostatakrebs. Milchkonsum zeigte einen dosisabhängigen Effekt auf die Entstehung von Prostatakrebs, wobei das Risiko um 37 % erhöht war. Die Autoren kommen zu dem Schluss, dass ein hoher Konsum von Milchprodukten das Risiko für Prostatakrebs bei japanischen Männern erhöht. ⓘ
Soja
Mehrere Meta-Studien konnten bislang zeigen, dass der regelmäßige Konsum von Soja das Risiko, an Prostatakrebs zu erkranken, verringert. ⓘ
Eine Meta-Studie aus dem Jahr 2018, welche 30 Studien auswertete, stützt dieses Ergebnis. Für allgemeinen Soja-Konsum ergab sich eine Risikoreduktion um 29 %. Der Effekt scheint jedoch bei nicht-fermentierten Sojaprodukten (bspw. Sojamilch, Tofu, Sojabohnen) größer zu sein als bei fermentierten (bspw. Nattō oder Miso). So lag die berechnete Risikoreduktion für nicht-fermentierte Sojaprodukte bei 35 % und bei fermentierten bei 14 %. ⓘ
Calcium
Im Zusammenhang mit der chemopräventiven Wirkung von Vitamin D3 wurden auch mögliche negative Effekte hoher Calciumzufuhr betrachtet. Eine hohe Calciumzufuhr vermindert die körpereigene Cholecalciferol-Produktion. Bei vielen Studien wird ein Effekt von in Nahrungsmitteln enthaltenes Calcium (wie z. B. Milch oder Käse) auf die das Erkrankungsrisiko oder die Mortalität untersucht. Manche Studien weisen darauf hin, dass das Risiko an Prostatakrebs zu erkranken, erhöht ist. ⓘ
Phytotherapie
Ein Nutzen sogenannter Phytohormone aus Soja lässt sich nicht belegen, auch isoliert gegebene sekundäre Pflanzenstoffe zeigen keine Wirksamkeit. Fachgesellschaften warnen auch vor Beispielen in der Werbung, deren Wirksamkeit nicht belegt ist (z. B. Lycopin aus Tomaten). ⓘ
Gegenstand zahlreicher Studien ist Granatapfelsaft, dieser ist der am besten untersuchte Pflanzenstoff bei Prostatakrebs. So sollen die darin enthaltenen phytochemischen Pflanzenstoffe wirksam bei der Senkung des oxidativen Stresses und bei der Modulierung von Entzündungswegen sein. Zudem üben die enthaltenen Substanzen in Zellkultur einen inhibitorischen Effekt auf das Tumorwachstum aus. Im Mittelpunkt steht die Auswertung des PSA-Wertes (prostataspezifisches Antigen), das als zentraler Marker für einen möglichen Therapieerfolg gewertet wird. Die Ergebnisse zahlreicher Studien sind uneinheitlich, es fehlen verlässliche Überlebensdaten. Außerdem ist nicht bekannt, ob sich ein möglicher positiver Einfluss auf den PSA-Wert auf den Tumor auswirkt. Die Datenlage ist zu begrenzt, um Aussagen über eine mögliche Therapieform (als Ergänzung oder als Ersatz für die die klassische Therapieform) zu treffen. Ein pauschaler Gebrauch von Granatapfelprodukten bei Patienten mit Prostatakarzinom wird nicht empfohlen. Jedoch ist die Einnahme von Granatapfelsaft nebenwirkungsarm. ⓘ
Molekularbiologische Aspekte des Prostatakarzinoms
Wie allen Neoplasien liegt auch dem Prostatakarzinom letztlich die irreversible Veränderung des Erbgutes einer einzigen Zelle zugrunde. Alle Krebszellen sind Abkömmlinge (Klone) dieser Zelle. Verkomplizierend kommt hinzu, dass sich deren Erbgut weiter verändert, da die physiologischen Vorgänge, die DNA-Schäden reparieren oder mutierte normale Körperzellen absterben lassen würden (Apoptose), in Krebszellen nicht zum Tragen kommen. Mit der Zeit entwickelt sich daher ein Mosaik aus Zellen mit unterschiedlich stark verändertem Genom. Klinisch entspricht dem ein inhomogenes Erscheinungsbild des Tumors und ein zunehmendes „Bösartigerwerden“ über die Jahre. ⓘ
Anders als viele andere epitheliale Malignome hat das Prostatakarzinom keine typische Adenom-Karzinom-Sequenz und auch kein spezifisches Mutationsmuster. Stattdessen kommen sehr heterogene genomische Veränderungen in Form von Punktmutationen an verschiedenen Stellen, Verlusten von Allelen oder ganzen Chromosomen und bisweilen zusätzlich Polyploidie vor. Häufig sind jedoch in einem späteren (metastasierten) Stadium zumindest auch klassische Tumorsuppressorgene wie TP53 von Deletionen oder Mutationen betroffen. Eine wichtige Rolle scheinen Veränderungen des den Androgenrezeptor codierenden Gens zu spielen. Derzeit sind mindestens 17 genetisch verschiedene Zelllinien des Prostatakarzinoms bekannt. ⓘ
Symptomatik
In frühen Stadien ist Prostatakrebs nahezu immer symptomlos. Hauptbeschwerden ergeben sich beim fortgeschrittenen Karzinom aus der Blockade des Harnabflusses und bestehen somit in Störungen der Miktion (Urinieren). Möglich sind ein verzögerter Beginn, eine verlängerte Miktion mit schwachem Strahl, Nachtropfen oder die Unterbrechung des Harnstrahls während des Wasserlassens. Oft bleibt Restharn in der Blase zurück. Irritative Beschwerden sind vermehrter oder überwiegend nächtlich auftretender Harndrang (Nykturie), häufiges Lassen geringer Urinmengen (Pollakisurie), erschwertes Wasserlassen (Dysurie) oder Schmerzen beim Wasserlassen (Algurie). Durch Druckschädigung von Nerven des Kreuzbeinbereichs kann es zu Erektionsstörungen kommen. Sichtbares Blut im Urin (Hämaturie) oder Ejakulat (Hämatospermie) ist hingegen selten. ⓘ
Beschwerden können im fortgeschrittenen Stadium mit Metastasierung auch primär durch die Metastasen entstehen, während das Prostatakarzinom klinisch stumm bleibt (okkultes Karzinom). Am häufigsten sind hier Schmerzen der Wirbelsäule und des Beckens. Bei starker metastatischer Durchsetzung kann es zu spontanen Knochenbrüchen ohne Trauma, sogenannten pathologischen Frakturen, kommen. Da häufig die Wirbelsäule die erste Aussaatstrecke bildet, sind komplexe neurologische Ausfälle durch Rückenmarksverletzung wie Querschnittsyndrome oder das Cauda-equina-Syndrom nicht selten. Lymphknotenmetastasen können zu Lymphödemen der Beine oder des Hodensacks führen. Insgesamt stellen jedoch Knochenmetastasen für die meisten Patienten die vorherrschende Manifestation der Erkrankung dar und sind auch die hauptsächliche Ursache für die Morbidität und Mortalität des Prostatakarzinoms. ⓘ
Fortgeschritten metastasierte Tumoren führen in der Regel auch zu Allgemeinsymptomen wie Anämie und ungewolltem Gewichtsverlust. ⓘ
Diagnostik


Körperliche Untersuchung
Mit der digital-rektalen Untersuchung kann ein erfahrener Untersucher bereits die Verdachtsdiagnose stellen, da der Tastbefund typisch ist. Allerdings werden so die selteneren Tumoren der vorderen Organregionen unter Umständen übersehen und allgemein erst recht fortgeschrittene Stadien erkannt. ⓘ
Bildgebung
Ultraschall
Genauere Lokalisation und Größenbestimmung erlaubt die Ultraschalluntersuchung (transrektale Sonografie). Tumoren ab zehn Millimeter Durchmesser können damit zuverlässig gefunden werden, kleinere jedoch nur zu etwa 20 %. ⓘ
HistoScanning ist eine ultraschallbasierte, noch nicht abschließend evaluierte Methode, die jedoch auch wesentlich höhere Sensitivität und Spezifität als gewöhnlicher Ultraschall oder digital-rektale Untersuchungen verspricht. ⓘ
Magnetresonanztomographie
Seit 2011 wird die MRT zur Identifizierung von Zielen für die Prostatabiopsie eingesetzt, entweder durch Fusion der MRT mit Ultraschall (US) oder durch alleinige MRT-Führung. Mit einer MRT allein werden 91 % der Männer mit klinisch bedeutsamem Prostatakrebs korrekt identifiziert, aber 63 % der Männer mit einem Risiko für Prostatakrebs werden fälschlicherweise als Männer mit klinisch bedeutsamem Prostatakrebs eingestuft. Mit einer MRT-gesteuerten Biopsie werden 80 % der Männer mit Prostatakrebs korrekt identifiziert. Allerdings werden 6 % der Männer mit einem Risiko für Prostatakrebs als klinisch bedeutsam eingestuft. Die Entdeckung von klinisch unbedeutendem Krebs ist nachweislich geringer, wenn die MRT-gezielte Biopsie mit einer Standardbiopsie bei Männern mit positiven MRT-Ergebnissen kombiniert wird. ⓘ
Im Anschluss an eine MRT-Untersuchung werden interessante Regionen, bei denen es sich um Krebs handeln könnte, häufig auf einer Wahrscheinlichkeitsskala zwischen 1 und 5 eingestuft. Eine dieser Skalen ist die PI-RADS-Skala (Prostate Imaging Reporting and Data System), die Standards für klinische Dienstleistungen für die multiparametrische MRT (mpMRI) definiert, einschließlich der Erstellung von Bildern und Berichten. Das PI-RADS-Scoring Version 2 hat eine Spezifität und Sensitivität von 73 % bzw. 95 % für die Erkennung von Prostatakrebs ergeben. ⓘ
Wird eine MRT zur Entscheidung über eine Biopsie bei Männern herangezogen, bei denen bereits eine Biopsie durchgeführt wurde, ist die Wahrscheinlichkeit einer korrekten Diagnose um 5 % höher als bei einer Standardbiopsie und um 12 % höher bei Männern, bei denen bereits eine Biopsie durchgeführt wurde oder nicht. Bei Männern, die eine negative Biopsie hatten, führt diese Kombination mit 44 % höherer Wahrscheinlichkeit zu einer korrekten Diagnose. ⓘ
Die Magnetresonanztomographie hat sich dem transrektalen Ultraschall als etwa gleichwertig erwiesen, ist jedoch wesentlich aufwändiger und kostenintensiver in der Durchführung. Der Primärtumor stellt sich in T2-Gewichtung in der MRT als umschriebene dunkle Region mit relativ heller Umgebungszone dar. ⓘ
Moderne multi-parametrische MRT-Untersuchungen mit Endorektalspule, Diffusion (ADC) oder DTI, Perfusion (DCE) und 1H-Spektroskopie haben eine Sensitivität von gemittelt 86 % und einer Spezifität von 94 %. Negativer Vorhersagewert ist 95 %. Durch die schnell vorangehende Entwicklung der MRT-Technologie sind die Zahlen je nach eingesetzter Technik und Wissensstand des Radiologen potentiell noch deutlich höher. Das multi-parametrische MRT ist somit sehr mächtig und gesundheitlich unbedenklich, jedoch recht aufwändig. ⓘ
Positronen-Emissions-Tomographie
Außerdem etabliert sich immer mehr die Positronen-Emissions-Tomographie (PET) mit 18F-Cholin (radioaktiv markierter Tracer). Vor allem mittels 18F-Cholin-PET/CT kann zuverlässig Prostatakrebs-Gewebe von benigner Hyperplasie, chronischer Prostatitis und gesundem Prostatagewebe differenziert werden. ⓘ
Labordiagnostik
Etablierte Verfahren
Ein oft genutzter Laborparameter in der Prostatakrebsdiagnostik ist das prostataspezifische Antigen (PSA). Es ist spezifisch für die Prostata, allerdings nicht für ein Tumorleiden, sondern kann auch bei Entzündungen zum Beispiel bei einem Harnwegsinfekt, gutartiger Prostatavergrößerung, einem Harnverhalt oder aber auch, teils für mehrere Tage, nach jeder mechanischen Beanspruchung im Beckenbereich, etwa durch Sport, v. a. Fahrradfahren, Sex oder medizinische Maßnahmen, wie digitale-rektale Untersuchung (DRU), transrektale Prostatasonographie, oder Blasenkatheter, erhöht sein. Ein Wert über 4 ng/ml gilt als abklärungsbedürftig. Eine Differenzierung, wenn eine infektiöse Ursache (Prostatitis, Harnwegsinfekt) ausgeschlossen wurde, erlaubt die Bestimmung des komplexierten und freien Anteils des PSA. Liegt der Anteil des freien PSA unter 10 %, ist ein Prostatakarzinom wahrscheinlich, ein Anteil von 10–20 % gilt als Graubereich, bei mehr als 20 % kann man von einer gutartigen Veränderung ausgehen. In der Tumornachsorge nach operativer oder Strahlentherapie ist das PSA der entscheidende Parameter. Dieselbe Bedeutung kommt ihm in der Verlaufskontrolle einer antiandrogenen Behandlung (Hormontherapie) zu. ⓘ
Die prostataspezifische saure Phosphatase (PAP) hat heute nur noch untergeordnete Bedeutung. ⓘ
Nicht etablierte Verfahren
Des Weiteren stehen eine Protein-Muster-Diagnostik und der PCA3-Test zur Verfügung, als Material wird Urin verwendet. Beide Verfahren sind nicht etabliert, die Kosten werden in Deutschland üblicherweise von den gesetzlichen Krankenkassen nicht übernommen. ⓘ
Histologie

Besteht der Verdacht auf Krebs, wird rasch eine Biopsie durchgeführt. Bei einer Biopsie entnimmt ein Urologe oder Radiologe entweder über den Enddarm oder den Damm Gewebeproben aus der Prostata. Mit einer Biopsiepistole werden spezielle Hohlnadeln (in der Regel drei bis sechs auf jeder Seite der Prostata) in weniger als einer Sekunde eingeführt und entfernt. Prostatabiopsien werden routinemäßig ambulant durchgeführt und erfordern nur selten einen Krankenhausaufenthalt. Durch systematische Biopsien werden 63 % der Männer mit klinisch relevantem Prostatakrebs korrekt identifiziert, der Rest wird jedoch übersehen. Bei Männern mit Prostatakrebsrisiko wird die Biopsie keinen der Männer fälschlicherweise als klinisch signifikanten Prostatakrebs einstufen. ⓘ
Zur Vorbeugung von Komplikationen wie Fieber, Harnwegsinfektionen und Sepsis sollten Antibiotika eingesetzt werden, auch wenn die am besten geeignete Behandlung oder Dosis nicht bekannt ist. Etwa 55 % der Männer geben an, dass sie sich während der Prostatabiopsie unwohl fühlen. ⓘ
Der Aussagewert dieser sogenannten Systematischen Biopsie ist jedoch sehr gering. Selbst bei einer Probenanzahl von 12 werden nur etwa 25-50 % der tatsächlichen Krebsfälle entdeckt. Auch eine Erhöhung der Probenanzahl auf 24 erhöht die Rate nur unwesentlich. Zusätzlich ist das Risiko einer falschen Klassifizierung der Gefährlichkeit eines festgestellten Krebsbefalls mit ca. 20-50 % beträchtlich. ⓘ
Diagnostik zur Stadienbestimmung bei nachgewiesener Erkrankung
Falls sich die Diagnose „Prostatakrebs“ bestätigt, ist eine Stadienbestimmung, das sogenannte Staging, erforderlich. Hier wird festgestellt, ob der Tumor bereits ausgestreut hat oder ob es sich um ein auf die Prostata begrenztes Karzinom handelt. ⓘ
Zu den erforderlichen Untersuchungen gehört eine Ultraschalluntersuchung der Organe des Bauchraumes, insbesondere der Leber, der Nieren und Lymphknoten, sowie eine Röntgenuntersuchung der Lunge. Eine Skelettszintigrafie wird zum Ausschluss von Knochenmetastasen in Abhängigkeit vom PSA-Wert durchgeführt. Zusätzlich können noch eine Computertomographie von Bauch und Lunge sowie eine Ausscheidungsurografie der Nieren mit Kontrastmittel zur Beurteilung des Harnleiterverlaufes und eine Blasenspiegelung erfolgen. ⓘ
Zur exakten Beurteilung eines organüberschreitenden Wachstums (Stadium T3) bei stanzbioptisch gesichertem Prostatakarzinom hat sich bisher kein bildgebendes Verfahren (CT, MRT mit Endorektalspule, transrektale Ultraschalluntersuchung) etablieren können. ⓘ
Pathologie und Histopathologie
Stanzbiopsien und Operationspräparate werden von einem Pathologen untersucht. ⓘ
Makroskopische Pathologie

Makroskopisch (mit bloßem Auge) erscheint das Karzinom meist gelb oder weißlich, relativ homogen und unscharf begrenzt. Mehrheitlich geht es von den Epithelien der peripheren Drüsenanteile aus, zu etwa 85 % in den hinteren (rektalen) Anteilen der Vorsteherdrüse und breitet sich in den äußeren Zonen des Organs aus. Zur Verlegung der Harnröhre mit Beschwerden des Harnlassens kommt es daher erst spät, meist nachdem die Organkapsel schon durchbrochen wurde. ⓘ
Ausgedehnte Karzinome der Stadien T3/T4 können die Samenblasen, die Harnblase, den Beckenboden oder das Rektum infiltrieren. Die Metastasierung ist zunächst lymphogen (über die Lymphbahnen) in die ortständigen Lymphknoten. Häufig erfolgt später eine hämatogene Aussaat (über die Blutbahn). Typisch sind Knochenmetastasen in Becken, Kreuzbein und Lendenwirbelsäule, Oberschenkelknochen, Brustwirbelsäule und Rippen. So ist bei 80 % bis 90 % der Patienten mit einem metastasierenden Prostatakarzinom das Achsenskelett (Wirbelsäule, Becken und Strukturen, die am Rumpf oder nahe am Rumpf gelegen sind) betroffen. Diese sind fast immer osteoblastisch (knochenbildend). Fernmetastasen in Lunge und Leber durch hämatogene Aussaat (über den Blutkreislauf) sind seltener. ⓘ
Mikroskopische Pathologie
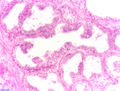
97 % aller Prostatatumoren sind Adenokarzinome, das heißt, sie entstehen aus entarteten Drüsenzellen. Ein Übergangsstadium zum manifesten Krebs wird als prostatische intraepitheliale Neoplasie (PIN) bezeichnet und entspricht einem Carcinoma in situ. Beim eigentlichen Karzinom kommen verschiedene histopathologische Wachstumsmuster vor, auch gleichzeitig nebeneinander: glandulär beziehungsweise azinär (drüsenartig), kribriform (siebartig) und solide. Das Ausmaß der Entdifferenzierung ist Grundlage des Gradings. 40–50 % der Tumoren liegen bei Diagnosestellung multifokal vor. ⓘ
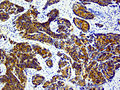
Knochen- und Weichteilmetastase eines Prostatakarzinoms mit immunhistochemischem Nachweis einer PSA-Expression (braun) ⓘ
Die Nicht-Adenokarzinome (weniger als drei Prozent) sind meist urothelialer Herkunft, leiten sich also aus dem Übergangsgewebe der Harnröhre oder -blase ab (siehe Blasenkrebs). Äußerst selten sind Sarkome (Leiomyosarkom, Fibrosarkom, Rhabdomyosarkom) des Stromas beim Erwachsenen. Bei Kindern sind Rhabdomyosarkome die häufigste Form des Prostatakrebses, werden aber nicht wie bei erwachsenen Patienten als Prostatakarzinom aufgefasst, sondern als Weichteilsarkom. ⓘ


Eine histopathologische Diagnose umfasst vor allem die Beurteilung, ob ein Krebs vorliegt, sowie, falls möglich, eine Subdiagnose. Die histopathologische Subdiagnose hat Auswirkungen auf die Möglichkeit und Methodik der Gleason-Bewertung. Die häufigste histopathologische Nebendiagnose ist das azinäre Adenokarzinom, das 93 % der Diagnosen ausmacht. Die häufigste Form des azinären Adenokarzinoms wiederum ist das "Adenokarzinom, nicht anderweitig spezifiziert", das auch als konventionelles oder gewöhnliches azinäres Adenokarzinom bezeichnet wird. ⓘ
Tumorgrad und Gleason-Score
Bei der mikroskopischen Untersuchung des entnommenen Gewebes werden die biologischen Eigenschaften des Tumors genauer bestimmt und seine Bösartigkeit ermittelt. So beschreibt ein besonderes Einordnungsschema (G: Histopathologisches Grading), wie stark sich die Tumorzellen mikroskopisch von normalen, „ausgereiften“ Zellen unterscheiden. ⓘ
Zum Grading des Prostatakarzinoms wird entsprechend der S3-Leitlinien zur Früherkennung, Diagnose und Therapie des Prostatakarzinoms der Gleason-Score verwendet. Dabei wird nach dem histologischen Bild in der Stanzbiopsie das am schlechtesten differenzierte und das am häufigsten vorkommende Tumorgewebe mit Punktwerten zwischen 1 und 5 (zusammen also zwischen 2 und 10) bewertet und addiert. Bei einer bereits erfolgten Operation wird der häufigste und der am zweithäufigsten vorkommende Gleason-Grad in der gesamten Prostata addiert. Die beiden addierten Gleason-Grade müssen in der richtigen Reihenfolge und in der Stanzbiopsie in Prozent (des Gesamttumors und des gesamten gewonnenen Gewebes) angegeben werden. Ein Gleason-Score 3+4 stellt einen besser differenzierten Grad dar, als Gleason-Score 4+3, obwohl die Summe gleich ist. Ihre Summe wird in der Stanzbiopsie demnach anders interpretiert als im Operationspräparat. Eine Besonderheit ist, dass die Gleason-Grade 1 und 2 in der Stanzbiopsie nicht diagnostiziert werden können. ⓘ
Der Gleason-Score ist neben der Tumorgröße, dem Vorliegen von Lymphknoten- und Fernmetastasen (TNM-Klassifikation) ein wichtiger Prognosefaktor. Manchmal können zusätzliche Informationen zum Grading (z. B. DNA-Zytometrie) hilfreich sein. Ein Gleason-Score kann nur bei Vorliegen eines nicht vorbehandelten Adenokarzinoms der Prostata erstellt werden, für Urothelkarzinome und neuroendokrine Tumoren wird ein anderes Grading-System benutzt. ⓘ
DNA-Zytometrie
Bei niedrigem Gleason-Grad kann die als Biopsie entnommene Probe zusätzlich auf den so genannten Ploidiegrad untersucht werden. Dieses Verfahren wird DNA-Zytometrie genannt und von einzelnen urologischen Chefärzten an Kliniken wie auch Pathologen eingesetzt. Sie kann im Falle eines niedrigen Malignitätsgrades des Karzinoms weitere Hinweise auf die Aggressivität der Tumorzellen geben und so als Hilfe zur Therapieentscheidung Anwendung finden. ⓘ
Tumorstadien
Manifestationsstadien
Man unterscheidet nach Mostofi folgende Manifestationsstadien:
| Manifestationsstadium | Beschreibung |
|---|---|
| Manifestes Karzinom | Der Primärtumor verursacht Symptome oder ist klinisch diagnostizierbar (palpabel). |
| Okkultes Karzinom | Die Metastasen werden symptomatisch oder klinisch diagnostizierbar, nicht aber der Primärtumor. |
| Inzidentielles Karzinom | Zufallsbefund bei der Untersuchung oder Operation unter anderer Fragestellung. |
| Latentes Karzinom | Zufälliger Obduktionsbefund bei einem aus anderer Ursache Verstorbenen. |
Staging (TNM-System)

Ein wichtiger Teil der Beurteilung von Prostatakrebs ist die Bestimmung des Stadiums bzw. des Ausbreitungsgrads. Die Kenntnis des Stadiums hilft bei der Bestimmung der Prognose und ist bei der Auswahl von Therapien hilfreich. Das gängigste System ist das vierstufige TNM-System (abgekürzt aus Tumor/Knoten/Metastasen). Zu seinen Bestandteilen gehören die Größe des Tumors, die Anzahl der befallenen Lymphknoten und das Vorhandensein anderer Metastasen. ⓘ
Die wichtigste Unterscheidung, die jedes Staging-System trifft, ist die Frage, ob der Krebs auf die Prostata beschränkt ist. Im TNM-System finden sich klinische T1- und T2-Karzinome nur in der Prostata, während T3- und T4-Karzinome bereits Metastasen gebildet haben. Es gibt verschiedene Tests, mit denen man nach Anzeichen für eine Ausbreitung suchen kann. Medizinische Fachverbände raten von PET-Scans, CT-Scans oder Knochenscans ab, wenn ein Arzt ein frühes Prostatakarzinom mit geringem Metastasierungsrisiko feststellt. Diese Untersuchungen sind dann angebracht, wenn eine CT-Untersuchung eine Ausbreitung im Becken, eine Knochenszintigraphie eine Ausbreitung in den Knochen und eine endorektale Magnetresonanztomographie eine Ausbreitung in der Prostatakapsel und den Samenblasen zeigt. Knochenscans sollten ein osteoblastisches Erscheinungsbild aufgrund einer erhöhten Knochendichte in den Bereichen der Knochenmetastasen zeigen - das Gegenteil von dem, was bei vielen anderen metastasierenden Krebsarten zu finden ist. Zugelassene radiopharmazeutische Diagnostika für die PET: Fluciclovin (2016), Ga 68 PSMA-11 (2020), Piflufolastat (2021). ⓘ
Nach einer Biopsie untersucht ein Pathologe die Proben unter einem Mikroskop. Wenn Krebs vorhanden ist, gibt der Pathologe den Grad des Tumors an. Der Grad gibt an, wie sehr sich das Tumorgewebe von normalem Prostatagewebe unterscheidet und wie schnell der Tumor wahrscheinlich wachsen wird. Der Pathologe vergibt eine Gleason-Zahl von 1 bis 5 für das am häufigsten unter dem Mikroskop beobachtete Muster und dann die gleiche Zahl für das zweithäufigste Muster. Die Summe dieser beiden Zahlen ist der Gleason-Score. Das Whitmore-Jewett-Stadium ist eine weitere Methode. ⓘ
Bei Männern mit lokal begrenztem Hochrisiko-Prostatakrebs kann ein Staging mit PSMA-PET/CT sinnvoll sein, um Knoten oder Fernmetastasen zu erkennen. Im Jahr 2020 wurde in einer randomisierten Phase-3-Studie Gallium-68-PSMA-PET/CT mit der Standardbildgebung (CT und Knochenscan) verglichen. Sie ergab eine höhere Genauigkeit der Gallium-68-PSMA-11-PET/CT (92 % gegenüber 65 %), eine höhere signifikante Änderung der Behandlung (28 % gegenüber 15 %), weniger zweideutige/unsichere Bildgebungsergebnisse (7 % gegenüber 23 %) und eine geringere Strahlenbelastung (10 msV gegenüber 19 mSv). Die Studie kam zu dem Schluss, dass die PSMA-PET/CT ein geeigneter Ersatz für die konventionelle Bildgebung ist. ⓘ
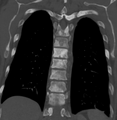
Sklerose der Beckenknochen aufgrund von Prostatakrebsmetastasen ⓘ
Bei der Beurteilung des Tumorstadiums nach dem TNM-System werden Größe und örtliche Ausdehnung des Prostatatumors (T), Lymphknotenbefall (N, von engl. node ‚Knoten‘) und Metastasen (M) berücksichtigt. Die Ziffern hinter den Buchstaben stehen für Größe und Ausdehnung des Primärtumors (T1-T4), das Vorliegen von befallenen Lymphknoten (N0-N1) sowie das Vorhandensein und die Verteilung von Fernmetastasen (M0-M1c). Ein recht guter Prädiktor für die Entdifferenzierung, die lokale Invasion der Nachbarorgane und die Wahrscheinlichkeit der Fernmetastasierung ist auch die Tumorgröße. Die „Schwelle der Kurabilität“, also die Größe des Tumors, bis zu welcher man eine Behandlung mit der Zielsetzung der Heilung (kurative Behandlung) als möglich erachtet, wird bei 4 cm³ angesetzt. Ist diese Schwelle überschritten, so ist eine Heilung in der Regel nicht mehr möglich. Jedoch können durchaus auch kleinere Tumoren bereits metastasiert sein und sich somit einer kurativen Behandlung entziehen. ⓘ
| Stadium | Beschreibung |
|---|---|
| Tx | Es kann keine Aussage zur Ausdehnung des Primärtumors getroffen werden. |
| T1 | Der Tumor ist klein und nicht tastbar. Er wird zufällig im Rahmen einer Prostataoperation wegen BPH oder erhöhter PSA-Werte gefunden (Inzidentaltumor). |
| T1a | Der Tumor befällt weniger als 5 % des Gewebes. |
| T1b | Der Tumor befällt mehr als 5 % des Gewebes. |
| T1c | Der Tumor wurde durch eine Nadelbiopsie diagnostiziert. |
| T2 | Der Tumor liegt noch innerhalb der Prostatakapsel. |
| T2a | Der Tumor befällt weniger als 50 % eines Seitenlappens. |
| T2b | Der Tumor befällt mehr als 50 % eines Seitenlappens. |
| T2c | Der Tumor befällt beide Seitenlappen. |
| T3 | Der Tumor hat sich über die Prostatakapsel hinaus ausgebreitet. |
| T3a | Der Tumor hat sich über die Prostatakapsel ausgebreitet, ohne die Samenblasen zu befallen. |
| T3b | Der Tumor hat sich über die Prostatakapsel ausgebreitet und befällt die Samenblasen. |
| T4 | Der Tumor hat Nachbarstrukturen befallen (infiltriert) oder ist fixiert (unverschieblich). |
| Nx | Es kann keine Aussage zu regionären Lymphknotenmetastasen getroffen werden. |
| N0 | Keine Metastasen in den regionären Lymphknoten. |
| N1 | Metastasen in den regionären Lymphknoten. |
| M0 | Keine Fernmetastasen nachweisbar. |
| M1 | Der Tumor hat Fernmetastasen gebildet. |
| M1a | Metastasen in anderen Lymphknoten (nicht regionäre Lymphknoten). |
| M1b | Metastasen in den Knochen. |
| M1c | Metastasen in anderen Organen und/oder Strukturen. |
An der Einordnung in das TNM-Schema orientiert sich die Behandlung. Auch die Prognose kann unter Hinzuziehung weiterer Parameter abgeschätzt werden. ⓘ
Ein anderes Schema der Stadieneinteilung ist das nach Whitmore-Jewett (modifiziert nach Hopkins). Hier werden die Grade A (mikroskopisches Karzinom, praktisch immer inzidentiell – entspricht T1), B (makroskopisch, auf die Prostata begrenzt – entspricht T2); C (organüberschreitend, auf das kleine Becken begrenzt – entspricht T3/4M0) und D (mit Fernmetastasen – entspricht T1-4M1) unterschieden. Dieses Schema wird im angloamerikanischen Raum bevorzugt, ist aber in Deutschland nicht üblich. ⓘ
Prognosefaktoren
Wichtigste Faktoren für die Einschätzung der Prognose sind das Tumorstadium nach TNM, der PSA-Blutwert und die Differenzierung des Tumors, der Gleason-Score. ⓘ
Therapie
Die beiden wichtigsten Komplikationen nach einer Prostatektomie und einer Prostatastrahlentherapie sind Erektionsstörungen und Harninkontinenz, vor allem Stressinkontinenz. Die meisten Männer erlangen ihre Kontinenz innerhalb von 6 bis 12 Monaten nach der Operation wieder, so dass die Ärzte in der Regel mindestens ein Jahr warten, bevor sie invasive Behandlungen durchführen. ⓘ
Stressharninkontinenz tritt in der Regel nach einer Prostataoperation oder einer Strahlentherapie auf, unter anderem aufgrund einer Schädigung des Harnröhrenschließmuskels oder des umliegenden Gewebes und der Nerven. Die Prostata umgibt die Harnröhre, einen muskulösen Schlauch, der die Harnblase verschließt. Jeder der genannten Gründe kann zu einem inkompetenten Verschluss der Harnröhre und damit zu Inkontinenz führen. Die Erstbehandlung umfasst Blasentraining, Änderungen der Lebensweise, Kegelübungen und die Verwendung von Inkontinenzeinlagen. Zu den invasiveren chirurgischen Behandlungen gehört das Einsetzen einer Harnröhrenschlinge oder eines künstlichen Harnröhrenschließmuskels. Dabei handelt es sich um eine mechanische Vorrichtung, die die Funktion des Harnröhrenschließmuskels nachahmt und vom Patienten manuell über einen in den Hodensack implantierten Schalter aktiviert wird. Letzteres gilt als Goldstandard bei Patienten mit mittelschwerer oder schwerer Belastungsharninkontinenz. ⓘ
Erektionsstörungen treten in unterschiedlichem Ausmaß bei fast allen Männern auf, die sich einer Prostatakrebsbehandlung, einschließlich Strahlentherapie oder Operation, unterziehen; innerhalb eines Jahres stellen die meisten von ihnen jedoch eine Verbesserung fest. Wenn die Nerven geschädigt wurden, ist dieser Fortschritt möglicherweise nicht zu verzeichnen. Die pharmakologische Behandlung umfasst PDE-5-Hemmer wie Viagra oder Cialis oder intrakavernös injizierbare Medikamente, die direkt in den Penis gespritzt werden (Prostaglandin E1 und vasoaktive Arzneimittelmischungen). Zu den anderen nicht-pharmakologischen Therapien gehören Vakuumverengungsgeräte und Penisimplantate. ⓘ
Aktive Überwachung, Strahlentherapie oder Operation: Ergebnisse der britischen ProtecT-Studie
Bis vor Kurzem war nicht eindeutig geklärt, ob Operation oder Strahlentherapie als gleichwertig anzusehen sind; es gab keinen direkten Vergleich beider Therapieverfahren. Ferner war unklar, ob eine Behandlung (egal welche) einen Vorteil gegenüber der aktiven Überwachung erbringt. Die in Deutschland zu dieser Frage durchgeführte PREFERE-Studie wurde im Herbst 2016 geschlossen. Fast zeitgleich wurde aber eine britische Studie veröffentlicht (sog. ProtecT-Studie), in der drei Methoden miteinander verglichen wurden, nämlich aktive Überwachung, Operation und Strahlentherapie (Bestrahlung von außen mit Linearbeschleuniger, kombiniert mit sechsmonatiger antihormoneller Therapie). ⓘ
Wichtige Ergebnisse der ProtecT-Studie sind:
- Aktive Überwachung ist möglich. Es gibt in den ersten zehn Jahren nach Diagnose keine erhöhte Todesrate.
- Allerdings traten bei Patienten, die zunächst nur überwacht und nicht sofort behandelt wurden, vermehrt Metastasen auf. Da dies längerfristig nachteilig ist, sollte man eine Therapie bei jüngeren Patienten und/oder bei Tumoren mit Risikokonstellation prüfen.
- In der Patientengruppe, die zunächst nur aktiv überwacht wurde, musste man innerhalb von zehn Jahren dann doch die Hälfte der Patienten mit Bestrahlung oder Operation behandeln, weil die Krebserkrankung messbar vorangeschritten war. Bei aktiver Überwachung gilt also bezüglich einer weiteren Behandlung: aufgeschoben, aber nicht endgültig aufgehoben.
- Ein wichtiges Ergebnis betrifft den Vergleich von Operation und Strahlentherapie. Beide Verfahren waren hinsichtlich der Beherrschung der Tumorerkrankung gleich gut (im Trend war die Bestrahlung sogar etwas besser). Beide Therapieverfahren wurden gut vertragen; die Nebenwirkungen waren bei Strahlentherapie aber deutlich geringer als bei Operation, obwohl die Bestrahlung noch nicht mit heute üblichen präziseren Bestrahlungstechniken durchgeführt wurde. ⓘ
Die beiden Originalpublikationen der Studie, eine Zusammenfassung der österreichischen Cochrane, ein Kommentar aus dem New England Journal of Medicine sowie eine Pressemitteilung der Deutschen Gesellschaft für Radioonkologie sind frei verfügbar. Die Aussagen gelten nur für Patienten mit den entsprechenden Kriterien, insbesondere einem Tumor mit weniger aggressiver Einstufung. ⓘ
Weitere Ergebnisse zur Frage, welche Behandlungsmethode die besten Erfolgsaussichten bietet, stammen aus der 2012 publizierten sogenannten „Grimm-Studie“. In dieser Metaanalyse wurden anhand der Daten von ca. 52.000 Patienten mit lokalisiertem Prostatakarzinom 11 Methoden (operative Verfahren, Bestrahlungsmethoden, HiFu usw.) untersucht und verglichen. Die besten Ergebnisse bei allen drei Risikogruppen lieferte stets ein Bestrahlungsverfahren. Den ausgeprägtesten Vorteil in Bezug auf die langjährige Tumorkontrolle zeigte die Bestrahlung im Vergleich zur Operation bei Patienten mit Hochrisiko-Prostatakrebs. ⓘ
Operation
Bei lokal begrenztem Prostatakarzinom (T1/2) und guter Konstitution ist die radikale (vollständige) Operation der Prostata, bei der Prostata, Samenbläschen und die regionalen Lymphknoten entfernt werden, die klassische Methode. Diese so genannte „radikale Prostatektomie“ (RPE) kann auf vier unterschiedliche Arten durchgeführt werden:
- als retropubische radikale Prostatektomie (RRP)
- als radikale perineale Prostatektomie (RPP) durch Schnitt am Damm (zwischen After und Hodensack)
- minimalinvasiv – laparoskopisch
- roboterassistiert (RARP) ⓘ
RRP wird vom Bauch aus durchgeführt, RPP wird extraperitoneal, also ohne Eröffnung der Bauchhöhle, ausgeführt. Die RPP ist weniger zeitaufwändig und mit geringeren Blutungen verbunden als die RRP, aber der Zugang ist relativ schmal. Ein Nachteil ist die fehlende Entfernung der Beckenlymphknoten bei der RPP, so dass ein zweiter Eingriff mittels laparoskopischer pelviner (auf das Becken bezogener) Lymphadenektomie manchmal notwendig ist. Einzelne Zentren haben Techniken publiziert, welche die Lymphknotenentfernung ermöglichen. ⓘ
Bei der minimalinvasiven Methode wird mittels Bauchspiegelungstechnik über einige kleine Schnitte die Prostata operiert. Vorteil im Vergleich zur „offenen“ Operation ist hier vor allem der zumeist geringere Blutverlust und die kleinen Wunden. ⓘ
Eine Weiterentwicklung der „minimalinvasiven“ Technik ist die roboterassistierte Prostatektomie. Hier wird mit Hilfe eines Operationsroboters die laparoskopische Technik durchgeführt. Der Roboter wird dabei vom Operateur mittels einer speziellen Konsole fernbedient und führt keine eigenständigen Bewegungen aus. Vorteil für den Operateur gegenüber der Standard-Laparoskopie ist hierbei die nahezu uneingeschränkte Beweglichkeit der Instrumente, die hervorragende Sicht (dreidimensional über ein Doppel-Optik-System) und die Feinheit der Bewegung, da der Roboter etwa das natürliche Zittern der Hand ausgleicht. Nachteil der Robotertechnik gegenüber der „Standard-Laparoskopie“ sind die vergleichsweise hohen Anschaffungs- und Unterhaltskosten für das Krankenhaus, so dass in Deutschland bisher nur wenige Zentren auf diese Technik zurückgreifen können, bei einigen Abteilungen wird eine private Zuzahlung zur Deckung der Materialkosten verlangt, da die Krankenkassen diese derzeit nicht übernehmen. Eine Verbesserung der Operationsergebnisse durch die Robotertechnik konnte bisher wissenschaftlich nicht belegt werden. ⓘ
Gelingt es bei der Operation, den Tumor vollständig zu entfernen, ist eine Heilung möglich, und die Prognose für ein Langzeitüberleben (fünf Jahre oder mehr) liegt zwischen 80 und 90 Prozent. Gemäß der weltweit größten urologischen Studie (52.000 Patienten) zur Behandlung des lokalisierten Prostatakrebses ist die Operation bei Patienten mit geringem oder mittlerem Risiko der Bestrahlung nach fünf Jahren im Ergebnis geringgradig unterlegen. Den größten Vorteil zeigte die Bestrahlung im Vergleich zur Operation insbesondere bei Patienten, die ein hohes Risiko haben, Metastasen zu entwickeln. ⓘ
Das Risiko, an der Operation oder ihren Folgen zu versterben, beträgt etwa 1,5 Prozent. Ein relevantes Risiko der Operation ist in erster Linie die Gefahr der langfristigen Harninkontinenz und beträgt je nach Studie zwischen 2 und 40 Prozent. So benötigten etwa in einer britischen Studie aus dem Jahr 2006 27,8 % der Patienten täglich bis zu eine Einlage. Zum Verlust der Erektionsfähigkeit (erektile Dysfunktion) in Folge einer Verletzung der Nervi cavernosi (Äste der parasympathischen Beckeninnervation) kommt es in etwa 80 % der Fälle. Ein trockener Orgasmus ist meist weiterhin möglich, eine Studie zeigt, dass 71 % der operierten Männer orgasmusfähig waren. Verletzungen des Nervus obturatorius, die im Rahmen der Lymphknotenentfernung auftreten können, oder des Rektums sind selten. In fünf bis 20 Prozent der Fälle kommt es, bedingt durch die Lymphknotenentfernung, zu einer Lymphozele. Als Spätfolge tritt in etwa 32 % der Fälle eine Verengung der Verbindungsstelle zwischen Harnröhre und Blase (Anastomose) auf, die so genannte Anastomosenstriktur. ⓘ
Etliche Zentren bieten eine „nerverhaltende“ Operationsmethode (nach Patrick Craig Walsh) an, bei der die kavernösen Nerven, die in unmittelbarer Lagebeziehung zur Prostata verlaufen, geschont werden. Das Risiko der postoperativen erektilen Dysfunktion kann damit auf zehn Prozent (bei jungen Patienten), bis 50 % (bei älteren Patienten) gesenkt werden, der Erfolg ist aber signifikant von der Erfahrung des Operateurs abhängig. Zudem birgt die Technik das Risiko einer zu wenig radikalen Ausräumung des Tumors. Es erhöht sich damit das langfristige Risiko eines Lokalrezidives. ⓘ
Die Art der angewandten Operationsmethode scheint keinen signifikanten Einfluss auf die onkologischen Ergebnisse (Überlebensrate, rezidivfreies Überleben etc.) des Eingriffs zu haben, vielmehr scheint die jeweilige Erfahrung des einzelnen Operateurs ausschlaggebend zu sein. ⓘ
Strahlentherapie (Radiatio)

Eine gleichwertige und nebenwirkungsärmere Alternative zur Operation ist bei lokal begrenztem Prostatakarzinom mit niedrigen und mittleren Risikofaktoren (siehe Prognosefaktoren) die alleinige Strahlentherapie. In einer Vergleichsstudie wurden über 1600 Patienten entweder mit radikaler Operation, perkutaner Strahlentherapie oder einer abwartenden Strategie behandelt. Nach einer Nachbeobachtungszeit von zehn Jahren ergab sich kein Vorteil einer Methode bezüglich des krebsspezifischen Überlebens, also der Wahrscheinlichkeit, am Prostatakrebs zu versterben. In der Behandlungsgruppe mit abwartender Strategie zeigte sich eine Verdopplung der Wahrscheinlichkeit des Auftretens von Fernabsiedlungen (Metastasen). Hinsichtlich der für Patienten wichtigsten Nebenwirkungen Inkontinenz und sexueller Funktion (Potenz) resultierte die Prostataoperation häufiger in einer signifikanten Verschlechterung beider Funktionen. Die Strahlentherapie zeigte signifikant häufiger Darmnebenwirkungen. Bezüglich der Lebensqualität ergaben sich keine Unterschiede zwischen den Gruppen. ⓘ
Die Strahlentherapie ist für verschiedene Gruppen von Patienten anwendbar, etwa nach Wiederauftreten eines operierten Tumors, bei metastasierten Tumoren oder auch als Konkurrenzmethode zur Operation. Sie erfolgt entweder von außen (perkutane Strahlentherapie) oder durch „Spickung“ (Brachytherapie) (von griechisch brachýs = nah) der Prostata mit radioaktivem Material. Die perkutane Bestrahlung wird mittels Linearbeschleuniger durchgeführt. Bei der Brachytherapie unterscheidet man zwischen der Implantation von „Seeds“ (radioaktiven Partikeln kurzer Halbwertszeit, auch „Low-Dose-Rate Brachytherapy“, LDR-Brachytherapie genannt) und dem „Afterloading“ („High-Dose-Rate Brachytherapy“, HDR-Brachytherapie), wobei für eine (mit einem speziellen Planungsprogramm über PC) vorausberechnete Zeit eine radioaktive Quelle in Hohlnadeln, die in dem zu bestrahlenden kranken Gewebe stecken, eingeführt und anschließend wieder entfernt werden. Die HDR-Brachytherapie kann sowohl mit der perkutanen Bestrahlung kombiniert als auch als alleinige Monotherapie angewandt werden. Die LDR-Brachytherapie („Seeds“) kann nicht mit anderen Formen der Bestrahlung kombiniert werden; diese Therapie stellt eine direkte Alternative zur Operation dar. Vorteile der Bestrahlung sind der Wegfall des OP-Risikos und die Möglichkeit einer ambulanten Behandlung. Nachteile sind Nebenwirkungen wie zeitweiliger Durchfall und Verdauungsstörungen. Im Rahmen einer Metaanalyse wurde der Einfluss der Brachytherapie alleine oder in Kombination mit perkutaner Bestrahlung in Bezug auf das tumorfreie Überleben als allen anderen damit verglichenen Methoden als überlegen bewertet. Ziel dieser sogenannten „Grimm-Studie“, die 2012 publiziert wurde, war der Vergleich aller damals gängigen Behandlungsmethoden des nicht metastasierten Prostatakarzinomes. Die besten Ergebnisse bei allen drei Risikogruppen wurden jeweils durch die Brachytherapie alleine oder in Kombination erbracht. Den ausgeprägtesten Vorteil in Bezug auf die langjährige Tumorkontrolle zeigte die kombinierte Brachytherapie im Vergleich zur Operation bei Patienten mit Hochrisiko-Prostatakrebs. Kritisiert wurde die Studie dafür, dass neue Verfahren wie z. B. die dosiseskalierte perkutane Bestrahlung oder hypofraktionierte Protonentherapie, die mittlerweile zumindest äquivalente Ergebnisse erbrachten, nicht in die Metaanalyse aufgenommen wurde. Um den Stellenwert der Operation im direkten Vergleich mit Bestrahlungsverfahren erneut zu ermitteln, wurde 2013 die sogenannte „PREFERE“-Studie aufgelegt, die 2016 jedoch abgebrochen werden musste. ⓘ
Bei einer geringen Zahl von Patienten treten nach Strahlentherapie eines Prostatakarzinoms bleibende Schädigungen von Darm (Radioproktitis, Radiocolitis) und Harnblase (Radiocystitis) auf. Auch ein Verlust der Gliedsteife (erektile Dysfunktion) sowie eine Störung der Schließmuskelfunktion des Afters oder der Harnblase ist bei wenigen Patienten nach Bestrahlung eines Prostatakarzinoms beobachtet worden. Die Strahlenbelastung angrenzender Organe kann durch den Einsatz sogenannter Goldmarker gesenkt werden, so dass auch das Risiko von Nebenwirkungen reduziert wird. Diese vor Beginn der Strahlentherapie in der Prostata abgelegten drei „Seeds“ erlauben es, die Prostata bei jeder Bestrahlungssitzung indirekt zu lokalisieren (sogenannte Image Guided Radio Therapie, IGRT), so dass eine gezieltere Bestrahlung mit einem geringeren „Sicherheitssaum“ möglich ist. Hierbei handelt es sich bisher jedoch um eine individuelle Gesundheitsleistung. ⓘ
Ein neues Therapieverfahren ist die Hochpräzisionsbestrahlung der Prostata. Dabei wird die gesamte Strahlendosis in nur fünf Behandlungssitzungen über einen Zeitraum von etwa anderthalb Wochen verabreicht. Die US-Fachgesellschaft für Strahlentherapie (ASTRO) sieht diese Methode bereits als eine Alternative zu den Standardverfahren an. In Deutschland wird diese Therapie aktuell in einer vom Bundesamt für Strahlenschutz genehmigten klinischen Studie an den Universitätskliniken Kiel, Lübeck, Rostock und Frankfurt angeboten und mit dem Bestrahlungsroboter Cyberknife (in Kooperation mit Saphir Radiochirurgie) durchgeführt. ⓘ
Wenn zum Zeitpunkt der Diagnose bereits eine Absiedelung in andere Organe stattgefunden hat, ist die Erkrankung meist nicht mehr heilbar. Durch Strahlentherapie kann hier jedoch zumindest die Ausbreitung des Krebses verzögert werden. Hier findet vor allem die Bestrahlung von Knochenmetastasen ihre Anwendung, die gefährdete Knochenbezirke stabilisiert und somit erheblich zur Mobilität und Schmerzfreiheit bei Patienten mit metastasierten Tumoren beiträgt. ⓘ
Protonentherapie ⓘ
Eine neue Form der Strahlentherapie ist die Behandlung mit Protonen. Hierbei nützt man das physikalische Phänomen des bragg peak, bei der die Strahlenenergie nur an einer vorbestimmten Stelle im Körper abgegeben wird. Der Vorteil der Protonentherapie liegt in der Genauigkeit wirksam den Krebsherd zu behandeln und dennoch dicht angrenzendes gesundes Gewebe zu schonen. Im März 2014 wurden erstmals 5-Jahres-Langzeitergebnisse der Protonenbestrahlung bei Prostatakrebs publiziert. Insgesamt wurden in den drei hier zusammengefassten Studien 211 Patienten mit nicht-metastasierten Prostatakrebs mit Protonen behandelt und über einen Zeitraum von durchschnittlich über 5 Jahren (5,2 Jahre) nachbeobachtet. Die Tumorkontroll-Rate nach fünf Jahren (cPFS) betrug bei Prostatakarzinom mit niedrigem Risiko und mit mittlerem Risiko jeweils 99 %, bei Prostatakarzinom mit hohem Risiko 76 %. Die Rate an schweren Nebenwirkungen gemäß internationaler Einteilungsrichtlinie CTCAE Version 3.0 (bzw. aktueller Version 4.0) lag am Darm (z. B. Blutung des Enddarmes) bei 1 % (0,5 %), am Harntrakt (z. B. Inkontinenz) bei 5,4 % (1 %). ⓘ
Prostata-Rektum-Hydrogel-Abstandshalter

Bei Prostatakrebs ist eine Strahlentherapie, die entweder in Form einer Brachytherapie oder externen Strahlentherapie durchgeführt wird, eine der am häufigsten gewählten Behandlungsmethoden. ⓘ
Obwohl die Strahlentherapie bei Prostatakrebserkrankungen im Vergleich zu anderen Behandlungsmethoden bessere Erfolge zeigt, birgt die Verletzung des Rektums durch die Bestrahlung (strahleninduzierte Proktitis) eine Gefahr, da sich das Rektum unmittelbar hinter der Prostata befindet. Die durch Strahlen ausgelöste Schädigung des Rektums kann zu Diarrhoe, rektalem Druck, zur Schleimhautproduktion und zu Blutungen führen. Bis zum Auftreten dieser Symptome kann es sechs bis zwölf Monate dauern. Die Symptome können jedoch zu jedem Zeitpunkt bis zu 30 Jahren nach der Bestrahlungstherapie auftreten. ⓘ
Eine aufkommende Strategie zur Minderung dieser rektalen Schädigung ist die Platzierung eines Abstandshalters zwischen diesen beiden Strukturen, wodurch das Rektum auf wirkungsvolle Art und Weise vom hochdosierten Strahlenfeld weggedrückt wird. Forschern war es möglich, diese Abstandshalter herzustellen, indem sie verschiedene Materialien in dem potenziellen Raum zwischen der Prostata und dem Rektum platzierten. ⓘ
Die Injektion von Hyaluronsäure in den Raum zwischen Prostata und Rektum führte zu einem zusätzlichen Raum von mehr als einem Zentimeter ohne Beschwerden durch Tenesmen oder das Gefühl einer rektalen Füllung. Bei Patienten, die mit Hyaluronsäure behandelt wurden, traten im Vergleich zu Patienten, die keinen Abstandshalter aus Hyaluronsäure erhalten hatten, bei proktoskopischen Untersuchungen deutlich seltener rektale Schleimhautbeschädigungen (5 % vs. 36 %, p = 0,002) und keine makroskopischen rektalen Blutungen (0 % vs. 12 %, p = 0,047) auf. Eine ähnliche Studie wurde mittels Collageninjektionen in den gleichen Raum durchgeführt. Mit dieser Methode schuf man einen Raum von durchschnittlich 1,1 cm zwischen der Prostata und dem anterioren Rektum, was zu einer mehr als 50-prozentigen Minderung der rektalen Strahlungsdosis während der Strahlentherapie an der Prostata führte. ⓘ
Forscher bewerteten einen absorbierbaren Ballon, der in den Raum zwischen Prostata und Rektum eingesetzt wurde, und ermittelten einen beinahe zwei Zentimeter großen Raum mit einer errechneten Reduktion der rektalen Bestrahlung. Untersuchungen von in gleichem Raum injiziertem, absorbierbarem Hydrogel (das sich derzeit in den USA in der Phase der klinischen Erprobung befindet), resultierten in einem zusätzlichen Raum von einem Zentimeter mit einer Minderung der rektalen Strahlung (V70) von 60 %. ⓘ
Obwohl sich die Prostata-Rektum-Abstandshalter noch in der Phase der klinischen Erprobung befinden, besteht ein vielversprechendes Potenzial dahingehend, dass sie nicht nur zur Minderung unbeabsichtigter rektaler Strahlenaussetzung und der daraus resultierenden Komplikationen beitragen, sondern außerdem höhere Dosierungen bei der Strahlentherapie von Krebspatienten ermöglichen. Somit kann die Überlebensrate der Patienten verbessert werden. Zusätzlich kann durch eine höhere Dosierung pro Behandlung eine vollständige Behandlung mit weniger Arztbesuchen realisiert werden, was zum einen angenehmer für den Patienten ist und zum anderen zu erheblichen Einsparungen der medizinischen Kosten führt. ⓘ
Im Gegensatz zu den USA, in denen sich das Hydrogel noch in der klinischen Erprobung befindet, ist das Hydrogel in Europa bereits CE-zertifiziert und in einigen Ländern auf dem Markt erhältlich. ⓘ
Hochintensiver fokussierter Ultraschall
Ein seit 1996 in Deutschland angewandtes Verfahren ist der hochintensive fokussierte Ultraschall (HIFU). Die Methode beruht darauf, dass die gesamte Prostata vom Enddarm aus mit gerichteten Ultraschallwellen erhitzt und das Karzinom damit zerstört wird. Dazu wird der Schallkopf in das Rektum eingeführt. Die Behandlung erfolgt in einer Sitzung, der Krankenhausaufenthalt beträgt nur drei bis fünf Tage. In mehreren Studien mit Nachbeobachtungszeiten von mittlerweile bis zu zehn Jahren wurden die Effektivität und die Sicherheit des Verfahrens nachgewiesen. Die HIFU-Therapie wird von mehr als 30 Zentren in Deutschland angewandt, die Behandlungskosten werden von den gesetzlichen Krankenkassen im Rahmen des DRG-Systems übernommen. Das Verfahren ist sowohl kurativ als auch palliativ einsetzbar. Im Gegensatz zu strahlentherapeutischen Verfahren ist es im Rezidivfall wiederholbar, es stellt also keine „therapeutische Sackgasse“ dar. Aufgrund der geringen Belastung für den Patienten eignet sich HIFU besonders auch für ältere Patienten sowie für die Patienten, die neben dem Krebs noch an weiteren schweren Erkrankungen leiden. Nach der aktuellen S3-Leitlinie zum Prostatakarzinom (Version 2.0, 1. Aktualisierung 09.2011) ist allerdings die „… HIFU-Therapie beim lokal begrenzten Prostatakarzinom ein experimentelles Verfahren. Die HIFU-Therapie soll nur im Rahmen von prospektiven Studien angewendet werden.“ ⓘ
Therapie mit HIFU wird seit August 2017 erstmals auch in Österreich, am Klinikum Wels, angeboten. ⓘ
Hormontherapie
Die Hormontherapie, die auch als Androgen-Deprivations-Therapie bezeichnet wird, basiert auf der meist vorhandenen Abhängigkeit des Prostatakarzinoms vom Testosteron. Sie wird eingesetzt als palliative Therapie bei metastasierten Tumoren oder ergänzend zu anderen Therapiemaßnahmen wie z. B. einer Strahlentherapie. Eine Hormontherapie in Form eines Hormonentzuges kann als (meist reversible) chemische Kastration durch Gabe von GnRH-Agonisten oder -Antagonisten durchgeführt werden. Ziel ist es, den Testosteronspiegel auf unter 50 ng/dl abzusenken. Da das Prostatakarzinom meist stark testosteronabhängig ist, kommt es bei beiden Verfahren meist zu einem deutlichen Rückgang bzw. Stillstand der Krankheit, so dass der Patient oft über Jahre keine karzinombedingten Beschwerden hat. Bei der chemischen Kastration mittels GnRH-Agonisten kann ein sogenanntes Flare-up-Phänomen entstehen, ein kurzzeitig stark beschleunigter Krankheitsverlauf, bedingt durch einen kurzzeitigen Anstieg des Testosterons. Dieser kann durch die kurzzeitige Gabe von Antiandrogenen wie Cyproteronacetat unterbunden werden, was insbesondere bei ausgeprägter Metastasierung zu empfehlen ist. Aktuelle Studiendaten liefern Hinweise darauf, dass die Therapieoptionen bei Patienten mit kardiovaskulären Erkrankungen sorgfältig abgewogen werden sollten. Darüber hinaus gibt es Studien, die gezeigt haben, dass GnRH-Antagonisten gegenüber den GnRH-Agonisten mit einem deutlich geringeren Risiko für kardiovaskuläre Erkrankungen einhergehen. ⓘ
Als Nebenwirkungen bei beiden Kastrationsverfahren kommt es meist zu Testosteronmangelsymptomen, unter anderem kann es zu Hitzewallungen, zu depressiven Zuständen, zu Anämie, Muskelabbau und als Langzeitwirkung zu Osteoporose kommen, wobei bei Orchiektomie sowohl die psychischen Belastungen durch die irreversible chirurgische Kastration als auch die Osteoporose durch das nicht gleichzeitig supprimierte Hormon LH stärker in Erscheinung treten. Außerdem kommt es zur erektilen Dysfunktion, die meist als nicht allzu schlimm empfunden wird, da auch die Libido nachlässt. Um diese therapiebedingten Nebenwirkungen zu minimieren, kann bei einigen Patienten die intermittierende Hormonblockade (intermittierende Androgendeprivation) zur Anwendung kommen, das heißt, therapiefreie Intervalle werden bewusst eingeplant. Eine weitere Alternative für ausgesuchte Patienten ist die alleinige Gabe eines Antiandrogens. Im Laufe der Therapie kann eine Kastrationsresistenz des Prostatakarzinomes eintreten, das heißt, trotz eines auf unter 50 ng/dl unterdrückten Testosterons kommt es zu einem Fortschreiten der Erkrankung. ⓘ
Der unkritische Einsatz der Hormontherapie als alleinige Therapie des lokalisierten, also nicht metastasierten Prostatakarzinoms führt nicht zu einer Lebensverlängerung. ⓘ
Chemotherapie
Die nicht-chirurgische Behandlung kann Strahlentherapie, Chemotherapie, Hormontherapie, externe Strahlentherapie, Partikeltherapie, hochintensiver fokussierter Ultraschall oder eine Kombination davon umfassen. ⓘ
Prostatakrebs, der auch dann noch besteht, wenn der Testosteronspiegel durch eine Hormontherapie gesenkt wird, wird als kastrationsresistenter Prostatakrebs (CRPC) bezeichnet. Viele Krebsarten im Frühstadium benötigen normale Testosteronspiegel, um zu wachsen, CRPC jedoch nicht. Der Begriff CRPC, der früher als "hormonresistenter Prostatakrebs" oder "androgenunabhängiger Prostatakrebs" bezeichnet wurde, ist entstanden, weil diese Krebsarten auf Hormone, insbesondere Testosteron, angewiesen sind, um den Androgenrezeptor zu aktivieren. ⓘ
Das Krebs-Chemotherapeutikum Docetaxel wurde zur Behandlung von CRPC mit einem medianen Überlebensvorteil von 2 bis 3 Monaten eingesetzt. Eine Zweitlinien-Chemotherapie ist Cabazitaxel. Eine Kombination aus Bevacizumab, Docetaxel, Thalidomid und Prednison scheint bei der Behandlung des CRPC wirksam zu sein. ⓘ
Eine immuntherapeutische Behandlung mit Sipuleucel-T bei CRPC scheint die Überlebenszeit um vier Monate zu verlängern. Die Zulassung für Sipuleucel-T wurde jedoch am 19. Mai 2015 zurückgezogen. Die hormonelle Zweitlinientherapie Abirateron verlängert die Überlebenszeit um etwa 4,6 Monate. Enzalutamid ist ein weiterer hormoneller Zweitlinienwirkstoff mit einem fünfmonatigen Überlebensvorteil. Sowohl Abirateron als auch Enzalutamid befinden sich derzeit in klinischen Studien bei Patienten mit CRPC, die zuvor keine Chemotherapie erhalten haben. ⓘ
Nicht alle Patienten sprechen auf Medikamente an, die die Androgensignale blockieren. Bestimmte Zellen mit stammzellähnlichen Eigenschaften bleiben unbeeinflusst. Der Wunsch, die Ergebnisse beim CRPC zu verbessern, führte daher zu einer Erhöhung der Dosis oder zu einer Kombinationstherapie mit synergistischen Androgensignalblockern. Aber auch diese Kombinationen wirken sich nicht auf stammzellenähnliche Zellen aus, die keine Androgensignalisierung aufweisen. ⓘ
Bei Patienten mit metastasierendem Prostatakrebs, der sich auf die Knochen ausgebreitet hat, setzen Ärzte verschiedene knochenverändernde Mittel ein, um Komplikationen am Skelett zu verhindern und die Bildung neuer Knochenmasse zu unterstützen. Zoledronsäure (ein Bisphosphonat) und Denosumab (ein RANK-Ligand-Inhibitor) scheinen wirksame Mittel zu sein, sind aber mit häufigeren und schwerwiegenderen Nebenwirkungen verbunden. ⓘ
Die Chemotherapie galt beim Prostatakrebs lange als wenig wirksam. Einige Patienten (responder) mit metastasiertem Prostatakarzinom können jedoch von einer Chemotherapie profitieren. Die Ansprechrate liegt bei etwa 20 %. Zumeist hat die Chemotherapie ihren Platz bei der Behandlung des Tumorrezidivs und versagender Hormontherapie (sogenanntes kastrationsresistentes Prostatakarzinom). Auch sie ist bisher rein palliativ. Angewendete Therapeutika sind Cyclophosphamid, Doxorubicin (Adriamycin), 5-Fluoruracil, Suramin und andere; für diese konnte jedoch bisher kein Überlebensvorteil gezeigt werden. In einer 2004 in der renommierten Zeitschrift The New England Journal of Medicine publizierten Arbeit konnte erstmals ein statistisch signifikanter Überlebensvorteil von median 2,5 Monaten für diejenigen Patienten nachgewiesen werden, welche alle drei Wochen das Medikament Docetaxel erhielten. Eine erstmals 2014 auf der Jahrestagung der American Society of Clinical Oncology. (ASCO) in Chicago vorgestellte, 2015 ebenfalls im New England Journal of Medicine. publizierte Studie zeigte auch bei Patienten mit einem metastasierten, hormonsensitiven Prostatakrebs einen Überlebensvorteil durch eine frühzeitige Docetaxel-Chemotherapie. ⓘ
Im Jahr 2011 wurden in Deutschland neue Medikamente zugelassen, die in Phase-III-Studien gute Erfolge für Patienten mit fortgeschrittenem kastrationsrefraktären Prostatakarzinomen auch nach Gabe einer Docetaxel-basierten Chemotherapie zeigten: Cabazitaxel (Handelsname Jevtana), zugelassen am 17. März 2011 sowie Abirateron (Zytiga), zugelassen am 5. September 2011. Weitere Medikamente sind aktuell in Entwicklung. Enzalutamid wurde im Juni 2013 unter dem Handelsnamen Xtandi in Europa zugelassen. Sowohl Enzalutamid als auch Abirateron sind inzwischen auch zur Anwendung vor einer Chemotherapie im kastrationsresistenten Stadium zugelassen. ⓘ
Streng genommen handelt es sich bei diesen beiden Medikamenten nicht um Chemotherapeutika, sondern um Präparate mit einer antiandrogenen Wirkung, also eine Form der Hormontherapie. ⓘ
Palliativtherapie
Im fortgeschrittenen Stadium, das keine kurative (heilende) Behandlung mehr erlaubt, können dennoch medizinische Maßnahmen die Beschwerden lindern und die Lebensqualität auf einem passablen Niveau halten. Bisphosphonate, wie beispielsweise Zoledronat, haben sich als wirksam erwiesen, um osteoporotische Veränderungen im Zuge der antiandrogenen Therapie ebenso wie durch Skelettmetastasen hervorgerufene Frakturen zu reduzieren. Zur Linderung der Knochenschmerzen werden Opioide wie Morphin oder Oxycodon eingesetzt. Durch die äußere Bestrahlung von Knochenmetastasen können ebenfalls für einige Zeit die Schmerzen reduziert werden. Die Injektion bestimmter Radioisotope, wie Strontium-89, Phosphor-32, Samarium-153 oder Radium-223 (Alpharadin, Xofigo), die sich in stoffwechselaktiven Knochenmetastasen anreichern, hat einen ähnlichen Effekt (siehe Radionuklidtherapie von Knochenmetastasen). ⓘ
Aktives Beobachten
Unter bestimmten Umständen kann eine Strategie des „aktiven Beobachtens“ (engl. active surveillance) in Betracht kommen. Daneben kommt watchful waiting, „Beobachten und Abwarten“, zur Anwendung. Definitionsgemäß hat Active Surveillance bei ansonsten gesunden und für eine kurative Therapie geeigneten Patienten das Ziel, unter genauer Überwachung einschließlich regelmäßiger Kontrollbiopsien die rechtzeitige kurative Behandlung bis zu einem Zeitpunkt aufzuschieben, an dem sich möglicherweise die Tumorbiologie oder der Wunsch des Patienten ändern. Als sekundäre Behandlung wird dann in den meisten Fällen die radikale Prostatektomie gewählt (48 %). Demgegenüber werden Patienten unter Watchful Waiting erst bei einer symptomatischen Progression palliativ behandelt. ⓘ
Faktoren, die aktives Beobachten sinnvoll erscheinen lassen, sind beispielsweise das Alter des Patienten, der sonstige Gesundheitszustand und der mit Methoden der DNA-Zytometrie gemessene so genannte Ploidiegrad, ein Kennwert für die chromosomale Veränderung der Krebszellen, der auch gut als Verlaufskontrolle geeignet ist. Die DNA-Zytometrie ist eine sehr preiswerte Methode, die von den Krankenkassen bezahlt wird, und aus allen Arten von Biopsien (Stanzbiopsie und nebenwirkungsarmer Feinnadel-Aspirationsbiopsie, kurz FNAB) gemacht werden kann. Die einfachste Methode der Verlaufskontrolle ist die regelmäßige Ermittlung der PSA-Verdopplungszeit. ⓘ
Patienten, die eine Perspektive des aktiven Beobachtens verfolgen, versuchen, das Fortschreiten eines Karzinoms aktiv, beispielsweise durch die Einnahme von Nahrungsergänzungsmitteln, zu verlangsamen. Von ärztlicher Seite werden diese Bestrebungen teils sehr kritisch beobachtet und als „Vabanquespiel“ bezeichnet, andererseits aber auch unterstützt, um eine so genannte Übertherapie zu vermeiden. ⓘ
Die Patienten, die sich für die Methode des active surveillance entscheiden, wägen Nebenwirkungen und Nutzen einer frühzeitigen, invasiven Therapie (OP, Bestrahlung) ab. Durch aktives Beobachten unter Aufsicht eines Arztes können immer noch rechtzeitig kurative Schritte unternommen werden, wenn diese aufgrund eines Fortschreitens der Krankheit nötig werden sollten. Ein aktuelles Review von Weißbach und Altwein kommt zu folgender Schlussfolgerung: 88 gesichtete Studien zum active surveillance belegen konsistent hohe tumorspezifische Überlebensraten (99–100 %) bei Behandlung durch aktives Beobachten. Alle sieben recherchierten Leitlinien zur Behandlung des Prostatakarzinoms seit 2006 erwähnen in ihren Empfehlungen das aktive Beobachten als Therapieoption für PCa mit geringem Progressionsrisiko. Das National Institute for Health and Clinical Excellence (in Großbritannien) empfiehlt in diesem Fall sogar ausschließlich „active surveillance“ als Behandlungsstrategie. ⓘ
Die Prognose beim aktiven Beobachten kann unter geeigneten Umständen derjenigen unter den üblichen Therapien entsprechen, ohne dass die Nebenwirkungen der anderen Prostatakrebsbehandlungen in Kauf genommen werden müssen. Wenn diese Strategie erfolgreich ist, verstirbt der Patient mit und nicht an seinem Karzinom. ⓘ
Experimentelle Verfahren
Irreversible Elektroporation
Mit der Technologie der irreversiblen Elektroporation (IRE) ist eine nicht-thermische, gewebeselektive Ablation bei Prostatakarzinomen möglich. IRE kann dabei sowohl fokal als auch großflächig eingesetzt werden. Potentiell sind aufgrund der intrinsischen Gewebeselektivität der Technik Potenzerhalt und Kontinenzerhalt sehr wahrscheinlich. Auch kann IRE potentiell bei komplizierten Rezidiven – selbst nach radikalen Prostatektomien und Strahlentherapien – eingesetzt werden. Nekrose tritt physikalisch bedingt nicht auf, wodurch auch keine Schmerzen oder intraprostatäre Vernarbungen oder Entzündungen zu erwarten sind. Die erste Studie bezüglich des Einsatzes von IRE für die Prostata stammt aus dem Jahr 2007. Somit ist das Verfahren noch sehr neu. Es existieren dafür noch keine Langzeitdaten. Auch die Anzahl verfügbarer Studien diesbezüglich ist bisher dünn. Prostatakrebsbehandlungen mit IRE werden in Deutschland von Universitätskliniken und einem Privatinstitut durchgeführt und weiterentwickelt. Gesetzliche Krankenkassen übernehmen die Behandlungskosten bisher nicht (Stand März 2013). ⓘ
Photodynamische Therapie
Photodynamische Therapie (PDT) ist eine sich gerade in der Erprobung befindende Therapie. Der Grundgedanke ist, den Photoeffekt zwischen dem von Lasern erzeugten Licht und einem lichtempfindlichen, sich nur an Krebs anreichernden Chemotherapeutikum (Photosensibilisator) zu nutzen, um einen lokalen zytotoxischen Effekt hervorzurufen. Freigesetzt wird ein 1O2, das direkt Tumorzellen durch Nekrose und/oder Apoptose töten kann. WST-11 und 5-ALA sind zwei sich im Versuchsstadion befindliche Photosensibilisatoren. ⓘ
Vorteile dieser Methode sind: Wiederholbarkeit, vermutlich geringe Kosten, echte Zellselektivität, minimaler lokaler Schaden. Nachteile sind: Bisher unbekannte Nebenwirkungen der Chemotherapeutika, unbekannter Einfluss der möglichen Tumorhypoxytät. ⓘ
Immuntherapie
Ein neuer therapeutischer Ansatz ist die „Impfung“ mit antigenpräsentierenden Zellen, die mit einem rekombinanten Fusionsprotein (PA2024) beladen werden und die körpereigene Immunantwort stimulieren. Versuche finden derzeit mit einigem Erfolg bei Patienten mit androgen-unabhängigem Prostatakarzinom statt. Diese Patienten konnten bisher nur schwer behandelt werden, da sie auf eine Hormontherapie nicht ansprechen. Die meist gut verträgliche immuntherapeutische Behandlung (Krebsimmuntherapie) führte im Rahmen der Studien zu signifikanten Remissionen und zur Verlängerung der Überlebenszeit. Diese Behandlung ist in Deutschland noch nicht zugelassen. ⓘ
Nachsorge
Nach den „Patientenleitlinien“ sind Nachuntersuchungen wie folgt vorzunehmen: Im ersten und zweiten Jahr alle drei Monate; im dritten und vierten Jahr alle sechs Monate und ab dem fünften Jahr jährlich. Dies umfasst vor allem regelmäßige Kontrollen des PSA-Wertes. Bildgebende Verfahren werden nur bei entsprechendem klinischem Verdacht auf ein Tumorrezidiv oder eine Krankheitsprogression eingesetzt. ⓘ
Prognose und Auswirkungen auf die Lebenserwartung
Die Prognose des Prostatakarzinoms ist für eine bösartige Geschwulst beziehungsweise eine Krebserkrankung relativ günstig. Zumindest im lokalisierten Stadium (es wird hier auch illustrierend vom „Haustierkrebs“ gesprochen) ist die Lebenserwartung kaum verkürzt. Man nimmt an, dass letztlich weniger als ein Fünftel der an Prostatakrebs Erkrankten auch an ihm versterben, also die Letalität weniger als 20 % beträgt. Grund hierfür ist die späte Manifestation und die zu diesem Zeitpunkt meist bestehende Komorbidität. In einer Studie konnte gezeigt werden, dass im lokalisierten Stadium die Prognose beim Zuwarten (siehe dazu den Abschnitt „Aktives Beobachten“) nicht schlechter ist als bei sofortiger Therapie. Die hohe Mortalität ist somit vor allem auf die auffallend hohe Prävalenz im höheren Lebensalter zurückzuführen. ⓘ
Das diagnosespezifische Fünfjahresüberleben nach Diagnosestellung liegt bei Tumoren, die auf die Drüse begrenzt sind, bei 80 bis 99 %. Bei gestreuten Tumoren liegt dieser Wert jedoch mit etwa 30 % deutlich niedriger. Die Aussicht auf Heilung (also darauf, alle Krebszellen zu zerstören) ist nur bei nicht metastasierten Karzinomen gegeben und dort unter aggressiver Therapie recht gut: Auf die Prostata begrenzte Karzinome können zu fast 90 %, die Organkapsel überschreitende zu etwa 50 % definitiv geheilt werden. Bei einem lokal begrenzten Prostatakarzinom liegt die Heilungschance bei etwa 70 %. Zur genaueren Abschätzung der Prognose dienen die so genannten Partin-Tabellen, bei denen eine Kombination aus PSA-Wert, Gleason-Score und T-Stadium zur Prognoseeinschätzung herangezogen wird. ⓘ
Die hier gemachten Aussagen gelten für das Adenokarzinom der Prostata. Die seltenen neuroendokrinen und kleinzelligen Prostatakarzinome haben eine deutliche schlechtere Prognose mit einer Überlebenszeit von durchschnittlich einem Jahr. ⓘ
Früherkennung
Zur Früherkennung werden vor allem Abtasten, PSA-Test und Ultraschall angeboten. Das Abtasten ist eine Kassenleistung. PSA-Test und Ultraschall übernehmen die gesetzlichen Krankenkassen nur bei einem Krebsverdacht oder bei Beschwerden, die auf Prostatakrebs hindeuten. ⓘ
PSA-Tests und Ultraschall-Untersuchungen zur Früherkennung von Prostatakrebs sind keine Leistung der gesetzlichen Krankenkassen. Viele Arztpraxen bieten sie jedoch als individuelle Gesundheitsleistung (IGeL) an. Wegen der unsicheren Ergebnisse, unnötiger Verunsicherung der Patienten und dem Risiko der Überdiagnostik und Überbehandlung empfehlen die maßgeblichen medizinischen Fachgesellschaften Untersuchungen zur Früherkennung ausdrücklich nicht, sondern nur die Information der Patienten – mit Vor- und Nachteilen – dass solche Untersuchungen möglich sind. Für die Hausarztpraxis wird sogar empfohlen, dass die Ärzte diese Möglichkeit nicht von sich aus ansprechen, sondern nur dann, wenn ein Patient einen entsprechenden Wunsch äußert. ⓘ
Im Dezember 2019 veröffentlichte das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) einen Vorbericht unter der Überschrift: Prostatakrebsscreening mittels PSA-Test. Darin wurden folgende Schlussfolgerungen gezogen:
„Das Prostatakarzinomscreening mittels PSA-Test schadet deutlich mehr Männern durch Überdiagnosen, als es Männern nutzt. Daher wird zusammenfassend festgestellt, dass der Nutzen des Prostatakarzinomscreenings mittels PSA-Test den Schaden nicht aufwiegt.“ ⓘ
Auch der transrektale Ultraschall zur Früherkennung von Prostatakrebs ist in Deutschland eine sogenannte Individuelle Gesundheitsleistung und muss von den gesetzlichen Krankenkassen nicht bezahlt werden. Der IGeL-Monitor des Vereins Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen hat diese Leistung mit „tendenziell negativ“ bewertet. Der Grund: Man habe in der systematischen Literaturanalyse keine Studien gefunden, die Nutzen und Schaden des Ultraschalls zur Prostatakrebs-Früherkennung untersucht hätten. ⓘ
In einem Interview mit dem Deutschlandfunk (Ausstrahlung am 4. Januar 2006) wies Robert Allan Weinberg, Krebsforscher am Whitehead-Institut für biomedizinische Forschung in Cambridge bei Boston, darauf hin, dass in den Vereinigten Staaten sechsmal häufiger Prostatakrebs diagnostiziert werde als in Dänemark. Die Sterblichkeit sei in beiden Ländern jedoch gleich hoch. ⓘ
Das National Cancer Institute der USA hat folgende Statistik für Prostata-Screening vorgelegt (Stand: Dezember 2015): Wenn 1000 Männer im Alter zwischen 55 und 69 Jahren zehn Jahre lang im Abstand von ein bis vier Jahren einen PSA-Test vornehmen lassen, dann
- werden 100–120 Männer einen falsch positiven Befund erhalten, der möglicherweise Ängste und weitere diagnostische Maßnahmen zur Folge hat;
- werden 110 Männer einen positiven Befund (eine korrekte Diagnose) für Prostatakrebs erhalten;
- werden 4–5 der Männer mit korrekt diagnostiziertem Prostatakrebs trotz des Screenings innerhalb der Zehn-Jahres-Frist an den Folgen des Prostatakrebs’ sterben;
- wird im besten Fall ein Todesfall aufgrund des Screenings verhindert;
- werden mindestens 50 der gescreenten Männer Komplikationen aufgrund der Behandlungen entwickeln, darunter erektile Dysfunktion, Inkontinenz und – seltener – Herz-Kreislauf-Erkrankungen ⓘ
Bei der Prostatakrebs-Vorsorgeuntersuchung wird bei Personen ohne Symptome nach Krebserkrankungen gesucht. Zu den Optionen gehören die digitale rektale Untersuchung und der PSA-Bluttest. Ein solches Screening ist umstritten und kann für viele zu unnötigen Störungen und möglicherweise schädlichen Folgen führen. Die Nachteile bevölkerungsbezogener Vorsorgeuntersuchungen, vor allem aufgrund von Überdiagnosen (Entdeckung latenter Krebserkrankungen, die andernfalls nicht entdeckt worden wären), könnten den Nutzen überwiegen. Andere empfehlen eine gemeinsame Entscheidungsfindung, bei der das Screening nach einer ärztlichen Beratung erfolgen kann. ⓘ
In den Leitlinien der American Urological Association (AUA 2013) wird dazu aufgerufen, den ungewissen Nutzen des Screenings gegen die bekannten Schäden abzuwägen, die mit diagnostischen Tests und Behandlungen verbunden sind. Die AUA empfiehlt, dass die gemeinsame Entscheidungsfindung das Screening für die 55- bis 69-Jährigen regeln sollte, und dass das Screening nicht öfter als alle zwei Jahre stattfinden sollte. Im Vereinigten Königreich gibt es seit 2018 kein Programm zur Früherkennung von Prostatakrebs. ⓘ

Mit verschiedenen anderen Untersuchungen lassen sich Informationen über die Prostata und die Harnwege gewinnen. Mit der digitalen rektalen Untersuchung kann der Arzt Anomalien der Prostata feststellen. Die Zystoskopie zeigt die Harnwege von der Innenseite der Blase aus, wobei ein dünner, flexibler Kameraschlauch in die Harnröhre eingeführt wird. Die transrektale Ultraschalluntersuchung erstellt ein Bild der Prostata mit Hilfe von Schallwellen, die von einer Sonde im Rektum abgegeben werden. Die einzige Untersuchung, die die Diagnose Prostatakrebs vollständig bestätigen kann, ist eine Biopsie, die Entnahme von kleinen Stücken der Prostata zur mikroskopischen Untersuchung. ⓘ
Geschichte
Die Prostata wurde erstmals 1536 von dem venezianischen Anatomen Niccolò Massa beschrieben und 1538 von dem flämischen Anatomen Andreas Vesalius illustriert. Prostatakrebs wurde im Jahr 1853 entdeckt. Ursprünglich galt er als seltene Krankheit, was wahrscheinlich auf die kürzere Lebenserwartung und die schlechteren Erkennungsmethoden im 19. Die ersten Behandlungen waren chirurgische Eingriffe zur Beseitigung der Harnwegsobstruktion. ⓘ
Die Entfernung der Drüse wurde erstmals 1851 beschrieben, und die radikale perineale Prostatektomie wurde erstmals 1904 von Hugh H. Young am Johns Hopkins Hospital durchgeführt. ⓘ
Die chirurgische Entfernung der Hoden (Orchiektomie) zur Behandlung von Prostatakrebs wurde erstmals in den 1890er Jahren durchgeführt, allerdings mit begrenztem Erfolg. Die transurethrale Resektion der Prostata (TURP) ersetzte Mitte des 20. Jahrhunderts die radikale Prostatektomie zur symptomatischen Beseitigung der Obstruktion, da sie die Erektionsfähigkeit des Penis besser erhalten konnte. Die radikale retropubische Prostatektomie wurde 1983 von Patrick Walsh entwickelt. Dieser chirurgische Ansatz ermöglichte die Entfernung der Prostata und der Lymphknoten bei gleichzeitigem Erhalt der Penisfunktion. ⓘ
1941 veröffentlichte Charles B. Huggins Studien, in denen er Östrogen einsetzte, um die Testosteronproduktion bei Männern mit metastasierendem Prostatakrebs zu hemmen. Für diese Entdeckung der "chemischen Kastration" erhielt Huggins 1966 den Nobelpreis für Physiologie oder Medizin. Die Rolle des Gonadotropin-Releasing-Hormons (GnRH) bei der Fortpflanzung wurde von Andrzej W. Schally und Roger Guillemin bestimmt, die sich für diese Arbeit 1977 den Nobelpreis für Physiologie oder Medizin teilten. In der Folge wurden GnRH-Rezeptor-Agonisten wie Leuprorelin und Goserelin entwickelt und zur Behandlung von Prostatakrebs eingesetzt. ⓘ
Die Strahlentherapie für Prostatakrebs wurde Anfang des 20. Jahrhunderts entwickelt und bestand zunächst aus intraprostatischen Radiumimplantaten. Die externe Strahlentherapie wurde populärer, als Mitte des 20. Jahrhunderts stärkere [Röntgen-]Strahlenquellen verfügbar wurden. Die Brachytherapie mit implantierten Seeds (für Prostatakrebs) wurde erstmals 1983 beschrieben. ⓘ
Die systemische Chemotherapie bei Prostatakrebs wurde erstmals in den 1970er Jahren untersucht. Zu dem anfänglichen Schema aus Cyclophosphamid und 5-Fluorouracil kamen bald weitere systemische Chemotherapien hinzu. ⓘ
Enzalutamid erhielt 2012 die FDA-Zulassung für die Behandlung von kastrationsresistentem Prostatakrebs (CRPC). Alpharadin wurde 2013 im Rahmen des Priority-Review-Programms von der FDA zugelassen. ⓘ
Im Jahr 2006 wurde ein bisher unbekanntes Retrovirus, das Xenotrope MuLV-verwandte Virus (XMRV), mit menschlichen Prostatatumoren in Verbindung gebracht, aber PLOS Pathogens zog den Artikel 2012 zurück. ⓘ
Der älteste bisher nachgewiesene Fall eines metastasierten Prostatakarzinoms wurde anhand von typischen Knochenveränderungen bei einem 2700 Jahre alten Skelett eines Skythen-Fürsten in Sibirien diagnostiziert. Entdecker waren Forscher der Universität Göttingen um Michael Schultz. ⓘ
Veterinärmedizin

Bei Haustieren sind Prostatatumoren wesentlich seltener zu finden als beim Menschen. Bei Katzen sind bisher nur fünf Fälle dieser Erkrankung beschrieben worden. Am relativ häufigsten erkranken Hunde. Hier sind etwa 0,2–0,6 % aller Neubildungen Tumoren der Prostata. Unter den Neoplasien der männlichen Harn- und Geschlechtsorgane beim Hund liegt der Anteil bei sechs Prozent. Bevorzugt erkranken Hunde mittelgroßer bis großer Rassen mit einem Altersdurchschnitt von acht bis zehn Jahren. Eine Kastration bewirkt keinen Rückgang der Erkrankungshäufigkeit; es gibt vielmehr Hinweise, dass die Erkrankung bei kastrierten Rüden häufiger auftritt. Die Erkrankung ist differentialdiagnostisch vor allem von der wesentlich häufiger auftretenden gutartigen Prostatavergrößerung des Hundes abzugrenzen. Ein Tumor der Prostata ist beim Hund fast immer eine bösartige Neubildung, in den meisten Fällen handelt es sich wie beim Menschen um Adenokarzinome. Kastrierte Rüden weisen dagegen bei etwa 50 % der Fälle undifferenzierte Karzinome auf. Als weitere bösartige Neoplasien sind Plattenepithelkarzinome, Übergangsepithelkarzinome und Leiomyosarkome sporadisch beschrieben worden. Lediglich Einzelfälle stellen gutartige Fibrome, Adenome oder Leiomyome dar. Entsprechend ihrem aggressiven Charakter liegen zum Zeitpunkt der Diagnosestellung in 70 bis 80 % der Fälle bereits Metastasen vor. Die Verschleppung der Tumorzellen erfolgt über die Lymphbahn und betrifft in 66 % der Fälle die Lunge. Dieser Verlauf scheint bei kastrierten Rüden häufiger zu sein als bei intakten. Außerdem sind von Metastasen die Lymphknoten im Beckenbereich sowie Leber, Milz, Herz, Nieren, entferntere Lymphknoten, Knochen und die Nebennieren betroffen. ⓘ
Symptome

Das klinische Erscheinungsbild der Erkrankung ist variabel. Kotabsatzstörungen wie Tenesmus oder Obstipation treten wesentlich häufiger als Beschwerden bei der Miktion auf. Die Neubildung kann Schmerzsymptome im Bereich der Hinterhand hervorrufen, die bei Metastasierung in die Wirbelsäule hinein sogar als Lähmungen imponieren können. Auf rektale Palpation treten in einigen Fällen Schmerzhaftigkeiten auf. Eine Vergrößerung des Organs ist jedoch nicht in allen Fällen nachweisbar. Im Urin lassen sich in zwei Dritteln der Fälle Anzeichen für eine Entzündung oder eine Einblutung nachweisen. Tumorzellen selbst werden hier allerdings nur selten gefunden. Eine Verwendung der humanmedizinischen Marker Saure Phosphatase und Prostataspezifisches Antigen ist umstritten, zumal die humanmedizinischen Tests beim Hund nicht angewendet werden können. ⓘ
Diagnostik
Im Röntgenbild können bei Metastasierung in den betroffenen Organen häufig Veränderungen nachgewiesen werden. Die Prostata selbst ist häufig vergrößert und weist Verkalkungsherde auf. Im Ultraschall ist neben einer Vergrößerung des Organs häufig eine erhöhte Echogenität und in einigen Fällen das Vorhandensein von Zysten nachweisbar. Die definitive Diagnose erfolgt mittels einer transabdominalen oder transrektalen Prostatabiopsie und anschließender pathohistologischer Untersuchung. Eine weitere Möglichkeit besteht in der Durchführung einer Kathetersaugbiopsie, bei welcher mittels eines Harnröhrenkatheters aus dem Bereich der Prostata Zellen angesaugt werden. ⓘ
Therapie
Da die meisten Hunde mit einem Tumor der Prostata erst beim Vorliegen von Metastasen vorgestellt werden, ist die Prognose in den meisten Fällen von vornherein ungünstig. Früherkennungsmaßnahmen wie z. B. PSA-Tests werden gegenwärtig noch nicht angeboten. Die mittlere Überlebenszeit nach Diagnosestellung liegt bei drei Monaten. Eine chirurgische Entfernung der Prostata ist durch die meist große Ausdehnung des Tumors oft nicht möglich. Bei intakten Rüden wird die Überlebenszeit auch durch eine Kastration oder die Gabe von Antiandrogenen nicht verbessert. Auch verschiedentlich getestete Chemotherapieprotokolle oder Strahlentherapien verbesserten die Prognose nicht nachweislich. ⓘ
Anzeichen und Symptome

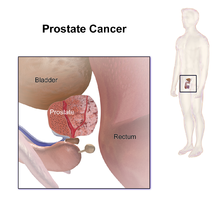
Prostatakrebs im Frühstadium hat in der Regel keine eindeutigen Symptome. Wenn sie auftreten, ähneln sie oft denen der gutartigen Prostatahyperplasie. Dazu gehören häufiges Wasserlassen, Nykturie (vermehrtes Wasserlassen in der Nacht), Schwierigkeiten beim Starten und Aufrechterhalten eines gleichmäßigen Urinstrahls, Hämaturie (Blut im Urin), Dysurie (schmerzhaftes Wasserlassen) sowie Müdigkeit aufgrund von Anämie und Knochenschmerzen. Eine Studie ergab, dass etwa ein Drittel der diagnostizierten Patienten eines oder mehrere dieser Symptome aufweist. ⓘ
Prostatakrebs geht mit Harndrangstörungen einher, da die Prostata die prostatische Harnröhre umgibt. Veränderungen innerhalb der Drüse wirken sich direkt auf die Harnfunktion aus. Da der Samenleiter Samenflüssigkeit in die Prostata-Harnröhre ableitet und Sekrete aus der Prostata zum Sameninhalt gehören, kann Prostatakrebs auch Probleme mit der sexuellen Funktion und Leistung verursachen, wie z. B. Erektionsschwierigkeiten oder schmerzhafte Ejakulation. ⓘ
Metastasierender Prostatakrebs kann zusätzliche Symptome verursachen. Das häufigste Symptom sind Knochenschmerzen, oft in den Wirbeln (Knochen der Wirbelsäule), im Becken oder in den Rippen. Die Ausbreitung des Krebses in andere Knochen, z. B. in den Oberschenkelknochen, betrifft in der Regel den Teil des Knochens, der näher an der Prostata liegt. Prostatakrebs in der Wirbelsäule kann das Rückenmark zusammendrücken und Kribbeln, Beinschwäche sowie Harn- und Stuhlinkontinenz verursachen. ⓘ
Risikofaktoren
Die wichtigsten Risikofaktoren sind Fettleibigkeit, Alter und familiäre Vorbelastung. Bei übergewichtigen Männern ist die Sterblichkeitsrate bei Prostatakrebs um 34 % höher als bei normalgewichtigen. Prostatakrebs ist bei Männern unter 45 Jahren selten, tritt aber mit zunehmendem Alter immer häufiger auf. Das Durchschnittsalter zum Zeitpunkt der Diagnose liegt bei 70 Jahren. In Autopsiestudien an chinesischen, deutschen, israelischen, jamaikanischen, schwedischen und ugandischen Männern, die an anderen Ursachen starben, wurde Prostatakrebs bei 30 % der Männer in ihren 50ern und bei 80 % der Männer in ihren 70ern festgestellt. ⓘ
Männer mit hohem Blutdruck haben ein höheres Risiko, an Prostatakrebs zu erkranken. Ein geringer Anstieg des Risikos wird mit Bewegungsmangel in Verbindung gebracht. Erhöhte Testosteronwerte im Blut können das Risiko erhöhen. ⓘ
Vererbung
Die Genetik kann sich auf das Risiko auswirken, wie die Assoziationen mit Rasse, Familie und bestimmten Genvarianten zeigen. Männer, bei denen ein Verwandter ersten Grades (Vater oder Bruder) an Prostatakrebs erkrankt ist, haben ein doppelt so hohes Risiko, an Prostatakrebs zu erkranken, und Männer, bei denen zwei Verwandte ersten Grades betroffen sind, haben ein fünffach höheres Risiko als Männer ohne familiäre Vorbelastung. Dieses Risiko scheint bei Männern mit einem betroffenen Bruder größer zu sein als bei denen mit einem betroffenen Vater. In den Vereinigten Staaten sind schwarze Männer häufiger von Prostatakrebs betroffen als weiße oder hispanische Männer, und er verläuft bei ihnen auch häufiger tödlich. Im Gegensatz dazu sind die Inzidenz- und Mortalitätsraten bei hispanischen Männern um ein Drittel niedriger als bei nicht-hispanischen Weißen. Zwillingsstudien in Skandinavien legen nahe, dass 58 % des Prostatakrebsrisikos durch vererbte Faktoren erklärt werden können. ⓘ
Viele Gene sind an dem vererbten Risiko für Prostatakrebs beteiligt. Das erste Gen, das in Familien mit vererbtem Prostatakrebs in Verbindung gebracht wurde, war das hereditäre Prostatakrebsgen 1 (HPC1). Auch Mutationen innerhalb des HOXB13-Gens können ein hohes Risiko für Prostatakrebs mit sich bringen. Vererbte genetische Variationen des Locus auf Chromosom 8q24, der in genomweiten Assoziationsstudien (GWAS) sowohl bei familiärem als auch bei sporadischem Prostatakrebs auffällig ist, können ein nahezu mendelsches (bis zu 20-faches) Risiko für Prostatakrebs mit sich bringen. Diese Region umfasst regulatorische Elemente, nicht kodierende Gene und das stammzellverwandte POU5F1B-Gen. Etwa 4 % der Familien, in denen mehrere Männer von Prostatakrebs betroffen sind, tragen Mutationen in HOXB13, und weitere 4 % tragen Mutationen in 8q24. Mutationen in BRCA1 und BRCA2 (wichtige Risikofaktoren für Eierstock- und Brustkrebs bei Frauen) wurden ebenfalls in Betracht gezogen. ⓘ
In zwei großen GWAS wurden 2008 häufige Einzel-Nukleotid-Polymorphismen (SNPs) mit geringem Risiko entdeckt, die mit Prostatakrebs in Verbindung stehen. In diesen Studien wurden mehrere relevante SNPs identifiziert. So wurde beispielsweise berichtet, dass Personen mit einem TT-Allelpaar beim SNP rs10993994 ein 1,6-fach höheres Risiko haben als Personen mit dem CC-Allelpaar. Dieser SNP erklärt einen Teil des erhöhten Risikos bei Afroamerikanern. Bei letzteren ist das C-Allel wesentlich häufiger; dieser SNP befindet sich in der Promotorregion des MSMB-Gens und beeinflusst somit die Menge des MSMB-Proteins, das von den Epithelzellen der Prostata synthetisiert und sezerniert wird. ⓘ
Während weniger Studien zur Bewertung des Risikos, an aggressivem Prostatakrebs zu erkranken, durchgeführt wurden, wurden in einer GWAS-Studie mit 12 518 Prostatakrebsfällen zwei Loci identifiziert, die mit einem hohen Gleason-Summen-Score assoziiert sind: SNP rs78943174 in der Nähe des Gens NAALADL2 und SNP rs35148638 in der Nähe von RASA1. ⓘ
Eine Reihe von somatischen Mutationen (eher erworben als vererbt) wurden ebenfalls in Prostatatumoren festgestellt, die deren Wachstum fördern. Die Fusion von Genen der TMPRSS2-ETS-Familie, insbesondere TMPRSS2-ERG oder TMPRSS2-ETV1/4, fördert das Wachstum von Krebszellen. Diese Fusionen können durch komplexe Umlagerungsketten entstehen, die als Chromoplexie bezeichnet werden. ⓘ
Medikamentenbelastung
Es wurden einige Zusammenhänge zwischen Prostatakrebs und Medikamenten, medizinischen Verfahren und Erkrankungen festgestellt. Statine können das Risiko ebenfalls senken. ⓘ
Umwelt
US-Kriegsveteranen, die Agent Orange ausgesetzt waren, hatten ein um 48 % erhöhtes Risiko für ein Wiederauftreten von Prostatakrebs nach einer Operation. ⓘ
Geschlecht
Obwohl einige Hinweise aus prospektiven Kohortenstudien darauf hindeuten, dass häufige Ejakulation das Prostatakrebsrisiko verringern kann, wurde dieser Nutzen in keiner randomisierten kontrollierten Studie nachgewiesen. Es wurde ein Zusammenhang zwischen Vasektomie und Prostatakrebs festgestellt, die Kausalität ist jedoch nicht erwiesen. ⓘ
Pathophysiologie
Die Prostata ist ein Teil des männlichen Fortpflanzungssystems, der zur Produktion und Speicherung von Samenflüssigkeit beiträgt. Bei erwachsenen Männern ist eine typische Prostata etwa 3 cm lang und wiegt etwa 20 g. Sie befindet sich im Becken, unter der Harnblase und vor dem Enddarm. Die Prostata umgibt einen Teil der Harnröhre, der Röhre, die beim Wasserlassen den Urin aus der Blase und beim Samenerguss den Samen transportiert. Die Prostata enthält viele kleine Drüsen, die etwa 20 % der Samenflüssigkeit produzieren. ⓘ
Im oberen Teil grenzt die Prostata an den Blasenausgang. Nach unten weist die Spitze der Prostata in Richtung des urogenitalen Zwerchfells, das nach anterio-inferior gerichtet ist. Die Prostata kann in vier anatomische Räume unterteilt werden: den peripheren, den zentralen, den Übergangsraum und das vordere fibromuskuläre Stroma. Der periphere Raum enthält die hinteren und seitlichen Anteile der Prostata sowie die unteren Anteile der Prostata. Der zentrale Raum enthält den oberen Teil der Prostata einschließlich der proximalsten Aspekte der Harnröhre und des Blasenhalses. Der Übergangsraum befindet sich unmittelbar vor dem Zentralraum und umfasst die Urethra distal der zentralen Drüsen-Urethra. Die neurovaskulären Bündel verlaufen entlang der posterolateralen Prostataoberfläche und durchdringen dort auch die Prostatakapsel. ⓘ
Der größte Teil des Drüsengewebes befindet sich in der peripheren und zentralen Zone (periphere Zone: 70-80 % des Drüsengewebes; zentrale Zone: 20 % des Drüsengewebes). Ein Teil befindet sich im Übergangsbereich (5 % des Drüsengewebes). Die meisten Krebsarten, die sich aus dem Drüsengewebe entwickeln, finden sich also in den peripheren und zentralen Bereichen, während etwa 5 % im Übergangsbereich zu finden sind. Im anterioren fibromuskulären Stroma wird kein Krebs gefunden, da sich in diesem anatomischen Raum keine Drüsen befinden. ⓘ
Die Prostatadrüsen benötigen männliche Hormone, die so genannten Androgene, um richtig zu funktionieren. Zu den Androgenen gehören Testosteron, das in den Hoden gebildet wird, Dehydroepiandrosteron, das in den Nebennieren gebildet wird, und Dihydrotestosteron, das in der Prostata selbst aus Testosteron gebildet wird. Androgene sind auch für sekundäre Geschlechtsmerkmale wie Gesichtsbehaarung und erhöhte Muskelmasse verantwortlich. ⓘ
Aufgrund der Lage der Prostata beeinträchtigen Prostataerkrankungen häufig das Wasserlassen, die Ejakulation und selten den Stuhlgang. Bei Prostatakrebs mutieren die Zellen dieser Drüsen zu Krebszellen. ⓘ


Die meisten Prostatakarzinome werden als Adenokarzinome oder Drüsenkarzinome eingestuft, die entstehen, wenn samenabsondernde Drüsenzellen zu Krebszellen mutieren. Die Region der Prostata, in der das Adenokarzinom am häufigsten vorkommt, ist die periphere Zone. Anfänglich verbleiben kleine Klumpen von Krebszellen in ansonsten normalen Prostatadrüsen, ein Zustand, der als Carcinoma in situ oder prostatische intraepitheliale Neoplasie (PIN) bekannt ist. Obwohl nicht bewiesen ist, dass PIN eine Krebsvorstufe ist, wird sie eng mit Krebs in Verbindung gebracht. Mit der Zeit vermehren sich diese Zellen und breiten sich auf das umgebende Prostatagewebe (das Stroma) aus und bilden einen Tumor. ⓘ
Mit der Zeit kann der Tumor so groß werden, dass er in nahe gelegene Organe wie die Samenblasen oder das Rektum eindringt, oder die Tumorzellen können die Fähigkeit entwickeln, in den Blutkreislauf und das Lymphsystem zu gelangen. ⓘ
Prostatakrebs gilt als bösartiger Tumor, weil er in andere Bereiche des Körpers eindringen kann. Diese Invasion wird als Metastasierung bezeichnet. Prostatakrebs metastasiert am häufigsten in die Knochen und Lymphknoten und kann nach lokalem Fortschreiten auch in das Rektum, die Blase und die unteren Harnleiter eindringen. Man geht davon aus, dass die Metastasierung in die Knochen über die Venen erfolgt, da der prostatavene Plexus, der die Prostata entwässert, mit den Wirbelvenen verbunden ist. ⓘ
Die Prostata ist ein Zink akkumulierendes, Citrat produzierendes Organ. Das Transportprotein ZIP1 ist für den Transport von Zink in die Prostatazellen verantwortlich. Eine der wichtigsten Aufgaben von Zink ist die Veränderung des Zellstoffwechsels zur Herstellung von Citrat, einem wichtigen Bestandteil des Samens. Der Prozess der Zinkanreicherung, der Veränderung des Stoffwechsels und der Zitratproduktion ist energieineffizient, und die Prostatazellen benötigen enorme Mengen an Energie (ATP), um diese Aufgabe zu bewältigen. Prostatakrebszellen enthalten im Allgemeinen kein Zink. Prostatakrebszellen sparen Energie, indem sie kein Citrat herstellen, und nutzen die eingesparte Energie für Wachstum, Vermehrung und Ausbreitung. ⓘ
Es wird vermutet, dass der Zinkmangel durch das Ausschalten des Gens verursacht wird, das ZIP1 produziert. Es handelt sich dabei um ein Tumorsuppressor-Genprodukt für das Gen SLC39A1. Die Ursache für die epigenetische Stilllegung ist unbekannt. Strategien, die Zink in transformierte Prostatazellen transportieren, eliminieren diese Zellen bei Tieren effektiv. Zink hemmt die NF-κB-Signalwege, wirkt proliferationshemmend und induziert die Apoptose in abnormen Zellen. Leider ist die orale Einnahme von Zink unwirksam, da hohe Zinkkonzentrationen in Prostatazellen ohne ZIP1 nicht möglich sind. ⓘ
Der Verlust von Krebsunterdrückergenen, der in der frühen Phase der Prostatakarzinogenese auftritt, wurde auf den Chromosomen 8p, 10q, 13q und 16q lokalisiert. P53-Mutationen im primären Prostatakarzinom sind relativ gering und treten häufiger in metastasierten Fällen auf, so dass p53-Mutationen ein spätes Ereignis in der Pathologie darstellen. Andere Tumorsuppressorgene, von denen man annimmt, dass sie eine Rolle spielen, sind PTEN und KAI1. "Bis zu 70 Prozent der Männer mit Prostatakrebs haben zum Zeitpunkt der Diagnose eine Kopie des PTEN-Gens verloren". Es wurde auch ein relativ häufiger Verlust von E-Cadherin und CD44 beobachtet. Der Verlust des Retinoblastom-Proteins (RB) führt zur Deregulierung des Androgenrezeptors bei kastrationsresistentem Prostatakrebs durch Deregulierung der E2F1-Expression. ⓘ
Die Faktoren, die das Fortschreiten der Krankheit und die klinische Prognose bestimmen, sind nach wie vor nur teilweise geklärt, aber es wurde eine Reihe von molekularen Determinanten identifiziert, die daran beteiligt zu sein scheinen. Die wichtigste davon könnte die Tyrosinphosphatase ACP1 sein, deren Expression das Gleason-Grading-System zur Vorhersage des Krankheitsverlaufs übertreffen könnte. Zu den weiteren identifizierten Molekülen gehören der Transkriptionsfaktor RUNX2, der Krebszellen daran hindern könnte, sich der Apoptose zu unterziehen, sowie die PI3k/Akt-Signalkaskade in Verbindung mit der Transforming Growth Factor Beta/SMAD-Signalkaskade, die ebenfalls vor Apoptose schützen. Pim-1 ist bei Prostatakrebs hochreguliert. Es wird angenommen, dass der X-linked Inhibitor of Apoptosis (XIAP) das Überleben und das Wachstum von Krebszellen fördert, während das Makrophagen-inhibitorische Zytokin-1 (MIC-1) den FAK-Signalweg stimuliert. Dennoch kann man mit Fug und Recht behaupten, dass die molekularen Faktoren, die dafür verantwortlich sind, warum manche Patienten eine ruhige Krankheit haben, während andere eine schlechte Prognose haben, noch weitgehend unbekannt sind. ⓘ
Der Androgenrezeptor hilft den Krebszellen zu überleben. Das prostataspezifische Membranantigen (PSMA) stimuliert die Krebsentwicklung, indem es den Folatspiegel erhöht und damit den Krebszellen hilft, zu überleben und zu wachsen; es erhöht das verfügbare Folat für die Verwendung, indem es glutamatierte Folate hydrolysiert. ⓘ
Bildgebung
Erscheinungsbild der Prostata im MRT
Bei der MRT weisen die zentrale Zone und die Übergangszone jeweils ein niedrigeres T2-Signal auf als die periphere Zone. Da die zentrale Zone und die Übergangszone nicht voneinander unterschieden werden können, lassen sie sich im MRT am besten als zentrale Drüse beschreiben. Daher hat die periphere Drüse im T2WI ein höheres Signal als die zentrale Drüse. In der peripheren Drüse erscheint das Prostatakarzinom als eine Läsion mit geringer Intensität. In der Zentraldrüse können jedoch Läsionen mit geringer Intensität nicht von der zentralen Drüse mit geringer Intensität unterschieden werden. Die Diffusionsbeschränkung ist für die Identifizierung und Charakterisierung von Läsionen der Zentraldrüse von entscheidender Bedeutung. Die kombinierte diffusionsgewichtete (DW) Bildgebung und die dynamische kontrastverstärkte MRT können zur Unterscheidung bösartiger von gutartigen Prostataläsionen eingesetzt werden. Die kombinierten Bilder von DW und MRI mit dynamischer Kontrastverstärkung können Bereiche mit geringer Signalintensität und schnellem Auswascheffekt sichtbar machen, die für Karzinome charakteristisch sind. Lymphadenopathie lässt sich am besten auf dem postkontrastiven, fettunterdrückten T1WI erkennen. Andere Regionen können im MRT dargestellt werden. Das anteriore fibromuskuläre Stroma und die Prostatakapsel entlang der posterioren und lateralen Prostata weisen ein schwaches T2WI-Signal auf, im Gegensatz zu dem hellen Signal der peripheren Zone. Bei einer Störung der Kapselintegrität kann eine extraprostatische Ausdehnung festgestellt werden. ⓘ
Ultraschall
Die Ultraschalluntersuchung kann transrektal durchgeführt werden und wird bei Prostatabiopsien eingesetzt. Prostatakrebs lässt sich in 60 % der Fälle als hypoechoische Läsion erkennen. Die übrigen 40 % der Krebsläsionen sind entweder hyperechoisch oder isoechoisch. Auf dem Farbdoppler erscheinen die Läsionen hypervaskulär. ⓘ
Biochemische Diagnose
Die alkalische Phosphatase ist bei metastasierten Zellen stärker erhöht als bei nicht-metastasierten. Hohe Werte der alkalischen Phosphatase sind mit einer signifikanten Verringerung der Überlebensrate verbunden. ⓘ
Tumormarker
Gewebeproben können auf das Vorhandensein von PSA und anderen Tumormarkern angefärbt werden, um die Herkunft bösartiger Zellen, die Metastasen gebildet haben, zu bestimmen. ⓘ
Das kleinzellige Karzinom ist ein seltener (1 %) Typ, der nicht mit PSA diagnostiziert werden kann. Seit 2009 suchen Forscher nach Möglichkeiten, diesen Typ zu erkennen, da er schnell metastasiert. ⓘ
Das Onkoprotein BCL-2 wird mit der Entwicklung von androgenunabhängigem Prostatakrebs in Verbindung gebracht, da es bei androgenunabhängigen Tumoren in fortgeschrittenen Stadien stark ausgeprägt ist. Die Hochregulierung von BCL-2 nach Androgenablation in Prostatakarzinom-Zelllinien und in einem kastrierten männlichen Rattenmodell hat einen weiteren Zusammenhang zwischen der BCL-2-Expression und dem Fortschreiten des Prostatakrebses hergestellt. ⓘ
Vorbeugung
Medikamente
5-Alpha-Reduktase-Hemmer (Finasterid und Dutasterid) senken das Gesamtrisiko für Prostatakrebs bei Personen, die regelmäßig an Vorsorgeuntersuchungen teilnehmen. Die Datenlage ist unzureichend, um festzustellen, ob sie das Sterberisiko beeinflussen, und sie können das Risiko für schwerere Fälle erhöhen. ⓘ
Behandlung
Psychologische Maßnahmen
Psychologische Interventionen wie Psychoedukation, kognitive Verhaltenstherapie (CBT) und Achtsamkeit werden für die Bewältigung der psychischen und emotionalen Komplikationen der Krankheitssymptome und der mit der aktiven Behandlung verbundenen Symptome empfohlen. Aufgrund der begrenzten Forschung und der unzureichenden methodischen Strenge der veröffentlichten Literatur können keine soliden Empfehlungen zur Wirksamkeit von Achtsamkeit bei Männern mit Prostatakrebs gegeben werden. ⓘ
Prognose
Viele Prostatakarzinome verlaufen nicht tödlich, und die meisten Männer sterben letztlich nicht an den Folgen der Krankheit. Die Sterblichkeitsrate ist je nach geografischer Lage und anderen Faktoren sehr unterschiedlich. In den Vereinigten Staaten liegt die Fünfjahresüberlebensrate zwischen 29 % (Fernmetastasen) und 100 % (lokale oder regionale Tumore). In Japan stieg die Sterblichkeitsrate im Jahr 2000 auf 8,6/100.000. In Indien starb in den 1990er Jahren die Hälfte der mit lokalem Krebs diagnostizierten Patienten innerhalb von 19 Jahren. Einer Studie zufolge ist die Sterblichkeitsrate bei Afroamerikanern 50-60 mal höher als in Shanghai, China. In Nigeria erkranken 2 % der Männer an Prostatakrebs, und 64 % von ihnen sind nach 2 Jahren tot. Die meisten nigerianischen Männer haben eine metastasierte Erkrankung und eine typische Überlebenszeit von 40 Monaten. ⓘ
Bei Patienten, die sich einer Behandlung unterziehen, sind die wichtigsten klinischen Prognoseindikatoren für den Krankheitsverlauf das Stadium, der PSA-Wert vor der Therapie und der Gleason-Score. Je höher der Grad und das Stadium sind, desto schlechter ist die Prognose. Mit Hilfe von Nomogrammen lässt sich das geschätzte Risiko des einzelnen Patienten berechnen. Die Vorhersagen beruhen auf den Erfahrungen mit großen Patientengruppen. Erschwerend kommt hinzu, dass die meisten Patienten bei der Diagnose mehrere unabhängige Tumorherde aufweisen, die sich durch unabhängige genetische Veränderungen und molekulare Merkmale auszeichnen. Aufgrund dieser großen interfokalen Heterogenität besteht die Gefahr, dass die Prognose auf der Grundlage des falschen Tumorherds festgelegt wird. ⓘ
Ein wichtiger Aspekt bei der Entscheidungsfindung über den Wert einer Behandlung ist die Abwägung zwischen der Prognose von Prostatakrebs und anderen Mortalitätsursachen sowie der Morbidität der Behandlung. Der PREDICT-Prostata-Algorithmus (https://prostate.predict.nhs.uk) ist ein multivariables Prognosemodell, das individualisierte Schätzungen des krebsspezifischen und des langfristigen Gesamtüberlebens bei nicht-metastasierten PCa-Patienten im Frühstadium liefert. Neben der Verwendung routinemäßig verfügbarer präoperativer klinisch-pathologischer Variablen wie PSA, Biopsie-Gleason-Score (ISUP-Gradgruppe) und klinisches T-Stadium berücksichtigt das PREDICT Prostate-Tool auch die Auswirkungen von Patientenmerkmalen (Alter und Komorbiditätsstatus) und Radikalbehandlung (radikale Prostatektomie oder Strahlentherapie) auf das Überleben. Das Tool liefert den Patienten geschätzte Überlebensraten nach der Behandlung im Zusammenhang mit der absoluten Sterblichkeitsrate, so dass die Patienten eine fundierte Entscheidung über den Wert der Behandlung und ihre möglichen Nebenwirkungen treffen können. Thurtle et al. führten eine externe Validierung ihres zuvor veröffentlichten PREDICT-Prostata-Modells durch. Das Instrument übertraf andere weit verbreitete Modelle und wies hohe c-Indizes für die Gesamtmortalität und die PCa-spezifische Sterblichkeit auf, und die Modellkalibrierung war gut und blieb innerhalb der Behandlungsuntergruppen genau. Jüngste Arbeiten haben auch gezeigt, dass das Modell die Behandlungsempfehlungen der Kliniker deutlich verändert und das Vertrauen der Patienten in die Entscheidungsfindung und ihr Verständnis der Sterblichkeitsrisiken bei einer neuen Prostatakrebsdiagnose verbessert. Predict Prostate wurde vom britischen National Institute for Health and Care Excellence als Entscheidungshilfe für Prostatakrebs empfohlen. ⓘ
Die Androgenablationstherapie führt bei 80-90 % der Patienten, die sich der Therapie unterziehen, zu einer Remission, was zu einem medianen progressionsfreien Überleben von 12 bis 33 Monaten führt. Nach der Remission stellt sich in der Regel ein androgenunabhängiger Phänotyp ein, bei dem die mediane Gesamtüberlebenszeit 23-37 Monate ab Beginn der Androgenablationstherapie beträgt. Wie die Androgenunabhängigkeit zustande kommt und wie sie das Fortschreiten der Erkrankung wiederherstellt, ist unklar. ⓘ
Klassifizierungssysteme

Es gibt mehrere Hilfsmittel zur Vorhersage von Ergebnissen, wie z. B. dem pathologischen Stadium und dem Wiederauftreten nach einer Operation oder Strahlentherapie. Die meisten kombinieren Stadium, Grad und PSA-Wert, einige berücksichtigen auch die Anzahl oder den Prozentsatz der positiven Biopsiekerne, das Alter und/oder andere Informationen. ⓘ
- Die D'Amico-Klassifizierung unterteilt Männer anhand von Stadium, Grad und PSA-Wert in ein niedriges, mittleres oder hohes Risiko. Sie wird in der klinischen Praxis und in der Forschung häufig verwendet. Der größte Nachteil des dreistufigen Systems ist, dass es bei der Stratifizierung der Patienten mehrere ungünstige Parameter (z. B. hoher Gleason-Score und hohes PSA) nicht berücksichtigt.
- Die Partin-Tabellen sagen pathologische Ergebnisse (Randstatus, extraprostatische Ausdehnung und Samenblaseninvasion) auf der Grundlage derselben drei Variablen voraus und werden als Nachschlagetabellen veröffentlicht.
- Die Kattan-Nomogramme dienen der Vorhersage des Wiederauftretens nach einer Operation und/oder Strahlentherapie auf der Grundlage der zum Zeitpunkt der Diagnose oder nach der Operation verfügbaren Daten. Der Kattan-Score gibt die Wahrscheinlichkeit an, in einem bestimmten Zeitintervall nach der Behandlung frei von Krankheit zu bleiben.
- Der UCSF Cancer of the Prostate Risk Assessment (CAPRA) Score sagt sowohl den pathologischen Status als auch das Wiederauftreten nach der Operation voraus. Er bietet eine mit dem präoperativen Kattan-Nomogramm vergleichbare Genauigkeit und kann ohne Tabellen oder Taschenrechner berechnet werden. Die Punkte werden auf der Grundlage von PSA, Grad, Stadium, Alter und Prozentsatz der positiven Bohrkerne vergeben; die Summe ergibt einen Score von 0 bis 10, wobei jeder zweite Punkt ungefähr einer Verdoppelung des Rezidivrisikos entspricht. Der CAPRA-Score wurde aus gemeindebasierten Daten der CaPSURE-Datenbank abgeleitet. Er wurde an über 10.000 Prostatektomie-Patienten validiert, darunter Patienten aus CaPSURE, dem SEARCH-Register, das Daten von mehreren Veterans Health Administration und militärischen medizinischen Zentren enthält, einer multinationalen Kohorte in Deutschland und der Prostatektomie-Kohorte der Johns Hopkins University. In jüngster Zeit hat sich gezeigt, dass er die Metastasierung und Sterblichkeit nach Prostatektomie, Strahlentherapie, Watchful Waiting oder Androgenentzugstherapie vorhersagen kann.
- In den Leitlinien des britischen National Institute for Health and Care Excellence wird die Verwendung des 5-stufigen Modells der Cambridge Prognostic Groups (CPG) bei der Festlegung von Behandlungsoptionen empfohlen. Die Begründung für diese Änderung bezieht sich auf neuere Erkenntnisse, die darauf hindeuten, dass das 5-stufige Risikostratifizierungsmodell die prostatakrebsspezifische Sterblichkeit besser vorhersagt als die älteren 3-stufigen Modelle. Das CPG-Modell wurde in Studien mit mehr als 80.000 Männern getestet und validiert. Das CPG-Modell und die Behandlungsempfehlungen des NICE können auf der Website der NICE-Leitlinien eingesehen werden. ⓘ
Lebenserwartung
Bei den Prognosen zur Lebenserwartung handelt es sich um Durchschnittswerte für die gesamte männliche Bevölkerung, und viele medizinische und Lebensstilfaktoren verändern diese Zahlen. Studien haben zum Beispiel gezeigt, dass ein 40-jähriger Mann 3,1 Lebensjahre verliert, wenn er übergewichtig ist (BMI 25-29), und 5,8 Lebensjahre, wenn er fettleibig ist (BMI 30 oder mehr), verglichen mit normalgewichtigen Männern. Übergewichtige und Raucher verlieren 6,7 Jahre und fettleibige und rauchende Männer 13,7 Jahre. ⓘ
Es gibt keine Anhaltspunkte dafür, dass eine Operation oder eine Bestrahlung in dieser Hinsicht einen Vorteil gegenüber der anderen hat. Die niedrigeren Sterberaten bei chirurgischen Eingriffen scheinen darauf zurückzuführen zu sein, dass chirurgische Eingriffe eher jüngeren Männern mit weniger schweren Krebserkrankungen angeboten werden. Es liegen nicht genügend Informationen vor, um festzustellen, ob die Seed-Bestrahlung das Leben eher verlängert als die anderen Behandlungen, aber die bisherigen Daten deuten nicht darauf hin, dass dies der Fall ist. ⓘ
Bei Männern mit geringgradiger Erkrankung (Gleason 2-4) war es unwahrscheinlich, dass sie innerhalb von 15 Jahren nach der Diagnose an Prostatakrebs starben. Bei älteren Männern (70-75 Jahre) mit geringgradiger Erkrankung lag die Gesamtüberlebensrate nach 15 Jahren bei etwa 20 %, da sie an konkurrierenden Ursachen starben. Bei Männern mit hochgradiger Erkrankung (Gleason 8-10) war die Sterblichkeit innerhalb von 15 Jahren nach der Diagnose unabhängig vom Alter hoch. ⓘ
Gesellschaft und Kultur
Männer, die an Prostatakrebs erkrankt sind, sind im Allgemeinen mit erheblichen Ungleichheiten in Bezug auf das Bewusstsein, die Finanzierung, die Medienberichterstattung und die Forschung konfrontiert - und damit mit einer schlechteren Behandlung und schlechteren Ergebnissen als bei anderen Krebsarten mit gleicher Prävalenz. Im Jahr 2001 stellte The Guardian fest, dass es in Großbritannien 3.000 Krankenschwestern gibt, die auf Brustkrebs spezialisiert sind, während es für Prostatakrebs nur eine einzige Krankenschwester gibt. Die Wartezeit zwischen Überweisung und Diagnose betrug bei Brustkrebs zwei Wochen, bei Prostatakrebs jedoch drei Monate. ⓘ
In einem Bericht der US-amerikanischen National Prostate Cancer Coalition aus dem Jahr 2007 heißt es, dass die Zahl der Prostatakrebsmedikamente die der Brustkrebsmedikamente sieben zu eins übersteigt. Die Times wies auch auf eine "männerfeindliche Ausrichtung der Krebsfinanzierung" hin, die im Vereinigten Königreich sowohl bei der Regierung als auch bei Krebshilfeorganisationen wie Cancer Research UK vier zu eins ausfällt. Kritiker führen solche Zahlen an, wenn sie behaupten, dass die Gesundheit von Frauen gegenüber der Gesundheit von Männern bevorzugt wird. ⓘ
Die Ungleichheiten erstrecken sich auch auf die Erkennung, da die Regierungen Prostatakrebs-Screenings weder finanzieren noch vorschreiben, während sie Brustkrebs-Programme voll unterstützen. In einem Bericht aus dem Jahr 2007 wurde beispielsweise festgestellt, dass 49 US-Bundesstaaten die Versicherungsdeckung für routinemäßige Brustkrebsvorsorgeuntersuchungen vorschreiben, während dies bei Prostatakrebs nur für 28 Staaten gilt. ⓘ
Über Prostatakrebs wird in den Medien deutlich weniger berichtet als über andere, ebenso verbreitete Krebsarten, die im Verhältnis 2,6:1 von Brustkrebs übertroffen werden. ⓘ
In einer Reihe von Ländern findet im September der Prostatakrebs-Aufklärungsmonat statt. Eine hellblaue Schleife wird verwendet, um für die Sache zu werben. ⓘ
Forschung
Kastrationsresistenter Prostatakrebs
Enzalutamid ist ein nichtsteroidales Antiandrogen (NSAA). ⓘ
Alpharadin setzt gezielt Radium-223-Isotope im Knochen ein, um Krebszellen durch Alphastrahlung abzutöten. ⓘ
Der PARP-Hemmer Olaparib ist ein zugelassenes Medikament gegen Brust- und Eierstockkrebs, das sich in der klinischen Prüfung befindet. Ebenfalls in der Erprobung für CRPC sind: der Checkpoint-Inhibitor Ipilimumab, der CYP17-Inhibitor Galeteron (TOK-001) und die Immuntherapie PROSTVAC. ⓘ
Alle Medikamente zur Behandlung des CRPC blockieren die Signalübertragung des Androgenrezeptors (AR) über eine direkte oder indirekte Ausrichtung auf die Ligandenbindungsdomäne (LBD) des AR. Der AR gehört zur Familie der nuklearen Steroidrezeptoren. Die Entwicklung der Prostata hängt von der durch den AR vermittelten Androgensignalisierung ab, und der AR ist auch für das Fortschreiten der Krankheit wichtig. Es sind Moleküle aufgetaucht, die erfolgreich auf alternative Domänen abzielen könnten. Solche Therapien könnten einen Vorteil darstellen, insbesondere bei der Behandlung von Prostatakrebs, der gegen die derzeitigen Therapien resistent ist. ⓘ
Präklinisch
Es wurde festgestellt, dass die Arachidonat-5-Lipoxygenase eine wichtige Rolle für das Überleben von Prostatakrebszellen spielt. Medikamente, die auf dieses Enzym abzielen, befinden sich in der Entwicklung. Insbesondere Arachidonat-5-Lipoxygenase-Inhibitoren führen zu einem massiven, schnellen programmierten Zelltod in Prostatakrebszellen. ⓘ
Galectin-3 ist ein weiteres potenzielles Ziel. Bei Prostatakrebs wurden abweichende Glykanprofile beschrieben, und in Studien wurden spezifische Zusammenhänge zwischen der Galektin-Signatur und Prostatakrebs festgestellt. ⓘ
Die PIM-Kinase-Familie ist ein weiteres potenzielles Ziel für eine selektive Hemmung. Eine Reihe von entsprechenden Medikamenten befindet sich in der Entwicklung. Es wurde vorgeschlagen, dass der vielversprechendste Ansatz darin bestehen könnte, diese Familie zusammen mit anderen Signalwegen, einschließlich PI3K, zu hemmen. ⓘ
Krebsmodelle
Wissenschaftler haben Prostatakrebs-Zelllinien zur Untersuchung des Krankheitsverlaufs entwickelt. LNCaP, PC-3 (PC3) und DU-145 (DU145) sind die am häufigsten verwendeten Prostatakrebs-Zelllinien. Die LNCaP-Zelllinie wurde aus einer menschlichen Lymphknotenmetastase eines Prostata-Adenokarzinoms gewonnen. PC-3- und DU-145-Zellen wurden aus menschlichen Adenokarzinomen der Prostata gewonnen, die in die Knochen bzw. das Gehirn metastasiert hatten. LNCaP-Zellen exprimieren AR, während PC-3- und DU-145-Zellen nur sehr wenig oder gar keinen AR exprimieren. ⓘ
Die Proliferation von LNCaP-Zellen ist androgenabhängig, während die Proliferation von PC-3- und DU-145-Zellen androgenunempfindlich ist. Eine erhöhte AR-Expression wird häufig bei fortgeschrittenen Prostatatumoren von Patienten beobachtet. Aus den androgenabhängigen LNCaP-Zellen von ATCC wurden nach Androgenentzug einige androgenunabhängige LNCaP-Sublinien entwickelt, um das Fortschreiten von Prostatakrebs zu untersuchen. Diese androgenunabhängigen LNCaP-Zellen weisen eine erhöhte AR-Expression auf und exprimieren bei Androgenbehandlung prostataspezifisches Antigen. Paradoxerweise hemmen Androgene die Proliferation dieser androgenunabhängigen Prostatakrebszellen. ⓘ
Diagnose
Ein aktiver Forschungsbereich und nicht klinisch angewandte Untersuchungen betreffen nicht-invasive Methoden der Tumorerkennung. Ein molekularer Test, der das Vorhandensein von zellassoziierter PCA3 mRNA in der Prostataflüssigkeit und der ersten Urinprobe nachweist, wird derzeit untersucht. PCA3 mRNA wird fast ausschließlich von Prostatazellen exprimiert, und es hat sich gezeigt, dass sie in Prostatakrebszellen stark überexprimiert ist. Das Testergebnis wird derzeit als Probenverhältnis von PCA3-mRNA zu PSA-mRNA angegeben. ⓘ
Der PCA3-Test soll helfen zu entscheiden, ob bei Männern mit Verdacht auf Prostatakrebs (vor allem, wenn eine erste Biopsie das erhöhte Serum-PSA nicht erklären kann) eine Biopsie/Rebiopsie erforderlich ist. Je höher die Expression von PCA3 in der Probe ist, desto größer ist die Wahrscheinlichkeit einer positiven Biopsie. Die CDC-Arbeitsgruppe Evaluation of Genomic Applications in Practice and Prevention rät von der klinischen Anwendung ab. ⓘ