Chemotherapie
| Chemotherapie ⓘ | |
|---|---|
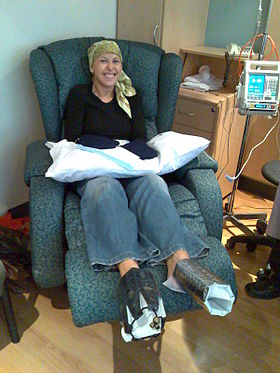 Eine Frau wird mit Docetaxel-Chemotherapie gegen Brustkrebs behandelt. Sie bekommt kalte Fäustlinge und kalte Stiefel an Händen und Füßen, um ihre Nägel zu schonen. | |
| Andere Bezeichnungen | Chemo, CTX, CTx |
Chemotherapie (oft abgekürzt als Chemo und manchmal auch CTX oder CTx) ist eine Art der Krebsbehandlung, bei der ein oder mehrere Krebsmedikamente (Chemotherapeutika) als Teil eines standardisierten Chemotherapieschemas eingesetzt werden. Eine Chemotherapie kann mit der Absicht der Heilung durchgeführt werden (was fast immer eine Kombination von Medikamenten erfordert), oder sie kann darauf abzielen, das Leben zu verlängern oder die Symptome zu lindern (palliative Chemotherapie). Die Chemotherapie ist eine der Hauptkategorien der medizinischen Disziplin, die sich speziell mit der Pharmakotherapie von Krebserkrankungen befasst und als medizinische Onkologie bezeichnet wird. ⓘ
Der Begriff Chemotherapie steht für den unspezifischen Einsatz von intrazellulären Giften, die die Mitose (Zellteilung) hemmen oder DNA-Schäden hervorrufen, weshalb die Hemmung der DNA-Reparatur die Chemotherapie verstärken kann. Die Konnotation des Wortes Chemotherapie schließt selektivere Mittel aus, die extrazelluläre Signale blockieren (Signaltransduktion). Die Entwicklung von Therapien mit spezifischen molekularen oder genetischen Zielen, die wachstumsfördernde Signale von klassischen endokrinen Hormonen (vor allem Östrogene bei Brustkrebs und Androgene bei Prostatakrebs) hemmen, werden heute als Hormontherapien bezeichnet. Im Gegensatz dazu werden andere Hemmungen von Wachstumssignalen, z. B. im Zusammenhang mit Rezeptortyrosinkinasen, als gezielte Therapie bezeichnet. ⓘ
Wichtig ist, dass es sich bei der Verwendung von Medikamenten (ob Chemotherapie, Hormontherapie oder zielgerichtete Therapie) um eine systemische Krebstherapie handelt, da sie in den Blutkreislauf eingebracht werden und daher prinzipiell in der Lage sind, Krebs an jedem anatomischen Ort im Körper zu bekämpfen. Die systemische Therapie wird häufig in Verbindung mit anderen Modalitäten eingesetzt, die eine lokale Krebstherapie darstellen (d. h. Behandlungen, deren Wirksamkeit auf den anatomischen Bereich beschränkt ist, in dem sie angewandt werden), wie z. B. Strahlentherapie, Chirurgie oder Hyperthermietherapie. ⓘ
Herkömmliche Chemotherapeutika sind zytotoxisch, indem sie die Zellteilung (Mitose) stören, aber Krebszellen sind sehr unterschiedlich empfindlich gegenüber diesen Wirkstoffen. Die Chemotherapie kann weitgehend als Mittel zur Schädigung oder Belastung von Zellen betrachtet werden, die dann zum Zelltod führen können, wenn die Apoptose eingeleitet wird. Viele der Nebenwirkungen der Chemotherapie lassen sich auf die Schädigung normaler Zellen zurückführen, die sich schnell teilen und daher empfindlich auf antimitotische Medikamente reagieren: Zellen im Knochenmark, im Verdauungstrakt und in den Haarfollikeln. Dies führt zu den häufigsten Nebenwirkungen der Chemotherapie: Myelosuppression (verringerte Produktion von Blutzellen, daher auch Immunsuppression), Mukositis (Entzündung der Schleimhaut des Verdauungstrakts) und Alopezie (Haarausfall). Aufgrund ihrer Wirkung auf Immunzellen (insbesondere Lymphozyten) werden Chemotherapeutika häufig bei einer Reihe von Krankheiten eingesetzt, die auf eine schädliche Überaktivität des Immunsystems gegen die eigene Person zurückzuführen sind (sogenannte Autoimmunität). Dazu gehören rheumatoide Arthritis, systemischer Lupus erythematodes, Multiple Sklerose, Vaskulitis und viele andere. ⓘ
Die Chemotherapie verwendet Stoffe, die ihre schädigende Wirkung möglichst gezielt auf bestimmte krankheitsverursachende Zellen beziehungsweise Mikroorganismen ausüben und diese abtöten oder in ihrem Wachstum hemmen. In der Krebstherapie heißen diese Substanzen Zytostatika; in der Behandlung von Infektionskrankheiten Antibiotika, Chemotherapeutika, Virustatika, Antimykotika und Anthelminthika. Bei der Behandlung bösartiger Tumorerkrankungen nutzen die meisten dieser Substanzen die schnelle Teilungsfähigkeit der Tumorzellen, da diese empfindlicher als gesunde Zellen auf Störungen der Zellteilung reagieren; auf gesunde Zellen mit ähnlich guter Teilungsfähigkeit üben sie allerdings eine ähnliche Wirkung aus, wodurch sich Nebenwirkungen wie Haarausfall oder Durchfall einstellen können. Bei der Behandlung von bakteriellen Infektionskrankheiten macht man sich den unterschiedlichen Aufbau von eukaryotischen (Mensch) und prokaryotischen Lebewesen (Bakterien) zunutze. ⓘ
Bei der Krebstherapie mit monoklonalen Antikörpern und Zytokinen, wie beispielsweise Interleukinen und Interferonen, handelt es sich nicht um eine Chemotherapie, sondern oftmals um eine Krebsimmuntherapie. ⓘ
Behandlungsstrategien
| Krebsart | Medikamente | Akronym ⓘ |
|---|---|---|
| Brustkrebs | Cyclophosphamid, Methotrexat, 5-Fluorouracil, Vinorelbin | CMF |
| Doxorubicin, Cyclophosphamid | AC | |
| Hodgkin-Lymphom | Docetaxel, Doxorubicin, Cyclophosphamid | TAC |
| Doxorubicin, Bleomycin, Vinblastin, Dacarbazin | ABVD | |
| Mustin, Vincristin, Procarbazin, Prednisolon | MOPP | |
| Non-Hodgkin-Lymphom | Cyclophosphamid, Doxorubicin, Vincristin, Prednisolon | CHOP, R-CVP |
| Keimzelltumor | Bleomycin, Etoposid, Cisplatin | BEP |
| Magenkrebs | Epirubicin, Cisplatin, 5-Fluorouracil | ECF |
| Epirubicin, Cisplatin, Capecitabin | ECX | |
| Harnblasenkrebs | Methotrexat, Vincristin, Doxorubicin, Cisplatin | MVAC |
| Lungenkrebs | Cyclophosphamid, Doxorubicin, Vincristin, Vinorelbin | CAV |
| Kolorektaler Krebs | 5-Fluorouracil, Folinsäure, Oxaliplatin | FOLFOX |
| Bauchspeicheldrüsenkrebs | Gemcitabin, 5-Fluorouracil | FOLFOX |
| Knochenkrebs | Doxorubicin, Cisplatin, Methotrexat, Ifosfamid, Etoposid | MAP/MAPIE |
Bei der Verabreichung von Chemotherapeutika gibt es heute eine Reihe von Strategien. Die Chemotherapie kann mit kurativer Absicht oder mit dem Ziel der Lebensverlängerung oder der Linderung von Symptomen durchgeführt werden.
- Die Induktionschemotherapie ist die Erstlinienbehandlung von Krebs mit einem Chemotherapeutikum. Diese Art der Chemotherapie wird in kurativer Absicht eingesetzt.
- Bei der kombinierten Chemotherapie werden Medikamente zusammen mit anderen Krebsbehandlungen wie Chirurgie, Strahlentherapie oder Hyperthermie eingesetzt.
- Eine Konsolidierungschemotherapie wird nach der Remission verabreicht, um die krankheitsfreie Zeit zu verlängern und das Gesamtüberleben zu verbessern. Das verabreichte Medikament ist dasselbe wie das, mit dem die Remission erreicht wurde.
- Die Intensivierungschemotherapie ist mit der Konsolidierungschemotherapie identisch, es wird jedoch ein anderes Medikament als bei der Induktionschemotherapie verwendet.
- Bei der Kombinationschemotherapie wird eine Person mit einer Reihe verschiedener Medikamente gleichzeitig behandelt. Die Medikamente unterscheiden sich in ihrer Wirkungsweise und ihren Nebenwirkungen. Der größte Vorteil besteht darin, dass das Risiko einer Resistenzentwicklung gegen ein bestimmtes Medikament minimiert wird. Außerdem können die Medikamente oft in niedrigeren Dosen eingesetzt werden, was die Toxizität verringert.
- Die neoadjuvante Chemotherapie wird vor einer lokalen Behandlung, z. B. einer Operation, verabreicht und soll den Primärtumor verkleinern. Sie wird auch bei Krebserkrankungen mit einem hohen Risiko für Mikrometastasen eingesetzt.
- Die adjuvante Chemotherapie wird nach einer lokalen Behandlung (Bestrahlung oder Operation) verabreicht. Sie kann eingesetzt werden, wenn kaum Anzeichen von Krebs vorhanden sind, aber das Risiko eines Rückfalls besteht. Sie ist auch nützlich, um Krebszellen abzutöten, die sich in andere Teile des Körpers ausgebreitet haben. Diese Mikrometastasen können mit einer adjuvanten Chemotherapie behandelt werden und die Rückfallquote aufgrund dieser gestreuten Zellen verringern.
- Die Erhaltungschemotherapie ist eine wiederholte niedrig dosierte Behandlung zur Verlängerung der Remission.
- Die Salvage-Chemotherapie oder palliative Chemotherapie wird ohne kurative Absicht verabreicht, sondern lediglich, um die Tumorlast zu verringern und die Lebenserwartung zu erhöhen. Für diese Therapien wird im Allgemeinen ein besseres Toxizitätsprofil erwartet. ⓘ
Alle Chemotherapieschemata setzen voraus, dass der Empfänger in der Lage ist, die Behandlung zu ertragen. Der Leistungsstatus wird häufig als Maßstab herangezogen, um festzustellen, ob eine Person eine Chemotherapie erhalten kann oder ob eine Dosisreduktion erforderlich ist. Da bei jeder Behandlung nur ein Bruchteil der Zellen eines Tumors abstirbt (fraktionierte Abtötung), müssen wiederholte Dosen verabreicht werden, um den Tumor weiter zu verkleinern. Bei den derzeitigen Chemotherapieschemata werden die Medikamente in Zyklen verabreicht, wobei die Häufigkeit und Dauer der Behandlungen durch die Toxizität begrenzt wird. ⓘ
Wirksamkeit
Die Wirksamkeit einer Chemotherapie hängt sehr stark von der Art des Tumors und seinem Stadium ab. Während es sehr viele Studien zu der Wirkung spezifischer Zytostatika auf entsprechende Tumorarten gibt, existiert bisher lediglich eine einzige Krebsregister-Studie, welche den Nutzen einer alleinigen Chemotherapie bei 22 Krebskrankheiten in Australien und den USA untersucht. Nicht ausgewertet wurden Krebskrankheiten, für die eine Chemotherapie die wichtigste Behandlung darstellt (z. B. Leukämie oder Lymphdrüsenkrebs), aber auch nicht die Krebsarten, bei der die Chemotherapie lediglich unterstützend (adjuvant) genutzt wird. Laut Studie sollen alleine angewandte zytotoxische Chemotherapien bei Erwachsenen zusätzliche 2,3 Prozent (in Australien) bzw. 2,1 Prozent (in den USA) zur jeweiligen Fünfjahresüberlebensrate beitragen. Die Studie bestätigt jedoch auch, dass bei bestimmten Krebsarten wie z. B. Hodenkrebs, Hodgkin-Lymphomen oder Zervixkarzinomen eine adjuvant angewandte Chemotherapie eine um 10 bis 40 Prozent bessere Prognose bringt. ⓘ
Die Studie wurde von australischen Onkologen stark kritisiert. Die Autoren hätten die verschiedenen Krebsarten nicht gewichtet (die Fallgruppe der Krebsarten, bei welchen die Chemotherapie schlecht wirkt und somit oft auch nicht angewendet wird, ist am größten) und es gebe methodische Mängel. Bei Anwendung sauberer Methodik würde aus dem gleichen Datenmaterial die Effektivität auf 6 Prozent über alle Fälle steigen. Außerdem wurden einige Krebsarten, welche hauptsächlich durch Chemotherapie behandelt werden (z. B. Leukämie) und wo diese Therapie sehr effektiv ist, nicht betrachtet. Überdies stammten die Daten aus den 1990er Jahren und seien folglich veraltet. Da die Wirkung einer Chemotherapie von der Art des Tumors abhängt, ist ein solcher Zusammenwurf aller Tumorarten nicht zielführend, denn er sage nichts über den Einzelfall aus. Zudem verwendet die Studie nur Fünfjahresüberlebensraten – bei manchen Krebsarten wie Brustkrebs kann Chemotherapie aber das späte Auftreten eines Rezidivs verhindern. ⓘ
Tatsache ist, dass hochwirksame Zytostatika dazu beigetragen haben, die relative Fünfjahresüberlebensrate bei bestimmten Krebsarten in den letzten 20 Jahren signifikant – mit verbesserten Prognosen im zweistelligen Prozentbereich – zu erhöhen. Dies gilt einerseits bei der adjuvanten Anwendung beispielsweise bei Brustkrebs, Hodenkrebs und Lungenkrebs sowie andererseits bei der primären Anwendung der Chemotherapie als Mittel der ersten Wahl, wie beispielsweise bei Hodgkin-Lymphomen und Leukämie. ⓘ
Neben einer Steigerung der Verträglichkeit bzw. Reduzierung der Nebenwirkungen durch kurzzeitiges Fasten in den Tagen der Therapie, konnte in Versuchen beobachtet werden, dass die erwünschte krebsschädigende Toxizität der Chemotherapeutika anstieg und also die Therapie wirksamer wurde. ⓘ
Dosierung

Die Dosierung der Chemotherapie kann schwierig sein: Ist die Dosis zu niedrig, ist sie gegen den Tumor unwirksam, während bei einer zu hohen Dosis die Toxizität (Nebenwirkungen) für den Empfänger unerträglich ist. Die Standardmethode zur Bestimmung der Chemotherapie-Dosierung basiert auf der berechneten Körperoberfläche (BSA). Die BSA wird in der Regel anhand einer mathematischen Formel oder eines Nomogramms unter Verwendung des Gewichts und der Größe des Empfängers und nicht durch direkte Messung der Körperoberfläche berechnet. Diese Formel wurde ursprünglich in einer Studie aus dem Jahr 1916 abgeleitet, in der versucht wurde, die an Labortieren ermittelten Arzneimitteldosen auf gleichwertige Dosen für Menschen zu übertragen. Die Studie umfasste nur neun menschliche Probanden. Als in den 1950er Jahren die Chemotherapie eingeführt wurde, wurde die BSA-Formel in Ermangelung einer besseren Möglichkeit als offizieller Standard für die Dosierung der Chemotherapie übernommen. ⓘ
Die Gültigkeit dieser Methode zur Berechnung einheitlicher Dosen wurde in Frage gestellt, da die Formel nur das Gewicht und die Größe der Person berücksichtigt. Die Absorption und Clearance von Arzneimitteln wird von zahlreichen Faktoren beeinflusst, darunter Alter, Geschlecht, Stoffwechsel, Krankheitszustand, Organfunktion, Wechselwirkungen zwischen Arzneimitteln, Genetik und Fettleibigkeit, die sich erheblich auf die tatsächliche Konzentration des Arzneimittels im Blutkreislauf des Patienten auswirken. Infolgedessen ist die systemische Konzentration von Chemotherapeutika bei Personen, die nach BSA dosiert werden, sehr unterschiedlich, und bei vielen Medikamenten beträgt diese Variabilität nachweislich mehr als das Zehnfache. Mit anderen Worten: Wenn zwei Personen die gleiche Dosis eines bestimmten Medikaments auf der Grundlage der BSA erhalten, kann die Konzentration dieses Medikaments im Blutkreislauf der einen Person zehnmal höher oder niedriger sein als die der anderen Person. Diese Variabilität ist typisch für viele Chemotherapeutika, die nach BSA dosiert werden, und wurde, wie unten gezeigt, in einer Studie mit 14 gängigen Chemotherapeutika nachgewiesen. ⓘ
Diese pharmakokinetische Variabilität hat zur Folge, dass viele Menschen nicht die richtige Dosis erhalten, um eine optimale Behandlungswirksamkeit mit möglichst geringen toxischen Nebenwirkungen zu erzielen. Manche Menschen erhalten eine Überdosis, andere eine Unterdosis. In einer randomisierten klinischen Studie wurde beispielsweise festgestellt, dass 85 % der mit 5-Fluorouracil (5-FU) behandelten Patienten mit metastasierendem Kolorektalkarzinom nicht die optimale therapeutische Dosis erhielten, wenn sie nach dem BSA-Standard dosiert wurden - 68 % waren unterdosiert und 17 % überdosiert. ⓘ
Die Verwendung des BSA zur Berechnung der Chemotherapie-Dosierung bei fettleibigen Menschen ist umstritten. Aufgrund ihres höheren BSA-Wertes reduzieren Kliniker oft willkürlich die nach der BSA-Formel verordnete Dosis aus Angst vor Überdosierung. In vielen Fällen kann dies zu einer suboptimalen Behandlung führen. ⓘ
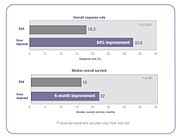
Mehrere klinische Studien haben gezeigt, dass sich die Behandlungsergebnisse verbessern und toxische Nebenwirkungen verringern lassen, wenn die Dosierung der Chemotherapie individuell angepasst wird, um eine optimale systemische Medikamentenexposition zu erreichen. In der oben zitierten klinischen 5-FU-Studie erzielten die Patienten, deren Dosis so angepasst wurde, dass eine vorher festgelegte Zielexposition erreicht wurde, eine 84 %ige Verbesserung der Ansprechrate auf die Behandlung und eine sechsmonatige Verbesserung des Gesamtüberlebens (OS) im Vergleich zu den Patienten, die nach BSA dosiert wurden. ⓘ

In der gleichen Studie verglichen die Forscher die Häufigkeit häufiger 5-FU-assoziierter Grad-3/4-Toxizitäten zwischen den Patienten mit angepasster Dosis und den Patienten, die nach BSA dosiert wurden. Die Häufigkeit von schweren Durchfallerkrankungen ging von 18 % in der nach BSA dosierten Gruppe auf 4 % in der dosisangepassten Gruppe zurück, und schwere hämatologische Nebenwirkungen traten nicht auf. Aufgrund der geringeren Toxizität konnten die Patienten in der dosisangepassten Gruppe über einen längeren Zeitraum behandelt werden. Die mit BSA behandelten Patienten wurden insgesamt 680 Monate lang behandelt, während die Patienten in der dosisangepassten Gruppe insgesamt 791 Monate lang behandelt wurden. Der Abschluss der Behandlung ist ein wichtiger Faktor, um bessere Behandlungsergebnisse zu erzielen. ⓘ
Ähnliche Ergebnisse wurden in einer Studie mit Patienten mit Kolorektalkarzinom erzielt, die mit dem beliebten FOLFOX-Schema behandelt wurden. Die Häufigkeit schwerer Durchfälle sank von 12 % in der mit BSA behandelten Patientengruppe auf 1,7 % in der dosisangepassten Gruppe, und die Häufigkeit schwerer Mukositis ging von 15 % auf 0,8 % zurück. ⓘ
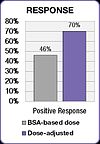
Die FOLFOX-Studie zeigte auch eine Verbesserung der Behandlungsergebnisse. Das positive Ansprechen stieg von 46 % in der mit BSA behandelten Gruppe auf 70 % in der dosisangepassten Gruppe. Das mediane progressionsfreie Überleben (PFS) und das Gesamtüberleben (OS) verbesserten sich in der dosisangepassten Gruppe um jeweils sechs Monate. ⓘ
Ein Ansatz, der Klinikern helfen kann, die Dosierung der Chemotherapie zu individualisieren, besteht darin, die Medikamentenspiegel im Blutplasma über einen längeren Zeitraum zu messen und die Dosis nach einer Formel oder einem Algorithmus anzupassen, um eine optimale Exposition zu erreichen. Mit einer festgelegten Zielexposition für eine optimierte Behandlungswirksamkeit bei minimalen Toxizitäten kann die Dosierung personalisiert werden, um die Zielexposition und optimale Ergebnisse für jede Person zu erreichen. Ein solcher Algorithmus wurde in den oben zitierten klinischen Studien verwendet und führte zu deutlich verbesserten Behandlungsergebnissen. ⓘ
Onkologen sind bereits dabei, die Dosierung einiger Krebsmedikamente auf der Grundlage der Exposition zu individualisieren. Die Dosierung von Carboplatin und Busulfan stützt sich auf Ergebnisse von Bluttests, um die optimale Dosis für jede Person zu berechnen. Einfache Bluttests sind auch für die Dosisoptimierung von Methotrexat, 5-FU, Paclitaxel und Docetaxel verfügbar. ⓘ
Der Serumalbuminspiegel unmittelbar vor der Verabreichung einer Chemotherapie ist ein unabhängiger prognostischer Faktor für das Überleben bei verschiedenen Krebsarten. ⓘ
Arten

Alkylierungsmittel
Alkylierungsmittel sind die älteste Gruppe von Chemotherapeutika, die heute verwendet werden. Ursprünglich vom Senfgas abgeleitet, das im Ersten Weltkrieg eingesetzt wurde, sind heute viele Arten von Alkylierungsmitteln in Gebrauch. Sie werden so genannt, weil sie in der Lage sind, viele Moleküle zu alkylieren, darunter Proteine, RNA und DNA. Diese Fähigkeit, sich über ihre Alkylgruppe kovalent an die DNA zu binden, ist die Hauptursache für ihre krebshemmende Wirkung. Die DNA besteht aus zwei Strängen, und die Moleküle können sich entweder zweimal an einen DNA-Strang (Intrastrang-Vernetzung) oder einmal an beide Stränge (Interstrang-Vernetzung) binden. Wenn die Zelle versucht, vernetzte DNA während der Zellteilung zu replizieren oder zu reparieren, können die DNA-Stränge brechen. Dies führt zu einer Form des programmierten Zelltods, der Apoptose. Alkylierungsmittel wirken an jedem Punkt des Zellzyklus und sind daher als zellzyklusunabhängige Medikamente bekannt. Aus diesem Grund ist die Wirkung auf die Zelle dosisabhängig; der Anteil der Zellen, die absterben, ist direkt proportional zur Medikamentendosis. ⓘ
Zu den Untergruppen der Alkylierungsmittel gehören die Stickstoffsenfstoffe, Nitrosoharnstoffe, Tetrazine, Aziridine, Cisplatine und Derivate sowie die nichtklassischen Alkylierungsmittel. Zu den Stickstoffsenfstoffen gehören Mechlorethamin, Cyclophosphamid, Melphalan, Chlorambucil, Ifosfamid und Busulfan. Zu den Nitrosoharnstoffen gehören N-Nitroso-N-methylharnstoff (MNU), Carmustin (BCNU), Lomustin (CCNU) und Semustin (MeCCNU), Fotemustin und Streptozotocin. Zu den Tetrazinen gehören Dacarbazin, Mitozolomid und Temozolomid. Zu den Aziridinen gehören Thiotepa, Mytomycin und Diaziquon (AZQ). Cisplatin und Derivate umfassen Cisplatin, Carboplatin und Oxaliplatin. Sie beeinträchtigen die Zellfunktion, indem sie kovalente Bindungen mit den Amino-, Carboxyl-, Sulfhydryl- und Phosphatgruppen in biologisch wichtigen Molekülen eingehen. Zu den nichtklassischen Alkylierungsmitteln gehören Procarbazin und Hexamethylmelamin. ⓘ
Antimetaboliten

Anti-Metabolite sind eine Gruppe von Molekülen, die die DNA- und RNA-Synthese behindern. Viele von ihnen haben eine ähnliche Struktur wie die Bausteine von DNA und RNA. Die Bausteine sind Nukleotide, ein Molekül, das aus einer Nukleobase, einem Zucker und einer Phosphatgruppe besteht. Die Nukleobasen werden in Purine (Guanin und Adenin) und Pyrimidine (Cytosin, Thymin und Uracil) unterteilt. Anti-Metaboliten ähneln entweder den Nukleobasen oder den Nukleosiden (ein Nukleotid ohne Phosphatgruppe), haben aber veränderte chemische Gruppen. Diese Medikamente entfalten ihre Wirkung, indem sie entweder die für die DNA-Synthese erforderlichen Enzyme blockieren oder in die DNA oder RNA eingebaut werden. Indem sie die an der DNA-Synthese beteiligten Enzyme hemmen, verhindern sie die Mitose, da sich die DNA nicht selbst duplizieren kann. Außerdem kann es nach dem Fehleinbau der Moleküle in die DNA zu DNA-Schäden kommen, die den programmierten Zelltod (Apoptose) auslösen. Im Gegensatz zu den Alkylierungsmitteln sind die Anti-Metaboliten zellzyklusabhängig. Das bedeutet, dass sie nur während eines bestimmten Abschnitts des Zellzyklus, in diesem Fall der S-Phase (der DNA-Synthesephase), wirken. Aus diesem Grund tritt bei einer bestimmten Dosis ein Plateau in der Wirkung ein, und bei höheren Dosen tritt proportional kein Zelltod mehr auf. Unterarten der Anti-Metaboliten sind die Anti-Folate, Fluoropyrimidine, Desoxynukleosid-Analoga und Thiopurine. ⓘ
Zu den Antifolaten gehören Methotrexat und Pemetrexed. Methotrexat hemmt die Dihydrofolatreduktase (DHFR), ein Enzym, das Tetrahydrofolat aus Dihydrofolat regeneriert. Wenn das Enzym durch Methotrexat gehemmt wird, sinkt der zelluläre Gehalt an Folat-Coenzymen. Diese werden für die Produktion von Thymidylat und Purin benötigt, die beide für die DNA-Synthese und die Zellteilung unerlässlich sind. Pemetrexed ist ein weiterer Anti-Metabolit, der die Purin- und Pyrimidin-Produktion und damit auch die DNA-Synthese hemmt. Es hemmt in erster Linie das Enzym Thymidylatsynthase, hat aber auch Auswirkungen auf DHFR, Aminoimidazolcarboxamid-Ribonukleotid-Formyltransferase und Glycinamid-Ribonukleotid-Formyltransferase. Zu den Fluoropyrimidinen gehören Fluorouracil und Capecitabin. Fluorouracil ist ein Nukleobasenanalogon, das in den Zellen zu mindestens zwei aktiven Produkten verstoffwechselt wird: 5-Fluourouridinmonophosphat (FUMP) und 5-Fluor-2'-desoxyuridin-5'-phosphat (fdUMP). FUMP wird in die RNA eingebaut und fdUMP hemmt das Enzym Thymidylatsynthase; beides führt zum Zelltod. Capecitabin ist ein Prodrug von 5-Fluorouracil, das in den Zellen abgebaut wird, um den aktiven Wirkstoff zu erzeugen. Zu den Desoxynukleosid-Analoga gehören Cytarabin, Gemcitabin, Decitabin, Azacitidin, Fludarabin, Nelarabin, Cladribin, Clofarabin und Pentostatin. Zu den Thiopurinen gehören Thioguanin und Mercaptopurin. ⓘ
Anti-Mikrotubuli-Mittel

Anti-Mikrotubuli-Mittel sind aus Pflanzen gewonnene Chemikalien, die die Zellteilung blockieren, indem sie die Funktion der Mikrotubuli verhindern. Mikrotubuli sind eine wichtige zelluläre Struktur, die aus zwei Proteinen, α-Tubulin und β-Tubulin, besteht. Sie sind hohle, stäbchenförmige Strukturen, die unter anderem für die Zellteilung erforderlich sind. Mikrotubuli sind dynamische Strukturen, d. h. sie befinden sich in einem ständigen Auf- und Abbauzustand. Vinca-Alkaloide und Taxane sind die beiden Hauptgruppen von Wirkstoffen gegen Mikrotubuli, und obwohl beide Wirkstoffgruppen eine Funktionsstörung der Mikrotubuli verursachen, sind ihre Wirkmechanismen völlig entgegengesetzt: Vinca-Alkaloide verhindern den Aufbau von Mikrotubuli, während Taxane deren Abbau verhindern. Auf diese Weise verhindern sie, dass die Krebszellen die Mitose abschließen. Daraufhin kommt es zu einem Stillstand des Zellzyklus, der den programmierten Zelltod (Apoptose) einleitet. Diese Medikamente können auch das Wachstum der Blutgefäße beeinträchtigen, ein wesentlicher Prozess, den Tumoren nutzen, um zu wachsen und Metastasen zu bilden. ⓘ
Vinca-Alkaloide werden aus dem madagassischen Immergrün, Catharanthus roseus, früher bekannt als Vinca rosea, gewonnen. Sie binden sich an bestimmte Stellen des Tubulins und hemmen den Zusammenbau von Tubulin zu Mikrotubuli. Die ursprünglichen Vinca-Alkaloide sind Naturprodukte, zu denen Vincristin und Vinblastin gehören. Nach dem Erfolg dieser Medikamente wurden halbsynthetische Vincaalkaloide hergestellt: Vinorelbin (zur Behandlung von nicht-kleinzelligem Lungenkrebs), Vindesin und Vinflunin. Diese Medikamente sind zellzyklusspezifisch. Sie binden an die Tubulinmoleküle in der S-Phase und verhindern die für die M-Phase erforderliche Bildung von Mikrotubuli. ⓘ
Taxane sind natürliche und halbsynthetische Arzneimittel. Das erste Medikament dieser Klasse, Paclitaxel, wurde ursprünglich aus Taxus brevifolia, der pazifischen Eibe, gewonnen. Heute werden dieses und ein weiteres Medikament dieser Klasse, Docetaxel, halbsynthetisch aus einer Chemikalie hergestellt, die in der Rinde einer anderen Eibe, Taxus baccata, vorkommt. ⓘ
Podophyllotoxin ist ein antineoplastisches Lignan, das hauptsächlich aus dem Amerikanischen Maiappel (Podophyllum peltatum) und dem Himalaya-Maiappel (Sinopodophyllum hexandrum) gewonnen wird. Es wirkt gegen Mikrotubuli und sein Mechanismus ähnelt dem der Vinca-Alkaloide, indem es sich an Tubulin bindet und die Bildung von Mikrotubuli hemmt. Podophyllotoxin wird zur Herstellung von zwei weiteren Medikamenten mit unterschiedlichen Wirkmechanismen verwendet: Etoposid und Teniposid. ⓘ
Topoisomerase-Hemmer

Topoisomerase-Hemmer sind Arzneimittel, die die Aktivität von zwei Enzymen beeinflussen: Topoisomerase I und Topoisomerase II. Wenn die DNA-Doppelstranghelix abgewickelt wird, z. B. während der DNA-Replikation oder Transkription, wickelt sich die benachbarte ungeöffnete DNA enger auf (Supercoils), als würde man die Mitte eines gedrehten Seils öffnen. Der durch diesen Effekt verursachte Stress wird zum Teil durch die Topoisomerase-Enzyme unterstützt. Sie erzeugen Einzel- oder Doppelstrangbrüche in der DNA, wodurch die Spannung im DNA-Strang verringert wird. Dies ermöglicht das normale Abwickeln der DNA während der Replikation oder Transkription. Die Hemmung von Topoisomerase I oder II beeinträchtigt beide Prozesse. ⓘ
Zwei Topoisomerase-I-Inhibitoren, Irinotecan und Topotecan, werden halbsynthetisch aus Camptothecin hergestellt, das aus dem chinesischen Zierbaum Camptotheca acuminata gewonnen wird. Medikamente, die auf die Topoisomerase II abzielen, können in zwei Gruppen unterteilt werden. Die Topoisomerase-II-Gifte bewirken einen Anstieg der an die DNA gebundenen Enzyme. Dies verhindert die DNA-Replikation und -Transkription, verursacht DNA-Strangbrüche und führt zum programmierten Zelltod (Apoptose). Zu diesen Mitteln gehören Etoposid, Doxorubicin, Mitoxantron und Teniposid. Die zweite Gruppe, die katalytischen Inhibitoren, sind Medikamente, die die Aktivität der Topoisomerase II blockieren und somit die DNA-Synthese und -Translation verhindern, da sich die DNA nicht richtig abwickeln kann. Zu dieser Gruppe gehören Novobiocin, Merbaron und Aclarubicin, die auch andere wichtige Wirkmechanismen haben. ⓘ
Zytotoxische Antibiotika
Bei den zytotoxischen Antibiotika handelt es sich um eine vielfältige Gruppe von Arzneimitteln mit unterschiedlichen Wirkmechanismen. Ihr gemeinsames Merkmal bei der Indikation zur Chemotherapie ist die Unterbrechung der Zellteilung. Die wichtigste Untergruppe sind die Anthrazykline und die Bleomycine; weitere bekannte Beispiele sind Mitomycin C und Actinomycin. ⓘ
Unter den Anthrazyklinen waren Doxorubicin und Daunorubicin die ersten, die aus dem Bakterium Streptomyces peucetius gewonnen wurden. Zu den Derivaten dieser Verbindungen gehören Epirubicin und Idarubicin. Weitere klinisch eingesetzte Medikamente aus der Gruppe der Anthrazykline sind Pirarubicin, Aclarubicin und Mitoxantron. Zu den Wirkmechanismen der Anthrazykline gehören die DNA-Interkalation (Moleküle fügen sich zwischen die beiden DNA-Stränge ein), die Bildung hochreaktiver freier Radikale, die interzelluläre Moleküle schädigen, und die Hemmung der Topoisomerase. ⓘ
Actinomycin ist ein komplexes Molekül, das die DNA einlagert und die RNA-Synthese verhindert. ⓘ
Bleomycin, ein aus Streptomyces verticillus isoliertes Glykopeptid, interkaliert ebenfalls die DNA, erzeugt aber freie Radikale, die die DNA schädigen. Dies geschieht, wenn Bleomycin sich an ein Metallion bindet, chemisch reduziert wird und mit Sauerstoff reagiert. ⓘ
Mitomycin ist ein zytotoxisches Antibiotikum mit der Fähigkeit zur Alkylierung der DNA. ⓘ
Lieferung

Die meisten Chemotherapien werden intravenös verabreicht, obwohl eine Reihe von Wirkstoffen auch oral verabreicht werden können (z. B. Melphalan, Busulfan, Capecitabin). Laut einer aktuellen (2016) systematischen Übersichtsarbeit stellen orale Therapien für Patienten und Pflegeteams eine zusätzliche Herausforderung dar, wenn es darum geht, die Einhaltung der Behandlungspläne zu gewährleisten und zu unterstützen. ⓘ
Für die intravenöse Verabreichung von Arzneimitteln gibt es zahlreiche Methoden, die als vaskuläre Zugangsgeräte bekannt sind. Dazu gehören das Winged Infusion Device, der periphere Venenkatheter, der Mittellinienkatheter, der periphere zentrale Katheter (PICC), der zentrale Venenkatheter und der implantierbare Port. Die Geräte werden in Bezug auf die Dauer der Chemotherapie, die Art der Verabreichung und die Art des Chemotherapeutikums unterschiedlich eingesetzt. ⓘ
Je nach Person, Krebsart, Krebsstadium, Art der Chemotherapie und Dosierung kann die intravenöse Chemotherapie entweder stationär oder ambulant durchgeführt werden. Für eine kontinuierliche, häufige oder längere intravenöse Verabreichung der Chemotherapie können verschiedene Systeme chirurgisch in das Blutgefäßsystem eingeführt werden, um den Zugang aufrechtzuerhalten. Häufig verwendete Systeme sind die Hickman-Leitung, der Port-a-Cath und die PICC-Leitung. Diese Systeme bergen ein geringeres Infektionsrisiko, sind viel weniger anfällig für Phlebitis oder Paravasate und machen das wiederholte Einführen von peripheren Kanülen überflüssig. ⓘ
Die isolierte Perfusion von Gliedmaßen (häufig bei Melanomen eingesetzt) oder die isolierte Infusion von Chemotherapie in die Leber oder die Lunge wurden zur Behandlung einiger Tumore eingesetzt. Der Hauptzweck dieser Verfahren besteht darin, eine sehr hohe Chemotherapiedosis an den Tumor zu verabreichen, ohne dass es zu übermäßigen systemischen Schäden kommt. Diese Ansätze können dazu beitragen, einzelne oder begrenzte Metastasen zu bekämpfen, aber sie sind definitionsgemäß nicht systemisch und behandeln daher keine verteilten Metastasen oder Mikrometastasen. ⓘ
Topische Chemotherapien, wie z. B. 5-Fluorouracil, werden zur Behandlung einiger Fälle von Nicht-Melanom-Hautkrebs eingesetzt. ⓘ
Wenn der Krebs das zentrale Nervensystem befallen hat oder eine Erkrankung der Hirnhaut vorliegt, kann eine intrathekale Chemotherapie verabreicht werden. ⓘ
Unerwünschte Wirkungen
Chemotherapeutische Verfahren haben eine Reihe von Nebenwirkungen, die von der Art der verwendeten Medikamente abhängen. Die gebräuchlichsten Medikamente wirken sich vor allem auf die sich schnell teilenden Zellen des Körpers aus, z. B. auf Blutzellen und die Zellen, die den Mund, den Magen und den Darm auskleiden. Chemotherapiebedingte Toxizitäten können akut nach der Verabreichung, innerhalb von Stunden oder Tagen, oder chronisch, über Wochen bis Jahre, auftreten. ⓘ
In vielen Fällen wurde sowohl im Human- als auch im Tierversuch eine Verbesserung der Verträglichkeit/Verringerung der Nebenwirkungen und eine verbesserte therapeutische Wirksamkeit durch kurzzeitiges Fasten in den Tagen der Therapie beobachtet. ⓘ
Immunsuppression und Myelosuppression
Praktisch alle Chemotherapieschemata können eine Depression des Immunsystems verursachen, häufig durch Lähmung des Knochenmarks, was zu einem Rückgang der weißen Blutkörperchen, der roten Blutkörperchen und der Blutplättchen führt. Anämie und Thrombozytopenie können Bluttransfusionen erforderlich machen. Eine Neutropenie (ein Rückgang der neutrophilen Granulozyten unter 0,5 x 109/Liter) kann mit synthetischem G-CSF (Granulozyten-Kolonie-stimulierender Faktor, z. B. Filgrastim, Lenograstim) verbessert werden. ⓘ
Bei sehr schwerer Myelosuppression, die bei einigen Therapien auftritt, werden fast alle Knochenmarkstammzellen (Zellen, die weiße und rote Blutkörperchen produzieren) zerstört, so dass eine allogene oder autologe Knochenmarkstransplantation erforderlich ist. (Bei autologen BMTs werden dem Patienten vor der Behandlung Zellen entnommen, vermehrt und anschließend wieder injiziert; bei allogenen BMTs ist die Quelle ein Spender). Dennoch entwickeln einige Menschen aufgrund dieser Beeinträchtigung des Knochenmarks Krankheiten. ⓘ
Obwohl Menschen, die eine Chemotherapie erhalten, angehalten werden, sich die Hände zu waschen, kranke Menschen zu meiden und andere infektionsvermeidende Maßnahmen zu ergreifen, sind etwa 85 % der Infektionen auf natürlich vorkommende Mikroorganismen im eigenen Magen-Darm-Trakt (einschließlich der Mundhöhle) und auf der Haut zurückzuführen. Diese können sich als systemische Infektionen wie Sepsis oder als lokale Ausbrüche wie Herpes simplex, Gürtelrose oder andere Vertreter der Herpesviren manifestieren. Das Krankheits- und Todesrisiko kann durch die Einnahme gängiger Antibiotika wie Chinolone oder Trimethoprim/Sulfamethoxazol verringert werden, bevor Fieber oder Anzeichen einer Infektion auftreten. Chinolone erweisen sich vor allem bei hämatologischem Krebs als wirksame Prophylaxe. Im Allgemeinen kann jedoch bei fünf Personen, die nach einer Chemotherapie immunsupprimiert sind und ein Antibiotikum einnehmen, ein Fieber verhindert werden; bei 34 Personen, die ein Antibiotikum einnehmen, kann ein Todesfall verhindert werden. Manchmal werden Chemotherapiebehandlungen verschoben, weil das Immunsystem auf ein kritisch niedriges Niveau unterdrückt ist. ⓘ
In Japan hat die Regierung die Verwendung einiger Heilpilze wie Trametes versicolor zugelassen, um der Unterdrückung des Immunsystems bei Menschen, die sich einer Chemotherapie unterziehen, entgegenzuwirken. ⓘ
Trilaciclib ist ein Hemmstoff der Cyclin-abhängigen Kinase 4/6, der zur Vorbeugung der durch Chemotherapie verursachten Myelosuppression zugelassen ist. Das Medikament wird vor der Chemotherapie verabreicht, um die Funktion des Knochenmarks zu schützen. ⓘ
Neutropenische Enterokolitis
Aufgrund der Unterdrückung des Immunsystems ist die neutropenische Enterokolitis (Typhlitis) eine "lebensbedrohliche gastrointestinale Komplikation der Chemotherapie". Typhlitis ist eine Darminfektion, die sich durch Symptome wie Übelkeit, Erbrechen, Durchfall, einen aufgeblähten Bauch, Fieber, Schüttelfrost oder Bauchschmerzen und Empfindlichkeit äußern kann. ⓘ
Typhlitis ist ein medizinischer Notfall. Sie hat eine sehr schlechte Prognose und verläuft oft tödlich, wenn sie nicht rechtzeitig erkannt und aggressiv behandelt wird. Eine erfolgreiche Behandlung hängt von einer frühzeitigen Diagnose ab, die durch einen hohen Verdachtsindex und den Einsatz von CT-Scans gewährleistet wird, sowie von einer nichtoperativen Behandlung in unkomplizierten Fällen und manchmal einer elektiven Hemikolektomie rechts, um ein Wiederauftreten zu verhindern. ⓘ
Magen-Darm-Beschwerden
Übelkeit, Erbrechen, Appetitlosigkeit, Durchfall, Bauchkrämpfe und Verstopfung sind häufige Nebenwirkungen von chemotherapeutischen Medikamenten, die schnell teilende Zellen abtöten. Unterernährung und Dehydrierung können die Folge sein, wenn der Empfänger nicht genug isst oder trinkt oder wenn er sich aufgrund von Magen-Darm-Schäden häufig erbricht. Dies kann zu einem raschen Gewichtsverlust oder gelegentlich auch zu einer Gewichtszunahme führen, wenn der Betroffene zu viel isst, um Übelkeit oder Sodbrennen zu lindern. Eine Gewichtszunahme kann auch durch einige Steroidmedikamente verursacht werden. Diese Nebenwirkungen können häufig durch antiemetische Medikamente verringert oder beseitigt werden. Es gibt auch Hinweise mit geringer Sicherheit, dass Probiotika eine vorbeugende und behandelnde Wirkung bei Durchfall im Zusammenhang mit einer Chemotherapie allein oder mit einer Strahlentherapie haben können. Allerdings ist ein hoher Verdachtsindex angebracht, da Durchfall und Blähungen auch Symptome einer Typhlitis sind, eines sehr ernsten und potenziell lebensbedrohlichen medizinischen Notfalls, der sofort behandelt werden muss. ⓘ
Anämie
Anämie kann durch eine myelosuppressive Chemotherapie und mögliche krebsbedingte Ursachen wie Blutungen, Zerstörung von Blutzellen (Hämolyse), Erbkrankheiten, Nierenfunktionsstörungen, Ernährungsmängel oder Anämie bei chronischen Erkrankungen verursacht werden. Ernährungsmängel oder Anämie bei chronischen Erkrankungen. Zu den Behandlungen zur Linderung der Anämie gehören Hormone zur Steigerung der Blutproduktion (Erythropoietin), Eisenpräparate und Bluttransfusionen. Eine myelosuppressive Therapie kann eine Tendenz zur Blutungsneigung verursachen, die zu Anämie führt. Medikamente, die sich schnell teilende Zellen oder Blutzellen abtöten, können die Zahl der Blutplättchen im Blut verringern, was zu blauen Flecken und Blutungen führen kann. Extrem niedrige Thrombozytenzahlen können vorübergehend durch Thrombozytentransfusionen erhöht werden, und es werden neue Medikamente zur Erhöhung der Thrombozytenzahl während der Chemotherapie entwickelt. Manchmal wird die Chemotherapie verschoben, damit sich die Thrombozytenzahl erholen kann. ⓘ
Müdigkeit kann eine Folge der Krebserkrankung oder ihrer Behandlung sein und Monate bis Jahre nach der Behandlung anhalten. Eine physiologische Ursache für Müdigkeit ist Anämie, die durch Chemotherapie, Operation, Strahlentherapie, Primär- und Metastasenerkrankungen oder Nährstoffmangel verursacht werden kann. Es hat sich gezeigt, dass aerobes Training die Müdigkeit bei Menschen mit soliden Tumoren verringert. ⓘ
Übelkeit und Erbrechen
Übelkeit und Erbrechen gehören zu den am meisten gefürchteten Nebenwirkungen der Krebstherapie für Krebskranke und ihre Angehörigen. Im Jahr 1983 stellten Coates et al. fest, dass Menschen, die eine Chemotherapie erhielten, Übelkeit und Erbrechen an erster bzw. zweiter Stelle der schlimmsten Nebenwirkungen nannten. Bis zu 20 % der Patienten, die in dieser Zeit stark emetogene Wirkstoffe erhielten, verschoben oder verweigerten sogar potenziell kurative Behandlungen. Chemotherapie-induzierte Übelkeit und Erbrechen (CINV) sind bei vielen Behandlungen und einigen Krebsarten üblich. Seit den 1990er Jahren sind mehrere neue Klassen von Antiemetika entwickelt und auf den Markt gebracht worden, die sich zu einem nahezu universellen Standard in Chemotherapieschemata entwickelt haben und dazu beitragen, diese Symptome bei vielen Menschen erfolgreich zu behandeln. Eine wirksame Behandlung dieser unangenehmen und manchmal lähmenden Symptome führt zu einer höheren Lebensqualität für den Empfänger und zu effizienteren Behandlungszyklen, da die Behandlung aufgrund der besseren Verträglichkeit seltener abgebrochen werden muss und der allgemeine Gesundheitszustand verbessert wird. ⓘ
Haarausfall
Haarausfall (Alopezie) kann durch eine Chemotherapie verursacht werden, die schnell teilende Zellen abtötet; andere Medikamente können dazu führen, dass die Haare dünner werden. Meistens handelt es sich dabei um vorübergehende Auswirkungen: In der Regel beginnt das Haar einige Wochen nach der letzten Behandlung wieder zu wachsen, manchmal jedoch mit einer Veränderung von Farbe, Textur, Dicke oder Stil. Manchmal neigt das Haar dazu, sich nach dem Nachwachsen zu kräuseln, was zu "Chemo-Locken" führt. Schwerer Haarausfall tritt am häufigsten bei Medikamenten wie Doxorubicin, Daunorubicin, Paclitaxel, Docetaxel, Cyclophosphamid, Ifosfamid und Etoposid auf. Bei einigen Standard-Chemotherapien kann es zu dauerhafter Ausdünnung oder Haarausfall kommen. ⓘ
Chemotherapie-induzierter Haarausfall beruht auf einem nicht-androgenen Mechanismus und kann sich als Alopecia totalis, Telogen effluvium oder seltener als Alopecia areata manifestieren. Aufgrund der hohen Mitoserate der Haarfollikel steht er in der Regel im Zusammenhang mit einer systemischen Behandlung und ist reversibler als androgener Haarausfall, obwohl auch dauerhafte Fälle auftreten können. Eine Chemotherapie führt bei Frauen häufiger zu Haarausfall als bei Männern. ⓘ
Die Kühlung der Kopfhaut bietet eine Möglichkeit, sowohl dauerhaften als auch vorübergehenden Haarausfall zu verhindern; es wurden jedoch Bedenken gegen diese Methode geäußert. ⓘ
Sekundäre Neoplasie
Nach einer erfolgreichen Chemo- oder Strahlentherapie kann es zur Entwicklung einer sekundären Neoplasie kommen. Die häufigste Sekundärneoplasie ist die sekundäre akute myeloische Leukämie, die sich vor allem nach einer Behandlung mit Alkylierungsmitteln oder Topoisomerasehemmern entwickelt. Bei Überlebenden einer Krebserkrankung im Kindesalter ist die Wahrscheinlichkeit, innerhalb von 30 Jahren nach der Behandlung ein sekundäres Neoplasma zu entwickeln, mehr als 13 Mal so hoch wie in der Allgemeinbevölkerung. Dieser Anstieg lässt sich nicht ausschließlich auf die Chemotherapie zurückführen. ⓘ
Unfruchtbarkeit
Einige Arten der Chemotherapie sind gonadotoxisch und können Unfruchtbarkeit verursachen. Zu den Chemotherapien mit hohem Risiko gehören Procarbazin und andere alkylierende Medikamente wie Cyclophosphamid, Ifosfamid, Busulfan, Melphalan, Chlorambucil und Chlormethin. Zu den Medikamenten mit mittlerem Risiko gehören Doxorubicin und Platinanaloga wie Cisplatin und Carboplatin. Zu den Therapien mit geringem Gonadotoxizitätsrisiko gehören dagegen Pflanzenderivate wie Vincristin und Vinblastin, Antibiotika wie Bleomycin und Dactinomycin sowie Antimetaboliten wie Methotrexat, Mercaptopurin und 5-Fluorouracil. ⓘ
Weibliche Unfruchtbarkeit durch Chemotherapie scheint sekundär auf ein vorzeitiges Versagen der Eierstöcke durch den Verlust von Primärfollikeln zurückzuführen zu sein. Dieser Verlust ist nicht unbedingt eine direkte Auswirkung der Chemotherapeutika, sondern könnte auf eine erhöhte Wachstumsrate zurückzuführen sein, um beschädigte Follikel zu ersetzen. ⓘ
Vor einer Chemotherapie stehen verschiedene Methoden zur Erhaltung der Fruchtbarkeit zur Verfügung, darunter die Kryokonservierung von Sperma, Eierstockgewebe, Eizellen oder Embryonen. Da mehr als die Hälfte der Krebspatienten ältere Menschen sind, ist diese negative Auswirkung nur für eine Minderheit der Patienten relevant. Eine zwischen 1999 und 2011 in Frankreich durchgeführte Studie kam zu dem Ergebnis, dass das Einfrieren von Embryonen vor der Verabreichung von gonadotoxischen Wirkstoffen bei Frauen in 34 % der Fälle zu einer Verzögerung der Behandlung und in 27 % der überlebenden Fälle, die schwanger werden wollten, zu einer Lebendgeburt führte, wobei die Nachbeobachtungszeit zwischen 1 und 13 Jahren lag. ⓘ
Zu den potenziell schützenden oder abschwächenden Wirkstoffen gehören GnRH-Analoga, bei denen in mehreren Studien eine schützende Wirkung in vivo beim Menschen nachgewiesen wurde, einige Studien zeigen jedoch keine solche Wirkung. Sphingosin-1-phosphat (S1P) hat eine ähnliche Wirkung gezeigt, aber sein Mechanismus der Hemmung des apoptotischen Sphingomyelin-Stoffwechsels kann auch die Apoptosewirkung von Chemotherapeutika beeinträchtigen. ⓘ
Bei der Chemotherapie als Konditionierungsregime bei der hämatopoetischen Stammzelltransplantation kam eine Studie an Personen, die wegen schwerer aplastischer Anämie allein mit Cyclophosphamid konditioniert wurden, zu dem Ergebnis, dass sich die Eierstöcke bei allen Frauen, die zum Zeitpunkt der Transplantation jünger als 26 Jahre waren, erholten, aber nur bei fünf von 16 Frauen, die älter als 26 Jahre waren. ⓘ
Teratogenität
Die Chemotherapie ist während der Schwangerschaft teratogen, insbesondere im ersten Trimester, so dass in der Regel ein Schwangerschaftsabbruch empfohlen wird, wenn während der Chemotherapie eine Schwangerschaft in diesem Zeitraum festgestellt wird. Die Exposition im zweiten und dritten Trimester erhöht in der Regel nicht das teratogene Risiko und die nachteiligen Auswirkungen auf die kognitive Entwicklung, kann aber das Risiko verschiedener Schwangerschaftskomplikationen und einer fetalen Myelosuppression erhöhen. ⓘ
Bei Männern, die sich zuvor einer Chemo- oder Strahlentherapie unterzogen haben, scheint es keinen Anstieg genetischer Defekte oder angeborener Fehlbildungen bei ihren nach der Therapie gezeugten Kindern zu geben. Der Einsatz von assistierten Reproduktionstechnologien und Mikromanipulationstechniken könnte dieses Risiko erhöhen. Bei Frauen, die sich zuvor einer Chemotherapie unterzogen haben, sind Fehlgeburten und angeborene Fehlbildungen bei nachfolgenden Empfängnissen nicht erhöht. Wenn jedoch zwischen oder kurz nach der Behandlung eine In-vitro-Fertilisation und eine Kryokonservierung der Embryonen durchgeführt wird, bestehen mögliche genetische Risiken für die heranwachsenden Eizellen, weshalb empfohlen wurde, die Babys zu untersuchen. ⓘ
Periphere Neuropathie
Bei 30 bis 40 Prozent der Patienten, die sich einer Chemotherapie unterziehen, tritt eine chemotherapiebedingte periphere Neuropathie (CIPN) auf. Dabei handelt es sich um einen fortschreitenden, dauerhaften und oft irreversiblen Zustand, der Schmerzen, Kribbeln, Taubheitsgefühle und Kälteempfindlichkeit verursacht, die in den Händen und Füßen beginnen und manchmal auf die Arme und Beine übergreifen. Zu den Chemotherapeutika, die mit CIPN in Verbindung gebracht werden, gehören Thalidomid, Epothilone, Vinca-Alkaloide, Taxane, Proteasom-Inhibitoren und Medikamente auf Platinbasis. Ob und in welchem Ausmaß eine CIPN auftritt, hängt von der Wahl des Medikaments, der Dauer der Einnahme, der insgesamt eingenommenen Menge und davon ab, ob die Person bereits eine periphere Neuropathie hat. Obwohl die Symptome hauptsächlich sensorisch sind, sind in einigen Fällen auch motorische Nerven und das autonome Nervensystem betroffen. Die CIPN tritt häufig nach der ersten Chemotherapie auf und nimmt mit fortschreitender Behandlung an Schwere zu, flacht aber in der Regel nach Abschluss der Behandlung wieder ab. Eine Ausnahme bilden die Medikamente auf Platinbasis; bei diesen Medikamenten kann sich das Empfinden noch mehrere Monate nach Ende der Behandlung verschlechtern. Einige CIPN scheinen irreversibel zu sein. Die Schmerzen lassen sich oft mit Medikamenten oder anderen Behandlungen in den Griff bekommen, aber das Taubheitsgefühl ist in der Regel therapieresistent. ⓘ
Kognitive Beeinträchtigung
Einige Patienten, die eine Chemotherapie erhalten, berichten über Müdigkeit oder unspezifische neurokognitive Probleme, wie z. B. Konzentrationsschwierigkeiten; dies wird manchmal als kognitive Beeinträchtigung nach der Chemotherapie bezeichnet und in den sozialen Medien als "Chemo-Brain" bezeichnet. ⓘ
Tumor-Lyse-Syndrom
Bei besonders großen Tumoren und Krebsarten mit einer hohen Anzahl weißer Blutkörperchen, wie Lymphomen, Teratomen und einigen Leukämien, entwickeln manche Menschen ein Tumorlyse-Syndrom. Der rasche Zerfall der Krebszellen führt zur Freisetzung von Chemikalien aus dem Inneren der Zellen. In der Folge finden sich hohe Harnsäure-, Kalium- und Phosphatwerte im Blut. Hohe Phosphatwerte führen zu sekundärem Hypoparathyreoidismus, der einen niedrigen Kalziumspiegel im Blut zur Folge hat. Dies führt zu Nierenschäden, und die hohen Kaliumwerte können Herzrhythmusstörungen hervorrufen. Obwohl es eine Prophylaxe gibt und diese bei Menschen mit großen Tumoren häufig eingeleitet wird, ist dies eine gefährliche Nebenwirkung, die unbehandelt zum Tod führen kann. ⓘ
Organschäden
Die Kardiotoxizität (Herzschäden) tritt besonders bei der Anwendung von Anthrazyklinen (Doxorubicin, Epirubicin, Idarubicin und liposomales Doxorubicin) auf. Die Ursache hierfür ist höchstwahrscheinlich auf die Bildung freier Radikale in der Zelle und die anschließende Schädigung der DNA zurückzuführen. Weitere Chemotherapeutika, die Kardiotoxizität verursachen, wenn auch in geringerem Maße, sind Cyclophosphamid, Docetaxel und Clofarabin. ⓘ
Hepatotoxizität (Leberschäden) kann durch viele zytotoxische Arzneimittel verursacht werden. Die Anfälligkeit einer Person für Leberschäden kann durch andere Faktoren wie die Krebserkrankung selbst, virale Hepatitis, Immunsuppression und Ernährungsmängel beeinflusst werden. Die Leberschäden können aus einer Schädigung der Leberzellen, einem hepatischen Sinusoidalsyndrom (Verstopfung der Lebervenen), einer Cholestase (wenn die Galle nicht von der Leber in den Darm fließt) und einer Leberfibrose bestehen. ⓘ
Nephrotoxizität (Nierenschäden) kann durch das Tumorlyse-Syndrom und auch durch direkte Auswirkungen der Arzneimittel-Clearance durch die Nieren verursacht werden. Verschiedene Arzneimittel wirken sich auf unterschiedliche Teile der Niere aus, und die Toxizität kann asymptomatisch sein (nur bei Blut- oder Urinuntersuchungen erkennbar) oder eine akute Nierenschädigung verursachen. ⓘ
Ototoxizität (Schädigung des Innenohrs) ist eine häufige Nebenwirkung von Arzneimitteln auf Platinbasis, die zu Symptomen wie Schwindel und Benommenheit führen kann. Bei Kindern, die mit Platinanaloga behandelt werden, besteht ein Risiko für die Entwicklung eines Hörverlusts. ⓘ
Andere Nebenwirkungen
Zu den weniger häufigen Nebenwirkungen gehören Hautrötungen (Erythem), trockene Haut, beschädigte Fingernägel, ein trockener Mund (Xerostomie), Wassereinlagerungen und sexuelle Impotenz. Einige Medikamente können allergische oder pseudoallergische Reaktionen auslösen. ⓘ
Bestimmte Chemotherapeutika sind mit organspezifischen Toxizitäten verbunden, darunter Herz-Kreislauf-Erkrankungen (z. B. Doxorubicin), interstitielle Lungenerkrankungen (z. B. Bleomycin) und gelegentlich sekundäre Neoplasmen (z. B. MOPP-Therapie bei Morbus Hodgkin). ⓘ
Das Hand-Fuß-Syndrom ist eine weitere Nebenwirkung der zytotoxischen Chemotherapie. ⓘ
Auch Ernährungsprobleme treten bei Krebspatienten zum Zeitpunkt der Diagnose und während der Chemotherapie häufig auf. Forschungsergebnisse deuten darauf hin, dass bei Kindern und Jugendlichen, die sich einer Krebsbehandlung unterziehen, die parenterale Ernährung im Vergleich zur enteralen Ernährung zu einer Gewichtszunahme und einer erhöhten Kalorien- und Proteinaufnahme führen kann. ⓘ
Beschränkungen
Eine Chemotherapie wirkt nicht immer, und selbst wenn sie nützlich ist, kann sie den Krebs nicht vollständig zerstören. Die Menschen sind sich häufig nicht über ihre Grenzen im Klaren. In einer Studie mit Menschen, bei denen unheilbarer Krebs im Stadium 4 neu diagnostiziert worden war, glaubten mehr als zwei Drittel der Menschen mit Lungenkrebs und mehr als vier Fünftel der Menschen mit Darmkrebs immer noch, dass eine Chemotherapie ihren Krebs wahrscheinlich heilen würde. ⓘ
Die Blut-Hirn-Schranke stellt ein Hindernis für die Verabreichung der Chemotherapie an das Gehirn dar. Denn das Gehirn verfügt über ein umfangreiches System, um es vor schädlichen Chemikalien zu schützen. Arzneimitteltransporter können Arzneimittel aus dem Gehirn und den Blutgefäßzellen des Gehirns in den Liquor- und Blutkreislauf pumpen. Diese Transporter pumpen die meisten Chemotherapeutika heraus, was ihre Wirksamkeit bei der Behandlung von Hirntumoren verringert. Nur kleine lipophile Alkylierungsmittel wie Lomustin oder Temozolomid sind in der Lage, diese Blut-Hirn-Schranke zu überwinden. ⓘ
Die Blutgefäße in Tumoren unterscheiden sich stark von denen in normalem Gewebe. Wenn ein Tumor wächst, werden die Tumorzellen, die am weitesten von den Blutgefäßen entfernt sind, sauerstoffarm (hypoxisch). Um dem entgegenzuwirken, signalisieren sie dann, dass neue Blutgefäße wachsen sollen. Das neu gebildete Tumorgefäßsystem ist schlecht ausgebildet und versorgt nicht alle Bereiche des Tumors mit ausreichend Blut. Dies führt zu Problemen bei der Verabreichung von Medikamenten, da viele Medikamente über den Blutkreislauf in den Tumor gelangen. ⓘ
Resistenz
Resistenz ist eine der Hauptursachen für das Scheitern der Behandlung mit Chemotherapeutika. Es gibt einige mögliche Ursachen für die Resistenz bei Krebs. Eine davon ist das Vorhandensein kleiner Pumpen auf der Oberfläche von Krebszellen, die Chemotherapeutika aktiv aus dem Inneren der Zelle nach außen transportieren. Krebszellen produzieren große Mengen dieser Pumpen, die als p-Glykoprotein bekannt sind, um sich vor Chemotherapeutika zu schützen. Die Forschung zu p-Glykoprotein und anderen Chemotherapie-Efflux-Pumpen wird derzeit fortgesetzt. Medikamente, die die Funktion von p-Glykoprotein hemmen sollen, werden derzeit untersucht, ihre Entwicklung gestaltet sich jedoch aufgrund von Toxizitäten und Wechselwirkungen mit Krebsmedikamenten schwierig. Ein weiterer Mechanismus der Resistenz ist die Genamplifikation, ein Prozess, bei dem Krebszellen mehrere Kopien eines Gens herstellen. Dadurch wird die Wirkung von Medikamenten, die die Expression von Genen, die an der Replikation beteiligt sind, reduzieren, überwunden. Wenn mehr Kopien des Gens vorhanden sind, kann das Medikament die Expression des Gens nicht vollständig verhindern, so dass die Zelle ihre Vermehrungsfähigkeit wiederherstellen kann. Krebszellen können auch Defekte in den zellulären Apoptosewegen (programmierter Zelltod) verursachen. Da die meisten Chemotherapeutika Krebszellen auf diese Weise abtöten, ermöglicht eine defekte Apoptose das Überleben dieser Zellen und macht sie resistent. Viele Chemotherapeutika verursachen auch DNA-Schäden, die durch Enzyme in der Zelle repariert werden können, die für die DNA-Reparatur zuständig sind. Eine Hochregulierung dieser Gene kann den DNA-Schaden überwinden und die Induktion der Apoptose verhindern. Es können Mutationen in Genen auftreten, die Zielproteine für Medikamente produzieren, wie z. B. Tubulin, die verhindern, dass die Medikamente an das Protein binden, was zu einer Resistenz gegen diese Arten von Medikamenten führt. Die in der Chemotherapie verwendeten Medikamente können Zellstress auslösen, der eine Krebszelle abtöten kann; unter bestimmten Bedingungen kann der Zellstress jedoch Veränderungen in der Genexpression hervorrufen, die eine Resistenz gegen verschiedene Arten von Medikamenten ermöglichen. Bei Lungenkrebs wird angenommen, dass der Transkriptionsfaktor NFκB über Entzündungswege eine Rolle bei der Resistenz gegen Chemotherapie spielt. ⓘ
Zytotoxika und zielgerichtete Therapien
Zielgerichtete Therapien sind eine relativ neue Klasse von Krebsmedikamenten, mit denen viele der Probleme überwunden werden können, die beim Einsatz von Zytostatika auftreten. Sie werden in zwei Gruppen unterteilt: kleine Moleküle und Antikörper. Die massive Toxizität, die bei der Verwendung von Zytostatika auftritt, ist auf die fehlende Zellspezifität der Medikamente zurückzuführen. Sie töten jede sich schnell teilende Zelle, ob Tumor oder normal. Zielgerichtete Therapien sind darauf ausgelegt, zelluläre Proteine oder Prozesse zu beeinflussen, die von den Krebszellen genutzt werden. Dies ermöglicht eine hohe Dosis für das Krebsgewebe und eine relativ geringe Dosis für andere Gewebe. Obwohl die Nebenwirkungen oft weniger schwerwiegend sind als bei zytotoxischen Chemotherapeutika, können lebensbedrohliche Wirkungen auftreten. Ursprünglich sollten die zielgerichteten Therapeutika nur für ein bestimmtes Protein selektiv sein. Heute ist klar, dass es oft eine Reihe von Proteinzielen gibt, an die das Medikament binden kann. Ein Beispiel für ein Target für eine gezielte Therapie ist das BCR-ABL1-Protein, das aus dem Philadelphia-Chromosom hervorgeht, einer genetischen Läsion, die häufig bei chronisch-myeloischer Leukämie und bei einigen Patienten mit akuter lymphatischer Leukämie auftritt. Dieses Fusionsprotein besitzt eine Enzymaktivität, die durch Imatinib, ein niedermolekulares Medikament, gehemmt werden kann. ⓘ
Wirkmechanismus

Krebs ist das unkontrollierte Wachstum von Zellen, verbunden mit bösartigem Verhalten: Invasion und Metastasierung (neben anderen Merkmalen). Er wird durch das Zusammenspiel von genetischer Anfälligkeit und Umweltfaktoren verursacht. Diese Faktoren führen zu einer Anhäufung von genetischen Mutationen in Onkogenen (Gene, die die Wachstumsrate von Zellen kontrollieren) und Tumorsuppressorgenen (Gene, die Krebs verhindern), wodurch die Krebszellen ihre bösartigen Eigenschaften wie unkontrolliertes Wachstum erhalten. ⓘ
Im weitesten Sinne wirken die meisten Chemotherapeutika durch die Beeinträchtigung der Mitose (Zellteilung) und zielen somit auf sich schnell teilende Zellen ab. Da diese Medikamente die Zellen schädigen, werden sie als zytotoxisch bezeichnet. Sie verhindern die Mitose durch verschiedene Mechanismen, darunter die Schädigung der DNA und die Hemmung der an der Zellteilung beteiligten Maschinen. Eine Theorie, warum diese Medikamente Krebszellen abtöten, ist, dass sie eine programmierte Form des Zelltods, die so genannte Apoptose, auslösen. ⓘ
Da die Chemotherapie auf die Zellteilung einwirkt, reagieren Tumoren mit hohen Wachstumsraten (wie die akute myeloische Leukämie und die aggressiven Lymphome, einschließlich der Hodgkin-Krankheit) empfindlicher auf die Chemotherapie, da ein größerer Anteil der betroffenen Zellen ständig in Zellteilung begriffen ist. Bösartige Tumoren mit langsameren Wachstumsraten, wie indolente Lymphome, sprechen in der Regel viel schwächer auf eine Chemotherapie an. Heterogene Tumore können je nach den subklonalen Populationen innerhalb des Tumors auch unterschiedlich empfindlich auf Chemotherapeutika reagieren. ⓘ
Auch die Zellen des Immunsystems tragen entscheidend zur antitumoralen Wirkung der Chemotherapie bei. So können beispielsweise die Chemotherapeutika Oxaliplatin und Cyclophosphamid das Absterben von Tumorzellen in einer Weise bewirken, die vom Immunsystem nachweisbar ist (sogenannter immunogener Zelltod), wodurch Immunzellen mit Antitumorfunktionen mobilisiert werden. Chemotherapeutika, die den immunogenen Zelltod von Krebszellen verursachen, können unempfindliche Tumore für eine Immun-Checkpoint-Therapie empfindlich machen. ⓘ
Andere Anwendungen
Einige Chemotherapeutika werden auch bei anderen Krankheiten als Krebs eingesetzt, z. B. bei Autoimmunkrankheiten und nicht krebsbedingten Plasmazelldyskrasien. In einigen Fällen werden sie häufig in niedrigeren Dosen eingesetzt, was bedeutet, dass die Nebenwirkungen minimiert werden, während in anderen Fällen ähnliche Dosen wie bei der Krebsbehandlung verwendet werden. Methotrexat wird zur Behandlung von rheumatoider Arthritis (RA), Psoriasis, Spondylitis ankylosans und Multipler Sklerose eingesetzt. Man geht davon aus, dass die entzündungshemmende Wirkung bei RA auf die Erhöhung des Adenosinspiegels, der eine Immunsuppression bewirkt, die Beeinflussung der immunregulierenden Cyclooxygenase-2-Enzymwege, die Verringerung der proinflammatorischen Zytokine und die antiproliferativen Eigenschaften zurückzuführen ist. Obwohl Methotrexat zur Behandlung von Multipler Sklerose und Spondylitis ankylosans eingesetzt wird, ist seine Wirksamkeit bei diesen Krankheiten noch ungewiss. Cyclophosphamid wird manchmal zur Behandlung von Lupusnephritis, einem häufigen Symptom des systemischen Lupus erythematodes, eingesetzt. Dexamethason zusammen mit Bortezomib oder Melphalan wird häufig zur Behandlung der AL-Amyloidose eingesetzt. In jüngster Zeit hat sich auch Bortezomid in Kombination mit Cyclophosphamid und Dexamethason als vielversprechende Behandlung der AL-Amyloidose erwiesen. Andere zur Behandlung des Myeloms eingesetzte Medikamente wie Lenalidomid haben sich bei der Behandlung der AL-Amyloidose als vielversprechend erwiesen. ⓘ
Chemotherapeutische Medikamente werden auch in Konditionierungsschemata vor einer Knochenmarktransplantation (hämatopoetische Stammzelltransplantation) eingesetzt. Konditionierungsschemata werden eingesetzt, um das Immunsystem des Empfängers zu unterdrücken, damit das Transplantat einwachsen kann. Cyclophosphamid ist ein gängiges zytotoxisches Medikament, das auf diese Weise eingesetzt wird, und wird häufig in Verbindung mit einer Ganzkörperbestrahlung verwendet. Chemotherapeutische Medikamente können in hohen Dosen verwendet werden, um die Knochenmarkzellen des Empfängers dauerhaft zu entfernen (myeloablative Konditionierung), oder in niedrigeren Dosen, die einen dauerhaften Verlust des Knochenmarks verhindern (nicht-myeloablative Konditionierung und Konditionierung mit reduzierter Intensität). Bei der Behandlung von Nicht-Krebs-Patienten wird die Behandlung immer noch als "Chemotherapie" bezeichnet und häufig in denselben Behandlungszentren durchgeführt, die auch für Krebspatienten verwendet werden. ⓘ
Berufliche Exposition und sichere Handhabung
In den 1970er Jahren wurden antineoplastische (Chemotherapie-)Medikamente als gefährlich eingestuft, und die American Society of Health-System Pharmacists (ASHP) hat seither das Konzept der gefährlichen Medikamente eingeführt, nachdem sie 1983 eine Empfehlung zum Umgang mit gefährlichen Medikamenten veröffentlicht hatte. Die Anpassung der Bundesvorschriften erfolgte, als die U.S. Occupational Safety and Health Administration (OSHA) ihre Richtlinien erstmals 1986 veröffentlichte und dann 1996, 1999 und zuletzt 2006 aktualisierte. ⓘ
Das National Institute for Occupational Safety and Health (NIOSH) führt seither eine Bewertung dieser Medikamente am Arbeitsplatz durch. Die berufsbedingte Exposition gegenüber antineoplastischen Arzneimitteln wurde mit zahlreichen gesundheitlichen Auswirkungen in Verbindung gebracht, darunter Unfruchtbarkeit und mögliche krebserregende Wirkungen. Der NIOSH-Alarmbericht enthält einige Fälle, wie den Fall einer Apothekerin, bei der ein papilläres Übergangszellkarzinom diagnostiziert wurde. Zwölf Jahre vor der Diagnose hatte die Apothekerin 20 Monate lang in einem Krankenhaus gearbeitet, wo sie für die Zubereitung mehrerer antineoplastischer Medikamente zuständig war. Die Apothekerin wies keine anderen Risikofaktoren für Krebs auf, so dass ihre Krebserkrankung auf die Exposition gegenüber den antineoplastischen Arzneimitteln zurückgeführt wurde, obwohl ein kausaler Zusammenhang in der Literatur nicht nachgewiesen wurde. In einem anderen Fall wurde vermutet, dass das Pflegepersonal durch eine Fehlfunktion in einem Biosicherheitsschrank mit antineoplastischen Arzneimitteln in Kontakt kam. Bei den Untersuchungen wurden zwei und neun Monate nach dieser Exposition genotoxische Biomarker nachgewiesen. ⓘ
Wege der Exposition
Antineoplastische Medikamente werden in der Regel intravenös, intramuskulär, intrathekal oder subkutan verabreicht. In den meisten Fällen müssen die Medikamente, bevor sie dem Patienten verabreicht werden, von mehreren Arbeitnehmern zubereitet und gehandhabt werden. Jeder Arbeitnehmer, der mit der Handhabung, Zubereitung oder Verabreichung der Medikamente oder mit der Reinigung von Gegenständen, die mit antineoplastischen Medikamenten in Kontakt gekommen sind, zu tun hat, ist potenziell gefährlichen Medikamenten ausgesetzt. Beschäftigte im Gesundheitswesen sind unter verschiedenen Umständen mit Arzneimitteln in Berührung gekommen, z. B. wenn Apotheker und Apothekenhelfer antineoplastische Arzneimittel zubereiten und handhaben und wenn Krankenschwestern und Ärzte die Arzneimittel an Patienten verabreichen. Darüber hinaus sind auch diejenigen, die für die Entsorgung von antineoplastischen Arzneimitteln in Gesundheitseinrichtungen zuständig sind, dem Risiko einer Exposition ausgesetzt. ⓘ
Man geht davon aus, dass die Exposition über die Haut der wichtigste Expositionsweg ist, da erhebliche Mengen der antineoplastischen Wirkstoffe in den Handschuhen gefunden wurden, die von den Beschäftigten im Gesundheitswesen getragen werden, die die Wirkstoffe vorbereiten, handhaben und verabreichen. Ein weiterer bemerkenswerter Expositionsweg ist die Inhalation der Dämpfe der Arzneimittel. In mehreren Studien wurde die Inhalation als Expositionsweg untersucht, und obwohl bei Luftproben keine gefährlichen Werte festgestellt wurden, ist dies dennoch ein möglicher Expositionsweg. Die Einnahme von Hand zu Mund ist ein Expositionsweg, der aufgrund der strengen Hygienestandards in den Gesundheitseinrichtungen weniger wahrscheinlich ist als andere. Dennoch ist dies ein möglicher Expositionsweg, insbesondere am Arbeitsplatz außerhalb eines Gesundheitsinstituts. Man kann diesen gefährlichen Drogen auch durch Injektionen mit Nadelstichen ausgesetzt sein. Die in diesem Bereich durchgeführten Forschungen haben ergeben, dass eine berufsbedingte Exposition vorliegt, indem sie Beweise in mehreren Urinproben von Beschäftigten des Gesundheitswesens untersucht haben. ⓘ
Gefahren
Gefährliche Arzneimittel setzen Beschäftigte im Gesundheitswesen ernsthaften Gesundheitsrisiken aus. Viele Studien zeigen, dass antineoplastische Medikamente zahlreiche Nebenwirkungen auf das Fortpflanzungssystem haben können, wie z. B. Fötusverlust, angeborene Missbildungen und Unfruchtbarkeit. Beschäftigte im Gesundheitswesen, die antineoplastischen Arzneimitteln ausgesetzt sind, haben häufig negative Auswirkungen auf die Fortpflanzung wie Spontanaborte, Totgeburten und angeborene Missbildungen. Außerdem haben Studien gezeigt, dass die Exposition gegenüber diesen Medikamenten zu Unregelmäßigkeiten im Menstruationszyklus führt. Antineoplastische Medikamente können auch das Risiko von Lernbehinderungen bei Kindern von Beschäftigten im Gesundheitswesen erhöhen, die diesen gefährlichen Substanzen ausgesetzt sind. ⓘ
Außerdem haben diese Medikamente krebserregende Wirkungen. In den letzten fünf Jahrzehnten haben mehrere Studien die krebserregenden Auswirkungen der Exposition gegenüber antineoplastischen Medikamenten gezeigt. Ebenso gab es Forschungsstudien, die einen Zusammenhang zwischen Alkylierungsmitteln und der Entwicklung von Leukämie beim Menschen herstellten. Studien berichteten über ein erhöhtes Risiko für Brustkrebs, Hautkrebs (ohne Melanom) und Krebs des Enddarms bei Krankenschwestern, die diesen Medikamenten ausgesetzt sind. Andere Untersuchungen ergaben, dass antineoplastische Medikamente eine potenziell genotoxische Wirkung auf Beschäftigte im Gesundheitswesen haben. ⓘ
Sicherer Umgang in der Gesundheitsversorgung
Im Jahr 2018 gab es keine Grenzwerte für die berufliche Exposition gegenüber antineoplastischen Arzneimitteln, d. h. die OSHA oder die American Conference of Governmental Industrial Hygienists (ACGIH) haben keine Richtlinien für die Sicherheit am Arbeitsplatz festgelegt. ⓘ
Vorbereitung
NIOSH empfiehlt die Verwendung eines belüfteten Schranks, der so konzipiert ist, dass die Exposition der Mitarbeiter verringert wird. Darüber hinaus empfiehlt sie die Schulung des gesamten Personals, die Verwendung von Schränken, die Durchführung einer ersten Bewertung der Technik des Sicherheitsprogramms und das Tragen von Schutzhandschuhen und Kitteln beim Öffnen von Arzneimittelverpackungen, beim Umgang mit Fläschchen oder bei der Etikettierung. Wenn persönliche Schutzausrüstung getragen wird, sollten die Handschuhe vor dem Gebrauch auf physische Defekte untersucht werden und immer doppelte Handschuhe und Schutzkittel getragen werden. Die Mitarbeiter des Gesundheitswesens sind außerdem verpflichtet, sich vor und nach der Arbeit mit antineoplastischen Arzneimitteln die Hände mit Wasser und Seife zu waschen, die Handschuhe alle 30 Minuten oder bei Durchstichen zu wechseln und sie sofort in einem Abfallbehälter für Chemotherapie zu entsorgen. ⓘ
Die verwendeten Kittel sollten Einwegkittel aus polyethylenbeschichtetem Polypropylen sein. Beim Tragen der Kittel sollten die Personen darauf achten, dass die Kittel geschlossen sind und lange Ärmel haben. Nach der Zubereitung sollte das Endprodukt vollständig in einem Plastikbeutel versiegelt werden. ⓘ
Die Mitarbeiter des Gesundheitswesens sollten auch alle Abfallbehälter im Inneren des belüfteten Schrankes abwischen, bevor sie sie aus dem Schrank nehmen. Schließlich sollte das Personal alle Schutzkleidung ablegen und in einen Beutel stecken, um sie innerhalb des belüfteten Schrankes zu entsorgen. ⓘ
Verwaltung
Die Verabreichung von Arzneimitteln sollte nur unter Verwendung von medizinischen Schutzvorrichtungen wie Nadellisten und geschlossenen Systemen sowie Techniken wie dem Vorfüllen von Infusionsschläuchen durch Apothekenpersonal in einem belüfteten Schrank erfolgen. Das Personal sollte beim Öffnen des Außenbeutels und beim Zusammenbau des Verabreichungssystems zur Verabreichung des Medikaments an den Patienten sowie bei der Entsorgung aller bei der Verabreichung der Medikamente verwendeten Materialien stets persönliche Schutzausrüstung wie doppelte Handschuhe, Schutzbrillen und Schutzkittel tragen. ⓘ
Krankenhausmitarbeiter sollten niemals Schläuche aus einem Infusionsbeutel entfernen, der ein antineoplastisches Medikament enthält, und beim Trennen der Schläuche im System darauf achten, dass die Schläuche gründlich gespült wurden. Nach dem Entfernen des Infusionsbeutels sollten die Mitarbeiter diesen zusammen mit anderen Einwegartikeln bei geschlossenem Deckel direkt in den gelben Chemotherapie-Abfallbehälter legen. Die Schutzausrüstung sollte entfernt und in einen Einweg-Chemotherapie-Abfallbehälter gelegt werden. Danach sollten die Chemotherapieabfälle doppelt verpackt werden, bevor oder nachdem die Innenhandschuhe ausgezogen werden. Außerdem muss man sich immer die Hände mit Wasser und Seife waschen, bevor man den Ort der Medikamentenverabreichung verlässt. ⓘ
Mitarbeiterschulung
Alle Mitarbeiter, die in Einrichtungen des Gesundheitswesens mit gefährlichen Arzneimitteln in Berührung kommen, müssen eine Schulung erhalten. Zu den zu schulenden Personen gehören Versand- und Empfangspersonal, Hausmeister, Apotheker, Assistenten und alle Personen, die mit dem Transport und der Lagerung von antineoplastischen Arzneimitteln zu tun haben. Diese Personen sollten Informationen und Schulungen erhalten, um sie über die Gefahren der in ihren Arbeitsbereichen vorhandenen Arzneimittel zu informieren. Sie sollten über die Abläufe und Verfahren in ihren Arbeitsbereichen informiert und geschult werden, bei denen sie auf Gefahren stoßen können, sowie über die verschiedenen Methoden, mit denen das Vorhandensein von gefährlichen Arzneimitteln festgestellt werden kann, und darüber, wie die Gefahren freigesetzt werden, sowie über die physischen und gesundheitlichen Gefahren der Arzneimittel, einschließlich ihres reproduktiven und karzinogenen Gefahrenpotenzials. Darüber hinaus sollten sie über die Maßnahmen informiert und geschult werden, die sie ergreifen sollten, um diese Gefahren zu vermeiden und sich vor ihnen zu schützen. Diese Informationen sollten bereitgestellt werden, wenn die Beschäftigten des Gesundheitswesens mit den Arzneimitteln in Kontakt kommen, d. h. wenn sie zum ersten Mal in einem Arbeitsbereich mit gefährlichen Arzneimitteln tätig werden. Darüber hinaus sollten auch Schulungen durchgeführt werden, wenn neue Gefahren auftauchen oder wenn neue Arzneimittel, Verfahren oder Geräte eingeführt werden. ⓘ
Haushaltsführung und Abfallentsorgung
Bei der Reinigung und Dekontaminierung des Arbeitsbereichs, in dem antineoplastische Arzneimittel verwendet werden, ist auf eine ausreichende Belüftung zu achten, um den Aufbau von luftgetragenen Arzneimittelkonzentrationen zu verhindern. Bei der Reinigung der Arbeitsfläche sollten die Krankenhausmitarbeiter vor und nach jeder Tätigkeit sowie am Ende ihrer Schicht Deaktivierungs- und Reinigungsmittel verwenden. Die Reinigung sollte immer mit doppelten Schutzhandschuhen und Einwegkitteln durchgeführt werden. Nach Beendigung der Reinigungsarbeiten sollten die Mitarbeiter mit Schutzhandschuhen die bei der Tätigkeit verwendeten Gegenstände in einem gelben Abfallbehälter für Chemotherapie entsorgen. Nach dem Ausziehen der Handschuhe sollten sie sich gründlich die Hände mit Wasser und Seife waschen. Alles, was mit den antineoplastischen Arzneimitteln in Berührung gekommen ist oder Spuren davon aufweist, wie z. B. Nadeln, leere Fläschchen, Spritzen, Kittel und Handschuhe, sollte in den Chemotherapie-Abfallbehälter gegeben werden. ⓘ
Kontrolle von Verschüttungen
Für den Fall, dass antineoplastische Mittel verschüttet werden, muss eine schriftliche Strategie vorliegen. Darin sollte auf die Möglichkeit von Verschüttungen unterschiedlicher Größe eingegangen werden sowie auf die für jede Größe erforderliche Vorgehensweise und persönliche Schutzausrüstung. Ein geschulter Mitarbeiter sollte sich um einen größeren Verschüttungsfall kümmern und alle Reinigungsmaterialien stets gemäß den EPA-Vorschriften in den Chemieabfallbehälter entsorgen, nicht in einen gelben Chemotherapieabfallbehälter. ⓘ
Berufliche Überwachung
Es muss ein medizinisches Überwachungsprogramm eingerichtet werden. Im Falle einer Exposition müssen die Arbeitsmediziner eine detaillierte Anamnese erheben und eine gründliche körperliche Untersuchung durchführen. Sie sollten den Urin des potenziell exponierten Arbeitnehmers mit einem Urintest oder einer mikroskopischen Untersuchung vor allem auf Blut untersuchen, da mehrere antineoplastische Medikamente bekanntermaßen Blasenschäden verursachen können. ⓘ
Die Mutagenität im Urin ist ein Marker für die Exposition gegenüber antineoplastischen Arzneimitteln, der erstmals 1979 von Falck und Kollegen eingesetzt wurde und bakterielle Mutagenitätstests verwendet. Der Test ist nicht nur unspezifisch, sondern kann auch durch äußere Faktoren wie Nahrungsaufnahme und Rauchen beeinflusst werden und wird daher nur sparsam eingesetzt. Der Test spielte jedoch eine wichtige Rolle bei der Umstellung von horizontalen auf vertikale Sicherheitswerkbänke bei der Herstellung von antineoplastischen Arzneimitteln, da die Mitarbeiter des Gesundheitswesens bei der Herstellung von Arzneimitteln hohen Konzentrationen ausgesetzt waren. Dadurch wurde der Umgang mit Arzneimitteln geändert und die Exposition der Arbeitnehmer gegenüber antineoplastischen Arzneimitteln wirksam verringert. ⓘ
Zu den Biomarkern für die Exposition gegenüber antineoplastischen Arzneimitteln gehören in der Regel Platin im Urin, Methotrexat, Cyclophosphamid und Ifosfamid im Urin sowie 5-Fluorouracil-Metaboliten im Urin. Darüber hinaus gibt es noch andere Medikamente, die zur direkten Messung der Medikamente im Urin verwendet werden, obwohl sie nur selten eingesetzt werden. Eine Messung dieser Arzneimittel direkt im Urin ist ein Zeichen für eine hohe Exposition und dafür, dass die Arzneimittel entweder durch Inhalation oder über die Haut aufgenommen werden. ⓘ
Verfügbare Wirkstoffe
Es gibt eine umfangreiche Liste antineoplastischer Wirkstoffe. Es gibt mehrere Klassifizierungsschemata, mit denen die Krebsmedikamente in verschiedene Typen eingeteilt werden. ⓘ
Geschichte
Zu Beginn des 20. Jahrhunderts wurden erstmals niedermolekulare Medikamente zur Behandlung von Krebs eingesetzt, obwohl die zuerst verwendeten Chemikalien ursprünglich nicht für diesen Zweck bestimmt waren. Senfgas wurde im Ersten Weltkrieg als chemischer Kampfstoff eingesetzt und erwies sich als starker Unterdrücker der Hämatopoese (Blutbildung). Eine ähnliche Familie von Verbindungen, die als Stickstoffsenf bekannt sind, wurde während des Zweiten Weltkriegs an der Yale School of Medicine weiter untersucht. Es wurde vermutet, dass ein Mittel, das die schnell wachsenden weißen Blutkörperchen schädigt, eine ähnliche Wirkung auf Krebs haben könnte. Im Dezember 1942 wurde daher mehreren Menschen mit fortgeschrittenen Lymphomen (Krebserkrankungen des Lymphsystems und der Lymphknoten) das Mittel über eine Vene verabreicht, anstatt das Reizgas einzuatmen. Ihre Besserung, wenn auch nur vorübergehend, war bemerkenswert. Gleichzeitig wurden während einer Militäroperation im Zweiten Weltkrieg nach einem deutschen Luftangriff auf den italienischen Hafen von Bari mehrere hundert Menschen versehentlich Senfgas ausgesetzt, das von den Alliierten dorthin transportiert worden war, um sich auf mögliche Vergeltungsmaßnahmen im Falle eines deutschen Einsatzes chemischer Kampfstoffe vorzubereiten. Bei den Überlebenden wurde später eine sehr niedrige Anzahl weißer Blutkörperchen festgestellt. Nach dem Ende des Zweiten Weltkriegs und der Freigabe der Berichte stimmten die Erfahrungen überein und veranlassten die Forscher, nach anderen Substanzen zu suchen, die eine ähnliche Wirkung gegen Krebs haben könnten. Das erste Chemotherapeutikum, das auf der Grundlage dieser Forschungsarbeiten entwickelt wurde, war Mustin. Seitdem sind viele weitere Medikamente zur Behandlung von Krebs entwickelt worden, und die Arzneimittelentwicklung hat sich zu einer milliardenschweren Industrie entwickelt, obwohl die von den frühen Forschern entdeckten Grundsätze und Grenzen der Chemotherapie immer noch gelten. ⓘ
Der Begriff Chemotherapie

Der im 18. Jahrhundert erstmals aufgetauchte Begriff wurde 1906 von Paul Ehrlich neu definiert und geprägt. Er beschrieb damit die Behandlung von Infektionskrankheiten mit chemischen Substanzen, die direkt gegen den Krankheitserreger wirken. Als erstes wirksames Chemotherapeutikum hatte er 1904 Trypanrot erkannt, mit dem er an der Schlafkrankheit erkrankte Mäuse heilte. Ehrlich begann am 31. August 1909 in Frankfurt am Main weitere Versuche, indem er Erreger der Syphilis in Ratten injizierte und anschließend mit Hilfe chemotherapeutischer Verfahren behandelte. Diese Versuche hatten eine so überzeugende Wirkung, dass man hierin die neue „Waffe“ der Medizin gegen Infektionskrankheiten sah. Ehrlich wurde danach als „Schöpfer der Chemotherapie“ bezeichnet. Die verwendeten Medikamente werden entweder künstlich hergestellt oder sind Abkömmlinge von in der Natur vorkommenden Stoffen. ⓘ
Das Wort Chemotherapie ohne Modifikator bezieht sich in der Regel auf die Behandlung von Krebs, aber seine historische Bedeutung war weiter gefasst. Der Begriff wurde in den frühen 1900er Jahren von Paul Ehrlich geprägt und bezeichnet jede Verwendung von Chemikalien zur Behandlung einer Krankheit (Chemo- + -therapie), wie z. B. die Verwendung von Antibiotika (antibakterielle Chemotherapie). Ehrlich war nicht optimistisch, dass wirksame Chemotherapeutika für die Behandlung von Krebs gefunden werden würden. Das erste moderne Chemotherapeutikum war Arsphenamin, eine Arsenverbindung, die 1907 entdeckt und zur Behandlung der Syphilis eingesetzt wurde. Später folgten Sulfonamide (Sulfamittel) und Penicillin. Im heutigen Sprachgebrauch wird die Bedeutung "jede Behandlung von Krankheiten mit Arzneimitteln" oft mit dem Wort Pharmakotherapie ausgedrückt. ⓘ
Verkäufe
Die 10 umsatzstärksten Krebsmedikamente des Jahres 2013 (gemessen am Umsatz):
| Nr. | 2013 Weltweiter Umsatz | INN | Handelsnamen | Inhaber der Marktzulassung | Indikationen ⓘ |
|---|---|---|---|---|---|
| 1 | 7,78 Milliarden Dollar | Rituximab | Rituxan, MabThera | Roche, Pharmstandard | Non-Hodgkin-Lymphom, CLL |
| 2 | 6,75 Mrd. $ | Bevacizumab | Avastin | Roche | Dickdarm-, Lungen-, Eierstock- und Gehirnkrebs |
| 3 | 6,56 Milliarden Dollar | Trastuzumab | Herceptin | Roche | Brust-, Speiseröhren- und Magenkrebs |
| 4 | 4,69 Mrd. $ | Imatinib | Gleevec | Novartis | Leukämie, Magen-Darm-Krebs |
| 5 | 1,09 Mrd. Dollar | Lenalidomid | Revlimid | Celgene, Pharmstandard | Multiples Myelom, Mantelzell-Lymphom |
| 6 | 2,7 Milliarden Dollar | Pemetrexed | Alimta | Eli Lilly | Lungenkrebs |
| 7 | 2,6 Milliarden Dollar | Bortezomib | Velcade | Johnson & Johnson, Takeda, Pharmstandard | Multiples Myelom |
| 8 | 1,87 Milliarden Dollar | Cetuximab | Erbitux | Merck KGaA, Bristol-Myers Squibb | Dickdarm-, Kopf- und Halskrebs |
| 9 | 1,73 Mrd. Dollar | Leuprorelin | Lupron, Eligard | AbbVie und Takeda; Sanofi und Astellas Pharma | Prostata- und Eierstockkrebs |
| 10 | 1,7 Milliarden Dollar | Abirateron | Zytiga | Johnson & Johnson | Prostatakrebs |
Forschung

Gezielte Therapien
Spezielle zielgerichtete Verabreichungsvehikel zielen darauf ab, die Wirksamkeit der Chemotherapie für Tumorzellen zu erhöhen und gleichzeitig die Wirksamkeit für andere Zellen zu verringern. Dies soll zu einer erhöhten Tumorabtötung oder einer geringeren Toxizität oder beidem führen. ⓘ
Antikörper-Wirkstoff-Konjugate
Antikörper-Wirkstoff-Konjugate (ADCs) bestehen aus einem Antikörper, einem Wirkstoff und einem Linker zwischen diesen. Der Antikörper zielt auf ein bevorzugt exprimiertes Protein in den Tumorzellen (ein so genanntes Tumorantigen) oder auf Zellen, die der Tumor nutzen kann, wie z. B. Endothelzellen der Blutgefäße. Sie binden an das Tumorantigen und werden internalisiert, wobei der Linker den Wirkstoff in die Zelle freisetzt. Diese zielgerichteten Vehikel unterscheiden sich in ihrer Stabilität, Selektivität und der Wahl des Ziels, aber im Wesentlichen zielen sie alle darauf ab, die maximale wirksame Dosis zu erhöhen, die an die Tumorzellen abgegeben werden kann. Die geringere systemische Toxizität bedeutet, dass sie auch bei kränkeren Menschen eingesetzt werden können und dass sie neue Chemotherapeutika transportieren können, die bei herkömmlichen systemischen Ansätzen viel zu toxisch gewesen wären. ⓘ
Das erste zugelassene Medikament dieser Art war Gemtuzumab Ozogamicin (Mylotarg), das von Wyeth (jetzt Pfizer) herausgegeben wurde. Das Medikament wurde zur Behandlung der akuten myeloischen Leukämie zugelassen. Zwei weitere Medikamente, Trastuzumab Emtansin und Brentuximab Vedotin, befinden sich beide in der späten klinischen Erprobung, wobei letzteres eine beschleunigte Zulassung für die Behandlung des refraktären Hodgkin-Lymphoms und des systemischen anaplastischen großzelligen Lymphoms erhalten hat. ⓘ
Nanopartikel
Bei Nanopartikeln handelt es sich um 1-1000 Nanometer (nm) große Partikel, die die Selektivität von Tumoren fördern und bei der Verabreichung schwer löslicher Arzneimittel helfen können. Nanopartikel können passiv oder aktiv ausgerichtet werden. Beim passiven Targeting wird der Unterschied zwischen Tumorblutgefäßen und normalen Blutgefäßen ausgenutzt. Blutgefäße in Tumoren sind "undicht", da sie Lücken von 200 bis 2000 nm aufweisen, durch die Nanopartikel in den Tumor gelangen können. Beim aktiven Targeting werden biologische Moleküle (Antikörper, Proteine, DNA und Rezeptor-Liganden) verwendet, um die Nanopartikel bevorzugt auf die Tumorzellen zu richten. Es gibt viele Arten von Nanopartikelträgersystemen, z. B. Silika, Polymere, Liposomen und magnetische Partikel. Nanopartikel aus magnetischem Material können auch dazu verwendet werden, Wirkstoffe mit Hilfe eines von außen angelegten Magnetfeldes an Tumorstellen zu konzentrieren. Sie haben sich als nützliches Vehikel für die magnetische Verabreichung schwer löslicher Wirkstoffe wie Paclitaxel erwiesen. ⓘ
Elektrochemotherapie
Bei der Elektrochemotherapie handelt es sich um eine kombinierte Behandlung, bei der nach der Injektion eines Chemotherapeutikums elektrische Hochspannungsimpulse lokal auf den Tumor angewendet werden. Die Behandlung ermöglicht es den Chemotherapeutika, die sonst die Zellmembran nicht oder nur schwer durchdringen können (z. B. Bleomycin und Cisplatin), in die Krebszellen einzudringen. Dadurch wird eine größere Wirksamkeit der Antitumorbehandlung erreicht. ⓘ
Die klinische Elektrochemotherapie wurde erfolgreich zur Behandlung von kutanen und subkutanen Tumoren eingesetzt, unabhängig von deren histologischem Ursprung. In allen Berichten über den klinischen Einsatz der Elektrochemotherapie wird die Methode als sicher, einfach und hochwirksam beschrieben. Im Rahmen des ESOPE-Projekts (European Standard Operating Procedures of Electrochemotherapy) wurden die Standard Operating Procedures (SOP) für die Elektrochemotherapie auf der Grundlage der Erfahrungen der führenden europäischen Krebszentren mit der Elektrochemotherapie erarbeitet. In jüngster Zeit wurden neue Modalitäten der Elektrochemotherapie für die Behandlung interner Tumoren entwickelt, bei denen chirurgische Verfahren, endoskopische oder perkutane Zugänge zum Behandlungsgebiet verwendet werden. ⓘ
Hyperthermie-Therapie
Bei der Hyperthermie-Therapie handelt es sich um eine Wärmebehandlung bei Krebs, die in Kombination mit Chemotherapie (Thermochemotherapie) oder Bestrahlung ein wirksames Mittel zur Bekämpfung einer Vielzahl von Krebsarten sein kann. Die Wärme kann lokal an der Tumorstelle angewendet werden, wodurch sich die Blutgefäße zum Tumor erweitern und mehr Chemotherapeutika in den Tumor gelangen können. Außerdem wird die Membran der Tumorzellen poröser, so dass mehr Chemotherapeutika in die Tumorzellen gelangen können. ⓘ
Hyperthermie kann nachweislich auch dazu beitragen, eine "Chemo-Resistenz" zu verhindern oder umzukehren. Chemotherapieresistenz entwickelt sich manchmal im Laufe der Zeit, wenn sich die Tumore anpassen und die Toxizität der Chemomedikamente überwinden können. "Die Überwindung der Chemoresistenz wurde in der Vergangenheit ausgiebig untersucht, insbesondere mit CDDP-resistenten Zellen. Im Hinblick auf den potenziellen Nutzen, dass arzneimittelresistente Zellen durch die Kombination von Chemotherapie und Hyperthermie für eine wirksame Therapie rekrutiert werden können, war es wichtig zu zeigen, dass die Chemoresistenz gegen mehrere Krebsmedikamente (z. B. Mitomycin C, Anthracycline, BCNU, Melphalan), einschließlich CDDP, durch die Zugabe von Wärme zumindest teilweise aufgehoben werden kann. ⓘ
Andere Tiere
Die Chemotherapie wird in der Veterinärmedizin ähnlich wie in der Humanmedizin eingesetzt. ⓘ
Sensitivität
Das Ansprechen einer Chemotherapie hängt von verschiedenen Faktoren ab. Erstens wird ein Chemotherapeutikum unterschiedlich schnell im Menschen abgebaut, und je kürzer das Medikament im Körper wirksam beziehungsweise präsent ist, desto kürzer kann es auch nur wirken. Zweitens ist die Erreichbarkeit der krankheitsverursachenden Zellen oder Mikroorganismen ein wichtiger Faktor. So kann ein Tumor sehr kompakt geformt sein und über wenig Blutversorgung verfügen. Daraus resultiert, dass das Medikament den eigentlichen Wirkort nicht oder nur schlecht erreichen kann. Ein dritter Faktor bestimmt das Ansprechverhalten von Chemotherapeutika. Zum Beispiel können auch bei guter Erreichbarkeit des Tumors durch das Zytostatikum die Krebszellen resistent gegen das Medikament sein. Diese Eigenschaften werden als Chemosensitivität und Chemoresistenz bezeichnet. ⓘ
Es ist möglich, die Wirksamkeit von Chemotherapeutika auf Bakterien im Rahmen eines Antibiogramms zu testen. Ebenso kann bei Krebszellen die Chemosensitivität in vitro getestet werden (Chemosensitivitätstest). ⓘ
Prinzipien der antineoplastischen Chemotherapie
Anwendungsgebiete
- Eine örtliche Behandlung reicht bei soliden Tumoren (d. h. fest, im Gegensatz z. B. zu Leukämien) nicht mehr aus, wenn bereits Metastasen nachweisbar sind.
- Leukämien und maligne Lymphome breiten sich oft von Anfang an über mehrere Körpergebiete aus. Dann ist in jedem Fall eine systemische Abgabe von Zytostatika notwendig.
- Eine adjuvante (= ergänzende, helfende) Zytostatikagabe wird vor oder nach der chirurgischen Entfernung eines Tumors auch ohne Nachweis von Metastasen gegeben, wenn das Rückfallrisiko erfahrungsgemäß hoch ist. ⓘ
Gegenanzeigen
Kontraindikationen für eine antineoplastische Chemotherapie können vorliegen, wenn
- der Tumor durch eine Operation oder Bestrahlung komplett und mit großer Wahrscheinlichkeit kurativ entfernt werden kann,
- die Abwägung ergibt, dass die zu erwartenden Nebenwirkungen der Behandlung schwerer sind als der zu erwartende Verlauf des Tumorleidens ohne Chemotherapie,
- der Allgemeinzustand des Patienten oder die Funktion wesentlicher Organe zu weit eingeschränkt sind. ⓘ
Beispiele für Krebserkrankungen, bei denen eine Chemotherapie zu einer dauerhaften Heilung führen kann:
- Brustkrebs ohne Fernmetastasen
- Chorionkarzinom der Frau
- Hodentumore
- akute Leukämien
- malignes Lymphom
- Morbus Hodgkin
- Tumoren bei Kindern, auch mit Metastasen. ⓘ
Wahl des Chemotherapeutikums
Die Wahl des Chemotherapeutikums richtet sich nicht nur nach dem Organ der Krebserkrankung (z. B. Brust-, Lungen-, Darmkrebs), sondern auch nach individuellen Kriterien, die bei verschiedenen Patienten mit „derselben“ Krebserkrankung unterschiedlich sein können. Solche Kriterien können beispielsweise sein:
- der Gewebstyp der Tumorzellen (z. B. kleinzellig, Plattenepithel, Drüsenepithel etc.)
- Rezeptoren, die die Tumorzellen tragen (bspw. HER2/neu)
- bestimmte Mutationen im Erbgut der Tumorzellen (bspw. KRAS, siehe auch Onkogene)
- die anfängliche Wirksamkeit der begonnenen Therapie
- andere Erkrankungen des Patienten
- die allgemeine Verfassung des Patienten ⓘ
Trotz dieser individuellen Gesichtspunkte können für maligne Erkrankungen typische Chemotherapeutika genannt werden, die bei diesen regelhaft zum Einsatz kommen. ⓘ
| Krebserkrankung | typisches Chemotherapeutikum oder Chemotherapie-Schema |
zusätzliche medikamentöse Therapie ⓘ |
|---|---|---|
| Darmkrebs | FOLFIRI, FOLFOX oder XELOX |
Bevacizumab, Cetuximab |
| Brustkrebs | 5-Fluoruracil + Anthracyclin + Cyclophosphamid evtl. Capecitabin |
Trastuzumab bei HER2-positiven Tumoren Tamoxifen Lapatinib Sunitinib Eribulin Everolimus |
| Leberzellkarzinom | 5-Fluoruracil + Folinsäure |
Sorafenib |
Therapieschemata
Heutzutage werden bei der Chemotherapie fast immer (abgesehen von möglicherweise nebenwirkungsärmeren Monotherapien bei der palliativen zytostatischen Chemotherapie) mehrere Wirkstoffe kombiniert. Dazu wurden Schemata entwickelt, in denen festgelegt ist, welche Wirkstoffe in welcher Abfolge und mit welchem Zeitabstand anzuwenden sind, um eine optimale Wirkung zu erzielen. Aus den Namen der beteiligten Wirkstoffe wird der Name des Schemas (meist als Akronym) abgeleitet:
- ABVD
- BEACOPP
- CMF (Cyclophosphamid, Methotrexat, 5-Fluoruracil)
- CHOP
- COPP
- CVI (Cyclophosphamid, Vincristin, Prednisolon)
- ECF (Epirubicin, Cisplatin, 5-Fluoruracil)
- FLP (5-Fluoruracil, Folinsäure (=Leucovorin), Cisplatin)
- FOLFIRI ist eine wöchentlich durchzuführende mittelgradig komplexe Chemotherapie mit folgenden Wirkstoffen:
- Folinsäure
- Fluorouracil als Bolus und anschließend als 24-Stunden-Infusion
- Irinotecan (wesentliche Nebenwirkung: cholinerges Syndrom)
- FOLFOX ist eine 14-täglich durchzuführende mittelgradig komplexe Chemotherapie mit folgenden Wirkstoffen:
- Folinsäure
- Fluorouracil als „Bolus“ und anschließend als 48-Stunden-Infusion.
- Oxaliplatin (wesentliche Nebenwirkung: Kribbelparästhesien; daher ist eine Magnesium- und Calciuminfusion indiziert)
- 5FUFS (5-Fluoruracil, Folinsäure)
- MCF (Mitomycin C, Cisplatin, 5-Fluoruracil)
- MTX (Methotrexat), in geringerer Dosierung auch gegen Autoimmunkrankheiten, z. B. Psoriasis
- PEB (Cisplatin, Etoposid, Bleomycin)
- PCV (Procarbazin, Lomustin, Vincristin)
- VAC beim Ewingsarkom
- TAC (Docetaxel, Adriamycin, Cyclophosphamid) ist ein dreiwöchentlicher Chemotherapiezyklus als Drei-Stunden-Infusion
- TEC (Docetaxel, Epirubicin, Cyclophosphamid)
- XELOX ist ein dreiwöchentlicher Chemotherapiezyklus bestehend aus folgenden Wirkstoffen:
- Capecitabin (oral, wesentliche Nebenwirkung: Hand-Fuß-Syndrom)
- Oxaliplatin ⓘ
Nebenwirkungen
Die Nebenwirkungen einer Chemotherapie sind abhängig von der Art der Therapie und der individuellen Verträglichkeit. Die einzelnen Nebenwirkungen treten unabhängig voneinander auf und können ganz ausbleiben oder in verschiedener Stärke (von mild bis tödlich) auftreten. ⓘ
Diese Nebenwirkungen sind Übelkeit und Erbrechen, Erschöpfung, Haarausfall, Geschmacksstörungen, Schleimhautentzündungen und Blutbildveränderungen. Sie werden nach den Common Toxicity Criteria eingeteilt. ⓘ
Viele Zytostatika sind selbst karzinogen, etwa Busulfan, Chlorambucil, Cyclophosphamid oder Semustin. Insgesamt ist die Rate an zytostatikainduzierten Leukämien zwar rückläufig, aber bei einigen Tumorarten steigt die Zahl der Erkrankungen immer noch an. Darunter fällt das Multiple Myelom, das Non-Hodgkin-Lymphom, Ösophaguskarzinom, Analkarzinom, Zervixkarzinom und Prostatakarzinom. Während bei den ersten beiden auch nach einem Jahrzehnt nach der Chemotherapie eine therapiebedingte akute myeloische Leukämie (tAML) auftreten kann, ist sie bei den übrigen Karzinomen auf die ersten zehn Jahre nach der Behandlung beschränkt. ⓘ
Bis zu drei Viertel der Tumorpatienten mit einer Chemotherapie erkranken an einer chemotherapieassoziierten Anämie. Ein hohes Risiko besteht vor allem bei Tumorentitäten wie dem Lymphom, multiplem Myelom, Bronchialkarzinom sowie bei gynäkologischen und urogenitalen Tumoren. Häufigkeit und Schweregrad der Anämie sind auch vom Tumorstadium abhängig. Während die nach den Common Toxicity Criteria aufgelisteten Nebenwirkungen meist mit dem Absetzen der Chemotherapie verschwinden, kann es unter Umständen zu einer irreversiblen Herzmuskelschädigung sowie zu einer temporären oder endgültigen Unfruchtbarkeit kommen. Die Gabe von Anthracyclinen führt bei etwa zehn Prozent der Patienten zu einer bleibenden Schädigung der Herzmuskelzellen, welche Herzrhythmusstörungen und/oder eine Herzinsuffizienz (Herzschwäche) auslösen kann. Seit 2007 sind sogenannte Kardioprotektiva zugelassen, welche Herzschäden durch die Gabe der Anthracycline Doxorubicin oder Epirubicin verhindern können. ⓘ
Wegen einer etwaigen durch die Chemotherapie bedingten Unfruchtbarkeit wird vor der Behandlung bei Männern, falls vom Patienten gewünscht, eine Aufbewahrung des Samens (ähnlich wie es bei Samenspendern praktiziert wird) vorgenommen. Durch die fachgerechte Lagerung wird dann die Chance auf eigene Kinder erhalten. Fertilitätserhaltende Maßnahmen bei Frauen sind möglich, tragen jedoch zum Teil noch experimentellen Charakter. Das Netzwerk Fertiprotekt bemüht sich im deutschsprachigen Raum, über Maßnahmen bei Männern und Frauen zu informieren und sie anzubieten. ⓘ
Manche Patienten erleben nach einer Chemotherapie eine meist vorübergehende Beeinträchtigung des Denk-, Merk- und Stressbewältigungsvermögens, die als Post-chemotherapy Cognitive Impairment (PCCI) (auch Chemotherapy-induced Cognitive Dysfunction oder „Chemo Brain“) bezeichnet wird. Die Ursache dieses Phänomens wird derzeit erforscht. Sie kann nach gegenwärtigem Forschungsstand entweder in der psychisch belastenden, traumaähnlichen Situation der Diagnose und Krankheit selbst, in den direkten physischen Auswirkungen der Chemotherapie oder in beiden Faktoren liegen. ⓘ
Zur Vorbeugung einer ausgeprägten Mukositis können mehrere Lokalanästhesien mit Vasokonstriktor im Mund-/Kieferbereich verabreicht werden, wodurch eine Anflutung des Chemotherapeutikums in die Schleimhaut vermindert wird. Zusätzlich kann eine Kältetherapie mittels Lutschen von Eiswürfeln die lokale Vasokonstriktion bei der Strahlentherapie verstärken. Die dadurch erreichte Sauerstoffunterversorgung des Gewebes vermindert die zelluläre Strahlenempfindlichkeit. ⓘ
Neben den allseits bekannten Nebenwirkungen der Chemotherapie wie Haarverlust und Übelkeit kann es bei der Chemotherapie (oder Stammzelltransplantation) auch zu Blutungen kommen. Zu diesen haben Estcourt und Mitarbeiter in den Jahren 2012 und 2015 Cochrane-Übersichtsarbeiten mit randomisierten kontrollierten Studien erstellt, um herauszufinden, welche Nutzung von Thrombozytentransfusionen die wirksamste ist, um Blutungen bei Patienten mit hämatologischen Erkrankungen zu verhindern, wenn sie eine Chemotherapie oder eine Stammzelltransplantation erhalten. ⓘ
Vielfach wurde eine Steigerung der Verträglichkeit bzw. Reduzierung der Nebenwirkungen durch kurzzeitiges Fasten in den Tagen der Therapie sowohl beim Menschen als auch bei Tieren (in Tierversuchen) beobachtet. ⓘ