Histologie

Die Histologie (von altgriechisch ἱστός histos, deutsch ‚Gewebe‘ und -logie, griechisch λόγος logos „Lehre“) oder Gewebelehre ist die Wissenschaft von den biologischen Geweben. Als „Lehre von Bildung und Struktur pflanzlicher und tierischer Gewebe in Bezug auf spezifische Funktionen“ ist sie ein Teilgebiet der Medizin und der Biologie. Im weiteren Sinn bezeichnet Histologie die mikroskopische Anatomie. Die Histopathologie ist die Wissenschaft von den krankhaften Gewebeveränderungen. ⓘ
In der Histologie werden Gewebeproben untersucht. Dazu werden mikrometerdünne, gefärbte Gewebsschnitte hergestellt und am Lichtmikroskop beurteilt. Die elektronenmikroskopische Untersuchung von wesentlich dünneren Schnitten (0,01–0,5 µm) fällt vorwiegend in den Forschungsbereich. ⓘ
Die feingeweblichen Untersuchungen in der Medizin dienen verschiedenen Zwecken: Frühdiagnose von Tumoren (z. B. Magenbiopsie), Klassifizierung von Tumoren (gutartig/bösartig), Nachweis von Stoffwechselerkrankungen und parasitären, bakteriellen, entzündlichen Erkrankungen, Hilfe zur Therapiewahl und vieles mehr. Man spricht von morphologischer Diagnostik, da der Befund anhand des Erscheinungsbildes und des färberischen Verhaltens der Gewebestrukturen erstellt wird. ⓘ
Zum Probengut beim histologischen Arbeiten gehören Operationspräparate (z. B. Magen, Darm, Niere), Probeexzisionen (z. B. Muttermal, Sehnen, Zysten) und Biopsien (z. B. Magen-, Darm-, Brustgewebe-Biopsien). Mit Hilfe der modernen Technik lassen sich schon an winzigen Gewebestückchen (1–2 mm) feingewebliche Diagnosen erstellen. Diese mikroinvasiven Methoden sind für die Patienten schonend und werden oft bei Vorsorgeuntersuchungen durchgeführt. ⓘ


Biologische Gewebe
Einteilung der tierischen Gewebe
Es gibt vier grundlegende Arten von tierischem Gewebe: Muskelgewebe, Nervengewebe, Bindegewebe und Epithelgewebe. Alle tierischen Gewebe werden als Subtypen dieser vier Hauptgewebetypen betrachtet (Blut wird beispielsweise als Bindegewebe eingestuft, da die Blutzellen in einer extrazellulären Matrix, dem Plasma, suspendiert sind).
- Epithel
- Einfaches Epithel
- Einfaches Plattenepithel
- Einfaches quaderförmiges Epithel
- Einfaches säulenförmiges Epithel
- Pseudostratifiziertes säulenförmiges Epithel
- Geschichtetes Epithel
- Geschichtetes Plattenepithel
- Geschichtetes quaderförmiges Epithel
- Geschichtetes Säulenepithel
- Transitionelles Epithel
- Vielzellige Drüsen
- Einfaches Epithel
- Muskelgewebe
- Glatter Muskel
- Skelettmuskel
- Herzmuskel
- Bindegewebe
- Allgemeines Bindegewebe
- Lockeres Bindegewebe
- Dichtes Bindegewebe
- Spezielles Bindegewebe
- Knorpel
- Knochen
- Hämatopoetisch
- Blut
- Lymphe
- Allgemeines Bindegewebe
- Nervöses Gewebe
- Zentrales Nervensystem
- Peripheres Nervensystem
- Spezielle Rezeptoren ⓘ
- Binde- und Stützgewebe
- Bindegewebe
- Fettgewebe
- Knochengewebe
- Knorpelgewebe
- Epithelgewebe
- Muskelgewebe
- Nervengewebe ⓘ
Klassifizierung von Pflanzengewebe

Die Untersuchung der Gewebe von Pflanzen fällt in den Bereich der Pflanzenanatomie, wobei die folgenden vier Haupttypen unterschieden werden:
- Dermales Gewebe
- Gefäßgewebe
- Bodengewebe
- Meristematisches Gewebe ⓘ
Medizinische Histologie
Die Histopathologie ist der Teilbereich der Histologie, der sich mit der mikroskopischen Identifizierung und Untersuchung von krankem Gewebe befasst. Sie ist ein wichtiger Teil der anatomischen Pathologie und der chirurgischen Pathologie, da die genaue Diagnose von Krebs und anderen Krankheiten häufig eine histopathologische Untersuchung von Gewebeproben erfordert. Ausgebildete Ärzte, häufig zugelassene Pathologen, führen die histopathologische Untersuchung durch und liefern auf der Grundlage ihrer Beobachtungen diagnostische Informationen. ⓘ
Berufe
Der Bereich der Histologie, der die Aufbereitung von Geweben für die mikroskopische Untersuchung umfasst, wird als Histotechnologie bezeichnet. Die Berufsbezeichnungen für das geschulte Personal, das histologische Proben für die Untersuchung vorbereitet, sind vielfältig und umfassen Histotechniker, Histotechnologen, Histologietechniker und -technologen, medizinische Labortechniker und biomedizinische Wissenschaftler. ⓘ
Vorbereitung der Proben
Die meisten histologischen Proben müssen vor der mikroskopischen Betrachtung präpariert werden; diese Methoden hängen von der jeweiligen Probe und der Betrachtungsmethode ab. ⓘ
Fixierung
Chemische Fixierungsmittel werden verwendet, um die Struktur von Geweben und Zellen zu bewahren und zu erhalten; die Fixierung härtet das Gewebe auch aus, was das Schneiden der für die mikroskopische Betrachtung erforderlichen dünnen Gewebeschnitte erleichtert. Fixiermittel konservieren Gewebe (und Zellen) im Allgemeinen durch irreversible Quervernetzung von Proteinen. Das am häufigsten verwendete Fixiermittel für die Lichtmikroskopie ist 10%iges neutral gepuffertes Formalin oder NBF (4% Formaldehyd in phosphatgepufferter Kochsalzlösung). ⓘ
Für die Elektronenmikroskopie ist das am häufigsten verwendete Fixiermittel Glutaraldehyd, in der Regel als 2,5%ige Lösung in phosphatgepufferter Kochsalzlösung. Andere für die Elektronenmikroskopie verwendete Fixiermittel sind Osmiumtetroxid oder Uranylacetat. ⓘ
Die Hauptwirkung dieser Aldehyd-Fixiermittel besteht in der Vernetzung von Aminogruppen in Proteinen durch die Bildung von Methylenbrücken (-CH2-) im Falle von Formaldehyd oder durch C5H10-Quervernetzungen im Falle von Glutaraldehyd. Dieser Prozess bewahrt zwar die strukturelle Integrität der Zellen und des Gewebes, kann aber die biologische Funktionalität der Proteine, insbesondere der Enzyme, beeinträchtigen. ⓘ
Die Fixierung mit Formalin führt zum Abbau von mRNA, miRNA und DNA sowie zur Denaturierung und Veränderung von Proteinen in Geweben. Die Extraktion und Analyse von Nukleinsäuren und Proteinen aus formalinfixierten, in Paraffin eingebetteten Geweben ist jedoch mit geeigneten Protokollen möglich. ⓘ
Auswahl und Zuschnitt

Auswahl ist die Auswahl des relevanten Gewebes in Fällen, in denen es nicht notwendig ist, die gesamte ursprüngliche Gewebemasse weiter zu verarbeiten. Der Rest kann fixiert bleiben, falls er zu einem späteren Zeitpunkt untersucht werden muss. ⓘ
Trimmen ist das Schneiden von Gewebeproben, um die relevanten Oberflächen für das spätere Schneiden freizulegen. Dabei werden auch Gewebeproben in geeigneter Größe hergestellt, damit sie in Kassetten passen. ⓘ
Einbetten
Gewebe werden in ein härteres Medium eingebettet, das als Träger dient und das Schneiden dünner Gewebeschnitte ermöglicht. Im Allgemeinen muss den Geweben zunächst das Wasser entzogen (Dehydratisierung) und durch ein Medium ersetzt werden, das sich entweder direkt verfestigt, oder durch eine Zwischenflüssigkeit (Klärung), die mit dem Einbettungsmedium mischbar ist. ⓘ
Paraffinwachs

Für die Lichtmikroskopie ist Paraffinwachs das am häufigsten verwendete Einbettungsmaterial. Paraffin ist mit Wasser, dem Hauptbestandteil von biologischem Gewebe, nicht mischbar, so dass es zunächst in einer Reihe von Entwässerungsschritten entfernt werden muss. Die Proben werden durch eine Reihe von immer stärker konzentrierten Ethanolbädern bis hin zu 100 % Ethanol geleitet, um die verbleibenden Spuren von Wasser zu entfernen. Nach der Dehydratisierung wird ein Klärmittel (in der Regel Xylol, obwohl auch andere umweltverträgliche Ersatzstoffe verwendet werden) zugegeben, das den Alkohol entfernt und mit dem Wachs mischbar ist. In den meisten Histologie- oder Histopathologielabors werden die Dehydratisierung, die Klärung und die Wachsinfiltration in Gewebebearbeitungsmaschinen durchgeführt, die diesen Prozess automatisieren. Nach der Infiltration mit Paraffin werden die Gewebe in Formen ausgerichtet, die mit Wachs gefüllt sind; nach der Positionierung wird das Wachs abgekühlt und der Block und das Gewebe verfestigt. ⓘ
Andere Materialien
Paraffin bietet nicht immer eine ausreichend harte Matrix für das Schneiden sehr dünner Schnitte (die besonders für die Elektronenmikroskopie wichtig sind). Paraffinwachs kann auch im Verhältnis zum Gewebe zu weich sein, die Hitze des geschmolzenen Wachses kann das Gewebe in unerwünschter Weise verändern, oder die Entwässerungs- oder Reinigungschemikalien können das Gewebe schädigen. Alternativen zum Paraffinwachs sind Epoxid-, Acryl-, Agar-, Gelatine-, Celloidin- und andere Wachsarten. ⓘ
In der Elektronenmikroskopie sind Epoxidharze die am häufigsten verwendeten Einbettungsmedien, aber auch Acrylharze werden verwendet, insbesondere wenn Immunhistochemie erforderlich ist. ⓘ
Für Gewebeschnitte in gefrorenem Zustand werden die Gewebe in ein Einbettungsmedium auf Wasserbasis gelegt. Vorgefrorene Gewebe werden mit dem flüssigen Einbettungsmaterial, in der Regel ein Glykol, OCT, TBS, Cryogen oder Harz auf Wasserbasis, in Formen gegeben, die dann zu gehärteten Blöcken gefroren werden. ⓘ
Schneiden

Für die Lichtmikroskopie wird ein Messer in einem Mikrotom verwendet, um Gewebeschnitte (in der Regel zwischen 5 und 15 Mikrometer dick) zu schneiden, die auf einen Objektträger aus Glas montiert werden. Für die Transmissionselektronenmikroskopie (TEM) wird ein Diamant- oder Glasmesser in einem Ultramikrotom verwendet, um Gewebeschnitte mit einer Dicke zwischen 50 und 150 Nanometern zu schneiden. ⓘ
Färbung
Biologisches Gewebe weist weder im Licht- noch im Elektronenmikroskop einen nennenswerten Kontrast auf. Färbungen werden eingesetzt, um sowohl den Kontrast des Gewebes zu erhöhen als auch bestimmte Merkmale hervorzuheben. Wenn die Färbung auf eine bestimmte chemische Komponente des Gewebes (und nicht auf die allgemeine Struktur) abzielt, wird der Begriff Histochemie verwendet. ⓘ
Lichtmikroskopie
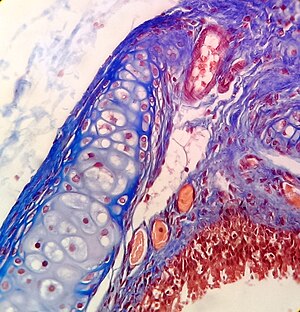
Hämatoxylin und Eosin (H&E-Färbung) ist eine der am häufigsten verwendeten Färbungen in der Histologie, um die allgemeine Struktur des Gewebes zu zeigen. Hämatoxylin färbt die Zellkerne blau; Eosin, ein saurer Farbstoff, färbt das Zytoplasma und andere Gewebe in verschiedenen Rosatönen. ⓘ
Im Gegensatz zu H&E, das als allgemeine Färbung verwendet wird, gibt es viele Techniken, die Zellen, zelluläre Bestandteile und spezifische Substanzen selektiver färben. Eine häufig durchgeführte histochemische Technik, die auf eine bestimmte Chemikalie abzielt, ist die Perls'sche Preußischblaureaktion, die zum Nachweis von Eisenablagerungen bei Krankheiten wie Hämochromatose verwendet wird. Die Nissl-Methode für die Nissl-Substanz und die Golgi-Methode (und verwandte Silberfärbungen), die bei der Identifizierung von Neuronen nützlich sind, sind weitere Beispiele für spezifischere Färbungen. ⓘ
Historadiographie
Bei der Historadiografie wird ein Objektträger (manchmal histochemisch gefärbt) geröntgt. In der Regel wird die Autoradiografie zur Visualisierung der Stellen verwendet, an die eine radioaktive Substanz im Körper transportiert wurde, wie z. B. Zellen in der S-Phase (die sich in der DNA-Replikation befinden), die tritiiertes Thymidin aufnehmen, oder Stellen, an die radioaktiv markierte Nukleinsäuresonden bei der In-situ-Hybridisierung binden. Für die Autoradiografie auf mikroskopischer Ebene wird der Objektträger in der Regel in eine flüssige Kerntrakt-Emulsion getaucht, die trocknet und den Belichtungsfilm bildet. Einzelne Silberkörner auf dem Film werden mit der Dunkelfeldmikroskopie sichtbar gemacht. ⓘ
Immunhistochemie
In jüngster Zeit werden Antikörper eingesetzt, um Proteine, Kohlenhydrate und Lipide spezifisch sichtbar zu machen. Dieses Verfahren wird als Immunhistochemie oder, wenn die Färbung ein fluoreszierendes Molekül ist, als Immunfluoreszenz bezeichnet. Diese Technik hat die Möglichkeiten zur Identifizierung von Zellkategorien unter dem Mikroskop erheblich verbessert. Andere fortschrittliche Techniken, wie die nicht-radioaktive In-situ-Hybridisierung, können mit der Immunchemie kombiniert werden, um spezifische DNA- oder RNA-Moleküle mit fluoreszierenden Sonden oder Markierungen zu identifizieren, die für die Immunfluoreszenz und die enzymatische Fluoreszenzverstärkung (insbesondere alkalische Phosphatase und Tyramid-Signalverstärkung) verwendet werden können. Fluoreszenzmikroskopie und konfokale Mikroskopie werden eingesetzt, um Fluoreszenzsignale mit guten intrazellulären Details zu erkennen. ⓘ
Elektronenmikroskopie
Für die Elektronenmikroskopie werden in der Regel Schwermetalle zur Färbung von Gewebeschnitten verwendet. Uranylacetat und Bleizitrat werden üblicherweise verwendet, um dem Gewebe im Elektronenmikroskop einen Kontrast zu verleihen. ⓘ
Spezialisierte Techniken
Kälteschneiden
Ähnlich wie das Gefrierschnittverfahren in der Medizin ist die Kryozerlegung eine Methode zum schnellen Einfrieren, Schneiden und Montieren von Gewebeschnitten für die Histologie. Das Gewebe wird in der Regel mit einem Kryostat oder Gefriermikrotom geschnitten. Die gefrorenen Schnitte werden auf einen Glasträger montiert und können angefärbt werden, um den Kontrast zwischen verschiedenen Geweben zu verstärken. Unfixierte Gefrierschnitte können für Studien verwendet werden, die eine Enzymlokalisierung in Geweben und Zellen erfordern. Die Fixierung des Gewebes ist für bestimmte Verfahren erforderlich, z. B. für die Färbung mit Antikörpern im Rahmen der Immunofluoreszenz. Gefrierschnitte werden häufig bei der chirurgischen Entfernung von Tumoren angefertigt, um eine schnelle Identifizierung der Tumorränder zu ermöglichen, wie z. B. bei der Mohs-Chirurgie, oder um die Bösartigkeit eines Tumors zu bestimmen, wenn dieser zufällig bei einer Operation entdeckt wird. ⓘ
Ultramikrotomie

Die Ultramikrotomie ist eine Methode zur Herstellung extrem dünner Schnitte für die Analyse im Transmissionselektronenmikroskop (TEM). Das Gewebe wird in der Regel in Epoxid oder ein anderes Kunststoffharz eingebettet. Sehr dünne Schnitte (mit einer Dicke von weniger als 0,1 Mikrometer) werden mit Diamant- oder Glasmessern auf einem Ultramikrotom geschnitten. ⓘ
Artefakte
Artefakte sind Strukturen oder Merkmale im Gewebe, die die normale histologische Untersuchung beeinträchtigen. Artefakte beeinträchtigen die Histologie, indem sie das Aussehen des Gewebes verändern und Strukturen verdecken. Zu den Artefakten bei der Gewebeverarbeitung gehören Pigmente, die sich durch Fixiermittel bilden, Schrumpfung, Auswaschen von Zellbestandteilen, Farbveränderungen bei verschiedenen Gewebetypen und Veränderungen der Gewebestrukturen. Ein Beispiel ist Quecksilberpigment, das nach der Fixierung eines Schnitts mit Zenker-Fixiermittel zurückbleibt. Auch bei der Fixierung mit Formalin kann unter sauren Bedingungen ein braunes bis schwarzes Pigment zurückbleiben. ⓘ
Geschichte

Im 17. Jahrhundert nutzte der Italiener Marcello Malpighi Mikroskope, um winzige biologische Gebilde zu untersuchen; manche sehen in ihm den Begründer der Histologie und mikroskopischen Pathologie. Malpighi analysierte verschiedene Teile der Organe von Fledermäusen, Fröschen und anderen Tieren unter dem Mikroskop. Bei der Untersuchung der Lungenstruktur fielen Malpighi die membranartigen Alveolen und die haarähnlichen Verbindungen zwischen Venen und Arterien auf, die er Kapillaren nannte. Er entdeckte, wie der eingeatmete Sauerstoff in den Blutkreislauf gelangt und den Körper versorgt. ⓘ
Im 19. Jahrhundert war die Histologie eine eigenständige akademische Disziplin. Der französische Anatom Xavier Bichat führte 1801 den Begriff "Gewebe" in die Anatomie ein, und der Begriff "Histologie", der die "Lehre von den Geweben" bezeichnet, tauchte erstmals 1819 in einem Buch von Karl Meyer auf. Bichat beschrieb einundzwanzig menschliche Gewebe, die sich unter den vier heute von den Histologen akzeptierten Kategorien zusammenfassen lassen. Die Verwendung von Abbildungen in der Histologie, die von Bichat als nutzlos erachtet wurde, wurde von Jean Cruveilhier gefördert. ⓘ
In den frühen 1830er Jahren erfand Purkynĕ ein Mikrotom mit hoher Präzision. ⓘ
Im Laufe des 19. Jahrhunderts wurden zahlreiche Fixierungstechniken von Adolph Hannover (Chromat- und Chromsäurelösungen), Franz Schulze und Max Schultze (Osmiumsäure), Alexander Butlerov (Formaldehyd) und Benedikt Stilling (Gefrieren) entwickelt. ⓘ
Die Einbettungstechniken wurden von Rudolf Heidenhain (1824-1898) entwickelt, der Gummi arabicum einführte, von Salomon Stricker (1834-1898), der eine Mischung aus Wachs und Öl befürwortete, und von Andrew Pritchard (1804-1884), der 1832 eine Mischung aus Gummi und Isolierglas verwendete. Im selben Jahr erschien Kanadabalsam auf der Bildfläche, und 1869 berichtete Edwin Klebs (1834-1913), dass er seine Präparate einige Jahre lang in Paraffin eingebettet hatte. ⓘ
Der Nobelpreis für Physiologie oder Medizin wurde 1906 an die Histologen Camillo Golgi und Santiago Ramon y Cajal verliehen. Sie vertraten unterschiedliche Auffassungen über die neuronale Struktur des Gehirns, die auf unterschiedlichen Interpretationen derselben Bilder beruhten. Ramón y Cajal erhielt den Preis für seine korrekte Theorie und Golgi für die Silberfärbetechnik, die er erfunden hatte, um sie zu ermöglichen. ⓘ
Der Begriff Histologie wurde im Jahre 1819 vom Anatomen Franz Josef Carl Mayer (1787–1865) umschrieben und als ein Teilgebiet der Anatomie angesehen. 1830 prägten Vincent Jaques Louis Chevalier (1770–1841) und sein Sohn Charles Louis Chevalier (1804–1859) die Bezeichnung Mikrotom für Gewebeschnittgeräte. Ihre Firma fertigte seit 1765 in Paris wissenschaftliche Instrumente. ⓘ
Entwicklung der Färbetechniken
Marcello Malpighi (1628–1694) gehörte zu den Ersten, die tierische Organe und Pflanzen mikroskopisch untersuchten. Henri Louis Duhamel du Monceau (1700–1782) stellte fest, dass Tierknochen sich mit dem Farbstoff Krapp aus der Färberkrappflanze (Rubia tinctorum) anfärben lassen. Die Entwicklung von Färbemethoden war entscheidend für die Weiterentwicklung der Histologie, da die natürlichen Präparate weitgehend farblos waren bzw. die optische Dichte der zu untersuchenden Gewebestrukturen meist keine großen Unterschiede aufweist. Christian Gottfried Ehrenberg benutzte 1838 Karmin zur Anfärbung und mikroskopischen Beobachtung von Protisten (die damals Infusorien genannt wurden). 1849 studierten Heinrich Göppert und Ferdinand Julius Cohn mittels der Farbstoffe Krapp und Karmin die Protoplasmaströmung in Pflanzenzellen. Um 1855 entwickelte der Anatom Joseph von Gerlach die histologischen Färbetechniken weiter. Er beschrieb die Färbung von Zellkernen in tierischen Zellen mittels Karmin. ⓘ
Heinrich Wilhelm Waldeyer verwendete 1863 einen Extrakt des Blutholzbaumes (Haematoxylum campechianum) für die Hämatoxylinfärbung von Nervenzellen. Ein weiterer wichtiger Schritt war der Einsatz von Anilinfarbstoffen durch Paul Ehrlich; er perfektionierte diese Möglichkeiten in den Jahren 1879 bis 1894. ⓘ
Digitale Histologie
Objektträger können vollständig in sogenannten Whole Slide Images (WSI) digitalisiert werden. Diese WSI können dann mit Kollegen geteilt, von Algorithmen ausgewertet oder beispielsweise für Lehrzwecke im Web gehostet werden. Ein Beispiel für ein solches Projekt ist Pathorama, preci.cloud oder Cytomine. ⓘ
Zukünftige Richtungen
In-vivo-Histologie
Gegenwärtig besteht großes Interesse an der Entwicklung von Techniken für die In-vivo-Histologie (vor allem mit Hilfe der MRT), die es den Ärzten ermöglichen würde, auf nicht-invasive Weise Informationen über gesundes und krankes Gewebe bei lebenden Patienten zu sammeln, anstatt anhand von fixierten Gewebeproben. ⓘ
Histologische Technik
Bevor die feingeweblichen Details einer Patientenprobe oder eines Experimentes begutachtet werden können, muss das Gewebe einer ausführlichen Verarbeitung unterzogen werden. Diese Methoden werden als histologische Technik zusammengefasst und im histologischen Labor größtenteils von biomedizinischen Analytikern bzw. (V)MTAs durchgeführt. ⓘ
Die Gewebeverarbeitung im histodiagnostischen Labor umfasst:
- Fixierung zur Stabilisierung des Gewebes (Hauptfixans: 4 % neutral gepufferte Formaldehydlösung)
- makroskopische Begutachtung, Zuschnitt der aussagekräftigen Gewebebezirke. In der Pathologie ärztliche Tätigkeit und zum diagnostischen Prozess gehörend.
- Entwässerung und Imprägnierung des Gewebes mit flüssigem Paraffin
- Einblocken des Gewebes in Paraffin: ein Paraffinquader wird hergestellt, der das Gewebe beinhaltet.
- In modernen Histologielaboren werden die Gewebsstückchen in sogenannte „Einbettkassetten“ gelegt. In diesen durchläuft die Gewebeprobe die Entwässerung und Einparaffinierung. Danach dient die Kassette als Blockunterlage und kann so in den sogenannten Schnellspannrahmen, mit dem die meisten heutigen Mikrotome versehen sind, eingespannt werden.
- Herstellung von 2–5 µm dicken Schnitten am Mikrotom
- Aufziehen der Schnitte auf (beschichtete) Glasobjektträger
- histologische Färbetechniken ⓘ
Die Verarbeitung von Formaldehyd-fixiertem, Paraffin-eingebettetem Gewebe inklusive der Hämatoxylin-Eosin-Färbung stellt die weltweite Routine-Methode der Pathologie dar und dauert durchschnittlich ein bis zwei Tage von der Probenannahme bis zur Befundung. Im Gegensatz zum klinisch-chemischen Labor sind viele Arbeitsschritte von Hand durchzuführen. Besonders die Schnittherstellung am Mikrotom bedarf großen Geschicks. ⓘ
Schnellschnittuntersuchung
Bei manchen Operationen benötigt der Chirurg noch während der Operation Informationen über das entnommene Gewebe für seine weitere Vorgehensweise. In diesem Fall kann ein Teil der Probe innerhalb von etwa zehn Minuten als Schnellschnitt verarbeitet werden:
- Gewebestabilisierung durch Gefrieren (etwa −20 °C), je nach Gewebeart
- Herstellen eines 5–10 µm dicken Schnittes mit einem Kryostat-Mikrotom
- Aufziehen des Schnittes auf einen beschichteten Glasobjektträger
- Färben mittels Schnell-HE-Färbung, Paragon-Färbung oder einer anderen Schnellfärbung
- mikroskopische Befundung ⓘ

