Methionin
 Skelettformel der kanonischen Form von Methionin
| |||
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Methionin
| |||
| Andere Bezeichnungen
2-Amino-4-(methylthio)butansäure
| |||
| Bezeichner | |||
3D-Modell (JSmol)
|
| ||
| Abkürzungen | Met, M | ||
| ChEBI |
| ||
| ChEMBL |
| ||
| ChemSpider | |||
| Arzneimittelbank |
| ||
| EC-Nummer |
| ||
| KEGG |
| ||
PubChem CID
|
|||
| UNII |
| ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C5H11NO2S | ||
| Molare Masse | 149,21 g-mol-1 | ||
| Erscheinungsbild | Weißes, kristallines Pulver | ||
| Dichte | 1.340 g/cm3 | ||
| Schmelzpunkt | 281 °C (538 °F; 554 K) zersetzt sich | ||
Löslichkeit in Wasser
|
Löslich | ||
| Acidität (pKa) | 2,28 (Carboxyl), 9,21 (Amino) | ||
| Pharmakologie | |||
ATC-Code
|
V03AB26 (WHO) QA05BA90 (WHO), QG04BA90 (WHO) | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox-Referenzen
| |||
Methionin (Symbol Met oder M) (/mɪˈθaɪəniːn/) ist eine für den Menschen essenzielle Aminosäure. Als Vorläufer anderer Aminosäuren wie Cystein und Taurin, vielseitiger Verbindungen wie SAM-e und des wichtigen Antioxidans Glutathion spielt Methionin eine entscheidende Rolle für den Stoffwechsel und die Gesundheit vieler Spezies, einschließlich des Menschen. Es wird durch das Codon AUG kodiert. ⓘ
Methionin ist auch ein wichtiger Bestandteil der Angiogenese, also des Wachstums neuer Blutgefäße. Eine Nahrungsergänzung kann für Menschen mit einer Kupfervergiftung von Vorteil sein. Ein übermäßiger Verzehr von Methionin, dem Methylgruppenspender bei der DNA-Methylierung, wird in einer Reihe von Studien mit dem Krebswachstum in Verbindung gebracht. Methionin wurde erstmals 1921 von John Howard Mueller isoliert. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
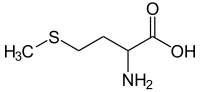
| |||||||||||||||||||
| Strukturformel ohne Angaben zur Stereoisomerie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methionin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H11NO2S | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 149,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,34 g·cm−3 | ||||||||||||||||||
| Schmelzpunkt |
280–281 °C (Zersetzung) | ||||||||||||||||||
| pKS-Wert |
| ||||||||||||||||||
| Löslichkeit |
mäßig in Wasser: 48 g·l−1 (20 °C) | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
36 g·kg−1 (LD50, Ratte, oral) | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Methionin ist eine schwefelhaltige α-Aminosäure, in der natürlich vorkommenden L-Form (abgekürzt Met oder M) eine essentielle proteinogene Aminosäure. ⓘ
Biochemische Einzelheiten
Methionin (abgekürzt als Met oder M; codiert durch das Codon AUG) ist eine α-Aminosäure, die in der Biosynthese von Proteinen verwendet wird. Sie enthält eine Carboxylgruppe (die unter biologischen pH-Bedingungen in der deprotonierten Form -COO- vorliegt), eine Aminogruppe (die unter biologischen pH-Bedingungen in der protonierten Form -NH3+ vorliegt), die sich in α-Position zur Carboxylgruppe befindet, und eine S-Methylthioether-Seitenkette, was sie als unpolare, aliphatische Aminosäure klassifiziert. ⓘ
In Kerngenen von Eukaryonten und Archaeen wird Methionin durch das Startcodon kodiert, d. h. es markiert den Beginn der kodierenden Region und ist die erste Aminosäure, die in einem naszierenden Polypeptid während der mRNA-Translation gebildet wird. ⓘ
Eine proteinogene Aminosäure
Zusammen mit Cystein ist Methionin eine der beiden schwefelhaltigen proteinogenen Aminosäuren. Abgesehen von den wenigen Ausnahmen, in denen Methionin als Redox-Sensor fungieren kann (z. B.), haben Methioninreste keine katalytische Funktion. Dies steht im Gegensatz zu Cysteinresten, bei denen die Thiolgruppe in vielen Proteinen eine katalytische Rolle spielt. Der Thioether spielt jedoch aufgrund des Stabilitätseffekts der S/π-Wechselwirkungen zwischen dem Schwefelatom der Seitenkette und den aromatischen Aminosäuren in einem Drittel aller bekannten Proteinstrukturen eine geringe strukturelle Rolle. Diese geringe Rolle spiegelt sich in Experimenten wider, bei denen nur geringe Auswirkungen in Proteinen beobachtet wurden, bei denen Methionin durch Norleucin ersetzt wurde, eine Aminosäure mit gerader Kohlenwasserstoffseitenkette, der der Thioether fehlt. Es wurde vermutet, dass Norleucin in frühen Versionen des genetischen Codes vorhanden war, aber Methionin in die endgültige Version des genetischen Codes eingedrungen ist, da es im Cofaktor S-Adenosylmethionin (SAM-e) verwendet wird. Diese Situation ist nicht einzigartig und kann auch bei Ornithin und Arginin vorkommen. ⓘ
Kodierung
Methionin ist eine von nur zwei Aminosäuren, die durch ein einziges Codon (AUG) im genetischen Standardcode codiert werden (die andere ist Tryptophan, das durch UGG codiert wird). In Anbetracht des evolutionären Ursprungs dieses Codons kodieren die anderen AUN-Codons für Isoleucin, das ebenfalls eine hydrophobe Aminosäure ist. Im mitochondrialen Genom mehrerer Organismen, darunter Metazoen und Hefen, kodiert das Codon AUA auch für Methionin. Im genetischen Standardcode kodiert AUA für Isoleucin und die entsprechende tRNA (ileX in Escherichia coli) verwendet die ungewöhnliche Base Lysidin (Bakterien) oder Agmatidin (Archaeen), um AUG zu diskriminieren. ⓘ
Das Methionin-Codon AUG ist auch das häufigste Start-Codon. Ein "Start"-Codon ist eine Nachricht für ein Ribosom, die den Beginn der Proteinumsetzung von der mRNA signalisiert, wenn sich das AUG-Codon in einer Kozak-Konsensussequenz befindet. Infolgedessen wird Methionin bei Eukaryonten und Archaeen während der Translation häufig in die N-terminale Position von Proteinen eingebaut, obwohl es durch posttranslationale Modifikation entfernt werden kann. In Bakterien wird das Derivat N-Formylmethionin als erste Aminosäure verwendet. ⓘ
Derivate
S-Adenosyl-Methionin

Das Methionin-Derivat S-Adenosyl-Methionin (SAM-e) ist ein Cofaktor, der hauptsächlich als Methyl-Donator dient. SAM-e besteht aus einem Adenosylmolekül (über den 5'-Kohlenstoff), das an den Schwefel des Methionins gebunden ist, wodurch es zu einem Sulfoniumkation wird (d. h. drei Substituenten und positive Ladung). Der Schwefel wirkt als weiche Lewis-Säure (d. h. Donor/Elektrophil), die es ermöglicht, die S-Methylgruppe auf ein Sauerstoff-, Stickstoff- oder aromatisches System zu übertragen, oft mit Hilfe anderer Cofaktoren wie Cobalamin (Vitamin B12 beim Menschen). Einige Enzyme nutzen SAM-e, um eine radikalische Reaktion einzuleiten; diese werden als radikale SAM-e-Enzyme bezeichnet. Durch die Übertragung der Methylgruppe entsteht S-Adenosyl-Homocystein. In Bakterien wird dieses entweder durch Methylierung regeneriert oder durch Entfernung des Adenins und des Homocysteins gerettet, wobei die Verbindung Dihydroxypentandion übrig bleibt, das sich spontan in Autoinducer-2 umwandelt, der als Abfallprodukt / Quorum-Signal ausgeschieden wird. ⓘ
Biosynthese

Als essenzielle Aminosäure wird Methionin beim Menschen und anderen Tieren nicht de novo synthetisiert, sie müssen Methionin oder methioninhaltige Proteine aufnehmen. In Pflanzen und Mikroorganismen gehört die Methioninbiosynthese zusammen mit Threonin und Lysin (über Diaminopimelat, aber nicht über α-Aminoadipat) zur Familie der Aspartate. Das Hauptgerüst wird aus Asparaginsäure gewonnen, während der Schwefel aus Cystein, Methanthiol oder Schwefelwasserstoff stammen kann.
- Zunächst wird Asparaginsäure über β-Aspartyl-Semialdehyd durch zwei Reduktionsschritte der terminalen Carboxylgruppe in Homoserin umgewandelt (Homoserin hat also ein γ-Hydroxyl, daher die Homo-Reihe). Das Zwischenprodukt Aspartat-Semialdehyd ist der Verzweigungspunkt mit dem Lysin-Biosyntheseweg, wo es stattdessen mit Pyruvat kondensiert wird. Homoserin ist der Verzweigungspunkt mit dem Threoninweg, wo es stattdessen nach Aktivierung des terminalen Hydroxyls mit Phosphat isomerisiert wird (wird auch für die Methioninbiosynthese in Pflanzen verwendet).
- Homoserin wird dann mit einer Phosphat-, Succinyl- oder Acetylgruppe an der Hydroxylgruppe aktiviert.
- In Pflanzen und möglicherweise in einigen Bakterien wird Phosphat verwendet. Dieser Schritt wird auch bei der Biosynthese von Threonin durchgeführt.
- In den meisten Organismen wird eine Acetylgruppe zur Aktivierung des Homoserin verwendet. In Bakterien kann dies durch ein Enzym katalysiert werden, das von metX oder metA (keine Homologen) kodiert wird.
- In Enterobakterien und einer begrenzten Anzahl anderer Organismen wird Succinat verwendet. Das Enzym, das die Reaktion katalysiert, ist MetA, und die Spezifität für Acetyl-CoA und Succinyl-CoA wird durch einen einzigen Rest bestimmt. Die physiologische Grundlage für die Bevorzugung von Acetyl-CoA oder Succinyl-CoA ist nicht bekannt, aber solche alternativen Wege gibt es in einigen anderen Stoffwechselwegen (z. B. Lysinbiosynthese und Argininbiosynthese).
- Die aktivierende Hydroxylgruppe wird dann durch Cystein, Methanthiol oder Schwefelwasserstoff ersetzt. Eine Ersatzreaktion ist technisch gesehen eine γ-Eliminierung, gefolgt von einer Variante einer Michael-Addition. Alle beteiligten Enzyme sind Homologe und gehören zur Familie der PLP-abhängigen Enzyme des Cys/Met-Stoffwechsels, die eine Untergruppe der PLP-abhängigen Faltung vom Typ I ist. Sie nutzen den Cofaktor PLP (Pyridoxalphosphat), der die Carbanion-Zwischenstufen stabilisiert.
- Wenn es mit Cystein reagiert, entsteht Cystathionin, das zu Homocystein gespalten wird. Die beteiligten Enzyme sind die Cystathionin-γ-Synthase (bei Bakterien durch metB kodiert) und die Cystathionin-β-Lyase (metC). Cystathionin ist in den beiden Enzymen unterschiedlich gebunden, so dass β- oder γ-Reaktionen stattfinden können.
- Wenn es mit freiem Schwefelwasserstoff reagiert, entsteht Homocystein. Dies wird durch die O-Acetylhomoserin-Aminocarboxypropyltransferase (früher bekannt als O-Acetylhomoserin(thiol)-Lyase) katalysiert. Sie wird in Bakterien entweder von metY oder metZ kodiert.
- Wenn sie mit Methanthiol reagiert, bildet sie direkt Methionin. Methanthiol ist ein Nebenprodukt des Abbauprozesses bestimmter Verbindungen, daher ist dieser Weg eher seltener.
- Wenn Homocystein gebildet wird, wird die Thiolgruppe methyliert, wodurch Methionin entsteht. Es sind zwei Methionin-Synthasen bekannt; eine ist von Cobalamin (Vitamin B12) abhängig, die andere ist unabhängig. ⓘ
Der Weg, der Cystein verwendet, wird als "Transsulfurierungsweg" bezeichnet, während der Weg, der Schwefelwasserstoff (oder Methanthiol) verwendet, als "direkter Sulfurylierungsweg" bezeichnet wird. ⓘ
Cystein wird auf ähnliche Weise hergestellt, nämlich aus einem aktivierten Serin und entweder aus Homocystein ("umgekehrter Trans-Sulfurierungsweg") oder aus Schwefelwasserstoff ("direkter Sulfurierungsweg"); das aktivierte Serin ist im Allgemeinen O-Acetyl-Serin (über CysK oder CysM in E. coli), aber in Aeropyrum pernix und einigen anderen Archaeen wird O-Phosphoserin verwendet. CysK und CysM sind homolog, gehören aber zur PLP-Faltung Typ III. ⓘ
Trans-Sulfurylierungs-Weg
Enzyme, die am trans-Sulfurylierungsweg der Methionin-Biosynthese in E. coli beteiligt sind:
- Aspartokinase
- Aspartat-Semialdehyd-Dehydrogenase
- Homoserin-Dehydrogenase
- Homoserin-O-Transsuccinylase
- Cystathionin-γ-Synthase
- Cystathionin-β-Lyase
- Methionin-Synthase (bei Säugetieren wird dieser Schritt von der Homocystein-Methyltransferase oder Betain-Homocystein-S-Methyltransferase ausgeführt). ⓘ
Andere biochemische Vorgänge

Obwohl Säugetiere Methionin nicht synthetisieren können, können sie es dennoch in einer Reihe von biochemischen Prozessen verwenden: ⓘ
Katabolismus
Im Rahmen der Translation wird die Proteinbiosynthese mit Methionin gestartet. Die Initiator-tRNA ist bei Archaeen und Eukaryoten eine mit Methionin beladene tRNAiMet, bei Bakterien eine tRNAifMet, die N-Formylmethionin (fMet) überträgt. Gewöhnlich binden diese tRNAs über ihr Anticodon an das Startcodon AUG. Die erste Aminosäure am N-Terminus der entstehenden Polypeptidkette ist in allen lebenden Zellen damit das (formylierte) Methionin. Doch wird bei dem entstandenen Protein später das erste Methionin häufig abgetrennt oder modifiziert, z. B. durch Acetylierung der Aminogruppe. ⓘ
Nicht für die Proteinbiosynthese benötigtes Methionin kann durch Verknüpfung mit ATP zu S-Adenosylmethionin (SAM) umgesetzt werden, einem wichtigen Methylgruppen-Donor in den meisten Organismen. Nach Abgabe der Methylgruppe entsteht S-Adenosylhomocystein (SAH), das zu Homocystein umgewandelt wird. Hieraus kann Methionin wieder zurückgewonnen werden. ⓘ
SAM und damit auch Methionin ist weiterhin Ausgangsmaterial für die Synthese der Polyamine, aus dem dabei entstehenden Nebenprodukt Methylthioadenosin kann Methionin zurückgewonnen werden – der sogenannte Methionin-Salvage-Stoffwechselweg. ⓘ
Methionin wird durch (1) Methionin-Adenosyltransferase in S-Adenosylmethionin (SAM-e) umgewandelt. ⓘ
(3) Adenosylhomocysteinase Cystein. ⓘ
Regenerierung
Methionin kann aus Homocystein über (4) Methioninsynthase in einer Reaktion regeneriert werden, die Vitamin B12 als Kofaktor benötigt. ⓘ
Homocystein kann auch mit Glycinbetain (NNN-Trimethylglycin, TMG) über das Enzym Betain-Homocystein-Methyltransferase (E.C.2.1.1.5, BHMT) zu Methionin remethyliert werden. Die BHMT macht bis zu 1,5 % des gesamten löslichen Proteins der Leber aus, und neuere Erkenntnisse deuten darauf hin, dass sie einen größeren Einfluss auf die Methionin- und Homocystein-Homöostase haben könnte als die Methioninsynthase. ⓘ
Umgekehrter Transulfurylierungsweg: Umwandlung in Cystein
Homocystein kann in Cystein umgewandelt werden. ⓘ
- (5) Die Cystathionin-β-Synthase (ein Enzym, das die aktive Form von Vitamin B6, Pyridoxalphosphat, benötigt) verbindet Homocystein und Serin, um Cystathionin herzustellen. Anstatt Cystathionin wie im Biosyntheseweg über Cystathionin-β-Lyase abzubauen, wird Cystathionin über (6) Cystathionin-γ-Lyase zu Cystein und α-Ketobutyrat abgebaut.
- (7) Das Enzym α-Ketosäure-Dehydrogenase wandelt α-Ketobutyrat in Propionyl-CoA um, das in einem dreistufigen Prozess zu Succinyl-CoA metabolisiert wird (siehe Propionyl-CoA für den Stoffwechselweg). ⓘ
Synthese von Ethylen
Diese Aminosäure wird von Pflanzen auch für die Synthese von Ethylen verwendet. Dieser Prozess wird als Yang-Zyklus oder Methionin-Zyklus bezeichnet. ⓘ

Chemische Synthese
Die industrielle Synthese von racemischem Methionin (Gemisch aus je 50 % L-Methionin und D-Methionin) geht von petrochemischen Rohstoffen aus, insbesondere Propen, Schwefel, Methan und Ammoniak. Nach gängigen Verfahren werden so die Zwischenprodukte Methylmercaptan 1, Acrolein 2 und Blausäure dargestellt. Die Michael-Addition von Methylmercaptan 1 an die Kohlenstoff-Kohlenstoff-Doppelbindung des Acroleins 2 liefert dann das Zwischenprodukt 3-Methylmercaptopropionaldehyd 3. Anschließend wird dieser Aldehyd 3 mit Ammoniak, Kohlendioxid und Blausäure (oder Hirschhornsalz und Natriumcyanid) in ein Hydantoin-Derivat 4 umgewandelt, dessen basische Hydrolyse zu einem Alkalisalz des Methionins führt. Durch Neutralisation mit einer Säure (Kohlendioxid oder Schwefelsäure) erhält man racemisches Methionin 5:
Zur Racematspaltung wird racemisches Methionin am Stickstoffatom acetyliert. Das racemische N-Acetyl-methionin [1:1-Gemisch aus (S)-6 und (R)-6] wird mit dem enantioselektiven Enzym L-Acylase behandelt, dabei wird das natürliche L-Methionin [(S)-5] unter Abspaltung von Essigsäure/Acetat gebildet, während die D-Form des N-Acetyl-methionins [(R)-6] unverändert bleibt:
Anschließend wird L-Methionin abgetrennt. Das D-N-Acetyl-methionin [(R)-6] wird mit Essigsäureanhydrid racemisiert und recycliert. ⓘ
Bei der industriellen Synthese werden Acrolein, Methanthiol und Cyanid kombiniert, wodurch das Hydantoin entsteht. Racemisches Methionin kann auch aus Diethylnatriumphthalimidomalonat durch Alkylierung mit Chlorethylmethylsulfid (ClCH2CH2SCH3) und anschließende Hydrolyse und Decarboxylierung synthetisiert werden. ⓘ
Menschliche Ernährung
Anforderungen
Das Food and Nutrition Board des U.S. Institute of Medicine hat im Jahr 2002 empfohlene Tagesdosen (Recommended Dietary Allowances, RDA) für essentielle Aminosäuren festgelegt. Für Methionin in Kombination mit Cystein gilt für Erwachsene ab 19 Jahren ein Wert von 19 mg/kg Körpergewicht/Tag. ⓘ
Dies entspricht etwa 1,33 Gramm pro Tag für eine 70 Kilogramm schwere Person. ⓘ
Ernährungsbedingte Quellen
| Lebensmittel | g/100g |
|---|---|
| Ei, weiß, getrocknet, Pulver, glukosereduziert | 3.204 |
| Sesamsamenmehl (fettarm) | 1.656 |
| Paranüsse | 1.124 |
| Käse, Parmesan, geraspelt | 1.114 |
| Hanfsamen, geschält | 0.933 |
| Sojaprotein-Konzentrat | 0.814 |
| Hähnchen, Masthähnchen oder Brathähnchen, gebraten | 0.801 |
| Fisch, Thunfisch, leicht, in Wasser eingedickt, abgetropft | 0.755 |
| Rindfleisch, gepökelt, getrocknet | 0.749 |
| Speck | 0.593 |
| Chiasamen | 0.588 |
| Rindfleisch, gemahlen, 95% mageres Fleisch / 5% Fett, roh | 0.565 |
| Schweinefleisch, gemahlen, 96% mager / 4% Fett, roh | 0.564 |
| Sojabohnen | 0.547 |
| Weizenkeime | 0.456 |
| Ei, ganz, gekocht, hartgekocht | 0.392 |
| Hafer | 0.312 |
| Erdnüsse | 0.309 |
| Kichererbse | 0.253 |
| Mais, gelb | 0.197 |
| Mandeln | 0.151 |
| Bohnen, Pinto, gekocht | 0.117 |
| Linsen, gekocht | 0.077 |
| Reis, braun, mittelkörnig, gekocht | 0.052 |
Hohe Methioningehalte finden sich in Eiern, Fleisch und Fisch, Sesamsamen, Paranüssen und einigen anderen Pflanzensamen sowie in Getreidekörnern. Die meisten Obst- und Gemüsesorten enthalten nur sehr wenig. Die meisten Hülsenfrüchte enthalten zwar viel Eiweiß, sind aber arm an Methionin. Proteine ohne ausreichend Methionin gelten nicht als vollständige Proteine. Aus diesem Grund wird rassisches Methionin manchmal als Zutat zu Tiernahrung hinzugefügt. ⓘ
Einschränkung
Einige wissenschaftliche Beweise deuten darauf hin, dass eine Einschränkung des Methioninverbrauchs die Lebenserwartung von Fruchtfliegen erhöhen kann. ⓘ
Eine Studie aus dem Jahr 2005 zeigte, dass eine Methioninrestriktion ohne Energieeinschränkung die Lebensdauer von Mäusen verlängert. Diese Verlängerung setzt eine intakte Wachstumshormon-Signalgebung voraus, da Tiere ohne intakte Wachstumshormon-Signalgebung bei einer Methionin-Restriktion keinen weiteren Anstieg der Lebensspanne aufweisen. Die metabolische Reaktion auf die Methioninrestriktion ist auch bei Mutanten mit Wachstumshormonsignalen verändert. ⓘ
Eine in der Zeitschrift Nature veröffentlichte Studie zeigte, dass die Zugabe der essenziellen Aminosäure Methionin zur Nahrung von Fruchtfliegen, die einer Ernährungsbeschränkung, einschließlich einer Beschränkung der essenziellen Aminosäuren (EAA), unterworfen waren, die Fruchtbarkeit wiederherstellte, ohne die längere Lebensspanne zu verkürzen, die für eine Ernährungsbeschränkung typisch ist, was die Forscher zu der Feststellung veranlasste, dass Methionin "in Kombination mit einer oder mehreren anderen EAA wirkt, um die Lebensspanne zu verkürzen". Die Wiederaufnahme von Methionin in die Ernährung von Mäusen, die einer Diätbeschränkung unterliegen, blockiert viele akute Vorteile der Diätbeschränkung, ein Prozess, der durch eine erhöhte Produktion von Schwefelwasserstoff vermittelt werden kann. ⓘ
Eine Methioninrestriktion kann das zirkulierende Leberhormon FGF21 bei Mäusen um das 5- bis 10-fache erhöhen. Mehrere Studien haben gezeigt, dass die Methioninrestriktion auch altersbedingte Krankheitsprozesse bei Mäusen und die Dickdarmkrebsentstehung bei Ratten hemmt. Beim Menschen könnte eine Methioninbeschränkung durch eine Ernährungsumstellung mit einer pflanzlichen Ernährung erreicht werden. ⓘ
Die Einschränkung von Methionin in der Nahrung führt zu einer Verringerung seines Kataboliten S-Adenosylmethionin (SAM-e) und damit zu einem Verlust der Histonmethylierung. Ein aktiver Prozess, der durch eine spezifische, konservierte Methylierung von H3K9 vermittelt wird, bewahrt die Erinnerung an das ursprüngliche Methylierungsprofil, so dass das Epigenom wiederhergestellt werden kann, wenn der Methioninspiegel in der Nahrung zurückkehrt. ⓘ
Eine Studie an Ratten aus dem Jahr 2009 zeigte, dass eine Methionin-Supplementierung in der Ernährung die mitochondriale ROS-Produktion und die oxidative Schädigung der mitochondrialen DNA in den Mitochondrien der Rattenleber spezifisch erhöht, was einen plausiblen Mechanismus für die Hepatotoxizität von Methionin darstellt". ⓘ
Da Methionin jedoch eine essenzielle Aminosäure ist, kann sie nicht vollständig aus der Ernährung der Tiere entfernt werden, ohne dass es im Laufe der Zeit zu Krankheiten oder zum Tod kommt. So entwickelten beispielsweise Ratten, die mit einer Diät ohne Methionin und Cholin gefüttert wurden, eine Steatohepatitis (Fettleber) und Anämie und verloren innerhalb von fünf Wochen zwei Drittel ihres Körpergewichts. Durch die Verabreichung von Methionin wurden die pathologischen Folgen des Methioninmangels gemildert. Die kurzzeitige Entfernung von Methionin aus der Nahrung kann diätbedingte Fettleibigkeit rückgängig machen und fördert die Insulinsensitivität bei Mäusen, und die Methioninbeschränkung schützt auch ein Mausmodell für spontane, polygene Fettleibigkeit und Diabetes. ⓘ
Gesundheit
Der Verlust von Methionin wird mit dem Ergrauen der Haare in Verbindung gebracht. Der Mangel an Methionin führt zu einer Anhäufung von Wasserstoffperoxid in den Haarfollikeln, zu einer Verringerung der Wirksamkeit der Tyrosinase und zu einem allmählichen Verlust der Haarfarbe. Methionin erhöht die intrazelluläre Konzentration von Glutathion und fördert so die antioxidativ vermittelte Zellabwehr und die Redoxregulierung. Außerdem schützt es die Zellen vor dem durch Dopamin induzierten nigralen Zellverlust, indem es oxidative Metaboliten bindet. ⓘ
Methionin ist ein Zwischenprodukt bei der Biosynthese von Cystein, Carnitin, Taurin, Lecithin, Phosphatidylcholin und anderen Phospholipiden. Eine unzureichende Umwandlung von Methionin kann aufgrund der Ansammlung von Homocystein zu Atherosklerose führen. ⓘ
Andere Verwendungen
DL-Methionin wird manchmal als Nahrungsergänzungsmittel an Hunde verabreicht; es trägt dazu bei, die Gefahr von Nierensteinen bei Hunden zu verringern. Methionin ist auch dafür bekannt, dass es die Urinausscheidung von Chinidin durch Ansäuerung des Urins erhöht. Aminoglykosid-Antibiotika, die zur Behandlung von Harnwegsinfektionen eingesetzt werden, wirken am besten in alkalischem Milieu, und eine Übersäuerung des Urins durch die Verwendung von Methionin kann ihre Wirksamkeit verringern. Wenn ein Hund eine Diät erhält, die den Urin ansäuert, sollte Methionin nicht verwendet werden. ⓘ
Methionin ist im Rahmen des US-amerikanischen Programms für ökologischen Landbau als Zusatz zu ökologischem Geflügelfutter zugelassen. ⓘ
Methionin kann als ungiftiges Pestizid zur Bekämpfung von Riesenschwalbenschwanzraupen eingesetzt werden, die eine ernsthafte Gefahr für Orangenkulturen darstellen. ⓘ
Stereoisomerie
Methionin ist chiral, da es ein Stereozentrum enthält. Es gibt somit zwei Enantiomere, die (S)-Form [(−)-L-Methionin] und die (R)-Form [(+)-D-Methionin]. Wenn Methionin ohne Deskriptor erwähnt wird, ist immer L-Methionin gemeint. Dem D-Methionin kommt momentan (Stand: 2022) praktisch keinerlei Bedeutung zu. Allerdings gibt es Hinweise, dass D-Methionin Gehörschäden infolge Lärmeinwirkung verhindern kann. ⓘ
| Isomere von Methionin ⓘ | ||
| Name | L-Methionin | D-Methionin |
| Andere Namen | (S)-Methionin (−)-Methionin |
(R)-Methionin (+)-Methionin |
| Strukturformel | 
|

|
| CAS-Nummer | 63-68-3 | 348-67-4 |
| 59-51-8 (DL) | ||
| EG-Nummer | 200-562-9 | 206-483-6 |
| 200-432-1 (DL) | ||
| ECHA-Infocard | 100.000.512 | 100.005.894 |
| 100.000.393 (DL) | ||
| PubChem | 6137 | 84815 |
| 876 (DL) | ||
| FL-Nummer | 17.027 | - |
| 17.014 (DL) | ||
| Wikidata | Q22124685 | Q27093862 |
| Q180341 (DL) | ||
Geschichte
Der amerikanische Bakteriologe und Immunologe John Howard Mueller musste 1922 feststellen, dass der Zusatz einer Mischung der bis dahin bekannten Aminosäuren zu Kolonien von Streptokokken (Streptococcus hemolyticus) nicht für deren Wachstum ausreichte. Dies gelang hingegen unter Zusatz von Casein. Daher nahm Mueller an, dass Casein noch mindestens eine weitere Aminosäure enthalten müsse. Bei der sich anschließenden Untersuchung von Casein konnte Mueller dann erstmals Methionin isolieren. Mueller gab auch die korrekte Summenformel an. Die Aufklärung der Strukturformel und die Synthese gelangen 1926 George Barger und seinem Assistenten Frederick Philip Coine, 1931 veröffentlichte Barger in Zusammenarbeit mit Weichselbaum eine verbesserte Synthese. Der Name Methionin, als Abkürzung für "γ-Methylthiol-α-amino-butyric acid", stammt von S. Odake (1925). ⓘ
Ein Syntheseverfahren im industriellen Maßstab für racemisches Methionin aus Acrolein, Methylmercaptan und Blausäure wurde ab 1946 von Werner Schwarze, Hans Wagner und Hermann Schulz bei der Degussa AG in den nach Konstanz ausgelagerten Forschungslaboratorien entwickelt. Mit der Synthese der Aminosäure wollte man einen Beitrag zum nach dem Zweiten Weltkrieg besonders bei Kriegsheimkehrern vorhandenen Eiweißmangel leisten (Hungerödeme). Die Ausgangsstoffe Blausäure und Acrolein wurden bei der Degussa produziert, und der Aufbau einer Versuchsanlage mit einer Produktion von 30 Tonnen pro Jahr dauerte nur ein Jahr. Das zur Degussa gehörige Chemiewerk Homburg brachte bald darauf das Methionin-haltige Medikament Thiomedon auf den Markt, und ab 1953 folgte die Anwendung als Futterzusatzmittel in der Landwirtschaft (Legehennen). ⓘ
Vorkommen
Methionin kommt in den Proteinen aller Lebewesen vor. Da der menschliche Organismus diese Aminosäure nicht selbst herstellen kann, ist er auf die Zufuhr mit der Nahrung angewiesen. Die folgenden Beispiele für den Gehalt an Methionin beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil am Gesamtprotein angegeben:
| Lebensmittel | Protein | Methionin | Anteil ⓘ |
|---|---|---|---|
| Rindfleisch, roh | 21,26 g | 554 mg | 2,6 % |
| Hähnchenbrustfilet, roh | 21,23 g | 552 mg | 2,6 % |
| Lachs, roh | 20,42 g | 626 mg | 3,1 % |
| Hühnerei | 12,57 g | 380 mg | 3,0 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 82 mg | 2,5 % |
| Sesamkörner | 17,73 g | 586 mg | 3,3 % |
| Paranüsse | 14,32 g | 1008 mg | 7,0 % |
| Walnüsse | 15,23 g | 236 mg | 1,5 % |
| Weizen-Vollkornmehl | 13,70 g | 212 mg | 1,5 % |
| Mais-Vollkornmehl | 6,93 g | 145 mg | 2,1 % |
| Reis, ungeschält | 7,94 g | 179 mg | 2,3 % |
| Buchweizen-Mehl | 12,62 g | 164 mg | 1,3 % |
| Sojabohnen, getrocknet | 36,49 g | 547 mg | 1,5 % |
| Erbsen, getrocknet | 24,55 g | 251 mg | 1,0 % |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Methionin als Proteinbestandteil, jedoch kein freies L-Methionin. Im Zuge der Verdauung wird es durch Verdauungsenzyme freigesetzt. ⓘ
Eigenschaften
Neben Cystein ist Methionin die einzige schwefelhaltige proteinogene Aminosäure. Durch die Thioethergruppe ist es weniger reaktiv als Cystein, dessen Schwefelatom Teil einer Thiolgruppe (Mercaptogruppe) ist. Methionin liegt überwiegend als inneres Salz bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:

Im elektrischen Feld wandert Methionin am isoelektrischen Punkt, der bei pH 5,74 liegt, nicht, da es dann als Ganzes ungeladen ist. Bei diesem pH-Wert hat Methionin auch seine geringste Löslichkeit in Wasser. ⓘ
Methionin ist im Stoffwechsel ein Lieferant von Methylgruppen (–CH3) z. B. für die Biosynthese von Cholin, Kreatin, Adrenalin, Carnitin, Nukleinsäuren, Histidin, Taurin und Glutathion (Transmethylierung). Die stoffwechselaktive Form von Methionin ist S-Adenosylmethionin. ⓘ
- Van-der-Waals-Volumen: 124
- Hydrophobizitätsgrad: 1,9 ⓘ
Bedarf
Im Organismus dient Methionin unter anderem zur Herstellung der nichtessentiellen, ebenfalls schwefelhaltigen proteinogenen Aminosäure Cystein. Bei Abwesenheit von Cystein in der Nahrung liegt der mittlere Methionin-Bedarf von gesunden Erwachsenen bei täglich ungefähr 13 bis 16 mg pro Kilogramm Körpermasse. Die Tagesmenge, die für nahezu jeden gesunden Erwachsenen ausreicht (RDA), wird mit 21 mg pro Kilogramm Körpermasse abgeschätzt. Manchmal wird dieser Betrag auch als der Gesamtbedarf an schwefelhaltigen Aminosäuren bezeichnet. (Korrekterweise muss dann aber als Maßeinheit nicht Gramm, sondern Mol gewählt werden, da sich die Molare Masse von Methionin und Cystein merklich unterscheiden.) In welchem Umfang Cystein Methionin ersetzen kann, ist beim Menschen noch nicht ausreichend geklärt und scheint versuchsabhängig zu sein. Die Angaben für den mittleren Bedarf an Methionin, wenn die Nahrung einen Überschuss an Cystein enthält, schwanken für gesunde Erwachsene zwischen 5 und 13 mg pro Kilogramm Körpermasse. ⓘ
Biochemie
Abbau überschüssigen Methionins
Methionin wird nur dann unwiderruflich abgebaut, wenn ein Überschuss besteht. In diesem Fall können zwei mögliche Stoffwechselwege aktiviert werden:
- Umbau zu Cystein über SAM und Homocystein – der Abbau überschüssigen Cysteins zu Sulfat und Taurin ist gut untersucht;
- Abbau auch über Transaminierung – dabei kehrt sich das Gleichgewicht in der letzten Reaktion des Methionin-Salvage-Wegs um und aus Methionin entsteht 5′-Methylthio-3-ketobutanoat (MOB), das mithilfe der Enzymkomplexe Verzweigte-Ketosäuren-Dehydrogenase und Kurzketten-Acyl-CoA-Dehydrogenase zu Methylthiopropionyl-CoA weiterverarbeitet wird, woraus Methanthiol entsteht, das teilweise als CO2 und Sulfat ausgeschieden, teilweise in der Leber im THF-Zyklus verwendet wird. ⓘ
Dieses Sicherheitsventil bei Schwefelüberschuss kann natürlich nur bis zu einer gewissen Grenze ohne Nebenwirkungen funktionieren. Ältere Studien zeigten Azidose bei frisch entwöhnten Ratten (600 mg Methionin/Tag); hepatisches Koma bei Hunden, bei denen gleichzeitig erhöhte Ammoniumwerte vorlagen; und sogar Tod bei Schafen, die große Mengen des Racemats in ihren Pansen erhielten (24 g/Tag). ⓘ
Aufgrund der Vermutung, ein erhöhter Spiegel von SAM könnte eine erhöhte Rate der DNA-Methylierung verursachen, untersuchten Amaral und andere, ob Ratten bei erhöhter Methioninzufuhr (2 % in der Diät über sechs Wochen) eine weniger stabile DNA oder eine Methylierung des p53-Gens aufwiesen, fanden jedoch keinen dieser Effekte. Auf der anderen Seite füllte die Diät einen erniedrigten Level an Glutathion in den Nieren wieder auf, der zuvor künstlich verursacht worden war. Dies zeigt, dass überschüssiges Methionin zunächst dem Cysteinpool zugutekommt, bevor Sulfat ausgeschieden wird. ⓘ
Medizinische Verwendung
Bei der Verstoffwechselung von überschüssigem Methionin wird der in der Substanz enthaltene Schwefel zu Schwefelsäure oxidiert und über die Nieren ausgeschieden, wodurch der Harn angesäuert wird. Der Mechanismus der Harnansäuerung kann bei einigen Erkrankungen die Heilung unterstützen. Therapeutisch wird L-Methionin verwendet zur:
- Optimierung der Wirkung von Antibiotika mit Wirkungsoptimum im sauren Urin (pH 4–6): z. B. Ampicillin, Carbenicillin, Nalidixinsäure, Nitrofurane
- Vermeidung der Neubildung von Nierensteinen (bei Phosphatsteinen wie Struvit, Carbonatapatit, Brushit)
- Hemmung des Bakterienwachstums bei einer Blasenentzündung
- Bestandteil von Infusionslösungen zur parenteralen Ernährung. ⓘ
In der Diagnostik wird es in Form von 11C-S-Methyl-L-Methionin als Radiopharmakon zur Darstellung von Hirntumoren bei der Positronen-Emissions-Tomographie benutzt. ⓘ
Anwendung in der Tierernährung
DL-Methionin (also das Racemat) wird zur Supplementierung (Ergänzung) von Futtermitteln eingesetzt. Dabei wird der Nährwert von Futtermitteln für Hühner durch geringe Zusätze von DL-Methionin gesteigert. Dies ist dann von besonderem wirtschaftlichen Nutzen, wenn die natürlichen Futtermittel-Bestandteile einen mangelhaften Gehalt an schwefelhaltigen Aminosäuren (Cystein/Cystin und Methionin) besitzen. Die mit weitem Abstand größten Mengen des synthetisch gewonnenen Methionins (> 400.000 t pro Jahr) werden für diesen Zweck eingesetzt. Größter Hersteller ist Evonik (früher Degussa) mit einer Kapazität von 580.000 t pro Jahr. ⓘ
Anwendung in der Chemie
Durch Erhitzen von Methionin mit wässriger Iodwasserstoffsäure wird die Methylgruppe des Methionins abgespalten. Beim Eindampfen entsteht unter Wasserabspaltung als Cyclisierungsprodukt das Hydroiodid von Homocystein-Thiolacton. ⓘ
Handelsnamen
Acimethin (D), Acimol (D), sowie verschiedene Generika ⓘ