Gentechnik
| Teil einer Serie über ⓘ |
| Gentechnologie |
|---|
 |
| Gentechnisch veränderte Organismen |
|
| Geschichte und Regulierung |
|
| Verfahren |
|
| Anwendungen |
|
| Kontroversen |
|
Gentechnik, auch genetische Veränderung oder genetische Manipulation genannt, ist die Veränderung und Manipulation der Gene eines Organismus mit Hilfe von Technologie. Es handelt sich um eine Reihe von Technologien zur Veränderung des Erbguts von Zellen, einschließlich des Transfers von Genen innerhalb und über die Grenzen von Arten hinweg, um verbesserte oder neuartige Organismen zu erzeugen. Neue DNA wird entweder durch die Isolierung und Vervielfältigung des gewünschten genetischen Materials mit Hilfe rekombinanter DNA-Methoden oder durch künstliche Synthese der DNA gewonnen. In der Regel wird ein Konstrukt erstellt, mit dem diese DNA in den Wirtsorganismus eingebracht wird. Das erste rekombinante DNA-Molekül wurde 1972 von Paul Berg durch die Kombination von DNA aus dem Affenvirus SV40 mit dem Lambda-Virus hergestellt. Neben dem Einfügen von Genen können mit diesem Verfahren auch Gene entfernt oder "ausgeschaltet" werden. Die neue DNA kann willkürlich oder gezielt in einen bestimmten Teil des Genoms eingefügt werden. ⓘ
Ein Organismus, der durch Gentechnik erzeugt wurde, gilt als gentechnisch verändert (GVO), und das daraus resultierende Gebilde ist ein gentechnisch veränderter Organismus (GVO). Der erste GVO war ein Bakterium, das 1973 von Herbert Boyer und Stanley Cohen erzeugt wurde. Rudolf Jaenisch schuf das erste gentechnisch veränderte Tier, als er 1974 fremde DNA in eine Maus einfügte. Das erste Unternehmen, das sich auf die Gentechnik konzentrierte, Genentech, wurde 1976 gegründet und begann mit der Produktion von menschlichen Proteinen. Gentechnisch hergestelltes menschliches Insulin wurde 1978 produziert und Insulin produzierende Bakterien wurden 1982 auf den Markt gebracht. Gentechnisch veränderte Lebensmittel werden seit 1994 verkauft, als die Flavr Savr-Tomate auf den Markt kam. Die Flavr Savr-Tomate wurde so verändert, dass sie länger haltbar ist, aber die meisten aktuellen gentechnisch veränderten Pflanzen sind so verändert, dass sie resistenter gegen Insekten und Herbizide sind. GloFish, der erste GVO, der als Haustier entwickelt wurde, wurde im Dezember 2003 in den Vereinigten Staaten verkauft. Im Jahr 2016 wurden mit einem Wachstumshormon modifizierte Lachse verkauft. ⓘ
Die Gentechnik wird in zahlreichen Bereichen eingesetzt, darunter Forschung, Medizin, industrielle Biotechnologie und Landwirtschaft. In der Forschung werden GVO eingesetzt, um die Funktion und Expression von Genen durch Funktionsverlust, Funktionsgewinn, Tracking und Expressionsexperimente zu untersuchen. Durch das Ausschalten von Genen, die für bestimmte Krankheiten verantwortlich sind, ist es möglich, Tiermodellorganismen für menschliche Krankheiten zu schaffen. Neben der Herstellung von Hormonen, Impfstoffen und anderen Arzneimitteln hat die Gentechnik auch das Potenzial, genetisch bedingte Krankheiten durch Gentherapie zu heilen. Die gleichen Techniken, die zur Herstellung von Arzneimitteln eingesetzt werden, können auch industriell genutzt werden, z. B. zur Herstellung von Enzymen für Waschmittel, Käse und andere Produkte. ⓘ
Der Aufstieg der kommerziell genutzten gentechnisch veränderten Pflanzen hat den Landwirten in vielen Ländern wirtschaftliche Vorteile gebracht, war aber auch die Ursache für die meisten Kontroversen im Zusammenhang mit dieser Technologie. Diese Kontroverse besteht seit den Anfängen der Technologie; die ersten Feldversuche wurden von Gentechnikgegnern zerstört. Obwohl ein wissenschaftlicher Konsens darüber besteht, dass die derzeit erhältlichen Lebensmittel aus gentechnisch veränderten Pflanzen kein größeres Risiko für die menschliche Gesundheit darstellen als herkömmliche Lebensmittel, ist die Sicherheit von gentechnisch veränderten Lebensmitteln ein Hauptanliegen der Kritiker. Auch der Genfluss, die Auswirkungen auf Nichtzielorganismen, die Kontrolle der Lebensmittelversorgung und die Rechte an geistigem Eigentum wurden als potenzielle Probleme angesprochen. Diese Bedenken haben zur Entwicklung eines Rechtsrahmens geführt, die 1975 begann. Er führte zu einem internationalen Vertrag, dem Cartagena-Protokoll über die biologische Sicherheit, das im Jahr 2000 verabschiedet wurde. Die einzelnen Länder haben ihre eigenen Regulierungssysteme für GVO entwickelt, wobei die deutlichsten Unterschiede zwischen den USA und Europa bestehen. ⓘ
Gentechnologie: Verfahren, bei dem neue genetische Informationen in bestehende Zellen eingebracht werden, um einen bestimmten Organismus zu verändern, um seine Eigenschaften zu verändern.
Anmerkung: Angepasst von ref. ⓘ

Obwohl es große Gemeinsamkeiten bei den verwendeten Methoden gibt, wird häufig nach Anwendungsbereich differenziert:
- Grüne Gentechnik – Agrogentechnik – Anwendung bei Pflanzen
- Rote Gentechnik – Anwendung in der Medizin und Pharmazeutik
- Weiße Gentechnik – Anwendung in der Industrie
- Graue Gentechnik – Anwendungen speziell in der Abfallwirtschaft
- Blaue Gentechnik – Anwendungen auf Lebewesen des Meeres, insbesondere Tiefseebakterien ⓘ
Überblick

Die Gentechnik ist ein Verfahren, bei dem die genetische Struktur eines Organismus verändert wird, indem entweder DNA entfernt oder eingeführt oder vorhandenes genetisches Material in situ verändert wird. Im Gegensatz zur traditionellen Tier- und Pflanzenzucht, bei der mehrere Kreuzungen vorgenommen und dann der Organismus mit dem gewünschten Phänotyp ausgewählt wird, wird bei der Gentechnik das Gen direkt aus einem Organismus entnommen und in den anderen eingebracht. Das geht viel schneller, es können beliebige Gene aus beliebigen Organismen (auch aus anderen Bereichen) eingefügt werden, und es wird verhindert, dass auch andere unerwünschte Gene hinzugefügt werden. ⓘ
Mit Hilfe der Gentechnik könnten schwere genetische Störungen beim Menschen behoben werden, indem das defekte Gen durch ein funktionierendes ersetzt wird. Sie ist ein wichtiges Instrument in der Forschung, mit dem die Funktion bestimmter Gene untersucht werden kann. Medikamente, Impfstoffe und andere Produkte wurden aus Organismen gewonnen, die zu ihrer Herstellung manipuliert wurden. Es wurden Nutzpflanzen entwickelt, die zur Ernährungssicherheit beitragen, indem sie den Ertrag, den Nährwert und die Toleranz gegenüber Umweltbelastungen erhöhen. ⓘ
Die DNA kann direkt in den Wirtsorganismus oder in eine Zelle eingebracht werden, die dann mit dem Wirtsorganismus fusioniert oder hybridisiert wird. Dabei werden rekombinante Nukleinsäuretechniken eingesetzt, um neue Kombinationen von vererbbarem genetischem Material zu bilden, das dann entweder indirekt über ein Vektorsystem oder direkt durch Mikro- oder Makroinjektion oder Mikroverkapselung eingebracht wird. ⓘ
Die Gentechnik umfasst in der Regel nicht die traditionelle Züchtung, die In-vitro-Fertilisation, die Induktion von Polyploidie, die Mutagenese und Zellfusionstechniken, bei denen keine rekombinanten Nukleinsäuren oder ein genetisch veränderter Organismus verwendet werden. Einige weit gefasste Definitionen der Gentechnik schließen jedoch auch die selektive Züchtung ein. Klonen und Stammzellenforschung werden zwar nicht als Gentechnik angesehen, sind aber eng miteinander verwandt, und die Gentechnik kann in diesen Bereichen eingesetzt werden. Die synthetische Biologie ist eine aufstrebende Disziplin, die die Gentechnik noch einen Schritt weiter treibt, indem sie künstlich synthetisiertes Material in einen Organismus einführt. ⓘ
Pflanzen, Tiere oder Mikroorganismen, die durch Gentechnik verändert wurden, werden als gentechnisch veränderte Organismen oder GVO bezeichnet. Wird dem Wirtsorganismus genetisches Material einer anderen Art hinzugefügt, wird der daraus resultierende Organismus als transgen bezeichnet. Wird genetisches Material derselben Art oder einer Art, die sich auf natürliche Weise mit dem Wirt vermehren kann, verwendet, wird der resultierende Organismus als cisgen bezeichnet. Wird mit Hilfe der Gentechnik genetisches Material aus dem Zielorganismus entfernt, wird der resultierende Organismus als Knockout-Organismus bezeichnet. In Europa ist die gentechnische Veränderung ein Synonym für die Gentechnik, während in den Vereinigten Staaten von Amerika und Kanada die gentechnische Veränderung auch für konventionellere Züchtungsmethoden verwendet werden kann. ⓘ
Geschichte
Seit Tausenden von Jahren verändert der Mensch das Genom von Arten durch selektive Züchtung oder künstliche Selektion im Gegensatz zur natürlichen Selektion. In jüngerer Zeit wurde bei der Mutationszüchtung die Einwirkung von Chemikalien oder Strahlung genutzt, um eine hohe Frequenz zufälliger Mutationen zu erzeugen, die der selektiven Züchtung dienen. Gentechnik als direkte Manipulation der DNA durch den Menschen außerhalb der Züchtung und Mutation gibt es erst seit den 1970er Jahren. Der Begriff "Gentechnik" wurde erstmals von Jack Williamson in seinem 1951 veröffentlichten Science-Fiction-Roman Dragon's Island geprägt - ein Jahr, bevor die Rolle der DNA bei der Vererbung von Alfred Hershey und Martha Chase bestätigt wurde, und zwei Jahre, bevor James Watson und Francis Crick zeigten, dass das DNA-Molekül eine Doppelhelix-Struktur hat -, obwohl das allgemeine Konzept der direkten genetischen Manipulation in rudimentärer Form in Stanley G. Weinbaums Science-Fiction-Geschichte Proteus Island von 1936 erforscht wurde. ⓘ

1972 schuf Paul Berg die ersten rekombinanten DNA-Moleküle, indem er die DNA des Affenvirus SV40 mit der des Lambda-Virus kombinierte. 1973 schufen Herbert Boyer und Stanley Cohen den ersten transgenen Organismus, indem sie Antibiotikaresistenzgene in das Plasmid eines Escherichia coli-Bakteriums einfügten. Ein Jahr später schuf Rudolf Jaenisch eine transgene Maus, indem er fremde DNA in ihren Embryo einfügte, was sie zum ersten transgenen Tier der Welt machte. Diese Errungenschaften führten in der wissenschaftlichen Gemeinschaft zu Bedenken über mögliche Risiken der Gentechnik, die erstmals 1975 auf der Asilomar-Konferenz eingehend diskutiert wurden. Eine der wichtigsten Empfehlungen dieser Konferenz lautete, dass eine staatliche Aufsicht über die rekombinante DNA-Forschung eingerichtet werden sollte, bis die Technologie als sicher gilt. ⓘ
1976 wurde Genentech, das erste Gentechnikunternehmen, von Herbert Boyer und Robert Swanson gegründet, und ein Jahr später produzierte das Unternehmen ein menschliches Protein (Somatostatin) in E. coli. Im Jahr 1978 gab Genentech die Produktion von gentechnisch hergestelltem menschlichem Insulin bekannt. 1980 entschied der Oberste Gerichtshof der USA im Fall Diamond gegen Chakrabarty, dass genetisch verändertes Leben patentiert werden kann. Das von Bakterien produzierte Insulin wurde 1982 von der Food and Drug Administration (FDA) zur Freigabe zugelassen. ⓘ
1983 beantragte das Biotech-Unternehmen Advanced Genetic Sciences (AGS) bei der US-Regierung die Genehmigung zur Durchführung von Feldversuchen mit dem Ice-minus-Stamm von Pseudomonas syringae zum Schutz von Nutzpflanzen vor Frost, aber Umweltgruppen und Demonstranten verzögerten die Feldversuche vier Jahre lang durch rechtliche Anfechtungen. 1987 wurde der Ice-minus-Stamm von P. syringae zum ersten gentechnisch veränderten Organismus (GVO), der in die Umwelt freigesetzt wurde, als ein Erdbeerfeld und ein Kartoffelfeld in Kalifornien mit ihm besprüht wurden. Beide Versuchsfelder wurden in der Nacht vor den Versuchen von Aktivistengruppen angegriffen: "Das erste Versuchsfeld der Welt zog den ersten Feldschänder der Welt an". ⓘ
Die ersten Freilandversuche mit gentechnisch veränderten Pflanzen fanden 1986 in Frankreich und den USA statt; Tabakpflanzen wurden so verändert, dass sie gegen Herbizide resistent waren. Die Volksrepublik China war das erste Land, das transgene Pflanzen auf den Markt brachte: 1992 wurde ein virusresistenter Tabak eingeführt. Im Jahr 1994 erhielt Calgene die Genehmigung für die kommerzielle Freigabe des ersten gentechnisch veränderten Lebensmittels, der Flavr Savr, einer Tomate, die so verändert wurde, dass sie länger haltbar ist. 1994 erteilte die Europäische Union die Zulassung für Tabak, der gegen das Herbizid Bromoxynil resistent ist, und machte ihn damit zur ersten gentechnisch veränderten Nutzpflanze, die in Europa vermarktet wurde. 1995 wurde die Bt-Kartoffel von der Umweltschutzbehörde als sicher eingestuft, nachdem sie zuvor von der FDA zugelassen worden war. Damit war sie die erste pestizidproduzierende Nutzpflanze, die in den USA zugelassen wurde. Im Jahr 2009 wurden 11 transgene Pflanzen in 25 Ländern kommerziell angebaut, wobei die größten Anbauflächen in den USA, Brasilien, Argentinien, Indien, Kanada, China, Paraguay und Südafrika lagen. ⓘ
Im Jahr 2010 schufen Wissenschaftler des J. Craig Venter Institute das erste synthetische Genom und fügten es in eine leere Bakterienzelle ein. Das daraus entstandene Bakterium mit dem Namen Mycoplasma laboratorium konnte sich vermehren und Proteine produzieren. Vier Jahre später ging man noch einen Schritt weiter, als ein Bakterium entwickelt wurde, das ein Plasmid mit einem einzigartigen Basenpaar replizierte und so den ersten Organismus schuf, der ein erweitertes genetisches Alphabet verwenden konnte. Im Jahr 2012 entwickelten Jennifer Doudna und Emmanuelle Charpentier gemeinsam das CRISPR/Cas9-System, eine Technik, mit der sich das Genom fast aller Organismen einfach und gezielt verändern lässt. ⓘ
Vor etwa 8000 Jahren wurde im heutigen Mexiko durch Züchtung das Erbgut von Teosinte-Getreide durch die Kombination von natürlich vorkommenden Mutationen so verändert, dass die Vorläufer der heutigen Mais-Sorten entstanden. Dadurch wurde nicht nur der Ertrag erhöht, sondern auch eine Pilzresistenz erzeugt. ⓘ
Künstliche Mutationen für Züchtungszwecke wurden innerhalb der konventionellen Landwirtschaft erzeugt, indem Keime stark ionisierender Strahlung oder anderen genverändernden Einflüssen (Mutagenen) ausgesetzt wurden, um Mutationen im Erbgut häufiger als unter natürlichen Bedingungen hervorzurufen. Samen wurden ausgesät und jene Pflanzen, die die gewünschten Eigenschaften besaßen, wurden weiter gezüchtet. Ob dabei auch noch andere, unerwünschte, Eigenschaften entstanden, wurde nicht systematisch überprüft. Diese Technik wurde bei fast allen Nutzpflanzen und auch bei einigen Tierarten angewendet, jedoch lag der Erfolg der Mutationszüchtung bei Pflanzen nur zwischen 0,5 und 1 % an züchterisch brauchbaren Mutanten, bei Tieren ist diese Methode überhaupt nicht zu gebrauchen. ⓘ

Die eigentliche Geschichte der Gentechnik begann, als es Ray Wu und Ellen Taylor 1971 gelang, mit Hilfe von 1970 entdeckten Restriktionsenzymen eine Sequenz von 12 Basenpaaren vom Ende des Genoms eines Lambdavirus abzutrennen. Zwei Jahre später erzeugte man das erste genetisch veränderte rekombinante Bakterium, indem ein Plasmid mit vereinter viraler und bakterieller DNA in das Darmbakterium Escherichia coli eingeschleust wurde. Angesichts dieser Fortschritte fand im Februar 1975 die Asilomar-Konferenz in Pacific Grove, Kalifornien, statt. Auf der Konferenz diskutierten 140 Molekularbiologen aus 16 Ländern Sicherheitsauflagen, unter denen die Forschung weiter stattfinden sollte. Die Ergebnisse waren Grundlage für staatliche Regelungen in den Vereinigten Staaten und später in vielen anderen Staaten. 1977 gelang erstmals die gentechnische Herstellung eines menschlichen Proteins in einem Bakterium. Im selben Jahr entwickelten Walter Gilbert, Allan Maxam und Frederick Sanger unabhängig voneinander Methoden zur effizienten DNA-Sequenzierung, für die sie 1980 mit dem Nobelpreis für Chemie ausgezeichnet wurden. Ende der 1970er Jahre entdeckten die Belgier Marc Van Montagu und Jeff Schell die Möglichkeit, mittels Agrobacterium tumefaciens Gene in Pflanzen einzuschleusen und legten damit den Grundstein für die Grüne Gentechnik. ⓘ
1980 beantragte Ananda Chakrabarty in den USA das erste Patent auf einen GVO, dessen Zulassungsverfahren bis vor den Supreme Court getragen wurde. Dieser entschied 1981, dass der Fakt, dass Mikro-Organismen lebendig sind, keine gesetzliche Bedeutung für den Zweck des Patent-Rechtes habe und machte damit den Weg für die Patentierung von Lebewesen frei. 1982 kam in den Vereinigten Staaten mit Insulin das erste gentechnisch hergestellte Medikament auf den Markt. 1982 wurde mit dem Bakteriophagen Lambda das erste Virus in seiner vollständigen DNA-Sequenz veröffentlicht. Im Jahr 1983 entwickelte Kary Mullis die Polymerase-Kettenreaktion, mit der DNA-Sequenzen vervielfältigt werden können und erhielt dafür 1993 den Chemie-Nobelpreis. 1985 wurden genetisch manipulierte Pflanzen in den USA patentierbar und es erfolgte die erste Freisetzung genetisch manipulierter Bakterien (ice minus bacteria). 1988 wurde das erste Patent für ein gentechnisch verändertes Säugetier, die sogenannte Krebsmaus, vergeben. ⓘ
Ab Herbst 1990 wurde im Humangenomprojekt damit begonnen, das gesamte Genom des Menschen zu sequenzieren. Am 14. September 1990 wurde die weltweit erste Gentherapie an einem vierjährigen Mädchen durchgeführt. Im Jahr 1994 kamen im Vereinigten Königreich und den Vereinigten Staaten gentechnisch veränderte Flavr-Savr-Tomaten, auf den Markt. ⓘ
Im Jahr 1996 wurden erstmals transgene Sojabohnen in den USA angebaut. Der Import dieser Sojabohnen nach Deutschland führte dort zu ersten öffentlichen Kontroversen über die Verwendung von Gentechnologie in der Landwirtschaft. Greenpeace führte im Herbst 1996 mehrfach illegale Protestaktionen durch, wie Behinderung der Löschung und Beschriften von Frachtern. ⓘ
Die Firma Celera und International Genetics & Health Collaboratory behaupteten 2001, das menschliche Genom, parallel zum Humangenomprojekt, vollständig entschlüsselt zu haben. Jedoch war die Sequenzierung nicht vollständig. Ein Jahr später wurde der erste in seiner Keimbahn gentechnisch veränderte Primat geboren. ⓘ
Verfahren
Die Schaffung eines GVO ist ein mehrstufiger Prozess. Die Gentechniker müssen zunächst auswählen, welches Gen sie in den Organismus einfügen wollen. Dies hängt davon ab, welches Ziel mit dem entstehenden Organismus verfolgt wird, und baut auf früheren Forschungsarbeiten auf. Es können genetische Screens durchgeführt werden, um potenzielle Gene zu ermitteln, und dann weitere Tests, um die besten Kandidaten zu identifizieren. Die Entwicklung von Microarrays, Transkriptomik und Genomsequenzierung hat die Suche nach geeigneten Genen erheblich erleichtert. Auch der Zufall spielt eine Rolle: Das Roundup-Ready-Gen wurde entdeckt, nachdem Wissenschaftler ein Bakterium entdeckt hatten, das in Gegenwart des Herbizids gedeiht. ⓘ
Genisolierung und Klonen
Der nächste Schritt besteht darin, das Kandidatengen zu isolieren. Die Zelle, die das Gen enthält, wird geöffnet, und die DNA wird gereinigt. Das Gen wird aufgetrennt, indem die DNA mit Restriktionsenzymen in Fragmente zerschnitten oder mit der Polymerase-Kettenreaktion (PCR) vervielfältigt wird. Diese Segmente können dann durch Gelelektrophorese extrahiert werden. Wenn das ausgewählte Gen oder das Genom des Spenderorganismus gut erforscht ist, kann es bereits in einer genetischen Bibliothek vorhanden sein. Wenn die DNA-Sequenz bekannt ist, aber keine Kopien des Gens zur Verfügung stehen, kann es auch künstlich synthetisiert werden. Nach der Isolierung wird das Gen in ein Plasmid ligiert, das dann in ein Bakterium eingebracht wird. Das Plasmid wird bei der Teilung der Bakterien repliziert, so dass eine unbegrenzte Anzahl von Kopien des Gens zur Verfügung steht. Das RK2-Plasmid zeichnet sich durch seine Fähigkeit aus, sich in einer Vielzahl von Einzellern zu replizieren, was es zu einem geeigneten Werkzeug für die Gentechnik macht. ⓘ
Bevor das Gen in den Zielorganismus eingeführt wird, muss es mit anderen genetischen Elementen kombiniert werden. Dazu gehören ein Promotor und eine Terminatorregion, die die Transkription einleiten und beenden. Ein selektierbares Markergen wird hinzugefügt, das in den meisten Fällen eine Antibiotikaresistenz verleiht, so dass die Forscher leicht feststellen können, welche Zellen erfolgreich transformiert wurden. Das Gen kann in diesem Stadium auch verändert werden, um eine bessere Expression oder Wirksamkeit zu erzielen. Diese Manipulationen werden mit Hilfe rekombinanter DNA-Techniken wie Restriktionsverdauung, Ligationen und molekularem Klonen durchgeführt. ⓘ
Einfügen von DNA in das Wirtsgenom

Es gibt eine Reihe von Techniken, um genetisches Material in das Wirtsgenom einzufügen. Einige Bakterien können von Natur aus fremde DNA aufnehmen. Bei anderen Bakterien kann diese Fähigkeit durch Stress (z. B. thermischer oder elektrischer Schock) hervorgerufen werden, der die Durchlässigkeit der Zellmembran für DNA erhöht; die aufgenommene DNA kann entweder in das Genom integriert werden oder als extrachromosomale DNA vorliegen. Die DNA wird im Allgemeinen durch Mikroinjektion in tierische Zellen eingebracht, wobei sie durch die Kernhülle der Zelle direkt in den Zellkern injiziert werden kann, oder durch die Verwendung viraler Vektoren. ⓘ
Pflanzengenome können durch physikalische Methoden oder durch die Verwendung von Agrobacterium für die Einbringung von Sequenzen, die in binären T-DNA-Vektoren untergebracht sind, manipuliert werden. Bei Pflanzen wird die DNA häufig durch Agrobacterium-vermittelte Transformation eingefügt, wobei die T-DNA-Sequenz des Agrobacteriums genutzt wird, die eine natürliche Einfügung von genetischem Material in Pflanzenzellen ermöglicht. Andere Methoden sind die Biolistik, bei der Gold- oder Wolframpartikel mit DNA beschichtet und dann in junge Pflanzenzellen geschossen werden, und die Elektroporation, bei der die Zellmembran durch einen Stromschlag durchlässig für Plasmid-DNA gemacht wird. ⓘ
Da nur eine einzige Zelle mit genetischem Material transformiert wird, muss der Organismus aus dieser einzigen Zelle regeneriert werden. Bei Pflanzen wird dies durch die Verwendung von Gewebekulturen erreicht. Bei Tieren muss sichergestellt werden, dass die eingefügte DNA in den embryonalen Stammzellen vorhanden ist. Bakterien bestehen aus einer einzigen Zelle und vermehren sich klonal, so dass eine Regeneration nicht erforderlich ist. Selektierbare Marker werden verwendet, um transformierte von nicht transformierten Zellen leicht unterscheiden zu können. Diese Marker sind in der Regel im transgenen Organismus vorhanden, obwohl eine Reihe von Strategien entwickelt wurden, die den selektierbaren Marker aus der reifen transgenen Pflanze entfernen können. ⓘ

Weitere Tests mittels PCR, Southern-Hybridisierung und DNA-Sequenzierung werden durchgeführt, um zu bestätigen, dass ein Organismus das neue Gen enthält. Diese Tests können auch die chromosomale Position und die Kopienzahl des eingefügten Gens bestätigen. Das Vorhandensein des Gens ist keine Garantie dafür, dass es im Zielgewebe in angemessener Menge exprimiert wird. Daher werden auch Methoden angewandt, mit denen die Genprodukte (RNA und Protein) gesucht und gemessen werden. Dazu gehören Nordhybridisierung, quantitative RT-PCR, Western Blot, Immunfluoreszenz, ELISA und phänotypische Analyse. ⓘ
Das neue genetische Material kann willkürlich in das Wirtsgenom eingefügt werden oder gezielt an einer bestimmten Stelle. Bei der Technik des Gen-Targeting wird die homologe Rekombination genutzt, um die gewünschten Veränderungen an einem bestimmten endogenen Gen vorzunehmen. Dies geschieht bei Pflanzen und Tieren in der Regel mit einer relativ geringen Häufigkeit und erfordert im Allgemeinen die Verwendung selektierbarer Marker. Die Häufigkeit des Gene Targeting kann durch Genome Editing erheblich gesteigert werden. Beim Genome Editing werden künstlich hergestellte Nukleasen verwendet, die spezifische Doppelstrangbrüche an den gewünschten Stellen im Genom erzeugen und die körpereigenen Mechanismen der Zelle nutzen, um die induzierten Brüche durch die natürlichen Prozesse der homologen Rekombination und des nonhomologen Endjoining zu reparieren. Es gibt vier Familien von Nukleasen: Meganukleasen, Zinkfingernukleasen, Transkriptionsaktivator-ähnliche Effektornukleasen (TALENs) und das Cas9-guideRNA-System (adaptiert von CRISPR). TALEN und CRISPR sind die beiden am häufigsten verwendeten Systeme und haben jeweils ihre eigenen Vorteile. TALENs haben eine größere Zielspezifität, während CRISPR einfacher zu entwickeln und effizienter ist. Zusätzlich zur Verbesserung der Zielgenauigkeit von Genen können mit Hilfe von Nukleasen Mutationen in endogene Gene eingebracht werden, die einen Gen-Knockout bewirken. ⓘ
Anwendungen
Die Gentechnik findet Anwendung in Medizin, Forschung, Industrie und Landwirtschaft und kann bei einer Vielzahl von Pflanzen, Tieren und Mikroorganismen eingesetzt werden. In Bakterien, den ersten Organismen, die gentechnisch verändert wurden, kann Plasmid-DNA mit neuen Genen eingefügt werden, die für Medikamente oder Enzyme zur Verarbeitung von Lebensmitteln und anderen Substraten kodieren. Pflanzen wurden im Hinblick auf Insektenschutz, Herbizidresistenz, Virusresistenz, verbesserte Ernährung, Toleranz gegenüber Umweltbelastungen und die Herstellung von essbaren Impfstoffen verändert. Die meisten kommerziell genutzten GVO sind insektenresistente oder herbizidtolerante Nutzpflanzen. Gentechnisch veränderte Tiere werden für die Forschung, als Modelltiere und zur Herstellung von landwirtschaftlichen oder pharmazeutischen Produkten verwendet. Zu den gentechnisch veränderten Tieren gehören Tiere mit ausgeschalteten Genen, erhöhter Krankheitsanfälligkeit, Hormonen für zusätzliches Wachstum und der Fähigkeit, Proteine in ihrer Milch zu produzieren. ⓘ
Transgene Tiere werden vor allem in der Forschung als Versuchstiere eingesetzt. Diese Tiere sind für den menschlichen Verzehr sowie zur Eindämmung von Infektionskrankheiten noch nicht zugelassen. ⓘ
Medizin
Die Gentechnik findet in der Medizin zahlreiche Anwendungen, z. B. bei der Herstellung von Arzneimitteln, der Schaffung von Modelltieren, die menschliche Krankheiten nachahmen, und der Gentherapie. Eine der frühesten Anwendungen der Gentechnik war die Massenproduktion von menschlichem Insulin in Bakterien. Diese Anwendung wurde inzwischen auf menschliche Wachstumshormone, follikelstimulierende Hormone (zur Behandlung von Unfruchtbarkeit), menschliches Albumin, monoklonale Antikörper, Antihämophiliefaktoren, Impfstoffe und viele andere Arzneimittel übertragen. Mäusehybridome, Zellen, die zur Bildung von monoklonalen Antikörpern miteinander verschmolzen sind, wurden gentechnisch angepasst, um menschliche monoklonale Antikörper zu erzeugen. Es werden gentechnisch veränderte Viren entwickelt, die immer noch Immunität verleihen können, denen aber die infektiösen Sequenzen fehlen. ⓘ
Die Gentechnik wird auch eingesetzt, um Tiermodelle für menschliche Krankheiten zu schaffen. Gentechnisch veränderte Mäuse sind das am häufigsten verwendete gentechnische Tiermodell. Sie wurden zur Erforschung und Modellierung von Krebs (Onkomaus), Fettleibigkeit, Herzerkrankungen, Diabetes, Arthritis, Drogenmissbrauch, Angstzuständen, Alterung und Parkinson-Krankheit eingesetzt. Potenzielle Heilmittel können an diesen Mausmodellen getestet werden. ⓘ
Gentherapie ist die gentechnische Veränderung des Menschen, in der Regel durch den Ersatz defekter Gene durch wirksame Gene. Klinische Forschungen mit somatischer Gentherapie wurden bei verschiedenen Krankheiten durchgeführt, darunter X-chromosomal bedingte SCID, chronische lymphatische Leukämie (CLL) und die Parkinsonsche Krankheit. Im Jahr 2012 wurde Alipogene tiparvovec als erste gentherapeutische Behandlung für den klinischen Einsatz zugelassen. Im Jahr 2015 wurde ein Virus verwendet, um ein gesundes Gen in die Hautzellen eines Jungen einzuschleusen, der an der seltenen Hautkrankheit Epidermolysis bullosa litt, um zu wachsen und dann gesunde Haut auf 80 Prozent des Körpers des Jungen zu transplantieren, der von der Krankheit betroffen war. ⓘ
Die Keimbahn-Gentherapie würde dazu führen, dass jede Veränderung vererbbar ist, was in der wissenschaftlichen Gemeinschaft Bedenken hervorgerufen hat. Im Jahr 2015 wurde CRISPR eingesetzt, um die DNA nicht lebensfähiger menschlicher Embryonen zu verändern, woraufhin Wissenschaftler der wichtigsten Akademien der Welt ein Moratorium für vererbbare Veränderungen des menschlichen Genoms forderten. Es gibt auch Bedenken, dass die Technologie nicht nur zur Behandlung, sondern auch zur Verbesserung, Modifizierung oder Veränderung des Aussehens, der Anpassungsfähigkeit, der Intelligenz, des Charakters oder des Verhaltens eines Menschen eingesetzt werden könnte. Die Unterscheidung zwischen Heilung und Verbesserung kann ebenfalls schwer zu treffen sein. Im November 2018 gab He Jiankui bekannt, dass er die Genome zweier menschlicher Embryonen bearbeitet hatte, um zu versuchen, das CCR5-Gen zu deaktivieren, das für einen Rezeptor kodiert, den HIV zum Eindringen in Zellen nutzt. Die Arbeit wurde weithin als unethisch, gefährlich und verfrüht verurteilt. Derzeit ist die Keimbahnveränderung in 40 Ländern verboten. Wissenschaftler, die diese Art von Forschung betreiben, lassen Embryonen oft einige Tage lang wachsen, ohne sie zu einem Baby heranwachsen zu lassen. ⓘ
Forscher verändern das Genom von Schweinen, um das Wachstum menschlicher Organe zu fördern, mit dem Ziel, den Erfolg von Organtransplantationen von Schweinen auf Menschen zu erhöhen. Wissenschaftler verändern das Genom von Moskitos, um sie immun gegen Malaria zu machen, und versuchen dann, die genetisch veränderten Moskitos in der gesamten Moskitopopulation zu verbreiten, in der Hoffnung, die Krankheit zu eliminieren. ⓘ
Forschung

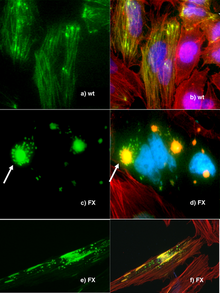
Die Gentechnik ist ein wichtiges Werkzeug für Naturwissenschaftler, wobei die Schaffung transgener Organismen eines der wichtigsten Instrumente für die Analyse der Genfunktion darstellt. Gene und andere genetische Informationen aus einem breiten Spektrum von Organismen können zur Speicherung und Veränderung in Bakterien eingebracht werden, wodurch genetisch veränderte Bakterien entstehen. Bakterien sind billig, leicht zu züchten, klonal, vermehren sich schnell, sind relativ leicht zu transformieren und können bei -80 °C fast unbegrenzt gelagert werden. Sobald ein Gen isoliert ist, kann es in den Bakterien gespeichert werden, so dass ein unbegrenzter Vorrat für die Forschung zur Verfügung steht. ⓘ
Organismen werden gentechnisch verändert, um die Funktionen bestimmter Gene zu entdecken. Dies könnte die Auswirkung auf den Phänotyp des Organismus sein, wo das Gen exprimiert wird oder mit welchen anderen Genen es interagiert. Bei diesen Experimenten geht es im Allgemeinen um Funktionsverlust, Funktionsgewinn, Verfolgung und Expression. ⓘ
- Funktionsverlustexperimente, wie z. B. ein Gen-Knockout-Experiment, bei dem ein Organismus so manipuliert wird, dass die Aktivität eines oder mehrerer Gene fehlt. Bei einem einfachen Knockout wurde eine Kopie des gewünschten Gens so verändert, dass es nicht mehr funktioniert. Embryonale Stammzellen nehmen das veränderte Gen auf, das die bereits vorhandene funktionale Kopie ersetzt. Diese Stammzellen werden in Blastozysten injiziert, die dann einer Leihmutter eingepflanzt werden. Auf diese Weise kann der Experimentator die durch die Mutation verursachten Defekte analysieren und so die Rolle bestimmter Gene bestimmen. Diese Methode wird besonders häufig in der Entwicklungsbiologie eingesetzt. Wenn dabei eine Bibliothek von Genen mit Punktmutationen an jeder Position im interessierenden Bereich oder sogar an jeder Position im gesamten Gen erstellt wird, spricht man von "Scanning-Mutagenese". Die einfachste Methode, die als erste angewandt wurde, ist das "Alanin-Scanning", bei dem jede Position der Reihe nach zu der unreaktiven Aminosäure Alanin mutiert wird.
- Gain of Function"-Experimente, das logische Gegenstück zu Knockouts. Diese werden manchmal in Verbindung mit Knockout-Experimenten durchgeführt, um die Funktion des gewünschten Gens genauer zu bestimmen. Das Verfahren ist dem des Knockout-Engineerings sehr ähnlich, mit dem Unterschied, dass das Konstrukt darauf ausgelegt ist, die Funktion des Gens zu erhöhen, in der Regel durch die Bereitstellung zusätzlicher Kopien des Gens oder die Induktion einer häufigeren Synthese des Proteins. Der Funktionsgewinn wird verwendet, um festzustellen, ob ein Protein für eine Funktion ausreicht oder nicht, aber er bedeutet nicht immer, dass es erforderlich ist, insbesondere wenn es sich um genetische oder funktionelle Redundanz handelt.
- Tracking-Experimente, mit denen Informationen über die Lokalisierung und Interaktion des gewünschten Proteins gewonnen werden sollen. Eine Möglichkeit, dies zu tun, besteht darin, das Wildtyp-Gen durch ein "Fusionsgen" zu ersetzen, d. h. eine Aneinanderreihung des Wildtyp-Gens mit einem Meldeelement wie dem grün fluoreszierenden Protein (GFP), das eine einfache Visualisierung der Produkte der genetischen Veränderung ermöglicht. Dies ist zwar eine nützliche Technik, aber die Manipulation kann die Funktion des Gens zerstören, was zu Sekundäreffekten führt und möglicherweise die Ergebnisse des Experiments in Frage stellt. Derzeit werden ausgefeiltere Techniken entwickelt, mit denen die Proteinprodukte verfolgt werden können, ohne ihre Funktion zu beeinträchtigen, wie z. B. das Hinzufügen kleiner Sequenzen, die als Bindungsmotive für monoklonale Antikörper dienen sollen.
- Expressionsstudien zielen darauf ab, herauszufinden, wo und wann bestimmte Proteine produziert werden. Bei diesen Experimenten wird die DNA-Sequenz vor der DNA, die für ein Protein kodiert, der so genannte Promotor eines Gens, wieder in einen Organismus eingebracht, wobei der Bereich, der das Protein kodiert, durch ein Reportergen wie GFP oder ein Enzym, das die Produktion eines Farbstoffs katalysiert, ersetzt wird. So kann beobachtet werden, wann und wo ein bestimmtes Protein produziert wird. Expressionsstudien können noch einen Schritt weiter gehen, indem der Promotor verändert wird, um herauszufinden, welche Teile für die korrekte Expression des Gens entscheidend sind und tatsächlich von Transkriptionsfaktorproteinen gebunden werden; dieser Vorgang wird als Promotor-Bashing bezeichnet. ⓘ
Industrielle

Die Zellen von Organismen können mit einem Gen transformiert werden, das für ein nützliches Protein, z. B. ein Enzym, kodiert, so dass sie das gewünschte Protein überexprimieren. Das Protein kann dann in großen Mengen hergestellt werden, indem der transformierte Organismus in Bioreaktoren durch industrielle Fermentation gezüchtet und das Protein anschließend gereinigt wird. Einige Gene funktionieren nicht gut in Bakterien, so dass auch Hefe-, Insekten- oder Säugetierzellen verwendet werden können. Diese Techniken werden zur Herstellung von Arzneimitteln wie Insulin, menschlichen Wachstumshormonen und Impfstoffen, von Nahrungsergänzungsmitteln wie Tryptophan, von Hilfsmitteln für die Lebensmittelherstellung (Chymosin für die Käseherstellung) und von Kraftstoffen eingesetzt. Andere Anwendungen mit gentechnisch veränderten Bakterien könnten darin bestehen, sie Aufgaben außerhalb ihres natürlichen Zyklus erfüllen zu lassen, z. B. die Herstellung von Biokraftstoffen, die Beseitigung von Ölverschmutzungen, Kohlenstoff und anderen giftigen Abfällen und den Nachweis von Arsen im Trinkwasser. Bestimmte gentechnisch veränderte Mikroben können auch im Biomining und in der Bioremediation eingesetzt werden, da sie in der Lage sind, Schwermetalle aus ihrer Umgebung zu extrahieren und sie in Verbindungen einzubauen, die sich leichter zurückgewinnen lassen. ⓘ
In der Materialwissenschaft wurde ein gentechnisch verändertes Virus in einem Forschungslabor als Gerüst für den Aufbau einer umweltfreundlicheren Lithium-Ionen-Batterie verwendet. Auch Bakterien wurden so verändert, dass sie als Sensoren fungieren, indem sie unter bestimmten Umweltbedingungen ein fluoreszierendes Protein exprimieren. ⓘ
Landwirtschaft

Eine der bekanntesten und umstrittensten Anwendungen der Gentechnik ist die Erzeugung und Verwendung gentechnisch veränderter Nutzpflanzen oder gentechnisch veränderter Nutztiere zur Erzeugung gentechnisch veränderter Lebensmittel. Die Pflanzen wurden entwickelt, um die Produktion zu steigern, die Toleranz gegenüber abiotischen Stressfaktoren zu erhöhen, die Zusammensetzung der Lebensmittel zu verändern oder neuartige Produkte herzustellen. ⓘ
Die ersten Nutzpflanzen, die in großem Maßstab kommerziell freigesetzt wurden, boten Schutz vor Schädlingen oder Toleranz gegenüber Herbiziden. Auch pilz- und virusresistente Pflanzen wurden entwickelt oder befinden sich in der Entwicklung. Dies erleichtert die Schädlings- und Unkrautbekämpfung und kann indirekt den Ernteertrag erhöhen. Gentechnisch veränderte Pflanzen, die den Ertrag direkt verbessern, indem sie das Wachstum beschleunigen oder die Pflanze widerstandsfähiger machen (indem sie salz-, kälte- oder trockenheitsresistenter werden), befinden sich ebenfalls in der Entwicklung. Im Jahr 2016 wurden Lachse mit Wachstumshormonen gentechnisch so verändert, dass sie viel schneller ihre normale Größe erreichen. ⓘ
Es wurden GVO entwickelt, die die Qualität von Produkten verändern, indem sie den Nährwert erhöhen oder industriell nutzbare Eigenschaften oder Mengen liefern. Die Amflora-Kartoffel produziert eine für die Industrie nützlichere Stärkemischung. Sojabohnen und Raps wurden gentechnisch verändert, um gesündere Öle zu produzieren. Das erste kommerziell genutzte gentechnisch veränderte Lebensmittel war eine Tomate, die eine verzögerte Reifung aufwies und dadurch länger haltbar war. ⓘ
Pflanzen und Tiere wurden so verändert, dass sie Stoffe produzieren, die sie normalerweise nicht herstellen. In der Pharmazie werden Pflanzen und Tiere als Bioreaktoren verwendet, um Impfstoffe, Zwischenprodukte oder die Medikamente selbst herzustellen; das nützliche Produkt wird aus der Ernte gereinigt und dann im normalen pharmazeutischen Produktionsprozess verwendet. Kühe und Ziegen wurden so manipuliert, dass sie Medikamente und andere Proteine in ihrer Milch produzieren. 2009 hat die FDA ein in Ziegenmilch hergestelltes Medikament zugelassen. ⓘ
Andere Anwendungen
Die Gentechnik kann auch im Naturschutz und bei der Bewirtschaftung von Naturgebieten eingesetzt werden. Der Gentransfer durch virale Vektoren wurde als Mittel zur Bekämpfung invasiver Arten und zur Impfung bedrohter Tierarten gegen Krankheiten vorgeschlagen. Transgene Bäume wurden als Möglichkeit vorgeschlagen, Wildpopulationen eine Resistenz gegen Krankheitserreger zu verleihen. Angesichts des zunehmenden Risikos von Fehlanpassungen bei Organismen infolge des Klimawandels und anderer Störungen könnte eine erleichterte Anpassung durch die Veränderung von Genen eine Lösung zur Verringerung des Aussterberisikos sein. Die Anwendungen der Gentechnik im Naturschutz sind bisher überwiegend theoretisch und müssen noch in die Praxis umgesetzt werden. ⓘ
Die Gentechnik wird auch zur Schaffung mikrobieller Kunstwerke eingesetzt. Einige Bakterien wurden gentechnisch so verändert, dass sie Schwarz-Weiß-Fotos erstellen können. Neuartige Gegenstände wie lavendelfarbene Nelken, blaue Rosen und leuchtende Fische wurden ebenfalls mit Hilfe der Gentechnik hergestellt. ⓘ
Weiße Gentechnik
Durch gelenkte Evolution werden hier Stämme von Mikroorganismen erzeugt und aufgrund ihrer Erträge der gewünschten Produkte, die durch ein Screening festgestellt wurden, selektiert. Dieser Vorgang wird in iterativen Zyklen wiederholt, bis die angestrebten Veränderungen erreicht sind. Zur Identifizierung von nicht kultivierbaren Organismen untersucht man Metagenome, d. h. die Gesamtheit der Genome eines Lebensraums, Biotops oder einer Lebensgemeinschaft (Biozönose). In Metagenomen können beispielsweise Biokatalysatoren aufgefunden werden, die bisher noch nicht bekannte biochemische Reaktionen katalysieren und neue, interessante Stoffwechselprodukte bilden. ⓘ
Zum Einschleusen von Plasmid-DNA in das Bakterium wird u. a. die Eigenschaft von Calciumchlorid genutzt, Zellmembranen durchlässig zu machen. ⓘ
Verordnung
Bei der Regulierung der Gentechnik geht es darum, wie die Regierungen die mit der Entwicklung und Freisetzung von GVO verbundenen Risiken bewerten und handhaben. Die Entwicklung eines rechtlichen Rahmens begann 1975 in Asilomar, Kalifornien. Auf dem Asilomar-Treffen wurde eine Reihe freiwilliger Leitlinien für den Einsatz der rekombinanten Technologie empfohlen. Als sich die Technologie verbesserte, richteten die USA einen Ausschuss beim Office of Science and Technology ein, der die Zulassung von gentechnisch veränderten Lebensmitteln an das USDA, die FDA und die EPA übertrug. Das Cartagena-Protokoll über die biologische Sicherheit, ein internationales Abkommen, das die Weitergabe, den Umgang und die Verwendung von GVO regelt, wurde am 29. Januar 2000 verabschiedet. Einhundertsiebenundfünfzig Länder sind Mitglieder des Protokolls, und viele nutzen es als Referenzpunkt für ihre eigenen Vorschriften. ⓘ
Der rechtliche und regulatorische Status von gentechnisch veränderten Lebensmitteln ist von Land zu Land unterschiedlich: Einige Länder verbieten oder schränken sie ein, während andere sie mit sehr unterschiedlichem Regulierungsgrad zulassen. Einige Länder gestatten die Einfuhr von GVO-Lebensmitteln mit Genehmigung, erlauben aber entweder nicht deren Anbau (Russland, Norwegen, Israel) oder haben Bestimmungen für den Anbau, obwohl noch keine GVO-Produkte hergestellt werden (Japan, Südkorea). Die meisten Länder, die den Anbau von GVO nicht zulassen, erlauben die Forschung. Einige der deutlichsten Unterschiede bestehen zwischen den USA und Europa. Die US-Politik konzentriert sich auf das Produkt (nicht auf das Verfahren), berücksichtigt nur nachweisbare wissenschaftliche Risiken und verwendet das Konzept der wesentlichen Gleichwertigkeit. Die Europäische Union hingegen hat die wohl strengsten GVO-Vorschriften der Welt. Alle GVO und auch bestrahlte Lebensmittel gelten als "neue Lebensmittel" und werden von der Europäischen Behörde für Lebensmittelsicherheit einer umfassenden, wissenschaftlich fundierten Einzelfallprüfung unterzogen. Die Kriterien für die Zulassung lassen sich in vier große Kategorien einteilen: "Sicherheit", "Wahlfreiheit", "Kennzeichnung" und "Rückverfolgbarkeit". Das Niveau der Regulierung in anderen Ländern, die GVO anbauen, liegt zwischen Europa und den Vereinigten Staaten. ⓘ
| Region | Regulierungsbehörden | Anmerkungen ⓘ |
|---|---|---|
| USA | USDA, FDA und EPA | |
| Europa | Europäische Behörde für Lebensmittelsicherheit | |
| Kanada | Health Canada und die kanadische Behörde für Lebensmittelkontrolle | Regulierte Produkte mit neuartigen Merkmalen, unabhängig von der Herkunftsmethode |
| Afrika | Gemeinsamer Markt für das östliche und südliche Afrika | Die endgültige Entscheidung liegt bei jedem einzelnen Land. |
| China | Amt für biologische Sicherheit in der landwirtschaftlichen Gentechnik (Office of Agricultural Genetic Engineering Biosafety Administration) | |
| Indien | Institutioneller Ausschuss für biologische Sicherheit, Überprüfungsausschuss für gentechnische Manipulation und Gentechnik-Zulassungsausschuss | |
| Argentinien | Nationaler Beratungsausschuss für landwirtschaftliche Biotechnologie (Umweltauswirkungen), Nationale Behörde für Gesundheit und Lebensmittelqualität (Lebensmittelsicherheit) und Nationale Direktion für Agrarwirtschaft (Auswirkungen auf den Handel) | Endgültige Entscheidung durch das Sekretariat für Landwirtschaft, Viehzucht, Fischerei und Ernährung. |
| Brasilien | Nationale technische Kommission für biologische Sicherheit (Umwelt- und Lebensmittelsicherheit) und der Ministerrat (Handels- und Wirtschaftsfragen) | |
| Australien | Office of the Gene Technology Regulator (überwacht alle GV-Produkte), Therapeutic Goods Administration (GV-Medikamente) und Food Standards Australia New Zealand (GV-Lebensmittel). | Die Regierungen der einzelnen Bundesstaaten können dann die Auswirkungen der Freisetzung auf die Märkte und den Handel bewerten und weitere Rechtsvorschriften zur Kontrolle der zugelassenen gentechnisch veränderten Produkte erlassen. |
Eine der wichtigsten Fragen für die Regulierungsbehörden ist, ob gentechnisch veränderte Produkte gekennzeichnet werden sollten. Die Europäische Kommission ist der Ansicht, dass eine obligatorische Kennzeichnung und Rückverfolgbarkeit erforderlich sind, um eine sachkundige Wahl zu ermöglichen, potenzielle falsche Werbung zu vermeiden und die Rücknahme von Produkten zu erleichtern, wenn nachteilige Auswirkungen auf die Gesundheit oder die Umwelt festgestellt werden. Die American Medical Association und die American Association for the Advancement of Science sind der Ansicht, dass selbst eine freiwillige Kennzeichnung in Ermangelung wissenschaftlicher Beweise für eine Schädigung irreführend ist und die Verbraucher fälschlicherweise alarmieren würde. Die Kennzeichnung von GVO-Produkten auf dem Markt ist in 64 Ländern vorgeschrieben. Die Kennzeichnung kann bis zu einem bestimmten Schwellenwert für den GVO-Gehalt (der von Land zu Land unterschiedlich ist) obligatorisch oder freiwillig sein. In Kanada und den USA ist die Kennzeichnung von GVO-Lebensmitteln freiwillig, während in Europa alle Lebensmittel (einschließlich verarbeiteter Lebensmittel) oder Futtermittel, die mehr als 0,9 % zugelassene GVO enthalten, gekennzeichnet werden müssen. ⓘ
Die Regulierung der Gentechnik ist außerhalb der deutschsprachigen Länder und der EU häufig weniger strikt. In den USA und Kanada ist Kennzeichnung z. B. freiwillig. ⓘ
Kontroverse
Kritiker haben sich aus verschiedenen Gründen gegen den Einsatz der Gentechnik ausgesprochen, unter anderem aus ethischen, ökologischen und wirtschaftlichen Gründen. Viele dieser Bedenken betreffen gentechnisch veränderte Pflanzen und die Frage, ob die daraus hergestellten Lebensmittel sicher sind und welche Auswirkungen ihr Anbau auf die Umwelt hat. Diese Kontroversen haben zu Rechtsstreitigkeiten, internationalen Handelskonflikten und Protesten sowie zu restriktiven Vorschriften für kommerzielle Produkte in einigen Ländern geführt. ⓘ
Der Vorwurf, Wissenschaftler würden "Gott spielen", und andere religiöse Fragen wurden der Technologie von Anfang an zugeschrieben. Zu den weiteren ethischen Fragen, die aufgeworfen wurden, gehören die Patentierung von Leben, die Nutzung von Rechten an geistigem Eigentum, die Kennzeichnung von Produkten, die Kontrolle der Lebensmittelversorgung und die Objektivität des Regulierungsprozesses. Obwohl Zweifel geäußert wurden, haben die meisten Studien ergeben, dass der Anbau von gentechnisch veränderten Pflanzen aus wirtschaftlicher Sicht für die Landwirte von Vorteil ist. ⓘ
Der Genfluss zwischen gentechnisch veränderten Pflanzen und kompatiblen Pflanzen sowie der verstärkte Einsatz selektiver Herbizide können das Risiko der Entwicklung von "Superunkräutern" erhöhen. Weitere Umweltbedenken betreffen die möglichen Auswirkungen auf Nichtzielorganismen, einschließlich Bodenmikroben, und die Zunahme von sekundären und resistenten Insektenschädlingen. Viele der Umweltauswirkungen von gentechnisch veränderten Pflanzen können erst nach vielen Jahren erkannt werden und sind auch bei konventionellen landwirtschaftlichen Praktiken zu beobachten. Die Kommerzialisierung von gentechnisch veränderten Fischen gibt Anlass zur Besorgnis über die Folgen für die Umwelt, wenn sie entweichen. ⓘ
Es gibt drei Hauptbedenken hinsichtlich der Sicherheit von gentechnisch veränderten Lebensmitteln: ob sie allergische Reaktionen hervorrufen können, ob die Gene aus den Lebensmitteln in menschliche Zellen übertragen werden können und ob sich die nicht für den menschlichen Verzehr zugelassenen Gene in andere Pflanzen auskreuzen können. Es besteht ein wissenschaftlicher Konsens darüber, dass die derzeit erhältlichen Lebensmittel aus gentechnisch veränderten Pflanzen kein größeres Risiko für die menschliche Gesundheit darstellen als herkömmliche Lebensmittel, dass aber jedes gentechnisch veränderte Lebensmittel vor seiner Einführung von Fall zu Fall geprüft werden muss. Dennoch hält die Öffentlichkeit gentechnisch veränderte Lebensmittel seltener für sicher als Wissenschaftler. ⓘ
Das Schweizer Volk stimmte im Rahmen einer Volksinitiative vom 27. November 2005 bei einer Stimmbeteiligung von über 42 % mehrheitlich für ein Moratorium bezüglich der Nutzung von Gentechnik in der Landwirtschaft. Für zunächst fünf Jahre wurde damit der Anbau von Pflanzen oder die Haltung von Tieren verboten, die gentechnisch verändert wurden. Ausnahmen gibt es nur für der Forschung (vor allem Risikoforschung) dienende kleine Anbauflächen, die den Vorschriften der Freisetzungs-Verordnung unterstehen. Importe von gentechnisch veränderten Produkten sind teils – unter strengen Auflagen – zugelassen. Nach intensiver politischer Diskussion wurde das Moratorium von Bundes-, Stände- und Nationalrat bis 2013 verlängert. Danach sollen Ergebnisse eines nationalen Forschungsprogramms, das bis 2012 lief, für eine neue Entscheidungsfindung berücksichtigt werden. Mit denselben Argumenten wurde das Moratorium im Dezember 2012 bis Ende 2017 verlängert. Trotz der Verlängerung will der Bundesrat es den Bauern erlauben, ab 2018 in gewissen Zonen gentechnisch veränderte Pflanzen anzubauen. Diese Pläne stoßen allerdings im Parlament auf heftigen Widerstand. Inzwischen wurde das Moratorium, welches den Anbau zu landwirtschaftlichen Zwecken verbietet, bis Ende 2021 verlängert. Im März 2019 erteilte das Bundesamt für Umwelt der Universität Zürich die Bewilligung für einen Freisetzungsversuch mit transgenem Weizen. Der Gesetzesentwurf, für eine weitere Verlängerung des Moratoriums bis Ende 2025, befindet sich derzeit in der Vernehmlassung (Stand November 2020). Am 23. September 2021 entscheidet der Nationalrat über die Verlängerung. Die Leiterin von Agroscope, Eva Reinhard, sprach sich im Vorfeld gegen eine Verlängerung aus. Schließlich stimmte der Nationalrat für die Verlängerung bis Ende 2025. Auch Anträge zur Zulassung von Genome Editing blieben chancenlos. Nun fehlt noch die Zustimmung des Ständerats. ⓘ
In der Populärkultur
Die Gentechnologie kommt in vielen Science-Fiction-Geschichten vor. In Frank Herberts Roman Die Weiße Pest wird der absichtliche Einsatz der Gentechnik beschrieben, um einen Krankheitserreger zu schaffen, der speziell Frauen tötet. In einer anderen Schöpfung Herberts, der Dune-Romanreihe, wird die Gentechnik eingesetzt, um die mächtigen Tleilaxu zu erschaffen. Nur wenige Filme haben das Publikum über die Gentechnik informiert, mit Ausnahme von The Boys from Brazil (1978) und Jurassic Park (1993), die beide auf eine Lektion, eine Demonstration und einen wissenschaftlichen Filmausschnitt zurückgreifen. Gentechnische Methoden werden im Film nur schwach dargestellt; Michael Clark, der für den Wellcome Trust schreibt, bezeichnet die Darstellung von Gentechnik und Biotechnologie in Filmen wie The 6th Day als "stark verzerrt". Clark ist der Ansicht, dass die Biotechnologie typischerweise "in fantastischen, aber visuell fesselnden Formen dargestellt wird", während die Wissenschaft entweder in den Hintergrund gedrängt oder fiktionalisiert wird, um ein junges Publikum anzusprechen. ⓘ
Im Videospiel BioShock von 2007 spielt die Gentechnik eine wichtige Rolle in der zentralen Handlung und im Universum. Das Spiel spielt in der fiktiven Unterwasser-Dystopie Rapture, in der die Bewohner genetisch bedingte übermenschliche Fähigkeiten besitzen, nachdem sie sich Plasmide" injiziert haben, ein Serum, das solche Kräfte verleiht. In der Stadt Rapture gibt es auch "Little Sisters", kleine Mädchen, die gentechnisch verändert wurden, sowie eine Nebenhandlung, in der eine Kabarettsängerin ihren Fötus an Genforscher verkauft, die dem Neugeborenen falsche Erinnerungen einpflanzen und es gentechnisch zu einem Erwachsenen heranwachsen lassen. ⓘ
Bedeutung
Nutzpflanzen
Transgene Nutzpflanzen haben seit ihrer Erstzulassung im Jahr 1996 weltweit an Bedeutung gewonnen und wurden 2015 in 28 Ländern auf 179 Millionen Hektar (das entspricht knapp ca. 12 % der globalen Landwirtschaftsfläche von 1,5 Mrd. Hektar) angebaut. Dabei handelt es sich insbesondere um Pflanzen, die aufgrund von gentechnischen Veränderungen tolerant gegenüber Pflanzenschutzmitteln oder giftig für bestimmte Schadinsekten sind. Durch den Einsatz haben sich für Landwirte, insbesondere in Entwicklungsländern, trotz höherer Ausgaben für Saatgut teilweise Ertrags-, Einkommens- und Gesundheitsvorteile oder Arbeitserleichterungen sowie geringere Umweltbelastungen ergeben. Zugelassenen Sorten wird von wissenschaftlicher Seite Unbedenklichkeit für Umwelt und Gesundheit attestiert. Umweltverbände, Anbieter ökologisch erzeugter Produkte sowie einige politische Parteien lehnen die grüne Gentechnik ab. ⓘ
Kennzeichnung
EU
Deutschland
Gesetzlich werden Haftung, Strafvorschriften und Definitionen in Bezug auf die Gentechnik durch das 1990 erlassene deutsche Gentechnikgesetz geregelt. Der Zweite Teil dieses Gesetzes definiert die Sicherheitsstufen und -maßnahmen an Arbeitsplätze für gentechnische Arbeiten. Die Einstufung erfolgt dabei nach Risiko für die menschliche Gesundheit und Umwelt in 4 Sicherheitsstufen:
| Stufe | Beschreibung ⓘ |
|---|---|
| S1 | Gentechnische Arbeiten, bei denen nach dem Stand der Wissenschaft nicht von einem Risiko für die menschliche Gesundheit und die Umwelt auszugehen ist |
| S2 | Gentechnische Arbeiten, bei denen nach dem Stand der Wissenschaft von einem geringen Risiko für die menschliche Gesundheit oder die Umwelt auszugehen ist |
| S3 | Gentechnische Arbeiten, bei denen nach dem Stand der Wissenschaft von einem mäßigen Risiko für die menschliche Gesundheit oder die Umwelt auszugehen ist |
| S4 | Gentechnische Arbeiten, bei denen nach dem Stand der Wissenschaft von einem hohen Risiko oder dem begründeten Verdacht eines solchen Risikos für die menschliche Gesundheit oder die Umwelt auszugehen ist |
Bei der Zuordnung wird nach Anhörung einer Kommission im Zweifel die höhere Sicherheitsstufe gewählt. ⓘ
Den genauen Umgang mit gentechnisch veränderten Organismen regelt die Gentechnik-Sicherheitsverordnung. Ein Gesetz zur Neuordnung des Gentechnikrechts wurde im Juni 2004 erlassen, um die EU-Richtlinie zur Freisetzung von GVOs umzusetzen. ⓘ
Österreich
In Österreich wurde im April 1997 das Gentechnik-Volksbegehren angenommen. Bei einer Wahlbeteiligung von über 21 % wurden damit ein gesetzlich verankertes Verbot der Produktion, des Imports und des Verkaufs gentechnisch veränderter Lebensmittel, ein ebensolches Verbot der Freisetzungen genetisch veränderter Pflanzen, Tiere und Mikroorganismen sowie ein Verbot der Patentierung von Lebewesen gefordert. Der Beschluss wurde am 16. April 1998 nach 3. Lesung angenommen. ⓘ
