Backhefe
| Saccharomyces cerevisiae ⓘ | |
|---|---|

| |
| S. cerevisiae, elektronenmikroskopische Aufnahme | |
| Wissenschaftliche Klassifizierung | |
| Königreich: | Pilze |
| Abteilung: | Ascomycota |
| Klasse: | Saccharomycetes |
| Ordnung: | Saccharomycetales |
| Familie: | Saccharomycetaceae |
| Gattung: | Saccharomyces |
| Spezies: | S. cerevisiae
|
| Binomialer Name | |
| Saccharomyces cerevisiae Meyen ex E.C. Hansen
| |
Saccharomyces cerevisiae (/ˌsɛrəˈvɪsi.iː/) ist eine Art der Hefe (einzellige Pilzmikroorganismen). Die Art ist seit der Antike in der Weinherstellung, beim Backen und Brauen von Bedeutung. Es wird angenommen, dass sie ursprünglich aus der Schale von Weintrauben isoliert wurde. Er ist einer der am intensivsten untersuchten eukaryotischen Modellorganismen in der Molekular- und Zellbiologie, ähnlich wie Escherichia coli als Modellbakterium. Er ist der Mikroorganismus, der die häufigste Art der Gärung bewirkt. S. cerevisiae-Zellen sind rund bis eiförmig und haben einen Durchmesser von 5-10 μm. Es vermehrt sich durch Knospung. ⓘ
Viele Proteine, die für die Biologie des Menschen wichtig sind, wurden zuerst durch die Untersuchung ihrer Homologe in der Hefe entdeckt; zu diesen Proteinen gehören Zellzyklusproteine, Signalproteine und proteinverarbeitende Enzyme. S. cerevisiae ist derzeit die einzige Hefezelle, von der bekannt ist, dass sie Berkeley-Körper besitzt, die an bestimmten Sekretionswegen beteiligt sind. Antikörper gegen S. cerevisiae werden bei 60-70 % der Patienten mit Morbus Crohn und bei 10-15 % der Patienten mit Colitis ulcerosa gefunden und können als Teil eines Panels von serologischen Markern bei der Unterscheidung zwischen entzündlichen Darmerkrankungen (z. B. zwischen Colitis ulcerosa und Morbus Crohn), ihrer Lokalisation und ihrem Schweregrad nützlich sein. ⓘ
Backhefe, auch Bierhefe, Bäckerhefe, nicht-fachsprachlich kurz Hefe (bundesdeutsches und Schweizer Hochdeutsch) oder Germ (österreichisches Hochdeutsch), mundartlich auch „Gest“ (norddeutsch; vgl. englisch yeast) oder „Bärme“ (v. a. Plattdeutsch; von niederdeutsch berme ‚Quellendes, Aufwallendes‘), lat.-wiss. Saccharomyces cerevisiae, gehört zu den Hefen (einzellige Pilze) und ist eine Knospungs-Hefe (englisch budding yeast). ⓘ
Die Vereinigung für Allgemeine und Angewandte Mikrobiologie (VAAM) hat die Backhefe zur Mikrobe des Jahres 2022 gekürt. ⓘ
Etymologie
"Saccharomyces" stammt aus dem latinisierten Griechischen und bedeutet "Zucker-Schimmel" oder "Zucker-Pilz", wobei saccharon (σάκχαρον) die zusammengesetzte Form "Zucker" und myces (μύκης) "Pilz" ist. cerevisiae kommt aus dem Lateinischen und bedeutet "vom Bier". Andere Namen für diesen Organismus sind:
- Bierhefe, obwohl auch andere Arten beim Brauen verwendet werden
- Bierhefe
- Obergärige Hefe
- Bäckerhefe
- Ragi-Hefe, in Verbindung mit der Herstellung von Tapai
- Knospenhefe ⓘ
Diese Art ist auch die Hauptquelle für Nährhefe und Hefeextrakt. ⓘ
Backhefe hat, wie sich aus der lateinischen Artbezeichnung cerevisiae ‚des Bieres‘ ersehen lässt, ihren Ursprung in obergärigen Bierhefen. Der griechisch-lateinische Gattungsname Saccharomyces bedeutet ‚Zuckerpilz‘. ⓘ
Geschichte
Im 19. Jahrhundert bezogen die Brotbäcker ihre Hefe von den Bierbrauern, was zu süß vergorenen Broten wie der Kaisersemmel führte, denen im Allgemeinen die Säure fehlte, die durch die für Lactobacillus typische Säuerung entsteht. Die Bierbrauer gingen jedoch langsam von der obergärigen (S. cerevisiae) zur untergärigen (S. pastorianus) Hefe über. Das Wiener Verfahren wurde im Jahr 1846 entwickelt. Diese Innovation wird oft der Verwendung von Dampf in Backöfen zugeschrieben, was zu einer anderen Krusteneigenschaft führte, aber sie ist auch bemerkenswert, weil sie Verfahren zur Hochvermahlung von Getreide beinhaltet (siehe Wiener Grütze), die schrittweise Zerkleinerung der Körner anstelle des Einmaischens in einem Durchgang sowie bessere Verfahren zur Züchtung und Ernte von obergärigen Hefen, die als Presshefen bekannt sind. ⓘ
Verfeinerungen in der Mikrobiologie nach der Arbeit von Louis Pasteur führten zu fortschrittlicheren Methoden der Kultivierung reiner Stämme. Im Jahr 1879 führte Großbritannien spezielle Zuchtgefäße für die Produktion von S. cerevisiae ein, und in den Vereinigten Staaten wurden um die Jahrhundertwende Zentrifugen zur Konzentrierung der Hefe eingesetzt, Damit wurde die Hefeproduktion zu einem industriellen Großverfahren, das den Vertrieb vereinfachte, die Stückkosten senkte und zur Kommerzialisierung und Kommerzialisierung von Brot und Bier beitrug. Frische "Kuchenhefe" wurde im frühen 20. Jahrhundert in weiten Teilen der westlichen Welt zum Standard-Sauerteig für Brotbäcker. ⓘ
Während des Zweiten Weltkriegs entwickelte Fleischmann's für die US-Streitkräfte eine granulierte aktive Trockenhefe, die nicht gekühlt werden musste und eine längere Haltbarkeit und bessere Temperaturtoleranz als frische Hefe aufwies; sie ist immer noch die Standardhefe für US-Militärrezepte. Das Unternehmen entwickelte eine Hefe, die doppelt so schnell aufging und so die Backzeit verkürzte. Später, in den 1970er Jahren, entwickelte Lesaffre Instant-Hefe, die in den verschiedenen Anwendungsbereichen auf Kosten von Frischhefe und Trockenhefe einen beträchtlichen Marktanteil erobert hat. ⓘ
Biologie
Ökologie
In der Natur findet man Hefezellen vor allem auf reifen Früchten wie Weintrauben (vor der Reifung sind Weintrauben fast frei von Hefen). S. cerevisiae kann auch ganzjährig in der Rinde von Eichen gefunden werden. Da S. cerevisiae nicht über die Luft übertragen werden kann, benötigt er einen Vektor, um sich fortzubewegen. ⓘ
Königinnen der erwachsen überwinternden sozialen Wespen (Vespa crabro und Polistes spp.) können vom Herbst bis zum Frühjahr Hefezellen beherbergen und diese auf ihre Nachkommen übertragen. Der Darm von Polistes dominula, einer sozialen Wespe, beherbergt sowohl S. cerevisiae-Stämme als auch S. cerevisiae × S. paradoxus-Hybriden. Stefanini et al. (2016) zeigten, dass der Darm von Polistes dominula die Paarung von S. cerevisiae-Stämmen sowohl untereinander als auch mit S. paradoxus-Zellen begünstigt, indem er Umgebungsbedingungen bietet, die die Sporulation der Zellen und die Keimung der Sporen fördern. ⓘ
Die optimale Temperatur für das Wachstum von S. cerevisiae liegt bei 30-35 °C (86-95 °F). ⓘ
Lebenszyklus
Zwei Formen von Hefezellen können überleben und wachsen: haploide und diploide. Die haploiden Zellen durchlaufen einen einfachen Lebenszyklus aus Mitose und Wachstum und sterben unter hohen Stressbedingungen im Allgemeinen ab. Dies ist die asexuelle Form des Pilzes. Die diploiden Zellen (die bevorzugte "Form" der Hefe) durchlaufen ebenfalls einen einfachen Lebenszyklus von Mitose und Wachstum. Die Geschwindigkeit, mit der der mitotische Zellzyklus abläuft, unterscheidet sich oft erheblich zwischen haploiden und diploiden Zellen. Unter Stressbedingungen können diploide Zellen eine Sporulation durchlaufen, in die Meiose eintreten und vier haploide Sporen produzieren, die sich anschließend paaren können. Dies ist die sexuelle Form des Pilzes. Unter optimalen Bedingungen können die Hefezellen ihre Population alle 100 Minuten verdoppeln. Die Wachstumsraten sind jedoch von Stamm zu Stamm und von Umgebung zu Umgebung sehr unterschiedlich. Die durchschnittliche Reproduktionslebensdauer beträgt etwa 26 Zellteilungen. ⓘ
In der Natur häufen sich rezessive schädliche Mutationen während langer Perioden der ungeschlechtlichen Vermehrung von Diploiden an und werden bei der Selbstvermehrung beseitigt: Diese Beseitigung wird als "Genom-Erneuerung" bezeichnet. ⓘ
Nährstoffbedarf
Alle Stämme von S. cerevisiae können aerob auf Glukose, Maltose und Trehalose wachsen, während sie auf Laktose und Cellobiose nicht wachsen. Das Wachstum auf anderen Zuckern ist jedoch unterschiedlich. Galaktose und Fruktose sind nachweislich zwei der am besten fermentierenden Zucker. Die Fähigkeit der Hefen, verschiedene Zucker zu nutzen, kann unterschiedlich sein, je nachdem, ob sie aerob oder anaerob gezüchtet werden. Einige Stämme können auf Saccharose und Trehalose nicht anaerob wachsen. ⓘ
Alle Stämme können Ammoniak und Harnstoff als einzige Stickstoffquelle nutzen, nicht aber Nitrat, da ihnen die Fähigkeit fehlt, dieses zu Ammoniumionen zu reduzieren. Sie können auch die meisten Aminosäuren, kleine Peptide und Stickstoffbasen als Stickstoffquellen nutzen. Histidin, Glycin, Cystin und Lysin werden jedoch nicht ohne weiteres verwertet. S. cerevisiae scheidet keine Proteasen aus, so dass extrazelluläres Protein nicht verstoffwechselt werden kann. ⓘ
Hefen haben auch einen Bedarf an Phosphor, der als Dihydrogenphosphat-Ion assimiliert wird, und an Schwefel, der als Sulfat-Ion oder als organische Schwefelverbindungen wie die Aminosäuren Methionin und Cystein assimiliert werden kann. Einige Metalle wie Magnesium, Eisen, Kalzium und Zink sind ebenfalls für ein gutes Wachstum der Hefe erforderlich. ⓘ
Was die organischen Anforderungen betrifft, so benötigen die meisten Stämme von S. cerevisiae Biotin. Ein auf S. cerevisiae basierender Wachstumsassay legte den Grundstein für die Isolierung, Kristallisierung und spätere Strukturbestimmung von Biotin. Die meisten Stämme benötigen auch Pantothenat für ein vollständiges Wachstum. Im Allgemeinen ist S. cerevisiae prototroph für Vitamine. ⓘ
Paarung
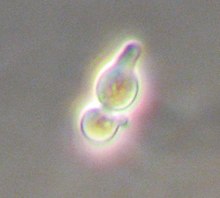
Hefe hat zwei Paarungstypen, a und α (alpha), die primitive Aspekte der Geschlechtsdifferenzierung zeigen. Wie bei vielen anderen Eukaryoten führt die Paarung zur genetischen Rekombination, d. h. zur Bildung neuer Chromosomenkombinationen. Zwei haploide Hefezellen des entgegengesetzten Paarungstyps können sich paaren und diploide Zellen bilden, die entweder sporulieren und eine weitere Generation haploider Zellen bilden oder als diploide Zellen weiter existieren können. Die Paarung wurde von Biologen als Werkzeug genutzt, um Gene, Plasmide oder Proteine nach Belieben zu kombinieren. ⓘ
Der Paarungsweg nutzt einen G-Protein-gekoppelten Rezeptor, ein G-Protein, ein RGS-Protein und eine dreistufige MAPK-Signalkaskade, die den beim Menschen vorkommenden homolog ist. Diese Eigenschaft wurde von Biologen genutzt, um grundlegende Mechanismen der Signaltransduktion und Desensibilisierung zu untersuchen. ⓘ
Zellzyklus
Das Wachstum der Hefe ist mit dem Wachstum der Knospe synchronisiert, die die Größe der reifen Zelle erreicht, wenn sie sich von der Mutterzelle trennt. In gut genährten, schnell wachsenden Hefekulturen haben alle Zellen Knospen, da die Knospenbildung den gesamten Zellzyklus in Anspruch nimmt. Sowohl Mutter- als auch Tochterzellen können die Knospenbildung einleiten, bevor die Zelltrennung stattgefunden hat. In Hefekulturen, die langsamer wachsen, sind Zellen ohne Knospen zu sehen, und die Knospenbildung nimmt nur einen Teil des Zellzyklus in Anspruch. ⓘ
Zytokinese
Die Zytokinese ermöglicht es der Knospenhefe Saccharomyces cerevisiae, sich in zwei Tochterzellen zu teilen. S. cerevisiae bildet eine Knospe, die während des gesamten Zellzyklus wachsen kann und später ihre Mutterzelle verlässt, wenn die Mitose abgeschlossen ist. ⓘ
S. cerevisiae ist für die Erforschung des Zellzyklus von Bedeutung, weil es sich asymmetrisch teilt, indem es eine polarisierte Zelle verwendet, um zwei Töchter mit unterschiedlichem Schicksal und unterschiedlicher Größe zu bilden. In ähnlicher Weise nutzen Stammzellen die asymmetrische Teilung zur Selbsterneuerung und Differenzierung. ⓘ
Zeitplan
Bei vielen Zellen tritt die M-Phase erst nach Abschluss der S-Phase ein. Für den Eintritt in die Mitose in S. cerevisiae trifft dies jedoch nicht zu. Die Zytokinese beginnt mit dem Knospungsprozess in der späten G1-Phase und ist erst nach etwa der Hälfte des nächsten Zyklus abgeschlossen. Der Aufbau der Spindel kann stattfinden, bevor die S-Phase die Verdopplung der Chromosomen abgeschlossen hat. Außerdem gibt es keine klar definierte G2-Phase zwischen M und S. Somit fehlt eine umfassende Regulierung, wie sie bei höheren Eukaryonten vorhanden ist. ⓘ
Wenn die Tochter entsteht, ist sie nur noch zwei Drittel so groß wie die Mutter. Während des gesamten Prozesses ändert sich die Größe der Mutter nur wenig oder gar nicht. Der RAM-Signalweg wird in der Tochterzelle unmittelbar nach Abschluss der Zytokinese aktiviert. Dieser Weg stellt sicher, dass sich die Tochterzelle ordnungsgemäß getrennt hat. ⓘ
Actomyosin-Ring und primäre Septumbildung
Die Zytokinese in S. cerevisiae wird durch zwei voneinander abhängige Ereignisse angetrieben. Das erste Ereignis ist die kontraktile Einschnürung des Aktomyosinrings (AMR) und das zweite Ereignis ist die Bildung des primären Septums (PS), einer chitinösen Zellwandstruktur, die nur während der Zytokinese gebildet werden kann. Das PS ähnelt bei Tieren dem Prozess des Umbaus der extrazellulären Matrix. Wenn sich die AMR verengt, beginnt das PS zu wachsen. Die Störung der AMR führt zu einer Fehlsteuerung des PS, was darauf hindeutet, dass beide eine abhängige Rolle spielen. Darüber hinaus führt eine Störung des PS auch zu einer Störung des AMR, was darauf hindeutet, dass sowohl der Aktomyosinring als auch das primäre Septum in einer wechselseitigen Abhängigkeit stehen. ⓘ
Der AMR, der an der Zellmembran befestigt ist und dem Zytosol zugewandt ist, besteht aus Aktin- und Myosin-II-Molekülen, die die Teilung der Zellen koordinieren. Man geht davon aus, dass der Ring eine wichtige Rolle bei der Ingression der Plasmamembran als kontraktile Kraft spielt. ⓘ
Die ordnungsgemäße Koordinierung und der korrekte Zusammenbau des kontraktilen Rings hängt von Septinen ab, die den Vorläufer des Septumrings darstellen. Diese GTPasen bauen Komplexe mit anderen Proteinen auf. Die Septine bilden einen Ring an der Stelle, an der die Knospe im späten G1 gebildet wird. Sie tragen dazu bei, die Bildung des Aktin-Myosin-Rings zu fördern, obwohl der Mechanismus unbekannt ist. Es wird vermutet, dass sie zur strukturellen Unterstützung anderer notwendiger Zytokineseprozesse beitragen. Nach dem Entstehen einer Knospe bildet der Septinring eine Sanduhr. Die Septin-Sanduhr und der Myosinring bilden zusammen den Beginn der zukünftigen Teilungsstelle. ⓘ
Der Septin- und der AMR-Komplex bilden das primäre Septum, das aus Glucanen und anderen Chitinmolekülen besteht, die von Vesikeln aus dem Golgi-Körper gesendet werden. Nachdem die AMR-Konstriktion abgeschlossen ist, werden zwei sekundäre Septen durch Glucane gebildet. Wie sich der AMR-Ring auflöst, ist noch weitgehend unbekannt. ⓘ
Mikrotubuli spielen bei der Zytokinese im Vergleich zum AMR und Septum keine so bedeutende Rolle. Eine Unterbrechung der Mikrotubuli beeinträchtigte das polarisierte Wachstum nicht wesentlich. Somit sind die AMR und die Septumbildung die wichtigsten Triebkräfte der Zytokinese. ⓘ
Unterschiede zur Spalthefe
- Knospende Hefen bilden eine Knospe aus der Mutterzelle. Diese Knospe wächst während des Zellzyklus und löst sich ab; Spalthefen teilen sich durch Bildung einer Zellwand
- Die Zytokinese beginnt bei Knospungshefen in G1, während sie bei Spalthefen in G2 beginnt. Spalthefen "wählen" den Mittelpunkt, während Knospungshefen eine Knospenstelle "wählen".
- Während der frühen Anaphase entwickeln sich der Aktomyosinring und das Septum bei der Knospungshefe weiter, bei der Spalthefe beginnt sich der Aktomyosinring während der Metaphase-Anaphase zu entwickeln ⓘ
In der biologischen Forschung
Modellorganismus

Wenn Forscher einen Organismus für ihre Studien suchen, achten sie auf mehrere Merkmale. Dazu gehören Größe, Generationszeit, Zugänglichkeit, Manipulation, Genetik, Erhaltung von Mechanismen und potenzieller wirtschaftlicher Nutzen. Die Hefearten S. pombe und S. cerevisiae sind beide gut erforscht; diese beiden Arten haben sich vor etwa 600 bis 300 Millionen Jahren auseinanderentwickelt und sind wichtige Werkzeuge für die Untersuchung von DNA-Schäden und Reparaturmechanismen. ⓘ
S. cerevisiae hat sich als Modellorganismus entwickelt, weil sie bei einer Reihe dieser Kriterien gut abschneidet.
- Als einzelliger Organismus ist S. cerevisiae klein, hat eine kurze Generationszeit (Verdopplungszeit 1,25-2 Stunden bei 30 °C oder 86 °F) und lässt sich leicht kultivieren. All dies sind positive Eigenschaften, da sie die rasche Herstellung und Erhaltung mehrerer Probenlinien zu geringen Kosten ermöglichen.
- S. cerevisiae teilt sich durch Meiose und ist damit ein Kandidat für die sexualgenetische Forschung.
- S. cerevisiae kann transformiert werden, was entweder das Hinzufügen neuer Gene oder die Deletion durch homologe Rekombination ermöglicht. Die Möglichkeit, S. cerevisiae als Haploid zu züchten, vereinfacht zudem die Herstellung von Gen-Knockout-Stämmen.
- Als Eukaryot teilt S. cerevisiae die komplexe innere Zellstruktur von Pflanzen und Tieren, ohne den hohen Prozentsatz an nicht-kodierender DNA, der die Forschung in höheren Eukaryoten behindern kann.
- Die S. cerevisiae-Forschung ist ein starker wirtschaftlicher Impulsgeber, zumindest anfänglich, aufgrund ihrer etablierten Verwendung in der Industrie. ⓘ
Bei der Erforschung des Alterns
Seit mehr als fünf Jahrzehnten wird S. cerevisiae als Modellorganismus zum besseren Verständnis des Alterns untersucht und hat zur Identifizierung von mehr Genen bei Säugetieren beigetragen, die das Altern beeinflussen, als jeder andere Modellorganismus. Einige der Themen, die mit Hefe untersucht wurden, sind Kalorienrestriktion sowie Gene und zelluläre Pfade, die an der Seneszenz beteiligt sind. Die beiden gebräuchlichsten Methoden zur Messung des Alterns in Hefe sind die Replikative Lebensdauer (RLS), bei der die Anzahl der Zellteilungen gemessen wird, und die Chronologische Lebensdauer (CLS), bei der gemessen wird, wie lange eine Zelle in einem nicht-teilenden Stasiszustand überleben kann. Es hat sich gezeigt, dass eine Begrenzung der Glukose- oder Aminosäuremenge im Wachstumsmedium die RLS und CLS in Hefe und anderen Organismen erhöht. Zunächst nahm man an, dass dies die RLS durch eine Hochregulierung des Enzyms sir2 erhöht, später wurde jedoch entdeckt, dass dieser Effekt unabhängig von sir2 ist. Eine Überexpression der Gene sir2 und fob1 erhöht die RLS nachweislich, indem sie die Anhäufung extrachromosomaler rDNA-Kreise verhindert, die als eine der Ursachen für die Seneszenz in Hefe gelten. Die Auswirkungen der Ernährungseinschränkung sind möglicherweise das Ergebnis einer verringerten Signalübertragung im zellulären TOR-Signalweg. Dieser Weg moduliert die Reaktion der Zelle auf Nährstoffe, und es wurde festgestellt, dass Mutationen, die die TOR-Aktivität verringern, CLS und RLS verstärken. Dies hat sich auch bei anderen Tieren gezeigt. Bei einer Hefemutante, der die Gene Sch9 und Ras2 fehlen, wurde kürzlich nachgewiesen, dass sich die chronologische Lebensdauer unter Bedingungen der Kalorienrestriktion um das Zehnfache erhöht - die größte Steigerung, die je bei einem Organismus erreicht wurde. ⓘ
Mutterzellen bringen durch mitotische Teilungen Nachkommen hervor, unterliegen aber über mehrere Generationen hinweg einer replikativen Alterung und sterben schließlich ab. Wenn eine Mutterzelle jedoch eine Meiose und Gametogenese durchläuft, wird die Lebensspanne zurückgesetzt. Das Replikationspotenzial von Gameten (Sporen), die von gealterten Zellen gebildet werden, ist das gleiche wie das von jungen Zellen, was darauf hindeutet, dass altersbedingte Schäden durch die Meiose von gealterten Mutterzellen beseitigt werden. Diese Beobachtung deutet darauf hin, dass die Beseitigung von altersbedingten Schäden während der Meiose zu einer Verjüngung führt. Die Art dieser Schäden muss jedoch noch geklärt werden. ⓘ
Während des Aushungerns von nicht-replizierenden S. cerevisiae-Zellen nehmen reaktive Sauerstoffspezies zu, was zu einer Anhäufung von DNA-Schäden wie apurinischen/apyrimidinischen Stellen und Doppelstrangbrüchen führt. Auch in nicht-replizierenden Zellen nimmt die Fähigkeit zur Reparatur körpereigener Doppelstrangbrüche im Laufe der chronologischen Alterung ab. ⓘ
Meiose, Rekombination und DNA-Reparatur
S. cerevisiae vermehrt sich durch Mitose als diploide Zellen, wenn Nährstoffe im Überfluss vorhanden sind. Wenn sie jedoch unterversorgt sind, durchlaufen diese Zellen eine Meiose und bilden haploide Sporen. ⓘ
Untersuchungen an S. cerevisiae haben Hinweise auf die adaptive Funktion der Meiose und der Rekombination ergeben. Mutationen, die in Genen defekt sind, die für die meiotische und mitotische Rekombination in S. cerevisiae wesentlich sind, führen zu einer erhöhten Empfindlichkeit gegenüber Strahlung oder DNA-schädigenden Chemikalien. So ist beispielsweise das Gen rad52 sowohl für die meiotische als auch für die mitotische Rekombination erforderlich. Rad52-Mutanten weisen eine erhöhte Empfindlichkeit gegenüber Röntgenstrahlen, Methylmethansulfonat und dem DNA-Vernetzungsmittel 8-Methoxypsoralen-plus-UVA auf und zeigen eine verminderte meiotische Rekombination. Diese Ergebnisse deuten darauf hin, dass die Rekombinationsreparatur während der Meiose und Mitose für die Behebung der verschiedenen durch diese Agenzien verursachten Schäden erforderlich ist. ⓘ
Ruderfer et al. (2006) analysierten die Abstammung natürlicher S. cerevisiae-Stämme und kamen zu dem Schluss, dass eine Auskreuzung nur etwa einmal alle 50 000 Zellteilungen stattfindet. Es scheint also, dass in der Natur die Paarung am häufigsten zwischen eng verwandten Hefezellen stattfindet. Die Paarung findet statt, wenn haploide Zellen des entgegengesetzten Paarungstyps MATa und MATα miteinander in Kontakt kommen. Ruderfer et al. wiesen darauf hin, dass solche Kontakte zwischen eng verwandten Hefezellen aus zwei Gründen häufig sind. Der erste Grund ist, dass Zellen des entgegengesetzten Paarungstyps zusammen im selben Ascus vorhanden sind, dem Sack, der die Zellen enthält, die direkt durch eine einzige Meiose entstanden sind, und diese Zellen können sich miteinander paaren. Der zweite Grund ist, dass haploide Zellen eines Paarungstyps bei der Zellteilung oft Zellen des anderen Paarungstyps hervorbringen, mit denen sie sich paaren können. Die relative Seltenheit von meiotischen Ereignissen, die aus einer Auskreuzung resultieren, widerspricht der Vorstellung, dass die Erzeugung von genetischer Variation die wichtigste selektive Kraft ist, die die Meiose in diesem Organismus aufrechterhält. Dieses Ergebnis steht jedoch im Einklang mit der alternativen Idee, dass die wichtigste selektive Kraft, die die Meiose aufrechterhält, die verbesserte rekombinative Reparatur von DNA-Schäden ist, da dieser Vorteil bei jeder Meiose realisiert wird, unabhängig davon, ob es zu Auskreuzungen kommt oder nicht. ⓘ
Genom-Sequenzierung
S. cerevisiae war das erste eukaryontische Genom, das vollständig sequenziert wurde. Die Genomsequenz wurde am 24. April 1996 der Öffentlichkeit zugänglich gemacht. Seitdem werden regelmäßige Aktualisierungen in der Saccharomyces Genome Database vorgenommen. Diese Datenbank enthält zahlreiche Anmerkungen und Querverweise für Hefeforscher. Eine weitere wichtige S. cerevisiae-Datenbank wird vom Munich Information Center for Protein Sequences (MIPS) gepflegt. Das Genom von S. cerevisiae besteht aus etwa 12.156.677 Basenpaaren und 6.275 Genen, die kompakt auf 16 Chromosomen angeordnet sind. Man geht davon aus, dass nur etwa 5.800 dieser Gene funktionell sind. Es wird geschätzt, dass mindestens 31 % der Hefegene Homologe im menschlichen Genom haben. Hefegene werden anhand von Gensymbolen (wie Sch9) oder systematischen Namen klassifiziert. Im letzteren Fall werden die 16 Chromosomen der Hefe durch die Buchstaben A bis P dargestellt, dann wird das Gen weiter klassifiziert durch eine Sequenznummer auf dem linken oder rechten Arm des Chromosoms und einen Buchstaben, der angibt, welcher der beiden DNA-Stränge seine kodierende Sequenz enthält. ⓘ
| Beispiel Genname | YGL118W |
|---|---|
| Y | das Y bedeutet, dass es sich um ein Hefegen handelt |
| G | Chromosom, auf dem sich das Gen befindet (Chromosom 1 = A usw.) |
| L | linker oder rechter Arm des Chromosoms |
| 118 | Sequenznummer des Gens/ORF auf diesem Arm, beginnend mit dem Zentromer |
| W | ob sich die kodierende Sequenz auf dem Watson- oder Crick-Strang befindet |
Beispiele:
- YBR134C (auch bekannt als SUP45, das für eRF1, einen Translationsterminationsfaktor, kodiert) befindet sich auf dem rechten Arm von Chromosom 2 und ist der 134. offene Leserahmen (ORF) auf diesem Arm, ausgehend vom Zentromer. Die kodierende Sequenz befindet sich auf dem Crick-Strang der DNA.
- YDL102W (auch bekannt als POL3, das für eine Untereinheit der DNA-Polymerase delta kodiert) befindet sich auf dem linken Arm von Chromosom 4; es ist der 102. ORF auf diesem Arm, ausgehend vom Zentromer, und kodiert vom Watson-Strang der DNA. ⓘ
Genfunktion und Interaktionen
Die Verfügbarkeit der Genomsequenz von S. cerevisiae und einer Reihe von Deletionsmutanten, die 90 % des Hefegenoms abdecken, hat die Bedeutung von S. cerevisiae als Modell für das Verständnis der Regulation eukaryontischer Zellen weiter erhöht. Ein laufendes Projekt zur Analyse der genetischen Interaktionen aller Doppeldeletionsmutanten mittels synthetischer genetischer Array-Analyse wird diese Forschung einen Schritt weiterbringen. Ziel ist es, eine funktionelle Karte der Zellprozesse zu erstellen. ⓘ
Im Jahr 2010 wurde das bisher umfassendste Modell genetischer Interaktionen erstellt, das "die Interaktionsprofile für ~75 % aller Gene in der Budding Hefe" enthält. Dieses Modell wurde auf der Grundlage von 5,4 Millionen Zwei-Gene-Vergleichen erstellt, bei denen ein doppelter Gen-Knockout für jede Kombination der untersuchten Gene durchgeführt wurde. Die Auswirkung des doppelten Knockouts auf die Fitness der Zelle wurde mit der erwarteten Fitness verglichen. Die erwartete Fitness wird aus der Summe der Ergebnisse der Fitness der Einzelgen-Knockouts für jedes verglichene Gen ermittelt. Wenn die Fitness von der erwarteten Fitness abweicht, ist davon auszugehen, dass die Gene miteinander interagieren. Dies wurde getestet, indem die Ergebnisse mit den bisher bekannten verglichen wurden. So wiesen beispielsweise die Gene Par32, Ecm30 und Ubp15 ähnliche Interaktionsprofile auf wie Gene, die am zellulären Prozess des Gap1-Sortiermoduls beteiligt sind. In Übereinstimmung mit den Ergebnissen führten diese Gene, wenn sie ausgeschaltet wurden, zu einer Unterbrechung dieses Prozesses, was bestätigt, dass sie Teil dieses Prozesses sind. ⓘ
Auf diese Weise wurden 170 000 Geninteraktionen gefunden, und Gene mit ähnlichen Interaktionsmustern wurden in Gruppen zusammengefasst. Gene mit ähnlichen genetischen Interaktionsprofilen sind in der Regel Teil desselben Signalwegs oder biologischen Prozesses. Diese Informationen wurden verwendet, um ein globales Netzwerk von Geninteraktionen zu erstellen, das nach Funktion geordnet ist. Dieses Netzwerk kann verwendet werden, um die Funktion von uncharakterisierten Genen auf der Grundlage der Funktionen von Genen, mit denen sie gruppiert sind, vorherzusagen. ⓘ
Andere Werkzeuge in der Hefeforschung
Hefewissenschaftler haben Ansätze entwickelt, die in vielen verschiedenen Bereichen der biologischen und medizinischen Wissenschaft eingesetzt werden können. Dazu gehören der Hefe-Two-Hybrid zur Untersuchung von Proteininteraktionen und die Tetradenanalyse. Weitere Ressourcen sind eine Gendeletionsbibliothek mit ca. 4 700 lebensfähigen haploiden Einzelgen-Deletionsstämmen. Eine GFP-Fusionsstammbibliothek zur Untersuchung der Proteinlokalisierung und eine TAP-Tag-Bibliothek zur Reinigung von Proteinen aus Hefezellextrakten. ⓘ
Im Rahmen des Hefe-Deletionsprojekts der Universität Stanford wurden Knockout-Mutationen aller Gene im S. cerevisiae-Genom erzeugt, um deren Funktion zu bestimmen. ⓘ
Synthetische Hefechromosomen und -genome
Das Hefegenom lässt sich leicht manipulieren und ist daher ein hervorragendes Modell für das Genome Engineering. ⓘ
Das internationale Synthetic Yeast Genome Project (Sc2.0 oder Saccharomyces cerevisiae Version 2.0) zielt darauf ab, ein vollständig designtes, anpassbares, synthetisches S. cerevisiae-Genom von Grund auf zu erstellen, das stabiler ist als der Wildtyp. Im synthetischen Genom werden alle Transposons, repetitiven Elemente und viele Introns entfernt, alle UAG-Stopcodons durch UAA ersetzt und die Transfer-RNA-Gene auf ein neuartiges Neochromosom verschoben. Bis März 2017 wurden 6 der 16 Chromosomen synthetisiert und getestet. Es wurden keine signifikanten Fitnessdefekte festgestellt. ⓘ
Alle 16 Chromosomen können durch aufeinanderfolgende End-to-End-Chromosomenfusionen und Zentromerdeletionen zu einem einzigen Chromosom fusioniert werden. Das Einzelchromosom und Wildtyp-Hefezellen haben nahezu identische Transkriptome und ähnliche Phänotypen. Das riesige Einzelchromosom kann das Zellleben unterstützen, obwohl dieser Stamm ein geringeres Wachstum in verschiedenen Umgebungen, eine geringere Wettbewerbsfähigkeit, eine geringere Gametenproduktion und eine geringere Lebensfähigkeit aufweist. ⓘ
Astrobiologie
Neben anderen Mikroorganismen war eine Probe des lebenden S. cerevisiae Teil des Living Interplanetary Flight Experiment, das in einer kleinen Kapsel an Bord des russischen Fobos-Grunt-Raumschiffs, das Ende 2011 gestartet wurde, eine dreijährige interplanetare Rundreise unternommen hätte. Ziel war es, zu testen, ob ausgewählte Organismen einige Jahre im tiefen Weltraum überleben können, indem sie durch den interplanetaren Raum geflogen werden. Mit dem Experiment sollte ein Aspekt der Transpermie getestet werden, d. h. die Hypothese, dass Leben im Weltraum überleben kann, wenn es im Inneren von Gesteinsbrocken geschützt ist, die durch einen Aufprall von einem Planeten weggesprengt werden und auf einem anderen landen. Die Mission von Fobos-Grunt endete jedoch erfolglos, als es ihr nicht gelang, die niedrige Erdumlaufbahn zu verlassen. Bei einem unkontrollierten Wiedereintritt am 15. Januar 2012 stürzte das Raumfahrzeug mitsamt seinen Instrumenten in den Pazifischen Ozean. Die nächste geplante Exposition im tiefen Weltraum mit S. cerevisiae ist BioSentinel. (siehe: Liste der im Weltraum getesteten Mikroorganismen) ⓘ
In kommerziellen Anwendungen
Bierbrauen
Saccharomyces cerevisiae wird beim Bierbrauen verwendet, wo sie manchmal als obergärige oder obergärige Hefe bezeichnet wird. Sie wird so genannt, weil ihre hydrophobe Oberfläche während des Gärprozesses dazu führt, dass die Flocken an CO2 haften und an die Spitze des Gärbehälters aufsteigen. Obergärige Hefen werden bei höheren Temperaturen vergoren als die Lagerhefe Saccharomyces pastorianus, und die daraus resultierenden Biere haben einen anderen Geschmack als das gleiche Getränk, das mit einer Lagerhefe vergoren wurde. "Fruchtige Ester" können sich bilden, wenn die Hefe Temperaturen in der Nähe von 21 °C (70 °F) ausgesetzt ist oder wenn die Gärtemperatur des Getränks während des Prozesses schwankt. Lagerhefe gärt normalerweise bei einer Temperatur von etwa 5 °C (41 °F), bei der Saccharomyces cerevisiae in den Ruhezustand übergeht. Eine Variante der Hefe, Saccharomyces cerevisiae var. diastaticus, ist ein Bierverderber, der in verpackten Produkten Nachgärungen verursachen kann. ⓘ
Im Mai 2013 ernannte die Legislative von Oregon S. cerevisiae zur offiziellen Mikrobe des Bundesstaates und würdigte damit den Einfluss, den die handwerkliche Bierbraukunst auf die Wirtschaft und die Identität des Bundesstaates hat. ⓘ
Backen
S. cerevisiae wird beim Backen verwendet; das bei der Gärung entstehende Kohlendioxid wird als Treibmittel in Brot und anderen Backwaren eingesetzt. Historisch gesehen war diese Verwendung eng mit der Verwendung von Hefe in der Brauindustrie verbunden, da die Bäcker den mit Hefe gefüllten Schaum des Bieres von den Brauern abnahmen oder kauften (Herstellung des Hefekuchens); heute unterscheiden sich die Hefestämme für Brauerei und Bäckerei etwas. ⓘ
Nährhefe
Saccharomyces cerevisiae ist die Hauptquelle für Nährhefe, die im Handel als Lebensmittelprodukt verkauft wird. Sie ist bei Veganern und Vegetariern als Zutat in Käseersatzprodukten oder als allgemeiner Lebensmittelzusatz als Quelle von Vitaminen und Mineralien, insbesondere Aminosäuren und Vitaminen des B-Komplexes, beliebt. ⓘ
Verwendung in Aquarien
Aufgrund der hohen Kosten kommerzieller CO2-Zylindersysteme ist die CO2-Injektion durch Hefe eine der beliebtesten DIY-Methoden von Aquakulturisten, um Wasserpflanzen unter Wasser mit CO2 zu versorgen. Die Hefekultur wird in der Regel in Plastikflaschen gehalten, und typische Systeme liefern alle 3-7 Sekunden eine Luftblase. Es wurden verschiedene Ansätze entwickelt, um eine angemessene Absorption des Gases im Wasser zu ermöglichen. ⓘ
Direkte Verwendung in der Medizin
Saccharomyces cerevisiae wird als Probiotikum bei Mensch und Tier eingesetzt. Der Stamm Saccharomyces cerevisiae var. boulardii wird industriell hergestellt und klinisch als Medikament verwendet. ⓘ
Mehrere klinische und experimentelle Studien haben gezeigt, dass S. cerevisiae var. boulardii in geringerem oder größerem Umfang zur Vorbeugung oder Behandlung verschiedener Magen-Darm-Erkrankungen nützlich ist. Es gibt mäßige Belege dafür, dass S. cerevisiae var. boulardii das Risiko einer Antibiotika-assoziierten Diarrhö sowohl bei Erwachsenen als auch bei Kindern verringert und das Risiko unerwünschter Wirkungen der Helicobacter-pylori-Eradikationstherapie reduziert. Es gibt einige Belege für die Wirksamkeit von S. cerevisiae var. boulardii bei der Vorbeugung (aber nicht bei der Behandlung) von Reisedurchfall und, zumindest als Zusatzmedikation, bei der Behandlung von akutem Durchfall bei Erwachsenen und Kindern sowie von anhaltendem Durchfall bei Kindern. Es kann auch die Symptome einer allergischen Rhinitis lindern. ⓘ
Die Verabreichung von S. cerevisiae var. boulardii gilt allgemein als sicher. In klinischen Studien wurde es von den Patienten gut vertragen, und die Rate der unerwünschten Wirkungen war ähnlich hoch wie in Kontrollgruppen (d. h. Gruppen mit Placebo oder ohne Behandlung). Während der klinischen Studien wurde kein Fall von S. cerevisiae var. boulardii Fungämie gemeldet. ⓘ
In der klinischen Praxis wurden jedoch Fälle von Fungämie, verursacht durch S. cerevisiae var. boulardii, berichtet. Patienten mit geschwächter Immunität oder Patienten mit zentralen Gefäßkathetern sind besonders gefährdet. Einige Forscher haben empfohlen, die Verwendung von S. cerevisiae var. boulardii zur Behandlung solcher Patienten zu vermeiden. Andere weisen lediglich darauf hin, dass bei der Verwendung bei Patienten der Risikogruppe Vorsicht geboten ist. ⓘ
Ein menschlicher Krankheitserreger
Saccharomyces cerevisiae ist nachweislich ein opportunistisches Humanpathogen, wenn auch von relativ geringer Virulenz. Obwohl dieser Mikroorganismus im Haushalt und in der Industrie weit verbreitet ist, führt der Kontakt mit ihm nur sehr selten zu einer Infektion. Saccharomyces cerevisiae wurde in der Haut, der Mundhöhle, dem Oropharinx, der Zwölffingerdarmschleimhaut, dem Verdauungstrakt und der Vagina gesunder Menschen gefunden (in einer Übersichtsarbeit wurde er bei 6 % der Proben aus dem menschlichen Darm nachgewiesen). Einige Fachleute betrachten S. cerevisiae als Teil der normalen Mikrobiota des Magen-Darm-Trakts, der Atemwege und der Vagina des Menschen, während andere der Meinung sind, dass die Art nicht als echter Kommensale bezeichnet werden kann, da sie aus der Nahrung stammt. Das Vorhandensein von S. cerevisiae im menschlichen Verdauungstrakt kann eher vorübergehend sein; so zeigen Versuche, dass es bei oraler Verabreichung an gesunde Personen innerhalb von 5 Tagen nach Ende der Verabreichung aus dem Darm ausgeschieden wird. ⓘ
Unter bestimmten Umständen, z. B. bei geschwächter Immunität, kann Saccharomyces cerevisiae beim Menschen Infektionen verursachen. Studien zeigen, dass er 0,45-1,06 % der Fälle von Hefepilz-Vaginitis verursacht. In einigen Fällen handelte es sich bei den Frauen, die an einer S. cerevisiae-induzierten Vaginalinfektion litten, um Intimpartnerinnen von Bäckern, und es wurde festgestellt, dass es sich um denselben Stamm handelte, den ihre Partner zum Backen verwendeten. Bis 1999 wurden in der wissenschaftlichen Literatur keine Fälle von S. cerevisiae-induzierter Vaginitis bei Frauen, die selbst in Bäckereien arbeiteten, gemeldet. Einige Fälle wurden von Forschern mit der Verwendung der Hefe beim Backen zu Hause in Verbindung gebracht. Es sind auch Fälle von Infektionen der Mundhöhle und des Rachens bekannt, die durch S. cerevisiae verursacht wurden. ⓘ
Invasive und systemische Infektionen
Gelegentlich verursacht Saccharomyces cerevisiae invasive Infektionen (d. h. es gelangt in den Blutkreislauf oder in andere normalerweise sterile Körperflüssigkeiten oder in tief liegendes Gewebe, z. B. Lunge, Leber oder Milz), die systemisch verlaufen können (mehrere Organe betreffen). Solche Erkrankungen sind lebensbedrohlich. Mehr als 30 % der Fälle von invasiven S. cerevisiae-Infektionen führen zum Tod, selbst wenn sie behandelt werden. Invasive Infektionen mit S. cerevisiae sind jedoch viel seltener als invasive Infektionen durch Candida albicans, selbst bei Patienten, die durch Krebs geschwächt sind. S. cerevisiae verursacht 1 % bis 3,6 % der nosokomialen Fälle von Fungämie. Eine umfassende Untersuchung der Fälle von invasiven S. cerevisiae-Infektionen ergab, dass alle Patienten mindestens eine prädisponierende Erkrankung aufwiesen. ⓘ
Saccharomyces cerevisiae kann durch Translokation von der oralen oder enteralen Schleimhaut oder durch Kontamination intravaskulärer Katheter (z. B. zentraler Venenkatheter) in den Blutkreislauf oder an andere tiefe Stellen des Körpers gelangen. Intravaskuläre Katheter, Antibiotikatherapie und geschwächte Immunität sind wichtige prädisponierende Faktoren für eine invasive Infektion mit S. cerevisiae. ⓘ
Eine Reihe von Fällen von Fungämie wurde durch die absichtliche Einnahme von lebenden S. cerevisiae-Kulturen zu diätetischen oder therapeutischen Zwecken verursacht, einschließlich der Verwendung von Saccharomyces boulardii (ein Stamm von S. cerevisiae, der als Probiotikum zur Behandlung bestimmter Formen von Durchfallerkrankungen eingesetzt wird). Saccharomyces boulardii verursacht in etwa 40 % der Fälle invasive Saccharomyces-Infektionen und ist (im Vergleich zu anderen S. cerevisiae-Stämmen) eher in der Lage, invasive Infektionen beim Menschen zu verursachen, ohne dass es zu allgemeinen Problemen mit der Immunität kommt; allerdings sind solche unerwünschten Wirkungen im Vergleich zur therapeutischen Verabreichung von Saccharomyces boulardii sehr selten. ⓘ
S. boulardii kann intravaskuläre Katheter durch die Hände des medizinischen Personals kontaminieren, das probiotische Zubereitungen von S. boulardii an Patienten verabreicht. ⓘ
Systemische Infektionen treten in der Regel bei Patienten auf, deren Immunität aufgrund einer schweren Erkrankung (HIV/AIDS, Leukämie, andere Krebsarten) oder bestimmter medizinischer Verfahren (Knochenmarktransplantation, Bauchoperationen) geschwächt ist. ⓘ
Es wurde über einen Fall berichtet, bei dem ein Knötchen aus der Lunge eines Mannes, der im Backgewerbe tätig war, chirurgisch entfernt wurde, und bei der Untersuchung des Gewebes wurde Saccharomyces cerevisiae nachgewiesen. Es wird angenommen, dass die Inhalation von trockenem Backhefepulver in diesem Fall die Infektionsquelle war. ⓘ
Virulenz der verschiedenen Stämme

Nicht alle Stämme von Saccharomyces cerevisiae sind für den Menschen gleichermaßen virulent. Die meisten in der Umwelt vorkommenden Stämme sind nicht in der Lage, bei Temperaturen über 35 °C zu wachsen (d. h. bei Temperaturen, die den lebenden Körpern von Menschen und anderen Säugetieren entsprechen). Virulente Stämme sind jedoch in der Lage, bei mindestens 37 °C und oft bis zu 39 °C (selten bis 42 °C) zu wachsen. Einige industrielle Stämme sind auch in der Lage, über 37 °C zu wachsen. Die Europäische Behörde für Lebensmittelsicherheit (Stand 2017) schreibt vor, dass alle S. cerevisiae-Stämme, die zu einem Wachstum bei über 37 °C fähig sind und der Lebens- oder Futtermittelkette in lebensfähiger Form zugesetzt werden, keine Resistenz gegen antimykotische Medikamente aufweisen dürfen, die zur Behandlung von Hefeinfektionen eingesetzt werden, um als vermutlich sicher zu gelten. ⓘ
Die Fähigkeit, bei erhöhten Temperaturen zu wachsen, ist ein wichtiger Faktor für die Virulenz des Stammes, aber nicht der einzige. ⓘ
Andere Eigenschaften, die üblicherweise mit der Virulenz in Verbindung gebracht werden, sind: die Fähigkeit, bestimmte Enzyme wie Proteinase und Phospholipase zu produzieren, invasives Wachstum (d. h. Wachstum mit Eindringen in das Nährmedium), die Fähigkeit, an Säugetierzellen zu haften, die Fähigkeit, in Gegenwart von Wasserstoffperoxid zu überleben (das von Makrophagen verwendet wird, um fremde Mikroorganismen im Körper abzutöten) und andere Fähigkeiten, die es der Hefe ermöglichen, der Immunantwort des Wirtskörpers zu widerstehen oder sie zu beeinflussen. Die Fähigkeit, verzweigte Zellketten zu bilden, die als Pseudohyphen bekannt sind, wird manchmal auch mit Virulenz in Verbindung gebracht, obwohl einige Untersuchungen darauf hindeuten, dass dieses Merkmal sowohl virulenten als auch nicht-virulenten Stämmen von Saccharomyces cerevisiae gemeinsam ist. ⓘ
Beschreibung
Die Zellen von Saccharomyces cerevisiae sind rund bis oval, haben einen Durchmesser von fünf bis zehn Mikrometern und vermehren sich durch den Prozess der Knospung. S. cerevisiae kann auch in der Hyphenform vorliegen und Ascosporen bilden. ⓘ
Wissenschaft

Der Eukaryot Saccharomyces cerevisiae ist wie der Prokaryot Escherichia coli ein Modellorganismus in der molekularbiologischen und zellbiologischen Forschung. Aufgrund der einfachen Kulturbedingungen und der Verwandtschaft der internen Zellstruktur zu anderen eukaryoten Zellen in der Pflanzen- und Tierwelt wird er zum Beispiel zur Untersuchung des Zellzyklus oder des Proteinabbaus verwendet. ⓘ
Backhefe war der erste eukaryotische Organismus, dessen Nukleinsäure-Basensequenz im Genom vollständig ermittelt wurde. Das Genom besteht aus 13 Millionen Basenpaaren (bp), das entspricht 6.275 Genen in 16 Chromosomen. Zu mehr als 23 % der Gene des Hefegenoms fanden sich homologe Gene im humanen Genom. Inzwischen gibt es drei große Datenbanken über das Hefegenom. ⓘ
Eine weitere wissenschaftliche Pioniertat war die vollständige Synthetisierung eines der 16 Chromosomen der Backhefe, die im März 2014 bekanntgegeben wurde. Das Chromosom III, eines der kürzesten, wurde in siebenjähriger Arbeit im Rahmen eines internationalen Projektes unter der Leitung des Genetikers Jef Boeke im Labor nachgebildet und stellte seine Funktionsfähigkeit in lebenden Hefezellen unter Beweis. Es ist mit 273.871 bp erheblich kürzer als seine natürliche Entsprechung mit 316.667 bp, da die Wissenschaftler Wiederholungen und andere Sequenzen, die sie als unnötig einschätzten, wegließen. Die Arbeit ist der erste Schritt eines Vorhabens zur Synthetisierung des gesamten Hefegenoms unter dem Namen „Sc2.0“ (die „zweite Version“ von S. cerevisiae). Im März 2017 waren bereits sechs Chromosomen nachgebaut. Ein nützliches Verfahren, bei dem Backhefe nicht als Modellorganismus fungiert, sondern als Werkzeug zur Erforschung von Wechselwirkungen von Proteinen ist das Hefe-Zwei-Hybrid-System. ⓘ
Weitere Beispiele für Forschungen an diesem Modellorganismus sind:
- Wie man die Anziehungskraft von Hefe verbessert, auf wissenschaft.de vom 28. Februar 2012. — Magnetische Backhefe vermöge Gentechnik
- Daniela Albat: Hefe als Cannabinoid-Produzent: Genmanipulierte Pilze produzieren Cannabis-Wirkstoffe wie THC und CBD, auf scinexx vom 28. Februar 2019
- Bier (fast) ohne Hopfen: Genmanipulierte Bierhefe erzeugt hopfiges Aroma ohne zusätzlichen Hopfenzusatz, auf scinexx vom 21. März 2018; Quelle: University of California – Berkeley, NPO. — S. cerevisiae
- Bäckerhefe strahlt bei Sprengstoff grün, auf welt.de vom 8. Mai 2007; Bäckerhefe gibt bei Sprengstoff „grünen“ Alarm, in: Welt Kompakt vom 8. Mai 2007, S. 11. — Gentechnisch veränderte S. cerevisiae. ⓘ
Stoffwechsel
Backhefe gilt als fakultativ anaerob. Das bedeutet, die Energiegewinnung kann sowohl aerob (mit Sauerstoff) in Form der Zellatmung als auch durch Gärung erfolgen. Backhefe verwendet für ihren Energiestoffwechsel als Ausgangsstoffe fast ausschließlich Mono- oder Disaccharide (Zucker). Langkettige Kohlenhydrate (Stärke) können dagegen nicht verwertet werden, der Hefe fehlen die notwendigen Amylasen. Ausscheidungsprodukte sind im Wesentlichen Kohlenstoffdioxid aus der Atmung und Ethanol (Alkohol) aus der Gärung. Das Mengenverhältnis der Produkte ist davon abhängig, ob die Umgebung, in der die Hefe wächst, Sauerstoff enthält oder nicht, sowie von der Zuckerkonzentration im Medium. Bei der Produktion von Alkohol und der Verwendung als Triebmittel beim Backen ist der anaerobe Stoffwechsel entscheidend. ⓘ
Die Bezeichnung der Backhefe als fakultativ anaerob ist nicht ganz korrekt, da für die Biosynthese von Ergosterin geringe Mengen an elementarem Sauerstoff benötigt werden. ⓘ
Beim Vorhandensein größerer Mengen an gut verwertbaren organischen Stoffen (vor allem Zucker) werden diese auch trotz aerober Kultivierung vergoren. Dieses Phänomen wird als Crabtree-Effekt bezeichnet. Der Crabtree-Effekt mindert die Ausbeute (Biomasse pro eingesetztem Zucker) und ist deshalb in der Regel bei der Hefeproduktion unerwünscht. Durch entsprechende Substratzuführung kann dieser minimiert werden (siehe Fed-Batch-Prozess). ⓘ
Wenn der Backhefe kein Zucker mehr zur Verfügung steht, wird unter oxischen Bedingungen als Energiequelle die Oxidation des vorher selbst produzierten Ethanols mit Sauerstoff benutzt. Auf diese Weise kann sich die Hefe weiter vermehren, solange keine Hemmung durch zu große Ethanolkonzentrationen oder eine Begrenzung durch den Mangel an anderen Nährstoffen (Phosphate, Aminosäuren) vorliegt. ⓘ
Die beste Temperatur für die Gärung (den „Trieb“) der Hefe liegt bei etwa 32 °C. Zur Vermehrung der Hefe sind ungefähr 28 °C optimal. Bei guter Nährstoff- und Sauerstoffversorgung (aerob) verdoppelt sich die Hefemasse in einer Bierhefekultur in etwa zwei Stunden, der Zuwachs ist also bedeutend langsamer als bei vielen Bakterienarten. Bei anaerober Gärung läuft die Vermehrung erheblich langsamer ab. Bei Temperaturen über 45 °C beginnt Backhefe abzusterben. ⓘ
Backhefe ist druckempfindlich. Wenn der Druck im Gärbehälter über 8 bar ansteigt, stellt Hefe ihre Gärtätigkeit ein. Dieser Effekt wird auch zur Steuerung des Gärprozesses genutzt. ⓘ
Verwendung

Hefen der Gattung Saccharomyces werden in vielerlei Bereichen eingesetzt. Neben ihrer Verwendung beim Backen sind diese Hefen auch an der Gärung von Bier, Cider, Wein und Essig beteiligt. Ebenso dienen sie heutzutage bei der Herstellung von Ethanol-Kraftstoff und Cellulose-Ethanol. Außerdem wird Backhefe zur Biosorption von Schwermetallen wie Zink, Kupfer, Cadmium und Uran aus Abwässern verwendet. Die Schwermetalle lagern sich im Inneren und Äußeren der Zellen als Kristalle an und können chemisch von den Hefen abgesondert werden. ⓘ
In der Medizin wird Saccharomyces cerevisiae ähnlich wie die verwandte Spezies Saccharomyces boulardii als probiotischer Arzneistoff zur Behandlung von Durchfallerkrankungen, zur Kräftigung des Allgemeinbefindens und gegen Haarausfall eingesetzt. ⓘ
Herstellung
Grundlage für die industrielle Backhefe-Produktion sind zwei Dinge:

- Ein Hefestamm (Reinzuchthefe), der seit Jahrhunderten durch Auslese und Züchtung aus Sauerteighefen bzw. aus der Bierhefe von obergärigen Bieren gewonnen wurde. Backhefen zeichnen sich durch hohe Triebkraft und ein geringes Maß an Gluten-zerstörenden Enzymen aus. Durch die Weiterzüchtung ist die Bäckerhefe triebstärker als die wilden Hefen im Sauerteig, verträgt aber im Gegensatz zur Sauerteighefe viele andere Stoffe nicht: Säuren, Salze, Fette und anderes mehr.
- Ein Kulturmedium mit Melasse dient als Hauptbestandteil zur Vermehrung der Hefe. ⓘ
Während der Hefestamm das Betriebsgeheimnis der jeweiligen Hefeproduzenten ist, ist der technische Ablauf der Hefevermehrung allgemein bekannt. ⓘ
Um Massen von Mikroorganismen in Reinkultur herzustellen, werden sie in der Biotechnik in der Regel in mehrstufigen Kulturverfahren produziert. Ein einstufiges Verfahren, bei der ein großes Volumen eines Kulturmediums mit einer kleinen Menge der Organismen beimpft wird, ist aus mehreren Gründen sehr nachteilig. Würde so vorgegangen, würde eine großvolumige Anlage relativ lange Zeit für die Vermehrung benötigen. Das hätte folgende Nachteile:
- Technisch: Je größer eine Anlage ist, desto schwieriger ist es, das Eindringen von fremden, unerwünschten Mikroorganismen zu verhindern. Die Phase der Vermehrung in einer großen Anlage muss deshalb so kurz wie möglich gehalten werden. Dadurch mindert sich der Ertrag. Alternativ kann die Fermentation unter Zusatz von antibakteriell wirksamen Hilfsstoffen länger geführt werden.
- Ökonomisch: Eine teure, große Anlage würde lange Zeit für die Vermehrung einer kleinen Menge von Mikroorganismen beanspruchen, für deren Produktion auch kleinere, billigere Anlagen ausreichen.
- Biologisch: Kulturmedien sind nach ihrer Zubereitung meistens nicht optimal für die Vermehrung von Mikroorganismen (unter anderem zu hohes Redoxpotential, zu geringe Kohlenstoffdioxid-Konzentration, zu geringe Konzentration spezifischer Wachstumsstimulatoren). Die Organismen müssen erst durch ihren Stoffwechsel ein günstigeres Milieu schaffen. Das dauert bei einer kleinen Menge von Mikroorganismen in einem großen Kulturmediumvolumen sehr lange, und das Wachstum würde zu Beginn stark verzögert. ⓘ
Auch bei der Backhefe-Produktion wird deshalb die Vermehrung in mehreren Stufen geführt, zum Beispiel von einer Reagenzglaskultur über flüssige Kulturmedien mit 50 ml, 1 l, 10 l, 40 l, 400 l, 4 m³, 10 m³ und 200 m³. Die Abstufungen können auch anders sein. ⓘ
Als Kulturmedium wird eine wässrige Lösung von acht bis zehn Prozent verwendet. Melasse enthält etwa 50 % Zucker. Die Lösung wird mittels Säuren auf einen pH-Wert von etwa 4,5 gebracht, gekocht (damit fremde Mikroorganismen abgetötet werden) und gefiltert. Dann werden Nährsalze (hauptsächlich Ammoniumsalze und Phosphate) sowie Vitamine der B-Gruppe zugesetzt, da diese für das Hefewachstum benötigt werden und in der Melasse nicht in ausreichenden Mengen vorhanden sind. Die Kulturen werden aerob, das bedeutet unter Belüftung, geführt, um eine möglichst hohe Biomasse-Ausbeute zu erhalten. ⓘ
Die ersten vier Stufen bis etwa 40 l werden im Laboratorium geführt, wobei die Kultureinrichtungen sterilisiert werden, die Hefe also in Reinkultur vermehrt wird. Dies dauert etwa acht Tage. Die nächsten zwei bis drei Stufen bis etwa 10 m³ werden im Betrieb in einer stationären technischen Anlage geführt, der sogenannten Reinzuchtanlage, die ebenfalls sterilisiert wird (Heißdampf 120 °C unter 1 bar Überdruck), Dauer etwa zwei Tage. Für die letzten zwei Stufen werden wegen ihrer Größe (200 m³) nicht sterilisierte Anlagen verwendet, jedoch werden Fremdmikroorganismen weitgehend ausgeschlossen. Diese Kulturen dauern jeweils nur kurze Zeit (je 10 bis 20 Stunden) und werden mit einer hohen Hefekonzentration gestartet, so dass etwaige Fremdorganismen praktisch nicht zur Entwicklung kommen. Im angeführten Beispiel wird in der 200-m³-Stufe zunächst etwa 18 t „Stellhefe“ erhalten. Manchmal wird Stellhefe auch in zwei Stufen erzeugt. Aus der Stellhefe wird in einer letzten Phase, ebenfalls in einer 200-m³-Anlage, in etwa zehn Stunden die Versandhefe produziert, zum Beispiel in vier Parallelkulturen mit je 200 m³ Medium etwa 65–70 t. ⓘ
In etwa elf Tagen wird so aus etwa 8 mg Ausgangsmasse mit etwa 33 Verdoppelungen die fast zehnmilliardenfache Hefemasse hergestellt. ⓘ
Die Hefe wird mittels Separatoren konzentriert (ergibt sogenannte „Hefemilch“ oder „Hefesahne“) und je nach gewünschtem Ergebnis weiterverarbeitet:
- Presshefe
- Über Filterpressen oder Vakuumrotationsfilter wird die Hefemilch auf einen Trockenstoffanteil von etwa 30 % konzentriert. Anschließend wird die Masse durch eine Strangpresse ausgeformt und abgepackt. Ein Gramm Presshefe enthält etwa 1010 (10 Milliarden) Hefezellen.
- Aktive Trockenhefe
- Im Extruder wird Presshefe zu kleinen Zylindern geformt, die dann im Wirbelschichtverfahren getrocknet werden.
- Trockenhefe
- Die restliche Hefemilch wird im Walzentrockner oder in einer Sprühgefriertrocknungsanlage getrocknet, wobei die enzymatische Aktivität völlig verlorengeht, so dass diese Hefe hauptsächlich als Futtermittelzusatz oder für diätetische und kulinarische Zwecke (sogenannte Nährhefe) verwendet wird.
- Flüssighefe
- Die Hefemilch wird in flüssiger Form auf die vom Kunden gewünschte Triebkraft eingestellt.
Insgesamt fallen bei der Herstellung auf Melassebasis größere Mengen organischer und chemischer Stoffe sowie Mikroorganismen-haltiges Hefewasser an, die nach wie vor ein Entsorgungsproblem darstellen. ⓘ
In Entwicklung ist derzeit der Versuch, mit Hilfe der Gentechnik Hefe zur Bildung von Aromen (z. B. Vanille) zu veranlassen. ⓘ
Dosierung der Backhefe

Backhefe wird, bezogen auf die Mehlmenge, mit etwa 3 bis 6 % den Hefeteigen zugegeben. Teige mit hohem Fettanteil bedürfen bis zu 8 %, da sich der geringere Wassergehalt negativ auf den Stoffwechsel der Hefe auswirkt. Bei extrem langen Teigführungen oder Vorteigen liegt der Anteil der verwendeten Hefe bei etwa 1–2 %. Als optimale Nährbasis verwendet man Backmalz. ⓘ
Handelsformen der Backhefe und ihre Haltbarkeit

Hefe wird als gepresste Frischhefe (Blockhefe), als Trockenhefe (Haltbarkeit etwa 1 Jahr) oder Flüssighefe angeboten. Zur Herstellung der Trockenhefe wird der von der Maische gereinigten Hefe sukzessive ein Großteil des Wassers entzogen. Meist wird der Emulgator Citrem (Ester der Citronensäure mit Monoglyceriden) zugegeben. Dieser soll eine zu starke Austrocknung der Hefezellen verhindern, damit die Zellen nur inaktiv werden, aber nicht absterben. So inaktivierte Hefe kann lange bei Raumtemperatur gelagert werden. Dennoch sollte man das auf die Packung gedruckte Haltbarkeitsdatum berücksichtigen, da die Fähigkeit der Hefezellen zur Reaktivierung im Laufe der Zeit verlorengeht. Ein typisches 7-g-Päckchen Trockenhefe, wie es im Einzelhandel angeboten wird, besitzt etwa dieselbe Gärkraft wie ein halber 42-g-Würfel Frischhefe. ⓘ
Gewöhnliche Frischhefe behält bei einer Lagertemperatur von 2 bis 8 °C für zehn bis zwölf Tage die volle Triebkraft. Ein permanenter Abbau von Kohlenhydratreserven und Eiweiß erhält die Lebensfunktionen der Hefe. Je mehr alte oder abgestorbene Zellen in einem Stück Hefe enthalten sind, desto schlechter wird die Triebkraft. Gleichzeitig treten Stoffe wie Glutathion aus der Zelle aus. Das führt zu einer Erweichung des Klebers (Gluten-Getreideprotein) im Teig. Alte Frischhefe ist auch bei höherer Dosierung somit praktisch unbrauchbar. ⓘ
Frische Backhefe erkennt man an einer hellen, meist gelblichen Farbe. Sie hat einen angenehmen Geruch, einen süßlichen, intensiven Geschmack und einen festen muschelartigen Bruch. Alte Hefe ist braungrau, rissig, bröckelig, hat einen zunehmend bitteren Geschmack und unangenehmen Geruch. ⓘ
Die Haltbarkeit frischer Backhefe kann durch Einfrieren verlängert werden. Bei entsprechend geringer Portionierung, z. B. einem halben Würfel (ca. 21 g, normalerweise hinreichend für 500 g Mehl), ist eine direkte Verarbeitung aus der Tiefkühlung möglich. ⓘ
Eine Alternative zur Verwendung der Backhefe ist Backferment. ⓘ
Besondere Backhefe-Sorten
Für besondere Aufgaben werden Spezialzüchtungen verwendet, wie beispielsweise osmotolerante Hefen, die – bei sehr süßen Teigen – unempfindlicher gegen osmotischen Druck sind. Ökohefen (Sauerteighefen), welche auf einem Getreidenährboden gezüchtet werden, sind speziell geeignet für Menschen mit einer Hefeallergie. ⓘ
Nährwerte
Presshefe
Je 100 Gramm:
- Brennwert 439 kJ (105 kcal), Wasser 73 g, Eiweiß 16,7 g, Fett 1,18 g, Kohlenhydrate 6,72 g davon: Ballaststoffe 0,3 g
- Mineralien: Kalium 649 mg, Phosphor 605 mg, Calcium 28 mg, Natrium 34 mg, Eisen 4,9 mg,
- Vitamine: Niacin (B3) 17,4 mg, Pantothensäure (B5) 3,46 mg, Thiamin (B1) 1,43 mg, Riboflavin (B2) 2,31 mg, Folsäure (B9) 1,02 mg, Biotin 0,033 mg ⓘ
Aktive Trockenhefe
Je 100 Gramm:
- Brennwert 1361 kJ (325 kcal), Wasser 5,1 g, Eiweiß 40,4 g, Fett 7,61 g, Kohlenhydrate 41,2 g davon: Ballaststoffe 26,9 g
- Mineralien: Kalium 955 mg, Phosphor 637 mg, Magnesium 54 mg, Calcium 30 mg, Natrium 51 mg, Zink 7,94 mg, Eisen 2,17 mg, Mangan 0,31 mg, Kupfer 436 µg, Selen 7,9 µg
- Vitamine: Niacin (B3) 40,2 mg, Pantothensäure (B5) 13,5 mg, Thiamin (B1) 10,99 mg, Pyridoxin (B6) 1,5 mg, Riboflavin (B2) 4 mg, Folsäure (B9) 2,34 mg ⓘ
Nährhefe (getrocknete Bierhefe, Trockenhefe)

Je 100 Gramm:
- Brennwert 1440 kJ (344 kcal), Wasser 6 g, Eiweiß 47,6 g, Fett 1,3 g, Kohlenhydrate 36,1 g davon: Ballaststoffe 0,8 g
- Mineralien: Kalium 1,41 g, Phosphor 1,9 g, Eisen 17,6 mg, Mangan 0,53 mg
- Vitamine: Niacin (B3) 44,8 mg, Pantothensäure (B5) 7,21 mg, Thiamin (B1) 12 mg, Pyridoxin (B6) 4,41 mg, Riboflavin (B2) 3,17 mg, Folsäure (B9) 3,17 mg ⓘ
