Muskelkontraktion
Muskelkontraktion ist die Aktivierung von spannungserzeugenden Stellen in den Muskelzellen. In der Physiologie bedeutet Muskelkontraktion nicht notwendigerweise Muskelverkürzung, da Muskelspannung auch ohne Veränderung der Muskellänge erzeugt werden kann, z. B. wenn etwas Schweres in derselben Position gehalten wird. Auf die Beendigung der Muskelkontraktion folgt die Muskelrelaxation, d. h. die Rückkehr der Muskelfasern in ihren Zustand geringer Spannung. ⓘ
Muskelkontraktionen können anhand von zwei Variablen beschrieben werden: Länge und Spannung. Eine Muskelkontraktion wird als isometrisch bezeichnet, wenn sich die Muskelspannung ändert, aber die Muskellänge gleich bleibt. Im Gegensatz dazu ist eine Muskelkontraktion isotonisch, wenn die Muskelspannung während der gesamten Kontraktion gleich bleibt. Wenn sich die Muskellänge verkürzt, handelt es sich um eine konzentrische Kontraktion; wenn sich die Muskellänge verlängert, handelt es sich um eine exzentrische Kontraktion. Bei den natürlichen Bewegungen, die dem Bewegungsapparat zugrunde liegen, sind die Muskelkontraktionen vielfältig, da sie in der Lage sind, Längen- und Spannungsänderungen in zeitlich variabler Weise zu erzeugen. Daher ist es wahrscheinlich, dass weder die Länge noch die Spannung der Skelettmuskeln, die sich während der Fortbewegung zusammenziehen, gleich bleiben. ⓘ
Bei Wirbeltieren sind Skelettmuskelkontraktionen neurogen, da sie synaptischen Input von Motoneuronen benötigen. Ein einziges Motoneuron ist in der Lage, mehrere Muskelfasern zu erregen, so dass sich die Fasern gleichzeitig zusammenziehen. Nach der Erregung gleiten die Proteinfilamente in jeder Skelettmuskelfaser aneinander vorbei, um eine Kontraktion zu erzeugen, was durch die Theorie der gleitenden Filamente erklärt wird. Die erzeugte Kontraktion kann als Zuckung, Summation oder Tetanus beschrieben werden, je nach der Frequenz der Aktionspotentiale. In der Skelettmuskulatur ist die Muskelspannung am größten, wenn der Muskel auf eine mittlere Länge gedehnt wird, die durch die Längen-Spannungs-Beziehung beschrieben wird. ⓘ
Im Gegensatz zur Skelettmuskulatur sind die Kontraktionen der glatten Muskulatur und der Herzmuskulatur myogen (d. h. sie werden von den glatten Muskelzellen oder den Herzmuskelzellen selbst ausgelöst und nicht durch ein äußeres Ereignis, wie z. B. eine Nervenstimulation, stimuliert), obwohl sie durch Reize des autonomen Nervensystems moduliert werden können. Die Mechanismen der Kontraktion in diesen Muskelgeweben ähneln denen der Skelettmuskulatur. ⓘ
Arten

Muskelkontraktionen lassen sich anhand von zwei Variablen beschreiben: Kraft und Länge. Die Kraft selbst kann als Spannung oder Belastung unterschieden werden. Die Muskelspannung ist die Kraft, die der Muskel auf ein Objekt ausübt, während eine Last die Kraft ist, die ein Objekt auf den Muskel ausübt. Wenn sich die Muskelspannung ändert, ohne dass sich die Muskellänge entsprechend ändert, wird die Muskelkontraktion als isometrisch bezeichnet. Wenn sich die Muskellänge ändert, während die Muskelspannung gleich bleibt, ist die Muskelkontraktion isotonisch. Bei einer isotonischen Kontraktion kann sich die Muskellänge entweder verkürzen, um eine konzentrische Kontraktion zu erzeugen, oder verlängern, um eine exzentrische Kontraktion zu erzeugen. Bei den natürlichen Bewegungen, die dem Bewegungsapparat zugrunde liegen, sind die Muskelkontraktionen vielfältig, da sie in der Lage sind, Längen- und Spannungsänderungen in zeitlich variabler Weise zu erzeugen. Daher ist es wahrscheinlich, dass weder die Länge noch die Spannung konstant bleiben, wenn der Muskel während der Fortbewegung aktiv ist. ⓘ
Isometrische Kontraktion
Eine isometrische Kontraktion eines Muskels erzeugt Spannung, ohne die Länge zu verändern. Die Gelenke der Hand bewegen sich nicht, aber die Muskeln erzeugen genügend Kraft, um zu verhindern, dass der Gegenstand fallen gelassen wird. ⓘ
Isotonische Kontraktion
Bei der isotonischen Kontraktion bleibt die Spannung im Muskel trotz einer Änderung der Muskellänge konstant. Dies ist der Fall, wenn die Kontraktionskraft eines Muskels der Gesamtbelastung des Muskels entspricht. ⓘ
Konzentrische Kontraktion
Bei der konzentrischen Kontraktion reicht die Muskelspannung aus, um die Belastung zu überwinden, und der Muskel verkürzt sich, während er sich zusammenzieht. Dies ist der Fall, wenn die vom Muskel erzeugte Kraft größer ist als die Belastung, die seiner Kontraktion entgegensteht. ⓘ
Während einer konzentrischen Kontraktion wird ein Muskel gemäß der Theorie der gleitenden Fäden zur Kontraktion angeregt. Dies geschieht über die gesamte Länge des Muskels, wobei am Ursprung und am Ansatz eine Kraft erzeugt wird, die zu einer Verkürzung des Muskels führt und den Winkel des Gelenks verändert. In Bezug auf den Ellbogen würde eine konzentrische Kontraktion des Bizeps dazu führen, dass sich der Arm am Ellbogen beugt, wenn die Hand vom Bein zur Schulter wandert (Bizepscurl). Eine konzentrische Kontraktion des Trizeps würde den Winkel des Gelenks in die entgegengesetzte Richtung verändern, den Arm strecken und die Hand zum Bein hin bewegen. ⓘ
Exzentrische Kontraktion
Bei der exzentrischen Kontraktion reicht die bei der isometrischen Kontraktion erzeugte Spannung nicht aus, um die äußere Belastung des Muskels zu überwinden, und die Muskelfasern verlängern sich bei der Kontraktion. Anstatt ein Gelenk in die Richtung der Muskelkontraktion zu ziehen, dient der Muskel dazu, das Gelenk am Ende einer Bewegung abzubremsen oder auf andere Weise die Repositionierung einer Last zu steuern. Dies kann unwillkürlich geschehen (z. B. beim Versuch, ein Gewicht zu bewegen, das für den Muskel zu schwer ist) oder freiwillig (z. B. wenn der Muskel eine Bewegung "ausgleicht" oder der Schwerkraft widersteht, wie beim Bergabgehen). Kurzfristig scheint ein Krafttraining, bei dem sowohl exzentrische als auch konzentrische Kontraktionen ausgeführt werden, die Muskelkraft stärker zu steigern als ein Training, bei dem nur konzentrische Kontraktionen ausgeführt werden. Allerdings sind die trainingsbedingten Muskelschäden bei dehnenden Kontraktionen auch größer. ⓘ
Bei einer exzentrischen Kontraktion des Bizepsmuskels wird der Ellbogen zunächst gebeugt und dann gestreckt, während sich die Hand von der Schulter entfernt. Bei einer exzentrischen Kontraktion des Trizepsmuskels beginnt der Ellenbogen die Bewegung gerade und beugt sich dann, wenn sich die Hand zur Schulter hin bewegt. Desmin, Titin und andere Z-Linien-Proteine sind an exzentrischen Kontraktionen beteiligt, aber ihr Mechanismus ist im Vergleich zum Kreuzbrücken-Zyklus bei konzentrischen Kontraktionen kaum verstanden. ⓘ
Obwohl der Muskel einen negativen Betrag an mechanischer Arbeit leistet (es wird Arbeit auf den Muskel ausgeübt), wird dennoch chemische Energie (aus Fett oder Glukose oder vorübergehend in ATP gespeichert) verbraucht, wenn auch weniger als bei einer konzentrischen Kontraktion mit der gleichen Kraft. Zum Beispiel verbraucht man mehr Energie, wenn man eine Treppe hinaufsteigt, als wenn man die gleiche Treppe hinuntersteigt. ⓘ
Muskeln, die stark exzentrisch belastet werden, erleiden bei Überlastung (z. B. beim Muskelaufbau oder beim Krafttraining) größere Schäden als bei konzentrischer Belastung. Wenn beim Krafttraining exzentrische Kontraktionen verwendet werden, nennt man sie normalerweise Negativkontraktionen. Bei einer konzentrischen Kontraktion gleiten die kontraktilen Muskelfilamente aus Myosin und Aktin aneinander vorbei und ziehen die Z-Linien zusammen. Bei einer exzentrischen Kontraktion gleiten die Myofilamente in umgekehrter Richtung aneinander vorbei, wobei die tatsächliche Bewegung der Myosinköpfe während einer exzentrischen Kontraktion nicht bekannt ist. Eine Übung mit einer schweren exzentrischen Belastung kann ein größeres Gewicht tragen (die Muskeln sind bei exzentrischen Kontraktionen etwa 40 % stärker als bei konzentrischen Kontraktionen) und führt auch zu größeren Muskelschäden und einem verzögert einsetzenden Muskelkater ein bis zwei Tage nach dem Training. Übungen, die sowohl exzentrische als auch konzentrische Muskelkontraktionen beinhalten (d. h. eine starke Kontraktion und ein kontrolliertes Absenken des Gewichts), können zu größeren Kraftzuwächsen führen als konzentrische Kontraktionen allein. Während ungewohnt starke exzentrische Kontraktionen leicht zu Übertraining führen können, kann ein moderates Training vor Verletzungen schützen. ⓘ
Exzentrische Kontraktionen in der Bewegung
Exzentrische Kontraktionen treten normalerweise als Bremskraft im Gegensatz zu einer konzentrischen Kontraktion auf, um die Gelenke vor Schäden zu schützen. Bei praktisch jeder Routinebewegung tragen exzentrische Kontraktionen dazu bei, die Bewegungen flüssig zu halten, können aber auch schnelle Bewegungen wie einen Schlag oder Wurf verlangsamen. Ein Teil des Trainings für schnelle Bewegungen, wie z. B. das Werfen beim Baseball, besteht darin, das exzentrische Abbremsen zu reduzieren, damit während der gesamten Bewegung eine größere Kraft entwickelt werden kann. ⓘ
Exzentrische Kontraktionen werden auf ihre Fähigkeit hin erforscht, die Rehabilitation schwacher oder verletzter Sehnen zu beschleunigen. Achillessehnenentzündungen und Patellarsehnenentzündungen (auch bekannt als Springerknie oder Patellarsehnenentzündung) profitieren nachweislich von exzentrischen Kontraktionen mit hoher Belastung. ⓘ
Wirbeltiere

Bei Wirbeltieren gibt es drei Arten von Muskelgewebe: Skelettmuskulatur, glatte Muskulatur und Herzmuskulatur. Die Skelettmuskulatur macht den größten Teil der Muskelmasse des Körpers aus und ist für den Bewegungsapparat verantwortlich. Die glatte Muskulatur bildet die Blutgefäße, den Magen-Darm-Trakt und andere Bereiche des Körpers, die anhaltende Kontraktionen erzeugen. Die Herzmuskeln bilden das Herz, das das Blut pumpt. Skelett- und Herzmuskeln werden wegen ihres gestreiften Aussehens unter dem Mikroskop als quergestreifte Muskeln bezeichnet, was auf das hochgradig organisierte, abwechselnde Muster von A- und I-Bändern zurückzuführen ist. ⓘ
Skelettmuskel

Mit Ausnahme der Reflexe werden alle Kontraktionen der Skelettmuskeln durch Signale ausgelöst, die ihren Ursprung im Gehirn haben. Das Gehirn sendet elektrochemische Signale über das Nervensystem an das motorische Neuron, das mehrere Muskelfasern innerviert. Bei einigen Reflexen kann das Signal zur Kontraktion über eine Rückkopplungsschleife mit der grauen Substanz aus dem Rückenmark kommen. Andere Handlungen wie Fortbewegung, Atmung und Kauen haben einen reflexartigen Aspekt: Die Kontraktionen können sowohl bewusst als auch unbewusst ausgelöst werden. ⓘ
Neuromuskuläre Verbindung

Eine neuromuskuläre Verbindung ist eine chemische Synapse, die durch den Kontakt zwischen einem motorischen Neuron und einer Muskelfaser entsteht. Sie ist der Ort, an dem ein Motoneuron ein Signal an eine Muskelfaser sendet, um die Muskelkontraktion einzuleiten. Die Abfolge der Ereignisse, die zur Depolarisation der Muskelfaser an der neuromuskulären Verbindung führen, beginnt mit der Auslösung eines Aktionspotenzials im Zellkörper eines Motoneurons, das dann durch saltatorische Leitung entlang seines Axons in Richtung der neuromuskulären Verbindung weitergeleitet wird. Sobald es das endständige Bouton erreicht, bewirkt das Aktionspotenzial einen Ca2+
Ioneneinstrom in das Endglied über die spannungsgesteuerten Kalziumkanäle. Der Ca2+
Einstrom bewirkt, dass synaptische Vesikel, die den Neurotransmitter Acetylcholin enthalten, mit der Plasmamembran verschmelzen und Acetylcholin in den synaptischen Spalt zwischen dem terminalen Motorneuron und der neuromuskulären Verbindung der Skelettmuskelfaser freisetzen. Acetylcholin diffundiert durch die Synapse, bindet an nicotinische Acetylcholinrezeptoren an der neuromuskulären Verbindung und aktiviert diese. Durch die Aktivierung des nikotinischen Rezeptors wird der intrinsische Natrium-Kalium-Kanal geöffnet, wodurch Natrium einströmt und Kalium austritt. Infolgedessen kehrt das Sarkolemm seine Polarität um und seine Spannung springt schnell vom Ruhemembranpotenzial von -90mV auf bis zu +75mV, wenn Natrium eintritt. Das Membranpotenzial wird dann hyperpolarisiert, wenn Kalium austritt, und wird dann wieder an das Ruhemembranpotenzial angepasst. Diese schnelle Fluktuation wird als Endplattenpotenzial bezeichnet. Die spannungsgesteuerten Ionenkanäle des Sarkolemmas neben der Endplatte öffnen sich als Reaktion auf das Endplattenpotenzial. Sie sind natrium- und kaliumspezifisch und lassen nur eines der beiden Ionen durch. Diese Welle von Ionenbewegungen erzeugt das Aktionspotenzial, das sich von der motorischen Endplatte in alle Richtungen ausbreitet. Wenn keine Aktionspotenziale mehr ankommen, wird auch kein Acetylcholin mehr aus dem terminalen Bouton freigesetzt. Das verbleibende Acetylcholin im synaptischen Spalt wird entweder durch aktive Acetylcholinesterase abgebaut oder durch den synaptischen Knubbel resorbiert, und es bleibt nichts übrig, um das abgebaute Acetylcholin zu ersetzen. ⓘ
Erregung-Kontraktion-Kopplung
Die Erregungs-Kontraktions-Kopplung ist der Prozess, durch den ein muskuläres Aktionspotenzial in der Muskelfaser die Myofibrillen zur Kontraktion veranlasst. Im Skelettmuskel beruht die Erregungs-Kontraktions-Kopplung auf einer direkten Kopplung zwischen Schlüsselproteinen, dem Kalziumfreisetzungskanal des sarkoplasmatischen Retikulums (SR) (identifiziert als Ryanodinrezeptor 1, RYR1) und spannungsgesteuerten Kalziumkanälen vom L-Typ (identifiziert als Dihydropyridinrezeptoren, DHPRs). DHPRs befinden sich auf dem Sarkolemm (das das Oberflächensarkolemm und die transversalen Tubuli umfasst), während die RyRs auf der SR-Membran sitzen. Die enge Aneinanderreihung eines Quertubulus und zweier SR-Regionen, die RyRs enthalten, wird als Triade bezeichnet und ist in erster Linie der Ort, an dem die Erregungs-Kontraktions-Kopplung stattfindet. Die Erregungs-Kontraktions-Kopplung tritt auf, wenn die Depolarisierung einer Skelettmuskelzelle zu einem Aktionspotenzial führt, das sich über die Zelloberfläche und in das T-Tubuli-Netzwerk der Muskelfaser ausbreitet und dadurch den inneren Teil der Muskelfaser depolarisiert. Die Depolarisierung der inneren Teile aktiviert Dihydropyridinrezeptoren in den terminalen Zisternen, die sich in unmittelbarer Nähe zu Ryanodinrezeptoren im angrenzenden sarkoplasmatischen Retikulum befinden. Die aktivierten Dihydropyridinrezeptoren interagieren physisch mit den Ryanodinrezeptoren, um sie über Fußprozesse zu aktivieren (was Konformationsänderungen beinhaltet, die die Ryanodinrezeptoren allosterisch aktivieren). Wenn sich die Ryanodinrezeptoren öffnen, wird Ca2+
aus dem sarkoplasmatischen Retikulum in den lokalen Junktionsraum freigesetzt und diffundiert in das Gesamtzytoplasma, um einen Kalziumfunken auszulösen. Man beachte, dass das sarkoplasmatische Retikulum eine große Kalziumpufferkapazität hat, die zum Teil auf ein Kalzium-bindendes Protein namens Calsequestrin zurückzuführen ist. Die nahezu synchrone Aktivierung tausender Kalziumfunken durch das Aktionspotenzial verursacht einen zellweiten Kalziumanstieg, der den Aufwärtshub der Kalziumtransiente auslöst. Das Ca2+
das in das Zytosol freigesetzt wird, bindet sich an Troponin C in den Aktinfilamenten und ermöglicht so die Bildung von Kreuzbrücken, die Kraft und in manchen Situationen auch Bewegung erzeugen. Die Kalzium-ATPase des sarko-endoplasmatischen Retikulums (SERCA) pumpt aktiv Ca2+
zurück in das sarkoplasmatische Retikulum. Wenn Ca2+
wieder auf den Ruhezustand zurückgeht, nimmt die Kraft ab und es kommt zur Entspannung. ⓘ
Theorie des gleitenden Filaments

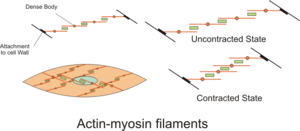
Die Theorie der gleitenden Filamente beschreibt einen Prozess, der von Muskeln zur Kontraktion genutzt wird. Es handelt sich um einen Zyklus sich wiederholender Ereignisse, bei denen ein dünnes Filament über ein dickes Filament gleitet und eine Spannung im Muskel erzeugt. Sie wurde unabhängig voneinander von Andrew Huxley und Rolf Niedergerke sowie von Hugh Huxley und Jean Hanson im Jahr 1954 entwickelt. Physiologisch gesehen ist diese Kontraktion im gesamten Sarkomer nicht gleichmäßig; die zentrale Position der dicken Filamente wird instabil und kann sich während der Kontraktion verschieben, was jedoch durch die Wirkung des elastischen Myofilaments aus Titin ausgeglichen wird. Dieses feine Myofilament hält die gleichmäßige Spannung im Sarkomer aufrecht, indem es das dicke Filament in eine zentrale Position zieht. ⓘ
Kreuzbrückenzyklus

Der Kreuzbrückenzyklus ist eine Abfolge von molekularen Ereignissen, die der Theorie der gleitenden Filamente zugrunde liegt. Eine Kreuzbrücke ist ein aus zwei Myosinköpfen bestehender Myosinfortsatz, der von den dicken Filamenten ausgeht. Jeder Myosinkopf hat zwei Bindungsstellen: eine für Adenosintriphosphat (ATP) und eine für Aktin. Die Bindung von ATP an einen Myosinkopf löst das Myosin vom Aktin und ermöglicht so die Bindung des Myosins an ein anderes Aktinmolekül. Nach der Bindung wird das ATP von Myosin hydrolysiert, das die freigesetzte Energie nutzt, um sich in eine "gespannte Position" zu begeben, in der es sich schwach an einen Teil der Aktinbindungsstelle bindet. Der Rest der Aktinbindungsstelle ist durch Tropomyosin blockiert. Da das ATP hydrolysiert ist, enthält der gespannte Myosinkopf nun Adenosindiphosphat (ADP) + Pi. Zwei Ca2+
Ionen binden an Troponin C auf den Aktinfilamenten. Der Troponin-Ca2+
Komplex veranlasst Tropomyosin, über die Aktinbindungsstelle zu gleiten und den Rest der Aktinbindungsstelle freizugeben. Die Freigabe der restlichen Aktinbindungsstellen ermöglicht es den beiden Myosinköpfen, sich zu schließen, und das Myosin kann stark an das Aktin binden. Der Myosinkopf setzt dann das anorganische Phosphat frei und leitet einen Kraftstoß ein, der eine Kraft von 2 pN erzeugt. Durch den Kraftstoß wird das Aktinfilament nach innen bewegt, wodurch sich das Sarkomer verkürzt. Myosin setzt daraufhin ADP frei, bleibt aber weiterhin fest an Aktin gebunden. Am Ende des Kraftstoßes wird ADP aus dem Myosinkopf freigesetzt, so dass Myosin in einem starren Zustand an Aktin gebunden bleibt, bis ein weiteres ATP an Myosin bindet. Ein Mangel an ATP würde zu der für die Totenstarre charakteristischen Starre führen. Sobald ein weiteres ATP an das Myosin bindet, löst sich der Myosinkopf wieder vom Aktin, und es kommt zu einem weiteren Kreuzbrückenzyklus. ⓘ
Der Kreuzbrückenzyklus kann so lange fortgesetzt werden, wie ausreichende Mengen an ATP und Ca2+
im Zytoplasma vorhanden sind. Der Querbrückenzyklus kann beendet werden, wenn Ca2+
aktiv in das sarkoplasmatische Retikulum zurückgepumpt wird. Wenn Ca2+
nicht mehr auf dem dünnen Filament vorhanden ist, ändert das Tropomyosin seine Konformation zurück in seinen vorherigen Zustand, so dass die Bindungsstellen wieder blockiert werden. Das Myosin bindet nicht mehr an das dünne Filament, und der Muskel entspannt sich. Die Ca2+
Ionen verlassen das Troponinmolekül, um die Ca2+
Ionenkonzentration im Sarkoplasma aufrechtzuerhalten. Das aktive Pumpen von Ca2+
Ionen in das sarkoplasmatische Retikulum führt zu einem Flüssigkeitsmangel in der Umgebung der Myofibrillen. Dies bewirkt die Entfernung von Ca2+
Ionen aus dem Troponin. Dadurch bedeckt der Tropomyosin-Troponin-Komplex wieder die Bindungsstellen an den Aktinfilamenten und die Kontraktion hört auf. ⓘ
Abstufung von Skelettmuskelkontraktionen
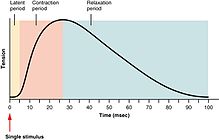
Die Stärke der Skelettmuskelkontraktionen lässt sich grob in Zuckung, Summation und Tetanus unterteilen. Eine Zuckung ist ein einzelner Kontraktions- und Entspannungszyklus, der durch ein Aktionspotenzial in der Muskelfaser selbst erzeugt wird. Die Zeit zwischen einem Reiz am motorischen Nerv und der anschließenden Kontraktion des innervierten Muskels wird als Latenzzeit bezeichnet, die in der Regel etwa 10 ms dauert und durch die Zeit für die Ausbreitung des Nervenaktionspotenzials, die Zeit für die chemische Übertragung an der neuromuskulären Verbindungsstelle und die anschließenden Schritte der Erregungs-Kontraktions-Kopplung bedingt ist. ⓘ
Wenn vor der vollständigen Entspannung einer Muskelzuckung ein weiteres Aktionspotenzial erzeugt wird, summiert sich die nächste Zuckung einfach auf die vorhergehende Zuckung auf, wodurch eine Summation entsteht. Die Summation kann auf zwei Arten erreicht werden: durch Frequenzsummation und durch Summation über mehrere Fasern. Bei der Frequenzsummierung wird die vom Skelettmuskel ausgeübte Kraft durch Variation der Frequenz gesteuert, mit der Aktionspotenziale an die Muskelfasern gesendet werden. Aktionspotenziale treffen nicht synchron an den Muskeln ein, und während einer Kontraktion feuert ein Teil der Muskelfasern zu jedem Zeitpunkt. Wenn ein Mensch seine Muskeln so stark anspannt, wie er bewusst in der Lage ist, wird in der Regel etwa ein Drittel der Fasern in jedem dieser Muskeln gleichzeitig feuern, obwohl dieses Verhältnis durch verschiedene physiologische und psychologische Faktoren (einschließlich Golgi-Sehnenorgane und Renshaw-Zellen) beeinflusst werden kann. Dieses "niedrige" Kontraktionsniveau ist ein Schutzmechanismus, um ein Abreißen der Sehne zu verhindern - die Kraft, die bei einer Kontraktion von 95 % aller Fasern entsteht, reicht aus, um den Körper zu schädigen. Bei der Summierung mehrerer Fasern werden, wenn das zentrale Nervensystem ein schwaches Signal zur Kontraktion eines Muskels sendet, zuerst die kleineren motorischen Einheiten stimuliert, da sie erregbarer sind als die größeren. Mit zunehmender Signalstärke werden neben den größeren auch mehr motorische Einheiten erregt, wobei die größten motorischen Einheiten eine bis zu 50-mal stärkere Kontraktionskraft haben als die kleineren. Je mehr und größere motorische Einheiten aktiviert werden, desto stärker wird die Kraft der Muskelkontraktion. Ein Konzept, das als Größenprinzip bekannt ist, ermöglicht eine Abstufung der Muskelkraft bei einer schwachen Kontraktion in kleinen Schritten, die dann immer größer werden, wenn größere Kraftbeträge erforderlich sind. ⓘ
Wenn schließlich die Frequenz der Muskelaktionspotenziale so ansteigt, dass die Muskelkontraktion ihre Spitzenkraft erreicht und auf diesem Niveau stehen bleibt, handelt es sich um eine Tetanus-Kontraktion. ⓘ
Verhältnis zwischen Länge und Spannung

Das Längen-Spannungs-Verhältnis setzt die Stärke einer isometrischen Kontraktion in Beziehung zur Länge des Muskels, bei der die Kontraktion auftritt. Die Muskeln arbeiten mit der größten aktiven Spannung, wenn sie sich einer idealen Länge nähern (häufig ihre Ruhelänge). Wenn sie über diese Länge hinaus gedehnt oder verkürzt werden (sei es durch die Wirkung des Muskels selbst oder durch eine äußere Kraft), nimmt die maximal erzeugte aktive Spannung ab. Diese Abnahme ist bei kleinen Abweichungen minimal, aber die Spannung nimmt schnell ab, wenn die Länge weiter vom Idealwert abweicht. Aufgrund des Vorhandenseins elastischer Proteine in der Muskelzelle (z. B. Titin) und der extrazellulären Matrix entsteht bei einer Dehnung des Muskels über eine bestimmte Länge hinaus eine rein passive Spannung, die einer Verlängerung entgegenwirkt. Zusammengenommen gibt es einen starken Widerstand gegen die Verlängerung eines aktiven Muskels weit über die Spitze der aktiven Spannung hinaus. ⓘ
Kraft-Geschwindigkeits-Beziehungen
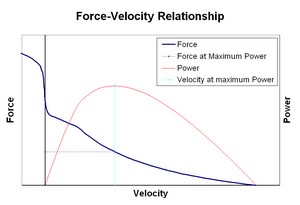
Die Kraft-Geschwindigkeits-Beziehung setzt die Geschwindigkeit, mit der ein Muskel seine Länge verändert (in der Regel durch äußere Kräfte wie Last oder andere Muskeln reguliert), in Beziehung zur Menge der von ihm erzeugten Kraft. Die Kraft nimmt im Verhältnis zur isometrischen Kraft hyperbolisch ab, wenn die Verkürzungsgeschwindigkeit zunimmt, und erreicht schließlich bei einer bestimmten Maximalgeschwindigkeit den Wert Null. Bei der Dehnung des Muskels verhält es sich umgekehrt: Die Kraft steigt über das isometrische Maximum hinaus, bis sie schließlich ein absolutes Maximum erreicht. Diese Eigenschaft von aktivem Muskelgewebe spielt eine Rolle bei der aktiven Dämpfung von Gelenken, die von gleichzeitig aktiven, entgegengesetzten Muskeln betätigt werden. In solchen Fällen verstärkt das Kraft-Geschwindigkeits-Profil die vom verlängernden Muskel erzeugte Kraft auf Kosten des verkürzenden Muskels. Diese Bevorzugung desjenigen Muskels, der das Gelenk ins Gleichgewicht bringt, erhöht die Dämpfung des Gelenks effektiv. Außerdem nimmt die Stärke der Dämpfung mit der Muskelkraft zu. Das motorische System kann also die Gelenkdämpfung durch die gleichzeitige Kontraktion (Ko-Kontraktion) entgegengesetzter Muskelgruppen aktiv steuern. ⓘ

Dabei handelt es sich allgemein um einen biologischen Prozess, bei dem mechanische Kräfte im Muskelgewebe erzeugt werden. Im Falle der Skelettmuskeln werden diese Kräfte durch Sehnen auf die Knochen übertragen. ⓘ
Die Kräfte entstehen durch Umwandlung von chemischer in mechanische Energie mittels des Aktin-Myosin-Komplexes in den einzelnen Muskelzellen. Die Muskelleistung wiederum bezieht ihre chemische Energie aus der Hydrolyse von ATP. ⓘ
Ein Muskel ist ein Teil des Gewebes in den meisten vielzelligen Tieren, das als Ganzes beweglich meist einem Knochen oder anderen Muskeln aufliegt (Verschiebbarkeit durch Schichten von lockerem Bindegewebe, Faszien und Logen) und durch seine Verbindungen mit Sehnen in der Lage ist, Gliedmaßen, innere Körperbezirke (Bauchpresse beim Husten, Miktion, Defäkation, Geburtsvorgang usw.; Atmungsbewegung) zu bewegen und damit letztlich dem Individuum ermöglicht, Kräfte auf seine Umwelt auszuüben (z. B. einen Nagel in die Wand schlagen) und sich selbst fortzubewegen. ⓘ
Glatter Muskel
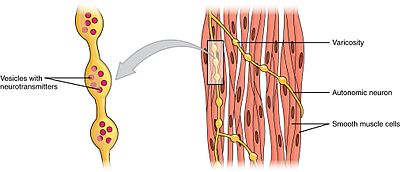
Die glatte Muskulatur kann in zwei Untergruppen eingeteilt werden: einteilige und mehrteilige. Einzelne glatte Muskelzellen finden sich im Darm und in den Blutgefäßen. Da diese Zellen durch Gap Junctions miteinander verbunden sind, sind sie in der Lage, sich als funktionelles Synzytium zusammenzuziehen. Einzelne glatte Muskelzellen kontrahieren myogen, was durch das autonome Nervensystem moduliert werden kann. ⓘ
Im Gegensatz zu den glatten Muskelzellen mit einer Einheit finden sich glatte Muskelzellen mit mehreren Einheiten in der Muskulatur des Auges und an der Basis der Haarfollikel. Mehrgliedrige glatte Muskelzellen kontrahieren, indem sie von Nerven des autonomen Nervensystems separat stimuliert werden. Als solche ermöglichen sie eine feine Kontrolle und allmähliche Reaktionen, ähnlich wie die Rekrutierung von motorischen Einheiten in der Skelettmuskulatur. ⓘ
Mechanismen der Kontraktion der glatten Muskulatur
Die kontraktile Aktivität von Zellen der glatten Muskulatur kann tonisch (anhaltend) oder phasisch (vorübergehend) sein und wird durch eine Vielzahl von Einflüssen beeinflusst, wie z. B. spontane elektrische Aktivität, neuronale und hormonelle Einflüsse, lokale Veränderungen der chemischen Zusammensetzung und Dehnung. Dies steht im Gegensatz zur kontraktilen Aktivität von Skelettmuskelzellen, die von einem einzigen neuronalen Input abhängt. Einige Arten von glatten Muskelzellen sind in der Lage, spontan eigene Aktionspotenziale zu erzeugen, die in der Regel nach einem Schrittmacherpotenzial oder einem langsamen Wellenpotenzial auftreten. Diese Aktionspotenziale werden durch den Einstrom von extrazellulärem Ca2+
und nicht durch Na+
. Wie in der Skelettmuskulatur sind zytosolische Ca2+
Ionen auch für den Crossbridge-Zyklus in glatten Muskelzellen erforderlich. ⓘ
Die beiden Quellen für zytosolisches Ca2+
in glatten Muskelzellen sind das extrazelluläre Ca2+
das durch Kalziumkanäle eintritt, und die Ca2+
Ionen, die aus dem sarkoplasmatischen Retikulum freigesetzt werden. Die Erhöhung des zytosolischen Ca2+
führt dazu, dass mehr Ca2+
Bindung an Calmodulin, das dann die Myosin-Leichtkettenkinase bindet und aktiviert. Der Kalzium-Calmodulin-Myosin-Leichtketten-Kinase-Komplex phosphoryliert Myosin an den 20 Kilodalton (kDa) leichten Myosinketten am Aminosäurerest Serin 19, wodurch die Kontraktion eingeleitet und die Myosin-ATPase aktiviert wird. Im Gegensatz zu Skelettmuskelzellen fehlt den glatten Muskelzellen Troponin, obwohl sie das dünne Filamentprotein Tropomyosin und andere wichtige Proteine - Caldesmon und Calponin - enthalten. Daher werden Kontraktionen der glatten Muskeln durch die Ca2+
-aktivierte Phosphorylierung von Myosin und nicht durch die Ca2+
Bindung an den Troponin-Komplex, der wie in der Skelett- und Herzmuskulatur die Myosin-Bindungsstellen am Aktin reguliert. ⓘ
Die Beendigung des Crossbridge-Zyklus (und das Verlassen des Muskels im Latch-Status) erfolgt, wenn die Phosphatase der leichten Myosinkette die Phosphatgruppen von den Myosinköpfen entfernt. Die Phosphorylierung der 20 kDa leichten Myosinketten korreliert gut mit der Verkürzungsgeschwindigkeit der glatten Muskulatur. Während dieses Zeitraums kommt es zu einem raschen Ausbruch der Energieverwertung, gemessen am Sauerstoffverbrauch. Innerhalb weniger Minuten nach der Einleitung sinkt der Kalziumspiegel deutlich ab, die Phosphorylierung der leichten 20 kDa-Myosinketten nimmt ab und der Energieverbrauch sinkt; die Kraft im tonischen glatten Muskel bleibt jedoch erhalten. Während der Kontraktion des Muskels bilden sich schnell zyklische Querbrücken zwischen aktiviertem Aktin und phosphoryliertem Myosin, die Kraft erzeugen. Es wird angenommen, dass die Aufrechterhaltung der Kraft auf dephosphorylierte "Latch-Bridges" zurückzuführen ist, die langsam zirkulieren und die Kraft aufrechterhalten. Es wird angenommen, dass eine Reihe von Kinasen wie die Rho-Kinase, DAPK3 und die Proteinkinase C an der anhaltenden Phase der Kontraktion beteiligt sind, und der Ca2+
Fluss könnte von Bedeutung sein. ⓘ
Neuromodulation
Obwohl die Kontraktionen der glatten Muskulatur myogenetisch sind, können Geschwindigkeit und Stärke ihrer Kontraktionen durch das autonome Nervensystem moduliert werden. Postganglionäre Nervenfasern des parasympathischen Nervensystems setzen den Neurotransmitter Acetylcholin frei, der sich an muskarinische Acetylcholinrezeptoren (mAChRs) auf glatten Muskelzellen bindet. Diese Rezeptoren sind metabotrope oder G-Protein-gekoppelte Rezeptoren, die eine Second-Messenger-Kaskade in Gang setzen. Umgekehrt setzen postganglionäre Nervenfasern des sympathischen Nervensystems die Neurotransmitter Epinephrin und Norepinephrin frei, die an adrenerge Rezeptoren binden, die ebenfalls metabotrop sind. Die genauen Auswirkungen auf die glatte Muskulatur hängen von den spezifischen Eigenschaften des aktivierten Rezeptors ab - sowohl der parasympathische als auch der sympathische Input können entweder erregend (kontraktil) oder hemmend (entspannend) wirken. ⓘ
Herzmuskel

Es gibt zwei Arten von Herzmuskelzellen: autorhythmische und kontraktile Zellen. Autorhythmische Zellen kontrahieren nicht, sondern geben den Kontraktionsrhythmus für andere Herzmuskelzellen vor, der durch das autonome Nervensystem moduliert werden kann. Im Gegensatz dazu bilden die kontraktilen Muskelzellen (Kardiomyozyten) den Großteil des Herzmuskels und sind in der Lage zu kontrahieren. ⓘ
Erregungs-Kontraktions-Kopplung
Sowohl bei der Erregungs-Kontraktions-Kopplung (E-Kopplung) des Skelettmuskels als auch des Herzmuskels finden Depolarisationsleitung und Ca2+-Freisetzung statt. Obwohl die beteiligten Proteine ähnlich sind, unterscheiden sie sich in Struktur und Regulation. Die Dihydropyridinrezeptoren (DHPRs) werden von verschiedenen Genen kodiert, und die Ryanodinrezeptoren (RyRs) sind unterschiedliche Isoformen. Außerdem stehen die DHPR in Kontakt mit RyR1 (der wichtigsten RyR-Isoform in der Skelettmuskulatur), um die Ca2+-Freisetzung in der Skelettmuskulatur zu regulieren, während der L-Typ-Kalziumkanal (DHPR in Herzmuskelzellen) und RyR2 (die wichtigste RyR-Isoform in der Herzmuskulatur) in der Herzmuskulatur nicht physisch gekoppelt sind, sondern einander über eine junktionale Kopplung gegenüberstehen. ⓘ
Im Gegensatz zum Skelettmuskel hängt die E-Kopplung im Herzmuskel vermutlich in erster Linie von einem Mechanismus ab, der als Kalzium-induzierte Kalziumfreisetzung bezeichnet wird und auf der Verbindungsstruktur zwischen T-Tubulus und sarkoplasmatischem Retikulum beruht. Junctophilin-2 (JPH2) ist für die Aufrechterhaltung dieser Struktur sowie für die Integrität des T-Tubulus von wesentlicher Bedeutung. Ein weiteres Protein, das Rezeptor-Accessory-Protein 5 (REEP5), sorgt für die Aufrechterhaltung der normalen Morphologie des junktionalen SR. Defekte der funktionellen Kopplung können durch einen Mangel an einem der beiden Proteine verursacht werden. Während des Prozesses der Kalzium-induzierten Kalziumfreisetzung werden die RyR2 durch einen Kalzium-Trigger aktiviert, der durch den Fluss von Ca2+ durch die L-Typ-Kalziumkanäle ausgelöst wird. Danach weist der Herzmuskel eher Diaden- als Triadenstrukturen auf. ⓘ
Die Erregungs-Kontraktions-Kopplung in Herzmuskelzellen tritt auf, wenn ein Aktionspotenzial von Schrittmacherzellen im Sinusknoten oder im Atrioventrikularknoten ausgelöst und über Gap Junctions an alle Zellen des Herzens weitergeleitet wird. Das Aktionspotenzial wandert entlang der Oberflächenmembran in die T-Tubuli (letztere sind nicht in allen Herzzelltypen zu finden), und die Depolarisierung bewirkt, dass extrazelluläres Ca2+
über L-Typ-Calciumkanäle und möglicherweise Natrium-Calcium-Austauscher (NCX) während des frühen Teils der Plateauphase in die Zelle ein. Obwohl dieser Ca2+-Einstrom nur etwa 10 % des für die Aktivierung benötigten Ca2+ ausmacht, ist er relativ größer als der des Skelettmuskels. Dieser Ca2+
Einstrom verursacht einen geringen lokalen Anstieg des intrazellulären Ca2+
. Der Anstieg des intrazellulären Ca2+
wird von RyR2 in der Membran des sarkoplasmatischen Retikulums erkannt, das Ca2+
in einer positiven physiologischen Rückkopplung freisetzt. Diese positive Rückkopplung wird als Calcium-induzierte Calcium-Freisetzung bezeichnet und führt zu Calcium-Funken (Ca2+
Funken). Die räumliche und zeitliche Summierung von ~30.000 Ca2+
Funken führt zu einem zellweiten Anstieg der zytoplasmatischen Kalziumkonzentration. Der Anstieg des zytosolischen Kalziums infolge des Kalziumflusses durch die Zellmembran und das sarkoplasmatische Retikulum wird durch Kalziumpuffer gedämpft, die einen großen Teil des intrazellulären Kalziums binden. Infolgedessen führt ein starker Anstieg des Gesamtkalziums zu einem relativ geringen Anstieg des freien Ca2+
. ⓘ
Das zytoplasmatische Kalzium bindet an Troponin C, wodurch sich der Tropomyosin-Komplex von der Aktin-Bindungsstelle entfernt und der Myosinkopf an das Aktinfilament binden kann. Von diesem Punkt an ist der Kontraktionsmechanismus im Wesentlichen derselbe wie beim Skelettmuskel (siehe oben). Kurz gesagt, zieht der Myosinkopf durch ATP-Hydrolyse das Aktinfilament zur Mitte des Sarkomers hin. ⓘ

Nach der Systole wird intrazelluläres Kalzium von der Pumpe des sarkoplasmatischen Retikulums ATPase (SERCA) wieder in das sarkoplasmatische Retikulum aufgenommen, damit der nächste Zyklus beginnen kann. Kalzium wird auch aus der Zelle ausgestoßen, hauptsächlich durch den Natrium-Kalzium-Austauscher (NCX) und, in geringerem Maße, durch eine Kalzium-ATPase der Plasmamembran. Ein Teil des Kalziums wird auch von den Mitochondrien aufgenommen. Ein Enzym, Phospholamban, dient als Bremse für SERCA. Bei niedrigen Herzfrequenzen ist Phospholamban aktiv und verlangsamt die Aktivität der ATPase, so dass Ca2+
die Zelle nicht vollständig verlassen muss. Bei hohen Herzfrequenzen wird Phospholamban phosphoryliert und deaktiviert, wodurch das meiste Ca2+
aus dem Zytoplasma zurück in das sarkoplasmatische Retikulum. Auch hier dämpfen Kalziumpuffer diesen Abfall der Ca2+
Konzentration ab, so dass ein relativ geringer Rückgang der freien Ca2+
Konzentration als Reaktion auf eine große Veränderung des Gesamtcalciums. Die sinkende Ca2+
Konzentration ermöglicht es dem Troponinkomplex, sich vom Aktinfilament zu lösen und die Kontraktion zu beenden. Das Herz entspannt sich, so dass sich die Herzkammern mit Blut füllen und der Herzzyklus erneut beginnen kann. ⓘ
Invertebraten
Kreis- und Längsmuskeln

Bei Ringelwürmern wie Regenwürmern und Blutegeln bilden Kreis- und Längsmuskelzellen die Körperwand dieser Tiere und sind für ihre Bewegung verantwortlich. Bei einem Regenwurm, der sich z. B. durch den Boden bewegt, kontrahieren Kreis- und Längsmuskulatur wechselseitig, während die Coelomflüssigkeit als Hydroskelett dient, indem sie die Spannkraft des Regenwurms aufrechterhält. Wenn sich die zirkulären Muskeln in den vorderen Segmenten zusammenziehen, beginnt sich der vordere Teil des Tierkörpers radial zu verengen, wodurch die inkompressible Coelomflüssigkeit nach vorne gedrückt wird und die Länge des Tieres zunimmt. Infolgedessen bewegt sich das Vorderende des Tieres nach vorne. Wenn sich das Vorderende des Regenwurms verankert und die zirkulären Muskeln in den vorderen Segmenten entspannen, läuft eine Welle von längsgerichteten Muskelkontraktionen nach hinten durch, die den Rest des Hinterkörpers des Tieres nach vorne zieht. Diese abwechselnden Wellen von Kreis- und Längskontraktionen werden als Peristaltik bezeichnet, die der kriechenden Bewegung des Regenwurms zugrunde liegt. ⓘ
Schräg gestreifte Muskeln
Wirbellose Tiere wie Ringelwürmer, Weichtiere und Fadenwürmer besitzen schräg gestreifte Muskeln, die Bänder aus dicken und dünnen Filamenten enthalten, die schraubenförmig und nicht wie bei den Skelett- oder Herzmuskeln von Wirbeltieren quer angeordnet sind. Bei Muscheln können die schräg gestreiften Muskeln die Spannung über lange Zeiträume aufrechterhalten, ohne zu viel Energie zu verbrauchen. Muscheln nutzen diese Muskeln, um ihre Schalen geschlossen zu halten. ⓘ
Asynchrone Muskeln
Fortgeschrittene Insekten wie Wespen, Fliegen, Bienen und Käfer verfügen über asynchrone Muskeln, die bei diesen Tieren die Flugmuskeln bilden. Diese Flugmuskeln werden oft als fibrilläre Muskeln bezeichnet, weil sie dicke und auffällige Myofibrillen enthalten. Ein bemerkenswertes Merkmal dieser Muskeln ist, dass sie nicht für jede Muskelkontraktion stimuliert werden müssen. Daher werden sie als asynchrone Muskeln bezeichnet, weil die Anzahl der Kontraktionen in diesen Muskeln nicht mit der Anzahl der Aktionspotenziale übereinstimmt (oder synchronisiert). Ein Flügelmuskel einer gefesselten Fliege kann beispielsweise Aktionspotenziale mit einer Frequenz von 3 Hz empfangen, ist aber in der Lage, mit einer Frequenz von 120 Hz zu schlagen. Das hochfrequente Schlagen ist möglich, weil die Muskeln mit einem Resonanzsystem verbunden sind, das auf eine natürliche Schwingungsfrequenz gebracht wird. ⓘ
Geschichte

1780 entdeckte Luigi Galvani, dass die Muskeln der Beine toter Frösche zuckten, wenn sie von einem elektrischen Funken getroffen wurden. Dies war einer der ersten Vorstöße in die Erforschung der Bioelektrizität, ein Gebiet, das bis heute die elektrischen Muster und Signale in Geweben wie Nerven und Muskeln untersucht. ⓘ
Im Jahr 1952 wurde der Begriff Erregungs-Kontraktions-Kopplung geprägt, um den physiologischen Prozess der Umwandlung eines elektrischen Reizes in eine mechanische Reaktion zu beschreiben. Dieser Prozess ist für die Muskelphysiologie von grundlegender Bedeutung, wobei der elektrische Reiz in der Regel ein Aktionspotenzial ist und die mechanische Reaktion eine Kontraktion darstellt. Die Erregungs-Kontraktions-Kopplung kann bei vielen Krankheiten gestört sein. Obwohl die Erregungs-Kontraktions-Kopplung seit über einem halben Jahrhundert bekannt ist, ist sie immer noch ein aktives Gebiet der biomedizinischen Forschung. Das allgemeine Schema besteht darin, dass ein Aktionspotenzial die Zellmembran depolarisiert. Durch muskeltypspezifische Mechanismen führt diese Depolarisation zu einem Anstieg des zytosolischen Kalziums, der als Kalziumtransient bezeichnet wird. Dieser Kalziumanstieg aktiviert kalziumempfindliche kontraktile Proteine, die dann ATP verwenden, um eine Zellverkürzung zu bewirken. ⓘ
Der Mechanismus der Muskelkontraktion hat sich den Wissenschaftlern jahrelang entzogen und muss weiter erforscht und aktualisiert werden. Die Theorie der gleitenden Filamente wurde unabhängig voneinander von Andrew F. Huxley und Rolf Niedergerke sowie von Hugh Huxley und Jean Hanson entwickelt. Ihre Erkenntnisse wurden in zwei aufeinanderfolgenden Artikeln in der Ausgabe vom 22. Mai 1954 von Nature unter dem gemeinsamen Thema "Structural Changes in Muscle During Contraction" veröffentlicht. ⓘ
Muskelkontraktion im Kontext des Bewegungsapparates der Extremitäten
Um eine Bewegung von Körperteilen gegen Widerstand, z. B. das Anheben eines Beines, welches ein erhebliches Eigengewicht aufweist, oder gar das Abbremsen aus dem Lauf oder Sprung zu ermöglichen, muss der Muskel über den Sehnenapparat Kraft auf die Angriffspunkte an den Knochen ausüben können. Hierzu ist ein durchgängiger Kraftschluss erforderlich, der alle Teile der Sehnen und des Muskels einbeziehen muss. ⓘ
Dieser Kraftschluss muss nach dem Prinzip „Die Kette ist so stark wie ihr schwächstes Glied“ sämtliche Elemente sowohl der Grob- als auch der Feinstruktur des Muskelaufbaus umfassen. Dies beinhaltet also verschiedene Ebenen: den Muskel als ganzen Gewebeteil, die Muskelfaser, die Myofibrille und in longitudinaler Gliederung das Sarkomer als kleinsten Abschnitt der Myofibrille. An den Übergängen Muskelfaser/Muskelfaser (Endomysium), Fibrille/Fibrille, Endomysium/Sehne, Perimysium/Sehne usw. bis zu den Übergängen der Sarkomere innerhalb der Fibrille müssen die Strukturen die auftretenden Kräfte kontrollieren und teilweise umleiten (Scherkräfte) können. Die Muskelfasern können pro cm² Muskelquerschnitt eine Kraft von bis zu 40 N aufbringen und sind passiv bis zu 100 N/cm² belastbar. ⓘ
Auffällig ist, dass von den die Sehnenkräfte übertragenden Strukturen insbesondere das Endomysium zur Übertragung beiträgt, indem es direkt mit den einstrahlenden Sehnenenden verbunden ist. Da das Endomysium über Myotendinöse Verbindungen die auf die Enden der Aktinfilamente (s. u.) ausgeübten Kräfte direkt aufnimmt, ist der Kraftschluss hier gewährleistet. ⓘ
Neben der Kraftübertragung in Richtung der Kontraktion ist die Verhinderung bzw. Umleitung von Scherkräften eine wichtige Aufgabe, die der Muskel durch Mechanismen der mechanischen Verbindung, aber auch der Steuerung der Kontraktion der Muskelfaserzellen erfüllt. Hier kommen den transversalen Strukturen, die den Zusammenhalt der Fibrillen zu Fasern und wiederum der Fasern zu Muskelsträngen gewährleisten, große Bedeutung zu. In mechanischer Hinsicht sind hier die Costamere und die Desmin-Filamente zu nennen, in Hinsicht auf die Steuerung und damit Reduzierung von Scherkräften die Synchronisation der Arbeit der Sarkomere und damit der Fibrillen durch die schnelle Weiterleitung des von den Endplatten erzeugten Aktionspotentials in longitudinaler und transversaler Richtung über die sog. Triaden. Hierbei handelt es sich um eine die Fibrillen umfassende, transversale Struktur aus je zwei endständigen Zisternen des Sarkoplasmatischen Retikulums und einem transversalen Tubulus, der morphologisch eine Einstülpung der Plasmamembran darstellt und das Aktionspotential sowohl in der Länge als auch in die Tiefe überträgt. Dort sorgt er für die Öffnung spezifischer Ca-Kationen-Kanäle, was die Auslösung des kontraktilen Mechanismus bewirkt. ⓘ