Phenylketonurie
| Phenylketonurie ⓘ | |
|---|---|
| Andere Namen | Phenylalanin-Hydroxylase-Mangel, PAH-Mangel, Følling-Krankheit |
 | |
| Phenylalanin | |
| Fachgebiet | Medizinische Genetik, Pädiatrie, Diätetik |
| Symptome | Ohne Behandlung geistige Behinderung, Krampfanfälle, Verhaltensstörungen, psychische Störungen, muffiger Geruch |
| Übliches Auftreten | Bei der Geburt |
| Arten | Klassisch, Variante |
| Ursachen | Genetisch bedingt (autosomal rezessiv) |
| Diagnostische Methode | Neugeborenen-Screening-Programme in vielen Ländern |
| Behandlung | Diät mit wenig phenylalaninhaltigen Lebensmitteln; spezielle Nahrungsergänzungsmittel |
| Medikamentöse Behandlung | Sapropterin-Dihydrochlorid, Pegvaliase |
| Prognose | Normale Gesundheit mit Behandlung |
| Häufigkeit | ~1 von 12.000 Neugeborenen |
Die Phenylketonurie (PKU) ist eine angeborene Stoffwechselstörung, die zu einer verminderten Verstoffwechselung der Aminosäure Phenylalanin führt. Unbehandelt kann PKU zu geistiger Behinderung, Krampfanfällen, Verhaltensproblemen und psychischen Störungen führen. Sie kann auch zu einem muffigen Geruch und heller Haut führen. Ein Baby, das von einer Mutter mit schlecht behandelter PKU geboren wird, kann Herzprobleme, einen kleinen Kopf und ein niedriges Geburtsgewicht haben. ⓘ
Phenylketonurie ist eine genetische Störung, die von den Eltern vererbt wird. Sie ist auf Mutationen im PAH-Gen zurückzuführen, die zu einem niedrigen Spiegel des Enzyms Phenylalaninhydroxylase führen. Dies führt zu einer Anhäufung von Phenylalanin aus der Nahrung in potenziell toxischen Mengen. Die Krankheit wird autosomal rezessiv vererbt, d. h. beide Kopien des Gens müssen mutiert sein, damit sich die Krankheit entwickeln kann. Es gibt zwei Haupttypen, die klassische PKU und die variante PKU, je nachdem, ob noch eine Enzymfunktion vorhanden ist. Menschen mit einer Kopie eines mutierten Gens haben in der Regel keine Symptome. In vielen Ländern gibt es Programme zum Screening von Neugeborenen auf diese Krankheit. ⓘ
Die Behandlung besteht in einer Diät, die (1) wenig phenylalaninhaltige Lebensmittel enthält und (2) spezielle Nahrungsergänzungsmittel einschließt. Säuglinge sollten eine spezielle Säuglingsnahrung mit einem geringen Anteil an Muttermilch erhalten. Die Diät sollte so bald wie möglich nach der Geburt beginnen und lebenslang beibehalten werden. Menschen, die frühzeitig diagnostiziert werden und eine strenge Diät einhalten, können eine normale Gesundheit und eine normale Lebenserwartung haben. Die Wirksamkeit wird durch regelmäßige Blutuntersuchungen überwacht. Das Medikament Sapropterin-Dihydrochlorid kann in einigen Fällen hilfreich sein. ⓘ
Die Phenylketonurie betrifft etwa 1 von 12 000 Säuglingen. Männer und Frauen sind gleichermaßen betroffen. Die Krankheit wurde 1934 von Ivar Asbjørn Følling entdeckt, wobei 1935 die Bedeutung der Ernährung festgestellt wurde. Die Gentherapie ist zwar vielversprechend, erfordert aber noch viele Studien (Stand 2014). ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| E70.0 | Klassische Phenylketonurie |
| E70.1 | Sonstige Hyperphenylalaninämien |
| ICD-10 online (WHO-Version 2019) | |
Phenylketonurie (PKU), syn. Følling-Krankheit, Föllingsche Krankheit, Phenylbrenztraubensäure-Oligophrenie und Oligophrenia phenylpyruvica, ist eine der häufigsten angeborenen Stoffwechselstörungen. Sie wird autosomal-rezessiv mit einer Inzidenz von etwa 1:8000 Neugeborenen vererbt. Betroffene Patienten können die Aminosäure Phenylalanin nicht abbauen, wodurch diese sich im Körper anreichert und Phenylpyruvat, Phenylacetat oder Phenyllactat entsteht, was unbehandelt zu einer schweren geistigen Entwicklungsstörung mit einer Epilepsie führt. Bestimmte Stoffwechselprodukte, die Phenylketone, die mit dem Urin ausgeschieden werden, waren für die Erkrankung namensgebend. Die Erkrankung kann durch eine einfache Reihenuntersuchung schon bei Neugeborenen erkannt werden. Eine rechtzeitig begonnene eiweißarme Diät kann die vorgenannten Symptome verhindern und sollte idealerweise lebenslang durchgeführt werden. ⓘ
Anzeichen und Symptome
Unbehandelte PKU kann zu geistiger Behinderung, Krampfanfällen, Verhaltensproblemen und psychischen Störungen führen. Sie kann auch zu einem muffigen Geruch und heller Haut führen. Ein Baby, das von einer Mutter mit schlecht behandelter PKU geboren wird, kann Herzprobleme, einen kleinen Kopf und ein niedriges Geburtsgewicht haben. ⓘ
Da der Körper der Mutter in der Lage ist, Phenylalanin während der Schwangerschaft abzubauen, sind Säuglinge mit PKU bei der Geburt normal. Die Krankheit ist zu diesem Zeitpunkt nicht durch eine körperliche Untersuchung nachweisbar, da noch keine Schäden entstanden sind. Das Neugeborenen-Screening wird durchgeführt, um die Krankheit zu erkennen und eine Behandlung einzuleiten, bevor ein Schaden entsteht. Die Blutprobe wird in der Regel durch einen Stich in die Ferse entnommen, der in der Regel 2-7 Tage nach der Geburt durchgeführt wird. Bei diesem Test können erhöhte Phenylalaninwerte nach ein oder zwei Tagen normaler Säuglingsernährung festgestellt werden. ⓘ
Wird ein Kind beim routinemäßigen Neugeborenenscreening nicht diagnostiziert und wird keine phenylalaninarme Diät eingeführt, steigen die Phenylalaninwerte im Blut mit der Zeit an. Toxische Phenylalaninwerte (und unzureichende Tyrosinwerte) können die Entwicklung des Kindes in einer Weise beeinträchtigen, die dauerhafte Auswirkungen hat. Die Krankheit kann sich klinisch durch Krampfanfälle, Hypopigmentierung (übermäßig helles Haar und helle Haut) und einen "muffigen Geruch" von Schweiß und Urin des Babys äußern (aufgrund von Phenylacetat, einer Carbonsäure, die bei der Oxidation von Phenylaceton entsteht). In den meisten Fällen sollte ein Wiederholungstest im Alter von etwa zwei Wochen durchgeführt werden, um den ersten Test zu überprüfen und eine eventuell übersehene Phenylketonurie aufzudecken. ⓘ
Unbehandelte Kinder erreichen oft nicht die frühen Meilensteine der Entwicklung, entwickeln Mikrozephalie und zeigen eine fortschreitende Beeinträchtigung der Gehirnfunktion. Hyperaktivität, EEG-Anomalien und Krampfanfälle sowie schwere Lernbehinderungen sind die wichtigsten klinischen Probleme im späteren Leben. Ein charakteristischer "muffiger" Geruch auf der Haut sowie eine Veranlagung zu Ekzemen bleiben bei fehlender Behandlung lebenslang bestehen. ⓘ
Die Schädigung des Gehirns ist nicht umkehrbar, wenn PKU in den ersten Lebensmonaten nicht behandelt wird. Die Ernährung von Säuglingen mit PKU muss sehr sorgfältig kontrolliert werden, damit das Gehirn die Möglichkeit hat, sich normal zu entwickeln. Bei betroffenen Kindern, die bei der Geburt erkannt und behandelt werden, ist die Wahrscheinlichkeit, dass sie neurologische Probleme entwickeln oder Krampfanfälle und geistige Behinderungen erleiden, sehr viel geringer (obwohl solche klinischen Störungen wie Asthma, Ekzeme, Anämie, Gewichtszunahme, Niereninsuffizienz, Osteoporose, Gastritis, Speiseröhren- und Nierenschwäche, Nierensteine und Bluthochdruck immer noch möglich sind). Darüber hinaus treten schwere depressive Störungen 230 % häufiger auf als bei den Kontrollpersonen, Schwindel und Schwindel 180 % häufiger, chronische ischämische Herzkrankheiten, Asthma, Diabetes und Gastroenteritis 170 % häufiger und Stress und Anpassungsstörungen 160 % häufiger. Im Allgemeinen sind die Ergebnisse für Menschen, die wegen PKU behandelt werden, jedoch gut. Bei behandelten Personen sind unter Umständen keinerlei körperliche, neurologische oder entwicklungsbezogene Probleme feststellbar. ⓘ
Genetik

PKU ist eine autosomal rezessive genetische Stoffwechselstörung. Da es sich um eine autosomal rezessive Störung handelt, sind zwei PKU-Allele erforderlich, damit eine Person Symptome der Krankheit aufweist. Damit ein Kind PKU erben kann, müssen sowohl die Mutter als auch der Vater das defekte Gen haben und weitergeben. Wenn beide Eltern PKU-Träger sind, besteht eine 25-prozentige Chance, dass ihr Kind mit der Krankheit geboren wird, eine 50-prozentige Chance, dass das Kind ein Träger ist, und eine 25-prozentige Chance, dass das Kind die Krankheit weder entwickelt noch ein Träger ist. ⓘ
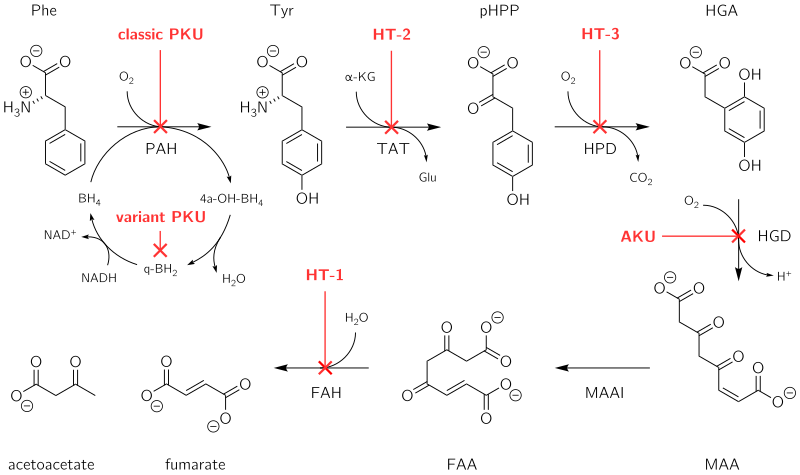
Die PKU ist durch homozygote oder heterozygote Mutationen im Gen für das Leberenzym Phenylalaninhydroxylase (PAH) gekennzeichnet, wodurch es funktionsunfähig wird. Dieses Enzym ist für die Umwandlung der Aminosäure Phenylalanin (Phe) in die Aminosäure Tyrosin (Tyr) erforderlich. Wenn die PAH-Aktivität reduziert ist, sammelt sich Phenylalanin an und wird in Phenylpyruvat (auch bekannt als Phenylketon) umgewandelt, das im Urin nachgewiesen werden kann. ⓘ
Träger eines einzigen PKU-Allels zeigen keine Krankheitssymptome, scheinen aber bis zu einem gewissen Grad gegen das Pilzgift Ochratoxin A geschützt zu sein. Dies erklärt die Persistenz des Allels in bestimmten Populationen, da es einen Selektionsvorteil bietet - mit anderen Worten, ein Heterozygote zu sein ist von Vorteil. ⓘ
Das PAH-Gen befindet sich auf Chromosom 12 in den Bereichen 12q22-q24.2. Bis zum Jahr 2000 wurden rund 400 krankheitsverursachende Mutationen im PAH-Gen gefunden. Dies ist ein Beispiel für die allelische genetische Heterogenität. ⓘ
Pathophysiologie
Bei ca. 98 % aller Fälle führt eine fehlende oder verminderte Aktivität des Enzyms Phenylalaninhydroxylase (PAH, EC 1.14.16.1) zu einer Anhäufung des Phenylalanins im Körper. Die alternativen Abbauprodukte Phenylessigsäure (Phenylacetat), Phenylbrenztraubensäure (Phenylpyruvat, das namengebende Phenylketon) und Phenylmilchsäure (Phenyllaktat) werden vermehrt ausgeschieden, was der Erkrankung schließlich den Namen Phenylketonurie gab. Durch den fehlenden Stoffwechselpfad zum Tyrosin tritt ein relativer Mangel an dieser eigentlich nichtessenziellen Aminosäure auf, die nun wiederum über die Nahrung aufgenommen werden muss. Tyrosin wird benötigt für die Biosynthese des Neurotransmitters Dopamin, der Schilddrüsenhormone, aber auch für die Bildung des Pigmentfarbstoffs Melanin, durch das die Färbung von Haut und Haaren zustande kommt. ⓘ
Wenn Phenylalanin (Phe) vom Körper nicht verstoffwechselt werden kann, führt eine typische Ernährung, die für Menschen ohne PKU gesund wäre, zu einer abnorm hohen Anhäufung von Phe im Blut, das für das Gehirn giftig ist. Bleibt die PKU unbehandelt (und oft sogar in Behandlung), können als Komplikationen schwere geistige Behinderungen, Hirnfunktionsstörungen, Mikrozephalie, Stimmungsschwankungen, motorische Unregelmäßigkeiten und Verhaltensprobleme wie Aufmerksamkeitsdefizit-/Hyperaktivitätsstörungen sowie körperliche Symptome wie ein muffiger" Geruch, Ekzeme und eine ungewöhnlich helle Haut- und Haarfärbung auftreten. ⓘ
Klassische PKU
Die klassische PKU und ihre weniger schweren Formen "milde PKU" und "milde Hyperphenylalaninämie" werden durch ein mutiertes Gen für das Enzym Phenylalaninhydroxylase (PAH) verursacht, das die Aminosäure Phenylalanin ("Phe") in andere essenzielle Verbindungen im Körper umwandelt, insbesondere in Tyrosin. Tyrosin ist für PKU-Patienten eine bedingt essenzielle Aminosäure, da sie ohne PAH nicht im Körper durch den Abbau von Phenylalanin hergestellt werden kann. Tyrosin ist für die Produktion von Neurotransmittern wie Epinephrin, Norepinephrin und Dopamin notwendig. ⓘ
PAH-Mangel verursacht ein Spektrum von Störungen, darunter die klassische Phenylketonurie (PKU) und die milde Hyperphenylalaninämie (auch bekannt als "Hyperphe" oder "milde HPA"), eine weniger schwere Anhäufung von Phenylalanin. Im Vergleich zu klassischen PKU-Patienten haben Patienten mit "Hyperphe" eine höhere PAH-Enzymaktivität und können größere Mengen Phenylalanin in ihrer Nahrung vertragen. Ohne diätetische Maßnahmen haben Patienten mit leichter HPA höhere Phe-Werte im Blut als Patienten mit normaler PAK-Aktivität. Derzeit gibt es keinen internationalen Konsens über die Definition der leichten HPA, jedoch wird sie am häufigsten bei Phe-Werten im Blut zwischen 2-6 mg/dL diagnostiziert. ⓘ
Phenylalanin ist eine große, neutrale Aminosäure (LNAA). LNAAs konkurrieren um den Transport durch die Blut-Hirn-Schranke (BHS) über den großen neutralen Aminosäuretransporter (LNAAT). Befindet sich ein Überschuss an Phenylalanin im Blut, wird der Transporter gesättigt. Ein übermäßiger Phenylalaninspiegel führt zu einer Verringerung des Gehalts an anderen LNAAs im Gehirn. Da diese Aminosäuren für die Synthese von Proteinen und Neurotransmittern notwendig sind, behindert eine Anhäufung von Phe die Entwicklung des Gehirns und führt zu geistiger Behinderung. ⓘ
Jüngste Forschungsergebnisse deuten darauf hin, dass die neurokognitiven und psychosozialen Fähigkeiten, die Lebensqualität, das Wachstum, die Ernährung und die Knochenpathologie selbst bei Patienten, die behandelt werden und deren Phe-Spiegel im Zielbereich liegen, leicht suboptimal sind, wenn ihre Ernährung nicht mit anderen Aminosäuren ergänzt wird. ⓘ
Die klassische PKU beeinträchtigt die Myelinisierung und die Bahnen der weißen Substanz bei unbehandelten Säuglingen; dies könnte eine der Hauptursachen für neurologische Probleme im Zusammenhang mit Phenylketonurie sein. Unterschiede in der Entwicklung der weißen Substanz lassen sich mit der Magnetresonanztomographie feststellen. Auch in der grauen Substanz können Anomalien festgestellt werden, insbesondere im motorischen und prä-motorischen Kortex, im Thalamus und im Hippocampus. ⓘ
Kürzlich wurde die Vermutung geäußert, dass PKU aufgrund der Bildung toxischer, amyloidähnlicher Phenylalanin-Ablagerungen Amyloid-Krankheiten wie der Alzheimer-Krankheit und der Parkinson-Krankheit ähneln könnte. ⓘ
Hyperphenylalaninämie mit Tetrahydrobiopterin-Mangel
Eine seltenere Form der Hyperphenylalaninämie ist der Tetrahydrobiopterinmangel, der auftritt, wenn das PAH-Enzym normal ist und ein Defekt in der Biosynthese oder im Recycling des Cofaktors Tetrahydrobiopterin (BH4) vorliegt. BH4 ist für die ordnungsgemäße Aktivität des Enzyms PAH erforderlich, und dieses Coenzym kann zur Behandlung zugesetzt werden. Bei dieser Form der Hyperphenylalaninämie kann ein Mangel an Tyrosin vorliegen (das von der PAK aus Phenylalanin gebildet wird). In diesem Fall besteht die Behandlung in der Supplementierung von Tyrosin, um diesen Mangel auszugleichen. ⓘ
Der Dopaminspiegel kann zur Unterscheidung zwischen diesen beiden Typen herangezogen werden. Tetrahydrobiopterin wird benötigt, um Phe in Tyr umzuwandeln, und wird benötigt, um Tyr über das Enzym Tyrosinhydroxylase in L-DOPA umzuwandeln. L-DOPA wird seinerseits in Dopamin umgewandelt. Niedrige Dopaminspiegel führen zu hohen Prolaktinspiegeln. Im Gegensatz dazu sind die Prolaktinwerte bei der klassischen PKU (ohne Beteiligung von Dihydrobiopterin) relativ normal. ⓘ
Bis 2020 war bekannt, dass der Tetrahydrobiopterinmangel auf Defekte in fünf Genen zurückzuführen ist. ⓘ

In ungefähr 2 % aller Fälle liegen jedoch Störungen des Stoffwechsels eines Koenzyms der Phenylalaninhydroxylase, des Tetrahydrobiopterins (BH4), vor, und man spricht von sogenannten atypischen Phenylketonurien. Da Tetrahydrobiopterin auch in der körpereigenen Herstellung (Biosynthese) der Neurotransmitter Serotonin und Dopamin eine zentrale Rolle spielt, weist die atypische PKU meist einen schwerwiegenderen Verlauf auf. Die Störungen des Biopterinstoffwechsels haben unterschiedliche Ursachen. Einerseits sind Defekte in der Biosynthese des Tetrahydrobiopterins bekannt. Andererseits kann das Enzym Dihydropteridinreduktase (DHPR, EC 1.5.1.34) Defekte aufweisen (Dihydropteridinreduktasemangel). Dieses Enzym ist für die Reduktion des Dihydrobiopterins zum Tetrahydrobiopterin zuständig. Die daraus resultierende verminderte oder unterbleibende Regeneration führt zu einem Mangel am Cofaktor. ⓘ
Stoffwechselwege
Das Enzym Phenylalaninhydroxylase wandelt normalerweise die Aminosäure Phenylalanin in die Aminosäure Tyrosin um. Findet diese Reaktion nicht statt, kommt es zu einer Anhäufung von Phenylalanin und einem Mangel an Tyrosin. Überschüssiges Phenylalanin kann über den Nebenweg, einen Transaminaseweg mit Glutamat, in Phenylketone umgewandelt werden. Zu den Metaboliten gehören Phenylacetat, Phenylpyruvat und Phenethylamin. Erhöhte Phenylalaninwerte im Blut und der Nachweis von Phenylketonen im Urin sind diagnostisch, die meisten Patienten werden jedoch durch das Neugeborenenscreening diagnostiziert. ⓘ
Screening
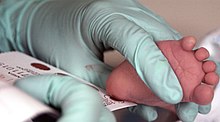
PKU ist in vielen Ländern Bestandteil des Neugeborenen-Screenings, wobei es unterschiedliche Nachweisverfahren gibt. Die meisten Säuglinge in den Industrieländern werden kurz nach der Geburt auf PKU untersucht. Das Screening auf PKU erfolgt mit einem bakteriellen Inhibitionstest (Guthrie-Test), einem Immunoassay mit fluorometrischem oder photometrischem Nachweis oder einer Aminosäurenmessung mit Tandem-Massenspektrometrie (MS/MS). Bei MS/MS-Messungen werden die Phe-Konzentration und das Verhältnis von Phe zu Tyrosin bestimmt, wobei das Verhältnis bei PKU erhöht ist. ⓘ
Behandlung
PKU ist nicht heilbar. Wenn PKU jedoch früh genug diagnostiziert wird, kann ein betroffenes Neugeborenes mit einer normalen Gehirnentwicklung aufwachsen, indem der Phenylalaninspiegel (Phe") durch eine Diät oder eine Kombination aus Diät und Medikamenten gesteuert und kontrolliert wird. ⓘ
Diät
Menschen, die von Geburt an die vorgeschriebene diätetische Behandlung befolgen, haben möglicherweise (aber nicht immer) keine Symptome. Ihre PKU wäre nur durch einen Bluttest nachweisbar. Für eine optimale Gehirnentwicklung müssen die Betroffenen eine spezielle Phe-arme Diät einhalten. Da Phe für die Synthese vieler Proteine notwendig ist, ist es für ein angemessenes Wachstum erforderlich, aber die Werte müssen streng kontrolliert werden. ⓘ
Für Menschen, die nicht an Phenylketonurie leiden, empfiehlt das U.S. Institute of Medicine mindestens 33 mg/kg Körpergewicht/Tag Phenylalanin plus Tyrosin für Erwachsene ab 19 Jahren. Für Menschen mit PKU liegt die Empfehlung für Kinder bis zum Alter von 10 Jahren bei 200 bis 500 mg/Tag, für ältere Kinder und Erwachsene unter 600 mg/Tag. Wo diese Spanne liegt, hängt vom Körpergewicht und Alter sowie von der Überwachung der Blutkonzentration ab. ⓘ
Optimale Gesundheitsbereiche (oder "Zielbereiche") liegen zwischen 120 und 360 μmol/L oder entsprechend 2 bis 6 mg/dL. Dieser Wert sollte mindestens in den ersten 10 Jahren erreicht werden, damit sich das Gehirn normal entwickeln kann. ⓘ
Die Diät erfordert die Einschränkung oder den Verzicht auf Lebensmittel mit hohem Phe-Gehalt, wie Sojabohnen, Eiweiß, Garnelen, Hühnerbrust, Spirulina, Brunnenkresse, Fisch, Nüsse, Flusskrebse, Hummer, Thunfisch, Truthahn, Hülsenfrüchte und fettarmer Hüttenkäse. Stärkehaltige Lebensmittel wie Kartoffeln und Mais sind in der Regel in kontrollierten Mengen akzeptabel, aber die Menge an Phe, die mit diesen Lebensmitteln aufgenommen wird, muss überwacht werden. In einigen Fällen kann eine getreidefreie Diät verordnet werden. In der Regel wird ein Ernährungstagebuch geführt, in dem die mit jeder Mahlzeit, jedem Snack oder Getränk aufgenommene Phe-Menge festgehalten wird. Mit Hilfe eines Austauschsystems kann die Phe-Menge in einer Lebensmittelportion anhand des Proteingehalts berechnet werden, der auf einem Etikett mit Nährwertangaben angegeben ist. Anstelle von normalem Brot, Nudeln und anderen Nahrungsmitteln auf Getreidebasis, die einen hohen Phe-Gehalt aufweisen, werden häufig eiweißärmere "medizinische Lebensmittel" verwendet. Viele Obst- und Gemüsesorten enthalten weniger Phe und können in größeren Mengen verzehrt werden. Säuglinge können nach wie vor gestillt werden, um alle Vorteile der Muttermilch zu erhalten, doch muss auch die Menge überwacht werden, und fehlende Nährstoffe müssen ergänzt werden. Der Süßstoff Aspartam, der in vielen Diätlebensmitteln und Erfrischungsgetränken enthalten ist, muss ebenfalls gemieden werden, da Aspartam Phenylalanin enthält. ⓘ
Verschiedene Menschen vertragen unterschiedliche Mengen an Phe in ihrer Ernährung. Regelmäßige Bluttests dienen dazu, die Auswirkungen der Phe-Aufnahme auf den Phe-Spiegel im Blut zu bestimmen. ⓘ
Nahrungsergänzungsmittel
Für PKU-Patienten (ab dem Säuglingsalter) werden in der Regel zusätzliche Eiweißersatzpräparate verschrieben, um die Aminosäuren und andere notwendige Nährstoffe zuzuführen, die bei einer phenylalaninarmen Ernährung sonst fehlen würden. Tyrosin, das normalerweise aus Phenylalanin gewonnen wird und für eine normale Gehirnfunktion notwendig ist, wird in der Regel ergänzt. Der Verzehr von Eiweißersatzpräparaten kann den Phenylalaninspiegel tatsächlich senken, wahrscheinlich weil dadurch der Prozess des Eiweißabbaus gestoppt wird, der die Freisetzung von in den Muskeln und anderen Geweben gespeichertem Phe in das Blut bewirkt. Bei vielen PKU-Patienten sind die Phe-Werte nach einer Fastenperiode (z. B. über Nacht) am höchsten, weil das Fasten den Katabolismus auslöst. Auch eine phenylalaninarme Ernährung ohne Eiweißersatzstoffe kann den Phe-Spiegel im Blut nicht senken, da eine unzureichende Ernährung ebenfalls den Stoffwechsel auslösen kann. Aus all diesen Gründen ist die verordnete Nahrung ein wichtiger Bestandteil der Behandlung von Patienten mit klassischer PKU. ⓘ
Es gibt Belege für eine Nahrungsergänzung mit großen neutralen Aminosäuren (LNAAs). Die LNAAs (z. B. Leu, Tyr, Trp, Met, His, Ile, Val, Thr) konkurrieren möglicherweise mit Phe um spezifische Trägerproteine, die die LNAAs über die Darmschleimhaut ins Blut und über die Blut-Hirn-Schranke ins Gehirn transportieren. In den USA wird es aus Kostengründen nur in begrenztem Umfang eingesetzt, ist aber in den meisten Ländern als Teil einer eiweißarmen / PHE-Diät erhältlich, um fehlende Nährstoffe zu ersetzen. ⓘ
Eine weitere interessante Behandlungsstrategie ist Casein-Glykomakropeptid (CGMP), ein Milchpeptid, das in seiner reinen Form natürlich frei von Phe ist. CGMP kann den größten Teil der freien Aminosäuren in der PKU-Diät ersetzen und bietet im Vergleich zu freien Aminosäuren mehrere vorteilhafte Ernährungseffekte. Die Tatsache, dass CGMP ein Peptid ist, sorgt dafür, dass die Absorptionsrate seiner Aminosäuren im Vergleich zu freien Aminosäuren verlängert wird, was zu einer verbesserten Proteinspeicherung und einem erhöhten Sättigungsgefühl im Vergleich zu freien Aminosäuren führt. Ein weiterer wichtiger Vorteil von CGMP besteht darin, dass der Geschmack deutlich verbessert wird, wenn CGMP einen Teil der freien Aminosäuren ersetzt, was dazu beitragen kann, dass die PKU-Diät besser eingehalten wird. ⓘ
Darüber hinaus enthält CGMP eine hohe Menge der Phe-senkenden LNAAs, die etwa 41 g pro 100 g Protein ausmachen und somit dazu beitragen, den Phe-Plasmaspiegel im Zielbereich zu halten. ⓘ
Enzymtherapie
Im Mai 2018 hat die US-amerikanische Zulassungsbehörde Food and Drug Administration (FDA) eine Zulassung für Pegvaliase erteilt. Hierbei handelt es sich um eine neuartige, so genannte Enzymtherapie. Wegen des Risikos einer Anaphylaxie, die am häufigsten bei der Aufwärtstitration der Dosis innerhalb des ersten Behandlungsjahres auftrat, wird der Kennzeichnung eine „Boxed Warning“ hinzugefügt und die Verordnung nur über ein eingeschränktes Programm im Rahmen einer Risikobewertungs- und Eindämmungsstrategie („Risk Evaluation and Mitigation Strategy“, REMS) ermöglicht. In der Europäischen Union ist Pegvaliase seit Mai 2019 zugelassen. ⓘ
Etwa die Hälfte der europäischen Patienten mit klassischer PKU sprechen auf eine Zufuhr von Tetrahydrobiopterin (Sapropterin, BH4) an, d. h. der Phenylalaninspiegel wird gesenkt. Es handelt sich nicht wie bei atypischer PKU um einen Defekt im Biopterinstoffwechsel, sondern um eine Eigenschaft der veränderten Phenylalaninhydroxylase. Es soll möglich sein, die Tatsache, ob jemand auf BH4 anspricht, an der Art der PHA-Mutation ablesen zu können. ⓘ
Ein entsprechender Wirkstoff namens Sapropterindihydrochlorid (6R-BH4), ein pharmakologisches Chaperon, wurde von der FDA und der EU inzwischen zugelassen. ⓘ
Im Jahr 2018 hat die FDA einen Enzymersatz namens Pegvaliase zugelassen, der Phenylalanin verstoffwechselt. Es ist für Erwachsene gedacht, die mit anderen Behandlungen schlecht zurechtkommen. ⓘ
Tetrahydrobiopterin (BH4) (ein Cofaktor für die Oxidation von Phenylalanin) kann bei manchen Menschen die Blutspiegel dieser Aminosäure senken, wenn es über den Mund eingenommen wird. ⓘ
Mütter
Für Frauen mit PKU ist es für die Gesundheit ihrer Kinder wichtig, vor und während der Schwangerschaft einen niedrigen Phe-Spiegel zu halten. Auch wenn der sich entwickelnde Fötus nur Träger des PKU-Gens ist, kann die intrauterine Umgebung sehr hohe Phenylalaninwerte aufweisen, die die Plazenta passieren können. Das Kind kann in der Folge eine angeborene Herzerkrankung, Wachstumsverzögerung, Mikrozephalie und geistige Behinderung entwickeln. Für Frauen mit PKU selbst besteht kein Risiko für zusätzliche Komplikationen während der Schwangerschaft. ⓘ
In den meisten Ländern wird Frauen mit PKU und Kinderwunsch geraten, ihre Phe-Werte im Blut zu senken (in der Regel auf 2 bis 6 mg/dL), bevor sie schwanger werden, und ihre Werte während der Schwangerschaft sorgfältig zu kontrollieren. Dies wird durch regelmäßige Blutuntersuchungen und eine sehr strenge Diät erreicht, die im Allgemeinen täglich von einem auf Stoffwechselerkrankungen spezialisierten Ernährungsberater überwacht wird. In vielen Fällen sinkt der Phe-Spiegel im Blut der Mutter, wenn die Leber des Fötus beginnt, sich zu entwickeln und normal PAK zu produzieren, so dass die Zufuhr erhöht werden muss, um innerhalb des sicheren Bereichs von 2-6 mg/dL zu bleiben. Die tägliche Phe-Aufnahme der Mutter kann sich daher bis zum Ende der Schwangerschaft verdoppeln oder sogar verdreifachen. Wenn der Phe-Spiegel im mütterlichen Blut unter 2 mg/dL sinkt, kann es nach anonymen Berichten bei den Müttern zu unerwünschten Wirkungen wie Kopfschmerzen, Übelkeit, Haarausfall und allgemeinem Unwohlsein kommen. Wenn niedrige Phenylalaninwerte während der gesamten Schwangerschaft beibehalten werden, besteht kein erhöhtes Risiko für Geburtsfehler im Vergleich zu einem Kind, das von einer Mutter ohne PKU geboren wurde. ⓘ
Frauen mit PKU und Kinderwunsch müssen auf eine besonders strenge Diät achten, um die Entwicklung des ungeborenen Kindes nicht zu gefährden. Auch ein stoffwechselgesundes Kind kann durch eine erhöhte Phenylalaninkonzentration erheblich geschädigt werden, da die Aminosäure den Mutterkuchen (Plazenta) problemlos durchwandert. Es entsteht eine Embryofetopathie mit niedrigem Geburtsgewicht, vermindertem Kopfumfang (Mikrozephalus), Herzfehler und anderen angeborenen Fehlbildungen. In der weiteren Entwicklung sind weiterhin mangelnde Längen- und Gewichtszunahme (Gedeihstörung) und eine geistige und motorische Entwicklungsverzögerung auffällig. Phenylketonurie der Mutter ist hingegen keine Kontraindikation zum Stillen gesunder Kinder. ⓘ
Epidemiologie
| Land | Vorkommen ⓘ |
|---|---|
| Australien | 1 von 10.000 |
| Brasilien | 1 von 8.690 |
| Kanada | 1 von 22.000 |
| China | 1 von 17.000 |
| Tschechoslowakei | 1 von 7.000 |
| Dänemark | 1 von 12.000 |
| Finnland | 1 von 200.000 |
| Frankreich | 1 von 13.500 |
| Indien | 1 von 18.300 |
| Irland | 1 von 4.500 |
| Italien | 1 von 17.000 |
| Japan | 1 von 125.000 |
| Korea | 1 von 41.000 |
| Niederlande | 1 von 18.000 |
| Norwegen | 1 von 14.500 |
| Philippinen | 1 von 102.000 |
| Polen | 1 von 8.000 |
| Schottland | 1 von 5.300 |
| Spanien | 1 von 20.000 |
| Schweden | 1 von 20.000 |
| Türkei | 1 von 2.600 |
| Vereinigtes Königreich | 1 von 10.000 |
| Vereinigte Staaten | 1 von 25.000 |
Die durchschnittliche Zahl der neuen PKU-Fälle variiert in den verschiedenen Bevölkerungsgruppen. Kaukasier in den Vereinigten Staaten sind in einer Rate von 1 zu 10.000 betroffen. Die Türkei hat mit 1 von 2.600 Geburten die höchste dokumentierte Rate der Welt, während Länder wie Finnland und Japan mit weniger als einem PKU-Fall pro 100.000 Geburten extrem niedrige Raten aufweisen. Eine Studie aus der Slowakei aus dem Jahr 1987 berichtet über eine Roma-Bevölkerung mit einer extrem hohen Inzidenz von PKU (ein Fall bei 40 Geburten), die auf umfangreiche Inzucht zurückzuführen ist. Im Vereinigten Königreich ist PKU das häufigste Problem des Aminosäurestoffwechsels. ⓘ
Geschichte
Bevor die Ursachen der PKU bekannt waren, führte die PKU bei den meisten Menschen, die die entsprechenden Mutationen geerbt hatten, zu schweren Behinderungen. Die Nobelpreisträgerin und Pulitzer-Preisträgerin Pearl S. Buck hatte eine Tochter namens Carol, die mit PKU lebte, bevor eine Behandlung zur Verfügung stand, und schrieb einen Bericht über die Auswirkungen in ihrem Buch The Child Who Never Grew. Viele unbehandelte PKU-Patienten, die vor dem weit verbreiteten Neugeborenenscreening geboren wurden, leben noch immer, größtenteils in Heimen und Einrichtungen für Pflegebedürftige. ⓘ
Die Phenylketonurie wurde 1934 von dem norwegischen Arzt Ivar Asbjørn Følling entdeckt, als er feststellte, dass Hyperphenylalaninämie (HPA) mit geistiger Behinderung einherging. In Norwegen ist diese Störung als Følling-Krankheit bekannt, benannt nach ihrem Entdecker. Følling war einer der ersten Ärzte, der eine detaillierte chemische Analyse zur Untersuchung von Krankheiten einsetzte. ⓘ
Im Jahr 1934 sah Følling im Rikshospitalet eine junge Frau namens Borgny Egeland. Sie hatte zwei Kinder, Liv und Dag, die bei der Geburt normal waren, später aber eine geistige Behinderung entwickelten. Als Dag etwa ein Jahr alt war, bemerkte die Mutter einen starken Geruch in seinem Urin. Følling entnahm den Kindern Urinproben, und nach zahlreichen Tests stellte er fest, dass die Substanz, die den Geruch im Urin verursachte, Phenylbrenztraubensäure war. Er kam zu dem Schluss, dass die Kinder einen Überschuss an Phenylbrenztraubensäure im Urin aufwiesen, ein Zustand, der später als Phenylketonurie (PKU) bezeichnet wurde. ⓘ
Seine sorgfältige Analyse des Urins der beiden betroffenen Geschwister veranlasste ihn, viele Ärzte in der Nähe von Oslo zu bitten, den Urin anderer betroffener Patienten zu untersuchen. Dabei entdeckte er die gleiche Substanz, die er bei acht anderen Patienten gefunden hatte. Er führte Tests durch und fand Reaktionen, die zu Benzaldehyd und Benzoesäure führten, woraus er schloss, dass die Verbindung einen Benzolring enthielt. Weitere Tests ergaben, dass der Schmelzpunkt mit dem von Phenylbrenztraubensäure übereinstimmte, was darauf hindeutete, dass sich die Substanz im Urin befand. ⓘ
1954 veröffentlichten Horst Bickel, Evelyn Hickmans und John Gerrard eine Arbeit, in der sie beschrieben, wie sie eine phenylalaninarme Diät einführten und der Patient wieder gesund wurde. Bickel, Gerrard und Hickmans wurden 1962 für ihre Entdeckung mit der John-Scott-Medaille ausgezeichnet. ⓘ
PKU war die erste Störung, die routinemäßig durch ein umfassendes Neugeborenenscreening diagnostiziert wurde. Robert Guthrie führte Anfang der 1960er Jahre den Neugeborenen-Screening-Test für PKU ein. Mit dem Wissen, dass PKU erkannt werden kann, bevor Symptome auftreten, und dass eine Behandlung eingeleitet werden kann, wurde das Screening schnell in der ganzen Welt eingeführt. Irland war das erste Land, das im Februar 1966 ein nationales Screeningprogramm einführte, Österreich begann ebenfalls 1966 mit dem Screening und England 1968. ⓘ
Im Jahr 2017 wurden die Europäischen Leitlinien veröffentlicht. Sie wurden von Patientenorganisationen wie der European Society for Phenylketonuria and Allied Disorders Treated as Phenylketonuria gefordert. Sie sind teilweise kritisch aufgenommen worden. ⓘ
Im Jahr 1934 wurde vom norwegischen Arzt Ivar Asbjørn Følling erstmals bei geistig behinderten Patienten die vermehrte Ausscheidung der Phenylbrenztraubensäure mit dem Urin mittels Eisen(III)-chlorid nachgewiesen („Følling-Probe“). Er nannte das neue Krankheitsbild zunächst Imbezillitas phenylpyruvica („Phenylbrenztraubenschwachsinn“). 1947 erfolgte dann die Entdeckung des eigentlichen Defektes in der Umwandlung von Phenylalanin zu Tyrosin durch George A. Jervis. Der nächste Meilenstein in der Geschichte der PKU (genannt auch Föllingsche Krankheit und Oligophrenia phenylpyruvia) war die Einführung einer phenylalaninarmen Diät zur Behandlung der Erkrankung durch den deutschen Kinderarzt Horst Bickel 1953. Zehn Jahre später ermöglichte schließlich der amerikanische Mikrobiologe Robert Guthrie mit dem von ihm entwickelten bakteriellen Hemmtest den einfachen Nachweis einer erhöhten Phenylalanin-Konzentration im Blut. Die Bestimmung konnte aus Bluttropfen erfolgen, die auf Filterpapier getrocknet wurden, wodurch sich die Methode auch für ein Massenscreening eignete. Im Rahmen erweiterter Neugeborenenscreeningprogramme erfolgt die Untersuchung in einigen Regionen inzwischen mit Hilfe der Tandem-Massenspektrometrie. ⓘ
Etymologie und Aussprache
Das Wort Phenylketonurie setzt sich zusammen aus Phenyl + Keton + -uria; es wird ausgesprochen /ˌfiːnaɪlˌkiːtəˈnjʊəriə, ˌfɛn-, -nɪl-, -nəl-, -toʊ-/. ⓘ
Forschung
Andere Therapien werden derzeit untersucht, darunter auch die Gentherapie. ⓘ
Biomarin führt derzeit klinische Studien zu PEG-PAL (PEGylierte rekombinante Phenylalanin-Ammoniak-Lyase oder "PAL") durch, einer Enzymsubstitutionstherapie, bei der das fehlende PAH-Enzym durch ein analoges Enzym ersetzt wird, das ebenfalls Phe abbaut. PEG-PAL befindet sich derzeit in der Phase 2 der klinischen Entwicklung. ⓘ
Ursache
Biochemie

Therapie
Eine normale geistige Entwicklung kann gewährleistet werden, wenn die Krankheit frühzeitig erkannt und behandelt wird. Die Aufnahme von Phenylalanin über die Nahrung muss streng kontrolliert und begrenzt werden, damit der Phenylalaninspiegel im Blut möglichst dauerhaft in einen verträglichen Bereich absinkt. Bei der Hyperphenylalaninämie sind die Werte des Phenylalanins erhöht, bedürfen jedoch keiner Therapie oder Diät. Die Voraussetzung ist eine regelmäßige Kontrolle dieser Werte. ⓘ
Atypische Phenylketonurie
Die Therapie beim Tetrahydrobiopterin-Mangel richtet sich nach der Ursache. Ist die Biosynthese des BH4s gestört, kann der Phenylalaninspiegel durch eine Substitution von BH4 gesenkt werden und es ist keine phenylalaninarme Diät nötig. Allerdings kann BH4 die Blut-Hirn-Schranke nicht in ausreichendem Maß überwinden. Daher steht es im Zentralnervensystem wiederum nicht in ausreichender Menge zur Verfügung, was die Biosynthese der Neurotransmitter Dopamin und Serotonin behindert. Zusätzlich zum Biopterin bekommen die Patienten daher auch noch Vorstufen dieser Neurotransmitter, L-Dopa und 5-Hydroxytryptophan, verabreicht. Zur Anpassung der individuell erforderlichen Dosis ist eine regelmäßige Überprüfung der Konzentration von Pterinen, Phenylalanin-Abbauprodukten und biogenen Aminen im Nervenwasser (Liquor cerebrospinalis) nötig. Außerdem ist zur Vermeidung eines Mangels an Tetrahydrofolsäure (Folinsäure), einem Abkömmling (Derivat) der zum Vitamin-B-Komplex gehörenden Folsäure, innerhalb des Nervensystems auch eine Substitution dieses Vitamins nötig. Eine Behandlung mit Folsäure selbst kann eher zu einer Verschlechterung der neurologischen Symptome führen und ist daher zu vermeiden. Im Falle eines Dihydropteridinreduktasemangels reicht es nicht aus, BH4 mit der Nahrung zuzuführen, sondern es muss ebenfalls eine phenylalaninarme Diät eingehalten werden. ⓘ
Prognose
Bei frühzeitig einsetzender Behandlung ist die Prognose der klassischen Phenylketonurie ausgesprochen gut. Längen- und Gewichtsentwicklung bleiben bis zum zweiten Lebensjahr etwas gegenüber gesunden Vergleichskindern zurück, später tritt jedoch ein Aufholwachstum ein und die Kinder neigen eher zur Entwicklung von Übergewicht. Die Entwicklung der Intelligenz verläuft unter früher und strenger Diät nahezu normal. Sie ist im Wesentlichen davon abhängig, wie gut die Behandlung während der ersten sechs Lebensjahre eingehalten wurde. Pubertätsentwicklung und Knochenalter weichen nicht von den Werten gesunder Kinder ab. Bei der atypischen PKU sind die Aussichten auf eine ungestörte Entwicklung nicht ganz so einheitlich zu beurteilen. Einerseits wurden dramatische Verbesserungen nach Einleitung der Behandlung selbst bei schon schwer erkrankten Patienten beobachtet. Andererseits ist auch bei frühem Therapiebeginn das Auftreten von Symptomen seitens des Nervensystems möglich. Dies ist bei Patienten mit einem Synthesedefekt häufiger der Fall als bei solchen mit einem Dihydropteridinreduktase-Mangel. ⓘ