Glykogen
Glykogen ist ein mehrfach verzweigtes Polysaccharid aus Glukose, das in Tieren, Pilzen und Bakterien als Energiespeicher dient. Die Polysaccharidstruktur stellt die wichtigste Speicherform von Glukose im Körper dar. ⓘ
Glykogen fungiert als eine von zwei Formen von Energiereserven, wobei Glykogen für die kurzfristige Speicherung und die andere Form als Triglyceridspeicher im Fettgewebe (d. h. im Körperfett) für die langfristige Speicherung vorgesehen ist. Beim Menschen wird Glykogen hauptsächlich in den Zellen der Leber und der Skelettmuskulatur gebildet und gespeichert. In der Leber kann Glykogen 5-6 % des Frischgewichts des Organs ausmachen, und die Leber eines Erwachsenen, der 1,5 kg wiegt, kann etwa 100-120 g Glykogen speichern. In der Skelettmuskulatur ist Glykogen in geringer Konzentration vorhanden (1-2 % der Muskelmasse), und die Skelettmuskulatur eines 70 kg schweren Erwachsenen speichert etwa 400 g Glykogen. ⓘ
Die Menge des im Körper gespeicherten Glykogens - insbesondere in den Muskeln und in der Leber - hängt in erster Linie vom körperlichen Training, dem Grundumsatz und den Ernährungsgewohnheiten ab (insbesondere bei oxidativen Fasern vom Typ 1). Unterschiedliche Glykogenspeicher in der Muskulatur im Ruhezustand werden erreicht, indem die Anzahl der Glykogenpartikel verändert wird, anstatt die Größe der vorhandenen Partikel zu erhöhen, obwohl die meisten Glykogenpartikel im Ruhezustand kleiner sind als ihr theoretisches Maximum. Geringe Mengen Glykogen finden sich auch in anderen Geweben und Zellen, darunter in den Nieren, den roten Blutkörperchen, den weißen Blutkörperchen und den Gliazellen im Gehirn. Auch die Gebärmutter speichert während der Schwangerschaft Glykogen, um den Embryo zu ernähren. ⓘ
Im Blut des Menschen befinden sich stets etwa 4 Gramm Glukose; bei nüchternen Menschen wird der Blutzuckerspiegel auf Kosten der Glykogenspeicher in der Leber und den Skelettmuskeln konstant gehalten. Die Glykogenspeicher in der Skelettmuskulatur dienen als Energiespeicher für den Muskel selbst; der Abbau des Muskelglykogens behindert jedoch die Aufnahme von Glukose aus dem Blut durch die Muskeln, wodurch die für die Verwendung in anderen Geweben verfügbare Glukosemenge im Blut erhöht wird. Die Glykogenspeicher der Leber dienen als Glukosespeicher für die Verwendung im gesamten Körper, insbesondere im zentralen Nervensystem. Das menschliche Gehirn verbraucht etwa 60 % der Blutglukose bei nüchternen, sitzenden Personen. ⓘ
Glykogen ist das Analogon von Stärke, einem Glukosepolymer, das in Pflanzen als Energiespeicher dient. Es hat eine ähnliche Struktur wie Amylopektin (ein Bestandteil von Stärke), ist aber stärker verzweigt und kompakter als Stärke. Beide sind im trockenen Zustand weiße Pulver. Glykogen kommt in Form von Körnchen im Zytosol/Zytoplasma in vielen Zelltypen vor und spielt eine wichtige Rolle im Glukosezyklus. Glykogen bildet eine Energiereserve, die schnell mobilisiert werden kann, um einen plötzlichen Glukosebedarf zu decken, die aber weniger kompakt ist als die Energiereserven der Triglyceride (Lipide). Als solches ist es auch als Speicherreserve in vielen parasitären Protozoen zu finden. ⓘ
| Strukturformel ⓘ | |||||||
|---|---|---|---|---|---|---|---|

| |||||||
| Allgemeines | |||||||
| Name | Glykogen | ||||||
| Andere Namen |
| ||||||
| CAS-Nummer | 9005-79-2 | ||||||
| Monomer | Glucose | ||||||
| Summenformel der Wiederholeinheit | C6H10O5 | ||||||
| Molare Masse der Wiederholeinheit | 162,14 g·mol−1 | ||||||
| Art des Polymers |
Biopolymer, Homoglycan | ||||||
| Kurzbeschreibung |
geruchloses weißes Pulver | ||||||
| Eigenschaften | |||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt |
270–280 °C (Zersetzung) | ||||||
| Löslichkeit |
| ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Das Glykogen (auch Glycogen, tierische Stärke oder Leberstärke) ist ein Oligosaccharid oder ein verzweigtes Polysaccharid (Vielfachzucker), das aus Glucose-Monomeren aufgebaut ist. Glykogen dient als in Zellen (vor allem der Leber) gespeichertes Kohlenhydrat der kurz- bis mittelfristigen Speicherung und Bereitstellung des Energieträgers Glucose im tierischen, also auch menschlichen, Organismus. Auch Pilze und einige Bakterien verwenden diese Form der Energiespeicherung, während Pflanzen Stärke als Kohlenhydratspeicher benutzen. Der Vorgang des Aufbaus von Glykogen aus Glucose wird als Glykogensynthese bezeichnet, der umgekehrte Prozess des Glykogenabbaus als Glykogenolyse. ⓘ
Vor allem in Leber- und Muskelzellen wird bei einem Überangebot von Kohlenhydraten Glykogen aufgebaut, bis dessen Massenanteil in der Leber 20 % beträgt. Bei vermehrtem Energiebedarf verwenden die Muskelzellen ihr gespeichertes Glykogen. Auch das in Leber und Nieren gespeicherte Glykogen wird bei Bedarf wieder zu Glucose aufgespalten, wobei hier die Glucose über das Blut dem Gesamtorganismus zur Verfügung gestellt wird. ⓘ
Struktur
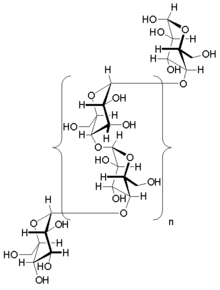

Glykogen ist ein verzweigtes Biopolymer, das aus linearen Ketten von Glukoseresten mit einer durchschnittlichen Kettenlänge von etwa 8-12 Glukoseeinheiten und 2.000-60.000 Resten pro Glykogenmolekül besteht. ⓘ
Wie bei Amylopektin sind die Glukoseeinheiten durch α(1→4)-Glykosidbindungen von einer Glukose zur nächsten linear miteinander verbunden. Zweige sind mit den Ketten, von denen sie abzweigen, durch α(1→6)-Glykosidbindungen zwischen der ersten Glukose des neuen Zweigs und einer Glukose der Stammkette verbunden. ⓘ
Jedes Glykogen ist im Wesentlichen ein Knäuel aus Glukosebäumen mit etwa 12 Schichten, in deren Zentrum ein Glykogenin-Protein steht, mit drei Arten von Glukoseketten: A, B und C. Es gibt nur eine C-Kette, die an das Glycogenin gebunden ist. Diese C-Kette entsteht durch die Selbstglucosylierung des Glykogenins, wobei eine kurze Grundkette gebildet wird. Aus der C-Kette entwickeln sich B-Ketten, und aus den B-Ketten verzweigen sich B- und A-Ketten. Die B-Ketten haben im Durchschnitt 2 Verzweigungspunkte, während die A-Ketten endständig, also unverzweigt sind. Im Durchschnitt hat jede Kette eine Länge von 12, wobei sie zwischen 11 und 15 liegen muss. Alle A-Ketten erreichen die kugelförmige Oberfläche des Glykogens. ⓘ
Glykogen in Muskel-, Leber- und Fettzellen wird in einer hydratisierten Form gespeichert, die aus drei oder vier Teilen Wasser pro Teil Glykogen besteht, verbunden mit 0,45 Millimol (18 mg) Kalium pro Gramm Glykogen. ⓘ
Glukose ist ein osmotisches Molekül und kann in hohen Konzentrationen tiefgreifende Auswirkungen auf den osmotischen Druck haben, was zu Zellschäden oder zum Zelltod führen kann, wenn sie unmodifiziert in der Zelle gespeichert wird. Glykogen ist ein nicht-osmotisches Molekül, so dass es als Lösung für die Speicherung von Glukose in der Zelle verwendet werden kann, ohne den osmotischen Druck zu stören. ⓘ

Funktionen
Leber
Wenn eine kohlenhydrat- oder eiweißhaltige Mahlzeit gegessen und verdaut wird, steigt der Blutzuckerspiegel an, und die Bauchspeicheldrüse schüttet Insulin aus. Der Blutzucker gelangt über die Pfortader in die Leberzellen (Hepatozyten). Das Insulin wirkt auf die Hepatozyten ein und stimuliert die Tätigkeit verschiedener Enzyme, darunter die Glykogensynthase. Solange sowohl Insulin als auch Glukose in ausreichender Menge vorhanden sind, werden Glukosemoleküle an die Glykogenketten angehängt. In diesem postprandialen oder "gesättigten" Zustand nimmt die Leber mehr Glukose aus dem Blut auf als sie abgibt. ⓘ
Nach der Verdauung einer Mahlzeit und dem Absinken des Glukosespiegels wird die Insulinausschüttung reduziert und die Glykogensynthese eingestellt. Wenn es zur Energiegewinnung benötigt wird, wird Glykogen abgebaut und wieder in Glukose umgewandelt. Glykogenphosphorylase ist das wichtigste Enzym des Glykogenabbaus. In den nächsten 8-12 Stunden ist die aus dem Leberglykogen stammende Glukose die Hauptquelle für die Blutglukose, die vom Rest des Körpers als Brennstoff verwendet wird. ⓘ
Glucagon, ein weiteres von der Bauchspeicheldrüse produziertes Hormon, dient in vielerlei Hinsicht als Gegensignal zum Insulin. Als Reaktion auf einen zu niedrigen Insulinspiegel (wenn der Glukosespiegel im Blut unter den Normalbereich zu fallen beginnt) wird Glukagon in zunehmenden Mengen ausgeschüttet und stimuliert sowohl die Glykogenolyse (den Abbau von Glykogen) als auch die Glukoneogenese (die Herstellung von Glukose aus anderen Quellen). ⓘ
Muskeln
Muskelzellglykogen scheint als unmittelbare Reservequelle für verfügbare Glukose für Muskelzellen zu fungieren. Andere Zellen, die geringe Mengen davon enthalten, nutzen es ebenfalls lokal. Da den Muskelzellen die Glukose-6-Phosphatase fehlt, die erforderlich ist, um Glukose in das Blut abzugeben, steht das gespeicherte Glykogen ausschließlich für den internen Gebrauch zur Verfügung und wird nicht mit anderen Zellen geteilt. Dies steht im Gegensatz zu den Leberzellen, die bei Bedarf ihr gespeichertes Glykogen in Glukose umwandeln und diese über den Blutkreislauf als Brennstoff für andere Organe bereitstellen. ⓘ
Scheinbare Optimalität
1999 wiesen Meléndez et al. nach, dass die Struktur des Glykogens unter einem bestimmten Stoffwechselmodell optimal ist. Im Einzelnen ist die Glykogenstruktur das optimale Design, das eine Fitnessfunktion maximiert, die auf der Maximierung von drei Größen beruht: der Anzahl der Glukoseeinheiten auf der Oberfläche der Kette, die für den enzymatischen Abbau zur Verfügung stehen, der Anzahl der Bindungsstellen, an die sich die abbauenden Enzyme anlagern können, der Gesamtzahl der gespeicherten Glukoseeinheiten; und der Minimierung einer Eigenschaft: dem Gesamtvolumen. ⓘ
Wenn jede Kette 0 oder 1 Verzweigungspunkt hat, erhalten wir im Wesentlichen eine lange Kette, keine Kugel, und sie würde ein zu großes Volumen mit nur wenigen terminalen Glukoseeinheiten für den Abbau einnehmen. Wenn jede Kette 3 Verzweigungspunkte hat, würde sich das Glykogen zu schnell füllen. Der Gleichgewichtspunkt ist 2. ⓘ
Bei dieser Verzweigungszahl 2 muss die Kettenlänge mindestens 4 betragen. Nach dem Modell von Meléndez et al. erreicht die Fitnessfunktion ihr Maximum bei 13 und nimmt dann langsam ab. ⓘ
Empirisch gesehen liegt die Verzweigungszahl bei 2 und die Kettenlänge bei den meisten Organismen, von Wirbeltieren bis hin zu Bakterien und Pilzen, zwischen 11 und 15. Die einzige signifikante Ausnahme ist die Auster, deren Glykogenkettenlänge zwischen 2 und 30 liegt, mit einem Durchschnittswert von 7. ⓘ
Geschichte
Glykogen wurde von Claude Bernard entdeckt. Seine Experimente zeigten, dass die Leber eine Substanz enthält, aus der durch ein "Ferment" in der Leber reduzierender Zucker entstehen kann. Im Jahr 1857 beschrieb er die Isolierung einer Substanz, die er "la matière glycogène" oder "zuckerbildende Substanz" nannte. Bald nach der Entdeckung des Glykogens in der Leber stellte A. Sanson fest, dass auch das Muskelgewebe Glykogen enthält. Die empirische Formel für Glykogen von (C
6H
10O
5)n wurde 1858 von Kekulé aufgestellt. ⓘ
Stoffwechsel
Synthese
Die Glykogensynthese ist im Gegensatz zu ihrem Abbau endergonisch, d. h. sie erfordert Energiezufuhr. Die Energie für die Glykogensynthese stammt von Uridintriphosphat (UTP), das mit Glukose-1-Phosphat unter Bildung von UDP-Glukose in einer von der UTP-Glukose-1-Phosphat-Uridylyltransferase katalysierten Reaktion reagiert. Glykogen wird aus UDP-Glukosemonomeren zunächst durch das Protein Glykogenin synthetisiert, das zwei Tyrosin-Anker für das reduzierende Ende des Glykogens besitzt, da Glykogenin ein Homodimer ist. Nachdem etwa acht Glukosemoleküle an einen Tyrosinrest angehängt worden sind, verlängert das Enzym Glykogensynthase die Glykogenkette schrittweise mit Hilfe von UDP-Glukose, indem es α(1→4)-gebundene Glukose an das nicht reduzierende Ende der Glykogenkette anhängt. ⓘ
Das Glykogenverzweigungsenzym katalysiert die Übertragung eines endständigen Fragments von sechs oder sieben Glukoseresten von einem nicht reduzierenden Ende auf die C-6-Hydroxylgruppe eines Glukoserests tiefer im Inneren des Glykogenmoleküls. Das Verzweigungsenzym kann nur auf einen Zweig mit mindestens 11 Resten einwirken, und das Enzym kann auf dieselbe Glukosekette oder benachbarte Glukoseketten übertragen. ⓘ
Spaltung
Glykogen wird durch das Enzym Glykogenphosphorylase von den nicht reduzierenden Enden der Kette abgespalten, um Monomere von Glukose-1-Phosphat zu erzeugen:
In vivo verläuft die Phosphorolyse in Richtung Glykogenabbau, da das Verhältnis von Phosphat und Glucose-1-Phosphat in der Regel größer als 100 ist. Glukose-1-Phosphat wird dann durch Phosphoglucomutase in Glukose-6-Phosphat (G6P) umgewandelt. Um die α(1-6)-Verzweigungen in verzweigtem Glykogen zu entfernen und die Kette in ein lineares Polymer umzuformen, ist ein spezielles Entzweigungsenzym erforderlich. Die entstehenden G6P-Monomere haben drei mögliche Schicksale:
- G6P kann den Glykolysepfad fortsetzen und als Brennstoff verwendet werden.
- G6P kann über das Enzym Glucose-6-Phosphat-Dehydrogenase in den Pentosephosphatweg eintreten, um NADPH und 5-Kohlenstoff-Zucker zu produzieren.
- In Leber und Niere kann G6P durch das Enzym Glukose-6-Phosphatase wieder zu Glukose dephosphoryliert werden. Dies ist der letzte Schritt des Gluconeogenesewegs. ⓘ
Klinische Relevanz
Störungen des Glykogenstoffwechsels
Die häufigste Erkrankung, bei der es zu Störungen des Glykogenstoffwechsels kommt, ist Diabetes, bei der es aufgrund abnormaler Insulinmengen zu einer abnormalen Anhäufung oder einem abnormalen Abbau von Leberglykogen kommen kann. Die Wiederherstellung eines normalen Glukosestoffwechsels normalisiert normalerweise auch den Glykogenstoffwechsel. ⓘ
Bei einer durch übermäßiges Insulin verursachten Hypoglykämie ist der Leberglykogenspiegel hoch, aber die hohen Insulinspiegel verhindern die Glykogenolyse, die zur Aufrechterhaltung eines normalen Blutzuckerspiegels erforderlich ist. Glucagon ist eine gängige Behandlung für diese Art von Hypoglykämie. ⓘ
Verschiedene angeborene Stoffwechselstörungen werden durch einen Mangel an Enzymen verursacht, die für die Glykogensynthese oder den Glykogenabbau erforderlich sind. Diese werden unter dem Begriff Glykogenspeicherkrankheiten zusammengefasst. ⓘ
Glykogenverarmung und Ausdauersport
Bei Langstreckensportlern wie Marathonläufern, Skilangläufern und Radfahrern kommt es häufig zu einer Glykogendepletion, bei der die Glykogenspeicher des Sportlers nach längerer Anstrengung ohne ausreichende Kohlenhydratzufuhr fast vollständig entleert sind. Dieses Phänomen wird beim Laufen als "Hitting the Wall" und beim Radfahren als "Bonking" bezeichnet. ⓘ
Dem Glykogenabbau kann auf drei Arten vorgebeugt werden:
- Erstens werden während des Trainings kontinuierlich Kohlenhydrate mit einer möglichst hohen Umwandlungsrate in Blutzucker (hoher glykämischer Index) aufgenommen. Das bestmögliche Ergebnis dieser Strategie ist der Ersatz von etwa 35 % der Glukose, die bei einer Herzfrequenz von mehr als 80 % des Maximums verbraucht wird.
- Zweitens kann der Körper durch Ausdauertrainingsanpassungen und spezielle Programme (z. B. Fasten, Ausdauertraining mit niedriger Intensität) die Muskelfasern des Typs I so konditionieren, dass sowohl die Effizienz der Brennstoffnutzung als auch die Belastbarkeit verbessert werden, um den Anteil der als Brennstoff verwendeten Fettsäuren zu erhöhen und den Verbrauch von Kohlenhydraten aus allen Quellen zu verringern.
- Drittens kann der Körper die Speicherkapazität der intramuskulären Glykogenspeicher erhöhen, indem er große Mengen an Kohlenhydraten zu sich nimmt, nachdem die Glykogenspeicher durch Sport oder Ernährung aufgebraucht wurden. Dieser Vorgang wird als "Kohlenhydratladung" bezeichnet. Im Allgemeinen spielt der glykämische Index der Kohlenhydratquelle keine Rolle, da die Insulinempfindlichkeit der Muskeln durch die vorübergehende Erschöpfung der Glykogenspeicher erhöht wird. ⓘ
Wenn Sportler nach einem anstrengenden Training sowohl Kohlenhydrate als auch Koffein zu sich nehmen, werden ihre Glykogenspeicher tendenziell schneller wieder aufgefüllt; die Mindestdosis an Koffein, bei der ein klinisch signifikanter Effekt auf die Glykogenauffüllung eintritt, ist jedoch nicht bekannt. ⓘ
Glykogen im menschlichen Stoffwechsel
Mit der Nahrung aufgenommene Stärke wird durch das Enzym alpha-Amylase (genauer Ptyalin) im Mund und im Zwölffingerdarm in die beiden Disaccharide Maltose und Isomaltose gespalten, welche durch weitere Enzyme in Glucose überführt werden. ⓘ
Die Muskeln nutzen ihren Glykogenvorrat ausschließlich selbst, die Leber und die Nieren dienen als Glykogenspeicher und stellen es hauptsächlich anderen Zellen zur Verfügung. Dies ist vor allem im Schlafzustand als Energieversorgung für Zellen des Nebennierenmarks und Erythrozyten wichtig, da diese Zellen auf Glucose als Energielieferant angewiesen sind. ⓘ
Der Blutzuckerspiegel wird unter anderem mittels Glykogenauf- und -abbau durch verschiedene Hormone reguliert: Adrenalin und Glucagon regen den Glykogenabbau an, Insulin fördert den Glykogenaufbau. Insulin und Glucagon werden in Teilen der Bauchspeicheldrüse gebildet. Der Glykogengehalt der Leber variiert dabei je nach Ernährungszustand des menschlichen Körpers. Im Hungerzustand beträgt er weniger als 1 % des Lebergewichtes. Bei gutem Ernährungszustand und kohlenhydratreicher Kost kann er auf bis zu 20 % des Lebergewichtes anwachsen. Pro Gramm Gewebe gerechnet ist die Glykogen-Kapazität der Nieren höher als die der Leber. Da die Leber aber das deutlich größere Organ ist, ist die absolute Kapazität der Leber höher. ⓘ
Glykogen-Abbau
Der lineare Anteil des Glykogens wird von dem Enzym Glycogenphosphorylase abgebaut. Dieses ist Pyridoxalphosphat-abhängig. Es katalysiert die Bindung freien Phosphats am C1-Atom der Glucose. Dabei wird die glykosidische Bindung zwischen den Glucose-Molekülen aufgespalten und es entsteht Glucose-1-phosphat. Dieses kann von einer Mutase in Glucose-6-phosphat überführt werden. Glucose-6-phosphat ist die normale Form der Glucose in einer Zelle. Entstünde freie Glucose, müsste die Hexokinase IV, ein Enzym, das auch in der Glykolyse eine Rolle spielt, unter Verwendung einer Phosphorylgruppe aus ATP Glucose-6-phosphat herstellen. Außerdem verursacht eine erhöhte Konzentration von Glucose in der Zelle eine Abnahme des Konzentrationsgradienten zwischen Zytosol und Extrazellularraum, sodass der Glucosetransport in die Zelle vermindert wird. ⓘ
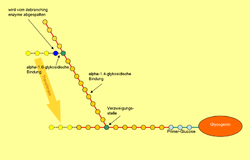
Die Glykogen-Phosphorylase kann Glykogen nur bis zum vierten Glucose-Molekül vor einer Verzweigungsstelle abbauen. An dieser Stelle kommt die 4-α-Glucanotransferase (eine enzymatische Aktivität des debranching enzyme) ins Spiel: Dieses Enzym überträgt drei der vier Glucose-Moleküle vor der Verzweigungsstelle auf eine andere Kette und fügt sie linear an. Das verbleibende alpha-1,6-glykosidisch gebundene Glucose-Molekül wird nun von der anderen enzymatischen Aktivität des Debranching enzyme abgespalten, wobei freie Glucose entsteht. Beim Glykogen-Abbau entsteht somit zu etwa 90 % Glucose-1-phosphat, da im Schnitt nur jedes zehnte Glucose-Molekül an einer Verzweigungsstelle sitzt. ⓘ
Mengenmäßig besitzt die Muskulatur die größte Glykogenmenge. Aber ihr fehlt das Enzym Glucose-6-phosphatase, welches den Phosphatrest am C-Atom 6 der Glucose abspalten kann. Dieses kommt nur in Leberzellen, Nierenzellen und Enterozyten vor. Somit können Leber und Nieren ihren Glykogen-Speicher effektiv dazu benutzen, einen geringen Blutzuckerspiegel (z. B. nachts) abzupuffern. ⓘ
Hormonelle Regulation des Auf- und Abbaus von Glykogen


Sowohl von der Glykogenphosphorylase als auch von der Glykogensynthase gibt es zwei Formen: eine a- und eine b-Form. Die beiden Formen sind durch Phosphorylierung mittels einer Kinase bzw. Dephosphorylierung mittels einer Phosphatase ineinander umwandelbar. Da die a-Form jeweils wesentlich höhere Aktivität besitzt als die b-Form, kann auf diese Weise die Geschwindigkeit der jeweiligen Reaktion den Erfordernissen des Stoffwechsels angepasst werden. ⓘ
Im Fall der Glykogenphosphorylase ist die phosphorylierte die a-Form. Sie wird durch eine hormonell gesteuerte Phosphorylase-Kinase phosphoryliert und eine ebenfalls hormonell gesteuerte Protein-Phosphatase dephosphoryliert. Während die b-Form durch allosterische Kontrolle vor allem durch Adenosinmonophosphat (AMP) den lokalen Bedürfnissen in der Leberzelle angepasst wird, ist die a-Form immer aktiv und liefert in kurzer Zeit große Mengen an Glucose für periphere Gewebe. Die Überführung der inaktiven in die aktive Form durch Phosphorylierung ist hormongesteuert. Die Aktivierung der Glykogenphosphorylase durch die Kinase ist eine typische Stress-Reaktion. Die Protein-Phosphatase wird hingegen bei einem Überangebot an Glucose aktiviert, um eine zusätzliche Freisetzung zu verhindern. Der wichtigste Aktivierungsmechanismus der Glykogenphosphorylase erfolgt über eine Phosphorylierungskaskade, die vom second messenger zyklisches Adenosinmonophosphat (cAMP) in Gang gesetzt wird. Bindet ein Hormon, das eine Erhöhung des Blutzuckers bewirkt, wie z. B. Glucagon oder Adrenalin, an die entsprechenden Rezeptoren in der Membran der Hepatozyten, so erfolgt über die Aktivierung eines trimeren G-Proteins die Stimulierung des Enzyms Adenylylcyclase. Diese bildet das cAMP aus ATP. cAMP aktiviert allosterisch eine spezifische Proteinkinase, die Proteinkinase A, diese phosphoryliert die schon genannte Phosphorylase-Kinase, die dann in weiterer Folge die Glycogenphosphorylase phosphoryliert und damit von der b- in die a-Form umwandelt. ⓘ
Die Folge dieser Kaskadenaktivierung ist eine enorme Verstärkung des ursprünglichen Hormonsignals (des nanomolar vorliegenden first messengers) zu einer metabolischen Reaktion im Millimolbereich. Durch eine Phosphodiesterase wird cAMP wieder abgebaut, so dass das Signal zeitlich begrenzt bleibt. ⓘ
Die Vorgänge im Muskel sind analog, allerdings wirkt das typische Hungerhormon Glucagon dort nicht. Insulin hingegen aktiviert die Protein-Phosphatase (PP1) und die Phosphodiesterase (PDE) und wirkt dadurch antagonistisch zu den Stress- und Hungersignalen. Die Glykogensynthese wird gegensinnig reguliert, d. h., sie wird durch Phosphorylierung inaktiviert und durch Dephosphorylierung aktiviert, wobei jedenfalls zum Teil die gleichen Kinasen und Phosphatasen an dieser Regulation beteiligt sind. Die a-Form ist demnach die dephosphorylierte, die b-Form die phosphorylierte. Letztere ist nur in Gegenwart hoher Konzentrationen an Glucose-6-phosphat aktiv, wie etwa bei einem starken Überangebot an Nahrungsglucose in der Leber. Entsprechend ist auch die hormonelle Regulation zu verstehen, d. h., Insulin stimuliert, Adrenalin und Glucagon hemmen die Glykogen-Synthase. ⓘ