Ethylenglycol

| |||
|
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
1,2-Ethandiol
| |||
| Bevorzugte IUPAC-Bezeichnung
Ethan-1,2-diol | |||
Andere Bezeichnungen
| |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| 3DMet | |||
| Abkürzungen | MEG | ||
Beilstein-Referenz
|
505945 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin-Referenz
|
943 | ||
| KEGG | |||
| MeSH | Ethylen+Glykol | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 3082 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C2H6O2 | ||
| Molekulare Masse | 62,068 g-mol-1 | ||
| Erscheinungsbild | Klare, farblose Flüssigkeit | ||
| Geruch | Geruchlos | ||
| Dichte | 1,1132 g/cm3 (0,04022 lb/cu in) | ||
| Schmelzpunkt | -12,9 °C (8,8 °F; 260,2 K) | ||
| Siedepunkt | 197,3 °C (387,1 °F; 470,4 K) | ||
Löslichkeit in Wasser
|
mischbar | ||
| Löslichkeit | Löslich in den meisten organischen Lösungsmitteln | ||
| log P | -1.69 | ||
| Dampfdruck | 0,06 mmHg (20 °C) | ||
| Viskosität | 1,61×10-2 Pa-s | ||
| Gefahren | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Hauptgefahren
|
Gesundheitsschädlich, entzündlich | ||
| GHS-Kennzeichnung: | |||
Piktogramme
|
  
| ||
Signalwort
|
Warnhinweis | ||
Gefahrenhinweise
|
H302, H373 | ||
Sicherheitshinweise
|
P260, P264, P270, P301+P312, P302, P314, P330, P501 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 111 °C (232 °F; 384 K) geschlossener Tiegel | ||
Selbstentzündung
temperatur |
410 °C (770 °F; 683 K) | ||
| Explosionsgrenzen | 3.2–15.2% | ||
| NIOSH (US-Grenzwerte für Gesundheitsgefährdung): | |||
PEL (Zulässig)
|
Keine | ||
REL (Empfohlen)
|
Keine festgelegt | ||
IDLH (Unmittelbare Gefahr)
|
Keine | ||
| Sicherheitsdatenblatt (SDS) | Externes SDB | ||
| Verwandte Verbindungen | |||
Verwandte Diole
|
| ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Ethylenglykol (IUPAC-Name: Ethan-1,2-diol) ist eine organische Verbindung (ein vicinales Diol) mit der Formel (CH2OH)2. Es wird hauptsächlich für zwei Zwecke verwendet: als Rohstoff für die Herstellung von Polyesterfasern und für Frostschutzmittel. Es ist eine geruchlose, farblose, süßlich schmeckende, brennbare, viskose Flüssigkeit. Ethylenglykol ist in hohen Konzentrationen für den Menschen giftig. ⓘ
(Mono-)Ethylenglycol (MEG, Trivialname Glycol) ist der einfachste zweiwertige Alkohol mit der chemischen Bezeichnung Ethan-1,2-diol. Es ist das einfachste vicinale Diol. Der Trivialname leitet sich von süß-schmeckend (griechisch glykys ‚süß‘) ab. ⓘ
Die Bezeichnung Glycole wird darüber hinaus für zwei Klassen von Diolen, die sich vom Ethylenglycol ableiten, verwendet. Das sind zum einen 1,2-Diole wie 1,2-Propandiol und zum anderen α,ω-Diole, die durch Kondensation von Ethylenglycol entstehen: Polyethylenglycole. Beispiele sind Diethylenglycol (DEG), Triethylenglycol (TEG). ⓘ
Herstellung
Industrielle Wege
Ethylenglykol wird aus Ethylen (Ethen) über das Zwischenprodukt Ethylenoxid hergestellt. Ethylenoxid reagiert mit Wasser zu Ethylenglykol gemäß der folgenden chemischen Gleichung: C2H4O + H2O → HO-CH2CH2-OH ⓘ
Diese Reaktion kann entweder durch Säuren oder Basen katalysiert werden oder bei neutralem pH-Wert und erhöhten Temperaturen ablaufen. Die höchste Ausbeute an Ethylenglykol wird bei saurem oder neutralem pH-Wert mit einem großen Wasserüberschuss erzielt. Unter diesen Bedingungen können Ethylenglykolausbeuten von 90 % erreicht werden. Die wichtigsten Nebenprodukte sind die Oligomere Diethylenglykol, Triethylenglykol und Tetraethylenglykol. Die Abtrennung dieser Oligomere und des Wassers ist energieaufwändig. Jährlich werden etwa 6,7 Millionen Tonnen hergestellt. ⓘ
Eine höhere Selektivität wird durch den Einsatz des OMEGA-Verfahrens von Shell erreicht. Beim OMEGA-Verfahren wird das Ethylenoxid zunächst mit Kohlendioxid (CO2) zu Ethylencarbonat umgewandelt. Dieser Ring wird dann in einem zweiten Schritt mit einem Basenkatalysator hydrolysiert, um Monoethylenglykol mit einer Selektivität von 98 % herzustellen. Das Kohlendioxid wird in diesem Schritt wieder freigesetzt und kann dem Prozesskreislauf wieder zugeführt werden. Das Kohlendioxid stammt zum Teil aus der Ethylenoxid-Produktion, bei der ein Teil des Ethylens vollständig oxidiert wird. ⓘ
Ethylenglykol wird in Ländern mit großen Kohlevorkommen und weniger strengen Umweltvorschriften aus Kohlenmonoxid hergestellt. Die oxidative Carbonylierung von Methanol zu Dimethyloxalat ist ein vielversprechender Ansatz für die Herstellung von C
1-basiertem Ethylenglykol. Dimethyloxalat kann durch Hydrierung mit einem Kupferkatalysator in Ethylenglykol mit hoher Ausbeute (94,7 %) umgewandelt werden:
Da das Methanol rezykliert wird, werden nur Kohlenmonoxid, Wasserstoff und Sauerstoff verbraucht. Eine Anlage mit einer Produktionskapazität von 200 000 Tonnen Ethylenglykol pro Jahr befindet sich in der Inneren Mongolei, und eine zweite Anlage in der chinesischen Provinz Henan mit einer Kapazität von 250 000 Tonnen pro Jahr wurde für 2012 geplant. Im Jahr 2015 waren in China vier Anlagen mit einer Kapazität von jeweils 200 000 t/a in Betrieb, und mindestens 17 weitere werden folgen. ⓘ
Biologische Wege
Die Raupe der Großen Wachsmotte, Galleria mellonella, besitzt Darmbakterien, die in der Lage sind, Polyethylen (PE) zu Ethylenglykol abzubauen. ⓘ
Historische Wege
Den meisten Quellen zufolge stellte der französische Chemiker Charles-Adolphe Wurtz (1817-1884) 1856 erstmals Ethylenglykol her. Er behandelte zunächst "Ethyleniodid" (C2H4I2) mit Silberacetat und hydrolysierte dann das entstandene "Ethylendiacetat" mit Kaliumhydroxid. Wurtz nannte seine neue Verbindung "Glykol", weil sie Eigenschaften sowohl mit Ethylalkohol (mit einer Hydroxylgruppe) als auch mit Glycerin (mit drei Hydroxylgruppen) gemeinsam hatte. Im Jahr 1859 stellte Wurtz Ethylenglykol durch Hydratisierung von Ethylenoxid her. Vor dem Ersten Weltkrieg scheint es keine kommerzielle Herstellung oder Anwendung von Ethylenglykol gegeben zu haben, als es in Deutschland aus Ethylendichlorid synthetisiert und als Ersatz für Glycerin in der Sprengstoffindustrie verwendet wurde. ⓘ
In den Vereinigten Staaten begann 1917 die halbkommerzielle Herstellung von Ethylenglykol aus Ethylenchlorhydrin. Die erste kommerzielle Glykol-Großanlage wurde 1925 in South Charleston, West Virginia, von Carbide and Carbon Chemicals Co. (jetzt Union Carbide Corp.) errichtet. Bis 1929 wurde Ethylenglykol von fast allen Dynamitherstellern verwendet. 1937 nahm Carbide die erste Anlage in Betrieb, die auf dem Lefort'schen Verfahren zur Dampfphasenoxidation von Ethylen zu Ethylenoxid basierte. Carbide behielt das Monopol auf das direkte Oxidationsverfahren bis 1953, als das Scientific Design-Verfahren kommerzialisiert und zur Lizenzvergabe angeboten wurde. ⓘ
Verwendungen
Kühlmittel und Wärmeübertragungsmittel
Ethylenglykol wird hauptsächlich als Frostschutzmittel in Kühlmitteln verwendet, z. B. in Kraftfahrzeugen und in Klimaanlagen, bei denen die Kältemaschine oder die Klimageräte im Freien stehen oder unter die Gefriertemperatur von Wasser gekühlt werden müssen. In geothermischen Heiz-/Kühlsystemen ist Ethylenglykol die Flüssigkeit, die die Wärme durch den Einsatz einer geothermischen Wärmepumpe transportiert. Das Ethylenglykol gewinnt entweder Energie aus der Quelle (See, Meer, Brunnen) oder gibt Wärme an die Senke ab, je nachdem, ob das System zum Heizen oder Kühlen verwendet wird. ⓘ
Reines Ethylenglykol hat eine spezifische Wärmekapazität, die etwa halb so groß ist wie die von Wasser. Ethylenglykol bietet zwar einen Gefrierschutz und einen höheren Siedepunkt, senkt aber die spezifische Wärmekapazität von Wassergemischen im Vergleich zu reinem Wasser. Eine 1:1-Massenmischung hat eine spezifische Wärmekapazität von etwa 3140 J/(kg-°C) (0,75 BTU/(lb-°F)), drei Viertel derjenigen von reinem Wasser, so dass im Vergleich zu Wasser höhere Durchflussraten erforderlich sind. Die Bildung großer Blasen in den Kühlkanälen von Verbrennungsmotoren führt zu einer starken Beeinträchtigung des Wärmeflusses in diesem Bereich, so dass es nicht ratsam ist, eine Keimbildung (kleine Blasen) zuzulassen. Große Blasen in Kühlkanälen sind selbsterhaltend oder vergrößern sich, so dass die Kühlung in diesem Bereich praktisch vollständig verloren geht. Bei reinem MEG (Monoethylenglykol) erreicht der Hot Spot 200 °C (392 °F). Die Kühlung durch andere Effekte, wie z. B. Luftzug von Ventilatoren (bei der Analyse der reinen Keimbildung nicht berücksichtigt), trägt dazu bei, die Bildung großer Blasen zu verhindern. ⓘ
Die Mischung von Ethylenglykol mit Wasser bietet zusätzliche Vorteile für Kühl- und Frostschutzlösungen, wie die Verhinderung von Korrosion und Säureabbau sowie die Hemmung des Wachstums der meisten Mikroben und Pilze. Mischungen aus Ethylenglykol und Wasser werden in der Industrie manchmal informell als Glykolkonzentrate, -verbindungen, -mischungen oder -lösungen bezeichnet. ⓘ
Gefrierschutzmittel
Reines Ethylenglykol gefriert bei etwa -12 °C (10,4 °F), aber wenn es mit Wasser gemischt wird, gefriert die Mischung bei einer niedrigeren Temperatur. Beispielsweise gefriert eine Mischung aus 60 % Ethylenglykol und 40 % Wasser bei -45 °C (-49 °F). Diethylenglykol verhält sich ähnlich. Die Gefrierpunktserniedrigung einiger Gemische kann als kolligative Eigenschaft von Lösungen erklärt werden, aber bei hochkonzentrierten Gemischen wie dem Beispiel sind Abweichungen vom idealen Lösungsverhalten aufgrund des Einflusses zwischenmolekularer Kräfte zu erwarten. Es ist wichtig zu wissen, dass reines und destilliertes Wasser zwar eine größere spezifische Wärmekapazität hat als ein Gemisch aus Frostschutzmittel und Wasser, dass aber handelsübliche Frostschutzmittel in der Regel auch einen Korrosionsschutzzusatz enthalten, um zu verhindern, dass reines Wasser die Kühlmittelkanäle im Motorblock, den Zylinderköpfen, der Wasserpumpe und dem Kühler korrodiert. ⓘ
Je nachdem, ob es sich um Ethylenglykol oder Propylenglykol handelt, gibt es Unterschiede im Mischungsverhältnis. Bei Ethylenglykol sind die Mischungsverhältnisse typischerweise 30/70 und 35/65, während die Mischungsverhältnisse bei Propylenglykol typischerweise 35/65 und 40/60 betragen. Es ist wichtig, dass die Mischung bei der niedrigsten Betriebstemperatur frostsicher ist. ⓘ
Wegen der niedrigen Gefriertemperaturen wird Ethylenglykol als Enteisungsflüssigkeit für Windschutzscheiben und Flugzeuge, als Frostschutzmittel in Automotoren und als Bestandteil von Verglasungsmischungen (Antikristallisationsmittel) zur Konservierung von biologischem Gewebe und Organen bei niedrigen Temperaturen verwendet. ⓘ
Durch die Verwendung von Ethylenglykol wird nicht nur der Gefrierpunkt wässriger Mischungen gesenkt, sondern auch ihr Siedepunkt angehoben. Dies führt dazu, dass der Betriebstemperaturbereich für Wärmeträgerflüssigkeiten an beiden Enden der Temperaturskala erweitert wird. Der Anstieg der Siedetemperatur ist darauf zurückzuführen, dass reines Ethylenglykol einen viel höheren Siedepunkt und einen niedrigeren Dampfdruck als reines Wasser hat, wie es für die meisten binären Gemische flüchtiger Flüssigkeiten typisch ist. ⓘ
Vorprodukt für Polymere
In der Kunststoffindustrie ist Ethylenglykol ein wichtiges Vorprodukt für Polyesterfasern und -harze. Polyethylenterephthalat, das zur Herstellung von Plastikflaschen für Softdrinks verwendet wird, wird aus Ethylenglykol hergestellt. ⓘ

Andere Verwendungen
Dehydratisierungsmittel
Ethylenglykol wird in der Erdgasindustrie verwendet, um dem Erdgas vor der Weiterverarbeitung Wasserdampf zu entziehen, ähnlich wie Triethylenglykol (TEG). ⓘ
Hydrathemmung
Aufgrund seines hohen Siedepunkts und seiner Affinität für Wasser ist Ethylenglykol ein nützliches Trockenmittel. Ethylenglykol wird häufig eingesetzt, um die Bildung von Erdgas-Clathraten (Hydraten) in langen Mehrphasen-Pipelines zu verhindern, die Erdgas von entlegenen Gasfeldern zu einer Gasverarbeitungsanlage befördern. Ethylenglykol kann aus dem Erdgas zurückgewonnen und nach einer Reinigungsbehandlung, bei der Wasser und anorganische Salze entfernt werden, als Inhibitor wiederverwendet werden. ⓘ
Erdgas wird durch Ethylenglykol dehydriert. Bei dieser Anwendung fließt Ethylenglykol vom oberen Ende eines Turms nach unten und trifft auf ein aufsteigendes Gemisch aus Wasserdampf und Kohlenwasserstoffgasen. Das trockene Gas tritt am oberen Ende des Turms aus. Das Glykol und das Wasser werden getrennt, und das Glykol wird recycelt. Anstatt Wasser zu entfernen, kann auch Ethylenglykol verwendet werden, um die Temperatur, bei der sich Hydrate bilden, zu senken. Der Reinheitsgrad des zur Hydratunterdrückung verwendeten Glykols (Monoethylenglykol) beträgt in der Regel etwa 80 %, während der Reinheitsgrad des zur Dehydratisierung verwendeten Glykols (Triethylenglykol) in der Regel 95 bis über 99 % beträgt. Außerdem ist die Einspritzrate für die Hydratunterdrückung viel geringer als die Umwälzrate in einem Glykol-Trocknungsturm. ⓘ
Anwendungen
Zu den kleineren Verwendungszwecken von Ethylenglykol gehören die Herstellung von Kondensatoren, als chemisches Zwischenprodukt bei der Herstellung von 1,4-Dioxan, als Zusatzstoff zum Schutz vor Korrosion in Flüssigkeitskühlsystemen für Personalcomputer und in den Linsenvorrichtungen von Rückprojektionsfernsehern mit Kathodenstrahlröhren. Ethylenglykol wird auch bei der Herstellung einiger Impfstoffe verwendet, ist aber selbst nicht in diesen Injektionen enthalten. Es wird in geringem Umfang (1-2 %) in Schuhcreme und in einigen Tinten und Farbstoffen verwendet. Ethylenglykol wurde in gewissem Umfang zur Behandlung von Fäulnis und Pilzbefall bei Holz verwendet, sowohl zur Vorbeugung als auch zur Nachbehandlung. In einigen wenigen Fällen wurde es zur Behandlung teilweise verrotteter Holzgegenstände verwendet, die in Museen ausgestellt werden sollen. Es ist eines der wenigen Mittel, die bei der Behandlung von Fäulnis in Holzbooten erfolgreich sind, und es ist relativ billig. Ethylenglykol kann neben dem Hauptbestandteil Isopropylalkohol auch einer der Nebenbestandteile von Bildschirmreinigungslösungen sein. Ethylenglykol wird häufig als Konservierungsmittel für biologische Präparate verwendet, insbesondere in Sekundarschulen beim Sezieren als sicherere Alternative zu Formaldehyd. Es wird auch als Teil der Hydraulikflüssigkeit auf Wasserbasis verwendet, die zur Steuerung von Unterwasser-Öl- und Gasförderanlagen eingesetzt wird. ⓘ
Ethylenglykol wird als Schutzgruppe in der organischen Synthese verwendet, um Carbonylverbindungen wie Ketone und Aldehyde zu schützen. ⓘ
Siliciumdioxid reagiert in erhitztem Rückfluss unter Distickstoff mit Ethylenglykol und einer Alkalimetallbase zu hochreaktiven, pentakoordinierten Silikaten, die den Zugang zu einer Vielzahl neuer Siliciumverbindungen ermöglichen. Die Silikate sind im Wesentlichen in allen polaren Lösungsmitteln außer Methanol unlöslich. ⓘ
Es kann auch bei der Herstellung von Impfstoffen oder als Formaldehyd-Ersatz bei der Konservierung biologischer Präparate verwendet werden. ⓘ
Chemische Reaktionen
Ethylenglykol wird in der organischen Synthese als Schutzgruppe für Carbonylgruppen verwendet. Die Behandlung eines Ketons oder Aldehyds mit Ethylenglykol in Gegenwart eines sauren Katalysators (z. B. p-Toluolsulfonsäure; BF3-Et2O) ergibt das entsprechende 1,3-Dioxolan, das gegen Basen und andere Nukleophile resistent ist. Die 1,3-Dioxolan-Schutzgruppe kann anschließend durch weitere Säurehydrolyse entfernt werden. In diesem Beispiel wurde Isophoron unter Verwendung von Ethylenglykol mit p-Toluolsulfonsäure in mäßiger Ausbeute geschützt. Das Wasser wurde durch azeotrope Destillation entfernt, um das Gleichgewicht nach rechts zu verschieben. ⓘ
Toxizität
Ethylenglykol hat eine relativ hohe Toxizität für Säugetiere, wenn es verschluckt wird, die ungefähr der von Methanol entspricht, mit einer oralen LDLo = 786 mg/kg für Menschen. Die größte Gefahr geht von seinem süßen Geschmack aus, der Kinder und Tiere anlocken kann. Nach dem Verschlucken wird Ethylenglykol zu Glykolsäure oxidiert, die wiederum zu Oxalsäure oxidiert wird, die giftig ist. Sie und ihre giftigen Nebenprodukte wirken sich zunächst auf das zentrale Nervensystem, dann auf das Herz und schließlich auf die Nieren aus. Der Verzehr ausreichender Mengen ist unbehandelt tödlich. Allein in den USA werden jährlich mehrere Todesfälle verzeichnet. ⓘ
Es sind Frostschutzmittel für Kraftfahrzeuge erhältlich, die Propylenglykol anstelle von Ethylenglykol enthalten. Sie gelten im Allgemeinen als sicherer, da Propylenglykol weniger schmackhaft ist und im Körper in Milchsäure umgewandelt wird, ein normales Produkt des Stoffwechsels und der Bewegung. ⓘ
Australien, das Vereinigte Königreich und siebzehn US-Bundesstaaten (Stand 2012) verlangen den Zusatz eines bitteren Aromas (Denatoniumbenzoat) zu Frostschutzmitteln. Im Dezember 2012 erklärten sich die US-amerikanischen Frostschutzmittelhersteller freiwillig bereit, allen Frostschutzmitteln, die auf dem US-amerikanischen Verbrauchermarkt verkauft werden, einen Bitterstoff zuzusetzen. ⓘ
Auswirkungen auf die Umwelt
Ethylenglykol ist eine in großen Mengen hergestellte Chemikalie, die sich in der Luft in etwa 10 Tagen und im Wasser oder Boden in einigen Wochen abbaut. Es gelangt durch die Verbreitung von ethylenglykolhaltigen Produkten in die Umwelt, insbesondere auf Flughäfen, wo es in Enteisungsmitteln für Landebahnen und Flugzeuge verwendet wird. Während Ethylenglykol in niedrigen Dosen über einen längeren Zeitraum hinweg keine Toxizität aufweist, wirkt es in nahezu tödlichen Dosen (≥ 1000 mg/kg pro Tag) als Teratogen. "Auf der Grundlage einer recht umfangreichen Datenbank führt es bei Ratten und Mäusen über alle Expositionswege zu Skelettveränderungen und Missbildungen." Dieses Molekül wurde im Weltraum beobachtet. ⓘ
Gewinnung und Darstellung
Technische Herstellung
Die großtechnische Herstellung von Ethylenglycol erfolgt meistens durch die katalysatorfreie Hydratisierung von Ethylenoxid bei Temperaturen von 150–200 °C und Drücken von 20–40 bar. ⓘ
Die Umsetzung wird in adiabatisch betriebenen Rohrreaktoren durchgeführt. Man arbeitet mit einem 10–20 fachem molaren Überschuss an Wasser, um die Bildung von höheren Glycolen zu unterdrücken (vor allem Diethylenglycol und Triethylenglycol). Die Aufarbeitung und Trennung der Komponenten aus dem Produktgemisch erfolgt für gewöhnlich durch mehrstufige Destillation in Rektifikationskolonnen. ⓘ
Des Weiteren kann die Hydratisierung auch mit sauren oder basischen Katalysatoren bei niedrigen Temperaturen (50–70 °C) und drucklos durchgeführt werden. ⓘ
OMEGA-Prozess der Royal Dutch Shell
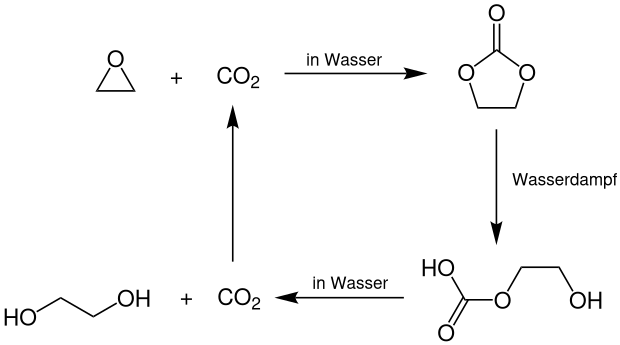
Eine Weiterentwicklung dieses Verfahrens ist der OMEGA-Prozess der Royal Dutch Shell. Hierbei wird das Ethylenoxid zunächst mit Kohlenstoffdioxid in Wasser zum Ethylencarbonat umgesetzt. Dieses hydrolysiert dann mit Wasserdampf zum 2-Hydroxyethylhydrogencarbonat, welches anschließend durch Decarboxylierung in Wasser zu Ethylenglycol und Kohlenstoffdioxid zerfällt. Letzteres wird nach Aufbereitung wieder zur ersten Reaktionsstufe zurückgeführt. ⓘ
Die Ausbeute an Ethylenglycol beträgt in diesem Prozess ca. 99 %. Als Katalysatoren dienen hierbei Gemische von Kaliumiodid (KI) und Kaliummolybdat (K2MoO4). ⓘ
Die Produktionskapazitäten für Ethylenglycol betrugen im Jahre 2010 weltweit etwa 25 Millionen Jahrestonnen. ⓘ
Eigenschaften
Physikalische Eigenschaften
Ethylenglycol ist bei Raumtemperatur eine farblose, viskose Flüssigkeit. Der Schmelzpunkt liegt bei −16 °C. Unter Normaldruck siedet die Verbindung bei 197 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in Torr, T in °C) mit A = 9,6, B = 3225 und C = 283 im Temperaturbereich von 53 °C bis 198 °C. ⓘ
Ethylenglycol besitzt bei 20 °C eine Viskosität von 20,81 mPas. Bei 30 °C sinkt die Viskosität auf 13,87 mPas. ⓘ
Bei Verwendung als Kühlflüssigkeit schwankt die Wärmekapazität je nach Wasserzusatz von 2,4 bis 4,2 kJ/(kg·K) für reines Wasser. Ein 50/50-Gemisch friert bei −40 °C, siedet bei 108 °C und erreicht eine Wärmekapazität von 3,5 kJ/(kg·K). Es bildet, abweichend von anderen Glycolethern, mit Wasser kein Azeotrop. ⓘ
Chemische Eigenschaften
Ethylenglycol zersetzt sich bei Luftzutritt am Siedepunkt und setzt dabei unter anderem Glycolaldehyd, Glyoxal, Acetaldehyd, Methan, Formaldehyd, Kohlenstoffmonoxid und Wasserstoff frei. ⓘ
Ethylenglycol wirkt schwach korrosiv auf Eisenrohre. ⓘ
Sicherheitstechnische Kenngrößen
Ethylenglycol bildet oberhalb des Flammpunktes bei 111 °C entzündbare Dampf-Luft-Gemische. Die untere Explosionsgrenze liegt bei 3,2 Vol.‑% (80 g/m³), die obere Explosionsgrenze (OEG) im Bereich von 43 bis 51 Vol.‑% (1090 – 1326 g/m³). Der unteren Explosionspunkt beträgt 109 °C. Mit einer Zündtemperatur von 410 °C resultiert eine Temperaturklasse T2. Mit einer elektrische Leitfähigkeit von 1,16·10−4 S·m−1 bzw. einem spezifischen Widerstand von 8,62·103 Ω·m ist Ethylenglycol entsprechend der TRGS 727 als noch leitfähig anzusehen. ⓘ
Verwendung
Es wurde 1928 von der I.G. Farben in Ludwigshafen als frostsichere Kühlflüssigkeit für Verbrennungsmotoren entwickelt und unter dem Markennamen Glysantin vertrieben. ⓘ
(Mono)Ethylenglycol dient heute hauptsächlich zur Herstellung von Polyesterfasern und Polyethylenterephthalat, einem Polyester aus stöchiometrischen Mengen Terephthalsäure und Ethylenglycol mit 100 % Veresterungsgrad. 45 % der weltweit produzierten Menge werden in China verarbeitet. ⓘ
Wegen seiner hygroskopischen Eigenschaften findet es als Absorptionsmittel für die Entfernung von Wasserdampf aus Erd- und Raffineriegas oder Kreislaufgasen der Hydroraffination Anwendung. Auf allen Verkehrsflughäfen werden Glycol-Wasser-Gemische als Enteisungsmittel für Flugzeuge und Verkehrsflächen genutzt. ⓘ
In der Forschung wird Ethylenglycol als Lösungsmittel und Reduktionsmittel für die Flüssigphasensynthese von eindimensionalen Metallnanostrukturen verwendet. ⓘ
Sicherheitshinweise
- Die Hautdurchgängigkeit von Ethylenglycol ähnelt der von Ethanol und Glycerin. Ethylenglycol wird sehr schwer durch die intakte Haut aufgenommen. Rötung oder Entzündung kann auftreten, bei Kontakt von Augen oder Schleimhäuten können Reizeffekte empfunden werden.
- Wegen des geringen Dampfdrucks kann es praktisch nur als Aerosol oder Dampf von heißen ethylenglycolhaltigen Produkten eingeatmet werden.
- Bei oraler Aufnahme von 30 ml oder mehr handelt es sich um eine schwere, bei mehr als 100 ml um eine lebensbedrohliche Intoxikation. Das BfR gibt für Menschen eine toxische Dosis von 0,1 ml/kg Körpergewicht an. ⓘ
Orale Toxizität
Die Symptome ähneln denen einer Methanolvergiftung ("gepanschter Alkohol"). Die Abbauprodukte sind jedoch vollkommen unterschiedlich. Wegen des süßen Geschmacks von wasserverdünnten Frostschutzmitteln sind Vergiftungen durch Ethylenglycol nicht ungewöhnlich. Für Erwachsene wird als Antidot die sofortige Aufnahme von Trinkethanol empfohlen (150 ml Whisky oder Weinbrand), klinisch wird 4-Methylpyrazol (Fomepizol) oder Ethanol i.v. gegeben. ⓘ
Zelltoxisch wirkt nicht das Ethylenglycol selbst, sondern dessen Metaboliten mit Aldehydfunktionen, Glycolaldehyd, Glyoxal und Glyoxylsäure. Diese reagieren mit allen Thiol- und Aminofunktionen von Enzymen und Proteinen. Das Enzym Alkoholdehydrogenase (ADH) katalysiert diese Oxidationsschritte (Alkohol → Aldehyd). Die empfohlenen Antidote wirken als kompetitive Hemmer der Alkoholdehydrogenase. Das Enzym Aldehydoxidase (AO) steuert den langsamen Oxidationsschritt (Aldehyd → Carbonsäure). ⓘ
Unbehandelt verläuft die Vergiftung in drei Stadien über erste Symptome (Schwindel, Trunkenheit, Bewusstseinsstörungen), Schäden an Herz und Leber (nach 12–24 Stunden) bis zum urämischen Koma mit akutem Nierenversagen. Typische Abbau- und Folgeprodukte wie Glycolsäure, Hippursäure und Oxalsäure werden nachgewiesen. ⓘ
Handelsnamen
- GENTANIN (Clariant)
- GLYSANTIN (BASF) ⓘ