UV/VIS-Spektroskopie

UV-Spektroskopie oder UV-visuelle Spektrophotometrie (UV-Vis oder UV/Vis) bezeichnet die Absorptionsspektroskopie oder Reflexionsspektroskopie in einem Teil des ultravioletten und dem gesamten angrenzenden sichtbaren Bereich des elektromagnetischen Spektrums. Da diese Methode relativ kostengünstig und einfach zu implementieren ist, wird sie in vielen angewandten und grundlegenden Anwendungen eingesetzt. Die einzige Voraussetzung ist, dass die Probe im UV-Vis-Bereich absorbiert, d. h. ein Chromophor ist. Die Absorptionsspektroskopie ist komplementär zur Fluoreszenzspektroskopie. Die Parameter, die neben der Wellenlänge von Interesse sind, sind die Absorption (A), die Transmission (%T) oder die Reflexion (%R) und ihre zeitliche Veränderung. ⓘ
Die UV/VIS-Spektroskopie ist ein spektroskopisches Verfahren der optischen Molekülspektroskopie, das elektromagnetische Wellen des ultravioletten (UV) und des sichtbaren (englisch visible, VIS) Lichts nutzt. Die Methode ist auch unter UV/VIS-Spektralphotometrie oder als Elektronenabsorptionsspektroskopie bekannt. Im Alltag werden die verwendeten Geräte häufig ungenau als Photometer bezeichnet. ⓘ
Optische Übergänge
Die meisten Moleküle und Ionen absorbieren Energie im ultravioletten oder sichtbaren Bereich, d. h. sie sind Chromophore. Das absorbierte Photon regt ein Elektron im Chromophor zu Molekülorbitalen höherer Energie an, wodurch ein angeregter Zustand entsteht. Bei organischen Chromophoren werden vier mögliche Arten von Übergängen angenommen: π-π*, n-π*, σ-σ* und n-σ*. Übergangsmetallkomplexe sind oft farbig (d. h. sie absorbieren sichtbares Licht), da sie mehrere elektronische Zustände aufweisen, die mit unvollständig gefüllten d-Orbitalen verbunden sind. ⓘ
Anwendungen
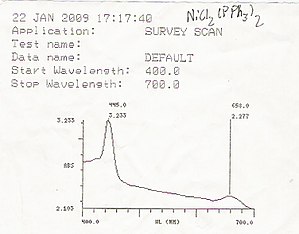
Die UV/Vis-Spektroskopie wird in der analytischen Chemie routinemäßig zur quantitativen Bestimmung verschiedener Analyten oder Proben eingesetzt, z. B. von Übergangsmetallionen, stark konjugierten organischen Verbindungen und biologischen Makromolekülen. Die spektroskopische Analyse wird in der Regel in Lösungen durchgeführt, aber auch Feststoffe und Gase können untersucht werden.
- Organische Verbindungen, insbesondere solche mit einem hohen Grad an Konjugation, absorbieren auch Licht im UV- oder sichtbaren Bereich des elektromagnetischen Spektrums. Die Lösungsmittel für diese Bestimmungen sind häufig Wasser für wasserlösliche Verbindungen oder Ethanol für organisch lösliche Verbindungen. (Organische Lösungsmittel können eine erhebliche UV-Absorption aufweisen; nicht alle Lösungsmittel sind für die UV-Spektroskopie geeignet. Ethanol absorbiert bei den meisten Wellenlängen nur sehr schwach.) Die Polarität des Lösungsmittels und der pH-Wert können das Absorptionsspektrum einer organischen Verbindung beeinflussen. Bei Tyrosin beispielsweise nehmen die Absorptionsmaxima und der molare Extinktionskoeffizient zu, wenn der pH-Wert von 6 auf 13 ansteigt oder wenn die Polarität des Lösungsmittels abnimmt.
- Auch bei Ladungstransferkomplexen entstehen Farben, die jedoch oft zu intensiv sind, um sie für quantitative Messungen zu verwenden. ⓘ
Das Beer-Lambert-Gesetz besagt, dass die Absorption einer Lösung direkt proportional zur Konzentration der absorbierenden Spezies in der Lösung und zur Weglänge ist. Bei einer festen Weglänge kann die UV/Vis-Spektroskopie also zur Bestimmung der Konzentration des Absorbers in einer Lösung verwendet werden. Dazu muss man wissen, wie schnell sich die Extinktion mit der Konzentration ändert. Dies kann aus Referenzen (Tabellen mit molaren Extinktionskoeffizienten) entnommen oder genauer aus einer Eichkurve bestimmt werden. ⓘ
Ein UV/Vis-Spektrophotometer kann als Detektor für die HPLC verwendet werden. Das Vorhandensein eines Analyten führt zu einer Reaktion, von der angenommen wird, dass sie proportional zur Konzentration ist. Um genaue Ergebnisse zu erzielen, sollte die Reaktion des Geräts auf den Analyten in der unbekannten Probe mit der Reaktion auf einen Standard verglichen werden; dies ist der Verwendung von Kalibrierkurven sehr ähnlich. Die Reaktion (z. B. die Peakhöhe) für eine bestimmte Konzentration wird als Reaktionsfaktor bezeichnet. ⓘ
Die Wellenlängen der Absorptionspeaks können mit den Bindungstypen in einem bestimmten Molekül korreliert werden und sind für die Bestimmung der funktionellen Gruppen innerhalb eines Moleküls von großem Nutzen. Die Woodward-Fieser-Regeln zum Beispiel sind eine Reihe empirischer Beobachtungen, die zur Vorhersage von λmax, der Wellenlänge der intensivsten UV/Vis-Absorption, für konjugierte organische Verbindungen wie Diene und Ketone verwendet werden. Das Spektrum allein ist jedoch kein spezifischer Test für eine bestimmte Probe. Die Art des Lösungsmittels, der pH-Wert der Lösung, die Temperatur, hohe Elektrolytkonzentrationen und das Vorhandensein störender Substanzen können das Absorptionsspektrum beeinflussen. Auch experimentelle Variationen wie die Spaltbreite (effektive Bandbreite) des Spektrophotometers verändern das Spektrum. Bei der Anwendung der UV/Vis-Spektroskopie zur Analyse müssen diese Variablen kontrolliert oder berücksichtigt werden, um die vorhandenen Substanzen zu identifizieren. ⓘ
Die Methode wird am häufigsten quantitativ zur Bestimmung der Konzentration einer absorbierenden Spezies in Lösung unter Verwendung des Beer-Lambert-Gesetzes eingesetzt:
- , ⓘ
wobei A die gemessene Absorption ist (formal dimensionslos, aber im Allgemeinen in Absorptionseinheiten (AU) angegeben), die Intensität des einfallenden Lichts bei einer bestimmten Wellenlänge ist, die transmittierte Intensität, L die Weglänge durch die Probe und c die Konzentration der absorbierenden Spezies ist. Für jede Art und Wellenlänge ist ε eine Konstante, die als molares Absorptionsvermögen oder Extinktionskoeffizient bezeichnet wird. Diese Konstante ist eine grundlegende molekulare Eigenschaft in einem bestimmten Lösungsmittel, bei einer bestimmten Temperatur und einem bestimmten Druck, und hat die Einheiten . ⓘ
Absorption und Extinktion ε werden manchmal als natürlicher Logarithmus anstelle des Logarithmus zur Basis 10 definiert. ⓘ
Das Beer-Lambert-Gesetz ist für die Charakterisierung vieler Verbindungen nützlich, gilt jedoch nicht als universelle Beziehung für die Konzentration und Absorption aller Substanzen. Eine polynomiale Beziehung 2. Ordnung zwischen Absorption und Konzentration ist manchmal bei sehr großen, komplexen Molekülen wie organischen Farbstoffen (z. B. Xylenol Orange oder Neutralrot) zu finden. ⓘ
Die UV-Vis-Spektroskopie wird auch in der Halbleiterindustrie eingesetzt, um die Dicke und die optischen Eigenschaften von dünnen Schichten auf einem Wafer zu messen. Mit UV-Vis-Spektrometern wird das Reflexionsvermögen von Licht gemessen, das mit Hilfe der Forouhi-Bloomer-Dispersionsgleichungen analysiert werden kann, um den Brechungsindex () und den Extinktionskoeffizienten () eines bestimmten Films über den gemessenen Spektralbereich zu bestimmen. ⓘ
Praktische Überlegungen
Das Beer-Lambert-Gesetz enthält implizite Annahmen, die experimentell erfüllt sein müssen, damit es anwendbar ist; andernfalls besteht die Möglichkeit von Abweichungen von diesem Gesetz. So können beispielsweise die chemische Zusammensetzung und die physikalische Umgebung der Probe ihren Extinktionskoeffizienten verändern. Die chemischen und physikalischen Bedingungen einer Testprobe müssen daher mit den Referenzmessungen übereinstimmen, damit die Schlussfolgerungen gültig sind. Weltweit verlangen Pharmakopöen wie die amerikanische (USP) und die europäische (Ph. Eur.) Pharmakopöe, dass Spektralphotometer strenge gesetzliche Anforderungen erfüllen, die auch Faktoren wie Streulicht und Wellenlängengenauigkeit umfassen. ⓘ
Spektrale Bandbreite
Es ist wichtig, eine monochromatische Strahlungsquelle für das auf die Probenzelle einfallende Licht zu haben. Die Monochromatizität wird gemessen als die Breite des "Dreiecks", das durch die Intensitätsspitze bei der Hälfte der Spitzenintensität gebildet wird. Ein bestimmtes Spektrometer hat eine spektrale Bandbreite, die angibt, wie monochromatisch das einfallende Licht ist. Wenn diese Bandbreite mit der Breite der Absorptionslinie vergleichbar (oder größer) ist, wird der gemessene Extinktionskoeffizient falsch sein. Bei Referenzmessungen wird die Gerätebandbreite (Bandbreite des einfallenden Lichts) unterhalb der Breite der Spektrallinien gehalten. Bei der Messung eines Testmaterials sollte die Bandbreite des einfallenden Lichts ebenfalls ausreichend schmal sein. Eine Verringerung der spektralen Bandbreite reduziert die zum Detektor gelangende Energie und erfordert daher eine längere Messzeit, um das gleiche Signal-Rausch-Verhältnis zu erreichen. ⓘ
Wellenlängenfehler
In Flüssigkeiten ändert sich der Extinktionskoeffizient in der Regel langsam mit der Wellenlänge. Ein Peak der Absorptionskurve (eine Wellenlänge, bei der die Absorption ein Maximum erreicht) ist der Punkt, an dem die Änderung der Absorption mit der Wellenlänge am geringsten ist. Messungen werden in der Regel an einem Peak vorgenommen, um Fehler zu minimieren, die durch Wellenlängenfehler im Messgerät entstehen, d. h. Fehler aufgrund eines anderen Extinktionskoeffizienten als angenommen. ⓘ
Streulicht
Ein weiterer wichtiger Faktor ist die Reinheit des verwendeten Lichts. Der wichtigste Faktor, der sich darauf auswirkt, ist der Streulichtpegel des Monochromators. ⓘ
Der verwendete Detektor ist breitbandig; er reagiert auf das gesamte Licht, das ihn erreicht. Wenn ein erheblicher Teil des durch die Probe gelangenden Lichts Wellenlängen enthält, die einen viel niedrigeren Extinktionskoeffizienten als den Nennwert haben, wird das Gerät eine falsch niedrige Extinktion anzeigen. Bei jedem Gerät wird ein Punkt erreicht, an dem eine Erhöhung der Probenkonzentration nicht zu einer Erhöhung der gemeldeten Absorption führt, da der Detektor lediglich auf das Streulicht reagiert. In der Praxis muss die Konzentration der Probe oder die optische Weglänge angepasst werden, um die unbekannte Absorption in einen für das Gerät gültigen Bereich zu bringen. Manchmal wird eine empirische Kalibrierungsfunktion entwickelt, bei der bekannte Konzentrationen der Probe verwendet werden, um Messungen in dem Bereich zu ermöglichen, in dem das Gerät nichtlinear wird. ⓘ
Als grober Anhaltspunkt gilt, dass ein Gerät mit einem einzelnen Monochromator in der Regel einen Streulichtpegel hat, der etwa 3 Absorptionseinheiten (AE) entspricht, was Messungen oberhalb von etwa 2 AE problematisch machen würde. Ein komplexeres Instrument mit einem Doppelmonochromator hätte einen Streulichtpegel, der etwa 6 AE entspricht, und würde daher die Messung eines viel größeren Absorptionsbereichs ermöglichen. ⓘ
Abweichungen vom Beer-Lambert-Gesetz
Bei ausreichend hohen Konzentrationen kommt es zu einer Sättigung der Absorptionsbanden und einer Abflachung der Absorption. Die Absorptionsspitze scheint abzuflachen, weil nahezu 100 % des Lichts bereits absorbiert werden. Die Konzentration, bei der dies auftritt, hängt von der jeweiligen Verbindung ab, die gemessen wird. Ein Test, mit dem dieser Effekt überprüft werden kann, besteht darin, die Weglänge der Messung zu variieren. Im Beer-Lambert-Gesetz haben die Variation der Konzentration und der Schichtdicke den gleichen Effekt: Die Verdünnung einer Lösung um den Faktor 10 hat den gleichen Effekt wie die Verkürzung der Schichtdicke um den Faktor 10. Wenn Küvetten mit unterschiedlichen Schichtdicken zur Verfügung stehen, ist die Überprüfung dieser Beziehung eine Möglichkeit zu beurteilen, ob eine Abflachung der Absorption stattfindet. ⓘ
Lösungen, die nicht homogen sind, können aufgrund des Phänomens der Absorptionsabflachung Abweichungen vom Beer-Lambert-Gesetz aufweisen. Dies kann z. B. der Fall sein, wenn sich die absorbierende Substanz in Schwebeteilchen befindet. Die Abweichungen sind am deutlichsten bei niedriger Konzentration und hoher Absorption. Der letzte Hinweis beschreibt eine Möglichkeit, diese Abweichung zu korrigieren. ⓘ
Einige Lösungen, wie z. B. Kupfer(II)-chlorid in Wasser, verändern sich bei einer bestimmten Konzentration optisch, weil sich die Bedingungen in der Umgebung des farbigen Ions (des zweiwertigen Kupferions) ändern. Für Kupfer(II)chlorid bedeutet dies eine Verschiebung von blau nach grün, was bedeutet, dass monochromatische Messungen vom Beer-Lambert-Gesetz abweichen würden. ⓘ
Quellen der Messunsicherheit
Die oben genannten Faktoren tragen zur Messunsicherheit der mit der UV/Vis-Spektrophotometrie erzielten Ergebnisse bei. Wenn die UV/Vis-Spektralphotometrie in der quantitativen chemischen Analyse eingesetzt wird, werden die Ergebnisse zusätzlich durch Unsicherheitsquellen beeinflusst, die sich aus der Art der gemessenen Verbindungen und/oder Lösungen ergeben. Dazu gehören spektrale Interferenzen durch Überlappung der Absorptionsbanden, Verblassen der Farbe der absorbierenden Spezies (durch Zersetzung oder Reaktion) und eine mögliche Nichtübereinstimmung der Zusammensetzung zwischen der Probe und der Kalibrierlösung. ⓘ
Ultraviolett-sichtbares Spektralphotometer
Das in der Ultraviolett-Spektroskopie verwendete Gerät wird als UV/Vis-Spektrophotometer bezeichnet. Es misst die Intensität des Lichts nach dem Durchgang durch eine Probe () und vergleicht sie mit der Intensität des Lichts vor dem Durchgang durch die Probe (). Das Verhältnis wird als Transmissionsgrad bezeichnet und normalerweise als Prozentsatz (%T) angegeben. Die Extinktion, basiert auf dem Transmissionsgrad:
Das UV-Spektralphotometer kann auch so konfiguriert werden, dass es den Reflexionsgrad misst. In diesem Fall misst das Spektralphotometer die Intensität des von einer Probe reflektierten Lichts () reflektiert wird, und vergleicht sie mit der Intensität des Lichts, das von einem Referenzmaterial () (z. B. eine weiße Fliese) reflektiert wird. Das Verhältnis wird als Reflexionsgrad bezeichnet und in der Regel als Prozentsatz (%R) angegeben. ⓘ
Ein Spektrophotometer besteht im Wesentlichen aus einer Lichtquelle, einem Halter für die Probe, einem Beugungsgitter in einem Monochromator oder einem Prisma zur Trennung der verschiedenen Wellenlängen des Lichts und einem Detektor. Bei der Strahlungsquelle handelt es sich häufig um einen Wolfram-Glühfaden (300-2500 nm), eine Deuterium-Bogenlampe, die im ultravioletten Bereich (190-400 nm) kontinuierlich leuchtet, eine Xenon-Bogenlampe, die von 160 bis 2.000 nm kontinuierlich leuchtet, oder neuerdings auch Leuchtdioden (LED) für die sichtbaren Wellenlängen. Der Detektor ist in der Regel eine Photomultiplier-Röhre, eine Photodiode, ein Photodioden-Array oder ein ladungsgekoppeltes Gerät (CCD). Einzelne Fotodiodendendetektoren und Fotovervielfacherröhren werden mit Abtastmonochromatoren verwendet, die das Licht so filtern, dass jeweils nur Licht einer einzigen Wellenlänge den Detektor erreicht. Der Abtastmonochromator bewegt das Beugungsgitter, um jede Wellenlänge zu "durchlaufen", so dass die Intensität als Funktion der Wellenlänge gemessen werden kann. Feste Monochromatoren werden mit CCDs und Photodiodenarrays verwendet. Da diese beiden Geräte aus vielen Detektoren bestehen, die in ein- oder zweidimensionalen Arrays gruppiert sind, können sie Licht verschiedener Wellenlängen auf verschiedenen Pixeln oder Pixelgruppen gleichzeitig sammeln. ⓘ
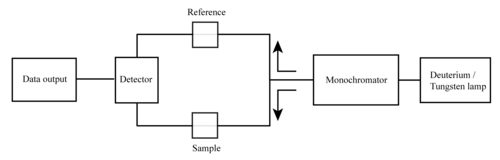
Ein Spektralphotometer kann entweder einstrahlig oder zweistrahlig sein. Bei einem Einstrahlgerät (wie dem Spectronic 20) geht das gesamte Licht durch die Probenzelle. muss gemessen werden, indem die Probe entfernt wird. Dies war die früheste Konstruktion und wird immer noch häufig in Lehr- und Industrielabors verwendet. ⓘ
Bei einem Zweistrahlgerät wird das Licht in zwei Strahlen aufgeteilt, bevor es die Probe erreicht. Ein Strahl wird als Referenz verwendet; der andere Strahl geht durch die Probe. Die Intensität des Referenzstrahls wird als 100% Transmission (oder 0 Absorption) angenommen, und die angezeigte Messung ist das Verhältnis der beiden Strahlintensitäten. Einige Zweistrahlgeräte verfügen über zwei Detektoren (Fotodioden), und der Proben- und der Referenzstrahl werden gleichzeitig gemessen. Bei anderen Geräten durchlaufen die beiden Strahlen einen Strahlzerhacker, der jeweils einen Strahl blockiert. Der Detektor misst abwechselnd den Probenstrahl und den Referenzstrahl, und zwar synchron mit dem Chopper. Es kann auch ein oder mehrere Dunkelintervalle im Chopper-Zyklus geben. In diesem Fall können die gemessenen Strahlintensitäten korrigiert werden, indem die im Dunkelintervall gemessene Intensität abgezogen wird, bevor das Verhältnis ermittelt wird. ⓘ
Bei einem Einstrahlgerät muss die Küvette, die nur ein Lösungsmittel enthält, zuerst gemessen werden. Mettler Toledo hat ein Einstrahl-Array-Spektrophotometer entwickelt, das schnelle und genaue Messungen im UV/VIS-Bereich ermöglicht. Die Lichtquelle besteht aus einer Xenon-Blitzlampe für den ultravioletten (UV) sowie für den sichtbaren (VIS) und nahen infraroten Wellenlängenbereich, der einen Spektralbereich von 190 bis 1100 nm abdeckt. Die Lampenblitze werden auf eine Glasfaser fokussiert, die den Lichtstrahl auf eine Küvette mit der Probenlösung lenkt. Der Strahl durchdringt die Probe und bestimmte Wellenlängen werden von den Probenbestandteilen absorbiert. Das restliche Licht wird nach der Küvette von einer Glasfaser aufgefangen und in einen Spektrographen geleitet. Der Spektrograf besteht aus einem Beugungsgitter, das das Licht in die verschiedenen Wellenlängen aufteilt, und einem CCD-Sensor zur Aufzeichnung der Daten. Das gesamte Spektrum wird also gleichzeitig gemessen, was eine schnelle Aufnahme ermöglicht. ⓘ
Bei den Proben für die UV/Vis-Spektrophotometrie handelt es sich meist um Flüssigkeiten, obwohl auch die Absorption von Gasen und sogar von Feststoffen gemessen werden kann. Die Proben werden in der Regel in eine durchsichtige Zelle, eine so genannte Küvette, gegeben. Küvetten haben in der Regel eine rechteckige Form mit einer Innenbreite von 1 cm. (Diese Breite ist die Weglänge, im Beer-Lambert-Gesetz.) In einigen Geräten können auch Reagenzgläser als Küvetten verwendet werden. Die Art des verwendeten Probenbehälters muss den Durchgang der Strahlung durch den interessierenden Spektralbereich ermöglichen. Die am häufigsten verwendeten Küvetten bestehen aus hochwertigem Quarzglas oder Quarzglas, da diese im gesamten UV-, sichtbaren und nahen Infrarotbereich transparent sind. Glas- und Kunststoffküvetten sind ebenfalls üblich, obwohl Glas und die meisten Kunststoffe im UV absorbieren, was ihre Nützlichkeit auf den sichtbaren Wellenlängenbereich beschränkt. ⓘ
Es wurden auch spezialisierte Instrumente hergestellt. Dazu gehört die Anbringung von Spektralphotometern an Teleskopen zur Messung der Spektren astronomischer Objekte. UV-sichtbare Mikrospektrophotometer bestehen aus einem UV-sichtbaren Mikroskop und einem UV-sichtbaren Spektrophotometer. ⓘ
Ein vollständiges Spektrum der Absorption bei allen interessierenden Wellenlängen kann oft direkt von einem anspruchsvolleren Spektralphotometer erstellt werden. Bei einfacheren Geräten wird die Absorption bei einer Wellenlänge nach der anderen bestimmt und dann vom Bediener zu einem Spektrum zusammengestellt. Durch Entfernen der Konzentrationsabhängigkeit kann der Extinktionskoeffizient (ε) als Funktion der Wellenlänge bestimmt werden. ⓘ
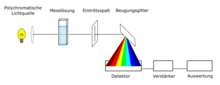

Mikrospektrophotometrie
Die UV-Spektroskopie mikroskopischer Proben erfolgt durch die Integration eines optischen Mikroskops mit UV-Optik, Weißlichtquellen, einem Monochromator und einem empfindlichen Detektor wie einem CCD (Charge-Coupled Device) oder einer PMT (Photomultiplier Tube). Da nur ein einziger optischer Pfad zur Verfügung steht, handelt es sich um Einstrahlgeräte. Moderne Geräte sind in der Lage, UV-Vis-Spektren sowohl in Reflexion als auch in Transmission auf mikrometergroßen Probeflächen zu messen. Die Vorteile solcher Geräte liegen darin, dass sie mikroskopische Proben messen können, aber auch in der Lage sind, die Spektren größerer Proben mit hoher räumlicher Auflösung zu messen. So werden sie im forensischen Labor zur Analyse von Farbstoffen und Pigmenten in einzelnen Textilfasern, mikroskopischen Farbsplittern und der Farbe von Glasscherben eingesetzt. Sie werden auch in der materialwissenschaftlichen und biologischen Forschung sowie zur Bestimmung des Energiegehalts von Kohle und Erdölgestein durch Messung des Vitrinit-Reflexionsgrads eingesetzt. Mikrospektrophotometer werden in der Halbleiter- und Mikrooptikindustrie zur Überwachung der Dicke dünner Schichten nach deren Abscheidung eingesetzt. In der Halbleiterindustrie werden sie eingesetzt, weil die kritischen Abmessungen von Schaltkreisen mikroskopisch klein sind. Eine typische Prüfung eines Halbleiterwafers würde die Erfassung von Spektren von vielen Punkten auf einem strukturierten oder unstrukturierten Wafer beinhalten. Die Dicke der abgeschiedenen Schichten lässt sich aus dem Interferenzmuster der Spektren berechnen. Darüber hinaus kann die Dicke zusammen mit dem Brechungsindex und dem Extinktionskoeffizienten dünner Schichten mit Hilfe der Ultraviolett-Spektrophotometrie bestimmt werden. Anschließend kann eine Karte der Schichtdicke auf dem gesamten Wafer erstellt und für die Qualitätskontrolle verwendet werden. ⓘ
Weitere Anwendungen
UV/Vis kann eingesetzt werden, um die Geschwindigkeit einer chemischen Reaktion zu charakterisieren. Ein Beispiel hierfür ist die Umwandlung der gelb-orangen und blauen Isomere von Quecksilberdithizonat. Diese Analysemethode stützt sich auf die Tatsache, dass die Konzentration linear proportional zur Konzentration ist. Mit dem gleichen Ansatz lassen sich Gleichgewichte zwischen Chromophoren bestimmen. ⓘ
Aus dem Spektrum der Verbrennungsgase lassen sich die chemische Zusammensetzung des Brennstoffs, die Temperatur der Gase und das Luft-Kraftstoff-Verhältnis bestimmen. ⓘ
Chemische Beispiele
Nützlich sind die π-zu-π*-Übergänge bei ungesättigten Kohlenwasserstoffen (beispielsweise Alkenen). Sie erfolgen über längerwelliges UV-Licht und sind einfach zu messen. Man erhält Informationen über die absorbierende Wellenlänge des Moleküls, die Struktur und Farbe. Dabei erfolgt die Lichtabsorption im umso längerwelligen Bereich, je größer die Anzahl der konjugierten Doppelbindungen ist. Liegt die Energie der π-zu-π*-Übergänge im Bereich des sichtbaren Lichts, so erscheint das Molekül farbig. Dabei nimmt es immer die Komplementärfarbe des absorbierten Lichts an. ⓘ
Bei den betrachteten Elektronenübergängen sind stets die folgenden Auswahlregeln zu beachten (u. a. Laporte-Regel):
- Spinregel: Der Gesamtspin muss erhalten bleiben
- Übergänge zwischen verschiedenen Spinmultiplizitäten sind verboten. Eine Anregung ist nur erlaubt, wenn sich der Gesamtspin des Moleküls nicht ändert, also wenn vor und nach der Anregung die gleiche Anzahl an gepaarten und ungepaarten Elektronen (Spins) vorhanden ist.
- Verbot von Übergängen gleicher Parität (Laporte-Verbot)
Bei dem Laporte-Verbot müssen nach der Ligandenfeldtheorie zwei Abfragen getätigt werden.
- Besitzt das Molekül ein Inversionszentrum? Wenn ja (z. B. ein Oktaeder), dann ist eine Anregung erstmal nicht erlaubt. Wenn nein (z. B. ein Tetraeder), dann ist die Anregung erlaubt.
- Ändert sich die Parität (das Vorzeichen) der Orbitale? Wenn ja, dann ist die Anregung erlaubt (also z. B. der Übergang von s → p-Orbital). Wenn nein, dann ist die Anregung nicht erlaubt (z. B. der Übergang von p → f-Orbital). Ein Übergang darf also nur von gerade nach ungerade, oder von ungerade nach gerade stattfinden (gerade sind die s- und d-Orbitale, ungerade die p- und f-Orbitale).
Bsp.:
- verboten ist der Übergang 3s → 4s
- erlaubt ist der Übergang 3s → 4p ⓘ
Achtung: Verboten heißt nicht, dass diese Übergänge nicht vorkommen! Die schwache Farbe von Komplexen entsteht durch Schwingungen der Liganden relativ zum Metallzentrum. Dadurch wird die beim Laporte-Verbot wichtige Inversionssymmetrie kurzzeitig aufgehoben und ein Übergang kann stattfinden. ⓘ











