Natriumcarbonat
| |

| |
| Bezeichnungen | |
|---|---|
| IUPAC-Bezeichnung
Natriumkarbonat
| |
| Bevorzugte IUPAC-Bezeichnung
Dinatriumcarbonat | |
| Andere Bezeichnungen
Soda, Waschsoda, Soda-Kristalle, Natriumtrioxocarbonat
| |
| Bezeichner | |
3D-Modell (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC-Nummer |
|
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII |
|
InChI
| |
SMILES
| |
| Eigenschaften | |
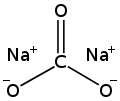
Chemische Formel
|
Na2CO3 |
| Molekulare Masse | 105,9888 g/mol (wasserfrei) 286,1416 g/mol (Dekahydrat) |
| Erscheinungsbild | Weißer Feststoff, hygroskopisch |
| Geruch | Geruchlos |
| Dichte |
|
| Schmelzpunkt | 851 °C (1.564 °F; 1.124 K) (wasserfrei) 100 °C (212 °F; 373 K) zersetzt sich (Monohydrat) 33,5 °C (92,3 °F; 306,6 K) zersetzt sich (Heptahydrat) 34 °C (93 °F; 307 K) (Dekahydrat) |
Löslichkeit in Wasser
|
Wasserfrei, g/100 mL:
|
| Löslichkeit | Löslich in wässrigen Alkalien, Glycerin Schwach löslich in wässrigem Alkohol Unlöslich in CS2, Aceton, Alkylacetaten, Alkohol, Benzonitril, flüssigem Ammoniak |
| Löslichkeit in Glyzerin | 98,3 g/100 g (155 °C) |
| Löslichkeit in Ethandiol | 3,46 g/100 g (20 °C) |
| Löslichkeit in Dimethylformamid | 0,5 g/kg |
| Azidität (pKa) | 10.33 |
Magnetische Suszeptibilität (χ)
|
-4,1-10-5 cm3/mol |
Brechungsindex (nD)
|
1,485 (wasserfrei) 1,420 (Monohydrat) 1,405 (Dekahydrat) |
| Viskosität | 3,4 cP (887 °C) |
| Struktur | |
Kristallstruktur
|
Monoklin (γ-Form, β-Form, δ-Form, wasserfrei) Orthorhombisch (Monohydrat, Heptahydrat) |
Raumgruppe
|
C2/m, Nr. 12 (γ-Form, wasserfrei, 170 K) C2/m, Nr. 12 (β-Form, wasserfrei, 628 K) P21/n, Nr. 14 (δ-Form, wasserfrei, 110 K) Pca21, Nr. 29 (Monohydrat) Pbca, Nr. 61 (Heptahydrat) |
Punktgruppe
|
2/m (γ-Formen, β-Formen, δ-Formen, wasserfrei) mm2 (Monohydrat) 2/m 2/m 2/m (Heptahydrat) |
Gitterkonstante
|
a = 8,920(7) Å, b = 5,245(5) Å, c = 6,050(5) Å (γ-Form, wasserfrei, 295 K) α = 90°, β = 101.35(8)°, γ = 90°
|
Koordinationsgeometrie
|
Oktaedrisch (Na+, wasserfrei) |
| Thermochemie | |
Wärmekapazität (C)
|
112,3 J/mol-K |
Std. molare
Entropie (S |
135 J/mol-K |
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-1130,7 kJ/mol |
Gibbssche freie Energie (ΔfG˚)
|
-1044,4 kJ/mol |
| Gefahren | |
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |
Hauptgefahren
|
Reizend |
| GHS-Kennzeichnung: | |
Piktogramme
|

|
Signalwort
|
Warnhinweis |
Gefahrenhinweise
|
H319 |
Sicherheitshinweise
|
P305+P351+P338 |
| NFPA 704 (Feuerdiamant) | |
| Tödliche Dosis oder Konzentration (LD, LC): | |
LD50 (Mittlere Dosis)
|
4090 mg/kg (Ratte, oral) |
| Sicherheitsdatenblatt (SDS) | MSDS |
| Verwandte Verbindungen | |
Andere Anionen
|
Natriumbicarbonat |
Andere Kationen
|
Lithiumkarbonat Kaliumkarbonat Rubidiumkarbonat Cäsiumcarbonat |
Verwandte Verbindungen
|
Natrium-Sesquicarbonat Natriumpercarbonat |
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Natriumcarbonat, Na2CO3, (auch bekannt als Waschsoda, Soda und Sodakristalle) ist die anorganische Verbindung mit der Formel Na2CO3 und ihre verschiedenen Hydrate. Alle Formen sind weiße, geruchlose, wasserlösliche Salze, die in Wasser mäßig alkalische Lösungen ergeben. In der Vergangenheit wurde es aus der Asche von Pflanzen gewonnen, die auf natriumreichen Böden wachsen. Da sich die Asche dieser natriumreichen Pflanzen deutlich von der Asche von Holz (die früher zur Herstellung von Pottasche verwendet wurde) unterschied, wurde Natriumcarbonat als "Soda" bekannt. Es wird in großen Mengen aus Natriumchlorid und Kalkstein nach dem Solvay-Verfahren hergestellt. ⓘ
Natriumcarbonat (fachsprachlich; standardsprachlich Natriumkarbonat) Na2CO3, wasserfrei auch calciniertes Soda, reines Soda oder Waschsoda genannt, ist ein Salz der Kohlensäure. Als Lebensmittelzusatzstoff trägt es das Kürzel E 500i. ⓘ
Hydrate

Natriumcarbonat ist polymorph, kristallisiert also in Abhängigkeit von Druck und Temperatur bei gleicher chemischer Zusammensetzung in verschiedenen Kristallstrukturen. Es existieren auch Hydrate, die Kristallwasser enthalten. ⓘ
- Wasserfrei, Na2CO3
- Bekannt als Mineral Natrit oder unter der Bezeichnung reine oder calcinierte Soda, weiße Substanz mit einem Schmelzpunkt von 854 °C und einer Dichte von 2,51 g/cm3. Bildet sich bei Temperaturen größer 107 °C.
- Monohydrat, Na2CO3 · H2O
- Bekannt als Mineral Thermonatrit, bildet sich bei Temperaturen > 35,4 °C aus dem Heptahydrat.
- Heptahydrat, Na2CO3 · 7 H2O
- Bildet sich bei Temperaturen oberhalb 32,5 °C aus dem Decahydrat.
- Decahydrat, Na2CO3 · 10 H2O
- Bekannt als Mineral Soda oder unter der Bezeichnung Kristallsoda, kristallisiert bei unter 32,5 °C aus gesättigten Natriumcarbonat-Lösungen aus (Dichte 1,45 g/cm3). ⓘ
Darüber hinaus findet sich Natriumcarbonat zusammen mit Natriumhydrogen- beziehungsweise Calciumcarbonat in der Natur in folgenden Mineralen:
- Dihydrat, Na2Ca(CO3)2 · 2 H2O
- Bekannt als Mineral Pirssonit.
- Pentahydrat, Na2Ca(CO3)2 · 5 H2O
- Bekannt als Mineral Gaylussit oder unter der Bezeichnung Natrocalcit.
- Hydrogencarbonat, Na(HCO3) · Na2CO3 · 2 H2O
- Bekannt als Mineral Trona. ⓘ
Waschsoda
Natriumcarbonat-Decahydrat (Na2CO3-10H2O), auch bekannt als Waschsoda, ist das häufigste Hydrat von Natriumcarbonat mit 10 Molekülen Kristallwasser. Soda wird in Wasser aufgelöst und kristallisiert, um Waschsoda zu erhalten. ⓘ
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{Na2CO3 + 10H2O -> Na2CO3.10H2O <span title="Aus: Englische Wikipedia, Abschnitt "Washing soda"" class="plainlinks">[https://en.wikipedia.org/wiki/Sodium_carbonate#Washing_soda <span style="color:#dddddd">ⓘ</span>]</span>}}
- Es ist ein weißer, kristalliner Feststoff;
- Es ist eines der wenigen Metallcarbonate, die in Wasser löslich sind;
- Sie ist alkalisch; sie färbt roten Lackmus blau;
- Es hat reinigende Eigenschaften durch den Prozess der Verseifung, der Fette und Schmiere wassermischbar macht. ⓘ
Anwendungen
Einige häufige Anwendungen von Natriumcarbonat (oder Waschsoda) sind:
- Natriumcarbonat (oder Waschsoda) wird als Reinigungsmittel für häusliche Zwecke wie das Waschen von Kleidung verwendet. Natriumcarbonat ist ein Bestandteil vieler Trockenseifenpulver.
- Es wird zur Beseitigung vorübergehender und dauerhafter Wasserhärte verwendet. (siehe Wasserenthärtung).
- Es wird bei der Herstellung von Glas, Seife und Papier verwendet. (siehe Glasherstellung)
- Es wird bei der Herstellung von Natriumverbindungen wie Borax verwendet. ⓘ
Glasherstellung
Natriumcarbonat dient als Flussmittel für Siliziumdioxid und senkt den Schmelzpunkt des Gemischs auf einen Wert, der ohne besondere Materialien erreicht werden kann. Dieses "Soda-Glas" ist schwer wasserlöslich, daher wird der Schmelzmischung etwas Kalziumkarbonat zugesetzt, um das Glas unlöslich zu machen. Flaschen- und Fensterglas (Kalk-Natron-Glas) wird durch Schmelzen solcher Gemische aus Natriumcarbonat, Calciumcarbonat und Quarzsand (Siliciumdioxid (SiO2)) hergestellt. Wenn diese Materialien erhitzt werden, setzen die Karbonate Kohlendioxid frei. Auf diese Weise ist Natriumkarbonat eine Quelle für Natriumoxid. Kalknatronglas ist seit Jahrhunderten die häufigste Form von Glas. Es ist auch ein wichtiger Rohstoff für die Herstellung von Tafelglas. ⓘ
Wasserenthärtung
Hartes Wasser enthält gelöste Verbindungen, in der Regel Kalzium- oder Magnesiumverbindungen. Natriumkarbonat wird zur Beseitigung vorübergehender und dauerhafter Wasserhärte verwendet. ⓘ
Da Natriumkarbonat wasserlöslich ist und Magnesiumkarbonat und Kalziumkarbonat unlöslich sind, wird Natriumkarbonat zur Enthärtung von Wasser verwendet, indem es Mg2+ und Ca2+ entfernt. Diese Ionen bilden bei der Behandlung mit Karbonat-Ionen unlösliche feste Niederschläge:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{Ca^2+(aq) + Na2CO3(aq) -> CaCO3(s) + 2Na+(aq) <span title="Aus: Englische Wikipedia, Abschnitt "Water softening"" class="plainlinks">[https://en.wikipedia.org/wiki/Sodium_carbonate#Water_softening <span style="color:#dddddd">ⓘ</span>]</span>}}
Ähnlich, Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{Mg^2+(aq) + Na2CO3(aq) -> MgCO3(s) + 2Na+(aq) <span title="Aus: Englische Wikipedia, Abschnitt "Water softening"" class="plainlinks">[https://en.wikipedia.org/wiki/Sodium_carbonate#Water_softening <span style="color:#dddddd">ⓘ</span>]</span>}}
Das Wasser wird enthärtet, da es keine gelösten Kalzium- und Magnesiumionen mehr enthält. ⓘ
Lebensmittelzusatzstoffe und Kochen
Natriumcarbonat wird in der Küche auf verschiedene Weise verwendet, vor allem weil es eine stärkere Base ist als Backpulver (Natriumbicarbonat), aber schwächer als Lauge (die sich auf Natriumhydroxid oder, seltener, Kaliumhydroxid beziehen kann). Die Alkalität wirkt sich auf die Glutenbildung in gekneteten Teigen aus und verbessert auch die Bräunung, indem sie die Temperatur, bei der die Maillard-Reaktion stattfindet, verringert. Um den erstgenannten Effekt zu nutzen, ist Natriumcarbonat einer der Bestandteile von Kansui (かん水), einer Lösung aus alkalischen Salzen, die japanischen Ramen-Nudeln ihren charakteristischen Geschmack und ihre zähe Textur verleiht; eine ähnliche Lösung wird in der chinesischen Küche aus ähnlichen Gründen zur Herstellung von Lamian verwendet. Auch kantonesische Bäcker verwenden Natriumcarbonat als Ersatz für Laugenwasser, um Mondkuchen ihre charakteristische Textur zu verleihen und die Bräunung zu verbessern. In der deutschen Küche (und allgemein in der mitteleuropäischen Küche) können Brote wie Brezeln und Laugenbrötchen, die traditionell mit Lauge behandelt werden, um die Bräunung zu verbessern, stattdessen mit Natriumkarbonat behandelt werden; Natriumkarbonat bewirkt zwar keine ganz so starke Bräunung wie Lauge, ist aber viel sicherer und einfacher zu verarbeiten. ⓘ
Natriumcarbonat wird bei der Herstellung von Brausepulver verwendet. Das kühlende und prickelnde Gefühl entsteht durch die endotherme Reaktion zwischen Natriumcarbonat und einer schwachen Säure, in der Regel Zitronensäure, bei der Kohlendioxidgas freigesetzt wird, das entsteht, wenn die Brause mit Speichel befeuchtet wird. ⓘ
Natriumcarbonat wird in der Lebensmittelindustrie auch als Lebensmittelzusatzstoff (E500) als Säureregulator, Antibackmittel, Backtriebmittel und Stabilisator verwendet. Es wird auch bei der Herstellung von Snus verwendet, um den pH-Wert des Endprodukts zu stabilisieren. ⓘ
Obwohl die Gefahr von Verätzungen geringer ist als bei Lauge, ist bei der Arbeit mit Natriumcarbonat in der Küche Vorsicht geboten, da es Aluminiumkochgeschirr, -utensilien und -folie angreift. ⓘ
Andere Anwendungen
Natriumcarbonat wird auch als relativ starke Base in verschiedenen Bereichen verwendet. Als gewöhnliches Alkali wird es in vielen chemischen Prozessen bevorzugt, da es billiger als Natriumhydroxid und weitaus sicherer in der Handhabung ist. Seine Milde empfiehlt es vor allem für den Einsatz im Haushalt. ⓘ
So wird es beispielsweise als pH-Regulator verwendet, um stabile alkalische Bedingungen aufrechtzuerhalten, die für die Wirkung der meisten fotografischen Filmentwicklungsmittel erforderlich sind. Es ist auch ein gängiger Zusatz in Schwimmbädern und Aquarienwasser, um den gewünschten pH-Wert und die Karbonathärte (KH) zu erhalten. Beim Färben mit faserreaktiven Farbstoffen wird Natriumcarbonat (oft unter Bezeichnungen wie Soda-Asche-Fixiermittel oder Soda-Asche-Aktivator) verwendet, um eine ordnungsgemäße chemische Bindung des Farbstoffs mit Zellulosefasern (Pflanzenfasern) zu gewährleisten, in der Regel vor dem Färben (bei Krawattenfarbstoffen), mit dem Farbstoff gemischt (beim Färben) oder nach dem Färben (beim Tauchfärben). Es wird auch in der Schaumflotation zur Aufrechterhaltung eines günstigen pH-Werts als Flotationshilfsmittel neben CaO und anderen schwach basischen Verbindungen verwendet. ⓘ
Vorstufe zu anderen Verbindungen
Natrium Bicarbonat (NaHCO3) oder Backsoda, auch ein Bestandteil von Feuerlöschern, wird häufig aus Natriumcarbonat hergestellt. Obwohl NaHCO3 selbst ein Zwischenprodukt des Solvay-Prozesses ist, wird durch die Erhitzung, die erforderlich ist, um das Ammoniak, das es verunreinigt, zu entfernen, ein Teil des NaHCO3 zersetzt, so dass es wirtschaftlicher ist, das fertige Na2CO3 mit CO2 umzusetzen:
- Na2CO3 + CO2 + H2O → 2NaHCO3 ⓘ
In einer verwandten Reaktion wird Natriumcarbonat zur Herstellung von Natriumbisulfit (NaHSO3) verwendet, das bei der "Sulfit"-Methode zur Abtrennung von Lignin aus Zellulose eingesetzt wird. Diese Reaktion wird zur Entfernung von Schwefeldioxid aus Rauchgasen in Kraftwerken genutzt:
- Na2CO3 + SO2 + H2O → NaHCO3 + NaHSO3
Diese Anwendung wird immer häufiger eingesetzt, insbesondere dort, wo Kraftwerke strenge Emissionskontrollen einhalten müssen. ⓘ
Natriumcarbonat wird in der Baumwollindustrie verwendet, um die Schwefelsäure zu neutralisieren, die für die saure Entfärbung von unscharfer Baumwollsaat benötigt wird. ⓘ
Es wird auch zur Bildung von Karbonaten anderer Metalle durch Ionenaustausch verwendet, häufig mit den Sulfaten der anderen Metalle. ⓘ
Sonstiges
Natriumcarbonat wird in der Ziegelindustrie als Netzmittel verwendet, um die zum Strangpressen des Tons benötigte Wassermenge zu reduzieren. In der Gießerei wird es als "Bindemittel" bezeichnet und dient dazu, feuchtes Alginat an geliertem Alginat haften zu lassen. Natriumcarbonat wird in Zahnpasten verwendet, wo es als Schaumbildner und Schleifmittel wirkt und den pH-Wert im Mund vorübergehend erhöht. ⓘ
Natriumcarbonat wird auch bei der Verarbeitung und Gerbung von Tierhäuten verwendet. ⓘ
Physikalische Eigenschaften
Die integrale Lösungsenthalpie von Natriumcarbonat beträgt -28,1 kJ/mol für eine 10 %ige wässrige Lösung. Die Mohshärte von Natriumcarbonat-Monohydrat beträgt 1,3. ⓘ
Vorkommen als natürliches Mineral

Natriumkarbonat ist wasserlöslich und kann in Trockengebieten natürlich vorkommen, insbesondere in mineralischen Ablagerungen (Evaporiten), die durch das Verdunsten saisonaler Seen entstehen. Ablagerungen des Minerals Natron werden seit der Antike in Ägypten auf dem Grund trockener Seen abgebaut, wo Natron bei der Herstellung von Mumien und bei der frühen Glasherstellung verwendet wurde. ⓘ
Die wasserfreie Mineralform von Natriumkarbonat ist recht selten und wird Natrit genannt. Natriumkarbonat bricht auch am Ol Doinyo Lengai, dem einzigen Vulkan Tansanias, aus, und es wird vermutet, dass es in der Vergangenheit auch an anderen Vulkanen ausgebrochen ist, aber aufgrund der Instabilität dieser Mineralien an der Erdoberfläche werden sie wahrscheinlich erodiert. Alle drei mineralogischen Formen von Natriumkarbonat sowie Trona, Trinatriumhydrogendikarbonat-Dihydrat, sind auch aus ultraalkalischem Pegmatitgestein bekannt, das z. B. auf der Kola-Halbinsel in Russland vorkommt. ⓘ
Extraterrestrisch ist Natriumkarbonat nur selten bekannt. Ablagerungen wurden als Quelle der hellen Flecken auf Ceres identifiziert, Material aus dem Inneren, das an die Oberfläche gebracht wurde. Auf dem Mars gibt es zwar Karbonate, und man geht davon aus, dass diese auch Natriumkarbonat enthalten, doch müssen die Vorkommen erst noch bestätigt werden. Dieses Fehlen wird von einigen damit erklärt, dass in dem zuvor wässrigen Marsboden ein niedriger pH-Wert vorherrscht. ⓘ
Produktion
Bergbau
Trona, Trinatriumhydrogendicarbonat-Dihydrat (Na3HCO3CO3-2H2O), wird in mehreren Gebieten der USA abgebaut und deckt fast den gesamten Inlandsverbrauch an Natriumcarbonat. Große natürliche Vorkommen, die 1938 entdeckt wurden, wie z. B. in der Nähe von Green River, Wyoming, haben den Abbau wirtschaftlicher gemacht als die industrielle Produktion in Nordamerika. In der Türkei gibt es bedeutende Trona-Reserven; aus den Vorkommen bei Ankara wurden zwei Millionen Tonnen Soda gewonnen. Es wird auch aus einigen alkalischen Seen wie dem Magadi-See in Kenia durch Ausbaggern gewonnen. Durch heiße Salzquellen wird das Salz im See kontinuierlich nachgefüllt, so dass die Quelle vollständig nachhaltig ist, sofern die Baggerrate nicht höher ist als die Nachfüllrate. ⓘ
Barilla und Seetang
Mehrere halophytische (salztolerante) Pflanzenarten und Seetangarten können so verarbeitet werden, dass sie eine unreine Form von Natriumkarbonat liefern, und diese Quellen waren in Europa und anderswo bis zum frühen 19. Die Landpflanzen (in der Regel Glas- oder Salzpflanzen) oder die Algen (in der Regel Fucus-Arten) wurden geerntet, getrocknet und verbrannt. Die Asche wurde dann "lixiert" (mit Wasser gewaschen), um eine alkalische Lösung zu bilden. Diese Lösung wurde trocken gekocht, um das Endprodukt zu erhalten, das als "Soda" bezeichnet wurde; dieser sehr alte Name leitet sich von dem arabischen Wort Soda ab, das wiederum auf Salsola-Soda, eine der vielen Arten von Meerespflanzen, die für die Herstellung geerntet wurden, angewandt wurde. "Barilla" ist ein Handelsname für eine unreine Form von Pottasche, die aus Küstenpflanzen oder Seetang gewonnen wird. ⓘ
Die Natriumkarbonatkonzentration in Soda variiert sehr stark und reicht von 2 bis 3 % bei der aus Seetang gewonnenen Form ("Kelp") bis zu 30 % bei der besten Barilla, die aus Salzwasserpflanzen in Spanien hergestellt wird. Gegen Ende des 18. Jahrhunderts wurden die pflanzlichen und seetangartigen Quellen für Soda und das verwandte Alkali "Pottasche" immer unzureichender, und die Suche nach kommerziell tragfähigen Wegen zur Synthese von Soda aus Salz und anderen Chemikalien wurde intensiver. ⓘ
Das Leblanc-Verfahren
1792 patentierte der französische Chemiker Nicolas Leblanc ein Verfahren zur Herstellung von Natriumcarbonat aus Salz, Schwefelsäure, Kalkstein und Kohle. In der ersten Stufe wird Natriumchlorid mit Schwefelsäure nach dem Mannheimer Verfahren behandelt. Bei dieser Reaktion entstehen Natriumsulfat (Salzkuchen) und Chlorwasserstoff:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl ⓘ
Der Salzkuchen und der zerkleinerte Kalkstein (Calciumcarbonat) wurden durch Erhitzen mit Kohle reduziert. Diese Umwandlung besteht aus zwei Teilen. Der erste ist die karbothermische Reaktion, bei der die Kohle, eine Kohlenstoffquelle, das Sulfat zu Sulfid reduziert:
- Na2SO4 + 2C → Na2S + 2CO2 ⓘ
Die zweite Stufe ist die Reaktion zur Bildung von Natriumcarbonat und Calciumsulfid:
- Na2S + CaCO3 → Na2CO3 + CaS
Diese Mischung wird als schwarze Asche bezeichnet. Die Soda-Asche wird mit Wasser aus der schwarzen Asche extrahiert. Durch Verdampfen dieses Extrakts erhält man festes Natriumcarbonat. Dieser Extraktionsprozess wurde als Auslaugen bezeichnet. ⓘ
Die beim Leblanc-Verfahren entstehende Salzsäure war eine große Quelle der Luftverschmutzung, und das als Nebenprodukt anfallende Kalziumsulfid stellte auch ein Problem für die Abfallentsorgung dar. Dennoch blieb dieses Verfahren bis in die späten 1880er Jahre die wichtigste Methode zur Herstellung von Natriumcarbonat. ⓘ
Solvay-Verfahren
Im Jahr 1861 entwickelte der belgische Industriechemiker Ernest Solvay ein Verfahren zur Herstellung von Natriumcarbonat, bei dem zunächst Natriumchlorid, Ammoniak, Wasser und Kohlendioxid zu Natriumbicarbonat und Ammoniumchlorid umgesetzt wurden:
- NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl ⓘ
Das entstandene Natriumbicarbonat wurde dann durch Erhitzen in Natriumcarbonat umgewandelt, wobei Wasser und Kohlendioxid freigesetzt wurden:
- 2NaHCO3 → Na2CO3 + H2O + CO2 ⓘ
In der Zwischenzeit wurde das Ammoniak aus dem Nebenprodukt Ammoniumchlorid regeneriert, indem es mit dem Kalk (Kalziumoxid) behandelt wurde, der bei der Kohlendioxiderzeugung übrig geblieben war:
- 2NH4Cl + CaO → 2NH3 + CaCl2 + H2O ⓘ
Beim Solvay-Verfahren wird das Ammoniak recycelt. Es verbraucht nur Sole und Kalkstein, und Calciumchlorid ist das einzige Abfallprodukt. Das Verfahren ist wesentlich wirtschaftlicher als das Leblanc-Verfahren, bei dem zwei Abfallprodukte entstehen, nämlich Calciumsulfid und Chlorwasserstoff. Das Solvay-Verfahren beherrschte schnell die weltweite Natriumcarbonatproduktion. Um 1900 wurden 90 % des Natriumkarbonats nach dem Solvay-Verfahren hergestellt, und die letzte Anlage nach dem Leblanc-Verfahren wurde in den frühen 1920er Jahren geschlossen. ⓘ
Der zweite Schritt des Solvay-Verfahrens, das Erhitzen von Natriumbicarbonat, wird in kleinem Maßstab von Hausfrauen und in Restaurants zur Herstellung von Natriumcarbonat für kulinarische Zwecke (einschließlich Brezeln und Alkalinudeln) verwendet. Das Verfahren ist für diese Anwender attraktiv, weil Natriumbicarbonat weithin als Backsoda verkauft wird und die Temperaturen, die für die Umwandlung von Backsoda in Natriumcarbonat erforderlich sind (250 °F (121 °C) bis 300 °F (149 °C)), in herkömmlichen Küchenöfen leicht erreicht werden können. ⓘ
Das Hou-Verfahren
Dieses Verfahren wurde von dem chinesischen Chemiker Hou Debang in den 1930er Jahren entwickelt. Das frühere Nebenprodukt der Dampfreformierung, Kohlendioxid, wurde durch eine gesättigte Lösung von Natriumchlorid und Ammoniak gepumpt, um durch diese Reaktionen Natriumbicarbonat herzustellen:
Das Natriumbicarbonat wurde aufgrund seiner geringen Löslichkeit als Niederschlag gesammelt und dann auf etwa 80 °C (176 °F) oder 95 °C (203 °F) erhitzt, um reines Natriumcarbonat zu erhalten, ähnlich wie im letzten Schritt des Solvay-Verfahrens. Der verbleibenden Lösung aus Ammonium- und Natriumchlorid wird mehr Natriumchlorid zugesetzt; außerdem wird mehr Ammoniak bei 30-40 °C zu dieser Lösung gepumpt. Die Temperatur der Lösung wird dann auf unter 10 °C gesenkt. Die Löslichkeit von Ammoniumchlorid ist bei 30 °C höher als die von Natriumchlorid und bei 10 °C niedriger. Aufgrund dieses temperaturabhängigen Löslichkeitsunterschieds und des Common-Ion-Effekts wird Ammoniumchlorid in einer Natriumchloridlösung ausgefällt. ⓘ
Der chinesische Name von Hous Verfahren, lianhe zhijian fa (联合制碱法), bedeutet "gekoppeltes Herstellungsverfahren für Alkali": Das Hou-Verfahren ist mit dem Haber-Verfahren gekoppelt und bietet eine bessere Atomökonomie, da die Herstellung von Calciumchlorid entfällt, da Ammoniak nicht mehr regeneriert werden muss. Das als Nebenprodukt anfallende Ammoniumchlorid kann als Düngemittel verkauft werden. ⓘ
Eigenschaften
Chemische Eigenschaften

Als Natriumsalz der schwachen Kohlensäure reagiert es mit stärkeren Säuren unter Bildung von Kohlenstoffdioxid (Aufschäumen). In Wasser löst Natriumcarbonat sich unter Wärmeentwicklung (Hydratationswärme). Eine stark alkalische Lösung entsteht, da das Carbonat-Anion als Base mit einem Proton aus dem Dissoziationsgleichgewicht des Lösungsmittels Wasser zum Hydrogencarbonation (HCO3−) reagiert und eine entsprechend hohe Hydroxidionenkonzentration entsteht:
- Dissoziationsgleichgewicht des Carbonations in Wasser. ⓘ
Vor der Verfügbarkeit größerer Mengen von Natriumhydroxid war Natriumcarbonat damit die wichtigste Base, da es sich in Wasser gelöst verhält wie eine Mischung aus Natriumhydrogencarbonat und Natriumhydroxid: Eine Lösung von 50 g Natriumcarbonat pro Liter Wasser weist einen pH-Wert von 11,5 auf. ⓘ
- Reaktion von Natriumcarbonat und Wasser. ⓘ
Die Standardbildungsenthalpie von Natriumcarbonat beträgt ΔfH0298 = −1131,7 kJ·mol−1, die Freie Standardbildungsenthalpie ΔG0298 = −1048,4 kJ·mol−1, und die molare Standardentropie S0298 = 136,1 J·K−1 ·mol−1. ⓘ
Lagerung
Kristallsoda muss gut verschlossen oder in feuchter Atmosphäre gelagert werden, da es an trockener Luft Kristallwasser abgibt und in ein weißes Pulver zerfällt. ⓘ
Umgekehrt muss man calcinierte, d. h. wasserfreies Soda in trockener Atmosphäre aufbewahren, da sie – ohne dadurch sofort feucht auszusehen – leicht Feuchtigkeit aus der Luft aufnimmt und mit dieser in das Monohydrat Na2CO3 · H2O übergeht (Hygroskopie). ⓘ
Verwendung
Natriumcarbonat wird seit langer Zeit durch den Menschen genutzt. Schon die alten Ägypter setzten es zum Mumifizieren ein („Nitron“). Ebenso fand es seit dem Altertum Verwendung als Reinigungsmittel und bei der Glasherstellung. Heute wird Natriumcarbonat von fast allen Industriezweigen eingesetzt und ist damit eines der vielseitigsten chemischen Produkte. ⓘ
Natriumcarbonat wird in der Lebensmitteltechnik als Säureregulator, Aufschlussmittel oder Trägerstoff eingesetzt. Zusammen mit Natriumhydrogencarbonat ist es in der EU als Lebensmittelzusatzstoff unter der Nummer E 500 ohne Höchstmengenbeschränkung (quantum satis) für alle Lebensmittel allgemein zugelassen und darf nach EG-Öko-Verordnung auch in ökologisch erzeugten Lebensmitteln zugesetzt werden. ⓘ
Weltweit wurden 1997 ca. 39 Millionen Tonnen Soda produziert. In Deutschland betrug das Marktvolumen 1999 ca. 2,4 Millionen Tonnen. Der größte Anteil an Soda wird dabei von den folgenden fünf Industriebranchen verbraucht:
- Die Glasindustrie verwendet Soda als Rohstoff für ihre Glasschmelzen und ist damit der größte Sodaverbraucher. Soda fungiert dabei als Flussmittel, das in der erstarrenden Glasschmelze deren Auskristallisieren verhindert und dadurch das Glas amorph hält. Der Anteil an Soda bestimmt dabei die Fließfähigkeit der Schmelze.
- Die chemische Industrie setzt Soda zur Herstellung von Bleichmitteln, Borax, Chromaten wie Natriumchromat und Natriumdichromat, Farben, Füllstoffen, Gerbereihilfen, Industriereinigern, Kryolith, Leim- und Klebstoffen, Metallcarbonaten, Natronsalpeter, Perborat, Natriumphosphaten wie zum Beispiel Pentanatriumtriphosphat, Silikaten (Wassergläser) wie zum Beispiel Natriummetasilikat-Pentahydrat und Natriumorthosilikat, Sulfit, Ultramarinfarben, Wasserglas u. a. Chemikalien ein.
- In der Eisenhüttenindustrie wird Soda zur Entschwefelung von Roheisen, Gusseisen und Stahl sowie als Flotations- und Flussmittel verwendet.
- In der Waschmittel- und Seifenindustrie werden mit Soda Grobwaschmittel und andere Reinigungsmittel hergestellt sowie Fette verseift. Früher wurde Soda zu diesem Zweck kaustifiziert, d. h. mit Calciumoxid oder -hydroxid zu Ätznatron umgesetzt.
- In der Papier- und Zellstoffindustrie dient Soda sowohl zum Aufschluss, zur Neutralisation, zum Reinigen und Bleichen als auch zur Aufarbeitung von Altpapier. ⓘ
- Weitere Anwendungen:
- Lederindustrie
- Wasserreinigung
- Innere Speisewasseraufbereitung bei Dampfkesseln
- Keramik- und Emailleherstellung
- Textilindustrie
- Rauchgasentschwefelung
- Urtitersubstanz nach Arzneibuch
- Entgiftung von Nervenkampfstoffen
- pH-Wert-Anhebung von Trinkwasser sowie in Schwimmbädern („pH-Plus Pulver“ und Granulat ist meist Natriumcarbonat)
- Zusatz zu Entwicklerlösungen ⓘ




