Thrombozyt
| Blutplättchen ⓘ | |
|---|---|
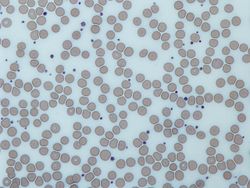 Lichtmikroskopische Aufnahme (500 ×) eines mit Giemsa gefärbten peripheren Blutausstrichs mit Blutplättchen (violette Punkte), umgeben von roten Blutkörperchen (rosa kreisförmige Strukturen) | |
| Einzelheiten | |
| Vorläufer | Megakaryozyten |
| Funktion | Bildung von Blutgerinnseln; Verhinderung von Blutungen |
| Bezeichner | |
| Lateinisch | Thrombozyten |
| Anatomische Begriffe der Mikroanatomie [Bearbeiten auf Wikidata] | |
Thrombozyten, auch Thrombozyten genannt (von griechisch θρόμβος, "Gerinnsel" und κύτος, "Zelle"), sind ein Bestandteil des Blutes, dessen Funktion (zusammen mit den Gerinnungsfaktoren) darin besteht, auf Blutungen infolge von Verletzungen der Blutgefäße durch Verklumpung zu reagieren und dadurch ein Blutgerinnsel zu bilden. Thrombozyten haben keinen Zellkern; sie sind Fragmente von Zytoplasma, die aus den Megakaryozyten des Knochenmarks oder der Lunge stammen und dann in den Blutkreislauf gelangen. Zirkulierende inaktive Thrombozyten sind bikonvexe scheibenförmige (linsenförmige) Strukturen mit einem größten Durchmesser von 2-3 µm. Aktivierte Thrombozyten haben Zellmembranvorsprünge, die ihre Oberfläche bedecken. Thrombozyten kommen nur bei Säugetieren vor, während bei anderen Wirbeltieren (z. B. Vögel, Amphibien) Thrombozyten als intakte mononukleäre Zellen zirkulieren. ⓘ
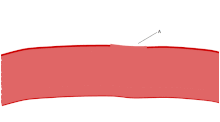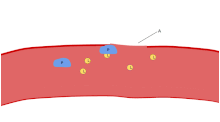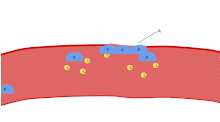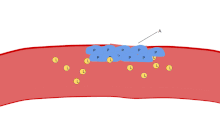
Auf einem gefärbten Blutausstrich erscheinen die Blutplättchen als dunkelviolette Flecken, die etwa 20 % des Durchmessers der roten Blutkörperchen haben. Der Ausstrich wird verwendet, um die Thrombozyten auf Größe, Form, qualitative Anzahl und Verklumpung zu untersuchen. Ein gesunder Erwachsener hat normalerweise 10 bis 20 Mal mehr rote Blutkörperchen als Blutplättchen. Eine wichtige Funktion der Blutplättchen ist die Hämostase, d. h. die Blutstillung an der Stelle, an der das Endothel unterbrochen ist. Sie sammeln sich an der Stelle und verstopfen das Loch, sofern die Unterbrechung nicht physisch zu groß ist. Zunächst heften sich die Blutplättchen an Substanzen außerhalb des unterbrochenen Endothels: Adhäsion. Zweitens verändern sie ihre Form, schalten Rezeptoren ein und geben chemische Botenstoffe ab: Aktivierung. Drittens verbinden sie sich durch Rezeptorbrücken miteinander: Aggregation. Die Bildung dieses Thrombozytenpfropfens (primäre Hämostase) geht mit einer Aktivierung der Gerinnungskaskade einher, die zur Ablagerung und Verknüpfung von Fibrin führt (sekundäre Hämostase). Diese Prozesse können sich überschneiden: Das Spektrum reicht von einem überwiegend aus Thrombozyten bestehenden Pfropf oder "weißem Gerinnsel" bis hin zu einem überwiegend aus Fibrin bestehenden Pfropf oder "rotem Gerinnsel" oder der typischen Mischung. Einige würden die anschließende Retraktion und die Thrombozytenhemmung als vierten und fünften Schritt zur Vervollständigung des Prozesses hinzufügen, und wieder andere würden einen sechsten Schritt, die Wundheilung, hinzufügen. Thrombozyten sind außerdem sowohl an der angeborenen als auch an der adaptiven intravaskulären Immunantwort beteiligt. Die Zellmembran der Blutplättchen besitzt Rezeptoren für Kollagen. Nach dem Riss der Blutgefäßwand liegen die Thrombozyten frei und heften sich an das Kollagen im umgebenden Bindegewebe. ⓘ
Eine niedrige Thrombozytenkonzentration wird als Thrombozytopenie bezeichnet und ist entweder auf eine verminderte Produktion oder eine erhöhte Zerstörung zurückzuführen. Eine erhöhte Thrombozytenkonzentration wird als Thrombozytose bezeichnet und ist entweder angeboren, reaktiv (auf Zytokine) oder auf eine unregulierte Produktion zurückzuführen: eines der myeloproliferativen Neoplasmen oder bestimmte andere myeloische Neoplasmen. Eine Störung der Thrombozytenfunktion wird als Thrombozytopathie oder Thrombozytenfunktionsstörung bezeichnet. ⓘ
Normale Thrombozyten können eher auf eine Anomalie an der Gefäßwand als auf eine Blutung reagieren, was zu einer unangemessenen Adhäsion/Aktivierung der Thrombozyten und einer Thrombose führt: der Bildung eines Gerinnsels in einem intakten Gefäß. Diese Art von Thrombose entsteht durch andere Mechanismen als ein normales Gerinnsel: nämlich durch die Ausdehnung des Fibrins einer venösen Thrombose, durch die Ausdehnung einer instabilen oder rupturierten arteriellen Plaque, die eine arterielle Thrombose verursacht, und durch eine mikrozirkulatorische Thrombose. Ein arterieller Thrombus kann den Blutfluss teilweise behindern, was zu einer stromabwärts gelegenen Ischämie führt, oder ihn vollständig blockieren, was zu einem stromabwärts gelegenen Gewebetod führt. ⓘ

Thrombozyten oder Thrombocyten (Singular der Thrombozyt; von altgriechisch θρόμβος thrómbos „Klumpen“ sowie altgriechisch κύτος kýtos „Höhlung“, „Gefäß“, „Hülle“) oder Blutplättchen sind die kleinsten Zellen des Blutes. Sie spielen eine wichtige Rolle bei der Blutgerinnung, indem sie sich bei der Verletzung eines Blutgefäßes an das umliegende Gewebe anheften („Thrombozytenadhäsion“) oder aneinanderheften („Thrombozytenaggregation“), sodass die Verletzung verschlossen wird. Zusätzlich setzen sie dabei gerinnungsfördernde Stoffe frei. ⓘ
Blutplättchen haben weder Zellkerne noch Erbinformation (DNA). Sie entstehen durch Abschnürung aus Megakaryozyten, die sich im Knochenmark befinden. ⓘ
Messung
Die Thrombozytenkonzentration wird entweder manuell mit einem Hämozytometer oder durch Einlegen des Blutes in ein automatisches Thrombozytenanalysegerät mit elektrischer Impedanz, wie z. B. einen Coulter-Zähler, gemessen. Der Normalbereich (99 % der analysierten Bevölkerung) für Thrombozyten bei gesunden weißen Menschen liegt bei 150.000 bis 450.000 pro Kubikmillimeter (ein mm3 entspricht einem Mikroliter) oder 150-450 × 109 pro Liter. Es wurde bestätigt, dass der Normalbereich bei älteren Menschen und der spanischen Bevölkerung der gleiche ist. ⓘ
Die Anzahl der Blutplättchen ist von Mensch zu Mensch unterschiedlich. Der normale physiologische Bereich liegt bei 200.000 bis 500.000 pro Mikroliter Blut. Da sie Rezeptoren für Thrombopoietin (das Protein, das die Reifung der Megakaryozyten und die Freisetzung von Blutplättchen fördert) enthalten, bindet eine höhere Anzahl von Blutplättchen mehr von diesem Protein. Infolgedessen wird die Produktion von Thrombopoietin in der Leber und den Nieren angeregt. Dies ist die Grundlage für die Produktion von mehr Thrombopoietin und infolgedessen mehr Blutplättchen im Blutkreislauf während des Blutgerinnungsprozesses. ⓘ
Form
In erster Näherung kann die Form der Thrombozyten als abgeflachte Sphäroide mit einem Halbachsenverhältnis von 2 bis 8 betrachtet werden. Diese Näherung wird häufig verwendet, um die hydrodynamischen und optischen Eigenschaften einer Thrombozytenpopulation zu modellieren und die geometrischen Parameter einzelner durchflusszytometrisch gemessener Thrombozyten wiederherzustellen. Genauere biophysikalische Modelle der Oberflächenmorphologie der Blutplättchen, die ihre Form nach ersten Prinzipien modellieren, ermöglichen eine realistischere Geometrie der Blutplättchen im ruhigen und aktivierten Zustand. ⓘ
Struktur
Strukturell kann das Blutplättchen in vier Zonen unterteilt werden, von der peripheren bis zur innersten Zone:
- Die periphere Zone ist reich an Glykoproteinen, die für die Adhäsion, Aktivierung und Aggregation der Blutplättchen erforderlich sind. Zum Beispiel GPIb/IX/V; GPVI; GPIIb/IIIa.
- Sol-Gel-Zone - ist reich an Mikrotubuli und Mikrofilamenten, die es den Blutplättchen ermöglichen, ihre scheibenförmige Form beizubehalten.
- Organelle Zone - ist reich an Thrombozytengranula. Die Alpha-Granula enthalten Gerinnungsmediatoren wie Faktor V, Faktor VIII, Fibrinogen, Fibronektin, aus Thrombozyten gewonnene Wachstumsfaktoren und chemotaktische Substanzen. Die Delta-Granula oder Dense Bodies enthalten ADP, Kalzium und Serotonin, die Thrombozyten-aktivierende Mediatoren sind.
- Membranöse Zone - enthält Membranen, die aus dem glatten endoplasmatischen Retikulum der Megakaryozyten stammen und in einem dichten Röhrensystem organisiert sind, das für die Synthese von Thromboxan A2 verantwortlich ist. Dieses dichte röhrenförmige System ist mit der Oberflächenmembran der Thrombozyten verbunden, um die Freisetzung von Thromboxan A2 zu unterstützen. ⓘ
Struktur und Funktion
Thrombozyten entstehen im Knochenmark, wo sie von Megakaryozyten, riesigen thrombozytenbildenden Zellen, abgeschnürt werden. Bis zu 8000 Thrombozyten können sich im Laufe eines Lebens von solch einer Knochenmarkszelle abschnüren. Dieser Vorgang wird Thrombopoese genannt und durch das Hormon Thrombopoietin unterstützt. ⓘ
Thrombozyten haben einen Durchmesser von 1,5 µm bis 3,0 µm und sind scheibenartig flach (discoid). Während der Blutgerinnung ändern die Thrombozyten durch Aktivatoren wie ADP, Kollagen, Thromboxan und Thrombin ihre Form. Es erfolgt die Ausstülpung von Pseudopodien, was mit einer mehrfachen Oberflächenvergrößerung einhergeht. Dies begünstigt die Thrombusbildung durch fibrinvermittelte Bindung mit anderen Thrombozyten. Dieser Vorgang beschreibt die Funktion von Thrombozyten und wird Thrombozytenaggregation genannt. ⓘ
Bei gesunden Personen gilt eine Thrombozytenanzahl zwischen 150.000 und 450.000 pro µl Blut als Normalwert. Die Thrombozyten-Konzentration ist individuell genetisch bedingt und variiert über die Lebenszeit eines gesunden Erwachsenen wenig. In einer gesunden Population folgt die Thrombozytenkonzentration einer Normalverteilung. ⓘ
Die durchschnittliche Lebensdauer von Thrombozyten beträgt acht bis zwölf Tage. Der Abbau erfolgt hauptsächlich in der Milz, in der auch ein Drittel der Thrombozyten temporär gespeichert ist, sowie in der Lunge und, in geringerem Maße, in der Leber. ⓘ

- Die Produktion von Megakaryozyten und Blutplättchen wird durch das Hormon Thrombopoietin gesteuert, das in den Nieren und der Leber gebildet wird.
- Jeder Megakaryozyt produziert im Laufe seines Lebens zwischen 1.000 und 3.000 Blutplättchen.
- Ein gesunder Erwachsener produziert täglich durchschnittlich 1011 Blutplättchen.
- Reserve-Thrombozyten werden in der Milz gespeichert und bei Bedarf durch eine vom sympathischen Nervensystem ausgelöste Kontraktion der Milz freigesetzt. ⓘ

Blutstillung

Ein Überblick über die Thrombozytendynamik, den komplexen Prozess der Umwandlung inaktiver Thrombozyten in einen Thrombozytenpfropf, ist unerlässlich. Die Tatsache, dass mindestens 193 Proteine und 301 Interaktionen an der Plättchendynamik beteiligt sind, erschwert jede verbale Beschreibung. Die Unterteilung der Thrombozytendynamik in drei Phasen ist in dieser Hinsicht nützlich, aber künstlich: Tatsächlich wird jede Phase in rascher Abfolge eingeleitet und dauert so lange an, bis der Auslöser für die jeweilige Phase nicht mehr vorhanden ist, so dass es Überschneidungen gibt. ⓘ
Adhäsion
Die Thrombusbildung auf einem intakten Endothel wird durch Stickstoffmonoxid, Prostacyclin und CD39 verhindert. ⓘ
Endothelzellen werden durch den von Willebrand-Faktor (VWF), den diese Zellen produzieren, an das subendotheliale Kollagen gebunden. VWF wird auch in den Weibel-Palade-Körpern der Endothelzellen gespeichert und konstitutiv ins Blut sezerniert. Thrombozyten speichern vWF in ihren Alpha-Granula. ⓘ
Wenn die Endothelschicht durchbrochen wird, verankern Kollagen und VWF die Thrombozyten am Subendothel. Der GP1b-IX-V-Rezeptor der Thrombozyten bindet an VWF, der GPVI-Rezeptor und das Integrin α2β1 binden an Kollagen. ⓘ
Aktivierung

Hemmung
Die intakte Endothelauskleidung hemmt die Thrombozytenaktivierung durch die Produktion von Stickstoffmonoxid, Endothel-ADPase und PGI2 (Prostazyklin). Die Endothelial-ADPase baut den Thrombozytenaktivator ADP ab. ⓘ
Thrombozyten im Ruhezustand unterhalten einen aktiven Kalziumausfluss über eine durch zyklisches AMP aktivierte Kalziumpumpe. Die intrazelluläre Kalziumkonzentration bestimmt den Aktivierungsstatus der Thrombozyten, da sie der zweite Botenstoff ist, der die Konformationsänderung der Thrombozyten und die Degranulation (siehe unten) antreibt. Endotheliales Prostacyclin bindet an Prostanoidrezeptoren auf der Oberfläche ruhender Thrombozyten. Dieser Vorgang stimuliert das gekoppelte Gs-Protein zur Steigerung der Adenylatzyklaseaktivität und erhöht die Produktion von cAMP, was den Kalziumabfluss weiter fördert und die Verfügbarkeit von intrazellulärem Kalzium für die Thrombozytenaktivierung verringert. ⓘ
ADP wiederum bindet an purinerge Rezeptoren auf der Thrombozytenoberfläche. Da der thrombozytäre purinerge Rezeptor P2Y12 an Gi-Proteine gekoppelt ist, reduziert ADP die Adenylatzyklaseaktivität der Thrombozyten und die cAMP-Produktion, was zu einer Anhäufung von Kalzium im Inneren der Thrombozyten führt, indem die cAMP-Kalzium-Effluxpumpe inaktiviert wird. Der andere ADP-Rezeptor P2Y1 koppelt an Gq, das die Phospholipase C-beta 2 (PLCB2) aktiviert, was zur Bildung von Inositol 1,4,5-Trisphosphat (IP3) und zur intrazellulären Freisetzung von mehr Kalzium führt. Dies zusammen führt zur Aktivierung der Blutplättchen. Die endotheliale ADPase baut ADP ab und verhindert dies. Clopidogrel und verwandte Thrombozytenaggregationshemmer wirken auch als purinerge P2Y12-Rezeptorantagonisten. ⓘ
Auslöser (Induktion)
Die Thrombozytenaktivierung beginnt Sekunden nach dem Auftreten der Adhäsion. Sie wird ausgelöst, wenn Kollagen aus dem Subendothel mit seinen Rezeptoren (GPVI-Rezeptor und Integrin α2β1) auf dem Thrombozyten bindet. GPVI ist mit der Fc-Rezeptor-Gamma-Kette assoziiert und führt über die Aktivierung einer Tyrosinkinase-Kaskade schließlich zur Aktivierung von PLC-gamma2 (PLCG2) und einer verstärkten Kalziumfreisetzung. ⓘ
Der Gewebefaktor bindet auch an den Faktor VII im Blut, der die extrinsische Gerinnungskaskade in Gang setzt und die Thrombinproduktion erhöht. Thrombin ist ein starker Thrombozytenaktivator, der über Gq und G12 wirkt. Dabei handelt es sich um G-Protein-gekoppelte Rezeptoren, die kalziumvermittelte Signalwege innerhalb der Thrombozyten aktivieren und so den grundlegenden Kalziumausfluss überwinden. Familien von drei G-Proteinen (Gq, Gi, G12) arbeiten für die vollständige Aktivierung zusammen. Thrombin fördert auch die sekundäre Fibrinverstärkung des Thrombozytenpfropfens. Die Aktivierung der Thrombozyten führt wiederum zur Degranulation und Freisetzung von Faktor V und Fibrinogen, wodurch die Gerinnungskaskade verstärkt wird. Der Prozess der Thrombozytenverstopfung und die Gerinnung laufen also in Wirklichkeit gleichzeitig und nicht nacheinander ab, wobei sich beide gegenseitig zur Bildung des endgültigen fibrinvernetzten Thrombus anregen. ⓘ
Komponenten (Folgen)
GPIIb/IIIa-Aktivierung
Durch Kollagen vermittelte GPVI-Signale erhöhen die Thrombozyten die Produktion von Thromboxan A2 (TXA2) und verringern die Produktion von Prostacyclin. Dies geschieht durch eine Veränderung des Stoffwechselflusses im Eicosanoid-Syntheseweg der Thrombozyten, an dem die Enzyme Phospholipase A2, Cyclooxygenase 1 und Thromboxan-A-Synthase beteiligt sind. Thrombozyten sezernieren Thromboxan A2, das auf die eigenen Thromboxanrezeptoren auf der Thrombozytenoberfläche (daher der so genannte "Out-in"-Mechanismus) und auf die anderer Thrombozyten wirkt. Diese Rezeptoren lösen eine Signalübertragung innerhalb der Blutplättchen aus, die die GPIIb/IIIa-Rezeptoren in ihre aktive Form umwandelt, um die Aggregation einzuleiten. ⓘ
Sekretion von Granula
Trotz Fehlens eines Zellkerns wurde in Thrombozyten mRNA aus Megakaryozyten gefunden. Sie sind daher, wenn auch begrenzt, zur Neusynthese von Proteinen befähigt. Sie besitzen wie andere Zellen Mitochondrien, jedoch eine spezielle Form des rauen Endoplasmatischen Retikulums (rER), das kanalikuläre System. Es dient als Calciumionen-Speicher, dessen rasche Entleerung ins Zytosol eine essentielle Voraussetzung für die physiologische Thrombozytenaggregation ist. Als weitere Kompartimente sind bei Thrombozyten die Speicher-Granula bedeutsam: Sie werden in α-Granula, elektronendichte Granula und Lysosomen unterteilt und enthalten aggregationsfördernde Substanzen und Proteine, deren Sekretion (Ausschüttung) für die Thrombozytenfunktion notwendig ist. Die Plasmamembran von Thrombozyten enthält unter anderem das Protein Gewebefaktor (engl. tissue factor). Man geht davon aus, dass sich Vesikel mit diesem Protein abschnüren und nun als zirkulierende Mikropartikel im Blut zu finden sind. Durch diese Fähigkeit, die sie mit Monozyten gemein haben, unterstützen sie die Blutgerinnung. ⓘ
Eine Milzvergrößerung (Splenomegalie) oder eine Immunthrombozytopenie führen zu einer Verringerung der durchschnittlichen Thrombozytenlebensdauer, was bei einer gleichbleibenden Produktionsrate zu einer insgesamt geringen Thrombozytenkonzentration führt. Umgekehrt kommt es nach Entfernung der Milz (Splenektomie) zu einem starken Anstieg der Thrombozytenanzahl durch das Fehlen des milzvermittelten Abbaus. ⓘ

Veränderung der Morphologie
Wie die Durchflusszytometrie und die Elektronenmikroskopie zeigen, sind morphologische Veränderungen das empfindlichste Zeichen für eine Aktivierung, wenn Blutplättchen mit ADP exponiert werden. Die Hyperpolarisierung der Mitochondrien ist ein Schlüsselereignis für die Auslösung morphologischer Veränderungen. Die Kalziumkonzentration im Blutplättchen steigt an und stimuliert das Zusammenspiel zwischen dem Mikrotubuli/Aktinfilament-Komplex. Die kontinuierlichen Formveränderungen vom nicht aktivierten zum vollständig aktivierten Thrombozyten sind am besten in der Rasterelektronenmikroskopie zu erkennen. Drei Schritte auf diesem Weg werden als frühe Dendriten, frühe Ausbreitung und Ausbreitung bezeichnet. Die Oberfläche des nicht aktivierten Blutplättchens sieht der Oberfläche des Gehirns sehr ähnlich, mit einem faltigen Aussehen durch zahlreiche flache Falten zur Vergrößerung der Oberfläche; früh dendritisch, ein Krake mit mehreren Armen und Beinen; früh gespreizt, ein ungekochtes Bratei in einer Pfanne, wobei das "Eigelb" der zentrale Körper ist; und die Spreizung, ein gekochtes Spiegelei mit einem dichteren zentralen Körper. ⓘ
All diese Veränderungen werden durch die Interaktion des Mikrotubuli/Aktin-Komplexes mit der Zellmembran der Blutplättchen und dem offenen kanalikulären System (OCS), einer Erweiterung und Einstülpung dieser Membran, hervorgerufen. Dieser Komplex verläuft direkt unter diesen Membranen und ist der chemische Motor, der das invaginierte OCS buchstäblich aus dem Inneren des Blutplättchens herauszieht, so als würde man die Hosentaschen von innen nach außen drehen, wodurch die Dendriten entstehen. Dieser Prozess ähnelt dem Mechanismus der Kontraktion einer Muskelzelle. Das gesamte OCS ist somit nicht mehr von der ursprünglichen Thrombozytenmembran zu unterscheiden und bildet das "Spiegelei". Diese dramatische Vergrößerung der Oberfläche wird weder durch Dehnung noch durch Zugabe von Phospholipiden zur Thrombozytenmembran erreicht. ⓘ
Wechselwirkungen zwischen Thrombozyten und Gerinnungsfaktoren: Erleichterung der Gerinnung
Die Aktivierung der Thrombozyten führt dazu, dass ihre Membranoberfläche negativ geladen wird. Einer der Signalwege schaltet die Scramblase ein, die negativ geladene Phospholipide von der inneren zur äußeren Plättchenmembranoberfläche verschiebt. Diese Phospholipide binden dann die Tenase- und Prothrombinase-Komplexe, zwei der Stellen, an denen die Blutplättchen mit der Gerinnungskaskade zusammenwirken. Calciumionen sind für die Bindung dieser Gerinnungsfaktoren unerlässlich. ⓘ
Zusätzlich zur Interaktion mit vWF und Fibrin interagieren Thrombozyten mit Thrombin, den Faktoren X, Va, VIIa, XI, IX und Prothrombin, um die Bildung über die Gerinnungskaskade abzuschließen. Sechs Studien legten nahe, dass Thrombozyten Gewebefaktor exprimieren: die endgültige Studie zeigt, dass sie es nicht tun. Es konnte nachgewiesen werden, dass Rattenplättchen Gewebefaktorprotein exprimieren und dass die Rattenplättchen sowohl die prä-mRNA als auch die reife mRNA des Gewebefaktors tragen. ⓘ
Verklumpung

Die Aggregation beginnt Minuten nach der Aktivierung und wird durch die Aktivierung des GPIIb/IIIa-Rezeptors ausgelöst, so dass sich diese Rezeptoren mit vWF oder Fibrinogen verbinden können. Pro Blutplättchen gibt es etwa 60.000 dieser Rezeptoren. Wenn einer oder mehrere der mindestens neun verschiedenen Oberflächenrezeptoren der Thrombozyten während der Aktivierung eingeschaltet werden, bewirken die Signalwege innerhalb der Thrombozyten, dass die vorhandenen GpIIb/IIIa-Rezeptoren ihre Form ändern - von gewellt zu gerade - und so zur Bindung fähig werden. ⓘ
Da Fibrinogen ein stäbchenförmiges Protein mit Knötchen an beiden Enden ist, die GPIIb/IIIa binden können, können aktivierte Thrombozyten mit exponiertem GPIIb/IIIa Fibrinogen binden und aggregieren. GPIIb/IIIa kann die Thrombozyten auch an subendothelialen vWF verankern, um die Struktur zusätzlich zu stabilisieren. ⓘ
Klassischerweise ging man davon aus, dass dies der einzige Mechanismus ist, der an der Aggregation beteiligt ist. Es wurden jedoch drei neue Mechanismen identifiziert, die die Aggregation in Abhängigkeit von der Geschwindigkeit des Blutflusses (d. h. dem Scherbereich) auslösen können. ⓘ
Reparatur von Wunden
Das Blutgerinnsel ist nur eine vorübergehende Lösung, um die Blutung zu stoppen; das Gewebe muss repariert werden. Kleine Unterbrechungen im Endothel werden durch physiologische Mechanismen behoben, große Unterbrechungen durch den Unfallchirurgen. Das Fibrin wird langsam durch das fibrinolytische Enzym Plasmin aufgelöst, und die Blutplättchen werden durch Phagozytose beseitigt. ⓘ
Immunfunktion
Thrombozyten spielen eine zentrale Rolle in der angeborenen Immunität. Sie initiieren und beteiligen sich an zahlreichen Entzündungsprozessen, binden direkt Krankheitserreger und zerstören sie sogar. Dies stützt klinische Daten, die zeigen, dass viele Menschen mit schweren bakteriellen oder viralen Infektionen eine Thrombozytopenie aufweisen, wodurch ihr Beitrag zur Entzündung verringert wird. Auch Thrombozyten-Leukozyten-Aggregate (PLAs), die im Blutkreislauf gefunden werden, sind typisch für Sepsis oder entzündliche Darmerkrankungen und zeigen die Verbindung zwischen Thrombozyten und Immunzellen im engeren Sinne. ⓘ
Immunthrombose
Da die Blutstillung eine grundlegende Funktion der Thrombozyten bei Säugetieren ist, wird sie auch bei der Eindämmung möglicher Infektionen eingesetzt. Im Falle einer Verletzung bilden die Blutplättchen zusammen mit der Gerinnungskaskade die erste Verteidigungslinie, indem sie ein Blutgerinnsel bilden. Hämostase und Wirtsabwehr waren also in der Evolution miteinander verwoben. Bei der atlantischen Hufeisenkrabbe (ein lebendes Fossil, das auf ein Alter von über 400 Millionen Jahren geschätzt wird) beispielsweise erleichtert der einzige Blutzelltyp, der Amöbozyt, sowohl die hämostatische Funktion als auch die Einkapselung und Phagozytose von Krankheitserregern durch die Exozytose intrazellulärer Granula, die bakterizide Abwehrmoleküle enthalten. Die Blutgerinnung unterstützt die Immunfunktion, indem sie die pathogenen Bakterien in ihrem Inneren festhält. ⓘ
Obwohl die Thrombose, d. h. die Blutgerinnung in intakten Blutgefäßen, in der Regel als pathologische Immunreaktion betrachtet wird, die zum Verschluss des Gefäßlumens und zu einer anschließenden hypoxischen Gewebeschädigung führt, kann in einigen Fällen eine gezielte Thrombose, die so genannte Immunthrombose, die Ausbreitung der Infektion lokal kontrollieren. Die Thrombose wird durch das Zusammenwirken von Blutplättchen, Neutrophilen und Monozyten gesteuert. Der Prozess wird entweder von Immunzellen sensu stricto durch Aktivierung ihrer Mustererkennungsrezeptoren (PRRs) oder durch Bindung von Thrombozyten an Bakterien ausgelöst. Thrombozyten können sich entweder direkt über thrombozytäre PRRs und bakterielle Oberflächenproteine an Bakterien binden oder über Plasmaproteine, die sowohl an Thrombozyten als auch an Bakterien binden. Monozyten reagieren auf bakterielle pathogen-assoziierte molekulare Muster (PAMPs) oder schadensassoziierte molekulare Muster (DAMPs), indem sie den extrinsischen Weg der Blutgerinnung aktivieren. Neutrophile erleichtern die Blutgerinnung durch NETosis. Die Thrombozyten wiederum unterstützen die NETosis der Neutrophilen. NETs binden Gewebefaktoren und binden die Gerinnungszentren an den Ort der Infektion. Sie aktivieren auch den intrinsischen Gerinnungsweg, indem sie dem Faktor XII ihre negativ geladene Oberfläche zur Verfügung stellen. Andere neutrophile Sekrete, wie proteolytische Enzyme, die Gerinnungsinhibitoren abspalten, unterstützen den Prozess ebenfalls. ⓘ
Kommt es bei der Regulierung der Immunthrombose zu einem Ungleichgewicht, kann dieser Prozess schnell aus dem Ruder laufen. Regulationsstörungen der Immunthrombose stehen im Verdacht, ein Hauptfaktor bei der Entstehung pathologischer Thrombosen in vielen Formen zu sein, wie z. B. der disseminierten intravasalen Gerinnung (DIC) oder der tiefen Venenthrombose. Die DIC bei Sepsis ist ein Paradebeispiel für einen dysregulierten Gerinnungsprozess und eine übermäßige systemische Entzündungsreaktion, die zu einer Vielzahl von Mikrothromben führt, die eine ähnliche Zusammensetzung aufweisen wie bei der physiologischen Immunthrombose - Fibrin, Blutplättchen, Neutrophile und NETs. ⓘ
Entzündung
Thrombozyten gelangen schnell an den Ort einer Verletzung oder Infektion und können Entzündungsprozesse modulieren, indem sie mit Leukozyten interagieren und Zytokine, Chemokine und andere Entzündungsmediatoren absondern. Thrombozyten sezernieren auch den aus Blutplättchen gewonnenen Wachstumsfaktor (PDGF). ⓘ
Thrombozyten modulieren Neutrophile, indem sie Thrombozyten-Leukozyten-Aggregate (PLAs) bilden. Diese Formationen führen zu einer erhöhten Produktion von αmβ2 (Mac-1) Integrin in Neutrophilen. Die Interaktion mit PLAs führt auch zur Degranulation und verstärkten Phagozytose bei Neutrophilen. Thrombozyten sind auch die größte Quelle für lösliches CD40L, das die Produktion reaktiver Sauerstoffspezies (ROS) induziert und die Expression von Adhäsionsmolekülen wie E-Selektin, ICAM-1 und VCAM-1 in Neutrophilen hochreguliert, Makrophagen aktiviert und die zytotoxische Reaktion in T- und B-Lymphozyten auslöst. ⓘ
Kürzlich wurde das Dogma durchbrochen, dass Säugetierplättchen ohne Zellkern nicht in der Lage sind, sich autonom fortzubewegen. Tatsächlich sind die Thrombozyten aktive Fresszellen, die die Wände der Blutgefäße abkratzen und den Thrombus neu organisieren. Sie sind in der Lage, viele Oberflächen zu erkennen und daran zu haften, darunter auch Bakterien. Sie sind sogar in der Lage, diese vollständig in ihr offenes kanalikuläres System (OCP) einzuhüllen, was dazu führt, dass der Prozess nicht Phagozytose, sondern "Covercytose" genannt wird, da das OCS lediglich eine Einstülpung der äußeren Plasmamembran ist. Diese Thrombozyten-Bakterien-Bündel werden dann als Interaktionsplattform für Neutrophile genutzt, die die Bakterien mit Hilfe der NETose und der Phagozytose zerstören. ⓘ
Thrombozyten sind auch an chronischen Entzündungskrankheiten wie Synovitis oder rheumatischer Arthritis beteiligt. Thrombozyten werden durch den Kollagenrezeptor Glykoprotein IV (GPVI) aktiviert. Proinflammatorische Thrombozyten-Mikrovesikel lösen eine konstante Zytokinsekretion aus benachbarten fibroblastenähnlichen Synoviozyten aus, vor allem Il-6 und Il-8. Durch die entzündliche Schädigung der umgebenden extrazellulären Matrix wird kontinuierlich mehr Kollagen freigesetzt, wodurch die Produktion von Mikrovesikeln aufrechterhalten wird. ⓘ
Adaptive Immunität
Aktivierte Blutplättchen sind in der Lage, an der adaptiven Immunität teilzunehmen, indem sie mit Antikörpern interagieren. Sie sind in der Lage, IgG über FcγRIIA, den Rezeptor für das konstante Fragment (Fc) von IgG, spezifisch zu binden. Wenn die Thrombozyten aktiviert und an mit IgG opsonisierte Bakterien gebunden werden, setzen sie anschließend reaktive Sauerstoffspezies (ROS), antimikrobielle Peptide, Defensine, Kinocidine und Proteasen frei und töten die Bakterien direkt ab. Thrombozyten sezernieren auch entzündungsfördernde und gerinnungsfördernde Mediatoren wie anorganische Polyphosphate oder den Thrombozytenfaktor 4 (PF4), der die angeborene und die adaptive Immunantwort miteinander verbindet. ⓘ
Anzeichen und Symptome von Störungen
Spontane und übermäßige Blutungen können aufgrund von Störungen der Blutplättchen auftreten. Diese Blutungen können durch einen Mangel an Blutplättchen, eine Funktionsstörung der Blutplättchen oder eine sehr hohe Anzahl von Blutplättchen (über 1,0 Millionen/Mikroliter) verursacht werden. (Die überhöhte Anzahl führt zu einem relativen Mangel an von-Willebrand-Faktor aufgrund von Sequestrierung). ⓘ
Anhand der Merkmale und des Ortes der Blutung kann man erkennen, ob die Blutung auf eine Störung der Blutplättchen oder eine Störung der Gerinnungsfaktoren zurückzuführen ist. Alle folgenden Merkmale deuten auf eine Thrombozytenblutung und nicht auf eine Gerinnungsstörung hin: die Blutung aus einem Hautschnitt, z. B. einer Rasierklinge, ist schnell und stark, kann aber durch Druck kontrolliert werden; spontane Blutungen in die Haut, die einen violetten Fleck verursachen, der nach seiner Größe benannt wird: Petechien, Purpura, Ekchymosen; Blutungen in Schleimhäute, die Zahnfleischbluten, Nasenbluten und gastrointestinale Blutungen verursachen; Menorrhagie sowie intraretinale und intrakranielle Blutungen. ⓘ
Eine übermäßige Anzahl von Blutplättchen und/oder normale Blutplättchen, die auf abnorme Gefäßwände reagieren, können zu Venenthrombosen und arteriellen Thrombosen führen. Die Symptome hängen von der Stelle ab, an der die Thrombose auftritt. ⓘ
Tests der Funktion

Blutungszeit
Die Blutungszeit wurde erstmals 1910 von Duke als Test für die Thrombozytenfunktion entwickelt. Mit dem Test von Duke wurde die Zeit gemessen, die benötigt wurde, um die Blutung aus einer standardisierten Wunde im Ohrläppchen zu stoppen, die alle 30 Sekunden abgetupft wurde. Die normale Zeit bis zum Stillstand der Blutung betrug weniger als 3 Minuten. Heute werden modernere Techniken verwendet. Eine normale Blutungszeit spiegelt eine ausreichende Anzahl und Funktion der Blutplättchen sowie eine normale Mikrovaskulatur wider. ⓘ
Aggregometrie mit mehreren Elektroden
Bei der Aggregometrie mit mehreren Elektroden wird antikoaguliertes Vollblut mit Kochsalzlösung und einem Thrombozytenagonisten in einer Einwegküvette mit zwei Elektrodenpaaren gemischt. Der Anstieg der Impedanz zwischen den Elektroden, wenn Thrombozyten an ihnen aggregieren, wird gemessen und als Kurve dargestellt. ⓘ
| ADP | Epinephrin | Kollagen | Ristocetin ⓘ | |
|---|---|---|---|---|
| P2Y-Rezeptordefekt (einschließlich Clopidogrel) | Verringert | Normal | Normal | Normal |
| Defekt des adrenergen Rezeptors | Normal | Verringert | Normal | Normal |
| Kollagenrezeptordefekt | Normal | Normal | Verringert oder nicht vorhanden | Normal |
|
Normal | Normal | Normal | Verringert oder nicht vorhanden |
|
Verringert | Verringert | Verringert | Normal oder vermindert |
| Mangel an Speicherpools | Fehlende zweite Welle | Teilweise | ||
| Aspirin oder Aspirin-ähnliche Störung | Fehlende zweite Welle | Fehlend | Normal | |
Lichttransmissionsaggregometrie
Bei der Lichttransmissionsaggregometrie (LTA) wird plättchenreiches Plasma zwischen einer Lichtquelle und einer Fotozelle angeordnet. Unaggregiertes Plasma lässt relativ wenig Licht durch. Nach Zugabe eines Agonisten aggregieren die Thrombozyten, was zu einer größeren Lichtdurchlässigkeit führt, die von der Fotozelle erfasst wird. ⓘ
PFA-100
Der PFA-100 (Platelet Function Assay - 100) ist ein System zur Analyse der Thrombozytenfunktion, bei dem zitriertes Vollblut durch eine Einwegkartusche gesaugt wird, die eine Öffnung innerhalb einer Membran enthält, die entweder mit Kollagen und Epinephrin oder Kollagen und ADP beschichtet ist. Diese Agonisten induzieren die Thrombozytenadhäsion, -aktivierung und -aggregation, was zu einem raschen Verschluss der Öffnung und zur Unterbrechung des Blutflusses führt, was als Verschlusszeit (CT) bezeichnet wird. Eine erhöhte CT mit EPI und Kollagen kann auf intrinsische Defekte wie die von-Willebrand-Krankheit, Urämie oder zirkulierende Thrombozyteninhibitoren hinweisen. Der Folgetest mit Kollagen und ADP wird verwendet, um festzustellen, ob die abnorme CT mit Kollagen und EPI durch die Wirkung von Acetylsulfosalicylsäure (Aspirin) oder Medikamenten mit Hemmstoffen verursacht wurde. ⓘ
Störungen
Adaptiert von: Die drei großen Kategorien von Thrombozytenstörungen sind "zu wenig", "dysfunktional" und "zu viele". ⓘ
Thrombozytopenie
- Immunthrombozytopenien (ITP) - früher bekannt als immunthrombozytopenische Purpura und idiopathische thrombozytopenische Purpura
- Splenomegalie
- Gaucher-Krankheit
- Familiäre Thrombozytopenie
- Chemotherapie
- Babesiose
- Dengue-Fieber
- Onyalai
- Thrombotische thrombozytopenische Purpura
- HELLP-Syndrom
- Hämolytisch-urämisches Syndrom
- Medikamenteninduzierte thrombozytopenische Purpura (fünf bekannte Medikamente - am problematischsten ist die Heparin-induzierte Thrombozytopenie (HIT)
- Schwangerschaft-assoziiert
- Neonatal alloimmun-assoziiert
- Aplastische Anämie
- Transfusions-assoziiert
- Pseudothrombozytopenie
- Idiopathische thrombozytopenische Purpura
- Durch Impfung induzierte Immunthrombozytopenie
- Gilbert-Syndrom ⓘ
Veränderte Thrombozytenfunktion (Thrombozytopathie)
Bei den Blutplättchen gibt es drei Arten der Störung oder Abweichung. Unterschieden werden dabei primäre (meist genetisch bedingte) Abweichungen, die manchmal auch idiopathisch oder essentiell genannt werden, von sekundären Abweichungen aufgrund einer anderen zugrundeliegenden Erkrankung oder Störung. Die drei Arten der Abweichung sind:
- Thrombozytopenie: Verminderte Konzentration der Blutplättchen im Blut mit Werten unter 150.000/µl. Unter 80.000/µl ist mit einer erhöhten Blutungsneigung zu rechnen, unter 50.000/µl kann es zu spontanen Blutungen (Nasenbluten, Blutergüsse) kommen. Konzentrationen unter 10.000/µl müssen bei medizinischer Notwendigkeit intensiv überwacht und gegebenenfalls mit Thrombozyten-Konzentraten behandelt werden.
Ursachen können in einer verminderten Bildung, einem erhöhten Abbau oder Verbrauch liegen. Primäre, genetisch bedingte Ursachen einer Thrombozytopenie sind z. b. TAR-Syndrom, Wiskott-Aldrich-Syndrom, Jacobsen-Syndrom oder der Morbus Gaucher. Auch unter medikamentöser Therapie kann es gelegentlich zu einer Thrombozytopenie kommen, als sehr selten aber sehr gefährlich gilt dabei die durch Heparin oder andere niedermolekulare Heparine ausgelöste Heparin-induzierte Thrombozytopenie.
In der Schwangerschaft ist die Zahl der Thrombozyten im Blut häufig erniedrigt. Etwa 5–10 % der Schwangeren haben weniger als 150.000 Thrombozyten/µl. Bei Werten unter 100.000/µl sollten andere Ursachen als die Schwangerschaft oder eine Schwangerschaftskomplikation in Betracht gezogen werden. ⓘ
- Thrombozytose: Erhöhte Konzentration der Blutplättchen im Blut mit Werten über 450.000/µl, die mit einem Risiko für arterielle Thrombosen verbunden sein kann.
Eine primäre Ursache kann die Essentielle Thrombozythämie sein, eine Myeloproliferative Neoplasie.
Häufiger aber ist eine sekundäre Thrombozytose, auch "reaktiv" genannt, etwa nach einer Milzentfernung (Splenektomie), bei bösartigen Tumoren oder chronisch-entzündlichen Erkrankungen (z. B. Morbus Crohn, rheumatische Erkrankungen), aber auch beispielsweise bei chronischem Eisenmangel oder nach akutem Blutverlust. Eine erhöhte Thrombozytenkonzentration kann auch ein allgemeiner Hinweis auf eine systemische Entzündung sein, assoziiert mit einer Aktivierung des proinflammatorischen Mediators Interleukin-6. ⓘ
- Thrombozytopathie: Funktionsstörung der Blutplättchen ohne oder mit nur geringfügiger Veränderung der Konzentration im Blut, die mit einer erhöhten Blutungsneigung einhergeht. Störungen betreffen die Funktion der Thrombozyten, also vor allem die Adhäsion und die Aggregation.
Die bekanntesten angeborenen Thrombozytenfunktionsstörungen sind die Glanzmann-Thrombasthenie, die mit einer mangelnden Aggregation der Thrombozyten einhergeht, sowie das Bernard-Soulier-Syndrom, eine Thrombozyten-Dystrophie mit Thrombozytopenie und erheblich vergrößerten Thrombozyten, „Riesenthrombozyten“, das sich durch eine Adhäsionsstörung auszeichnet.
Beim von-Willebrand-Syndrom liegt eine Koagulopathie vor mit einer Verminderung oder Funktionsstörung des Von-Willebrand-Faktors, wodurch die Thrombozytenadhäsion sekundär gestört ist und es zu einer gesteigerten Blutungsneigung kommt (auch Hämorrhagische Diathese genannt). Daneben sind aber die sekundären Thrombozytopathien durch exogene Ursachen viel häufiger, teilweise auch therapeutisch gewollt. Die Medikamentengruppe der Thrombozytenaggregationshemmer, zu denen z. B. Clopidogrel, und vor allem Acetylsalicylsäure zählt, wird sehr häufig zur Vorbeugung und Behandlung von Schlaganfällen, Herzinfarkten und anderen Durchblutungsstörungen eingesetzt. Aber auch bei Penicillin und Entzündungshemmern wie Diclofenac sowie bei einigen Chemotherapeutika in der Krebstherapie kann es zu einer Funktionsstörung kommen. ⓘ
- Angeborene
- Störungen der Adhäsion
- Bernard-Soulier-Syndrom
- Störungen der Aktivierung
- Störungen der Granulatmenge oder -freisetzung
- Hermansky-Pudlak-Syndrom
- Graues-Plättchen-Syndrom
- ADP-Rezeptor-Defekt
- Verminderte Cyclooxygenase-Aktivität
- Mangel an Thrombozytenspeicherpools
- Störungen der Aggregation
- Glanzmannsche Thrombasthenie
- Wiskott-Aldrich-Syndrom
- Störungen der Gerinnungsaktivität
- COAT-Plättchen-Defekt
- Scott-Syndrom
- Störungen der Adhäsion
- Erworbene
Thrombozytose und Thrombozythämie
- Reaktiv
- Chronische Infektion
- Chronische Entzündung
- Bösartigkeit
- Hyposplenismus (nach Plenektomie)
- Eisenmangel
- Akuter Blutverlust
- Myeloproliferative Neoplasmen - Thrombozyten sind sowohl erhöht als auch aktiviert
- Essentielle Thrombozythämie
- Polyzythämie vera
- Assoziiert mit anderen myeloischen Neoplasmen
- Angeborene ⓘ
Beeinflussende Medikamente
Entzündungshemmende Medikamente
Einige Medikamente, die zur Behandlung von Entzündungen eingesetzt werden, haben die unerwünschte Nebenwirkung, die normale Thrombozytenfunktion zu unterdrücken. Dies sind die nicht-steroidalen Antirheumatika (NSAIDS). Aspirin unterbricht die Funktion der Blutplättchen irreversibel, indem es die Cyclooxygenase-1 (COX1) und damit die normale Blutstillung hemmt. Die so entstandenen Thrombozyten sind nicht in der Lage, neue Cyclooxygenase zu produzieren, da sie keine DNA besitzen. Die normale Thrombozytenfunktion kehrt erst zurück, wenn die Einnahme von Aspirin beendet ist und genügend der betroffenen Thrombozyten durch neue ersetzt wurden, was über eine Woche dauern kann. Ibuprofen, ein weiteres NSAID, wirkt nicht so lange, die Thrombozytenfunktion kehrt in der Regel innerhalb von 24 Stunden zurück, und die Einnahme von Ibuprofen vor Aspirin verhindert die irreversiblen Auswirkungen von Aspirin. ⓘ
Medikamente, die die Thrombozytenfunktion unterdrücken
Diese Medikamente werden eingesetzt, um die Bildung von Thromben zu verhindern. ⓘ
Orale Wirkstoffe
- Aspirin
- Clopidogrel
- Cilostazol
- Ticlopidin
- Ticagrelor
- Prasugrel ⓘ
Medikamente, die die Thrombozytenproduktion stimulieren
- Thrombopoietin-Mimetika
- Desmopressin
- Faktor VIIa ⓘ
Intravenöse Mittel
- Abciximab
- Eptifibatid
- Tirofiban
- Andere: Oprelvekin, Romiplostim, Eltrombopag, Argatroban ⓘ
Therapie mit Blutplättchen
Transfusion
Indikationen
Die Thrombozytentransfusion wird am häufigsten zur Korrektur ungewöhnlich niedriger Thrombozytenzahlen eingesetzt, entweder um spontane Blutungen zu verhindern (typischerweise bei Werten unter 10×109/L) oder in Erwartung medizinischer Eingriffe, die zwangsläufig mit Blutungen verbunden sind. Bei Patienten, die sich einem chirurgischen Eingriff unterziehen, wird beispielsweise ein Wert unter 50×109/L mit abnormalen chirurgischen Blutungen in Verbindung gebracht, und bei Werten unter 80×109/L werden regionale Anästhesieverfahren wie Epidurale vermieden. Thrombozyten können auch transfundiert werden, wenn die Thrombozytenzahl normal ist, die Thrombozyten aber nicht richtig funktionieren, z. B. wenn eine Person Aspirin oder Clopidogrel einnimmt. Schließlich können Thrombozyten im Rahmen eines Massentransfusionsprotokolls transfundiert werden, bei dem die drei wichtigsten Blutbestandteile (rote Blutkörperchen, Plasma und Thrombozyten) zur Behandlung schwerer Blutungen transfundiert werden. Die Transfusion von Blutplättchen ist bei thrombotischer thrombozytopenischer Purpura (TTP) kontraindiziert, da sie die Koagulopathie verstärkt. ⓘ
Sammlung

Thrombozyten werden entweder aus gesammelten Vollbluteinheiten isoliert und zu einer therapeutischen Dosis zusammengeführt oder durch Thrombozytenapherese gewonnen: Dem Spender wird Blut entnommen, durch ein Gerät geleitet, das die Thrombozyten entfernt, und der Rest wird dem Spender in einem geschlossenen Kreislauf zurückgegeben. Der Industriestandard sieht vor, dass die Thrombozyten vor der Transfusion auf Bakterien getestet werden, um septische Reaktionen zu vermeiden, die tödlich sein können. Seit kurzem erlauben die AABB-Industriestandards für Blutbanken und Transfusionsdienste (5.1.5.1) den Einsatz von Technologien zur Reduzierung von Krankheitserregern als Alternative zu bakteriellen Untersuchungen von Blutplättchen. ⓘ
Gepoolte Vollblut-Thrombozyten, manchmal auch "zufällige" Thrombozyten genannt, werden mit einer von zwei Methoden abgetrennt. In den USA wird eine Einheit Vollblut in einer großen Zentrifuge im so genannten "Soft Spin" zentrifugiert. Bei diesen Einstellungen bleiben die Blutplättchen im Plasma suspendiert. Das plättchenreiche Plasma (PRP) wird von den Erythrozyten abgetrennt und dann bei einer schnelleren Einstellung zentrifugiert, um die Blutplättchen aus dem Plasma zu gewinnen. In anderen Regionen der Welt wird die Vollbluteinheit mit einer Einstellung zentrifugiert, bei der die Thrombozyten in der Buffy-Coat-Schicht", die die Thrombozyten und die weißen Blutkörperchen enthält, suspendiert werden. Der "Buffy Coat" wird in einem sterilen Beutel isoliert, in einer kleinen Menge roter Blutkörperchen und Plasma suspendiert und dann erneut zentrifugiert, um die Blutplättchen und das Plasma von den roten und weißen Blutkörperchen zu trennen. Unabhängig von der anfänglichen Aufbereitungsmethode können mehrere Spenden mit Hilfe einer sterilen Verbindungsvorrichtung in einem Behälter kombiniert werden, um ein einziges Produkt mit der gewünschten therapeutischen Dosis herzustellen. ⓘ
Apherese-Thrombozyten werden mit einem mechanischen Gerät gewonnen, das dem Spender Blut abnimmt und das gesammelte Blut zentrifugiert, um die Thrombozyten und andere zu gewinnende Bestandteile abzutrennen. Das restliche Blut wird dem Spender zurückgegeben. Der Vorteil dieser Methode besteht darin, dass mit einer einzigen Spende mindestens eine therapeutische Dosis verabreicht wird, im Gegensatz zu den Mehrfachspenden von Vollblut-Thrombozyten. Dies bedeutet, dass der Empfänger nicht so vielen verschiedenen Spendern ausgesetzt ist und ein geringeres Risiko für durch Transfusionen übertragene Krankheiten und andere Komplikationen hat. Manchmal erhält eine Person, z. B. ein Krebspatient, der regelmäßig Thrombozytentransfusionen benötigt, wiederholte Spenden von einem bestimmten Spender, um das Risiko weiter zu minimieren. Die Pathogenreduzierung von Thrombozyten, z. B. durch Riboflavin- und UV-Licht-Behandlung, kann ebenfalls durchgeführt werden, um die infektiöse Belastung durch Krankheitserreger in gespendeten Blutprodukten zu reduzieren und so das Risiko der Übertragung von durch Transfusionen übertragenen Krankheiten zu verringern. Ein weiteres photochemisches Behandlungsverfahren, bei dem Amotosalen und UVA-Licht zum Einsatz kommen, wurde zur Inaktivierung von Viren, Bakterien, Parasiten und Leukozyten entwickelt, die die zur Transfusion bestimmten Blutkomponenten kontaminieren können. Darüber hinaus enthalten Apherese-Thrombozyten in der Regel weniger kontaminierende rote Blutkörperchen, da die Entnahmemethode bei der Isolierung des gewünschten Blutbestandteils effizienter ist als die "Soft Spin"-Zentrifugation. ⓘ
Lagerung
Mit beiden Methoden gewonnene Thrombozyten haben eine sehr kurze Haltbarkeit, in der Regel fünf Tage. Dies führt häufig zu Engpässen bei der Versorgung, da die Untersuchung der Spenden oft bis zu einem ganzen Tag in Anspruch nimmt. Da es keine wirksamen Konservierungsmittel für Thrombozyten gibt, verlieren sie schnell an Wirksamkeit und sind am besten frisch zu lagern. ⓘ
Thrombozyten werden unter ständiger Bewegung bei 20-24 °C (68-75,2 °F) gelagert. Die Einheiten dürfen nicht gekühlt werden, da dies dazu führt, dass die Thrombozyten ihre Form verändern und ihre Funktion verlieren. Die Lagerung bei Raumtemperatur bietet eine Umgebung, in der sich Bakterien, die während des Entnahmevorgangs in den Blutbestandteil gelangen, vermehren und in der Folge beim Patienten eine Bakteriämie verursachen können. In den Vereinigten Staaten gibt es Vorschriften, nach denen die Produkte vor der Transfusion auf bakterielle Verunreinigungen getestet werden müssen. ⓘ

Lieferung an die Empfänger
Thrombozyten müssen nicht derselben Blutgruppe (A-B-O) angehören wie der Empfänger oder kreuzverwandt sein, um die Immunkompatibilität zwischen Spender und Empfänger zu gewährleisten, es sei denn, sie enthalten eine erhebliche Menge roter Blutkörperchen (RBC). Das Vorhandensein von Erythrozyten verleiht dem Produkt eine rötlich-orange Farbe und wird normalerweise mit Vollblutplättchen in Verbindung gebracht. Manchmal wird versucht, typspezifische Thrombozyten auszugeben, aber dies ist nicht so entscheidend wie bei den Erythrozyten. ⓘ
Bevor die Thrombozyten an den Empfänger abgegeben werden, können sie bestrahlt werden, um eine transfusionsassoziierte Graft-versus-Host-Krankheit zu verhindern, oder sie können gewaschen werden, um das Plasma zu entfernen, falls dies erforderlich ist. ⓘ
Die Veränderung der Thrombozytenzahl des Empfängers nach der Transfusion wird als "Inkrement" bezeichnet und durch Subtraktion der Thrombozytenzahl vor der Transfusion von der Thrombozytenzahl nach der Transfusion berechnet. Viele Faktoren beeinflussen das Inkrement, darunter die Körpergröße des Empfängers, die Anzahl der transfundierten Blutplättchen und klinische Merkmale, die zu einer vorzeitigen Zerstörung der transfundierten Blutplättchen führen können. Wenn der Empfänger nach der Transfusion keinen angemessenen Anstieg der Thrombozytenzahl nachweisen kann, wird dies als Thrombozytentransfusionsrefraktär bezeichnet. ⓘ
Thrombozyten, die entweder durch Apherese oder nach dem Zufallsprinzip gespendet wurden, können durch ein Verfahren zur Volumenreduktion verarbeitet werden. Bei diesem Verfahren werden die Thrombozyten in einer Zentrifuge geschleudert und das überschüssige Plasma entfernt, so dass 10 bis 100 ml Thrombozytenkonzentrat übrig bleiben. Solche volumenreduzierten Thrombozyten werden normalerweise nur Neugeborenen und pädiatrischen Patienten transfundiert, wenn ein großes Plasmavolumen das kleine Kreislaufsystem des Kindes überlasten könnte. Das geringere Plasmavolumen verringert auch das Risiko einer unerwünschten Transfusionsreaktion auf Plasmaproteine. Volumenreduzierte Thrombozyten haben eine Haltbarkeit von nur vier Stunden. ⓘ
Behandlung von Wunden
Thrombozyten setzen den aus Blutplättchen gewonnenen Wachstumsfaktor (PDGF), ein starkes chemotaktisches Mittel, sowie TGF beta, der die Ablagerung von extrazellulärer Matrix stimuliert, Fibroblasten-Wachstumsfaktor, insulinähnlichen Wachstumsfaktor 1, aus Blutplättchen gewonnenen epidermalen Wachstumsfaktor und vaskulären endothelialen Wachstumsfaktor frei. Die lokale Anwendung dieser Faktoren in erhöhten Konzentrationen durch plättchenreiches Plasma (PRP) wird als Hilfsmittel bei der Wundheilung eingesetzt. ⓘ
Andere Tiere
Wirbeltiere, die keine Säugetiere sind, haben keine Blutplättchen, sondern kernhaltige Thrombozyten, die in ihrer Morphologie den B-Lymphozyten ähneln. Sie aggregieren als Reaktion auf Thrombin, nicht aber auf ADP, Serotonin oder Adrenalin, wie dies bei Blutplättchen der Fall ist. ⓘ
Geschichte
- George Gulliver zeichnete 1841 Bilder von Blutplättchen unter Verwendung des 1830 von Joseph Jackson Lister erfundenen Doppellinsenmikroskops (Compound). Mit diesem Mikroskop konnte die Auflösung so weit verbessert werden, dass es erstmals möglich war, Blutplättchen zu sehen.
- William Addison zeichnete 1842 Bilder von einem Thrombozyten-Fibringerinnsel.
- Lionel Beale veröffentlichte 1864 als erster eine Zeichnung, die Blutplättchen zeigte.
- Max Schultze beschrieb 1865 so genannte "Kügelchen", die viel kleiner als rote Blutkörperchen waren, gelegentlich verklumpten und manchmal in Ansammlungen von Fibrinmaterial gefunden wurden.
- Giulio Bizzozero untersuchte 1882 das Blut von Amphibien mikroskopisch in vivo. Er nannte Schultze's spherules (It.) piastrine: kleine Plättchen. Einem Artikel im Scientific American zufolge schlug Bizzozero den Namen Blutplättchen vor.
- William Osler beobachtete Thrombozyten und bezeichnete sie in seinen 1886 veröffentlichten Vorlesungen als drittes Blutkörperchen und Blutplättchen; er beschrieb sie als "farblose protoplasmatische Scheibe".
- James Wright untersuchte Blutausstriche mit der nach ihm benannten Färbung und verwendete in seiner Veröffentlichung von 1906 den Begriff Plättchen, änderte ihn jedoch in seiner Veröffentlichung von 1910 in Thrombozyten, was zum allgemein anerkannten Begriff geworden ist. ⓘ
Der Begriff Thrombozyt (Gerinnungszelle) kam in den frühen 1900er Jahren in Gebrauch und wird manchmal als Synonym für Thrombozyten verwendet, aber nicht allgemein in der wissenschaftlichen Literatur, außer als Wortstamm für andere Begriffe, die mit Thrombozyten zu tun haben (z. B. Thrombozytopenie bedeutet niedrige Thrombozyten). Der Begriff Thrombozyten ist die richtige Bezeichnung für mononukleäre Zellen, die im Blut von Wirbeltieren, die keine Säugetiere sind, vorkommen: Sie sind das funktionelle Äquivalent der Blutplättchen, zirkulieren aber als intakte Zellen und nicht als zytoplasmatische Fragmente von Megakaryozyten des Knochenmarks. ⓘ
In manchen Kontexten wird das Wort Thrombus austauschbar mit dem Wort Gerinnsel verwendet, unabhängig von seiner Zusammensetzung (weiß, rot oder gemischt). In anderen Zusammenhängen wird der Begriff verwendet, um ein normales von einem anormalen Gerinnsel zu unterscheiden: Ein Thrombus entsteht durch physiologische Blutstillung, eine Thrombose durch eine pathologische und übermäßige Menge an Gerinnsel. In einem dritten Zusammenhang wird er verwendet, um das Ergebnis vom Prozess zu unterscheiden: Thrombus ist das Ergebnis, Thrombose ist der Prozess. ⓘ
Vermutlich wurden Thrombozyten 1844 von Alfred Donné (1801–1878) zum ersten Mal als „Kügelchen“ im Blutplasma beschrieben (De l’órigine d. glob. du sang etc. Comptes rend. Soc. Biolog. 1844, t. XIV). 1865 beschrieb Max Schultze sie wesentlich genauer im Archiv für mikroscopische Anatomie, erkannte sie jedoch nicht als eigene Zellart, sondern hielt sie für Abbauprodukte. Giulio Bizzozero korrigierte 1883 diesen Irrtum und erkannte auch als erster die Funktion der Thrombozyten bei der Blutgerinnung. ⓘ
Wirtschaftliche Anwendung
Das Lysat aus (Spender-)Thrombozyten findet in der humanen Zellkultur als Nährmedienzusatz Anwendung (humanes Plättchenlysat). ⓘ