Distickstoffmonoxid

| |

| |
| Bezeichnungen | |
|---|---|
| IUPAC-Name
Distickstoffoxid
| |
| Andere Bezeichnungen
Lachgas, süße Luft, Stickstoffprotoxid, Distickstoffoxid, Distickstoffmonoxid
| |
| Bezeichnungen | |
3D-Modell (JSmol)
|
|
Beilstein-Referenz
|
8137358 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Arzneimittelbank | |
Gmelin-Referenz
|
2153410 |
| KEGG | |
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII | |
| UN-Nummer | 1070 (komprimiert) 2201 (flüssig) |
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
N 2O |
| Molekulare Masse | 44,013 g/mol |
| Erscheinungsbild | farbloses Gas |
| Dichte | 1,977 g/L (Gas) |
| Schmelzpunkt | -90,86 °C (-131,55 °F; 182,29 K) |
| Siedepunkt | -88,48 °C (-127,26 °F; 184,67 K) |
Löslichkeit in Wasser
|
1,5 g/L (15 °C) |
| Löslichkeit | löslich in Alkohol, Ether, Schwefelsäure |
| log P | 0.35 |
| Dampfdruck | 5150 kPa (20 °C) |
Magnetische Suszeptibilität (χ)
|
-18,9-10-6 cm3/mol |
Brechungsindex (nD)
|
1,000516 (0 °C, 101,325 kPa) |
| Viskosität | 14,90 μPa-s |
| Struktur | |
Molekulare Form
|
linear, C∞v |
Dipolmoment
|
0.166 D |
| Thermochemie | |
Std. molare
Entropie (S |
219,96 J/(K-mol) |
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
+82,05 kJ/mol |
| Pharmakologie | |
ATC-Code
|
N01AX13 (WHO) |
Wege der
Verabreichung |
Inhalation |
| Pharmakokinetik: | |
| 0.004% | |
Biologische Halbwertszeit
|
5 Minuten |
Ausscheidung
|
Über die Atemwege |
| Gefahren | |
| GHS-Kennzeichnung: | |
Piktogramme
|
  
|
| NFPA 704 (Feuerdiamant) | |
| Flammpunkt | Nicht brennbar |
| Sicherheitsdatenblatt (SDS) | Ilo.org, ICSC 0067 |
| Verwandte Verbindungen | |
Verwandte Stickoxide
|
Stickstoffmonoxid Distickstofftrioxid Stickstoffdioxid Distickstofftetroxid Distickstoffpentoxid |
Verwandte Verbindungen
|
Ammoniumnitrat Azid |
Wenn nicht anders angegeben, beziehen sich die Daten auf Stoffe im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Distickstoffoxid (Distickstoffoxid oder Distickstoffmonoxid), allgemein bekannt als Lachgas, Distickstoff oder Nos, ist eine chemische Verbindung, ein Stickstoffoxid mit der Formel N
2O. Bei Raumtemperatur ist es ein farbloses, nicht entflammbares Gas mit leicht süßlichem Geruch und Geschmack. Bei höheren Temperaturen ist Distickstoffoxid ein starkes Oxidationsmittel, das dem molekularen Sauerstoff ähnelt. ⓘ
Distickstoffoxid wird in der Medizin, insbesondere in der Chirurgie und Zahnmedizin, wegen seiner betäubenden und schmerzlindernden Wirkung eingesetzt. Sein von Humphry Davy geprägter umgangssprachlicher Name "Lachgas" ist auf die euphorisierende Wirkung beim Einatmen zurückzuführen, eine Eigenschaft, die zu seiner Verwendung in der Freizeit als dissoziatives Anästhetikum geführt hat. Es steht auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation. Es wird auch als Oxidationsmittel in Raketentreibstoffen und im Rennsport verwendet, um die Leistung der Motoren zu erhöhen. ⓘ
Die Lachgaskonzentration in der Atmosphäre erreichte im Jahr 2020 333 parts per billion (ppb) und nimmt jährlich um etwa 1 ppb zu. Lachgas ist ein wichtiger Ozonvernichter in der Stratosphäre, mit einer Wirkung, die mit der von FCKW vergleichbar ist. Globale Bilanzierung von N
2O-Quellen und -Senken im Jahrzehnt bis 2016 zeigt, dass etwa 40 % der durchschnittlichen Emissionen von 17 TgN/Jahr (Teragramm Stickstoff pro Jahr) auf menschliche Aktivitäten zurückzuführen sind, und zeigt, dass der Emissionsanstieg vor allem auf die expandierende Landwirtschaft und Industrie in den Schwellenländern zurückzuführen ist. Als drittwichtigstes langlebiges Treibhausgas trägt Distickstoffoxid ebenfalls erheblich zur globalen Erwärmung bei. ⓘ
Verwendungen
Raketenmotoren
Distickstoffoxid kann als Oxidationsmittel in einem Raketenmotor verwendet werden. Es hat gegenüber anderen Oxidationsmitteln den Vorteil, dass es viel weniger giftig ist und aufgrund seiner Stabilität bei Raumtemperatur auch einfacher zu lagern und relativ sicher auf einem Flug mitzuführen ist. Ein weiterer Vorteil ist, dass es sich leicht zu Atemluft zersetzen lässt. Aufgrund seiner hohen Dichte und seines niedrigen Speicherdrucks (wenn es bei niedriger Temperatur aufbewahrt wird) ist es sehr wettbewerbsfähig mit gespeicherten Hochdruckgassystemen. ⓘ
In einem Patent von 1914 schlug der amerikanische Raketenpionier Robert Goddard Distickstoffoxid und Benzin als mögliche Treibstoffe für eine Flüssigkeitsrakete vor. Distickstoffoxid war das Oxidationsmittel der Wahl in mehreren Hybridraketen (mit festem Brennstoff und flüssigem oder gasförmigem Oxidationsmittel). Die Kombination von Distickstoffoxid mit hydroxylterminiertem Polybutadien-Treibstoff wurde unter anderem von SpaceShipOne verwendet. Es wird auch in der Amateur- und Hochleistungsraketenindustrie mit verschiedenen Kunststoffen als Treibstoff verwendet. ⓘ
Distickstoffoxid kann auch in einer Monotreibstoffrakete verwendet werden. In Gegenwart eines erhitzten Katalysators wird N
2O in Gegenwart eines erhitzten Katalysators exotherm in Stickstoff und Sauerstoff bei einer Temperatur von etwa 577 °C (1.070 °F) zerfallen. Aufgrund der großen Wärmefreisetzung wird die katalytische Wirkung schnell zweitrangig, da die thermische Selbstzersetzung dominiert. In einem Vakuumtriebwerk kann dadurch ein spezifischer Impuls (Isp) von bis zu 180 s für eine Monotreibstoffturbine erreicht werden. Der Isp ist zwar deutlich geringer als der Isp von Hydrazintriebwerken (Monotreibstoff oder Bipropellant mit Distickstofftetroxid), aber die geringere Toxizität macht Distickstoffoxid zu einer untersuchenswerten Option. ⓘ
Distickstoffoxid verpufft bei etwa 600 °C (1.112 °F) und einem Druck von 309 psi (21 Atmosphären). Bei 600 psi beträgt die erforderliche Zündenergie beispielsweise nur 6 Joule, während N
2O bei 130 psi eine Zündenergie von 2.500 Joule nicht ausreicht. ⓘ
Verbrennungsmotor
Im Rennsport ermöglicht Distickstoffoxid (oft auch nur als "Lachgas" bezeichnet) dem Motor, mehr Kraftstoff zu verbrennen, indem es bei der Verbrennung mehr Sauerstoff liefert. Durch den erhöhten Sauerstoffgehalt kann die Kraftstoffeinspritzung erhöht werden, wodurch der Motor mehr Leistung erbringen kann. Das Gas ist bei niedrigem Druck und niedriger Temperatur nicht entflammbar, liefert aber mehr Sauerstoff als atmosphärische Luft, da es sich bei höheren Temperaturen (ca. 300 °C) zersetzt. Daher wird es oft mit einem anderen Brennstoff gemischt, der leichter zu verpuffen ist. Distickstoffoxid ist ein starkes Oxidationsmittel, das ungefähr dem Wasserstoffperoxid entspricht und viel stärker ist als Sauerstoffgas. ⓘ
Distickstoffoxid wird als komprimierte Flüssigkeit gespeichert; die Verdampfung und Ausdehnung des flüssigen Distickstoffoxids im Ansaugkrümmer führt zu einem starken Abfall der Ansaugladetemperatur, wodurch die Ladung dichter wird und mehr Luft/Kraftstoffgemisch in den Zylinder gelangen kann. Manchmal wird Distickstoffoxid in (oder vor) den Ansaugkrümmer eingespritzt, während andere Systeme direkt vor dem Zylinder einspritzen (Direkteinspritzung), um die Leistung zu erhöhen. ⓘ
Die Technik wurde im Zweiten Weltkrieg von Flugzeugen der Luftwaffe mit dem GM-1-System eingesetzt, um die Leistung von Flugzeugmotoren zu erhöhen. Ursprünglich sollte sie den Standardflugzeugen der Luftwaffe eine höhere Höhenleistung verleihen, doch aus technischen Gründen war ihr Einsatz auf extrem große Höhen beschränkt. Dementsprechend wurde es nur von Spezialflugzeugen wie Höhenaufklärern, Hochgeschwindigkeitsbombern und Höhenabfangjägern verwendet. Manchmal war es auch in Flugzeugen der Luftwaffe zu finden, die mit einem anderen System zur Triebwerksaufladung ausgestattet waren, dem MW 50, einer Art Wassereinspritzung für Flugzeugtriebwerke, die Methanol zur Aufladung verwendete. ⓘ
Eines der größten Probleme bei der Verwendung von Distickstoffoxid in einem Hubkolbenmotor besteht darin, dass es so viel Leistung erzeugen kann, dass der Motor beschädigt oder zerstört wird. Es sind sehr große Leistungssteigerungen möglich, und wenn die mechanische Struktur des Motors nicht entsprechend verstärkt ist, kann der Motor bei dieser Art von Betrieb schwer beschädigt oder sogar zerstört werden. Bei der Lachgasanreicherung von Benzinmotoren ist es sehr wichtig, die richtigen Betriebstemperaturen und Kraftstoffmengen einzuhalten, um eine "Vorzündung" oder "Detonation" (manchmal auch als "Klopfen" bezeichnet) zu verhindern. Die meisten Probleme, die im Zusammenhang mit Lachgas auftreten, sind nicht auf mechanisches Versagen aufgrund der Leistungssteigerung zurückzuführen. Da Lachgas eine wesentlich dichtere Ladung in den Zylinder bringt, erhöht sich der Zylinderdruck drastisch. Der erhöhte Druck und die erhöhte Temperatur können zu Problemen wie dem Schmelzen von Kolben oder Ventilen führen. Außerdem kann es zu Rissen oder Verformungen an Kolben oder Zylinderkopf kommen und aufgrund der ungleichmäßigen Erwärmung eine Vorzündung verursachen. ⓘ
Flüssiges Distickstoffoxid in Automobilqualität unterscheidet sich geringfügig von medizinischem Distickstoffoxid. Eine geringe Menge an Schwefeldioxid (SO
2) wird zugesetzt, um Drogenmissbrauch zu verhindern. Dieser kann durch mehrfaches Waschen mit einer Base (z. B. Natriumhydroxid) entfernt werden, wodurch die korrosiven Eigenschaften verringert werden, die auftreten, wenn SO
2 bei der Verbrennung weiter zu Schwefelsäure oxidiert wird, wodurch die Emissionen sauberer werden. ⓘ
Aerosol-Treibmittel
Das Gas ist für die Verwendung als Lebensmittelzusatzstoff (E-Nummer: E942), insbesondere als Aerosol-Treibmittel, zugelassen. Am häufigsten wird es in diesem Zusammenhang in Schlagsahne-Aerosolbehältern und Kochsprays verwendet. ⓘ
Das Gas ist extrem gut in Fettverbindungen löslich. In Schlagsahne-Aerosolen wird es in der fetthaltigen Sahne gelöst, bis sie die Dose verlässt, dann wird es gasförmig und erzeugt so Schaum. Auf diese Weise entsteht Schlagsahne, die das vierfache Volumen der Flüssigkeit hat, während das Aufschlagen von Luft in Sahne nur das doppelte Volumen ergibt. Bei der Verwendung von Luft als Treibmittel würde Sauerstoff das Ranzigwerden des Butterfetts beschleunigen, während Distickstoffoxid einen solchen Abbau verhindert. Kohlendioxid kann für Schlagsahne nicht verwendet werden, da es in Wasser sauer ist, wodurch die Sahne gerinnen würde und ein seltzerähnliches Prickeln entstünde. ⓘ
Die mit Distickstoffoxid hergestellte Schlagsahne ist jedoch instabil und kehrt innerhalb einer halben bis einer Stunde in einen flüssigeren Zustand zurück. Daher eignet sich die Methode nicht für die Dekoration von Speisen, die nicht sofort serviert werden sollen. ⓘ
Im Dezember 2016 meldeten einige Hersteller einen Mangel an Aerosol-Schlagsahne in den Vereinigten Staaten, nachdem es Ende August in der Lachgasanlage von Air Liquide in Florida zu einer Explosion gekommen war. Da eine wichtige Anlage außer Betrieb war, führte die Störung zu einer Verknappung, die dazu führte, dass das Unternehmen die Lachgaslieferungen an medizinische Kunden statt an die Lebensmittelherstellung umleitete. Die Verknappung fiel in die Weihnachts- und Urlaubszeit, wenn der Verbrauch von Schlagsahne in Dosen normalerweise am höchsten ist. ⓘ
Auch in Kochspray, das aus verschiedenen Arten von Ölen in Verbindung mit Lecithin (einem Emulgator) hergestellt wird, kann Distickstoffoxid als Treibmittel verwendet werden. Andere in Kochspray verwendete Treibmittel sind Alkohol in Lebensmittelqualität und Propan. ⓘ
Medizin
Lachgas wird seit 1844 in der Zahnmedizin und Chirurgie als Anästhetikum und Schmerzmittel eingesetzt. In den Anfängen wurde das Gas durch einfache Inhalatoren verabreicht, die aus einem Atembeutel aus Gummituch bestanden. Heute wird das Gas in Krankenhäusern mit einem automatisierten Gerät zur relativen Analgesie verabreicht, das über einen Anästhesieverdampfer und ein medizinisches Beatmungsgerät verfügt, das einen genau dosierten und atemgesteuerten Lachgasfluss abgibt, der mit Sauerstoff im Verhältnis 2:1 gemischt ist. ⓘ
Lachgas ist ein schwaches Allgemeinanästhetikum und wird daher im Allgemeinen nicht allein in der Allgemeinanästhesie verwendet, sondern als Trägergas (gemischt mit Sauerstoff) für stärkere Allgemeinanästhetika wie Sevofluran oder Desfluran. Es hat eine minimale alveolengängige Konzentration von 105 % und einen Blut-Gas-Verteilungskoeffizienten von 0,46. Die Verwendung von Distickstoffoxid in der Anästhesie kann jedoch das Risiko von postoperativer Übelkeit und Erbrechen erhöhen. ⓘ
Zahnärzte verwenden ein einfacheres Gerät, das nur eine N
2O/O
2-Gemisch abgibt, das der Patient bei Bewusstsein einatmen kann. Der Patient bleibt während des gesamten Eingriffs bei Bewusstsein und verfügt über ausreichende geistige Fähigkeiten, um auf Fragen und Anweisungen des Zahnarztes zu reagieren. ⓘ
Die Inhalation von Lachgas wird häufig zur Schmerzlinderung bei Geburten, Traumata, Oralchirurgie und akutem Koronarsyndrom (einschließlich Herzinfarkt) eingesetzt. Die Anwendung während der Wehen hat sich als sichere und wirksame Hilfe für die Gebärenden erwiesen. Der Nutzen der Anwendung bei akutem Koronarsyndrom ist unbekannt. ⓘ
In Großbritannien und Kanada werden Entonox und Nitronox häufig von Rettungsdiensten (auch von nicht registrierten Ärzten) als schnelles und hochwirksames Analgetikagas eingesetzt. ⓘ
Angesichts der relativ einfachen und sicheren Verabreichung von 50 %igem Lachgas als Analgetikum kann die Verwendung von 50 %igem Lachgas durch geschulte, nicht professionelle Ersthelfer in der prähospitalen Umgebung in Betracht gezogen werden. Die schnelle Reversibilität seiner Wirkung würde auch verhindern, dass es die Diagnose ausschließt. ⓘ
Verwendung in der Freizeit



Die Freizeitinhalation von Distickstoffoxid mit dem Ziel, Euphorie und/oder leichte Halluzinationen hervorzurufen, begann als Phänomen der britischen Oberschicht im Jahr 1799, bekannt als "Lachgaspartys". ⓘ
Ab dem 19. Jahrhundert wurde das Gas für medizinische und kulinarische Zwecke weithin verfügbar, so dass sich der Freizeitkonsum weltweit stark ausbreitete. Im Vereinigten Königreich wurde Lachgas 2014 schätzungsweise von fast einer halben Million junger Menschen in Nachtlokalen, auf Festivals und Partys verwendet. Die Legalität dieses Konsums variiert stark von Land zu Land und in einigen Ländern sogar von Stadt zu Stadt. ⓘ
Der weit verbreitete Freizeitkonsum der Droge im Vereinigten Königreich wurde 2017 in der Vice-Dokumentation Inside The Laughing Gas Black Market thematisiert, in der der Journalist Matt Shea mit Händlern der Droge zusammentraf, die sie aus Krankenhäusern stahlen, obwohl angesichts der Tatsache, dass Lachgas-Kanister online leicht erhältlich sind, die Fälle von Krankenhausdiebstahl äußerst selten sein dürften. ⓘ
Ein wichtiges Problem, das in der Londoner Presse erwähnt wird, ist die Ablagerung von Lachgasbehältern, die sehr gut sichtbar ist und zu erheblichen Beschwerden in den Gemeinden führt. ⓘ
Sicherheit
Die größten Sicherheitsrisiken von Distickstoffoxid ergeben sich aus der Tatsache, dass es sich um ein komprimiertes Flüssiggas handelt, das ein Erstickungsrisiko birgt und ein dissoziatives Anästhetikum ist. ⓘ
Obwohl Lachgas relativ ungiftig ist, hat es anerkanntermaßen eine Reihe von negativen Auswirkungen auf die menschliche Gesundheit, sei es durch Einatmen oder durch Kontakt der Flüssigkeit mit Haut oder Augen. ⓘ
Lachgas stellt ein erhebliches berufliches Risiko für Chirurgen, Zahnärzte und Krankenschwestern dar. Da Lachgas beim Menschen nur geringfügig verstoffwechselt wird (mit einer Rate von 0,004 %), behält es seine Wirkung, wenn es vom Patienten in den Raum ausgeatmet wird, und kann bei schlechter Belüftung des Raums für das Klinikpersonal eine berauschende und langanhaltende Gefahr darstellen. Bei der Verabreichung von Lachgas wird ein Frischluft-Ventilationssystem mit kontinuierlichem Durchfluss oder ein N
2O-Scavenger-System verwendet, um eine Abgasbildung zu verhindern. ⓘ
Das National Institute for Occupational Safety and Health (Nationales Institut für Sicherheit und Gesundheit am Arbeitsplatz) empfiehlt, dass die Exposition von Arbeitnehmern gegenüber Lachgas bei der Verabreichung von Anästhesiegas in medizinischen, zahnmedizinischen und tierärztlichen Betrieben kontrolliert werden sollte. Es hat einen empfohlenen Expositionsgrenzwert (REL) von 25 ppm (46 mg/m3) für entweichendes Narkosemittel festgelegt. ⓘ
Geistige und manuelle Beeinträchtigung
Die Exposition gegenüber Distickstoffoxid führt zu einer kurzfristigen Abnahme der geistigen Leistungsfähigkeit, der audiovisuellen Fähigkeiten und der manuellen Geschicklichkeit. Diese Wirkungen in Verbindung mit der induzierten räumlichen und zeitlichen Desorientierung können zu körperlichen Schädigungen des Anwenders durch Umweltgefahren führen. ⓘ
Neurotoxizität und Neuroprotektion
Wie bei anderen NMDA-Rezeptor-Antagonisten wird vermutet, dass N
2O führt bei Nagetieren nach längerer (mehrstündiger) Exposition zu Neurotoxizität in Form von Olney-Läsionen. Neue Forschungsergebnisse deuten jedoch darauf hin, dass die Olney-Läsionen beim Menschen nicht auftreten, und man geht inzwischen davon aus, dass ähnliche Drogen wie Ketamin nicht akut neurotoxisch sind. Es wurde argumentiert, dass, da N
2O unter normalen Umständen schnell aus dem Körper ausgeschieden wird, ist es weniger wahrscheinlich, dass es neurotoxisch ist als andere NMDAR-Antagonisten. In der Tat führt eine kurzfristige Exposition bei Nagetieren nur zu einer leichten Schädigung, die schnell reversibel ist, und der neuronale Tod tritt erst nach einer konstanten und anhaltenden Exposition ein. Distickstoffoxid kann auch nach längerer Exposition aufgrund von Hypoxie Neurotoxizität verursachen. Dies gilt insbesondere für nichtmedizinische Formulierungen wie Schlagsahne-Ladegeräte (auch als "Whippets" oder "Nangs" bekannt), die niemals Sauerstoff enthalten, da Sauerstoff die Sahne ranzig macht. ⓘ
Bei starken (≥400 g oder ≥200 l N2O-Gas in einer Sitzung) oder häufigen (regelmäßig, z. B. täglich oder wöchentlich) Anwendern, die den Giftnotrufzentralen gemeldet werden, wurden Anzeichen einer peripheren Neuropathie festgestellt: das Vorhandensein von Ataxie (Gangstörungen) oder Parästhesie (Wahrnehmung abnormaler Empfindungen, z. B. Kribbeln, Taubheit, Prickeln, meist in den Extremitäten). Dies gilt als frühes Anzeichen für neurologische Schäden und weist auf eine chronische Toxizität hin. ⓘ
Außerdem wird durch Distickstoffoxid der Vitamin-B12-Spiegel gesenkt. Dies kann zu ernsthafter Neurotoxizität führen, wenn der Konsument bereits einen Vitamin-B12-Mangel hat. ⓘ
Distickstoffmonoxid in einer Konzentration von 75 Volumenprozent reduziert den durch Ischämie induzierten neuronalen Tod, der durch den Verschluss der mittleren Hirnarterie bei Nagetieren hervorgerufen wird, und verringert den NMDA-induzierten Ca2+-Einstrom in neuronalen Zellkulturen, ein kritischer Vorgang bei der Exzitotoxizität. ⓘ
DNA-Schäden
Die berufsbedingte Exposition gegenüber Distickstoffmonoxid wurde mit DNA-Schäden in Verbindung gebracht, die auf eine Unterbrechung der DNA-Synthese zurückzuführen sind. Dieser Zusammenhang ist dosisabhängig und scheint sich nicht auf den gelegentlichen Freizeitkonsum zu erstrecken; es sind jedoch weitere Untersuchungen erforderlich, um die Dauer und Menge der Exposition zu bestätigen, die erforderlich ist, um Schäden zu verursachen. ⓘ
Gefahren
Bei der Verwendung von großen Gasflaschen in geschlossenen Räumen besteht Erstickungsgefahr. Lachgas ist brandfördernd (Vergleiche: Glimmspanprobe). Besondere Gefahren bestehen beim Gebrauch als Rauschmittel: Inhaliert man Lachgas pur – z. B. aus abgefüllten Ballons –, können als Folgen Dysphorie, Verwirrtheit, Übelkeit, Kopfschmerzen, Schluckauf und Blutdruckabfall auftreten. Bei hohen Mengen kommt es zu einer Unterversorgung des Blutes mit Sauerstoff (Hypoxämie), in deren Folge Kreislaufstillstand, Hirnschäden und der Tod möglich sind. Falls Lachgas direkt aus dem Gasbehälter eingeatmet wird, kann es zu Erfrierungserscheinungen (siehe: Joule-Thomson-Effekt) an Lippen, Kehlkopf und Bronchien aufgrund der Kälte des Gases kommen. Auch deshalb werden meist abgefüllte Ballons verwendet. ⓘ
Vitamin-B12-Mangel
Langfristige Exposition gegenüber Distickstoffmonoxid kann zu Vitamin-B12-Mangel führen. Es inaktiviert die Cobalaminform von Vitamin B12 durch Oxidation. Symptome eines Vitamin-B12-Mangels, einschließlich sensorischer Neuropathie, Myelopathie und Enzephalopathie, können bei Personen mit subklinischem Vitamin-B12-Mangel innerhalb von Tagen oder Wochen nach einer Lachgasnarkose auftreten. ⓘ
Die Symptome werden mit hohen Dosen von Vitamin B12 behandelt, aber die Heilung kann langsam und unvollständig sein. ⓘ
Menschen mit normalen Vitamin-B12-Spiegeln verfügen über Speicher, die die Auswirkungen von Lachgas unbedeutend machen, es sei denn, die Exposition wird wiederholt und über einen längeren Zeitraum durchgeführt (Lachgasmissbrauch). Bei Personen mit Risikofaktoren für einen Vitamin-B12-Mangel sollte der Vitamin-B12-Spiegel vor einer Lachgasanästhesie überprüft werden. ⓘ
Pränatale Entwicklung
Mehrere experimentelle Studien an Ratten deuten darauf hin, dass eine chronische Exposition trächtiger Weibchen gegenüber Lachgas schädliche Auswirkungen auf den sich entwickelnden Fötus haben kann. ⓘ
Chemische/physikalische Risiken
Bei Raumtemperatur (20 °C [68 °F]) beträgt der Sättigungsdampfdruck 50,525 bar und steigt bei 36,4 °C (97,5 °F) - der kritischen Temperatur - auf 72,45 bar an. Die Druckkurve ist also ungewöhnlich temperaturabhängig. ⓘ
Wie bei vielen starken Oxidationsmitteln ist die Verunreinigung von Teilen mit Brennstoffen in Raketenunfälle verwickelt, bei denen kleine Mengen von Stickstoff/Brennstoff-Gemischen aufgrund von "Wasserschlag"-ähnlichen Effekten explodieren (manchmal auch als "Dieseln" bezeichnet - die Erhitzung aufgrund der adiabatischen Kompression von Gasen kann Zersetzungstemperaturen erreichen). Einige gängige Baumaterialien wie Edelstahl und Aluminium können zusammen mit starken Oxidationsmitteln wie Distickstoffoxid als Brennstoffe dienen, ebenso wie Verunreinigungen, die sich aufgrund der adiabatischen Kompression entzünden können. ⓘ
Es hat auch Vorfälle gegeben, bei denen die Zersetzung von Distickstoffoxid in Rohrleitungen zur Explosion großer Tanks geführt hat. ⓘ
Wirkungsmechanismen
Der pharmakologische Wirkmechanismus von N
2O in der Medizin ist nicht vollständig bekannt. Es hat sich jedoch gezeigt, dass es ein breites Spektrum an ligandengesteuerten Ionenkanälen direkt moduliert, und dies spielt wahrscheinlich eine wichtige Rolle bei vielen seiner Wirkungen. Es blockiert mäßig NMDAR- und β2-Untereinheiten enthaltende nACh-Kanäle, hemmt schwach AMPA-, Kainat-, GABAC- und 5-HT3-Rezeptoren und potenziert leicht GABAA- und Glycinrezeptoren. Es hat sich auch gezeigt, dass es Zweiporen-K+
Kanäle. Während N
2O eine ganze Reihe von Ionenkanälen beeinflusst, sind seine betäubenden, halluzinogenen und euphorisierenden Wirkungen wahrscheinlich überwiegend oder vollständig auf die Hemmung von NMDA-Rezeptor-vermittelten Strömen zurückzuführen. Zusätzlich zu seinen Wirkungen auf Ionenkanäle kann N
2O möglicherweise Stickstoffmonoxid (NO) im zentralen Nervensystem imitieren, was mit seinen analgetischen und anxiolytischen Eigenschaften zusammenhängen könnte. Distickstoffoxid ist 30- bis 40-mal besser löslich als Stickstoff. ⓘ
Es ist bekannt, dass die Auswirkungen der Inhalation von Lachgas in subanästhetischen Dosen in Abhängigkeit von verschiedenen Faktoren, einschließlich der Umgebung und individueller Unterschiede, variieren; aus seiner Diskussion geht Jay (2008) jedoch hervor, dass zuverlässig bekannt ist, dass es die folgenden Zustände und Empfindungen hervorruft:
- Rauschzustände
- Euphorie/Dysphorie
- Räumliche Desorientierung
- Zeitliche Desorientierung
- Verminderte Schmerzempfindlichkeit
Bei einer Minderheit der Konsumenten kommt es auch zu unkontrollierten Vokalisationen und Muskelkrämpfen. Diese Wirkungen verschwinden im Allgemeinen wenige Minuten nach dem Entfernen der Lachgasquelle. ⓘ
Euphorisierende Wirkung
Bei Ratten stimuliert N
2O den mesolimbischen Belohnungsweg, indem es die Dopaminfreisetzung und die Aktivierung dopaminerger Neuronen im ventralen tegmentalen Bereich und im Nucleus accumbens stimuliert, vermutlich durch Antagonisierung der in diesem System lokalisierten NMDA-Rezeptoren. Diese Wirkung wird mit der euphorisierenden Wirkung in Verbindung gebracht und scheint auch die analgetischen Eigenschaften zu verstärken. ⓘ
Bemerkenswert ist jedoch, dass bei Mäusen N
2O bei Mäusen die amphetamininduzierte trägervermittelte Dopaminfreisetzung im Nucleus accumbens und die Verhaltenssensibilisierung blockiert, die konditionierte Platzpräferenz (CPP) von Kokain und Morphin aufhebt und selbst keine verstärkenden (oder aversiven) Wirkungen erzeugt. Die Auswirkungen der CPP von N
2O bei Ratten sind gemischt und bestehen aus Verstärkung, Abneigung und keiner Veränderung. Im Gegensatz dazu ist N 2O bei Totenkopfäffchen ein positiver Verstärker, und beim Menschen ist es als Droge des Missbrauchs bekannt. Diese Diskrepanzen bei der Reaktion auf N
2O können auf unterschiedliche Spezies oder methodische Unterschiede zurückzuführen sein. In klinischen Studien am Menschen wurde festgestellt, dass N
2O, ähnlich wie bei Ratten, gemischte Reaktionen hervorgerufen, was auf eine hohe subjektive individuelle Variabilität zurückzuführen ist. ⓘ
Anxiolytische Wirkung
In Verhaltenstests zu Angstzuständen ist eine niedrige Dosis von N
2O ein wirksames Anxiolytikum, und diese angstlösende Wirkung ist mit einer verstärkten Aktivität der GABAA-Rezeptoren verbunden, da sie durch Benzodiazepin-Rezeptorantagonisten teilweise aufgehoben wird. Entsprechend sind Tiere, die eine Toleranz gegenüber der angstlösenden Wirkung von Benzodiazepinen entwickelt haben, teilweise tolerant gegenüber N
2O. In der Tat, bei Menschen, die 30% N
2O verabreicht wurden, verringerten Benzodiazepin-Rezeptor-Antagonisten in klinischen Humanstudien die subjektiven Berichte über das Gefühl, "high" zu sein, veränderten aber nicht die psychomotorische Leistung. ⓘ
Analgetische Wirkung
Die analgetischen Wirkungen von N
2O sind mit der Interaktion zwischen dem endogenen Opioidsystem und dem absteigenden noradrenergen System verbunden. Wenn Tiere chronisch mit Morphin behandelt werden, entwickeln sie eine Toleranz gegenüber der schmerzstillenden Wirkung von Morphin, und dies macht die Tiere auch tolerant gegenüber der analgetischen Wirkung von N
2O. Die Verabreichung von Antikörpern, die die Aktivität einiger endogener Opioide (nicht β-Endorphin) binden und blockieren, blockiert auch die antinozizeptiven Wirkungen von N
2O. Medikamente, die den Abbau endogener Opioide hemmen, verstärken ebenfalls die antinozizeptiven Wirkungen von N
2O. Mehrere Experimente haben gezeigt, dass Opioidrezeptorantagonisten, die direkt ins Gehirn verabreicht werden, die antinozizeptiven Wirkungen von N
2O blockieren, aber diese Medikamente haben keine Wirkung, wenn sie in das Rückenmark injiziert werden. ⓘ
Abgesehen von einer indirekten Wirkung interagiert Distickstoffmonoxid wie Morphin auch direkt mit dem endogenen Opioidsystem, indem es an Opioidrezeptor-Bindungsstellen bindet. ⓘ
Umgekehrt blockieren α2-Adrenozeptor-Antagonisten die schmerzlindernde Wirkung von N
2O, wenn sie direkt in das Rückenmark verabreicht werden, aber nicht, wenn sie direkt im Gehirn angewendet werden. In der Tat sind α2B-Adrenozeptor-Knockout-Mäuse oder Tiere, denen Noradrenalin fehlt, fast vollständig resistent gegen die antinozizeptiven Wirkungen von N
2O. Offenbar ist die N
2O-induzierte Freisetzung endogener Opioide eine Enthemmung noradrenerger Neuronen im Hirnstamm bewirkt, die Noradrenalin in das Rückenmark freisetzen und die Schmerzsignalisierung hemmen. Wie genau N
2O die Freisetzung endogener Opioidpeptide bewirkt, bleibt unklar. ⓘ
Eigenschaften und Reaktionen
Distickstoffoxid ist ein farbloses, ungiftiges Gas mit schwachem, süßlichem Geruch. ⓘ
Distickstoffmonoxid unterstützt die Verbrennung durch Freisetzung des dipolar gebundenen Sauerstoffradikals und kann so eine glühende Schiene wieder anzünden. ⓘ
N
2O ist bei Raumtemperatur inert und zeigt nur wenige Reaktionen. Bei höheren Temperaturen nimmt seine Reaktivität zu. So reagiert Distickstoffoxid beispielsweise mit NaNH
2 bei 460 K (187 °C) unter Bildung von NaN
3:
- 2 NaNH
2 + N
2O → NaN
3 + NaOH + NH
3 ⓘ
Die oben beschriebene Reaktion wird von der chemischen Industrie zur Herstellung von Azidsalzen verwendet, die als Sprengstoffe eingesetzt werden. ⓘ
Geschichte
Das Gas wurde erstmals 1772 von dem englischen Naturphilosophen und Chemiker Joseph Priestley synthetisiert, der es dephlogisierte salpetrige Luft (siehe Phlogistontheorie) oder brennbare salpetrige Luft nannte. Priestley veröffentlichte seine Entdeckung in dem Buch Experiments and Observations on Different Kinds of Air (1775), in dem er beschrieb, wie man durch Erhitzen von mit Salpetersäure angefeuchteten Eisenfeilspänen eine Zubereitung von "nitroser Luft vermindert" herstellen kann. ⓘ
Frühe Verwendung

Ein satirischer Druck von 1830, der Humphry Davy zeigt, wie er einer Frau eine Dosis Lachgas verabreicht ⓘ
Die erste wichtige Verwendung von Distickstoffoxid wurde von Thomas Beddoes und James Watt ermöglicht, die gemeinsam das Buch Considerations on the Medical Use and on the Production of Factitious Airs (1794) veröffentlichten. Dieses Buch war aus zwei Gründen wichtig. Erstens hatte James Watt eine neuartige Maschine zur Herstellung "künstlicher Luft" (einschließlich Distickstoffoxid) und einen neuartigen "Atemapparat" zur Inhalation des Gases erfunden. Zweitens wurden in dem Buch auch die neuen medizinischen Theorien von Thomas Beddoes vorgestellt, wonach Tuberkulose und andere Lungenkrankheiten durch die Inhalation von "Factitious Airs" behandelt werden könnten. ⓘ

Die Maschine zur Herstellung von "Factitious Airs" bestand aus drei Teilen: einem Ofen, in dem das benötigte Material verbrannt wurde, einem Gefäß mit Wasser, durch das das erzeugte Gas in einem Spiralrohr geleitet wurde (um Verunreinigungen "auszuwaschen"), und schließlich der Gasflasche mit einem Gasometer, in dem das erzeugte Gas, "Luft", in tragbare Luftsäcke (aus luftdichter, öliger Seide) abgefüllt werden konnte. Das Atemgerät bestand aus einem der tragbaren Luftsäcke, der mit einem Schlauch an ein Mundstück angeschlossen war. Mit der Entwicklung und Herstellung dieser neuen Geräte im Jahr 1794 wurde der Weg für klinische Versuche geebnet, die 1798 begannen, als Thomas Beddoes in Hotwells (Bristol) die "Pneumatische Anstalt zur Linderung von Krankheiten durch medizinische Luft" gründete. Im Keller des Gebäudes produzierte eine große Maschine die Gase unter der Aufsicht des jungen Humphry Davy, der ermutigt wurde, mit neuen Gasen zu experimentieren, die die Patienten einatmen sollten. Die erste wichtige Arbeit von Davy war die Untersuchung von Distickstoffoxid und die Veröffentlichung seiner Ergebnisse in dem Buch: Researches, Chemical and Philosophical (1800). In dieser Veröffentlichung stellt Davy auf Seite 465 die schmerzlindernde Wirkung von Distickstoffmonoxid fest und auf Seite 556, dass es für chirurgische Eingriffe verwendet werden kann. Davy prägte den Namen "Lachgas" für Distickstoffmonoxid. ⓘ
Obwohl Davy entdeckte, dass das Einatmen von Distickstoffmonoxid einen Menschen bei Bewusstsein von Schmerzen befreien kann, vergingen weitere 44 Jahre, bevor Ärzte versuchten, es zur Anästhesie zu verwenden. Die Verwendung von Distickstoffmonoxid als Freizeitdroge auf "Lachgaspartys", die vor allem für die britische Oberschicht veranstaltet wurden, wurde ab 1799 ein unmittelbarer Erfolg. Während die Wirkung des Gases den Konsumenten im Allgemeinen stuporös, verträumt und sediert erscheinen lässt, geraten manche Menschen auch in einen euphorischen Zustand und brechen häufig in Gelächter aus. ⓘ
Einer der ersten kommerziellen Hersteller in den USA war George Poe, ein Cousin des Dichters Edgar Allan Poe, der auch der erste war, der das Gas verflüssigte. ⓘ
Verwendung als Narkosemittel
Das erste Mal, dass Distickstoffmonoxid als Narkosemittel bei der Behandlung eines Patienten eingesetzt wurde, war, als der Zahnarzt Horace Wells mit Unterstützung von Gardner Quincy Colton und John Mankey Riggs am 11. Dezember 1844 die Schmerzunempfindlichkeit bei einer Zahnextraktion nachwies. In den folgenden Wochen behandelte Wells in Hartford, Connecticut, die ersten 12 bis 15 Patienten mit Lachgas und hatte nach seinen eigenen Aufzeichnungen nur in zwei Fällen keinen Erfolg. Trotz dieser überzeugenden Ergebnisse, die Wells im Dezember 1844 der medizinischen Gesellschaft in Boston vorstellte, wurde die neue Methode nicht sofort von anderen Zahnärzten übernommen. Der Grund dafür war höchstwahrscheinlich, dass Wells im Januar 1845 bei seiner ersten öffentlichen Demonstration vor der medizinischen Fakultät in Boston teilweise erfolglos geblieben war, was seine Kollegen an der Wirksamkeit und Sicherheit der Methode zweifeln ließ. Die Methode wurde erst 1863 allgemein angewandt, als Gardner Quincy Colton damit begann, sie in allen Kliniken seiner "Colton Dental Association", die er gerade in New Haven und New York City gegründet hatte, erfolgreich einzusetzen. In den folgenden drei Jahren verabreichten Colton und seine Mitarbeiter erfolgreich Lachgas an mehr als 25.000 Patienten. Heute wird Lachgas in der Zahnmedizin als Anxiolytikum als Ergänzung zur Lokalanästhesie eingesetzt. ⓘ
Für den Einsatz bei größeren chirurgischen Eingriffen in Krankenhäusern erwies sich Lachgas jedoch nicht als ausreichend starkes Anästhetikum. Stattdessen wurde Diethylether, ein stärkeres und wirksameres Narkosemittel, im Oktober 1846 und Chloroform im Jahr 1847 demonstriert und für den Einsatz zugelassen. Als Joseph Thomas Clover 1876 den "Gas-Äther-Inhalator" erfand, wurde es in den Krankenhäusern üblich, alle Narkosebehandlungen mit einem schwachen Lachgasfluss zu beginnen und dann die Narkose mit dem stärkeren Äther oder Chloroform allmählich zu steigern. Der Gas-Äther-Inhalator von Clover diente dazu, dem Patienten gleichzeitig Lachgas und Äther zuzuführen, wobei die genaue Mischung vom Bediener des Geräts gesteuert wurde. Dieses Gerät wurde in vielen Krankenhäusern bis in die 1930er Jahre verwendet. Obwohl die Krankenhäuser heute fortschrittlichere Narkosegeräte verwenden, nutzen diese Geräte immer noch das gleiche Prinzip, das mit dem Gas-Äther-Inhalator von Clover eingeführt wurde, um die Narkose mit Distickstoffoxid einzuleiten, bevor ein stärkeres Narkosemittel verabreicht wird. ⓘ
Lachgas wurde erstmals 1771 von dem englischen Pfarrer, Chemiker und Physiker Joseph Priestley rein dargestellt und beschrieben. Die Entdeckung der betäubenden und schmerzstillenden Wirkung geht zurück auf den englischen Apotheker und späteren Chemiker Humphry Davy, der etwa ab dem Jahr 1797 begann, mit Selbstversuchen die Effekte des Lachgases zu erforschen. Er wendete es zur Behandlung von Zahnschmerzen an, publizierte seine Erkenntnisse 1800 und schlug Lachgas auch für die Betäubung bei chirurgischen Operationen vor. ⓘ
Als Patentarzneimittel
Coltons Popularisierung des Lachgases führte dazu, dass es von einer Reihe weniger seriöser Quacksalber übernommen wurde, die es als Heilmittel für Schwindsucht, Skrofulose, Katarrh und andere Erkrankungen des Blutes, des Rachens und der Lungen anpriesen. Die Behandlung mit Distickstoffoxid wurde von Leuten wie C. L. Blood und Jerome Harris in Boston und Charles E. Barney in Chicago verabreicht und als Patentarzneimittel lizenziert. ⓘ
Herstellung
Die Herstellung erfolgt in einer intramolekularen Redoxreaktion durch kontrollierte thermische Zersetzung von chloridfreiem Ammoniumnitrat
oder in einer Redoxreaktion durch Erhitzen einer Mischung aus Ammoniumsulfat und Natriumnitrat. Die Temperatur darf bei beiden Darstellungswegen jedoch nicht höher als 300 °C steigen, da es sonst zu einem explosiven Zerfall von Ammoniumnitrat kommen kann. ⓘ
Eine Übersicht über verschiedene Methoden zur Herstellung von Distickstoffmonoxid wird veröffentlicht. ⓘ
Industrielle Methoden
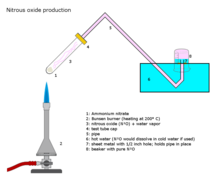
Lachgas wird in industriellem Maßstab durch vorsichtiges Erhitzen von Ammoniumnitrat auf etwa 250 °C hergestellt, das sich in Distickstoffoxid und Wasserdampf zersetzt.
- NH
4NO
3 → 2 H
2O + N
2O ⓘ
Die Zugabe von verschiedenen Phosphatsalzen begünstigt die Bildung eines reineren Gases bei etwas niedrigeren Temperaturen. Diese Reaktion kann schwer zu kontrollieren sein und zur Detonation führen. ⓘ
Methoden im Labor
Die Zersetzung von Ammoniumnitrat ist auch eine gängige Labormethode zur Herstellung des Gases. Es kann auch durch Erhitzen einer Mischung aus Natriumnitrat und Ammoniumsulfat gewonnen werden:
- 2 NaNO
3 + (NH
4)2SO
4 → Na
2SO
4 + 2 N
2O + 4 H
2O ⓘ
Eine andere Methode ist die Reaktion von Harnstoff, Salpetersäure und Schwefelsäure:
- 2 (NH2)2CO + 2 HNO
3 + H
2SO
4 → 2 N
2O + 2 CO
2 + (NH4)2SO4 + 2 H
2O ⓘ
Es wurde über die direkte Oxidation von Ammoniak mit einem Mangandioxid-Wismutoxid-Katalysator berichtet: vgl. Ostwald-Prozess.
- 2 NH
3 + 2 O
2 → N
2O + 3 H
2O ⓘ
Hydroxylammoniumchlorid reagiert mit Natriumnitrit unter Bildung von Distickstoffoxid. Wird das Nitrit der Hydroxylaminlösung zugesetzt, bleibt als einziges Nebenprodukt Salzwasser übrig. Gibt man jedoch die Hydroxylaminlösung zur Nitritlösung (Nitrit ist im Überschuss vorhanden), so bilden sich auch giftige höhere Stickoxide:
- NH
3OHCl + NaNO
2 → N
2O + NaCl + 2 H
2O ⓘ
Die Behandlung von HNO
3 mit SnCl
2 und HCl ist ebenfalls nachgewiesen worden:
- 2 HNO
3 + 8 HCl + 4 SnCl
2 → 5 H
2O + 4 SnCl
4 + N
2O ⓘ
Untere salpetrige Säure zerfällt bei 25 °C und pH 1-3 mit einer Halbwertszeit von 16 Tagen in N2O und Wasser.
- H2N2O2→ H2O + N2O ⓘ
Atmosphärisches Vorkommen



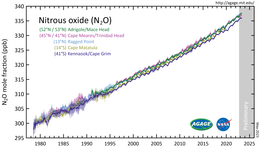
Distickstoffoxid ist ein kleiner Bestandteil der Erdatmosphäre und ein aktiver Teil des planetarischen Stickstoffkreislaufs. Die Analyse von Luftproben, die an Standorten auf der ganzen Welt gesammelt wurden, ergab, dass seine Konzentration im Jahr 2017 330 ppb überstieg. Die Wachstumsrate von etwa 1 ppb pro Jahr hat sich in den letzten Jahrzehnten ebenfalls beschleunigt. Die Häufigkeit von Lachgas in der Atmosphäre ist von einem Ausgangswert von etwa 270 ppb im Jahr 1750 um mehr als 20 % gestiegen.
Wichtige atmosphärische Eigenschaften von N
2O sind in der folgenden Tabelle zusammengefasst:
| Eigenschaft | Wert ⓘ |
|---|---|
| Ozonabbaupotenzial (ODP) | 0,17 (CCl3F = 1) |
| Erderwärmungspotenzial (GWP: 100 Jahre) | 265 (CO2 = 1) |
| Atmosphärische Lebensdauer | 121 Jahre |
Im Oktober 2020 veröffentlichten Wissenschaftler eine umfassende Quantifizierung der globalen N
2O-Quellen und -Senken. Sie berichten, dass die vom Menschen verursachten Emissionen in den letzten vier Jahrzehnten um 30 % gestiegen sind und die Hauptursache für den Anstieg der atmosphärischen Konzentration darstellen. Das jüngste Wachstum hat einige der höchsten Emissionsszenarien übertroffen. ⓘ
Emissionen nach Quellen
Für 2010 wurde geschätzt, dass etwa 29,5 Millionen Tonnen N
2O (mit 18,8 Millionen Tonnen Stickstoff) jährlich in die Atmosphäre gelangten, wovon 64 % natürlich und 36 % durch menschliche Aktivitäten verursacht waren. ⓘ
Der größte Teil des N
2O, das aus natürlichen und anthropogenen Quellen in die Atmosphäre gelangt, wird von Mikroorganismen wie denitrifizierenden Bakterien und Pilzen in Böden und Ozeanen produziert. Böden unter natürlicher Vegetation sind eine wichtige Lachgasquelle, auf die 60 % aller natürlich erzeugten Emissionen entfallen. Weitere natürliche Quellen sind die Ozeane (35 %) und chemische Reaktionen in der Atmosphäre (5 %). ⓘ
Eine Studie aus dem Jahr 2019 zeigt, dass die Emissionen aus dem auftauenden Permafrost 12-mal höher sind als bisher angenommen. ⓘ
Die wichtigsten Komponenten der anthropogenen Emissionen sind gedüngte landwirtschaftliche Böden und Viehdung (42 %), Abfluss und Auswaschung von Düngemitteln (25 %), Verbrennung von Biomasse (10 %), Verbrennung fossiler Brennstoffe und industrielle Prozesse (10 %), biologischer Abbau anderer stickstoffhaltiger atmosphärischer Emissionen (9 %) und menschliche Abwässer (5 %). Die Landwirtschaft fördert die Lachgasproduktion durch die Bodenbearbeitung, den Einsatz von Stickstoffdüngern und die Behandlung von tierischen Abfällen. Diese Aktivitäten regen natürlich vorkommende Bakterien dazu an, mehr Lachgas zu produzieren. Die Messung von Lachgasemissionen aus dem Boden kann schwierig sein, da sie zeitlich und räumlich stark schwanken und der Großteil der Emissionen eines Jahres unter günstigen Bedingungen während "heißer Momente" und/oder an günstigen Orten, den so genannten "Hotspots", auftreten kann. ⓘ
Unter den industriellen Emissionen sind die Produktion von Salpetersäure und Adipinsäure die größten Quellen für Lachgasemissionen. Die Adipinsäure-Emissionen entstehen insbesondere durch den Abbau des Nitrolsäure-Zwischenprodukts, das bei der Nitrierung von Cyclohexanon entsteht. ⓘ
Biologische Prozesse
Natürliche Prozesse, die Lachgas erzeugen, können als Nitrifikation und Denitrifikation klassifiziert werden. Dazu gehören im Einzelnen:
- aerobe autotrophe Nitrifikation, die schrittweise Oxidation von Ammoniak (NH
3) zu Nitrit (NO-
2) und zu Nitrat (NO-
3) - anaerobe heterotrophe Denitrifikation, die schrittweise Reduktion von NO-
3 zu NO-
2, Stickstoffmonoxid (NO), N
2O und schließlich N
2, wobei fakultative anaerobe Bakterien NO-
3 als Elektronenakzeptor bei der Veratmung von organischem Material unter der Bedingung, dass nicht genügend Sauerstoff (O
2) - nitrifizierende Denitrifikation, die von autotrophen NH
3-oxidierenden Bakterien durchgeführt wird, und der Weg, auf dem Ammoniak (NH
3) zu Nitrit oxidiert wird (NO-
2), gefolgt von der Reduktion von NO-
2 zu Stickstoffmonoxid (NO), N
2O und molekularem Stickstoff (N
2) - heterotrophe Nitrifikation
- aerobe Denitrifikation durch die gleichen heterotrophen Nitrifikanten
- pilzliche Denitrifikation
- nicht-biologische Chemodenitrifikation ⓘ
Diese Prozesse werden von den chemischen und physikalischen Eigenschaften des Bodens wie der Verfügbarkeit von mineralischem Stickstoff und organischem Material, dem Säuregehalt und der Bodenart sowie von klimatischen Faktoren wie Bodentemperatur und Wassergehalt beeinflusst. ⓘ
Die Emission des Gases in die Atmosphäre wird durch seinen Verbrauch innerhalb der Zellen stark eingeschränkt, der durch einen Prozess katalysiert wird, der durch das Enzym Lachgasreduktase ausgelöst wird. ⓘ
Auswirkungen auf die Umwelt
Treibhauseffekt

Distickstoffoxid hat als Treibhausgas ein erhebliches Treibhauspotenzial. Auf einer Pro-Molekül-Basis, über einen Zeitraum von 100 Jahren betrachtet, hat Distickstoffoxid die 265-fache Fähigkeit der Atmosphäre, Wärme zu binden, wie Kohlendioxid (CO
2). Aufgrund seiner geringen Konzentration (weniger als 1/1.000 der Konzentration von CO
2) ist sein Beitrag zum Treibhauseffekt jedoch weniger als ein Drittel des Beitrags von Kohlendioxid und auch geringer als der von Wasserdampf und Methan. Da andererseits 38 % oder mehr des in die Atmosphäre gelangenden N
2O, das in die Atmosphäre gelangt, das Ergebnis menschlicher Aktivitäten ist, wird die Kontrolle von Lachgas als Teil der Bemühungen um eine Verringerung der Treibhausgasemissionen angesehen. ⓘ
Eine Studie des Nobelpreisträgers Paul Crutzen aus dem Jahr 2008 deutet darauf hin, dass die Menge der Lachgasfreisetzung, die auf Nitratdünger in der Landwirtschaft zurückzuführen ist, erheblich unterschätzt wurde, wobei der größte Teil davon in den Daten der Umweltschutzbehörde vermutlich unter die Freisetzung aus dem Boden und dem Meer fällt. ⓘ
Lachgas wird durch die Landwirtschaft in die Atmosphäre freigesetzt, wenn Landwirte Stickstoffdünger auf den Feldern ausbringen, der durch den Abbau von Tierdung entsteht. Etwa 79 Prozent des gesamten in den Vereinigten Staaten freigesetzten Lachgases stammen aus der Stickstoffdüngung. Lachgas wird auch als Nebenprodukt bei der Verbrennung fossiler Brennstoffe freigesetzt, wobei die freigesetzte Menge davon abhängt, welcher Brennstoff verwendet wurde. Es wird auch bei der Herstellung von Salpetersäure freigesetzt, die bei der Synthese von Stickstoffdüngern verwendet wird. Bei der Herstellung von Adipinsäure, einem Vorprodukt von Nylon und anderen synthetischen Bekleidungsfasern, wird ebenfalls Lachgas freigesetzt. Die Gesamtmenge des freigesetzten Lachgases, die auf den Menschen zurückzuführen ist, beträgt etwa 40 Prozent. ⓘ
Zerstörung der Ozonschicht
Lachgas wird auch mit der Ausdünnung der Ozonschicht in Verbindung gebracht. Eine Studie aus dem Jahr 2009 legt nahe, dass die N
2O-Emissionen die wichtigste ozonabbauende Emission sind und auch im 21. Jahrhundert die größte bleiben werden. ⓘ
Rechtmäßigkeit
In den Vereinigten Staaten ist der Besitz von Distickstoffoxid nach Bundesrecht legal und unterliegt nicht dem Einflussbereich der DEA. Es wird jedoch von der Food and Drug Administration im Rahmen des Food Drug and Cosmetics Act reguliert; eine strafrechtliche Verfolgung ist aufgrund der "Misbranding"-Klauseln möglich, die den Verkauf oder Vertrieb von Distickstoffoxid zum Zwecke des menschlichen Verzehrs verbieten. In vielen Staaten gibt es Gesetze, die den Besitz, den Verkauf und den Vertrieb von Distickstoffoxid regeln. Diese Gesetze verbieten in der Regel die Abgabe an Minderjährige oder begrenzen die Menge an Distickstoffoxid, die ohne Sondergenehmigung verkauft werden darf. Im US-Bundesstaat Kalifornien beispielsweise ist der Besitz von Lachgas für den Freizeitgebrauch verboten und wird als Ordnungswidrigkeit eingestuft. ⓘ
Im August 2015 hat der Rat des Londoner Stadtbezirks Lambeth (Vereinigtes Königreich) den Konsum der Droge zu Freizeitzwecken verboten und Verstöße mit einer Geldstrafe von bis zu 1 000 Pfund belegt. ⓘ
In Neuseeland hat das Gesundheitsministerium darauf hingewiesen, dass Distickstoffoxid ein verschreibungspflichtiges Medikament ist und sein Verkauf oder Besitz ohne Rezept eine Straftat nach dem Arzneimittelgesetz darstellt. Diese Aussage würde anscheinend alle nichtmedizinischen Verwendungen von Distickstoffoxid verbieten, auch wenn angedeutet wird, dass nur der Freizeitgebrauch legalisiert werden soll. ⓘ
In Indien ist die Umfüllung von Distickstoffoxid aus Großflaschen in kleinere, leichter zu transportierende Tanks des Typs E mit einem Fassungsvermögen von 1.590 Litern legal, wenn das Gas für die medizinische Anästhesie verwendet werden soll. ⓘ
Namensherkunft
Die deutsche Bezeichnung als „Lachgas“ ist eine Übersetzung des englischen Wortes laughing gas. ⓘ
Für die Herkunft des Namens gibt es unterschiedliche Vermutungen; eine ist, dass der Name von einer Euphorie herrührt, die beim Einatmen von Lachgas entstehen kann, sodass der Konsument lacht. So schrieb Gardner Quincy Colton, der 1863 das nach dem Tod von Horace Wells zunächst als Anästhetikum außer Gebrauch gekommene Lachgas wieder eingeführt hatte, 1866: „The laughing gas […] acts as an exhilarant, as by supplying an extra supply of oxygen to the lungs, the pulse is increased fifteen to twenty beats to the minute. The former agents carry the patients down towards the point of death: the latter up into increased life.“ Das am 10. Dezember 1844 in Hartford öffentlich zur Schau gestellte Distickstoffmonoxid wurde als „Exhilarating or Laughing Gas“ bezeichnet und den zu unterhaltenden Zuschauern plakativ angekündigt als Gas, das je nach Charakter der damit berauschten Probanden bei Inhalation Lachen, Singen, Tanzen, Reden oder Prügeln bewirken könne. ⓘ
Eigenschaften
Lachgas ist in kaltem Wasser gut löslich: Bei 0 °C löst sich das Gas im Volumenverhältnis 1 : 1,305 in flüssigem Wasser, bei 25 °C immer noch im Verhältnis 1 : 0,596. Aus neutralen wässrigen Lösungen lässt sich bei tiefen Temperaturen ein kristallines Gashydrat ausscheiden, in dem auf jedes N2O-Molekül 5,75 Wassermoleküle kommen. Unter erhöhtem Druck weist Lachgas sehr gute Löslichkeit in Fetten auf. ⓘ
Lachgas ist nicht brennbar, kann aber andere Stoffe oxidieren. Daher wirkt es brandfördernd. Kohle, Schwefel und Phosphor brennen in Lachgas wie in Sauerstoff. So kann man die Bildung von Distickstoffmonoxid in einer Probe mit der Glimmspanprobe nachweisen. Um auch andere Stoffe zu oxidieren, benötigt es eine deutlich höhere Temperatur als Sauerstoff bei den entsprechenden Reaktionen. Da N2O eine metastabile Verbindung ist, zerfällt es bei ca. 600 °C in seine Elemente:
- . ⓘ
Unter der Bezeichnung E 942 ist Lachgas als Lebensmittelzusatzstoff zur Verwendung als Treibgas zugelassen, beispielsweise für Schlagsahne; es ist dem annähernd gleich schweren, isoelektronischen Kohlendioxid in seinen physikalischen Eigenschaften wie der Dichte der kondensierten Flüssigkeit oder Schmelz- und Siedepunkt sehr ähnlich. ⓘ
Thermodynamik
Pharmakologie
Das Gas ist farblos, geruchlos und geschmacklos; teilweise wird über einen leicht süßlichen Geschmack beim Einatmen berichtet. Es wirkt schmerzstillend und schwach narkotisch. Analgetische (schmerzstillende) Effekte treten ab einer Konzentration von etwa 20 Prozent Distickstoffmonoxid in der Atemluft auf. Lachgas oxidiert im Körper Vitamin B12, welches dann als Co-Enzym dem Enzym Methionin-Synthase nicht mehr zur Verfügung steht. So kommt es bei einer Anwendung von Lachgas von über sechs Stunden zu einer Funktionsabnahme der Methionin-Synthase, die für die Produktion vieler wichtiger Eiweißbausteine wichtig ist. Die Wirkung von Lachgas ist nur kurz, bereits nach ungefähr 15 Minuten sind keine Wirkungen mehr wahrnehmbar. Lachgas kann aufgrund der schmerzstillenden Wirkung in der Anästhesie zur Durchführung einer Vollnarkose dem Gasgemisch beigefügt werden, wo es den Verbrauch der inhalativen Anästhetika stark reduziert. ⓘ
Vor dem Hintergrund alternativer Narkoseverfahren, verbesserter Gerätetechnik (z. B. low-flow-Anästhesie) und erhöhter Vigilanz bezüglich möglicher Umweltbelastungen (Treibhausgas) wird seit Ende der 1990er Jahre weniger Lachgas in der Anästhesie verwendet. Viele Krankenhäuser sind zwischenzeitlich aus dem Gebrauch von Lachgas ausgestiegen und nutzen in der zentralen Gasversorgung nur noch Druckluft und Sauerstoff. Aus medizinischer Sicht spricht jedoch weiterhin wenig gegen die Verwendung von Lachgas zur Narkose. ⓘ