Ovarialkarzinom
| Eierstockkrebs ⓘ | |
|---|---|
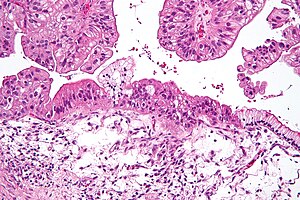 | |
| Mikroskopische Aufnahme eines muzinösen Ovarialkarzinoms, gefärbt mit H&E. | |
| Fachgebiet | Onkologie, Gynäkologie |
| Symptome | Früh: vage Später: Blähungen, Beckenschmerzen, Verstopfung, Schwellung des Abdomens, Appetitlosigkeit |
| Übliches Auftreten | Übliches Alter bei der Diagnose 63 Jahre |
| Arten | Ovarialkarzinom, Keimzelltumor, Geschlechtsstrangstromatumor |
| Risikofaktoren | Kinderlosigkeit, Hormontherapie nach der Menopause, Fruchtbarkeitsmedikamente, Adipositas, Genetik |
| Diagnostische Methode | Biopsie des Gewebes |
| Behandlung | Operation, Strahlentherapie, Chemotherapie |
| Prognose | Fünf-Jahres-Überlebensrate ca. 49% (US) |
| Häufigkeit | 1,2 Millionen (2015) |
| Todesfälle | 161,100 (2015) |
Eierstockkrebs ist eine Krebserkrankung, die sich in oder an einem Eierstock bildet. Er führt zu abnormen Zellen, die in andere Teile des Körpers eindringen oder sich dort ausbreiten können. Zu Beginn dieses Prozesses treten möglicherweise keine oder nur vage Symptome auf. Je weiter der Krebs fortschreitet, desto deutlicher werden die Symptome. Diese Symptome können unter anderem Blähungen, Beckenschmerzen, Schwellungen im Bauchraum, Verstopfung und Appetitlosigkeit sein. Der Krebs kann sich unter anderem auf die Bauchdecke, die Lymphknoten, die Lunge und die Leber ausbreiten. ⓘ
Das Risiko, an Eierstockkrebs zu erkranken, steigt bei Frauen, die im Laufe ihres Lebens mehr Eisprünge hatten. Dazu gehören Frauen, die noch nie Kinder hatten, Frauen, die ihren Eisprung in jüngeren Jahren haben, und Frauen, die erst im höheren Alter in die Wechseljahre kommen. Weitere Risikofaktoren sind eine Hormontherapie nach der Menopause, Fruchtbarkeitsmedikamente und Übergewicht. Zu den Faktoren, die das Risiko verringern, gehören hormonelle Geburtenkontrolle, Eileiterunterbindung und Stillen. Etwa 10 % der Fälle sind auf ein vererbtes genetisches Risiko zurückzuführen; Frauen mit Mutationen in den Genen BRCA1 oder BRCA2 haben eine etwa 50-prozentige Chance, an der Krankheit zu erkranken. Das Ovarialkarzinom ist die häufigste Form von Eierstockkrebs und macht mehr als 95 % der Fälle aus. Es gibt fünf Hauptunterarten des Ovarialkarzinoms, von denen das hochgradige seröse Karzinom (HGSC) die häufigste ist. Es wird angenommen, dass diese Eierstocktumore von den Zellen ausgehen, die die Eierstöcke bedecken, obwohl einige auch in den Eileitern entstehen können. Zu den selteneren Arten von Eierstockkrebs gehören Keimzelltumore und Stromatumore des Geschlechtsorgans. Die Diagnose Eierstockkrebs wird durch eine Gewebebiopsie bestätigt, die in der Regel während einer Operation entnommen wird. ⓘ
Bei Frauen mit durchschnittlichem Risiko wird das Screening nicht empfohlen, da eine Verringerung der Sterblichkeitsrate nicht belegt ist und die hohe Rate falsch positiver Tests zu unnötigen Operationen führen kann, die mit eigenen Risiken verbunden sind. Bei Frauen mit einem sehr hohen Risiko können die Eierstöcke als Präventivmaßnahme entfernt werden. Wenn Eierstockkrebs in einem frühen Stadium erkannt und behandelt wird, ist er häufig heilbar. Die Behandlung umfasst in der Regel eine Kombination aus Operation, Strahlentherapie und Chemotherapie. Die Heilungschancen hängen vom Ausmaß der Erkrankung, dem Subtyp des Krebses und anderen medizinischen Bedingungen ab. Die Gesamtüberlebensrate nach fünf Jahren liegt in den Vereinigten Staaten bei 49 %. In den Entwicklungsländern sind die Überlebenschancen schlechter. ⓘ
Im Jahr 2012 traten neue Fälle bei etwa 239 000 Frauen auf. Im Jahr 2015 erkrankten 1,2 Millionen Frauen an der Krankheit, die weltweit 161 100 Todesfälle zur Folge hatte. Bei Frauen ist es die siebthäufigste Krebserkrankung und die achthäufigste krebsbedingte Todesursache. Das typische Alter für die Diagnose liegt bei 63 Jahren. Der Tod durch Eierstockkrebs tritt in Nordamerika und Europa häufiger auf als in Afrika und Asien. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| C56 | Bösartige Neubildung des Ovars |
| ICD-10 online (WHO-Version 2019) | |

Das Ovarialkarzinom oder Eierstockkrebs ist eine bösartige Erkrankung der Eierstöcke. Es ist in der westlichen Welt nach dem Endometrium- und dem Zervixkarzinom das dritthäufigste Genitalmalignom der Frau und hat eine schlechtere Prognose als jene. ⓘ
Anzeichen und Symptome
Frühsymptome

Frühe Anzeichen und Symptome von Eierstockkrebs können fehlen oder unauffällig sein. In den meisten Fällen bestehen die Symptome mehrere Monate lang, bevor sie erkannt und diagnostiziert werden. Die Symptome können als Reizdarmsyndrom fehldiagnostiziert werden. Die frühen Stadien von Eierstockkrebs sind in der Regel schmerzfrei. Die Symptome können je nach Subtyp variieren. Borderline-Tumoren der Eierstöcke, die auch als Ovarialtumoren mit niedrigem Malignitätspotenzial (LMP) bezeichnet werden, verursachen keinen Anstieg des CA125-Spiegels und sind im Ultraschall nicht zu erkennen. Zu den typischen Symptomen eines LMP-Tumors können Blähungen oder Schmerzen im Beckenbereich gehören. Besonders große Geschwülste sind in der Regel gutartig oder grenzwertig. ⓘ
Zu den typischsten Symptomen von Eierstockkrebs gehören Blähungen, Bauch- oder Beckenschmerzen oder -beschwerden, Rückenschmerzen, unregelmäßige Menstruation oder vaginale Blutungen nach den Wechseljahren, Schmerzen oder Blutungen nach oder während des Geschlechtsverkehrs, Appetitlosigkeit, Müdigkeit, Durchfall, Verdauungsstörungen, Sodbrennen, Verstopfung, Übelkeit, Völlegefühl und möglicherweise Symptome beim Wasserlassen (einschließlich häufiges Wasserlassen und dringendes Wasserlassen). ⓘ
Die Symptome sind oft unspezifisch, wie z. B. gastrointestinale Beschwerden, Leistungsminderung oder Blutungsstörungen, sodass die Tumoren häufig erst in fortgeschrittenem Stadium erkannt werden. In 25 % der Fälle wird über genitale Blutungen berichtet. ⓘ
Spätere Symptome
Die wachsende Masse kann Schmerzen verursachen, wenn sich eine Eierstocktorsion entwickelt. Die Symptome können durch eine Masse, die auf andere Organe des Bauchraums und des Beckens drückt, oder durch Metastasen verursacht werden. Treten diese Symptome häufiger oder stärker als gewöhnlich auf, insbesondere wenn in der Vorgeschichte keine nennenswerten Beschwerden aufgetreten sind, wird an Eierstockkrebs gedacht. Metastasen können ein Schwester-Maria-Joseph-Knötchen verursachen. Selten können Teratome ein wachsendes Teratomsyndrom oder eine peritoneale Gliomatose verursachen. In den meisten Fällen treten nach der Menopause Menometrorrhagie und abnorme vaginale Blutungen auf. Weitere häufige Symptome sind Hirsutismus, Unterleibsschmerzen, Virilisierung und eine adnexale Masse. ⓘ
Kinder
Bei Jugendlichen oder Kindern mit Ovarialtumoren können Symptome wie starke Bauchschmerzen, Reizungen des Bauchfells oder Blutungen auftreten. Die Symptome von Tumoren der Geschlechtsorgane produzieren Hormone, die die Entwicklung der sekundären Geschlechtsmerkmale beeinflussen können. Bei Kindern in der Vorpubertät können sich Geschlechtsstrangstromatumoren durch eine frühe Pubertät bemerkbar machen; Bauchschmerzen und Blähungen sind ebenfalls häufig. Bei Jugendlichen mit Geschlechtsbandtumoren kann eine Amenorrhoe auftreten. Wenn der Krebs weiter fortgeschritten ist, kann er eine Flüssigkeitsansammlung im Bauchraum verursachen. Wenn die bösartige Erkrankung zu dem Zeitpunkt, zu dem sie Aszites verursacht, noch nicht diagnostiziert wurde, wird sie in der Regel kurz danach diagnostiziert. Fortgeschrittene Krebserkrankungen können auch Bauchgeschwüre, Lymphknotengeschwüre oder Pleuraergüsse verursachen. ⓘ
Risikofaktoren
Eierstockkrebs steht im Zusammenhang mit der Dauer des Eisprungs. So ist es ein Risikofaktor für Eierstockkrebs, keine Kinder zu haben, wahrscheinlich weil der Eisprung durch die Schwangerschaft unterdrückt wird. Während des Eisprungs werden die Zellen ständig zur Teilung angeregt, während die Ovulationszyklen weiterlaufen. Daher haben Frauen, die keine Kinder geboren haben, ein doppelt so hohes Risiko, an Eierstockkrebs zu erkranken, wie Frauen, die Kinder geboren haben. Ein längerer Zeitraum des Eisprungs aufgrund einer frühen ersten Menstruation und einer späten Menopause ist ebenfalls ein Risikofaktor. Fettleibigkeit und Hormonersatztherapie erhöhen das Risiko ebenfalls. ⓘ
Das Risiko, an Eierstockkrebs zu erkranken, ist bei Frauen geringer, die weniger oder gar keine Menstruationszyklen haben, die stillen, orale Verhütungsmittel einnehmen, mehrfach schwanger sind oder in jungen Jahren schwanger wurden. Das Risiko, an Eierstockkrebs zu erkranken, ist bei Frauen geringer, bei denen eine Eileiterunterbindung (umgangssprachlich "Tubenbindung"), die Entfernung beider Eierstöcke oder eine Hysterektomie (eine Operation, bei der die Gebärmutter und manchmal auch der Gebärmutterhals entfernt werden) durchgeführt wurde. Auch das Alter ist ein Risikofaktor. ⓘ
Hormone
Die Einnahme von Fruchtbarkeitsmedikamenten kann zur Bildung von Borderline-Tumoren an den Eierstöcken beitragen, aber der Zusammenhang zwischen beiden ist umstritten und schwer zu untersuchen. Fruchtbarkeitsmedikamente können mit einem höheren Risiko für Borderline-Tumore verbunden sein. Frauen, die wegen Unfruchtbarkeit behandelt wurden, aber nicht gebärfähig sind, haben ein höheres Risiko für epithelialen Eierstockkrebs; bei Frauen, die erfolgreich wegen Unfruchtbarkeit behandelt wurden und anschließend ein Kind zur Welt bringen, besteht jedoch kein höheres Risiko. Dies könnte auf die Ausscheidung von Krebsvorläuferzellen während der Schwangerschaft zurückzuführen sein, doch ist die Ursache dafür noch unklar. Der Risikofaktor könnte vielmehr die Unfruchtbarkeit selbst sein, nicht die Behandlung. ⓘ
Hormonelle Erkrankungen wie das polyzystische Ovarialsyndrom und die Endometriose werden mit Eierstockkrebs in Verbindung gebracht, aber der Zusammenhang ist nicht vollständig bestätigt. Eine postmenopausale Hormonersatztherapie (HRT) mit Östrogen erhöht wahrscheinlich das Risiko für Eierstockkrebs. Dieser Zusammenhang wurde zwar nicht in einer groß angelegten Studie bestätigt, doch haben namhafte Studien wie die Million Women Study diesen Zusammenhang bestätigt. Eine postmenopausale HRT mit einer Kombination aus Östrogen und Progesteron kann das Risiko für Eierstockkrebs erhöhen, wenn sie länger als 5 Jahre angewendet wird, aber dieses Risiko kehrt nach Beendigung der Therapie auf den Normalwert zurück. Eine Östrogen-HRT mit oder ohne Gestagene erhöht das Risiko für endometrioide und seröse Tumore, senkt aber das Risiko für muzinöse Tumore. Höhere Östrogendosierungen erhöhen dieses Risiko. Endometriose ist ein weiterer Risikofaktor für Eierstockkrebs, ebenso wie Schmerzen bei der Menstruation. Endometriose ist mit klarzelligen und endometrioiden Subtypen, niedriggradigen serösen Tumoren, Tumoren im Stadium I und II, Tumoren des Grades 1 und einer geringeren Sterblichkeit verbunden. ⓘ
Vor der Menopause kann Fettleibigkeit das Risiko für Eierstockkrebs erhöhen, nach der Menopause ist dieses Risiko nicht mehr gegeben. Dieses Risiko besteht auch bei Personen, die sowohl fettleibig sind als auch nie eine Hormonersatztherapie angewendet haben. Ein ähnlicher Zusammenhang mit Eierstockkrebs zeigt sich bei größeren Frauen. ⓘ
Genetik
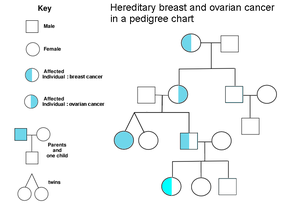
Eine familiäre Vorgeschichte von Eierstockkrebs ist ein Risikofaktor für Eierstockkrebs. Frauen mit erblichem nichtpolypösem Dickdarmkrebs (Lynch-Syndrom) und Frauen mit genetischen Anomalien BRCA-1 und BRCA-2 haben ein erhöhtes Risiko. ⓘ
Der wichtigste genetische Risikofaktor für Eierstockkrebs ist eine Mutation in den BRCA1- oder BRCA2-Genen oder in DNA-Mismatch-Reparatur-Genen, die in 10 % der Fälle von Eierstockkrebs vorliegt. Es muss nur ein Allel mutiert sein, damit eine Person ein hohes Risiko hat. Das Gen kann entweder über die mütterliche oder die väterliche Linie vererbt werden, hat aber eine unterschiedliche Penetranz. Obwohl Mutationen in diesen Genen in der Regel mit einem erhöhten Brustkrebsrisiko verbunden sind, bergen sie auch ein erhebliches Lebenszeitrisiko für Eierstockkrebs, das in den 40er und 50er Jahren seinen Höhepunkt erreicht. Das niedrigste Risiko wird mit 30 % angegeben, das höchste mit 60 %. Bei BRCA1-Mutationen liegt das Lebenszeitrisiko, an Eierstockkrebs zu erkranken, bei 15-45 %. BRCA2-Mutationen sind weniger riskant als BRCA1-Mutationen, mit einem Lebenszeitrisiko von 10 % (niedrigstes genanntes Risiko) bis 40 % (höchstes genanntes Risiko). Im Durchschnitt entwickeln sich BRCA-assoziierte Krebserkrankungen 15 Jahre vor den sporadischen Krebserkrankungen, da Menschen, die die Mutationen auf einer Kopie ihres Gens geerbt haben, nur eine Mutation benötigen, um den Prozess der Krebsentstehung in Gang zu setzen, während Menschen mit zwei normalen Genen zwei Mutationen erwerben müssten. ⓘ
In den Vereinigten Staaten erkranken fünf von 100 Frauen mit einer Verwandten ersten Grades, die an Eierstockkrebs erkrankt ist, irgendwann selbst an Eierstockkrebs, so dass das Risiko bei Frauen mit betroffenen Familienmitgliedern dreimal so hoch ist wie bei Frauen mit nicht betroffenen Familienmitgliedern. Sieben von 100 Frauen mit zwei oder mehr Verwandten mit Eierstockkrebs werden irgendwann selbst an Eierstockkrebs erkranken. Im Allgemeinen haben 5-10 % der Fälle von Eierstockkrebs eine genetische Ursache. BRCA-Mutationen werden mit hochgradigem serösem nicht-schleimigem epithelialem Eierstockkrebs in Verbindung gebracht. ⓘ
Eine ausgeprägte Familienanamnese von Endometriumkrebs, Darmkrebs oder anderen gastrointestinalen Krebsarten kann auf ein Syndrom hinweisen, das als hereditäres nichtpolypöses kolorektales Karzinom (auch Lynch-Syndrom genannt) bekannt ist und ein höheres Risiko für die Entwicklung einer Reihe von Krebsarten, einschließlich Eierstockkrebs, mit sich bringt. Das Lynch-Syndrom wird durch Mutationen in Mismatch-Reparatur-Genen verursacht, darunter MSH2, MLH1, MLH6, PMS1 und PMS2. Das Risiko, an Eierstockkrebs zu erkranken, liegt bei Personen mit Lynch-Syndrom zwischen 10 und 12 Prozent. Frauen isländischer Abstammung, europäischer jüdischer Abstammung/Ashkenazi-Juden und ungarischer Abstammung haben ein höheres Risiko für epithelialen Eierstockkrebs. Das Östrogenrezeptor-Beta-Gen (ESR2) scheint ein Schlüssel zur Pathogenese und zum Ansprechen auf die Therapie zu sein. Weitere Gene, die mit Eierstockkrebs in Verbindung gebracht wurden, sind BRIP1, MSH6, RAD51C und RAD51D. CDH1, CHEK2, PALB2 und RAD50 wurden ebenfalls mit Eierstockkrebs in Verbindung gebracht. ⓘ
Mehrere seltene genetische Störungen werden mit bestimmten Subtypen von Eierstockkrebs in Verbindung gebracht. Das Peutz-Jeghers-Syndrom, eine seltene genetische Störung, prädisponiert Frauen ebenfalls für einen Geschlechtsstrang-Tumor mit ringförmigen Tubuli. Die Ollier-Krankheit und das Maffucci-Syndrom werden mit Granulosazelltumoren bei Kindern in Verbindung gebracht und können auch mit Sertoli-Leydig-Tumoren assoziiert sein. Gutartige Fibrome werden mit dem Syndrom des nevoiden Basalzellkarzinoms in Verbindung gebracht. ⓘ
Ernährung
Alkoholkonsum scheint nicht mit Eierstockkrebs in Verbindung zu stehen. ⓘ
Die Amerikanische Krebsgesellschaft empfiehlt eine gesunde Ernährung mit viel Obst, Gemüse und Vollkornprodukten sowie eine Ernährung, die rotes und verarbeitetes Fleisch und verarbeiteten Zucker vermeidet oder einschränkt. Ein hoher Konsum von gesättigten Fettsäuren und Transfettsäuren erhöht das Eierstockkrebsrisiko. Eine Übersichtsstudie aus dem Jahr 2021 ergab, dass der Verzehr von Kaffee, Eiern und Fett das Risiko für Eierstockkrebs deutlich erhöht. Die Studien zum Eierstockkrebsrisiko und zum Verzehr von Milchprodukten liefern gemischte Erkenntnisse. ⓘ
Umweltfaktoren
In den Industrieländern, mit Ausnahme Japans, sind die Raten für epithelialen Eierstockkrebs hoch, was möglicherweise auf die Ernährung in diesen Ländern zurückzuführen ist. Weiße Frauen haben ein 30-40 % höheres Risiko für Eierstockkrebs als schwarze und hispanische Frauen, was wahrscheinlich auf sozioökonomische Faktoren zurückzuführen ist; weiße Frauen haben in der Regel weniger Kinder und eine andere Häufigkeit von gynäkologischen Operationen, die das Risiko für Eierstockkrebs beeinflussen. ⓘ
Es gibt Hinweise darauf, dass Talkum, Pestizide und Herbizide das Risiko für Eierstockkrebs erhöhen. Die American Cancer Society weist darauf hin, dass bisher keine Studie eine einzelne Chemikalie in der Umwelt oder in der menschlichen Ernährung direkt mit Mutationen in Verbindung bringen konnte, die Eierstockkrebs verursachen. ⓘ
Andere
Andere untersuchte Faktoren wie Rauchen, ein niedriger Vitamin-D-Spiegel im Blut, das Vorhandensein von Einschlusszysten in den Eierstöcken und eine Infektion mit dem humanen Papillomavirus (Ursache einiger Fälle von Gebärmutterhalskrebs) konnten als Risikofaktoren für Eierstockkrebs widerlegt werden. Die Karzinogenität von Perinealtalk ist umstritten, da er als Reizstoff wirken kann, wenn er durch den Fortpflanzungstrakt zu den Eierstöcken gelangt. Fall-Kontroll-Studien haben gezeigt, dass die Verwendung von Damm-Talk ein erhöhtes Risiko für Eierstockkrebs mit sich bringt, aber eine häufigere Verwendung von Talk führt nicht zu einem höheren Risiko. Die Verwendung von Talk an anderen Stellen des Körpers steht in keinem Zusammenhang mit Eierstockkrebs. Regelmäßiges und langes Sitzen ist mit einer höheren Sterblichkeit an epithelialem Eierstockkrebs verbunden. Das Risiko wird durch regelmäßige körperliche Betätigung nicht aufgehoben, aber es wird gesenkt. ⓘ
Ein höheres Alter (bis 70 Jahre) ist ein Risikofaktor für epithelialen Eierstockkrebs, da sich mehr Mutationen in den Zellen ansammeln und schließlich Krebs verursachen können. Bei den über 80-Jährigen ist das Risiko etwas geringer. ⓘ
Das Rauchen von Tabak wird mit einem höheren Risiko für schleimigen Eierstockkrebs in Verbindung gebracht; nach Beendigung des Rauchens kehrt das Risiko schließlich auf den Normalwert zurück. Höhere Werte des C-reaktiven Proteins werden mit einem höheren Risiko für Eierstockkrebs in Verbindung gebracht. ⓘ
Schützende Faktoren
Die Unterdrückung des Eisprungs, der andernfalls zu einer Schädigung des Eierstockepithels und damit zu einer Entzündung führen würde, ist im Allgemeinen schützend. Dieser Effekt kann durch Kindererziehung, die Einnahme kombinierter oraler Kontrazeptiva und das Stillen erreicht werden, die allesamt Schutzfaktoren darstellen. Eine längere Stillzeit korreliert mit einem größeren Rückgang des Eierstockkrebsrisikos. Mit jeder Geburt sinkt das Risiko für Eierstockkrebs stärker, und dieser Effekt ist bei bis zu fünf Geburten zu beobachten. Kombinierte orale Kontrazeptiva verringern das Risiko für Eierstockkrebs um bis zu 50 %, und die schützende Wirkung der kombinierten oralen Kontrazeptiva kann 25-30 Jahre nach dem Absetzen der Mittel anhalten. Die regelmäßige Einnahme von Aspirin oder Acetaminophen (Paracetamol) kann mit einem geringeren Risiko für Eierstockkrebs in Verbindung gebracht werden; andere NSAIDs scheinen keine ähnliche Schutzwirkung zu haben. ⓘ
Die Eileiterunterbindung wirkt schützend, da Karzinogene nicht über die Vagina, die Gebärmutter und die Eileiter in den Eierstock und die Fimbrien gelangen können. Die Eileiterunterbindung schützt auch Frauen mit der BRCA1-Mutation, nicht jedoch mit der BRCA2-Mutation. Eine Hysterektomie verringert das Risiko, und die Entfernung sowohl der Eileiter als auch der Eierstöcke (bilaterale Salpingo-Oophorektomie) senkt das Risiko nicht nur für Eierstockkrebs, sondern auch für Brustkrebs drastisch. Dies ist noch Gegenstand der Forschung, da der Zusammenhang zwischen Hysterektomie und geringerem Eierstockkrebsrisiko umstritten ist. Die Gründe für die schützende Wirkung der Hysterektomie sind bis 2015 noch nicht geklärt. ⓘ
Eine Ernährung, die große Mengen an Karotin, Ballaststoffen und Vitaminen und wenig Fett enthält - insbesondere eine Ernährung mit nicht stärkehaltigen Gemüsesorten (z. B. Brokkoli und Zwiebeln) - kann schützend wirken. Ballaststoffe werden mit einem deutlich geringeren Risiko für Eierstockkrebs in Verbindung gebracht. In einer Übersichtsarbeit aus dem Jahr 2021 wurde festgestellt, dass der Verzehr von grünem Blattgemüse, Alliumgemüse, Ballaststoffen, Flavanoiden und grünem Tee das Risiko für Eierstockkrebs deutlich senken kann. ⓘ
Pathophysiologie
| Mutiertes Gen | Art der Mutation | Untertyp | Prävalenz |
|---|---|---|---|
| AKT1 | Amplifikation | 3% | |
| AKT2 | Amplifikation/Mutation | 6%, 20% | |
| ARID1A | Punktmutation | endometrioid und klarzellig | |
| BECN1 | Deletion | ||
| BRAF | Punktmutation | niedriggradig serös | 0.5% |
| BRCA1 | Nonsens-Mutation | hochgradig serös | 5% |
| BRCA2 | Frameshift-Mutation | hochgradig serös | 3% |
| CCND1 | Amplifikation | 4% | |
| CCND2 | Hochregulierung | 15% | |
| CCNE1 | Amplifikation | 20% | |
| CDK12 | hochgradig serös | ||
| CDKN2A | Herunterregulierung (30%) und Deletion (2%) | 32% | |
| CTNNB1 | Klarzelle | ||
| DICER1 | Missense-Mutation (somatisch) | nicht-epithelial | 29% |
| DYNLRB1 (km23) | Mutation | 42% | |
| EGFR | Amplifikation/Überexpression | 20% | |
| ERBB2 (Her2/neu) | Amplifikation/Überexpression | muzinös und niedriggradig serös | 30% |
| FMS | Koexpression mit CSF-1 | 50% | |
| FOXL2 | Punktmutation (402 C zu G) | adulte Granulosazellen | ~100% |
| JAG1 | Amplifikation | 2% | |
| JAG2 | Amplifikation | 3% | |
| KRAS | Amplifikation | muzinös und niedriggradig serös | 11% |
| MAML1 | Amplifikation und Punktmutation | 2% | |
| MAML2 | Amplifikation und Punktmutation | 4% | |
| MAML3 | Amplifikation | 2% | |
| MLH1 | 1% | ||
| NF1 | Deletion (8%) und Punktmutation (4%) | hochgradig serös | 12% |
| NOTCH3 | Amplifikation und Punktmutation | 11% | |
| NRAS | niedriggradig serös | ||
| PIK3C3 (PI3K3) | Amplifikation/Mutation | 12–20% | |
| PIK3CA | Amplifikation | endometrioid und klarzellig | 18% |
| PPP2R1A | endometrioid und klarzellig | ||
| PTEN | Deletion | endometrioid und klarzellig | 7% |
| RB1 | Deletion (8%) und Punktmutation (2%) | 10% | |
| TGF-β | Mutation/Überexpression | 12% | |
| TP53 | Mutation/Überexpression | hochgradig serös | 20–50% |
| TβRI | Mutation | 33% | |
| TβRII | Mutation | 25% | |
| USP36 | Überexpression |
Eierstockkrebs entsteht, wenn Fehler im normalen Wachstum der Eierstockzellen auftreten. Wenn Zellen altern oder beschädigt werden, sterben sie normalerweise ab, und neue Zellen treten an ihre Stelle. Krebs entsteht, wenn sich nicht benötigte neue Zellen bilden und alte oder beschädigte Zellen nicht so absterben, wie sie sollten. Die Anhäufung zusätzlicher Zellen bildet oft eine Gewebemasse, die als Eierstocktumor oder -wucherung bezeichnet wird. Diese abnormen Krebszellen weisen viele genetische Anomalien auf, die sie zu einem übermäßigen Wachstum veranlassen. Wenn ein Eierstock eine Eizelle freisetzt, platzt der Eibläschenfollikel auf und bildet den Gelbkörper (Corpus luteum). Diese Struktur muss durch sich teilende Zellen im Eierstock repariert werden. Ein kontinuierlicher Eisprung über einen langen Zeitraum hinweg bedeutet, dass mehr Reparaturen im Eierstock durch sich teilende Zellen vorgenommen werden müssen, die bei jeder Teilung Mutationen erwerben können. ⓘ
Insgesamt treten die häufigsten Genmutationen bei Eierstockkrebs in NF1, BRCA1, BRCA2 und CDK12 auf. Ovarialkarzinome vom Typ I, die tendenziell weniger aggressiv sind, weisen in der Regel eine Mikrosatelliteninstabilität in mehreren Genen auf, darunter sowohl Onkogene (vor allem BRAF und KRAS) als auch Tumorsuppressoren (vor allem PTEN). Die häufigsten Mutationen bei Typ-I-Krebs sind KRAS, BRAF, ERBB2, PTEN, PIK3CA und ARID1A. Bei Krebserkrankungen des Typs II, dem aggressiveren Typ, sind verschiedene Gene mutiert, darunter p53, BRCA1 und BRCA2. Niedriggradige Krebsarten weisen in der Regel Mutationen in KRAS auf, während Krebsarten jeglichen Grades, die sich aus Tumoren mit geringem Malignitätspotenzial entwickeln, in der Regel Mutationen in p53 aufweisen. Typ-I-Karzinome entwickeln sich in der Regel aus Vorläuferläsionen, während sich Typ-II-Karzinome aus einem serösen Tubenintraepithelkarzinom entwickeln können. Seröse Karzinome, die BRCA-Mutationen aufweisen, haben zwangsläufig auch p53-Mutationen, was darauf hindeutet, dass die Entfernung beider funktioneller Gene für die Entstehung von Krebs wichtig ist. ⓘ
Bei 50 % der hochgradigen serösen Karzinome ist die homologe Rekombination der DNA-Reparatur gestört, ebenso wie die Notch- und FOXM1-Signalwege. Sie weisen auch fast immer p53-Mutationen auf. Abgesehen davon sind Mutationen in hochgradigen serösen Karzinomen schwer zu charakterisieren, abgesehen von ihrem hohen Grad an genomischer Instabilität. BRCA1 und BRCA2 sind wichtig für die DNA-Reparatur durch homologe Rekombination, und Keimbahnmutationen in diesen Genen werden bei etwa 15 % der Frauen mit Eierstockkrebs gefunden. Bei den häufigsten Mutationen in BRCA1 und BRCA2 handelt es sich um Frameshift-Mutationen, die ihren Ursprung in einer kleinen Gründungspopulation der aschkenasischen Juden haben. ⓘ
Nahezu 100 % der seltenen muzinösen Karzinome weisen Mutationen in KRAS und Amplifikationen von ERBB2 (auch bekannt als Her2/neu) auf. Insgesamt weisen 20 % der Ovarialkarzinome Mutationen in Her2/neu auf. ⓘ
Seröse Karzinome können sich aus einem serösen Tubenintraepithelkarzinom entwickeln, anstatt sich spontan aus Eierstockgewebe zu entwickeln. Andere Karzinome entwickeln sich aus kortikalen Einschlusszysten, d. h. aus Gruppen epithelialer Eierstockzellen innerhalb des Stromas. ⓘ
Diagnose
Untersuchung

Die Diagnose von Eierstockkrebs beginnt mit einer körperlichen Untersuchung (einschließlich einer Beckenuntersuchung), einer Blutuntersuchung (auf CA-125 und manchmal andere Marker) und einem transvaginalen Ultraschall. Manchmal wird auch eine rektovaginale Untersuchung durchgeführt, um eine Operation zu planen. Die Diagnose muss durch einen chirurgischen Eingriff bestätigt werden, um die Bauchhöhle zu untersuchen, Biopsien (Gewebeproben für die mikroskopische Analyse) zu entnehmen und die Bauchflüssigkeit auf Krebszellen zu untersuchen. So lässt sich feststellen, ob eine Eierstockmasse gut- oder bösartig ist. ⓘ
Die frühen Stadien des Eierstockkrebses (I/II) sind schwer zu diagnostizieren, da die meisten Symptome unspezifisch und daher für die Diagnose wenig hilfreich sind; daher wird der Krebs selten diagnostiziert, bis er sich ausbreitet und in die späteren Stadien (III/IV) übergeht. Außerdem können die Symptome des Eierstockkrebses dem Reizdarmsyndrom ähneln. Bei Frauen, bei denen eine Schwangerschaft möglich ist, kann der BHCG-Spiegel während des Diagnoseprozesses gemessen werden. Bei jungen Mädchen und Jugendlichen mit Verdacht auf Eierstockkrebs können Alpha-Fetoprotein, neuronenspezifische Enolase und Laktatdehydrogenase im Serum gemessen werden, da bei jüngeren Frauen mit Eierstockkrebs die Wahrscheinlichkeit eines bösartigen Keimzelltumors größer ist. ⓘ
Eine körperliche Untersuchung, einschließlich einer Beckenuntersuchung, und ein Beckenultraschall (transvaginal oder anderweitig) sind für die Diagnose unerlässlich: Bei der körperlichen Untersuchung kann ein vergrößerter Bauchumfang und/oder Aszites (Flüssigkeit in der Bauchhöhle) festgestellt werden, während bei der Beckenuntersuchung eine Eierstock- oder Unterleibsmasse entdeckt werden kann. Eine Adnexmasse ist ein wichtiger Befund, der häufig auf Eierstockkrebs hinweist, insbesondere wenn sie fest, knotig, unregelmäßig, fest und/oder beidseitig ist. 13-21 % der Adnexmassen sind bösartig; Es gibt jedoch auch andere gutartige Ursachen für Adnexe, darunter Ovarialfollikelzysten, Leiomyome, Endometriose, Eileiterschwangerschaft, Hydrosalpinx, Tuboovarialabszess, Ovarialtorsion, Dermoidzyste, Zystadenom (serös oder muzinös), Divertikel- oder Blinddarmabszess, Nervenscheidentumor, Beckenniere, Harnleiter- oder Blasendivertikel, gutartiges zystisches Mesotheliom des Peritoneums, Peritonealtuberkulose oder paraovarielle Zyste. Tastbare Eierstöcke sind bei postmenopausalen Frauen ebenfalls ein Zeichen für Eierstockkrebs. Weitere Bestandteile einer körperlichen Untersuchung bei Verdacht auf Eierstockkrebs können eine Untersuchung der Brust und eine digitale rektale Untersuchung sein. Beim Abtasten der supraklavikulären, axillären und inguinalen Lymphknoten kann eine Lymphadenopathie festgestellt werden, die auf eine Metastasierung hinweisen kann. Ein weiterer Indikator kann das Vorhandensein eines Pleuraergusses sein, der durch Auskultation festgestellt werden kann. ⓘ
Wenn ein bösartiges Ovarialkarzinom in die Liste der diagnostischen Möglichkeiten aufgenommen wird, ist eine begrenzte Anzahl von Laboruntersuchungen angezeigt. In der Regel werden ein komplettes Blutbild und ein Serum-Elektrolyt-Test durchgeführt; wenn ein Eierstockkrebs vorliegt, zeigen diese Tests häufig eine hohe Anzahl von Blutplättchen (20-25 % der Patientinnen) und einen niedrigen Natriumspiegel im Blut aufgrund von chemischen Signalen, die vom Tumor ausgeschieden werden. Ein positiver Test auf Inhibin A und Inhibin B kann auf einen Granulosazelltumor hinweisen. ⓘ
Ein Bluttest auf ein Markermolekül namens CA-125 ist für die Differentialdiagnose und die Verlaufskontrolle der Krankheit nützlich, hat sich jedoch aufgrund seiner inakzeptabel niedrigen Sensitivität und Spezifität nicht als wirksame Methode für das Screening auf Eierstockkrebs im Frühstadium erwiesen. CA-125-Werte bei prämenopausalen Frauen über 200 U/ml können auf Eierstockkrebs hinweisen, ebenso wie ein CA-125-Anstieg über 35 U/ml bei postmenopausalen Frauen. CA-125-Werte sind bei Eierstockkrebs im Frühstadium nicht genau, da die Hälfte der Patientinnen mit Eierstockkrebs im Stadium I einen normalen CA-125-Wert aufweisen. CA-125 kann auch bei gutartigen (nicht krebsartigen) Erkrankungen wie Endometriose, Schwangerschaft, Gebärmuttermyomen, Menstruation, Eierstockzysten, systemischem Lupus erythematodes, Lebererkrankungen, entzündlichen Darmerkrankungen, Beckenentzündungen und Leiomyomen erhöht sein. HE4 ist ein weiterer Kandidat für die Untersuchung auf Eierstockkrebs, der jedoch noch nicht umfassend getestet wurde. Weitere Tumormarker für Eierstockkrebs sind CA19-9, CA72-4, CA15-3, immunsuppressives saures Protein, Haptoglobin-alpha, OVX1, Mesothelin, Lysophosphatidsäure, Osteopontin und Fibroblastenwachstumsfaktor 23. ⓘ
Die Verwendung von Bluttests kann bei der Diagnose helfen. Das OVA1-Panel umfasst CA-125, Beta-2-Mikroglobulin, Transferrin, Apolipoprotein A1 und Transthyretin. Ein OVA1-Wert von über 5,0 bei prämenopausalen Frauen und 4,4 bei postmenopausalen Frauen weist auf ein hohes Krebsrisiko hin. Eine andere Reihe von Labortests wird zur Erkennung von Tumoren der Geschlechtsorgane eingesetzt. Hohe Testosteron- oder Dehydroepiandrosteron-Sulfat-Werte in Verbindung mit anderen Symptomen und hohen Inhibin-A- und Inhibin-B-Werten können auf einen SCST jeglicher Art hinweisen. ⓘ
In der aktuellen Forschung wird nach Möglichkeiten gesucht, Tumormarker-Proteomik in Kombination mit anderen Krankheitsindikatoren (d.h. Radiologie und/oder Symptome) zu berücksichtigen, um die diagnostische Genauigkeit zu verbessern. Die Herausforderung bei einem solchen Ansatz besteht darin, dass die ungleiche Prävalenz von Eierstockkrebs bedeutet, dass selbst bei Tests mit sehr hoher Sensitivität und Spezifität immer noch eine Reihe falsch positiver Ergebnisse auftreten, was wiederum zu Problemen führen kann, z. B. bei der Durchführung von chirurgischen Eingriffen, bei denen intraoperativ kein Krebs gefunden wird. Genomische Ansätze sind für Eierstockkrebs noch nicht entwickelt worden. ⓘ
Zur Beurteilung der Tumorausdehnung in der Bauch- und Beckenhöhle wird vorzugsweise die Computertomographie eingesetzt, aber auch die Magnetresonanztomographie kann verwendet werden. Die Computertomographie kann auch nützlich sein, um Anhaftungen im Bauchraum zu erkennen oder Flüssigkeit von einem festen Tumor zu unterscheiden, insbesondere bei Tumoren mit geringem Malignitätspotenzial. Kleinere Tumore werden jedoch möglicherweise nicht erkannt. Manchmal wird eine Röntgenaufnahme des Brustkorbs durchgeführt, um Metastasen im Brustkorb oder einen Pleuraerguss zu erkennen. Ein weiterer Test zur Feststellung von Metastasen ist ein Bariumeinlauf, der allerdings nur selten eingesetzt wird und zeigen kann, ob das Rektosigmoid von der Krankheit betroffen ist. Positronen-Emissions-Tomographie, Knochenscans und Parazentese sind von begrenztem Nutzen; die Parazentese kann zur Bildung von Metastasen an der Einstichstelle der Nadel führen und liefert möglicherweise keine brauchbaren Ergebnisse. Die Parazentese kann jedoch in Fällen eingesetzt werden, in denen keine Beckenmasse vorhanden ist und dennoch Aszites vorliegt. Ein Arzt, der Eierstockkrebs vermutet, kann auch eine Mammographie oder eine Endometriumbiopsie (bei abnormalen Blutungen) durchführen, um die Möglichkeit eines bösartigen Tumors der Brust bzw. des Endometriums zu beurteilen. Die vaginale Ultraschalluntersuchung ist häufig die erste bildgebende Untersuchung, die durchgeführt wird, wenn eine Masse in den Adnexen festgestellt wird. Mehrere Merkmale einer Adnexmasse deuten auf eine bösartige Erkrankung der Eierstöcke hin: Sie sind in der Regel solide, unregelmäßig, multilokulär und/oder groß und weisen typischerweise papilläre Merkmale, zentrale Gefäße und/oder unregelmäßige innere Scheidewände auf. Der SCST weist jedoch keine definitiven Merkmale in der Röntgenuntersuchung auf. ⓘ
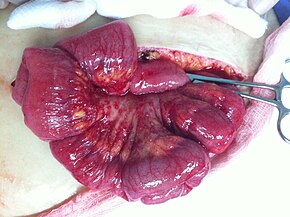
Zur endgültigen Diagnose von Eierstockkrebs ist ein chirurgischer Eingriff zur Inspektion des Abdomens erforderlich. Dies kann ein offener Eingriff (Laparotomie, Schnitt durch die Bauchdecke) oder eine Schlüsselloch-Chirurgie (Laparoskopie) sein. Bei diesem Eingriff wird verdächtiges Gewebe entnommen und zur mikroskopischen Untersuchung eingesandt. In der Regel umfasst dies eine einseitige Salpingo-Oophorektomie, die Entfernung eines einzelnen betroffenen Eierstocks und Eileiters. Auch die Flüssigkeit aus der Bauchhöhle kann auf Krebszellen untersucht werden. Wird Krebs gefunden, kann mit diesem Verfahren auch das Ausmaß seiner Ausbreitung bestimmt werden (eine Form des Tumor-Stagings). ⓘ
Pafolacianin ist für die Anwendung bei Erwachsenen mit Eierstockkrebs indiziert, um die Erkennung von Krebsläsionen während der Operation zu unterstützen. Es handelt sich um ein Diagnosemittel, das in Form einer intravenösen Injektion vor der Operation verabreicht wird. ⓘ
Risiko-Scoring
Eine weithin anerkannte Methode zur Abschätzung des Risikos eines bösartigen Eierstockkrebses ist der Risiko-Malignitäts-Index (RMI), der auf der Grundlage einer Erstuntersuchung berechnet wird. Ein RMI-Wert von über 200 oder 250 gilt im Allgemeinen als Hinweis auf ein hohes Risiko für Eierstockkrebs. ⓘ
Der RMI wird wie folgt berechnet:
- RMI = Ultraschall-Score × Menopausen-Score x CA-125-Wert in U/ml. ⓘ
Zur Bestimmung des Ultraschall-Scores und des Menopausen-Scores können zwei Methoden angewandt werden, wobei die sich daraus ergebenden Scores als RMI 1 bzw. RMI 2 bezeichnet werden, je nachdem, welche Methode verwendet wird. ⓘ
| Merkmal | RMI 1 | RMI 2 ⓘ |
|---|---|---|
|
Ultraschall-Anomalien:
|
|
|
| Punktzahl für die Menopause |
|
|
| CA-125 | Menge in U/ml | Menge in U/ml |
Eine weitere Methode zur Quantifizierung des Eierstockkrebsrisikos ist der Risk of Ovarian Cancer Algorithm (ROCA), der die Werte im Laufe der Zeit beobachtet und feststellt, ob sie schnell genug ansteigen, um eine transvaginale Ultraschalluntersuchung zu rechtfertigen. Der Algorithmus zur Bestimmung des Risikos für Eierstockkrebs (Risk of Ovarian Malignancy) verwendet CA-125-Werte und HE4-Werte zur Berechnung des Eierstockkrebsrisikos und ist möglicherweise effektiver als RMI. Die IOTA-Modelle können verwendet werden, um die Wahrscheinlichkeit abzuschätzen, dass ein Adnex-Tumor bösartig ist. Dazu gehören das LR2-Risikomodell, die SRrisk-Berechnung (Simple Rules risk) und das ADNEX-Modell (Assessment of Different Neoplasias in the Adnexa), mit dem das Malignitätsrisiko einer Adnexmasse auf der Grundlage ihrer Merkmale und Risikofaktoren bewertet werden kann. Der Algorithmus QCancer (Ovary) dient der Vorhersage der Wahrscheinlichkeit von Eierstockkrebs anhand von Risikofaktoren. ⓘ
Pathologie

Eierstockkrebs wird nach dem mikroskopischen Erscheinungsbild seiner Strukturen klassifiziert (Histologie oder Histopathologie). Die Histologie bestimmt viele Aspekte der klinischen Behandlung, des Managements und der Prognose. Die grobe Pathologie von Eierstockkrebs ist unabhängig vom histologischen Typ sehr ähnlich: Eierstocktumoren weisen solide und zystische Massen auf. Nach Angaben des SEER sind die Arten von Eierstockkrebs bei Frauen ab 20 Jahren wie folgt:
| Prozentsatz der Ovarialkarzinome bei Frauen Alter 20+ |
Prozentsatz der Ovarialkarzinome bei Frauen Alter 20+ nach Untergliederung |
Histologie | Fünf Jahre RSR ⓘ |
|---|---|---|---|
| 89.7 | Oberflächenepithelialer Stromatumor (Adenokarzinom) | 54.4 | |
| 26.4 | Papilläres seröses Zystadenokarzinom | 21.0 | |
| 15.9 | Borderline-Adenokarzinom (unterschätzt - kurzes Datenerfassungsintervall) |
98.2 | |
| 12.6 | Adenokarzinom, nicht anderweitig spezifiziert | 18.3 | |
| 9.8 | Endometrioider Tumor | 70.9 | |
| 5.8 | Seröses Zystadenokarzinom | 44.2 | |
| 5.5 | Papilläres | 21.0 | |
| 4.2 | Muzinöses Zystadenokarzinom | 77.7 | |
| 4.0 | Klarzelliger Ovarialtumor | 61.5 | |
| 3.4 | Muzinöses Adenokarzinom | 49.1 | |
| 1.3 | Zystadenokarzinom | 50.7 | |
| 5.5 | Karzinom | ||
| 4.1 | Karzinom nicht anderweitig spezifiziert | 26.8 | |
| 1.1 | Geschlechtsstrang-Stromtumor | 87.8 | |
| 0.3 | Andere Karzinome, spezifiziert | 37.3 | |
| 1.7 | Mullerscher Tumor | 29.8 | |
| 1.5 | Keimzelltumor | 91.0 | |
| 0.8 | Teratome | 89.1 | |
| 0.5 | Dysgerminom | 96.8 | |
| 0.3 | Sonstige, spezifiziert | 85.1 | |
| 0.6 | Nicht anderweitig spezifiziert | 23.0 | |
| 0.5 | Epidermoid (Plattenepithelkarzinom) | 51.3 | |
| 0.2 | Brenner-Tumor | 67.9 | |
| 0.2 | Sonstige, spezifiziert | 71.7 |
Ovarialkarzinome werden histologisch und genetisch in Typ I und Typ II eingeteilt. Typ I-Karzinome sind von geringerem histologischem Grad und umfassen endometrioide, muzinöse und klarzellige Karzinome. Typ-II-Karzinome sind von höherem histologischem Grad und umfassen seröse Karzinome und Karzinosarkome. ⓘ
Epitheliales Karzinom
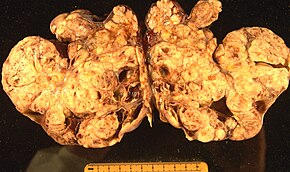
Der epithelial-stromale Oberflächentumor, auch als Epithelkarzinom der Eierstöcke bezeichnet, ist die häufigste Form von Eierstockkrebs und macht etwa 90 % aller Eierstockkrebserkrankungen aus. Dazu gehören der seröse Tumor, der endometrioide Tumor und das muzinöse Zystadenokarzinom. Seltenere Tumoren sind der bösartige endometrioide Ovarialkrebs, der klarzellige Ovarialkrebs und der Brenner-Tumor (Übergangszellkarzinom des Eierstocks). Epitheliale Ovarialkarzinome entwickeln sich aus dem Epithel, einer Zellschicht, die den Eierstock bedeckt. ⓘ
Seröses Karzinom
Die meisten Patientinnen mit epithelialem Ovarialkarzinom, etwa zwei Drittel, haben ein seröses Karzinom, wobei dieser Anteil auf bis zu 80 % geschätzt wird. Ein niedriggradiges seröses Karzinom ist weniger aggressiv als ein hochgradiges seröses Karzinom, spricht aber in der Regel nicht gut auf eine Chemotherapie oder Hormonbehandlung an. Es wird angenommen, dass seröse Karzinome im Eileiter beginnen. Histologisch weisen seröse Adenokarzinome Psammomkörper auf. Niedriggradige seröse Adenokarzinome ähneln dem Eileiterepithel, während hochgradige seröse Adenokarzinome Anaplasie und Kernatypie aufweisen. ⓘ
In 50 % der Fälle sind seröse Karzinome bilateral und in 85 % der Fälle haben sie sich zum Zeitpunkt der Diagnose bereits über das Ovar hinaus ausgebreitet. Die meisten haben einen Durchmesser von über 15 cm. ⓘ
Das seröse tubuläre intraepitheliale Karzinom (STIC) gilt heute als Vorläuferläsion der meisten so genannten hochgradigen serösen Ovarialkarzinome. STIC ist gekennzeichnet durch
- abnorme p53-Färbung
- Ki67-Proliferationsindex von über 10 %
- Positives WT1 (zum Ausschluss von Metastasen) ⓘ
Kleinzelliges Karzinom
Das kleinzellige Ovarialkarzinom ist ein seltenes und aggressives Karzinom, bei dem es zwei Hauptuntertypen gibt: das hyperkalzämische und das pulmonale Karzinom. Es endet in der Regel innerhalb von 2 Jahren nach der Diagnose tödlich. Das kleinzellige hyperkalzämische Ovarialkarzinom betrifft überwiegend Frauen in den 20er Jahren, verursacht hohe Kalziumwerte im Blut und betrifft ein Ovar. Das pulmonale kleinzellige Ovarialkarzinom befällt in der Regel beide Eierstöcke älterer Frauen und sieht wie ein Haferzellkarzinom der Lunge aus. ⓘ
Primäres Peritonealkarzinom
Primäre Peritonealkarzinome entwickeln sich aus dem Bauchfell (Peritoneum), einer Membran, die die Bauchhöhle auskleidet und den gleichen embryonalen Ursprung wie das Ovar hat. Sie werden häufig zusammen mit Eierstockkrebs diskutiert und klassifiziert, wenn sie den Eierstock befallen. Sie können sich auch nach der Entfernung der Eierstöcke entwickeln und können ähnlich wie Mesotheliome aussehen. ⓘ
Klarzelliges Karzinom
Klarzellige Ovarialkarzinome sprechen in der Regel nicht gut auf eine Chemotherapie an und können mit Endometriose in Verbindung stehen. Sie machen etwa 5 % aller Endometriumkarzinome aus. Japanische Frauen erkranken häufiger an klarzelligem Ovarialkarzinom als andere Gruppen von Frauen. ⓘ
Klarzelliges Adenokarzinom

Klarzellige Adenokarzinome sind histopathologisch ähnlich wie andere klarzellige Karzinome, mit klaren Zellen und Hobnailzellen. Sie machen etwa 5-10 % der epithelialen Ovarialkarzinome aus und werden mit Endometriose in der Beckenhöhle in Verbindung gebracht. Sie befinden sich in der Regel in einem frühen Stadium und sind daher durch eine Operation heilbar. Fortgeschrittene klarzellige Adenokarzinome (ca. 20 %) haben jedoch eine schlechte Prognose und sind häufig resistent gegen eine Platin-Chemotherapie. ⓘ
Endometrioid
Endometrioide Adenokarzinome machen etwa 15-20 % der epithelialen Ovarialkarzinome aus. Da sie in der Regel niedriggradig sind, haben endometrioide Adenokarzinome eine gute Prognose. Diese Tumore treten häufig zusammen mit Endometriose oder Endometriumkrebs auf. ⓘ
Bösartiger gemischter Müllerialtumor (Karzinosarkom)
Gemischte Müllerialtumoren machen weniger als 1 % der Eierstockkrebsfälle aus. Sie weisen sowohl Epithel- als auch Mesenchymzellen auf und haben in der Regel eine schlechte Prognose. ⓘ
Schleimige
Zu den muzinösen Tumoren gehören das muzinöse Adenokarzinom und das muzinöse Zystadenokarzinom. ⓘ
Muzinöses Adenokarzinom
Muzinöse Adenokarzinome machen 5-10 % der epithelialen Ovarialkarzinome aus. Histologisch ähneln sie den Adenokarzinomen des Darms oder des Gebärmutterhalses und sind häufig Metastasen von Blinddarm- oder Dickdarmkrebs. Fortgeschrittene muzinöse Adenokarzinome haben eine schlechte Prognose, im Allgemeinen schlechter als seröse Tumore, und sind oft resistent gegen eine Platin-Chemotherapie, obwohl sie selten sind. ⓘ
Pseudomyxoma peritonei
Pseudomyxoma peritonei bezeichnet eine Ansammlung von eingekapseltem schleimigem oder gallertartigem Material in der Bauch- und Beckenhöhle, die sehr selten durch einen primären muzinösen Eierstocktumor verursacht wird. Häufiger ist sie mit Ovarialmetastasen von Darmkrebs verbunden. ⓘ
Undifferenzierte epitheliale Tumore
Undifferenzierte Karzinome - also solche, bei denen der Zelltyp nicht bestimmt werden kann - machen etwa 10 % der epithelialen Ovarialkarzinome aus und haben eine vergleichsweise schlechte Prognose. Bei der Untersuchung unter dem Mikroskop weisen diese Tumore stark abnorme Zellen auf, die in Klumpen oder Blättern angeordnet sind. In der Regel sind im Inneren des Tumors Klumpen seröser Zellen zu erkennen. ⓘ
Bösartiger Brenner-Tumor
Bösartige Brenner-Tumore sind selten. Histologisch weisen sie ein dichtes fibröses Stroma mit Bereichen von Übergangsepithel und einer gewissen Plattenepithel-Differenzierung auf. Um als bösartiger Brenner-Tumor eingestuft zu werden, muss er Brenner-Tumorherde und ein Übergangszellkarzinom aufweisen. Die Komponente des Übergangszellkarzinoms ist typischerweise schlecht differenziert und ähnelt einem Harnwegskrebs. ⓘ
Übergangszellkarzinom
Übergangszellkarzinome machen weniger als 5 % der Ovarialkarzinome aus. Histologisch ähneln sie dem Harnblasenkarzinom. Die Prognose ist mittelmäßig - besser als bei den meisten Epithelkarzinomen, aber schlechter als bei malignen Brennertumoren. ⓘ
Geschlechtsstrang-Stromtumor
Geschlechtsstrangstromatumoren, zu denen der östrogenproduzierende Granulosazelltumor, das gutartige Thekom und der virilisierende Sertoli-Leydig-Zelltumor oder das Arrhenoblastom gehören, machen 7 % der Eierstockkrebsfälle aus. Sie treten am häufigsten bei Frauen im Alter zwischen 50 und 69 Jahren auf, können aber bei Frauen jeden Alters, auch bei jungen Mädchen, vorkommen. Sie sind in der Regel nicht aggressiv und meist einseitig; daher werden sie in der Regel nur operativ behandelt. Geschlechtsstrang-Stromatumoren sind die wichtigsten hormonproduzierenden Eierstocktumoren. ⓘ
Mehrere verschiedene Zellen des Mesenchyms können zu Geschlechtsstrang- oder Stromatumoren führen. Dazu gehören Fibroblasten und endokrine Zellen. Die Symptome eines Geschlechtsstrang- oder Stromatumors können sich von denen anderer Arten von Eierstockkrebs unterscheiden. Zu den häufigen Anzeichen und Symptomen gehören eine Ovarialtorsion, Blutungen aus dem Tumor oder dessen Ruptur, eine abdominale Masse und eine Hormonstörung. Bei Kindern kann bei Granulosazelltumoren eine isosexuelle, frühreife Pseudopubertät auftreten, da sie Östrogen produzieren. Diese Tumoren führen zu Störungen der Menstruation (übermäßige Blutungen, seltene oder ausbleibende Menstruation) oder zu Blutungen nach der Menopause. Da diese Tumore Östrogen produzieren, können sie Endometriumkrebs oder Brustkrebs verursachen oder gleichzeitig mit diesen auftreten. Andere Geschlechtsstrang-/Stromzelltumoren weisen unterschiedliche Symptome auf. Sertoli-Leydig-Zelltumoren führen aufgrund der Produktion von Testosteron und Androstendion zu Virilisierung und übermäßigem Haarwuchs, was in seltenen Fällen auch das Cushing-Syndrom auslösen kann. Es gibt auch Stromatumoren des Geschlechtsorgans, die kein hormonelles Ungleichgewicht verursachen, darunter gutartige Fibrome, die Aszites und Hydrothorax verursachen. Zusammen mit den Keimzelltumoren sind die Geschlechtsstrangstromatumoren der häufigste Eierstockkrebs, der bei Frauen unter 20 Jahren diagnostiziert wird. ⓘ
Granulosazelltumor
Granulosazelltumoren sind mit 70 % der Fälle die häufigsten Stromatumoren des Geschlechtsorgans und werden in zwei histologische Subtypen unterteilt: adulte Granulosazelltumoren, die sich bei Frauen über 50 entwickeln, und juvenile Granulosazelltumoren, die sich vor der Pubertät oder vor dem 30. Beide entwickeln sich im Ovarialfollikel aus einer Zellpopulation, die die Keimzellen umgibt. ⓘ
Adulter Granulosazelltumor
Adulte Granulosazelltumoren zeichnen sich durch ein späteres Auftreten aus (30+ Jahre, im Durchschnitt 50). Diese Tumoren produzieren einen hohen Östrogenspiegel, der die charakteristischen Symptome hervorruft: Menometrorrhagie, Endometriumhyperplasie, zarte, vergrößerte Brüste, postmenopausale Blutungen und sekundäre Amenorrhoe. Die Masse des Tumors kann weitere Symptome hervorrufen, darunter Unterleibsschmerzen und Blähungen oder Symptome, die einer Eileiterschwangerschaft ähneln, wenn der Tumor blutet und reißt. ⓘ
Sertoli-Leydig-Zelltumor
Sertoli-Leydig-Tumore treten am häufigsten bei Frauen vor dem 30. Lebensjahr auf, besonders häufig vor der Pubertät. ⓘ
Sklerosierende Stromatumoren
Sklerosierende Stromatumoren treten typischerweise bei Mädchen vor der Pubertät oder bei Frauen vor dem 30. ⓘ
Keimzelltumor
Keimzelltumore des Eierstocks entwickeln sich aus den Keimzellen des Eierstocks. Keimzelltumore machen etwa 30 % der Eierstocktumore, aber nur 5 % der Eierstockkrebsfälle aus, da die meisten Keimzelltumore Teratome sind und die meisten Teratome gutartig sind. Bösartige Teratome treten eher bei älteren Frauen auf, wenn sich eine der Keimschichten im Tumor zu einem Plattenepithelkarzinom entwickelt. Keimzelltumore treten eher bei jungen Frauen (20-30 Jahre) und Mädchen auf und machen 70 % der Eierstockkrebsfälle in dieser Altersgruppe aus. Zu den Keimzelltumoren gehören Dysgerminome, Teratome, Dottersacktumore/endodermale Sinustumore und Choriokarzinome, wenn sie im Eierstock entstehen. Einige Keimzelltumoren weisen ein Isochromosom 12 auf, bei dem ein Arm von Chromosom 12 deletiert und durch ein Duplikat des anderen ersetzt ist. Die meisten Keimzelltumoren haben eine bessere Prognose als andere Subtypen und sprechen besser auf eine Chemotherapie an. Sie befinden sich bei der Diagnose eher im Stadium I. Insgesamt metastasieren sie häufiger als epitheliale Ovarialkarzinome. Darüber hinaus variieren die verwendeten Krebsmarker je nach Tumortyp: Choriokarzinome werden mit beta-HCG und endodermale Sinustumoren mit alpha-Fetoprotein überwacht. ⓘ
Keimzelltumore werden in der Regel entdeckt, wenn sie sich zu großen, tastbaren Massen entwickeln. Sie können jedoch wie die Geschlechtsstrang-Tumoren eine Eierstock-Torsion oder -Blutung und bei Kindern eine isosexuelle Frühpubertät verursachen. Häufig metastasieren sie in nahe gelegene Lymphknoten, insbesondere in die para-aortalen und pelvinen Lymphknoten. Das häufigste Symptom von Keimzelltumoren sind subakute Unterleibsschmerzen, die durch eine Blutung des Tumors, eine Nekrotisierung oder eine Dehnung der Eierstockkapsel verursacht werden. Rupturiert der Tumor, verursacht er erhebliche Blutungen oder zerreißt er den Eierstock, kann er akute Unterleibsschmerzen verursachen, was bei weniger als 10 % der Patienten mit Keimzelltumoren auftritt. Sie können auch Hormone absondern, die den Menstruationszyklus verändern. Bei 25 % der Keimzelltumoren wird der Krebs bei einer Routineuntersuchung entdeckt und verursacht keine Symptome. ⓘ
Die Diagnose von Keimzelltumoren kann sich als schwierig erweisen, weil der normale Menstruationszyklus und die Pubertät Schmerzen und Beckenbeschwerden hervorrufen können, und eine junge Frau diese Symptome vielleicht sogar für die einer Schwangerschaft hält und aufgrund des Stigmas einer Teenagerschwangerschaft keine Behandlung sucht. Bluttests auf Alpha-Fetoprotein, Karyotyp, humanes Choriongonadotropin und Leberfunktion werden zur Diagnose eines Keimzelltumors und einer möglicherweise gleichzeitig auftretenden Gonadendysgenesie eingesetzt. Ein Keimzelltumor kann anfänglich mit einer gutartigen Ovarialzyste verwechselt werden. ⓘ
Dysgerminom
Das Dysgerminom macht 35 % der Ovarialkarzinome bei jungen Frauen aus und ist der Keimzelltumor, der am ehesten in die Lymphknoten metastasiert; in 25-30 % der Fälle treten Nodalmetastasen auf. Diese Tumore können Mutationen im KIT-Gen aufweisen, eine Mutation, die für ihre Rolle bei gastrointestinalen Stromatumoren bekannt ist. Bei Menschen mit einem XY-Karyotyp und Eierstöcken (gonadale Dysgenesie) oder einem X,0-Karyotyp und Eierstöcken (Turner-Syndrom), die ein einseitiges Dysgerminom entwickeln, besteht ein Risiko für ein Gonadoblastom im anderen Eierstock, und in diesem Fall werden in der Regel beide Eierstöcke entfernt, wenn ein einseitiges Dysgerminom entdeckt wird, um das Risiko eines weiteren bösartigen Tumors zu vermeiden. Gonadoblastome bei Menschen mit Swyer- oder Turner-Syndrom werden in etwa 40 % der Fälle bösartig. Im Allgemeinen sind die Dysgerminome jedoch in 10-20 % der Fälle bilateral. ⓘ
Sie bestehen aus Zellen, die sich nicht weiter differenzieren können und sich direkt aus Keimzellen oder aus Gonadoblastomen entwickeln. Dysgerminome enthalten in etwa 5 % der Fälle Synzytiotrophoblasten und können daher erhöhte hCG-Werte verursachen. Grob betrachtet sind Dysgerminome typischerweise rosa bis bräunlich gefärbt, haben mehrere Lappen und sind solide. Mikroskopisch gesehen sind sie identisch mit Seminomen und kommen den embryonalen primordialen Keimzellen sehr nahe, da sie große, polyedrische, abgerundete, klare Zellen aufweisen. Die Zellkerne sind einheitlich und rund oder quadratisch mit auffälligen Nukleoli, und das Zytoplasma weist hohe Glykogenkonzentrationen auf. Eine Entzündung ist ein weiteres auffälliges histologisches Merkmal von Dysgerminomen. ⓘ
Choriokarzinom
Das Choriokarzinom kann als primärer Ovarialtumor auftreten, der sich aus einer Keimzelle entwickelt, obwohl es sich in der Regel um eine Schwangerschaftserkrankung handelt, die in den Eierstock metastasiert. Das primäre Choriokarzinom der Eierstöcke hat eine schlechte Prognose und kann auch ohne eine Schwangerschaft auftreten. Sie produzieren hohe Mengen an hCG und können bei Kindern eine frühe Pubertät oder Menometrorrhagie (unregelmäßige, starke Menstruation) nach der Menarche verursachen. ⓘ
Unreife (feste) Teratome
Unreife oder solide Teratome sind die häufigste Form von Keimzelltumoren des Ovars und machen 40-50 % der Fälle aus. Teratome zeichnen sich durch das Vorhandensein von desorganisiertem Gewebe aus, das aus allen drei embryonalen Keimschichten stammt: Ektoderm, Mesoderm und Endoderm; unreife Teratome haben auch undifferenzierte Stammzellen, die sie bösartiger machen als reife Teratome (Dermoidzysten). Die verschiedenen Gewebe sind in der groben Pathologie sichtbar und umfassen oft Knochen, Knorpel, Haare, Schleim oder Talg, aber diese Gewebe sind von außen nicht sichtbar, da es sich um eine feste Masse mit Lappen und Zysten handelt. Histologisch weisen sie große Mengen an Neuroektoderm auf, das in Schichten und Röhrchen zusammen mit Glia organisiert ist; die Menge des Nervengewebes bestimmt den histologischen Grad. Unreife Teratome betreffen in der Regel nur ein Ovar (10 % treten gemeinsam mit Dermoidzysten auf) und metastasieren in der Regel im gesamten Peritoneum. Sie können auch dazu führen, dass reife Teratom-Implantate im gesamten Bauchraum wachsen, was als wachsendes Teratom-Syndrom bezeichnet wird; diese sind in der Regel gutartig, wachsen aber während der Chemotherapie weiter und erfordern oft eine weitere Operation. Im Gegensatz zu reifen Teratomen bilden unreife Teratome viele Verwachsungen, so dass es weniger wahrscheinlich ist, dass sie eine Eierstocktorsion verursachen. Es gibt keinen spezifischen Marker für unreife Teratome, aber Carcinoembryonales Antigen (CEA), CA-125, CA19-9 oder AFP können manchmal auf ein unreifes Teratom hinweisen. ⓘ
Teratome im Stadium I machen die Mehrheit (75 %) der Fälle aus und haben die beste Prognose: 98 % der Patienten überleben 5 Jahre; wenn ein Tumor im Stadium I auch Grad 1 ist, kann er nur mit einer einseitigen Operation behandelt werden. Tumore im Stadium II bis IV machen das restliche Viertel der Fälle aus und haben eine schlechtere Prognose: 73-88 % der Patientinnen überleben 5 Jahre. ⓘ
Reifes Teratom (Dermoidzyste)
Reife Teratome oder Dermoidzysten sind seltene Tumoren, die aus meist gutartigem Gewebe bestehen und sich nach der Menopause entwickeln. Die Tumoren bestehen aus desorganisiertem Gewebe mit Knötchen aus bösartigem Gewebe, das von unterschiedlicher Art sein kann. Die häufigste Bösartigkeit ist das Plattenepithelkarzinom, aber auch Adenokarzinom, Basalzellkarzinom, Karzinoidtumor, neuroektodermaler Tumor, malignes Melanom, Sarkom, Talgdrüsentumor und Struma ovarii können Teil der Dermoidzyste sein. Sie werden mit einer Operation und einer adjuvanten Platin-Chemotherapie oder Bestrahlung behandelt. ⓘ
Dottersacktumor/endodermaler Sinustumor
Dottersacktumoren, früher endodermale Sinustumoren genannt, machen etwa 10-20 % der bösartigen Keimzelltumoren der Eierstöcke aus und haben die schlechteste Prognose aller Keimzelltumoren der Eierstöcke. Sie treten sowohl vor der Menarche (in einem Drittel der Fälle) als auch nach der Menarche (in den restlichen zwei Dritteln der Fälle) auf. Die Hälfte der Patientinnen mit Dottersacktumoren wird im Stadium I diagnostiziert. In der Regel sind sie einseitig bis zur Metastasierung, die in der Peritonealhöhle und über den Blutkreislauf in die Lunge erfolgt. Dottersacktumoren wachsen schnell und treten leicht wieder auf, und wenn sie einmal aufgetreten sind, sind sie nicht leicht zu behandeln. Dottersacktumoren im Stadium I sind gut behandelbar, mit einer krankheitsfreien 5-Jahres-Überlebensrate von 93 %, aber Tumoren im Stadium II-IV sind weniger gut behandelbar, mit Überlebensraten von 64-91 %. ⓘ
Ihr Erscheinungsbild ist solide, brüchig und gelb, mit nekrotischen und hämorrhagischen Bereichen. Oft enthalten sie auch Zysten, die degenerieren oder platzen können. Histologisch zeichnen sich Dottersacktumoren durch das Vorhandensein von Schiller-Duval-Körpern (pathognomonisch für Dottersacktumoren) und ein netzartiges Muster aus. Dottersacktumoren sezernieren häufig Alpha-Fetoprotein und können immunhistochemisch auf dessen Vorhandensein angefärbt werden; der Alpha-Fetoprotein-Spiegel im Blut ist ein nützlicher Marker für das Wiederauftreten. ⓘ
Embryonales Karzinom
Embryonale Karzinome, ein seltener Tumortyp, der in der Regel in gemischten Tumoren vorkommt, entwickeln sich direkt aus Keimzellen, sind aber nicht endgültig differenziert; in seltenen Fällen können sie sich in dysgenetischen Keimdrüsen entwickeln. In seltenen Fällen können sie sich in dysgenetischen Keimdrüsen entwickeln. Sie können sich zu einer Vielzahl anderer Neoplasien weiterentwickeln, darunter Choriokarzinom, Dottersacktumor und Teratom. Sie treten bei jüngeren Menschen auf, mit einem Durchschnittsalter von 14 Jahren bei der Diagnose, und sezernieren sowohl Alpha-Fetoprotein (in 75 % der Fälle) als auch hCG. ⓘ
Histologisch ähnelt das embryonale Karzinom der Embryonalscheibe und besteht aus epithelialen, anaplastischen Zellen in desorganisierten Blättern mit drüsenartigen Zwischenräumen und papillären Strukturen. ⓘ
Polyembryom
Polyembryome, die unreifste Form von Teratomen und sehr seltene Eierstocktumoren, sind histologisch dadurch gekennzeichnet, dass sie mehrere embryoähnliche Körper mit Strukturen aufweisen, die Keimscheibe, Dottersack und Fruchtblase ähneln. Auch synzytiotrophoblastische Riesenzellen kommen in Polyembryomen vor. ⓘ
Plattenepithelkarzinom
Primäre Plattenepithelkarzinome der Eierstöcke sind selten und haben im fortgeschrittenen Stadium eine schlechte Prognose. In der Regel handelt es sich bei Plattenepithelkarzinomen der Eierstöcke um Metastasen aus dem Gebärmutterhals, um Differenzierungsbereiche in einem endometrioiden Tumor oder um Ableger eines reifen Teratoms. ⓘ
Gemischte Tumore
Gemischte Tumore enthalten Elemente von mehr als einer der oben genannten Klassen von Tumorhistologie. Um als gemischter Tumor eingestuft zu werden, muss der kleinere Typ mehr als 10 % des Tumors ausmachen. Obwohl gemischte Karzinome jede Kombination von Zelltypen aufweisen können, sind gemischte Ovarialkarzinome typischerweise serös/endometrioid oder klarzellig/endometrioid. Gemischte Keimzelltumoren machen etwa 25-30 % aller Keimzell-Ovarialkarzinome aus, mit Kombinationen aus Dysgerminom, Dottersacktumor und/oder unreifem Teratom. Die Prognose und die Behandlung hängen von den einzelnen Zelltypen ab. ⓘ
Sekundäres Ovarialkarzinom
Eierstockkrebs kann auch eine sekundäre Krebserkrankung sein, d. h. das Ergebnis einer Metastasierung einer primären Krebserkrankung an einer anderen Stelle des Körpers. Etwa 7 % der Eierstockkrebsfälle sind auf Metastasen zurückzuführen, während der Rest primäre Krebserkrankungen sind. Häufige primäre Krebsarten sind Brustkrebs, Dickdarmkrebs, Blinddarmkrebs und Magenkrebs (primäre Magenkarzinome, die in den Eierstock metastasieren, werden als Krukenberg-Tumore bezeichnet). Krukenberg-Tumoren haben Siegelringzellen und Schleimzellen. Auch Endometriumkrebs und Lymphome können in die Eierstöcke metastasieren. ⓘ
Borderline-Tumore
Borderline-Tumoren der Eierstöcke, manchmal auch als Ovarialtumoren mit niedrigem Malignitätspotenzial (LMP) bezeichnet, weisen einige gutartige und einige bösartige Merkmale auf. LMP-Tumoren machen etwa 10-15 % aller Ovarialtumoren aus. Sie entwickeln sich früher als epitheliale Ovarialkarzinome, etwa im Alter von 40-49 Jahren. Sie weisen in der Regel keine ausgedehnte Invasion auf; 10 % der AMP-Tumoren haben Bereiche mit stromaler Mikroinvasion (<3 mm, <5 % des Tumors). AMP-Tumoren weisen weitere abnorme Merkmale auf, darunter eine erhöhte Mitose, Veränderungen der Zellgröße oder Kerngröße, abnorme Kerne, Zellschichtung und kleine Zellfortsätze (papilläre Fortsätze). Bei der histologischen Untersuchung können seröse und/oder muzinöse Merkmale festgestellt werden, und die seröse Histologie macht die überwältigende Mehrheit der fortgeschrittenen AMP-Tumoren aus. Mehr als 80 % der AMP-Tumoren befinden sich im Stadium I, 15 % im Stadium II und III und weniger als 5 % im Stadium IV. Implantate von AMP-Tumoren sind häufig nicht invasiv. ⓘ
Stadieneinteilung
Die Stadieneinteilung von Eierstockkrebs erfolgt nach dem FIGO-Staging-System und stützt sich auf Informationen, die nach der Operation gewonnen werden, die eine totale abdominale Hysterektomie über eine Mittellinien-Laparotomie, die Entfernung (normalerweise) beider Eierstöcke und Eileiter umfassen kann, (in der Regel) des Omentums, Becken-(Peritoneal-)spülungen, Beurteilung der retroperitonealen Lymphknoten (einschließlich der pelvinen und para-aortalen Lymphknoten), Appendektomie bei Verdacht auf Schleimhauttumoren und Becken-/Peritonealbiopsien zur Zytopathologie. Etwa 30 % der Ovarialkarzinome, die auf den Eierstock beschränkt zu sein scheinen, haben mikroskopisch Metastasen gebildet, weshalb auch bei Krebserkrankungen im Stadium I eine vollständige Stadieneinteilung vorgenommen werden muss. Bei 22 % der Krebsarten, bei denen ein Stadium I vermutet wird, werden lymphatische Metastasen festgestellt. Das AJCC-Stadium ist dasselbe wie das FIGO-Stadium. Das AJCC-Stadiensystem beschreibt die Ausdehnung des Primärtumors (T), das Fehlen oder Vorhandensein von Metastasen in nahe gelegenen Lymphknoten (N) und das Fehlen oder Vorhandensein von Fernmetastasen (M). Das häufigste Stadium bei der Diagnose ist das Stadium IIIc mit über 70 % der Diagnosen. ⓘ
FIGO
| Stadium | Beschreibung ⓘ | |||
|---|---|---|---|---|
| I | Der Krebs ist vollständig auf den Eierstock begrenzt | |||
| IA | betrifft einen Eierstock, Kapsel intakt, kein Tumor auf der Eierstockoberfläche, negative Waschungen | |||
| IB | betrifft beide Eierstöcke; Kapsel intakt; kein Tumor an der Eierstockoberfläche; negative Waschungen | |||
| IC | Tumor betrifft einen oder beide Eierstöcke | |||
| IC1 | chirurgischer Ausfluss | |||
| IC2 | Kapsel ist gerissen oder Tumor auf der Eierstockoberfläche | |||
| IC3 | positiver Aszites oder Waschungen | |||
| II | Ausdehnung des Tumors im Becken (muss auf das Becken beschränkt sein) oder primärer Peritonealtumor, der ein oder beide Eierstöcke betrifft | |||
| IIA | Tumor an Gebärmutter oder Eileitern gefunden | |||
| IIB | Tumor an anderer Stelle des Beckens | |||
| III | Krebs, der außerhalb des Beckens oder in den retroperitonealen Lymphknoten gefunden wird und einen oder beide Eierstöcke betrifft | |||
| IIIA | Metastasierung in retroperitonealen Lymphknoten oder mikroskopische extrapelvine Metastasierung | |||
| IIIA1 | Metastasierung in retroperitonealen Lymphknoten | |||
| IIIA1(i) | die Metastase hat einen Durchmesser von weniger als 10 mm | |||
| IIIA1(ii) | die Metastase hat einen Durchmesser von mehr als 10 mm | |||
| IIIA2 | mikroskopische Metastasen im Peritoneum, unabhängig vom Status der retroperitonealen Lymphknoten | |||
| IIIB | Metastasen im Peritoneum mit einem Durchmesser von 2 cm oder weniger, unabhängig vom Status der retroperitonealen Lymphknoten, oder Metastasen in Leber oder Milzkapsel | |||
| IIIC | Metastasen im Peritoneum mit einem Durchmesser von mehr als 2 cm, unabhängig vom Status der retroperitonealen Lymphknoten, oder Metastasen in der Leber- oder Milzkapsel | |||
| IV | Fernmetastasen (d. h. außerhalb des Peritoneums) | |||
| IVA | Pleuraerguss mit Krebszellen | |||
| IVB | Metastasen in entfernten Organen (einschließlich des Parenchyms der Milz oder der Leber) oder Metastasen in den Leisten- und extraabdominalen Lymphknoten |
Stadium 4 Eierstockkrebs ⓘ
AJCC/TNM
Das AJCC/TNM-Stadiensystem gibt an, wo sich der Tumor entwickelt hat, wo er sich auf die Lymphknoten ausgebreitet hat und wo sich Metastasen gebildet haben. ⓘ
| Stadium | Beschreibung ⓘ | ||
|---|---|---|---|
| T | Primärtumor | ||
| Tx | Kann nicht beurteilt werden | ||
| T0 | Kein Nachweis | ||
| T1 | Tumor begrenzt auf Eierstock/Ovarien | ||
| T1a | Ein Eierstock mit intakter Kapsel, kein Oberflächentumor und negativer Aszites/Peritonealspülung | ||
| T1b | Beide Eierstöcke mit intakter Kapsel, kein Oberflächentumor und negativer Aszites/Peritonealspülung | ||
| T1c | Ein oder beide Eierstöcke mit gerissener Kapsel bzw. gerissenen Kapseln, Oberflächentumor, positiver Aszites/Peritonealspülung | ||
| T2 | Der Tumor befindet sich in den Eierstöcken und im Becken (Ausdehnung oder Einnistung) | ||
| T2a | Ausdehnung auf Gebärmutter oder Eileiter, negative Aszites/Peritonealspülungen | ||
| T2b | Ausdehnung in andere Beckengewebe, Aszites/Peritonealspülungen negativ | ||
| T2c | Ausdehnung in beliebigem Beckengewebe, positiver Aszites/Peritonealspülungen | ||
| T3 | Der Tumor befindet sich in den Eierstöcken und hat außerhalb des Beckens in das Bauchfell (einschließlich der Leberkapsel) metastasiert | ||
| T3a | Mikroskopische Metastasierung | ||
| T3b | Makroskopische Metastase mit einem Durchmesser von weniger als 2 cm | ||
| T3c | Makroskopische Metastasen mit einem Durchmesser von mehr als 2 cm | ||
| N | Regionale Lymphknotenmetastasen | ||
| Nx | Kann nicht beurteilt werden | ||
| N0 | Keine Metastasierung | ||
| N1 | Metastasierung vorhanden | ||
| M | Fernmetastasierung | ||
| M0 | Keine Metastasierung | ||
| M1 | Metastasierung vorhanden (ohne Leberkapsel, einschließlich Leberparenchym und zytologisch bestätigtem Pleuraerguss) |
Die AJCC/TNM-Stadien können mit den FIGO-Stadien korreliert werden:
| FIGO | T | N | M ⓘ |
|---|---|---|---|
| I | T1 | N0 | M0 |
| IA | T1a | N0 | M0 |
| IB | T1b | N0 | M0 |
| IC | T1c | N0 | M0 |
| II | T2 | N0 | M0 |
| IIA | T2a | N0 | M0 |
| IIB | T2b | N0 | M0 |
| IIC | T2c | N0 | M0 |
| III | T3 | N0 | M0 |
| IIIA | T3a | N0 | M0 |
| IIIB | T3b | N0 | M0 |
| IIIC | T3c | N0/N1 | M0 |
| IV | Jede | Jede | M1 |
Einstufung
Tumore des Grades 1 haben gut differenzierte Zellen (sehen dem normalen Gewebe sehr ähnlich) und haben die beste Prognose. Tumore des Grades 2 werden auch als mäßig gut differenziert bezeichnet und bestehen aus Zellen, die dem normalen Gewebe ähneln. Tumore des Grades 3 haben die schlechteste Prognose und ihre Zellen sind abnormal, sie werden als schlecht differenziert bezeichnet. ⓘ
Die Metastasierung von Eierstockkrebs ist im Bauchraum sehr häufig und erfolgt durch Exfoliation, d. h., die Krebszellen durchbrechen die Eierstockkapsel und können sich frei in der Peritonealhöhle bewegen. Eierstockkrebsmetastasen wachsen in der Regel an der Oberfläche von Organen und nicht im Inneren; sie sind auch am Omentum und an der Bauchfellauskleidung zu finden. Krebszellen können auch durch das Lymphsystem wandern und in Lymphknoten metastasieren, die über Blutgefäße mit den Eierstöcken verbunden sind, d. h. in den Lymphknoten entlang des Lig. infundibulopelvicum, des Lig. broadum und des Lig. roundum. Zu den am häufigsten betroffenen Lymphknotengruppen gehören die paraaortalen, hypogastrischen, externen iliakalen, obturatorischen und inguinalen Lymphknoten. In der Regel metastasiert Eierstockkrebs nicht in Leber, Lunge, Gehirn oder Nieren, es sei denn, es handelt sich um eine rezidivierende Erkrankung; dies unterscheidet Eierstockkrebs von vielen anderen Krebsarten. ⓘ
Vorbeugung
Frauen mit einem hohen genetischen Risiko für Eierstockkrebs können die chirurgische Entfernung ihrer Eierstöcke als vorbeugende Maßnahme in Betracht ziehen. Dies wird häufig nach Abschluss des gebärfähigen Alters durchgeführt. Dadurch verringert sich bei Frauen mit hohem Risiko die Wahrscheinlichkeit, sowohl an Brustkrebs (um etwa 50 %) als auch an Eierstockkrebs (um etwa 96 %) zu erkranken. Bei Frauen mit BRCA-Genmutationen werden in der Regel gleichzeitig auch die Eileiter entfernt (Salpingo-Oophorektomie), da sie ebenfalls ein erhöhtes Risiko für Eileiterkrebs haben. Aufgrund der Art und Weise, wie sie untersucht wurden, wird die Risikominderung in diesen Statistiken jedoch möglicherweise überschätzt. ⓘ
Frauen mit einer signifikanten familiären Vorbelastung für Eierstockkrebs werden häufig an einen genetischen Berater überwiesen, um zu prüfen, ob ein Test auf BRCA-Mutationen sinnvoll wäre. Die Verwendung oraler Verhütungsmittel, das Ausbleiben der Periode während des Menstruationszyklus und die Eileiterunterbindung verringern das Risiko. Es besteht möglicherweise ein Zusammenhang zwischen der Entwicklung von Eierstockkrebs und der Stimulation der Eierstöcke während einer Unfruchtbarkeitsbehandlung. Endometriose wurde mit Eierstockkrebs in Verbindung gebracht. Eine Infektion mit dem humanen Papillomavirus, Rauchen und Talkum erhöhen nachweislich nicht das Risiko für Eierstockkrebs. ⓘ
Vorsorgeuntersuchungen
Es gibt keine einfache und zuverlässige Methode, um Frauen, die keine Anzeichen oder Symptome aufweisen, auf Eierstockkrebs zu testen. Bei Frauen mit durchschnittlichem Risiko wird das Screening nicht empfohlen, da es keine Hinweise auf eine Verringerung der Sterblichkeitsrate gibt und die hohe Rate falsch positiver Tests zu einer unnötigen Operation führen kann, die mit eigenen Risiken verbunden ist. Der Pap-Test dient nicht der Erkennung von Eierstockkrebs. ⓘ
Eierstockkrebs ist in der Regel erst in fortgeschrittenen Stadien tastbar. Bei Frauen, die ein durchschnittliches Risiko haben, wird ein Screening mittels CA-125-Messung, HE4-Spiegel, Ultraschall oder Abtasten der Adnexe nicht empfohlen. Das Risiko, an Eierstockkrebs zu erkranken, kann bei Frauen mit genetischen Faktoren verringert werden. Frauen mit einer genetischen Veranlagung können von einem Screening profitieren. Diese Hochrisikogruppe hat von der Früherkennung profitiert. ⓘ
Die Prävalenz von Eierstockkrebs ist gering, selbst in der Hochrisikogruppe der Frauen im Alter von 50 bis 60 Jahren (etwa eine von 2000), und ein Screening bei Frauen mit durchschnittlichem Risiko führt eher zu unklaren Ergebnissen als zur Entdeckung eines behandlungsbedürftigen Problems. Da unklare Ergebnisse wahrscheinlicher sind als die Entdeckung eines behandelbaren Problems und weil die übliche Reaktion auf unklare Ergebnisse invasive Eingriffe sind, überwiegen bei Frauen mit durchschnittlichem Risiko die potenziellen Schäden eines Screenings ohne Indikation den potenziellen Nutzen. Der Zweck des Screenings besteht darin, Eierstockkrebs in einem frühen Stadium zu diagnostizieren, in dem eine erfolgreiche Behandlung wahrscheinlicher ist. ⓘ
Screening mit transvaginalem Ultraschall, Beckenuntersuchung und CA-125-Werten kann bei Frauen mit BRCA1- oder BRCA2-Mutationen anstelle einer präventiven Operation eingesetzt werden. Diese Strategie hat einige Erfolge gezeigt. ⓘ
Das Screening auf CA125, einen chemischen Stoff, der von Eierstocktumoren freigesetzt wird, mit anschließender Ultraschallkontrolle erwies sich in einer groß angelegten britischen Studie als unwirksam für die Verringerung der Sterblichkeit. ⓘ
Behandlung
Sobald festgestellt wird, dass Eierstock-, Eileiter- oder primärer Bauchfellkrebs vorliegt, wird die Behandlung von einem gynäkologischen Onkologen (einem Arzt, der für die Behandlung von Krebserkrankungen des weiblichen Fortpflanzungssystems ausgebildet ist) geplant. Gynäkologische Onkologen können Frauen mit Eierstockkrebs operieren und eine Chemotherapie durchführen. Es wird ein Behandlungsplan erstellt. ⓘ
Die Behandlung umfasst in der Regel eine Operation und eine Chemotherapie, manchmal auch eine Strahlentherapie, unabhängig vom Subtyp des Eierstockkrebses. Bei gut differenzierten bösartigen Tumoren, die auf den Eierstock beschränkt sind, kann eine chirurgische Behandlung ausreichen. Bei aggressiveren, auf den Eierstock begrenzten Tumoren kann eine zusätzliche Chemotherapie erforderlich sein. Bei Patientinnen mit fortgeschrittener Erkrankung ist eine Kombination aus chirurgischer Entfernung und einer kombinierten Chemotherapie Standard. Seit 1980 spielen Medikamente auf Platinbasis eine wichtige Rolle bei der Behandlung von Eierstockkrebs. Borderline-Tumoren, auch wenn sie sich außerhalb des Eierstocks ausgebreitet haben, lassen sich durch eine Operation gut behandeln, und eine Chemotherapie wird nicht als sinnvoll erachtet. Die zweite Operation und die Erhaltungschemotherapie haben sich nicht als nützlich erwiesen. ⓘ
Chirurgie
Die Operation ist seit Jahrzehnten der Standard der Behandlung und kann zur Gewinnung einer Probe für die Diagnose erforderlich sein. Die Operation hängt davon ab, wie weit der Krebs zum Zeitpunkt der Diagnose in andere Gewebe eingedrungen ist. Diese Ausdehnung des Krebses wird durch die Einteilung in ein Stadium, den vermuteten Typ und den Grad des Krebses beschrieben. Der gynäkologische Chirurg kann einen (unilaterale Oophorektomie) oder beide Eierstöcke (bilaterale Oophorektomie) entfernen. Auch die Eileiter (Salpingektomie), die Gebärmutter (Hysterektomie) und das Omentum (Omentektomie) können entfernt werden. In der Regel werden alle diese Organe entfernt. ⓘ
Bei niedriggradigen, einseitigen Krebserkrankungen im Stadium IA werden nur der betroffene Eierstock (der nicht durchgebrochen sein darf) und der Eileiter entfernt. Dies ist vor allem bei jungen Menschen möglich, die ihre Fruchtbarkeit erhalten wollen. Es besteht jedoch das Risiko mikroskopischer Metastasen, und es muss ein Staging durchgeführt werden. Wenn Metastasen gefunden werden, ist eine zweite Operation zur Entfernung des verbleibenden Eierstocks und der Gebärmutter erforderlich. Vor der Operation kann Tranexamsäure verabreicht werden, um den Bedarf an Bluttransfusionen aufgrund des Blutverlustes während des Eingriffs zu verringern. ⓘ
Wird bei einer prämenopausalen Frau während der Operation ein Tumor mit geringem Malignitätspotenzial festgestellt und handelt es sich eindeutig um Krebs im Stadium I, wird nur der betroffene Eierstock entfernt. Bei postmenopausalen Frauen mit Tumoren mit geringem Malignitätspotenzial ist die Hysterektomie mit bilateraler Salpingo-Oophorektomie nach wie vor die bevorzugte Option. Beim Staging kann der Blinddarm untersucht oder entfernt werden. Dies ist besonders wichtig bei schleimigen Tumoren. Bei Kindern und Jugendlichen mit Eierstockkrebs versuchen die Chirurgen in der Regel, einen Eierstock zu erhalten, um den Abschluss der Pubertät zu ermöglichen, aber wenn der Krebs gestreut hat, ist dies nicht immer möglich. Vor allem bei Dysgerminomen sind meist beide Eierstöcke betroffen: 8-15 % der Dysgerminome treten in beiden Eierstöcken auf. Menschen mit niedriggradigen (gut differenzierten) Tumoren werden in der Regel nur durch eine Operation behandelt, die oft heilend wirkt. Im Allgemeinen können Keimzelltumore mit einer einseitigen Operation behandelt werden, es sei denn, der Krebs ist weit verbreitet oder die Fruchtbarkeit spielt keine Rolle. Bei Frauen mit fortgeschrittenem epithelialem Ovarialkarzinom (Stadien III und IV) sollte laut Studien alles unternommen werden, um eine vollständige Zytoreduktion (chirurgische Entfernung des größten Teils des Tumors) zu erreichen. ⓘ
Bei fortgeschrittenem Krebs, bei dem eine vollständige Entfernung nicht in Frage kommt, wird in einer so genannten Debulking-Operation so viel Tumor wie möglich entfernt. Diese Operation ist nicht immer erfolgreich und bei Frauen mit ausgedehnten Metastasen im Bauchfell, Krebs im Stadium IV, Krebs in der Querspalte der Leber, im Mesenterium oder im Zwerchfell sowie bei großflächigem Aszites ist die Wahrscheinlichkeit geringer, dass sie erfolgreich ist. Eine Entlastungsoperation wird in der Regel nur einmal durchgeführt. Die Computertomographie (abdominale CT) wird häufig eingesetzt, um zu beurteilen, ob eine primäre Debulking-Operation möglich ist, aber es gibt auch Hinweise darauf, dass Fluordesoxyglukose-18 (FDG) PET/CT und MRT als Ergänzung zur Beurteilung des makroskopisch unvollständigen Debulking nützlich sein können. Ein vollständigeres Debulking ist mit besseren Ergebnissen verbunden: Frauen, die nach dem Debulking keine makroskopischen Anzeichen einer Erkrankung aufweisen, haben eine mediane Überlebenszeit von 39 Monaten, gegenüber 17 Monaten bei einer weniger vollständigen Operation. Durch die Entfernung der Metastasen werden viele Zellen, die gegen eine Chemotherapie resistent sind, entfernt, und auch abgestorbene Zellklumpen werden entfernt. Dadurch kann die Chemotherapie die verbleibenden Krebszellen besser erreichen, die eher schnell wachsen und daher empfindlich auf Chemotherapie reagieren. ⓘ
Ein weiteres Protokoll ist die Intervall-Debulking-Operation, bei der eine neoadjuvante Chemotherapie verabreicht, eine Debulking-Operation durchgeführt und die Chemotherapie nach dem Debulking beendet wird. Obwohl noch keine endgültigen Studien vorliegen, hat sich gezeigt, dass dieses Verfahren in Bezug auf die Überlebensrate der primären Debulking-Operation annähernd gleichwertig ist und eine etwas geringere Morbidität aufweist. ⓘ
Es gibt mehrere verschiedene chirurgische Verfahren, die zur Behandlung von Eierstockkrebs eingesetzt werden können. Bei Krebs im Stadium I und II kann die laparoskopische (Schlüsselloch-)Chirurgie angewandt werden, wobei jedoch möglicherweise keine Metastasen gefunden werden. Bei fortgeschrittenem Krebs wird die Laparoskopie nicht eingesetzt, da die Entfernung von Metastasen den Zugang zur gesamten Bauchhöhle erfordert. Je nach Ausmaß des Krebses können die Verfahren eine bilaterale Salpingo-Oophorektomie, Biopsien im gesamten Bauchfell und im abdominalen Lymphsystem, Omentektomie, Splenektomie, Darmresektion, Zwerchfellstripping oder -resektion, Appendektomie oder sogar eine hintere Beckenexenteration umfassen. ⓘ
Um ein vollständiges Stadium des Eierstockkrebses zu erreichen, kann eine Lymphadenektomie in die Operation einbezogen werden, aber ein signifikanter Überlebensvorteil ergibt sich daraus möglicherweise nicht. Dies ist besonders wichtig bei Keimzelltumoren, da diese häufig in nahe gelegene Lymphknoten metastasieren. ⓘ
Bei einem Wiederauftreten von Eierstockkrebs ist eine zweite Operation manchmal eine Behandlungsoption. Dies hängt davon ab, wie leicht der Tumor entfernt werden kann, wie viel Flüssigkeit sich im Bauchraum angesammelt hat und wie gut der allgemeine Gesundheitszustand ist. Die Effektivität dieser Operation hängt von der Operationstechnik, der Vollständigkeit der Zytoreduktion und dem Ausmaß der Erkrankung ab. Sie kann auch bei Patientinnen hilfreich sein, die ihre erste Operation von einem Allgemeinmediziner durchführen ließen, sowie bei epithelialem Eierstockkrebs. Eine sekundäre Operation kann bei Dysgerminomen und unreifen Teratomen wirksam sein. Es gibt Hinweise darauf, dass ein chirurgischer Eingriff bei rezidivierendem epithelialem Ovarialkarzinom bei einigen Frauen mit platinsensibler Erkrankung lebensverlängernd wirken kann. ⓘ
Die wichtigste Nebenwirkung der Oophorektomie bei jüngeren Frauen ist die frühe Menopause, die zu Osteoporose führen kann. Nach der Operation kann eine Hormonersatztherapie in Betracht gezogen werden, insbesondere bei jüngeren Frauen. Diese Therapie kann aus einer Kombination von Östrogen und Progesteron oder aus Östrogen allein bestehen. Östrogen allein ist nach einer Hysterektomie unbedenklich; wenn die Gebärmutter noch vorhanden ist, erhöht sich das Risiko für Endometriumkarzinome durch unbehandeltes Östrogen drastisch. Eine Östrogentherapie nach einer Operation hat keinen Einfluss auf die Überlebensrate. Patientinnen, die sich einer Eierstockkrebs-Operation unterziehen, werden in der Regel für 3 bis 4 Tage ins Krankenhaus eingewiesen und erholen sich etwa einen Monat lang zu Hause. Die besten Operationsergebnisse werden in Krankenhäusern erzielt, in denen eine große Zahl von Eierstockkrebsoperationen durchgeführt wird. ⓘ
Es ist unklar, ob die Laparoskopie oder die Laparotomie bei Eierstockkrebs im FIGO-Stadium I besser oder schlechter ist. Es gibt auch keinen offensichtlichen Unterschied zwischen einer totalen abdominalen Hysterektomie und einer suprazervikalen Hysterektomie bei fortgeschrittenen Krebserkrankungen. Etwa 2,8 % der Patientinnen, die sich einer Erstoperation bei fortgeschrittenem Eierstockkrebs unterziehen, sterben innerhalb von zwei Wochen nach der Operation (perioperative Sterblichkeitsrate von 2,8 %). Aggressivere Operationen sind bei fortgeschrittenem Eierstockkrebs (Stadium III oder IV) mit besseren Ergebnissen verbunden. ⓘ
Die Operation dient einerseits der Sicherung der Diagnose und genauen Stadienbestimmung. Über einen mediane Laparotomie wird der gesamte Unterleib systematisch auf Krebsbefall untersucht. Zusätzlich werden Gewebeproben zur histologischen Beurteilung entnommen. Andererseits verfolgt die Operation das Ziel einer möglichst vollständigen Entfernung aller sichtbaren Krebsgeschwüre. Dabei bestimmt die Radikalität der Tumorreduktion (als einziger beeinflussbarer Prognosefaktor) maßgeblich die Heilungsaussichten. Damit möglichst keine Krebszellen im Körper verbleiben, umfasst die Standard-Operation die Entfernung der Eierstöcke und Eileiter, der Gebärmutter, des großen Netzes sowie der Lymphknoten. Abhängig vom Krankheitsstadium kann die Entnahme weiterer Organteile, wie zum Beispiel Teilen des Darms, notwendig sein. Nur bei einem gesicherten Frühstadium (FIGO-Stadium IA) ist eine fertilitätserhaltende Operation möglich. Hierbei werden die Gebärmutter und der nicht befallene Eierstock bei bestehendem Kinderwunsch erhalten. Um nicht sichtbare Peritonealmetastasen während einer Operation zu behandeln, gibt es die Möglichkeit einer hyperthermen intraperitonealen Chemoperfusion (HIPEC). Eine erwärmte Lösung, welche mit einem Chemotherapeutikum (zum Beispiel Cisplatin oder Mitomycin C) versehen ist, wird über etwas eine Stunde im Bauchraum verteilt. Dadurch gelangt das Medikament auch zu schlecht durchbluteten Metastasen und durch die Erwärmung lässt sich eine Wirkungssteigerung erreichen. ⓘ
Chemotherapie
Die Chemotherapie ist seit Jahrzehnten ein allgemeiner Behandlungsstandard für Eierstockkrebs, wenn auch mit unterschiedlichen Protokollen. Die Chemotherapie wird nach der Operation eingesetzt, um gegebenenfalls eine Resterkrankung zu behandeln. In einigen Fällen kann es sinnvoll sein, zunächst eine Chemotherapie durchzuführen und dann zu operieren. Dies wird als "neoadjuvante Chemotherapie" bezeichnet und ist üblich, wenn ein Tumor durch eine Operation nicht vollständig entfernt oder optimal entfernt werden kann. Sie erhöht zwar nachweislich nicht die Überlebensrate, kann aber das Risiko von Komplikationen nach der Operation verringern. Wenn eine einseitige Salpingo-Oophorektomie oder eine andere Operation durchgeführt wird, kann eine zusätzliche Chemotherapie, die so genannte "adjuvante Chemotherapie", verabreicht werden. Eine adjuvante Chemotherapie wird in der Regel bei Krebs im Stadium 1 eingesetzt, wenn der Tumor einen hohen histologischen Grad (Grad 3) oder das höchste Unterstadium (Stadium 1c) aufweist, vorausgesetzt, der Krebs wurde bei der Operation optimal eingestuft. Bevacizumab kann als adjuvante Chemotherapie eingesetzt werden, wenn der Tumor bei der Operation nicht vollständig entfernt wurde oder wenn sich der Krebs im Stadium IV befindet; es kann das progressionsfreie Überleben verlängern, aber es hat sich nicht gezeigt, dass es das Gesamtüberleben verlängert. Eine Chemotherapie ist bei etwa 20 % der fortgeschrittenen Ovarialkarzinome kurativ; bei malignen Keimzelltumoren ist sie häufiger kurativ als bei Epitheltumoren. Es hat sich gezeigt, dass eine adjuvante Chemotherapie bei Frauen mit epithelialem Ovarialkarzinom im Frühstadium die Überlebenszeit verlängert und das Risiko eines erneuten Auftretens des Ovarialkarzinoms im Vergleich zu einer nicht adjuvanten Therapie verringert. ⓘ
Die Chemotherapie bei Eierstockkrebs besteht in der Regel aus Platinen, einer Gruppe von Medikamenten auf Platinbasis, in Kombination mit Nicht-Platinen. Platinbasierte Medikamente werden seit 1980 eingesetzt. Zu den gängigen Therapien gehören Paclitaxel, Cisplatin, Topotecan, Doxorubicin, Epirubicin und Gemcitabin. Carboplatin wird in der Regel in Kombination mit Paclitaxel oder Docetaxel verabreicht; die typische Kombination ist Carboplatin mit Paclitaxel. Carboplatin ist Cisplatin insofern überlegen, als es weniger toxisch ist und weniger Nebenwirkungen hat, was im Allgemeinen zu einer besseren Lebensqualität führt, obwohl beide ähnlich wirksam sind. Dreistufige Therapieschemata haben sich nicht als wirksamer erwiesen, und Platine allein oder Nicht-Platin allein sind weniger wirksam als Platine und Nicht-Platin in Kombination. Die platinhaltige Chemotherapie hat einen geringen Vorteil gegenüber der nicht-platinhaltigen Therapie. Platin-Kombinationen können die Überlebenschancen gegenüber einer Platin-Einzeltherapie verbessern. Bei Patienten mit rezidivierendem Eierstockkrebs hat Topotecan nachweislich eine ähnliche Wirkung auf das Gesamtüberleben wie Paclitaxel und Topotecan plus Thalidomid, während es Treosulfan überlegen ist und bei platinsensiblen Patienten nicht so wirksam ist wie pegyliertes liposomales Doxorubicin. ⓘ
Die Chemotherapie kann intravenös oder in der Peritonealhöhle durchgeführt werden. Die intraperitoneale Chemotherapie wird zwar mit einem längeren progressionsfreien Überleben und einer längeren Gesamtüberlebenszeit in Verbindung gebracht, verursacht aber auch mehr unerwünschte Nebenwirkungen als die intravenöse Chemotherapie. Sie wird vor allem dann eingesetzt, wenn der Krebs optimal entfernt worden ist. Die intraperitoneale Chemotherapie kann sehr wirksam sein, da sich der Eierstockkrebs hauptsächlich in der Bauchhöhle ausbreitet und die Medikamente auf diese Weise in höherer Dosierung den Tumor erreichen können. ⓘ
Die Chemotherapie kann zu Anämie führen; intravenös verabreichtes Eisen hat sich als wirksamer erwiesen als orale Eisenpräparate, um den Bedarf an Bluttransfusionen zu verringern. Typische Behandlungszyklen umfassen eine Behandlung alle 3 Wochen, die über 6 Wochen oder länger wiederholt wird. Eine Behandlung über weniger als 6 Wochen (Zyklen) ist weniger wirksam als eine Behandlung über 6 Wochen oder länger. Keimzelltumore werden anders behandelt als andere Ovarialkarzinome - es wird ein Schema aus Bleomycin, Etoposid und Cisplatin (BEP) mit einer 5-tägigen Chemotherapie verwendet, die alle 3 Wochen über 3 bis 4 Zyklen verabreicht wird. Es ist nicht erwiesen, dass eine Chemotherapie bei Keimzelltumoren Amenorrhoe, Unfruchtbarkeit, Geburtsfehler oder Fehlgeburten verursacht. Eine Erhaltungschemotherapie hat sich nicht als wirksam erwiesen. ⓘ
Bei Menschen mit BRCA-Mutationen ist eine Platin-Chemotherapie wirksamer. Keimzelltumore und bösartige Geschlechtsstrang-/Stromtumore werden mit Chemotherapie behandelt, wobei Dysgerminome und Geschlechtsstrang-Tumore in der Regel nicht sehr gut ansprechen. ⓘ
Platinempfindlich oder platinresistent
Wenn Eierstockkrebs wieder auftritt, wird er als teilweise platinempfindlich oder platinresistent eingestuft, je nachdem, wie viel Zeit seit dem letzten mit Platin behandelten Rezidiv verstrichen ist: Teilweise platinempfindliche Tumoren traten 6-12 Monate nach der letzten Behandlung wieder auf, und bei platinresistenten Tumoren beträgt der Abstand weniger als 6 Monate. Eine Zweitlinien-Chemotherapie kann verabreicht werden, nachdem der Krebs symptomatisch geworden ist, da kein Unterschied im Überleben zwischen der Behandlung asymptomatischer (erhöhter CA-125) und symptomatischer Rezidive festgestellt wurde. ⓘ
Bei platinsensiblen Tumoren sind Platine in Kombination mit anderen zytotoxischen Wirkstoffen die Mittel der Wahl für die Zweitlinien-Chemotherapie. Zu den Regimen gehören Carboplatin in Kombination mit pegyliertem liposomalem Doxorubicin, Gemcitabin oder Paclitaxel. Die Carboplatin-Doublett-Therapie kann in einigen Fällen mit Paclitaxel kombiniert werden, um die Wirksamkeit zu erhöhen. Eine weitere potenzielle adjuvante Therapie bei platinsensitiven Rezidiven ist Olaparib, das das progressionsfreie Überleben verbessern kann, aber nachweislich nicht das Gesamtüberleben verbessert. (Olaparib, ein PARP-Inhibitor, wurde von der US-amerikanischen Arzneimittelbehörde FDA zur Behandlung von BRCA-assoziiertem Eierstockkrebs zugelassen, der zuvor mit Chemotherapie behandelt worden war.) Bei rezidivierenden Keimzelltumoren sind zusätzliche 4 Zyklen BEP-Chemotherapie die Erstlinienbehandlung für diejenigen, die mit einer Operation oder Platinen behandelt wurden. ⓘ
Wird festgestellt, dass der Tumor platinresistent ist, kann als Zweitlinientherapie Vincristin, Dactinomycin und Cyclophosphamid (VAC) oder eine Kombination aus Paclitaxel, Gemcitabin und Oxaliplatin eingesetzt werden. ⓘ
Für platinresistente Tumoren gibt es keine hochwirksamen Chemotherapieoptionen. Einzeltherapieschemata (Doxorubicin oder Topotecan) haben keine hohen Ansprechraten, aber in einigen Fällen werden Einzeltherapieschemata aus Topotecan, pegyliertem liposomalem Doxorubicin oder Gemcitabin eingesetzt. Topotecan kann nicht bei Menschen mit einem Darmverschluss eingesetzt werden. Paclitaxel allein ist eine weitere mögliche Behandlungsform, oder es kann mit liposomalem Doxorubicin, Gemcitabin, Cisplatin, Topotecan, Etoposid oder Cyclophosphamid kombiniert werden. (Siehe auch Palliativmedizin unten.) ⓘ
Für Frauen mit Eierstockkrebs, die eine Resistenz gegen Chemotherapeutika entwickeln, werden derzeit neue Wirkstoffe entwickelt, die die Bildung neuer Blutgefäße (Angiogenese) hemmen. Seit 2011 liegen nur vorläufige Ergebnisse vor. ⓘ
Novocure hat eine Phase-2-Studie gesponsert, die die Wirksamkeit von Tumorbehandlungsfeldern bei rezidivierendem platinresistentem Ovarialkarzinom in Verbindung mit einer wöchentlichen Paclitaxel-Chemotherapie belegt. ⓘ
Strahlentherapie
Dysgerminome werden am wirksamsten durch Bestrahlung behandelt, die jedoch zu Unfruchtbarkeit führen kann und daher schrittweise zugunsten der Chemotherapie abgebaut wird. Bei gut differenzierten Tumoren verbessert die Strahlentherapie das Überleben nicht. ⓘ
Bei Krebserkrankungen im Stadium 1c und 2 wird die Strahlentherapie nach der Operation eingesetzt, wenn die Möglichkeit eines Restbefalls im Becken besteht, der Unterleib aber krebsfrei ist. Die Strahlentherapie kann auch in der Palliativmedizin bei fortgeschrittenen Krebserkrankungen eingesetzt werden. Eine typische Strahlentherapie bei Eierstockkrebs erfolgt an 5 Tagen pro Woche über 3-4 Wochen. Häufige Nebenwirkungen der Strahlentherapie sind Durchfall, Verstopfung und häufiges Wasserlassen. ⓘ
Hormonelle Therapie
Obwohl 60 % der Eierstocktumoren Östrogenrezeptoren haben, spricht Eierstockkrebs nur selten auf hormonelle Behandlungen an. Ein Cochrane-Review ergab, dass die Wirkung von Tamoxifen bei Patientinnen mit rezidivierendem Eierstockkrebs nicht ausreichend belegt ist. Östrogen allein hat keine Wirkung auf den Krebs, und Tamoxifen und Letrozol sind selten wirksam. "Einige Frauen mit bösartigem Eierstockkrebs im Grenzbereich zur Bösartigkeit und mit Stroma-Ovarialkarzinom können eine Hormontherapie erhalten. ⓘ
Immuntherapie
Die Immuntherapie ist ein Thema der aktuellen Forschung bei Eierstockkrebs. In einigen Fällen wird das Antikörpermedikament Bevacizumab, das noch Gegenstand aktiver Forschung ist, zur Behandlung von fortgeschrittenem Krebs zusammen mit einer Chemotherapie eingesetzt. Es ist in der Europäischen Union für diese Anwendung zugelassen. ⓘ
Nachsorge
Die spezifische Nachsorge hängt u. a. von der Art und dem Stadium des Eierstockkrebses, der Behandlung und dem Auftreten von Symptomen ab. In der Regel wird anfangs etwa alle 2 bis 3 Monate ein Kontrolltermin vereinbart, danach bis zu 5 Jahre lang zweimal jährlich. Bei epithelialem Ovarialkarzinom ist der häufigste Test bei der Nachuntersuchung der CA-125-Wert. Eine Behandlung, die nur auf erhöhten CA-125-Werten und nicht auf Symptomen beruht, kann jedoch die Nebenwirkungen verstärken, ohne das Leben zu verlängern, so dass die Auswirkungen des Ergebnisses eines CA-125-Tests vor dessen Durchführung besprochen werden können. Die Empfehlung aus dem Jahr 2014 lautet, dass ein Krebsrezidiv vorliegen kann, wenn der CA-125-Wert doppelt so hoch ist wie der Normalwert. Die Behandlung eines durch CA-125 festgestellten Rezidivs verbessert die Überlebensrate nicht. ⓘ
Bei Frauen mit Keimzelltumoren umfassen die Nachuntersuchungen im Allgemeinen Alpha-Fetoprotein (AFP) und/oder humanes Choriongonadotropin. Bei Frauen mit Stromatumoren sind Tests auf Hormone wie Östrogen, Testosteron und Inhibin manchmal hilfreich. Inhibin kann auch für die Überwachung des Fortschritts von Geschlechtsstrang-Tumoren nützlich sein, ebenso wie Mullerian inhibiting substance. AFP kann auch zur Überwachung von Sertoli-Leydig-Tumoren verwendet werden. Bei Dysgerminomen werden die Laktatdehydrogenase und ihre beiden Isoenzyme (LDH-1 und LDH-2) zur Untersuchung auf ein Rezidiv verwendet. ⓘ
Bei Frauen mit Eierstockkrebs sind routinemäßige bildgebende Untersuchungen zur Überwachung des Krebses nicht unbedingt erforderlich, es sei denn, es treten neue Symptome auf oder die Tumormarker beginnen zu steigen. Von einer Bildgebung ohne diese Indikationen wird abgeraten, da es unwahrscheinlich ist, dass sie ein Rezidiv entdeckt und die Überlebensrate verbessert, und weil sie mit Kosten und Nebenwirkungen verbunden ist. Auf Wunsch kann jedoch eine CT-Bildgebung durchgeführt werden, obwohl dies nicht üblich ist. Lässt sich ein Tumor gut abbilden, kann die Bildgebung zur Überwachung des Behandlungsfortschritts eingesetzt werden. ⓘ
Palliativmedizin
Die Palliativmedizin konzentriert sich darauf, Symptome zu lindern und die Lebensqualität zu verbessern oder zu erhalten. Diese Art der Behandlung zielt nicht darauf ab, den Krebs zu heilen, sondern der Frau das Leben mit einer nicht heilbaren Krebserkrankung zu erleichtern. Sie wird als Teil des Behandlungsplans für alle Personen mit fortgeschrittenem Eierstockkrebs oder Patientinnen mit erheblichen Symptomen empfohlen. In platinrefraktären und platinresistenten Fällen ist eine andere palliative Chemotherapie die Hauptbehandlung. ⓘ
Die Palliativmedizin kann die Behandlung von Symptomen und Komplikationen der Krebserkrankung umfassen, darunter Schmerzen, Übelkeit, Verstopfung, Aszites, Darmverschluss, Ödeme, Pleuraerguss und Mukositis. Vor allem wenn die Krebserkrankung fortschreitet und unheilbar wird, wird die Behandlung der Symptome zu einem der Hauptziele der Therapie. Die Palliativmedizin kann auch bei der Entscheidungsfindung behilflich sein, z. B. bei der Frage, ob oder wann eine Hospizbetreuung angebracht ist und wo der Patient am Ende seines Lebens betreut werden soll. ⓘ
Ein Darmverschluss kann palliativchirurgisch (Kolostomie, Ileostomie oder interner Bypass) oder medikamentös behandelt werden, wobei eine Operation nachweislich die Überlebenszeit verlängert. Eine palliative Operation kann zu einem Kurzdarmsyndrom, einer enterokutanen Fistel oder einer erneuten Obstruktion führen oder ist aufgrund des Ausmaßes der Obstruktion nicht möglich. Weitere Behandlungsmöglichkeiten für Komplikationen sind die totale parenterale Ernährung, eine rückstandsarme Diät, eine palliative Gastrostomie und eine angemessene Schmerzkontrolle. Eine Darmobstruktion kann auch mit Octreotid behandelt werden, wenn eine palliative Operation nicht in Frage kommt. Krebs kann auch die Harnleiter blockieren, was durch eine Nephrostomie oder einen Ureterstent behoben werden kann. Aszites kann durch wiederholte Parazentese oder das Anlegen einer Drainage gelindert werden, um den Komfort zu erhöhen. Pleuraergüsse können auf ähnliche Weise behandelt werden: durch wiederholte Thorakozentese, Pleurodese oder das Einlegen einer Drainage. ⓘ
Eine Strahlentherapie kann im Rahmen der palliativen Behandlung von fortgeschrittenem Eierstockkrebs eingesetzt werden, da sie dazu beitragen kann, Tumore, die Symptome verursachen, zu verkleinern. Die palliative Strahlentherapie umfasst in der Regel nur wenige Behandlungen und ist damit wesentlich kürzer als die nicht-palliative Strahlentherapie. Sie wird auch zur Palliation von chemotherapieresistenten Keimzelltumoren eingesetzt. ⓘ
Psychosoziale Betreuung
Eierstockkrebs hat erhebliche Auswirkungen auf die Lebensqualität, die psychische Gesundheit und das Wohlbefinden. Es stehen Maßnahmen zur Verfügung, die bei den Bedürfnissen und der sozialen Unterstützung helfen. Viele Überlebende von Eierstockkrebs berichten von einer guten Lebensqualität und Optimismus. Andere berichteten von einer "spirituellen Veränderung", die ihnen half, während ihrer Erfahrung einen Sinn zu finden. Andere haben beschrieben, dass sie nach der Diagnose Eierstockkrebs ihren Glauben verloren haben. Diejenigen, die eine Behandlung durchlaufen haben, erleben manchmal soziale Isolation, profitieren aber von den Beziehungen zu anderen Überlebenden. Frustration und Schuldgefühle wurden von einigen beschrieben, die ihre Unfähigkeit, für ihre Familie zu sorgen, zum Ausdruck brachten. ⓘ
Das Selbstwertgefühl und das Körperbild können sich aufgrund des Haarausfalls, der Entfernung der Eierstöcke und anderer reproduktiver Strukturen sowie der Narben verändern. Eine gewisse Besserung tritt ein, wenn die Haare nachwachsen. Sexuelle Probleme können auftreten. Die Entfernung der Eierstöcke führt zu einer chirurgisch induzierten Menopause, die sich in schmerzhaftem Geschlechtsverkehr, Scheidentrockenheit, Verlust des sexuellen Verlangens und Müdigkeit äußern kann. Auch wenn die Prognose für jüngere Überlebende besser ist, können die Auswirkungen auf die Sexualität immer noch erheblich sein. ⓘ
Angstzustände, Depressionen und Ängste sind bei Überlebenden von Eierstockkrebs häufiger anzutreffen als in der Allgemeinbevölkerung. Die gleichen psychosozialen Probleme können auch bei Familienmitgliedern auftreten. Zu den emotionalen Auswirkungen können Todesangst, Traurigkeit, Gedächtnisprobleme und Konzentrationsschwierigkeiten gehören. Wenn die Betroffenen zu Beginn der Behandlung optimistisch waren, war die Wahrscheinlichkeit geringer, dass sie Probleme bekamen. Diejenigen, die Angst vor einem Wiederauftreten des Krebses haben, können Schwierigkeiten haben, Freude zu empfinden, selbst wenn sie frei von Krankheit sind. Je mehr Behandlungen eine Frau durchläuft, desto wahrscheinlicher ist der Verlust der Hoffnung. Frauen können die negativen psychosozialen Auswirkungen oft durch eine Reihe von Strategien bewältigen und reduzieren. Aktivitäten wie Reisen, zusätzliche Zeit mit der Familie und Freunden verbringen, Statistiken ignorieren, Tagebuch führen und sich verstärkt an spirituellen Veranstaltungen beteiligen, sind adaptiv. ⓘ
Frauen mit Eierstockkrebs können auch Schwierigkeiten mit ihrer Ernährung haben und sind dem Risiko einer Mangelernährung ausgesetzt. ⓘ
Prognose

Eierstockkrebs hat in der Regel eine relativ schlechte Prognose. Er ist unverhältnismäßig tödlich, weil es keinen eindeutigen Früherkennungs- oder Screening-Test gibt, so dass die meisten Fälle erst in fortgeschrittenen Stadien diagnostiziert werden. ⓘ
Eierstockkrebs metastasiert schon früh in seiner Entwicklung, oft noch bevor er diagnostiziert wird. Hochgradige Tumore metastasieren leichter als niedriggradige. In der Regel beginnen die Tumorzellen zu metastasieren, indem sie in der Bauchhöhle wachsen. Mehr als 60 % der Frauen mit Eierstockkrebs haben Krebs im Stadium III oder IV, d. h. der Krebs hat sich bereits über die Eierstöcke hinaus ausgebreitet. Eierstockkrebs gibt Zellen in die natürlich vorkommende Flüssigkeit in der Bauchhöhle ab. Diese Zellen können sich dann in anderen Strukturen des Bauchraums (Peritoneum) einnisten, z. B. in der Gebärmutter, der Harnblase, dem Darm, der Darmwand und dem Omentum, und neue Tumoren bilden, bevor überhaupt ein Krebsverdacht besteht. ⓘ
Die Fünf-Jahres-Überlebensrate für alle Stadien von Eierstockkrebs liegt bei 46 %, die Ein-Jahres-Überlebensrate bei 72 % und die Zehn-Jahres-Überlebensrate bei 35 %. In Fällen, in denen die Diagnose in einem frühen Stadium der Erkrankung gestellt wird, wenn der Krebs noch auf den Primärherd beschränkt ist, liegt die Fünfjahresüberlebensrate bei 92,7 %. Etwa 70 % der Frauen mit fortgeschrittener Erkrankung sprechen auf die Erstbehandlung an, die meisten von ihnen erreichen eine vollständige Remission, aber bei der Hälfte dieser Frauen kommt es 1-4 Jahre nach der Behandlung zu einem Rückfall. Hirnmetastasen treten häufiger bei Krebs im Stadium III/IV auf, können aber auch bei Krebserkrankungen im Stadium I/II vorkommen. Menschen mit Hirnmetastasen überleben im Durchschnitt 8,2 Monate, obwohl eine Operation, Chemotherapie und Ganzhirnbestrahlung das Überleben verbessern kann. ⓘ
Die Überlebensrate bei Eierstockkrebs variiert je nach Subtyp erheblich. Dysgerminome haben eine sehr günstige Prognose. In frühen Stadien liegt die Fünfjahresüberlebensrate bei 96,9 %. Etwa zwei Drittel der Dysgerminome werden im Stadium I diagnostiziert. Dysgerminome im Stadium III haben eine Fünfjahresüberlebensrate von 61 %; bei Behandlung mit BEP-Chemotherapie nach unvollständiger chirurgischer Entfernung haben Dysgerminome eine Zweijahresüberlebensrate von 95 %. Geschlechtshormonale Malignome haben ebenfalls eine günstige Prognose; da sie langsam wachsen, können selbst diejenigen mit Metastasenbildung ein Jahrzehnt oder länger überleben. Tumoren mit geringem Malignitätspotenzial haben in der Regel nur dann eine schlechte Prognose, wenn sich invasive Tumorimplantate in der Bauchhöhle befinden. ⓘ
Zu den Komplikationen des Eierstockkrebses gehören die Ausbreitung des Krebses auf andere Organe, der fortschreitende Funktionsverlust verschiedener Organe, Aszites und Darmverschlüsse, die tödlich sein können. Darmobstruktionen an mehreren Stellen sind die häufigste unmittelbare Todesursache. Ein Darmverschluss bei Eierstockkrebs kann entweder eine echte Obstruktion sein, bei der der Tumor das Darmlumen blockiert, oder eine Pseudobstruktion, bei der der Tumor die normale Peristaltik verhindert. Eine kontinuierliche Ansammlung von Aszites kann durch Anlegen einer Drainage behandelt werden, die sich selbst entleeren kann. ⓘ
Entscheidend für die Prognose sind das Tumorstadium bei Stellung der Diagnose, der histologische Befund und vor allem die Größe des nach der Operation verbliebenen Tumorrestes. ⓘ
Die Prognose des Ovarialkarzinoms ist sehr uneinheitlich und schwankt in Abhängigkeit von dem Tumorstadium bei Diagnosestellung, aber auch in Abhängigkeit vom histologischen Befund und von der Menge des bei der ersten Operation zurückgelassenen Tumorrestes. Die 5-Jahres-Überlebensrate (über alle Erkrankten gemittelt) liegt bei 30–40 %. Grund hierfür ist vor allem die meist späte Diagnosestellung und das hohe Rezidivrisiko. ⓘ
| Stadium | 5-Jahres-Überlebensrate ⓘ |
| FIGO I | 80 % |
| FIGO II | 60 % |
| FIGO III | 23 % |
| FIGO IV | 14 % |
Prognostische Faktoren
Es gibt eine Reihe prognostischer Faktoren für Eierstockkrebs. Zu den positiven Prognosefaktoren - d. h. Faktoren, die auf bessere Überlebenschancen hindeuten - gehören: keine Resterkrankung nach der Operation (Stadium III/IV), vollständige makroskopische Resektion (Stadium IV), BRCA2-Mutationen, junges Alter (unter 45 Jahren), nicht-seröser Typ, niedriger histologischer Grad, frühes Stadium, gemeinsames Auftreten mit Endometriumkrebs und niedrige CA-125-Werte. Für BRCA1 als prognostischen Faktor gibt es widersprüchliche Belege. Zu den negativen Prognosefaktoren - die auf eine schlechtere Überlebenschance hindeuten - gehören dagegen eine Ruptur der Eierstockkapsel während der Operation, ein höheres Alter (über 45 Jahre), ein muzinöser Typ, Stadium IV, ein hoher histologischer Grad, ein klarzelliger Typ, eine Oberbauchbeteiligung, hohe CA-125-Werte, das Vorhandensein von Tumorzellen im Blut und eine erhöhte Cyclooxygenase-2. ⓘ
Die Expression verschiedener mRNAs kann ebenfalls eine prognostische Bedeutung für Eierstockkrebs haben. Hohe Werte von Drosha und Dicer werden mit einer besseren Überlebensrate in Verbindung gebracht, während hohe Werte von let-7b, HIF1A, EphA1 und Poly(ADP-Ribose)-Polymerase mit einer schlechteren Überlebensrate verbunden sind. Krebserkrankungen, die positiv für WT1 sind, haben eine schlechtere Prognose, während Krebserkrankungen, die positiv für Östrogenrezeptoren sind, eine bessere Prognose haben. ⓘ
Überlebensraten
Die Fünf-Jahres-Gesamtüberlebensraten für alle Arten von Eierstockkrebs sind nachstehend nach Stadium und histologischem Grad aufgeführt:
| Stadium | Überleben ⓘ |
|---|---|
| I | 90–95% |
| II | 70–80% |
| III | 20–50% |
| IV | 1–5% |
| Histologischer Grad | Überleben ⓘ |
|---|---|
| Niedriger Grad | 88% |
| Mittlerer Grad | 58% |
| Hochgradig | 27% |
Die nachstehenden Überlebensraten für die verschiedenen Arten von Eierstockkrebs stammen von der American Cancer Society. Sie stammen vom National Cancer Institute, SEER, und basieren auf Patientinnen, bei denen zwischen 2004 und 2010 die Diagnose gestellt wurde. ⓘ
| Invasives epitheliales Ovarialkarzinom ⓘ | |
|---|---|
| Stadium | Relative Fünfjahres Überlebensrate |
| I | 90% |
| IA | 94% |
| IB | 92% |
| IC | 85% |
| II | 70% |
| IIA | 78% |
| IIB | 73% |
| III | 39% |
| IIIA | 59% |
| IIIB | 52% |
| IIIC | 39% |
| IV | 17% |
| Stromatumoren der Eierstöcke ⓘ | |
|---|---|
| Stadium | Relative Fünfjahres Überlebensrate |
| I | 95% |
| II | 78% |
| III | 65% |
| IV | 35% |
| Keimzelltumore des Eierstocks ⓘ | |
|---|---|
| Stadium | Relative Fünfjahres Überlebensrate |
| I | 98% |
| II | 94% |
| III | 87% |
| IV | 69% |
| Eileiterkarzinom ⓘ | |
|---|---|
| Stadium | Relative Fünfjahres Überlebensrate |
| I | 87% |
| II | 86% |
| III | 52% |
| IV | 40% |
| Tumore mit niedrigem Malignitätspotenzial ⓘ | |
|---|---|
| Stadium | Relative Fünfjahres Überlebensrate |
| I | 99% |
| II | 98% |
| III | 96% |
| IV | 77% |
Rezidivraten
Eierstockkrebs tritt nach der Behandlung häufig wieder auf. In einem Zeitraum von 5 Jahren treten insgesamt 20 % der Krebserkrankungen im Stadium I und II erneut auf. Die meisten Rezidive treten im Unterleib auf. Wenn ein Rezidiv bei fortgeschrittener Erkrankung auftritt, geschieht dies in der Regel innerhalb von 18 Monaten nach der Erstbehandlung (18 Monate progressionsfreies Überleben). Rezidive können behandelt werden, aber das krankheitsfreie Intervall verkürzt sich tendenziell und die Chemoresistenz nimmt mit jedem Rezidiv zu. Wenn ein Dysgerminom rezidiviert, tritt es höchstwahrscheinlich innerhalb eines Jahres nach der Diagnose auf, und andere bösartige Keimzelltumoren rezidivieren in 90 % der Fälle innerhalb von 2 Jahren. Keimzelltumoren, die keine Dysgerminome sind, haben eine schlechte Prognose, wenn sie rezidivieren, mit einer Langzeitüberlebensrate von 10 %. Tumoren mit geringem Malignitätspotenzial bilden nur selten einen Rückfall, selbst wenn eine fertilitätserhaltende Operation die Behandlung der Wahl ist. 15 % der AMP-Tumoren bilden nach einer einseitigen Operation im zuvor nicht betroffenen Eierstock einen Rückfall und lassen sich in der Regel leicht operativ behandeln. Bei weiter fortgeschrittenen Tumoren kann es bis zu 20 Jahre dauern, bis es zu einem Rückfall kommt, wenn überhaupt, und sie werden nur operativ behandelt, es sei denn, der Tumor hat seine histologischen Merkmale verändert oder ist sehr schnell gewachsen. In diesen Fällen und bei erheblichem Aszites kann auch eine Chemotherapie eingesetzt werden. Ein Rezidiv wird in der Regel durch einen Anstieg des CA-125-Wertes angezeigt und führt dann innerhalb von 2-6 Monaten zu einem symptomatischen Rückfall. Rezidivierende Geschlechtsstrangtumoren sprechen in der Regel nicht auf die Behandlung an, sind aber nicht aggressiv. ⓘ
Es handelt sich um die tödlichste gynäkologische Krebsart. ⓘ
Epidemiologie

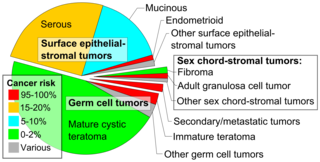
Im Jahr 2014 lag die Zahl der Neuerkrankungen in den Industrieländern bei 9,4 pro 100.000, in den Entwicklungsländern dagegen bei 5,0 pro 100.000. Im Jahr 2010 starben weltweit etwa 160 000 Menschen an Eierstockkrebs. Dies war ein Anstieg gegenüber 113.000 im Jahr 1990. Die Zahl der jährlichen Neuerkrankungen in Europa liegt bei etwa 5-15 pro 100 000 Frauen. In Europa ist die Inzidenz von Eierstockkrebs in Litauen, Lettland, Irland, der Slowakei und der Tschechischen Republik am höchsten, während sie in Portugal und Zypern am niedrigsten ist. Im Jahr 2008 lag die Fünfjahresüberlebensrate bei 44 %. Dies ist ein Anstieg seit 1977, als die Überlebensrate bei 36 % lag. ⓘ
Vereinigte Staaten

Im Jahr 2010 wurden in den Vereinigten Staaten schätzungsweise 21 880 neue Fälle diagnostiziert, und 13 850 Frauen starben an Eierstockkrebs. Etwa 1 800 der neuen Diagnosen waren Geschlechtsstrang- oder Stromatumoren. ⓘ
Im Jahr 2014 wurden jährlich über 220.000 Diagnosen von epithelialem Eierstockkrebs gestellt. Das allgemeine Lebenszeitrisiko liegt in den USA bei etwa 1,6 %. In den USA sind 1,3-1,4 % der Frauen von Eierstockkrebs betroffen und etwa 1 % stirbt daran. In den Vereinigten Staaten ist er die fünfthäufigste Krebserkrankung bei Frauen, aber die vierthäufigste Krebstodesursache. Durch diesen Rückgang ist sie die neunthäufigste Krebsart bei Frauen. ⓘ
Das Risiko, an bestimmten Arten von Eierstockkrebs zu erkranken, ist unterschiedlich hoch. Keimzelltumore und Geschlechtsstrangstromatumore sind seltener als Epitheltumore. Die Zahl der jährlichen Neuerkrankungen liegt in den USA bei 0,4 pro 100.000 Frauen bzw. 0,2 pro 100.000 Frauen. Bei jungen Menschen machen Geschlechtsstrangstromatumoren und Keimzelltumoren insgesamt 1 % der Eierstockkrebsfälle aus. Eierstockkrebs macht etwa 4 % der bei Frauen diagnostizierten Krebserkrankungen aus. ⓘ
Vereinigtes Königreich
Er ist die fünfthäufigste Krebserkrankung bei Frauen im Vereinigten Königreich (2011 wurden rund 7 100 Fälle diagnostiziert) und die fünfthäufigste Krebstodesursache bei Frauen (2012 starben rund 4 300 Menschen daran). Die Inzidenzrate in der Gesamtbevölkerung des Vereinigten Königreichs liegt bei 21,6 pro 100.000. ⓘ
Im Jahr 2014 gab es im Vereinigten Königreich jährlich etwa 7.000-7.100 Diagnosen und 4.200 Todesfälle. In einem Artikel der Times aus dem Jahr 2022 wurde die Zahl der jährlichen Neuerkrankungen in Großbritannien auf 7 500 geschätzt. Frühe Symptome werden oft mit gewöhnlichen Erkrankungen wie Blasenentzündung oder Reizdarmsyndrom verwechselt, und etwa 40 Prozent der britischen Frauen glauben fälschlicherweise, dass Gebärmutterhalskrebs bei der Vorsorgeuntersuchung entdeckt wird - ein Anstieg gegenüber 30 Prozent im Jahr 2016. Aschkenasisch-jüdische Frauen tragen fünfmal häufiger als der Rest der Bevölkerung mutierte BRCA-Allele in sich, wodurch sie ein höheres Risiko haben, an Eierstockkrebs zu erkranken. ⓘ
Ethnische Zugehörigkeit
Schwarze Frauen haben im Vergleich zu nicht-schwarzen Frauen ein doppelt so hohes Risiko für Eierstocktumore. ⓘ
Ältere Frauen
In den USA liegt die Inzidenzrate bei Frauen über 50 Jahren bei etwa 33 pro 100.000. Zwischen 1993 und 2008 ist die Eierstockkrebsrate bei Frauen der Altersgruppe 40-49 Jahre und der Altersgruppe 50-64 Jahre zurückgegangen. Eierstockkrebs wird am häufigsten nach der Menopause, im Alter zwischen 60 und 64 Jahren, diagnostiziert. Neunzig Prozent der Ovarialkarzinome treten bei Frauen über 45 Jahren auf, 80 Prozent bei Frauen über 50 Jahren. Bei älteren Frauen ist es wahrscheinlicher, dass sie an fortgeschrittenem Eierstockkrebs leiden. ⓘ
In der Schwangerschaft
Bösartige Keimzelltumore sind die Art von Eierstockkrebs, die am häufigsten während der Schwangerschaft auftritt. Sie werden in der Regel diagnostiziert, wenn bei der Untersuchung eine Masse in den Adnexen festgestellt wird (in 1-2 % aller Schwangerschaften), ein Tumor im Ultraschall zu sehen ist oder der Alpha-Fetoprotein-Spiegel der Mutter erhöht ist. Dermoidzysten und Dysgerminome sind die häufigsten Keimzelltumore in der Schwangerschaft. Bei Keimzelltumoren, die während der Schwangerschaft diagnostiziert werden, ist es unwahrscheinlich, dass sie Metastasen gebildet haben, und sie können durch eine Operation und in einigen Fällen durch eine Chemotherapie behandelt werden, die allerdings das Risiko von Geburtsschäden birgt. Dottersacktumoren und unreife Teratome wachsen besonders schnell und werden in der Regel auch während der Schwangerschaft mit einer Chemotherapie behandelt; Dysgerminome, die optimal entfernt wurden, können jedoch nach der Geburt behandelt werden. ⓘ
Andere Tiere
Ovarialtumore wurden auch bei Stuten gemeldet. Zu den berichteten Tumorarten gehören Teratome, Zystadenokarzinome und insbesondere Granulosazelltumore. ⓘ
Forschung
Vorsorgeuntersuchungen
Derzeit wird ein hysteroskopisches Screening entwickelt, bei dem Zellproben für die histologische Untersuchung entnommen werden. Dies ist vergleichbar mit dem derzeitigen Pap-Abstrich, der zur Erkennung von Gebärmutterhalskrebs verwendet wird. Im Rahmen des UK Collaborative Trial of Ovarian Cancer Screening wird ein Screening-Verfahren getestet, das CA-125-Bluttests mit transvaginalem Ultraschall kombiniert. Andere Studien deuten darauf hin, dass dieses Screening-Verfahren wirksam sein könnte. Obwohl die 2015 veröffentlichten Ergebnisse nicht schlüssig waren, gab es einige Hinweise darauf, dass das Screening langfristig Leben retten kann. Daher wurde die Studie verlängert und wird Ende 2019 endgültige Ergebnisse veröffentlichen. Ein großes Problem beim Screening ist, dass kein eindeutiges Fortschreiten der Krankheit vom Stadium I (nicht-invasiv) zum Stadium III (invasiv) zu erkennen ist und dass es möglicherweise nicht möglich ist, Krebserkrankungen zu entdecken, bevor sie das Stadium III erreichen. Ein weiteres Problem besteht darin, dass bei den Screening-Methoden tendenziell zu viele verdächtige Läsionen gefunden werden, von denen die meisten keinen Krebs darstellen, deren Bösartigkeit aber nur durch eine Operation festgestellt werden kann. Die ROCA-Methode in Kombination mit der transvaginalen Ultraschalluntersuchung wird bei Frauen mit hohem Risiko erforscht, um festzustellen, ob sie eine brauchbare Screening-Methode darstellt. Sie wird auch bei Frauen mit normalem Risiko untersucht, da sie sich in der breiten Bevölkerung als vielversprechend erwiesen hat. Außerdem wird untersucht, ob das Screening dazu beiträgt, Krebs bei Menschen mit BRCA-Mutationen früher zu erkennen. ⓘ
Prognosenforschung
Auch die Erforschung verschiedener Prognosefaktoren für Eierstockkrebs ist im Gange. Jüngste Untersuchungen zeigen, dass eine Thrombozytose eine niedrigere Überlebensrate und ein höheres Krebsstadium vorhersagt. Laufende Forschungsarbeiten befassen sich auch mit den Vorteilen einer Operation bei wiederkehrendem Eierstockkrebs. ⓘ
Immuntherapie
Obwohl es sich um ein aktives Forschungsgebiet handelt, gibt es 2018 keine guten Beweise dafür, dass eine Immuntherapie bei Eierstockkrebs wirksam ist. Studien mit dem Antikörper und VEGF-Hemmer Bevacizumab, der das Wachstum neuer Blutgefäße in der Krebserkrankung verlangsamen kann, haben jedoch vielversprechende Ergebnisse gezeigt, insbesondere in Kombination mit Pazopanib, das ebenfalls das Wachstum der Blutgefäße verlangsamt. Bevacizumab hat sich in Vorstudien bei Krebs im Stadium III und IV als besonders wirksam erwiesen und wird mit einer Ansprechrate von mindestens 15 % angegeben. Es wird insbesondere bei muzinösem Eierstockkrebs untersucht. ⓘ
Pharmakologie
mTOR-Inhibitoren waren in den 2000er und 2010er Jahren eine viel untersuchte potenzielle Behandlung, aber die Nebenwirkungen dieser Medikamente (insbesondere Hyperglykämie und Hyperlipidämie) wurden nicht gut vertragen und der Überlebensvorteil konnte nicht bestätigt werden. PI3-Kinase-Inhibitoren waren von Interesse, aber sie neigen dazu, hoch toxisch zu sein und Durchfall zu verursachen. Ein weiteres untersuchtes Medikament ist Selumetinib, ein MAPK-Inhibitor. Er verbesserte das Überleben, korrelierte aber nicht mit den in den Tumoren gefundenen Mutationen. ⓘ
Bevacizumab kann auch mit einer Platin-Chemotherapie kombiniert werden, eine Kombination, die positive vorläufige Ergebnisse in Bezug auf das PFS, aber unklare Ergebnisse hinsichtlich des Gesamtüberlebens erbracht hat. Ein Nachteil dieser Behandlungen ist das Nebenwirkungsprofil, zu dem hoher Blutdruck und Proteinurie gehören. Das Medikament kann auch Darmerkrankungen verschlimmern, was zu Fisteln oder Darmperforationen führen kann. Vintafolid, ein mit Vinblastin konjugiertes Antifolat, befindet sich ebenfalls in der klinischen Erprobung; es könnte sich als vorteilhaft erweisen, da bei vielen Ovarialkarzinomen die Folatrezeptoren überexprimiert sind. Eine weitere potenzielle Immuntherapie ist Trastuzumab, das bei Tumoren mit positiven Her2/neu-Mutationen wirksam ist. Auch andere Angiogenesehemmer werden als potenzielle Mittel zur Behandlung von Eierstockkrebs untersucht. Combretastatin und Pazopanib werden in Kombination für rezidivierenden Eierstockkrebs erforscht. Trebananib und Tasquinimod sind weitere Angiogenesehemmer, die untersucht werden. Der monoklonale Antikörper Farletuzumab wird als Adjuvans zur herkömmlichen Chemotherapie erforscht. Eine andere Art der Immuntherapie umfasst Impfstoffe, darunter TroVax. ⓘ
Eine Alternative zur BEP-Chemotherapie, die aus drei Zyklen Carboplatin und Etoposid besteht, ist ein aktuelles Forschungsthema bei malignen Keimzellerkrankungen. ⓘ
In den 2000er und 2010er Jahren wurde auch die intraperitoneale Chemotherapie untersucht, da sie die Möglichkeit bietet, den Tumoren höhere Dosen zytotoxischer Wirkstoffe zuzuführen. Vorläufige Studien mit Cisplatin und Paclitaxel haben gezeigt, dass diese Therapie nicht gut vertragen wird, aber das Überleben verbessert. Cisplatin und Paclitaxel werden beide als intraperitoneale Chemotherapeutika erforscht. Ein spezifisches Chemotherapieschema für seltene klarzellige Karzinome wird ebenfalls untersucht: Irinotecan in Kombination mit Cisplatin. ⓘ
PARP-Inhibitoren haben sich in ersten Versuchen ebenfalls als vielversprechend erwiesen, insbesondere bei Menschen mit BRCA-Genmutationen, da das BRCA-Protein mit dem PARP-Signalweg interagiert. Sie werden auch bei rezidivierendem Eierstockkrebs im Allgemeinen untersucht, wo vorläufige Studien ein längeres PFS gezeigt haben. Insbesondere hat Olaparib im Vergleich zu Doxorubicin ein längeres Überleben gezeigt, obwohl diese Behandlung noch untersucht wird. Es ist noch nicht klar, welche Biomarker das Ansprechen auf PARP-Inhibitoren vorhersagen können. Rucaparib ist ein weiterer PARP-Inhibitor, der bei BRCA-positivem und BRCA-negativem rezidiviertem fortgeschrittenem Eierstockkrebs erforscht wird. Niraparib ist ein PARP-Inhibitor, der bei BRCA-positivem rezidivierendem Eierstockkrebs getestet wird. ⓘ
Tyrosinkinase-Inhibitoren sind eine weitere Medikamentenklasse, die möglicherweise bei Eierstockkrebs eingesetzt werden kann. Angiogenese-Inhibitoren aus der Gruppe der Rezeptor-Tyrosinkinase-Inhibitoren, darunter Pazopanib, Cediranib und Nintedanib, verlängern nachweislich das progressionsfreie Überleben (PFS), ihr Nutzen für das Gesamtüberleben wurde jedoch bis 2015 noch nicht untersucht. Vorläufige Untersuchungen zeigten, dass Cediranib in Kombination mit Platinen bei rezidivierendem Eierstockkrebs die Zeit bis zum zweiten Rezidiv um 3 bis 4 Monate verlängert und das Überleben um 3 Monate verlängert. MK-1775 ist ein Tyrosinkinaseinhibitor, der in Kombination mit Paclitaxel und Carboplatin bei platinsensiblen Krebsarten mit p53-Mutationen eingesetzt wird. Nintedanib wird als mögliche Therapie in Kombination mit Cyclophosphamid für Patienten mit Rezidiven erforscht. ⓘ
Histon-Deacetylase-Inhibitoren (HDACi) sind ein weiteres Forschungsgebiet. ⓘ
Hormone und Bestrahlung
Hormontherapien sind ein aktuelles Forschungsthema bei Eierstockkrebs, insbesondere der Wert bestimmter Medikamente, die zur Behandlung von Brustkrebs eingesetzt werden. Dazu gehören Tamoxifen, Letrozol und Anastrozol. Vorläufige Studien haben gezeigt, dass Tamoxifen bei einer kleinen Anzahl von Patientinnen mit fortgeschrittenem Eierstockkrebs von Nutzen ist. Letrozol kann dazu beitragen, das Wachstum von Östrogenrezeptor-positivem Eierstockkrebs zu verlangsamen oder zu stoppen. Anastrozol wird bei postmenopausalen Patientinnen mit Östrogenrezeptor-positivem Krebs untersucht. ⓘ
Auch die Forschung zur Abschwächung der Nebenwirkungen einer Eierstockkrebsbehandlung ist im Gange. Die Strahlenfibrose, d. h. die Bildung von Narbengewebe in einem bestrahlten Bereich, kann durch eine hyperbare Sauerstofftherapie gemildert werden, doch sind die Forschungen in diesem Bereich noch nicht abgeschlossen. Die Behandlung von Eierstockkrebs kann auch zu psychiatrischen Problemen, einschließlich Depressionen, führen. Derzeit wird erforscht, wie Beratung und Psychotherapie Menschen mit Eierstockkrebs während der Behandlung helfen können. ⓘ
Entzündungen
Es gibt einige Hinweise darauf, dass Beckenentzündungen mit Eierstockkrebs in Verbindung gebracht werden können, insbesondere in nicht-westlichen Ländern. Dies könnte auf den entzündlichen Prozess zurückzuführen sein, der bei einer entzündlichen Beckenerkrankung auftritt. ⓘ
Klinische Studien
Klinische Studien werden von US-amerikanischen Regierungsorganisationen überwacht und finanziert, um Behandlungsmöglichkeiten auf ihre Sicherheit und Wirksamkeit hin zu prüfen. Dazu gehören NIH Clinical Research Trials and You (National Institutes of Health), Learn About Clinical Trials (National Cancer Institute), Search for Clinical Trials (National Cancer Institute), ClinicalTrials.gov (National Institutes of Health). Klinische Studien werden auch in Kanada durchgeführt. ⓘ
Ursachen
Als Auslöser für diese Tumorart sind bislang zahlreiche über das gesamte Genom verteilte und verschiedenartige Mutationen wie Vervielfältigungen und Verluste von Chromosomenabschnitten in den beteiligten Zellen festgestellt. Die Erkrankung tritt familiär gehäuft auf. Die beiden Gene BRCA1 und BRCA2 spielen (wie beim Brustkrebs) eine Rolle. Kinderlose und Spätgebärende haben gegenüber der Normalbevölkerung ein 2,5-fach erhöhtes Risiko, daran zu erkranken. Hormonelle Kontrazeptiva, häufige Schwangerschaften und langes Stillen sind dagegen protektive Faktoren, da die Eierstöcke durch sie „ruhiggestellt“ werden. ⓘ
Therapie
Chemotherapie
Postoperativ wird standardmäßig eine platinhaltige Chemotherapie durchgeführt. Im Frühstadium FIGO IA, Grad 1 kann hierauf verzichtet werden. Bis zum Stadium FIGO IIA wird z. B. mit Carboplatin behandelt. Im fortgeschrittenen Stadium wird mit einem Taxan, z. B. Paclitaxel, kombiniert. Im April 2019 hat das CHMP der Europäischen Arzneimittel-Agentur (EMA) eine positive Zulassungsempfehlung für den PARP-Inhibitor Olaparib (Handelsname: Lynparza, Hersteller: AstraZeneca) zur 1st-line-Therapie abgegeben. In der Regel kommt es dann auch zu einer entsprechenden Zulassung durch die Europäische Kommission. ⓘ
Antikörpertherapie
Ergänzend zur Chemotherapie ist seit Dezember 2011 der monoklonale Antikörper Bevacizumab für die Behandlung von Patientinnen mit einem fortgeschrittenen Ovarialkarzinom (FIGO-Stadium IIIB-IV) zugelassen. Der Angiogenesehemmer bindet an Wachstumsfaktoren des Tumors und verhindert somit die Neubildung von Blutgefäßen, die für die Versorgung des Tumors mit Sauerstoff und Nährstoffen zuständig sind. Es konnte eine Verlängerung des mittleren progressionsfreien Überlebens auf 14,1 Monate gegenüber 10,3 Monaten in der Kontrollgruppe nachgewiesen werden. ⓘ



