Karzinom
| Karzinom ⓘ | |
|---|---|
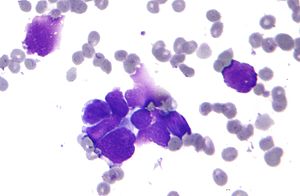 | |
| Mikroskopische Aufnahme eines primären kleinzelligen Lungenkarzinoms, einer Art von Karzinom. Die angehäuften Krebszellen bestehen hauptsächlich aus Zellkernen (violett); sie haben nur einen schmalen Rand aus Zytoplasma. Bei den umgebenden blass gefärbten, scheibenförmigen Zellen handelt es sich um rote Blutkörperchen. Zytopathologisches Präparat. Feldfärbung. | |
| Fachgebiet | Onkologie |
Ein Karzinom ist ein bösartiger Tumor, der sich aus Epithelzellen entwickelt. Genauer gesagt ist ein Karzinom ein Krebs, der in einem Gewebe beginnt, das die inneren oder äußeren Oberflächen des Körpers auskleidet, und der aus Zellen entsteht, die während der Embryogenese aus der endodermalen, mesodermalen oder ektodermalen Keimschicht stammen. ⓘ
Karzinome entstehen, wenn die DNA einer Zelle beschädigt oder verändert wird und die Zelle beginnt, unkontrolliert zu wachsen und bösartig zu werden. Der Begriff stammt aus dem Griechischen: καρκίνωμα, romanisiert: karkinoma, wörtl. Wunde, Geschwür, Krebs" (abgeleitet von karkinos für Krebs). ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| C80.9 | Bösartige Neubildung, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Ein Karzinom, lateinisch Carcinoma, auch Carcinom [kartsiˈnoːm] (von griechisch καρκίνος karkínos, „Krebs“, und karkínoma, „krebsartige Krankheit“), abgekürzt Ca, ist eine Krebserkrankung, die von Zellen im Deckgewebe von Haut oder Schleimhaut (Epithel) ausgeht. Genauer ist es eine ektodermale oder entodermale Neubildung; daraus ergibt sich eine weitere Differenzierung je nach Art des entarteten Epithels. Die meisten Karzinome gehen vom Plattenepithel (Plattenepithelkarzinom oder squamöses Karzinom) oder vom Drüsenepithel (Adenokarzinom) aus. Die primäre lymphogene Metastasierung ist besonders bei Karzinomen anzutreffen. ⓘ
Karzinome machen circa 80 % aller bösartigen Tumoren aus. Das Stadium beschreibt man mit der TNM-Klassifikation. Als Therapie kommen operative Entfernung, Strahlen- und Chemotherapie, in sehr frühen Stadien auch oberflächliche Abtragungen in Frage. Die alternative medizinische Schreibweise ist Carcinom. ⓘ
Klassifizierung
Bis zum Jahr 2004 wurde kein einfaches und umfassendes Klassifizierungssystem entwickelt und von der wissenschaftlichen Gemeinschaft akzeptiert. Traditionell werden bösartige Erkrankungen jedoch im Allgemeinen anhand einer Kombination von Kriterien in verschiedene Typen eingeteilt, darunter: Der Zelltyp, von dem sie ausgehen; insbesondere:
- Epithelzellen ⇨ Karzinom
- Nicht-hämatopoetische mesenchymale Zellen ⇨ Sarkom
- Hämatopoetische Zellen
- Aus dem Knochenmark stammende Zellen, die normalerweise in der Blutbahn heranreifen ⇨ Leukämie
- Aus dem Knochenmark stammende Zellen, die normalerweise im lymphatischen System heranreifen ⇨ Lymphom
- Keimzellen ⇨ Germinom ⓘ
Weitere Kriterien, die eine Rolle spielen, sind:
- Das Ausmaß, in dem die bösartigen Zellen ihren normalen, nicht umgewandelten Gegenstücken ähneln
- das Erscheinungsbild des lokalen Gewebes und der stromalen Architektur
- der anatomische Ort, an dem der Tumor entsteht
- Genetische, epigenetische und molekulare Merkmale ⓘ
Histologische Typen
- Adenokarzinom
- (adeno = Drüse) Bezeichnet ein Karzinom mit mikroskopischer, drüsenbezogener Gewebezytologie, Gewebearchitektur und/oder drüsenbezogenen Molekularprodukten, z. B. Muzin.
- Plattenepithelkarzinom
- Bezieht sich auf ein Karzinom mit beobachtbaren Merkmalen und Eigenschaften, die auf eine Plattenepithel-Differenzierung hinweisen (interzelluläre Brücken, Keratinisierung, Plattenepithelperlen).
- Adenosquamöses Karzinom
- Bezieht sich auf einen gemischten Tumor, der sowohl Adenokarzinom als auch Plattenepithelkarzinom enthält, wobei jede dieser Zellarten mindestens 10 % des Tumorvolumens ausmacht.
- Anaplastisches Karzinom
- Bezeichnet eine heterogene Gruppe von hochgradigen Karzinomen, deren Zellen keine eindeutigen histologischen oder zytologischen Anzeichen für eines der spezifischeren differenzierten Neoplasmen aufweisen. Diese Tumore werden als anaplastische oder undifferenzierte Karzinome bezeichnet.
- Großzelliges Karzinom
- Besteht aus großen, monotonen, rundlichen oder polygonalen Zellen mit reichlich Zytoplasma.
- Kleinzelliges Karzinom
- Die Zellen sind in der Regel rund und haben einen Durchmesser, der weniger als das Dreifache des Durchmessers eines ruhenden Lymphozyten beträgt, und weisen nur wenig Zytoplasma auf. Gelegentlich können kleinzellige Malignome selbst erhebliche Anteile leicht polygonaler und/oder spindelförmiger Zellen aufweisen. ⓘ
Es gibt eine große Anzahl seltener Subtypen des anaplastischen, undifferenzierten Karzinoms. Zu den bekannteren gehören die Läsionen mit pseudosarkomatösen Komponenten: das Spindelzellkarzinom (mit länglichen Zellen, die Bindegewebskrebs ähneln), das Riesenzellkarzinom (mit riesigen, bizarren, vielkernigen Zellen) und das sarkomatoide Karzinom (eine Mischung aus Spindel- und Riesenzellkarzinom). Das pleomorphe Karzinom enthält spindelzellige und/oder riesenzellige Bestandteile sowie mindestens 10 % Zellen, die für höher differenzierte Typen (d. h. Adenokarzinom und/oder Plattenepithelkarzinom) charakteristisch sind. Sehr selten können die Tumoren einzelne Komponenten enthalten, die sowohl einem Karzinom als auch einem echten Sarkom ähneln, darunter das Karzinosarkom und das pulmonale Blastom. Die häufigste Ursache für ein großzelliges Karzinom ist das Zigarettenrauchen in der Vorgeschichte. ⓘ
Karzinom mit unbekanntem Primärherd
Der Begriff Karzinom umfasst auch bösartige Tumoren, die sich aus transformierten Zellen zusammensetzen, deren Ursprung oder Entwicklungslinie unbekannt ist (siehe Krebs unbekannter primärer Herkunft; CUP), die jedoch bestimmte molekulare, zelluläre und histologische Merkmale aufweisen, die für Epithelzellen typisch sind. Dazu kann die Produktion einer oder mehrerer Formen von Cytokeratin oder anderen Intermediärfilamenten, interzellulären Brückenstrukturen, Keratinperlen und/oder gewebearchitektonischen Motiven wie Stratifikation oder Pseudostratifikation gehören. ⓘ
ICD-10-Code
- (8010-8045) Epitheliale Neoplasmen, NOS
- (8050-8080) Plattenepithelneubildungen
- (M8070/3) Plattenepithelkarzinom, NOS
- (8090-8110) Neoplasmen der Basalzellen
- (M8090/3) Basalzellkarzinom, NOS
- (8120-8130) Übergangszellkarzinome
- (8140-8380) Adenokarzinome
- (8390-8420) Neoplasmen der Adnexe und Hautanhangsgebilde
- (8430-8439) Mukoepidermoid-Neubildungen
- (8440-8490) Zystische, muzinöse und seröse Neoplasmen
- (8500-8540) Duktale, lobuläre und medulläre Neoplasmen
- (8550-8559) Akinäre Zellneubildungen
- (8560-8580) Komplexe epitheliale Neoplasmen ⓘ
Karzinom in situ
Der Begriff Carcinoma in situ (oder CIS) bezeichnet Zellen, die deutlich abnormal sind, aber keinen Krebs darstellen. Es handelt sich also nicht um typische Karzinome. ⓘ
Pathogenese
Krebs entsteht, wenn eine einzelne Vorläuferzelle Mutationen und andere Veränderungen in der DNA, den Histonen und anderen biochemischen Verbindungen, aus denen das Genom der Zelle besteht, anhäuft. Das Zellgenom steuert die Struktur der biochemischen Komponenten der Zelle, die biochemischen Reaktionen innerhalb der Zelle und die biologischen Interaktionen dieser Zelle mit anderen Zellen. Bestimmte Kombinationen von Mutationen in einer bestimmten Vorläuferzelle führen schließlich dazu, dass diese Zelle (auch Krebsstammzelle genannt) eine Reihe abnormaler, bösartiger zellulärer Eigenschaften aufweist, die in ihrer Gesamtheit als charakteristisch für Krebs gelten, darunter
- die Fähigkeit, sich unaufhörlich zu teilen und eine exponentiell (oder nahezu exponentiell) steigende Anzahl neuer bösartiger Krebs-"Tochterzellen" zu produzieren (unkontrollierte Mitose);
- die Fähigkeit, normale Körperoberflächen und Barrieren zu durchdringen und sich in oder durch nahe gelegene Körperstrukturen und Gewebe zu bohren (lokale Invasivität);
- die Fähigkeit, sich an anderen Stellen im Körper auszubreiten (Metastasierung), indem sie in die Lymphgefäße (regionale Metastasierung) und/oder die Blutgefäße (Fernmetastasierung) eindringen oder diese durchdringen. ⓘ
Wenn dieser Prozess des kontinuierlichen Wachstums, der lokalen Invasion und der regionalen und fernen Metastasierung nicht durch eine Kombination aus Stimulation der Immunabwehr und medizinischen Behandlungsmaßnahmen gestoppt wird, führt dies dazu, dass die Belastung des Wirts durch Tumorzellen im gesamten Körper kontinuierlich zunimmt. Schließlich beeinträchtigt die Tumorlast zunehmend die normalen biochemischen Funktionen der Wirtsorgane, was schließlich zum Tod führt. ⓘ
Das Karzinom ist nur eine Form von Krebs - eine, die aus Zellen besteht, die das zytologische Aussehen, die histologische Architektur oder die molekularen Merkmale von Epithelzellen entwickelt haben. Eine Progenitor-Karzinom-Stammzelle kann aus einer Reihe von onkogenen Mutationskombinationen in einer totipotenten Zelle, einer multipotenten Zelle oder einer reifen differenzierten Zelle entstehen. ⓘ
Invasion und Metastasierung
Ein bösartiger Tumor zeichnet sich dadurch aus, dass er dazu neigt, in lokale und benachbarte Strukturen einzudringen und diese zu infiltrieren und sich schließlich vom Ursprungsort auf nicht benachbarte regionale und entfernte Stellen im Körper auszubreiten. Wenn das Tumorwachstum und die Metastasierung nicht gestoppt werden, führt dies schließlich zu einer so großen Tumorlast, dass der Wirt erliegt. Karzinome metastasieren sowohl über die Lymphknoten als auch über das Blut. ⓘ
Mutation
Die Sequenzierung des gesamten Genoms hat die Mutationshäufigkeit für das gesamte menschliche Genom ermittelt. Die Mutationshäufigkeit im gesamten menschlichen Genom zwischen den Generationen (von Eltern zu Kindern) beträgt etwa 70 neue Mutationen pro Generation. ⓘ
Karzinome haben jedoch eine viel höhere Mutationsfrequenz. Die jeweilige Häufigkeit hängt vom Gewebetyp ab, davon, ob ein DNA-Reparaturdefekt vorliegt, und von der Exposition gegenüber DNA-schädigenden Stoffen wie z. B. Bestandteilen des Tabakrauchs. Tuna und Amos haben die Mutationshäufigkeiten pro Megabase (Mb) in einigen Karzinomen wie in der Tabelle dargestellt zusammengefasst (zusammen mit den angegebenen Häufigkeiten von Mutationen pro Genom). ⓘ
| Zelltyp | Mutationshäufigkeit | |
|---|---|---|
| Pro Megabasis | Pro diploidem Genom | |
| Keimbahn | 0.023 | 70 |
| Prostatakrebs | 0.9 | 5,400 |
| Kolorektales Karzinom | ~5 | ~30,000 |
| Mikrosatellitenstabiler (MSS) Dickdarmkrebs | 2.8 | 16,800 |
| Mikrosatelliteninstabiler (MSI) Dickdarmkrebs (Mismatch-Reparaturdefekt) | 47 | 282,000 |
| Hepatozelluläres Karzinom | 4.2 | 25,200 |
| Brustkrebs | 1.18–1.66 | 7,080–9,960 |
| Lungenkrebs | 17.7 | 106,200 |
| Kleinzelliger Lungenkrebs | 7.4 | 44,400 |
| Nicht-kleinzelliger Lungenkrebs (Raucher) | 10.5 | 63,000 |
| Nicht-kleinzelliges Lungenkarzinom (Nie-Raucher) | 0.6 | 3,600 |
| Adenokarzinom der Lunge (Raucher) | 9.8 | 58,500 |
| Adenokarzinom der Lunge (Nicht-Raucher) | 1.7 | 10,200 |
Ursache der Mutationen
Die wahrscheinlich wichtigste Ursache für Mutationen bei Karzinomen sind DNA-Schäden. Im Falle von Lungenkrebs beispielsweise werden DNA-Schäden durch Stoffe im exogenen genotoxischen Tabakrauch verursacht (z. B. Acrolein, Formaldehyd, Acrylnitril, 1,3-Butadien, Acetaldehyd, Ethylenoxid und Isopren). Endogene (stoffwechselbedingte) DNA-Schäden sind ebenfalls sehr häufig und treten im Durchschnitt mehr als 60.000 Mal pro Tag im Genom menschlicher Zellen auf. Extern und endogen verursachte Schäden können durch fehlerhafte Translesionssynthese oder fehlerhafte DNA-Reparatur (z. B. durch nicht-homologes Endjoining) in Mutationen umgewandelt werden. ⓘ
Hohe Häufigkeit
Die hohe Häufigkeit von Mutationen im Gesamtgenom von Karzinomen deutet darauf hin, dass eine frühe krebserregende Veränderung häufig auf einen Mangel in der DNA-Reparatur zurückzuführen ist. So ist beispielsweise die Mutationsrate in Zellen, die einen Defekt in der DNA-Mismatch-Reparatur aufweisen, deutlich erhöht (manchmal um das 100-fache). ⓘ
Ein Mangel in der DNA-Reparatur selbst kann dazu führen, dass sich DNA-Schäden anhäufen, und die fehleranfällige Translesionssynthese an einigen dieser Schäden vorbei kann zu Mutationen führen. Darüber hinaus kann eine fehlerhafte Reparatur dieser akkumulierten DNA-Schäden zu epigenetischen Veränderungen oder Epimutationen führen. Während eine Mutation oder Epimutation in einem DNA-Reparaturgen selbst keinen Selektionsvorteil bringt, kann ein solcher Reparaturdefekt als Passagier in einer Zelle mitgeführt werden, wenn die Zelle eine zusätzliche Mutation/Epimutation erwirbt, die einen Proliferationsvorteil bietet. Solche Zellen, die sowohl einen Proliferationsvorteil als auch einen oder mehrere DNA-Reparaturdefekte aufweisen (die eine sehr hohe Mutationsrate verursachen), sind wahrscheinlich die Ursache für die hohe Häufigkeit von Gesamtgenommutationen in Karzinomen. ⓘ
DNA-Reparatur
In somatischen Zellen entstehen Defizite bei der DNA-Reparatur manchmal durch Mutationen in DNA-Reparaturgenen, viel häufiger jedoch durch epigenetische Verringerungen der Expression von DNA-Reparaturgenen. So wiesen in einer Sequenz von 113 kolorektalen Karzinomen nur vier somatische Missense-Mutationen im DNA-Reparaturgen MGMT auf, während die Mehrheit dieser Karzinome eine reduzierte MGMT-Proteinexpression aufgrund einer Methylierung der MGMT-Promotorregion hatte. ⓘ
Diagnose
Karzinome können durch Biopsie, einschließlich Feinnadelaspiration (FNA), Kernbiopsie oder subtotale Entfernung eines einzelnen Knotens, definitiv diagnostiziert werden. Eine mikroskopische Untersuchung durch einen Pathologen ist dann erforderlich, um molekulare, zelluläre oder gewebebauliche Merkmale der Epithelzellen zu identifizieren. ⓘ
Arten
- Oral: Die meisten oralen Karzinome sind Plattenepithelkarzinome
- Lunge: Karzinome machen >98 % aller Lungenkrebsfälle aus.
- Brust: Bei fast allen Brustkrebsarten handelt es sich um duktale Karzinome.
- Prostata: Die häufigste Form des Prostatakarzinoms ist das Adenokarzinom.
- Kolon und Rektum: Fast alle bösartigen Erkrankungen des Kolons und Rektums sind entweder Adenokarzinome oder Plattenepithelkarzinome.
- Bauchspeicheldrüse: Das Bauchspeicheldrüsenkarzinom ist fast immer ein Adenokarzinom und hat eine hohe Letalität.
- Eierstöcke: Eine der tödlichsten Formen aufgrund der späten Entdeckung. ⓘ
Einige Karzinome werden nach ihrer oder der vermuteten Ursprungszelle benannt (z. B. Leberzellkarzinom, Nierenzellkarzinom). ⓘ
Stadieneinteilung
Bei der Stadieneinteilung von Karzinomen werden die physische/klinische Untersuchung, die pathologische Untersuchung von Zellen und Geweben, chirurgische Techniken, Labortests und bildgebende Untersuchungen in einer logischen Weise kombiniert, um Informationen über die Größe des Neoplasmas und das Ausmaß seiner Invasion und Metastasierung zu erhalten. ⓘ
Karzinome werden in der Regel mit römischen Ziffern eingeteilt. In den meisten Klassifikationen werden Karzinome im Stadium I und II bestätigt, wenn sich herausstellt, dass der Tumor klein ist und/oder sich nur auf lokale Strukturen ausgebreitet hat. Karzinome im Stadium III haben sich in der Regel auf regionale Lymphknoten, Gewebe und/oder Organstrukturen ausgebreitet, während Tumore im Stadium IV bereits über das Blut Metastasen in entfernte Stellen, Gewebe oder Organe gebildet haben. ⓘ
Bei einigen Arten von Karzinomen wurde das Stadium 0 verwendet, um Karzinome in situ und okkulte Karzinome zu beschreiben, die nur durch eine Untersuchung des Sputums auf bösartige Zellen (bei Lungenkarzinomen) nachweisbar sind. ⓘ
In neueren Stadieneinteilungssystemen werden immer häufiger Unterstadien (a, b, c) verwendet, um Patientengruppen mit ähnlicher Prognose oder ähnlichen Behandlungsmöglichkeiten besser zu definieren. ⓘ
Das Karzinomstadium ist die Variable, die am konsequentesten und engsten mit der Prognose des Malignoms verknüpft ist. ⓘ
Die Kriterien für die Stadieneinteilung können sich je nach Organsystem, in dem der Tumor auftritt, drastisch unterscheiden. Das Staging-System für Dickdarm- und Blasenkrebs basiert beispielsweise auf der Tiefe der Invasion, das Staging von Brustkrebs hängt eher von der Größe des Tumors ab, und beim Nierenkarzinom basiert das Staging sowohl auf der Größe des Tumors als auch auf der Tiefe der Tumorinvasion in den Nierensinus. Für das Lungenkarzinom gibt es ein komplizierteres Staging-System, bei dem eine Reihe von Größen- und anatomischen Variablen berücksichtigt werden. ⓘ
Am häufigsten werden die TNM-Systeme von UICC/AJCC verwendet. Bei einigen häufigen Tumoren werden jedoch auch weiterhin die klassischen Staging-Methoden (z. B. die Dukes-Klassifikation für Dickdarmkrebs) verwendet. ⓘ
Einstufung
Das Grading von Karzinomen bezieht sich auf die Anwendung von Kriterien, mit denen der Grad der Zell- und Gewebereife der transformierten Zellen im Vergleich zum Aussehen des normalen Stammepithelgewebes, aus dem das Karzinom hervorgegangen ist, semiquantifiziert werden soll. ⓘ
Die Einstufung eines Karzinoms erfolgt meist, nachdem ein behandelnder Arzt und/oder Chirurg eine Probe des vermuteten Tumorgewebes durch chirurgische Resektion, Nadel- oder chirurgische Biopsie, direktes Waschen oder Bürsten des Tumorgewebes, Sputumzytopathologie usw. entnommen hat. Ein Pathologe untersucht dann den Tumor und sein Stroma, eventuell mit Hilfe von Färbungen, Immunhistochemie, Durchflusszytometrie oder anderen Methoden. Schließlich klassifiziert der Pathologe den Tumor halbquantitativ in einen von drei oder vier Graden, darunter:
- Grad 1 oder gut differenziert: Es besteht eine große oder sehr große Ähnlichkeit mit dem normalen Ausgangsgewebe, und die Tumorzellen lassen sich leicht identifizieren und als eine bestimmte bösartige histologische Einheit klassifizieren;
- Grad 2 oder mäßig differenziert: Es besteht eine beträchtliche Ähnlichkeit mit den Ursprungszellen und -geweben, aber Abnormitäten sind häufig zu sehen und die komplexeren Merkmale sind nicht besonders gut ausgeprägt;
- Grad 3 oder schwach differenziert: Das bösartige Gewebe weist nur sehr geringe Ähnlichkeit mit dem normalen Ausgangsgewebe auf, Anomalien sind offensichtlich, und die komplexeren architektonischen Merkmale sind in der Regel rudimentär oder primitiv;
- Grad 4 oder undifferenziertes Karzinom: Diese Karzinome weisen keine nennenswerte Ähnlichkeit mit den entsprechenden Ursprungszellen und -geweben auf, ohne sichtbare Bildung von Drüsen, Kanälen, Brücken, geschichteten Schichten, Keratinperlen oder anderen bemerkenswerten Merkmalen, die auf ein höher differenziertes Neoplasma hindeuten. ⓘ
Obwohl es für einige Tumorarten und Herkunftsorte eine eindeutige und überzeugende statistische Korrelation zwischen Karzinomgrad und Tumorprognose gibt, kann die Stärke dieses Zusammenhangs sehr unterschiedlich sein. Allgemein lässt sich jedoch sagen, dass die Prognose umso schlechter ist, je höher der Grad der Läsion ist. ⓘ
Epidemiologie
Während Krebs im Allgemeinen als Alterskrankheit angesehen wird, können auch Kinder an Krebs erkranken. Im Gegensatz zu Erwachsenen sind Karzinome bei Kindern außergewöhnlich selten. Weniger als 1 % der Karzinomdiagnosen werden bei Kindern gestellt. ⓘ
Die beiden größten Risikofaktoren für das Ovarialkarzinom sind das Alter und die Familienanamnese. ⓘ
Beispiele
- Analkarzinom
- Bronchialkarzinom
- Endometriumkarzinom (Gebärmutterschleimhaut; auch als Korpuskarzinom bezeichnet)
- Gallenblasenkarzinom
- Leberkrebs (Hepatozelluläres Karzinom (HCC))
- Hodenkrebs (Hodenkarzinom)
- Kolorektales Karzinom
- Kehlkopfkrebs (Larynxkarzinom)
- Speiseröhrenkrebs
- Magenkarzinom
- Brustkrebs (Mammakarzinom)
- Nierenkrebs (Nierenkarzinom)
- Ovarialkarzinom
- Pankreastumor
- Pharynxkarzinom
- Prostatakrebs (Prostatakarzinom)
- Schilddrüsenkrebs (Schilddrüsenkarzinom)
- Zervixkarzinom ⓘ