Magenkarzinom
| Magenkrebs ⓘ | |
|---|---|
| Andere Namen | Magenkrebs |
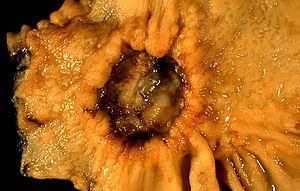 | |
| Ein Magengeschwür, das bei einer Biopsie als Krebs diagnostiziert und chirurgisch entfernt wurde | |
| Fachgebiet | Gastroenterologie Onkologie |
| Symptome | Früh: Sodbrennen, Blähungen, Oberbauchschmerzen, Übelkeit, Aufstoßen, Appetitlosigkeit. Später: Gewichtsverlust, Gelbfärbung der Haut und des Weißen der Augen, Erbrechen von Blut, Schluckbeschwerden, Blut im Stuhl |
| Gewöhnlicher Ausbruch | Über Jahre hinweg |
| Arten | Magenkarzinom, Lymphom, mesenchymaler Tumor |
| Auslöser | Helicobacter pylori, Genetik |
| Risikofaktoren | Rauchen, diätetische Faktoren wie eingelegtes Gemüse, Übergewicht |
| Diagnostische Methode | Biopsie bei der Endoskopie |
| Vorbeugung | Mediterrane Ernährung, Raucherentwöhnung |
| Behandlung | Operation, Chemotherapie, Strahlentherapie, gezielte Therapie |
| Prognose | Fünf-Jahres-Überlebensrate: < 10% (fortgeschrittene Fälle), 32 % (USA), 71 % (Japan) |
| Häufigkeit | 3,5 Millionen (2015) |
| Todesfälle | 783,000 (2018) |
Magenkrebs, auch bekannt als Magenkarzinom, ist eine Krebserkrankung, die sich aus der Magenschleimhaut entwickelt. Bei den meisten Fällen von Magenkrebs handelt es sich um Magenkarzinome, die in eine Reihe von Subtypen unterteilt werden können, darunter Magenadenokarzinome. Auch Lymphome und mesenchymale Tumore können sich im Magen entwickeln. Zu den frühen Symptomen gehören Sodbrennen, Oberbauchschmerzen, Übelkeit und Appetitlosigkeit. Spätere Anzeichen und Symptome können u. a. Gewichtsverlust, Gelbfärbung der Haut und des Weißen der Augen, Erbrechen, Schluckbeschwerden und Blut im Stuhlgang sein. Der Krebs kann sich vom Magen aus auf andere Körperteile ausbreiten, insbesondere auf die Leber, die Lunge, die Knochen, die Bauchhöhle und die Lymphknoten. ⓘ
Die häufigste Ursache ist eine Infektion mit dem Bakterium Helicobacter pylori, das für mehr als 60 % der Fälle verantwortlich ist. Bestimmte Arten von H. pylori haben ein höheres Risiko als andere. Weitere Risikofaktoren sind Rauchen, Ernährungsgewohnheiten wie eingelegtes Gemüse und Fettleibigkeit. Etwa 10 % der Fälle treten familiär gehäuft auf, und zwischen 1 % und 3 % der Fälle sind auf genetische Syndrome zurückzuführen, die von den Eltern vererbt werden, wie z. B. der vererbbare diffuse Magenkrebs. In den meisten Fällen entwickelt sich der Magenkrebs über Jahre hinweg in mehreren Stadien. Die Diagnose wird in der Regel durch eine Biopsie während einer Endoskopie gestellt. Anschließend werden bildgebende Verfahren eingesetzt, um festzustellen, ob sich die Krankheit auf andere Teile des Körpers ausgebreitet hat. In Japan und Südkorea, zwei Ländern mit einer hohen Erkrankungsrate, wird ein Screening auf Magenkrebs durchgeführt. ⓘ
Eine mediterrane Ernährung senkt das Risiko für Magenkrebs, ebenso wie der Verzicht auf das Rauchen. Es gibt erste Hinweise darauf, dass die Behandlung von H. pylori das künftige Risiko senkt. Wenn Magenkrebs frühzeitig behandelt wird, kann er geheilt werden. Die Behandlungen können eine Kombination aus Operation, Chemotherapie, Strahlentherapie und gezielter Therapie umfassen. Bei bestimmten Subtypen von Magenkrebs ist auch eine Krebsimmuntherapie eine Option. Bei einer späten Behandlung kann eine palliative Behandlung angezeigt sein. Einige Arten von Lymphomen können durch die Beseitigung von H. pylori geheilt werden. Die Ergebnisse sind oft schlecht, die Fünfjahresüberlebensrate für fortgeschrittene Fälle beträgt in der westlichen Welt weniger als 10 %. Dies ist vor allem darauf zurückzuführen, dass die meisten Betroffenen mit einer fortgeschrittenen Erkrankung kommen. In den Vereinigten Staaten liegt die Fünfjahresüberlebensrate bei 31,5 %, während sie in Südkorea bei über 65 % und in Japan bei über 70 % liegt, was zum Teil auf Screening-Maßnahmen zurückzuführen ist. ⓘ
Weltweit ist Magenkrebs die fünfthäufigste Krebsart und die dritthäufigste Krebstodesursache (7 % der Fälle und 9 % der Todesfälle). Im Jahr 2018 ist er bei 1,03 Millionen Menschen neu aufgetreten und hat 783.000 Todesfälle verursacht. Vor den 1930er Jahren war er in weiten Teilen der Welt, einschließlich der meisten westlichen Industrieländer, die häufigste Krebstodesursache. Seitdem ist die Sterblichkeitsrate in vielen Regionen der Welt zurückgegangen. Man geht davon aus, dass dies auf den Verzehr von weniger gesalzenen und eingelegten Lebensmitteln infolge der Entwicklung der Kühlung als Methode zur Lagerung von Lebensmitteln zurückzuführen ist. Magenkrebs tritt am häufigsten in Ostasien und Osteuropa auf. Er tritt bei Männern doppelt so häufig auf wie bei Frauen. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| C16.- | Magenkarzinom |
| ICD-10 online (WHO-Version 2019) | |


Ein Magenkarzinom (Synonym: Magenkrebs) ist eine Krebserkrankung des Magens. Im Gegensatz zu den meisten anderen Krebsarten hat die Anzahl an Neuerkrankungen pro Jahr in den westlichen Ländern seit Jahren kontinuierlich abgenommen. Hauptrisikofaktoren für die Entstehung eines Magenkarzinoms sind eine nitrosaminreiche Ernährung sowie eine chronische Infektion mit Helicobacter pylori. Zentrale Bedeutung in der Diagnostik des Magenkrebses hat die Magenspiegelung (Gastroskopie). Mittels kleiner Gewebeproben, die im Rahmen einer solchen Untersuchung gewonnen werden, kann die Diagnose genau vom Pathologen gestellt werden. Beim Fehlen von Metastasen (Tochtergeschwulsten) ist die Therapie der Wahl die operative Entfernung des Magens (Gastrektomie), verknüpft mit einer Entfernung der lokalen Lymphknoten (Lymphadenektomie). In Abhängigkeit vom Tumorstadium erfolgt bei lokalem Tumorstadium eventuell zusätzlich eine Chemotherapie vor der Operation, eine sogenannte neoadjuvante Chemotherapie, oder im Anschluss an die Operation (adjuvante Chemotherapie). Bei Vorliegen von Fernmetastasen ist keine heilende Therapie mehr möglich. In diesem Stadium wird bei Hinweis auf Behinderung der Magenpassage eine Umgehungsoperation (palliative Gastrektomie) durchgeführt. Fehlt diese Symptomatik, so wird in Abhängigkeit vom Allgemeinzustand des Patienten eine palliative Chemotherapie durchgeführt. ⓘ
Anzeichen und Symptome
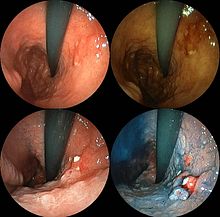
Magenkrebs ist häufig entweder asymptomatisch (ohne erkennbare Symptome) oder verursacht im Frühstadium nur unspezifische Symptome (die auch bei anderen verwandten oder nicht verwandten Erkrankungen auftreten können). Wenn die Symptome erkannt werden, hat der Krebs oft schon ein fortgeschrittenes Stadium erreicht (siehe unten) und kann metastasiert haben (sich auf andere, möglicherweise weit entfernte Teile des Körpers ausgebreitet haben), was einer der Hauptgründe für seine relativ schlechte Prognose ist. Magenkrebs kann die folgenden Anzeichen und Symptome hervorrufen: Ungeklärte Übelkeit, Erbrechen, Durchfall und Verstopfung. Die Patienten können auch einen unerklärlichen Gewichtsverlust erleiden. ⓘ
Im Frühstadium kann der Krebs mit Verdauungsstörungen oder einem brennenden Gefühl (Sodbrennen) einhergehen. Allerdings ist weniger als eine von 50 Personen, die aufgrund von Verdauungsstörungen zur Endoskopie überwiesen werden, an Krebs erkrankt. Bauchbeschwerden und Appetitlosigkeit, insbesondere auf Fleisch, können auftreten. ⓘ
Magenkrebs, der sich vergrößert hat und in normales Gewebe eingedrungen ist, kann Schwäche, Müdigkeit, Aufblähung des Magens nach den Mahlzeiten, Bauchschmerzen im Oberbauch, Übelkeit und gelegentlich Erbrechen verursachen. Eine weitere Vergrößerung kann zu Gewichtsverlust oder Blutungen mit Erbrechen von Blut oder Blut im Stuhl führen, wobei letzteres als schwarze Verfärbung (Meläna) auftritt und manchmal zu Anämie führt. Dysphagie deutet auf einen Tumor in der Kardia oder eine Ausdehnung des Magentumors in die Speiseröhre hin. ⓘ
Dies können Symptome für andere Probleme sein, wie z. B. ein Magenvirus, ein Magengeschwür oder eine tropische Sprue. ⓘ
Seltene mit einem Magenkarzinom vergesellschaftete Symptome sind Thrombosen oberflächlicher Venen, hämolytische Anämien mit Mikroangiopathie und Acanthosis nigricans. ⓘ
Teilweise werden Metastasen im Eierstock, auch Krukenberg-Tumor genannt, vor dem eigentlichen Magentumor entdeckt. ⓘ
Risikofaktoren
Magenkrebs kann als Folge vieler Faktoren auftreten. Er tritt bei Männern doppelt so häufig auf wie bei Frauen. Östrogen kann Frauen vor der Entwicklung dieser Krebsart schützen. ⓘ
Infektionen
Eine Infektion mit Helicobacter pylori ist ein wesentlicher Risikofaktor für 65-80 % der Magenkrebserkrankungen, aber nur 2 % der Menschen mit einer H. pylori-Infektion entwickeln Magenkrebs. Der Mechanismus, durch den H. pylori Magenkrebs hervorruft, beinhaltet möglicherweise eine chronische Entzündung oder die Wirkung von H. pylori-Virulenzfaktoren wie CagA. Es wurde geschätzt, dass das Epstein-Barr-Virus für 84 000 Fälle pro Jahr verantwortlich ist. Auch AIDS wird mit einem erhöhten Risiko in Verbindung gebracht. ⓘ
Rauchen
Rauchen erhöht das Risiko, an Magenkrebs zu erkranken, erheblich, und zwar von 40 % bei derzeitigen Rauchern bis zu 82 % bei starken Rauchern. Durch Rauchen verursachte Magenkrebserkrankungen treten meist im oberen Teil des Magens in der Nähe der Speiseröhre auf. Einige Studien zeigen auch ein erhöhtes Risiko bei Alkoholkonsum. ⓘ
Ernährung

Ernährungsbedingte Faktoren sind keine erwiesenen Ursachen, und der Zusammenhang zwischen Magenkrebs und verschiedenen Nahrungsmitteln und Getränken ist schwach. Einige Lebensmittel, darunter geräucherte Lebensmittel, Salz und salzhaltige Lebensmittel, rotes Fleisch, verarbeitetes Fleisch, eingelegtes Gemüse und Brackwasser, werden mit einem höheren Magenkrebsrisiko in Verbindung gebracht. Nitrate und Nitrite in gepökeltem Fleisch können von bestimmten Bakterien, einschließlich H. pylori, in Verbindungen umgewandelt werden, die bei Tieren nachweislich Magenkrebs verursachen. ⓘ
Der Verzehr von frischem Obst und Gemüse, von Zitrusfrüchten und von Antioxidantien wird mit einem geringeren Magenkrebsrisiko in Verbindung gebracht. Eine mediterrane Ernährung wird mit einem geringeren Magenkrebsrisiko in Verbindung gebracht, ebenso wie die regelmäßige Einnahme von Aspirin. ⓘ
Fettleibigkeit ist ein körperlicher Risikofaktor, der nachweislich das Risiko für ein Magenadenokarzinom erhöht, indem er zur Entwicklung der gastroösophagealen Refluxkrankheit (GERD) beiträgt. Der genaue Mechanismus, durch den Fettleibigkeit GERD verursacht, ist nicht vollständig bekannt. Studien stellen die Hypothese auf, dass ein erhöhtes Nahrungsfett, das zu einem erhöhten Druck auf den Magen und den unteren Ösophagussphinkter führt, aufgrund von überschüssigem Fettgewebe eine Rolle spielen könnte, doch wurden bisher keine statistisch signifikanten Daten erhoben. Es wurde jedoch festgestellt, dass das Risiko eines Adenokarzinoms der Magenkardia bei Vorliegen einer GERD bei fettleibigen Personen um mehr als das Zweifache ansteigt. Es besteht eine Korrelation zwischen Jodmangel und Magenkrebs. ⓘ
Genetik
Etwa 10 % der Fälle treten familiär gehäuft auf, und zwischen 1 und 3 % der Fälle sind auf genetische Syndrome zurückzuführen, die von den Eltern vererbt werden, wie z. B. das hereditäre diffuse Magenkarzinom. ⓘ
Ein genetischer Risikofaktor für Magenkrebs ist ein Gendefekt des CDH1-Gens, der als hereditärer diffuser Magenkrebs (HDGC) bezeichnet wird. Das CDH1-Gen, das für E-Cadherin kodiert, liegt auf dem 16. Chromosom. Chromosom. Wenn das Gen eine bestimmte Mutation aufweist, entwickelt sich durch einen noch nicht vollständig verstandenen Mechanismus Magenkrebs. Diese Mutation gilt als autosomal dominant, was bedeutet, dass die Hälfte der Kinder eines Genträgers wahrscheinlich die gleiche Mutation aufweisen wird. Die Diagnose des hereditären diffusen Magenkrebses wird in der Regel gestellt, wenn mindestens zwei Fälle bei einem Familienmitglied, z. B. einem Eltern- oder Großelternteil, diagnostiziert werden, wobei mindestens ein Fall vor dem 50. Die Diagnose kann auch gestellt werden, wenn mindestens drei Fälle in der Familie auftreten, wobei das Alter nicht berücksichtigt wird. ⓘ
Das Internationale Krebsgenom-Konsortium ist federführend bei den Bemühungen, genomische Veränderungen zu identifizieren, die bei Magenkrebs eine Rolle spielen. Ein sehr kleiner Prozentsatz von Magenkrebs des diffusen Typs (siehe Histopathologie unten) entsteht durch eine vererbte Anomalie im CDH1-Gen. Für Risikofamilien stehen Gentests und Behandlungsmöglichkeiten zur Verfügung. ⓘ
Andere
Weitere Risikofaktoren sind Diabetes, perniziöse Anämie, chronisch atrophische Gastritis, Morbus Menetrier (hyperplastische, hypersekretorische Gastropathie) und intestinale Metaplasie. ⓘ
Darüber hinaus könnte der Foxp3-Polymorphismus (rs3761548) durch Beeinflussung der Treg-Zell-Aktivität zur Entstehung von Magenkrebs beitragen. ⓘ
Diagnose
Um die Ursache der Symptome herauszufinden, erkundigt sich der Arzt nach der Krankengeschichte des Patienten, führt eine körperliche Untersuchung durch und kann Laboruntersuchungen anordnen. Der Patient kann sich auch einer oder allen dieser Untersuchungen unterziehen:
- Die Gastroskopie ist die diagnostische Methode der Wahl. Dabei wird eine faseroptische Kamera in den Magen eingeführt, um diesen zu visualisieren.
- Obere GI-Serie (kann auch als Barium-Röntgenaufnahme bezeichnet werden)
- Eine Computertomographie oder CT-Untersuchung des Abdomens kann Magenkrebs aufdecken. Sie ist nützlicher, um eine Invasion in angrenzendes Gewebe oder eine Ausbreitung auf lokale Lymphknoten festzustellen. Eine Wandverdickung von mehr als 1 cm, die fokal und exzentrisch ist und sich vergrößert, begünstigt eine bösartige Erkrankung. ⓘ
Im Jahr 2013 berichteten chinesische und israelische Wissenschaftler über eine erfolgreiche Pilotstudie eines Atemtests, mit dem Magenkrebs durch die Analyse von ausgeatmeten Chemikalien diagnostiziert werden soll, ohne dass eine intrusive Endoskopie erforderlich ist. Ein größerer klinischer Versuch mit dieser Technologie wurde 2014 abgeschlossen. ⓘ
Abnormales Gewebe, das bei einer Gastroskopieuntersuchung entdeckt wird, wird vom Chirurgen oder Gastroenterologen biopsiert. Dieses Gewebe wird dann zur histologischen Untersuchung unter dem Mikroskop an einen Pathologen geschickt, um zu prüfen, ob es sich um Krebszellen handelt. Eine Biopsie mit anschließender histologischer Untersuchung ist der einzige sichere Weg, um das Vorhandensein von Krebszellen zu bestätigen. ⓘ
Es wurden verschiedene gastroskopische Verfahren entwickelt, um die Ausbeute an nachgewiesener Schleimhaut mit einem Farbstoff zu erhöhen, der die Zellstruktur hervorhebt und Bereiche mit Dysplasie identifizieren kann. Bei der Endozytoskopie wird die Zellstruktur unter extremer Vergrößerung sichtbar gemacht, um Dysplasiebereiche besser zu erkennen. Andere gastroskopische Modalitäten wie die optische Kohärenztomographie werden derzeit für ähnliche Anwendungen getestet. ⓘ
Eine Reihe von Hautkrankheiten wird mit Magenkrebs in Verbindung gebracht. Eine dunkle Hyperplasie der Haut, häufig in den Achselhöhlen und in der Leistengegend, bekannt als Acanthosis nigricans, wird mit intra-abdominalen Krebsarten wie Magenkrebs in Verbindung gebracht. Andere Hautmanifestationen von Magenkrebs sind "Kuttelpalmen" (eine ähnliche dunkle Hyperplasie der Haut an den Handflächen) und das Leser-Trelat-Zeichen, d. h. die schnelle Entwicklung von Hautläsionen, die als seborrhoische Keratosen bekannt sind. ⓘ
Es können verschiedene Bluttests durchgeführt werden, darunter ein komplettes Blutbild, um eine Anämie festzustellen, und ein Test auf okkultes Blut im Stuhl, um nach Blut im Stuhl zu suchen. ⓘ
Histopathologie

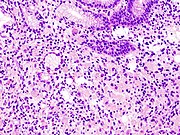
- Das Adenokarzinom des Magens ist ein bösartiger epithelialer Tumor, der vom Drüsenepithel der Magenschleimhaut ausgeht. Magenkrebs ist zu etwa 90 % ein Adenokarzinom. Histologisch lassen sich zwei Haupttypen von Magenadenokarzinomen unterscheiden (Lauren-Klassifikation): der intestinale Typ und der diffuse Typ. Adenokarzinome neigen dazu, aggressiv in die Magenwand einzudringen und die Muscularis mucosae, die Submukosa und dann die Muscularis propria zu infiltrieren. Intestinale Adenokarzinom-Tumorzellen beschreiben unregelmäßige röhrenförmige Strukturen, die eine Pluristratifikation, mehrere Lumen und ein reduziertes Stroma aufweisen ("back to back"-Aspekt). Häufig geht es mit einer intestinalen Metaplasie in der benachbarten Schleimhaut einher. Je nach Drüsenarchitektur, zellulärem Pleomorphismus und Mukosesekretion kann das Adenokarzinom 3 Differenzierungsgrade aufweisen: gut, mäßig und schlecht differenziert. Adenokarzinom vom diffusen Typ (muzinöser, kolloidaler, Linitis plastica- oder Lederflaschenmagen): Die Tumorzellen sind diskohäsiv und sezernieren Schleim, der in das Interstitium abgegeben wird, wodurch große Schleim-/Kolloidansammlungen (optisch "leere" Räume) entstehen. Es ist wenig differenziert. Bei Siegelringzellkarzinomen verbleibt der Schleim im Inneren der Tumorzelle und verdrängt den Zellkern an die Peripherie, wodurch Siegelringzellen entstehen.
- Etwa 5 % der Magenkarzinome sind Lymphome. Dazu gehören extranodale Marginalzonen-B-Zell-Lymphome (MALT-Typ) und in geringerem Maße diffuse große B-Zell-Lymphome. Der MALT-Typ macht etwa die Hälfte der Magenlymphome aus.
- Es können auch Karzinoide und Stromatumoren auftreten. ⓘ
Adenokarzinom des Magens und intestinale Metaplasie. H&E-Färbung. ⓘ
Viel seltener als Adenokarzinome sind adenosquamöse Karzinome, Plattenepithelkarzinome und undifferenzierte Karzinome. ⓘ
Stadieneinteilung

Wenn in der Gewebeprobe Krebszellen gefunden werden, ist der nächste Schritt die Stadieneinteilung, d. h. die Bestimmung des Ausmaßes der Krankheit. Mit verschiedenen Tests wird festgestellt, ob der Krebs gestreut hat und wenn ja, welche Teile des Körpers betroffen sind. Da sich Magenkrebs auf die Leber, die Bauchspeicheldrüse und andere Organe in der Nähe des Magens sowie auf die Lunge ausbreiten kann, kann der Arzt eine CT-Untersuchung, eine PET-Untersuchung, eine endoskopische Ultraschalluntersuchung oder andere Tests zur Überprüfung dieser Bereiche anordnen. Es können Bluttests für Tumormarker wie das karzinoembryonale Antigen und das Kohlenhydratantigen angeordnet werden, da ihre Werte mit dem Ausmaß der Metastasierung, insbesondere in der Leber, und der Heilungsrate korrelieren. ⓘ
Das Staging ist möglicherweise erst nach der Operation abgeschlossen. Der Chirurg entnimmt nahe gelegene Lymphknoten und möglicherweise Gewebeproben aus anderen Bereichen des Abdomens zur Untersuchung durch einen Pathologen. ⓘ
Die klinischen Stadien von Magenkrebs sind:
- Stadium 0 - Begrenzt auf die innere Magenschleimhaut, kann er durch eine endoskopische Schleimhautresektion behandelt werden, wenn er sehr früh entdeckt wird (bei Routineuntersuchungen), oder andernfalls durch eine Gastrektomie und Lymphadenektomie, ohne dass eine Chemotherapie oder Bestrahlung erforderlich ist.
- Stadium I - Eindringen in die zweite oder dritte Schicht des Magens (Stadium 1A) oder in die zweite Schicht und nahe gelegene Lymphknoten (Stadium 1B): Stadium 1A wird durch einen chirurgischen Eingriff, einschließlich der Entfernung des Omentums, behandelt. Stadium 1B kann mit Chemotherapie (5-Fluorouracil) und Strahlentherapie behandelt werden.
- Stadium II - Eindringen in die zweite Schicht und in weiter entfernte Lymphknoten oder in die dritte Schicht und nur in nahe gelegene Lymphknoten oder in alle vier Schichten, aber nicht in die Lymphknoten; die Behandlung erfolgt wie bei Stadium I, manchmal mit zusätzlicher neoadjuvanter Chemotherapie.
- Stadium III - Eindringen in die dritte Schicht und weiter entfernte Lymphknoten oder Eindringen in die vierte Schicht und entweder nahegelegenes Gewebe oder nahegelegene oder weiter entfernte Lymphknoten, wird wie Stadium II behandelt; eine Heilung ist in einigen Fällen noch möglich.
- Stadium IV - Der Krebs hat sich auf nahe gelegene Gewebe und weiter entfernte Lymphknoten ausgebreitet oder hat Metastasen in anderen Organen gebildet. In diesem Stadium ist eine Heilung nur noch sehr selten möglich. Es werden einige andere Techniken zur Lebensverlängerung oder zur Verbesserung der Symptome eingesetzt, darunter Laserbehandlung, Chirurgie und/oder Stents, um den Verdauungstrakt offen zu halten, sowie Chemotherapie mit Medikamenten wie 5-Fluorouracil, Cisplatin, Epirubicin, Etoposid, Docetaxel, Oxaliplatin, Capecitabin oder Irinotecan. ⓘ

Das TNM-Staging-System wird ebenfalls verwendet. ⓘ
In einer Studie über offen zugängliche Endoskopie in Schottland wurden 7 % der Patienten im Stadium I, 17 % im Stadium II und 28 % im Stadium III diagnostiziert. In einer Population in Minnesota wurden 10 % im Stadium I, 13 % im Stadium II und 18 % im Stadium III diagnostiziert. In einer Hochrisikopopulation in der Provinz Valdivia im Süden Chiles wurden jedoch nur 5 % der Patienten in den ersten beiden Stadien und 10 % im Stadium III diagnostiziert. ⓘ
Vorbeugung
Da das Ernährungsprofil viele Risikofaktoren abdeckt, andererseits auch die protektive Wirkung von Obst und Gemüse bekannt ist, sollten ungesunde Essgewohnheiten grundsätzlich umgestellt werden. Vor allem häufiger Verzehr von Fleisch und gepökelter Nahrung sollte reduziert werden. Raucherentwöhnung ist der Gesundheit prinzipiell zuträglich. ⓘ
Bei nachgewiesenem Befall mit Helicobacter pylori ist deren Eradikation (medikamentöse Beseitigung) anzustreben. Sollte Magenkrebs in der Familie verbreitet sein oder eine chronische Gastritis vorliegen, empfiehlt sich eine regelmäßige Magenspiegelung. ⓘ
Beim Deutschen Krebsforschungszentrum geht man davon aus, dass der registrierte Rückgang (zwischen 1977 und 1997 um rund ein Viertel) der Magenkrebserkrankungen auf die massenhafte Verbreitung von Kühlschränken und die ganzjährige Bereitstellung von frischem Obst und Gemüse und einem damit verbundenen Rückgang der Konservierung mittels Pökeln und Räuchern zurückzuführen ist. ⓘ
Je früher der Magentumor erkannt wird, desto erfolgreicher kann er behandelt werden. ⓘ
Die Beseitigung von H. pylori bei Infizierten senkt das Magenkrebsrisiko, zumindest bei asiatischen Patienten. Eine Metaanalyse von Beobachtungsstudien aus dem Jahr 2014 ergab, dass eine Ernährung mit einem hohen Anteil an Obst, Pilzen, Knoblauch, Sojabohnen und grünen Zwiebeln in der koreanischen Bevölkerung mit einem geringeren Magenkrebsrisiko verbunden war. Niedrige Dosen von Vitaminen, insbesondere aus einer gesunden Ernährung, verringern das Risiko für Magenkrebs. Eine frühere Überprüfung der Supplementierung mit Antioxidantien ergab keine Belege und möglicherweise schlechtere Ergebnisse. ⓘ
Behandlung
Magenkrebs ist schwer zu heilen, es sei denn, er wird in einem frühen Stadium entdeckt (bevor er begonnen hat, sich auszubreiten). Da Magenkrebs im Frühstadium nur wenige Symptome verursacht, ist die Krankheit zum Zeitpunkt der Diagnosestellung leider meist schon fortgeschritten. ⓘ
Die Behandlung von Magenkrebs kann eine Operation, eine Chemotherapie oder eine Strahlentherapie umfassen. Neue Behandlungsansätze wie Immun- oder Gentherapie sowie verbesserte Methoden werden derzeit in klinischen Studien untersucht. ⓘ
Chirurgie
Nach einer Voll- oder Teilentfernung des Magens kann es bei den Patienten zu verschiedenen Störungen kommen, welche eigene Maßnahmen zur Erhöhung der Lebensqualität des Patienten nach der Operation benötigen. So führt das totale oder teilweise Entfernen des Magens zu einer schnelleren Passage der Nahrung in den Dünndarm. Dadurch kann ein Dumping-Syndrom entstehen, welches beim Patienten zu einer osmotischen Schwellung des Dünndarms und vasomotorischen Störungen mit Blutdruckabfall bis zur Synkope direkt nach der Nahrungsaufnahme führen kann. Dies wird als Frühdumping bezeichnet. Die andere Seite des Krankheitsbilds, das sogenannte Spätdumping, beruht darauf, dass leicht verdauliche kohlenhydratreiche Nahrung zu schnell resorbiert wird. Dies führt zu einem zu hohen Blutzucker, den der Körper durch eine überschießende Ausschüttung von Insulin zu beherrschen versucht. Da aber meist zu viel Insulin ausgeschüttet wird, kommt es einige Stunden nach der Nahrung zur Unterzuckerung, was für den Patienten sehr belastend ist. Das Dumpingsyndrom kann durch diätetische Maßnahmen wie kleinere, aber häufigere Mahlzeiten, das Vermeiden von Flüssigkeitsaufnahme mit dem Essen oder Liegen nach den Mahlzeiten gebessert werden. ⓘ
Nach einer teilweisen Magenentfernung kann sich eine Refluxösophagitis ausbilden, wenn proximale Teile des Magens entfernt wurden. Ebenso kann basisches Duodenalsekret in den Restmagen oder die Speiseröhre gelangen und dort Schmerzen, Übelkeit oder eine chronische Entzündung auslösen. Diese Probleme können durch Hochlagern des Bettkopfendes oder auch durch medikamentöse Behandlung behoben werden. Auch die Fettverdauung kann den Patienten Probleme bereiten, da die Nahrung nicht mehr im Magen gespeichert werden kann und somit die Zeit sinkt, welche die Bauchspeicheldrüse für die Sekretion von Fett verdauenden Enzymen hat. Als Therapie kann der Fettanteil der Nahrung reduziert werden; auch können die Enzyme exogen zugeführt werden. Bei vielen Patienten treten Malassimilationssyndrome auf, bei denen Nahrungsmittelbestandteile nicht in ausreichendem Umfang verdaut oder resorbiert werden können. Deshalb ist der Patient auf eine ausreichende Zufuhr von Nahrungsenergie und eine ausreichende Zufuhr von Vitaminen und Mineralstoffen hinzuweisen und entsprechend zu schulen. Ebenso entwickeln fast alle Patienten mit einer vollständigen Magenentfernung einen Mangel an Vitamin B12. Dieser verursacht mit einer Latenz von drei bis fünf Jahren eine Anämie. Infolgedessen ist bei jedem Patienten eine Substitution des Vitamins indiziert. Ebenso treten bei Patienten nach der Operation Störungen des Knochenstoffwechsels auf, die Osteoporose sehr stark begünstigen. Einerseits wird dies auf verminderte Kalziumaufnahme zurückgeführt, da die meisten Patienten nach der Operation keine Milchprodukte mehr vertragen. Andererseits findet sich häufig ein Vitamin-D-Mangel. Kalzium und Vitamin D können exogen zugeführt werden. Darüber hinaus stellen die Krebserkrankung und der operative Eingriff für die Patienten in der Regel eine starke psychische Belastung dar. Die Fähigkeit des Patienten, mit seiner Erkrankung umzugehen, sollte infolgedessen wenn nötig durch psychologische Betreuung unterstützt werden. ⓘ

Die Chirurgie ist nach wie vor die einzige Heilungstherapie für Magenkrebs. Von den verschiedenen chirurgischen Techniken ist die endoskopische Schleimhautresektion (EMR) eine Behandlung für Magenkrebs im Frühstadium (der Tumor betrifft nur die Schleimhaut), die in Japan entwickelt wurde und in den Vereinigten Staaten in einigen Zentren angeboten wird. Bei der EMR wird der Tumor zusammen mit der inneren Magenschleimhaut mit einer elektrischen Drahtschlinge durch das Endoskop aus der Magenwand entfernt. Der Vorteil ist, dass es sich um einen viel kleineren Eingriff handelt als die Entfernung des Magens. Die endoskopische Submukosa-Dissektion ist eine ähnliche Technik, die in Japan entwickelt wurde und bei der ein großer Bereich der Schleimhaut in einem Stück entfernt wird. Zeigt die pathologische Untersuchung des Resektats eine unvollständige Resektion oder eine tiefe Tumorinvasion, muss der Patient eine formelle Magenresektion durchführen lassen. Ein Cochrane-Review aus dem Jahr 2016 ergab, dass es keinen Unterschied in der kurzfristigen Sterblichkeit zwischen laparoskopischer und offener Gastrektomie (Entfernung des Magens) gibt und dass Nutzen oder Schaden der laparoskopischen Gastrektomie nicht ausgeschlossen werden können. Postoperativ treten bei bis zu 70 % der Patienten, die sich einer totalen Gastrektomie unterziehen, Komplikationen wie Dumping-Syndrom und Refluxösophagitis auf. Die Konstruktion eines "Pouch", der als "Magenersatz" dient, reduzierte die Häufigkeit des Dumping-Syndroms und der Refluxösophagitis um 73 % bzw. 63 % und führte zu einer Verbesserung der Lebensqualität, der Ernährungsergebnisse und des Body-Mass-Index. ⓘ
Bei Patienten, die zum Zeitpunkt der Vorstellung eine metastasierte Erkrankung haben, kann eine palliative Operation durchgeführt werden. Obwohl dies aufgrund der Möglichkeit von Komplikationen bei der Operation selbst und der Verzögerung der Chemotherapie umstritten ist, sind die bisherigen Daten überwiegend positiv, da sich die Überlebensraten der so behandelten Patienten verbessert haben. ⓘ
Chemotherapie
Für die Chemotherapie zur Behandlung von Magenkrebs gibt es keinen fest etablierten Behandlungsstandard. Leider reagiert Magenkrebs nicht besonders empfindlich auf diese Medikamente, und wenn eine Chemotherapie eingesetzt wird, dient sie in der Regel dazu, den Tumor palliativ zu verkleinern, die Symptome der Krankheit zu lindern und die Überlebenszeit zu verlängern. Zu den Medikamenten, die bei der Behandlung von Magenkrebs eingesetzt werden, gehören Fluorouracil oder sein Analogon Capecitabin, BCNU (Carmustin), Methyl-CCNU (Semustin) und Doxorubicin (Adriamycin) sowie Mitomycin C und in jüngerer Zeit Cisplatin und Taxotere, wobei die Medikamente häufig in verschiedenen Kombinationen eingesetzt werden. Der relative Nutzen dieser verschiedenen Medikamente, einzeln und in Kombination, ist unklar. Klinische Forscher untersuchen die Vorteile einer Chemotherapie vor der Operation, um den Tumor schrumpfen zu lassen, oder als adjuvante Therapie nach der Operation, um verbleibende Krebszellen zu zerstören. ⓘ
Gezielte Therapie
Kürzlich wurde nachgewiesen, dass eine Behandlung mit dem humanen epidermalen Wachstumsfaktorrezeptor 2 (HER2)-Inhibitor Trastuzumab die Gesamtüberlebenszeit bei inoperablen lokal fortgeschrittenen oder metastasierten Magenkarzinomen, die das HER2/neu-Gen überexprimieren, verlängert. Insbesondere wird HER2 bei 13-22 % der Patienten mit Magenkrebs überexprimiert. Bemerkenswert ist, dass die HER2-Überexpression bei Magenneoplasien heterogen ist und nur eine Minderheit der Tumorzellen betrifft (weniger als 10 % der Magenkarzinome überexprimieren HER2 in mehr als 5 % der Tumorzellen). Daher sollte diese heterogene Expression bei HER2-Tests berücksichtigt werden, insbesondere bei kleinen Proben wie Biopsien, die die Auswertung von mehr als einer bioptischen Probe erfordern. ⓘ
Bestrahlung
Eine Strahlentherapie (auch Radiotherapie genannt) kann zur Behandlung von Magenkrebs eingesetzt werden, oft als Ergänzung zu einer Chemotherapie und/oder Operation. ⓘ
Lymphom
MALT-Lymphome können häufig durch die Behandlung einer zugrunde liegenden H. pylori-Infektion vollständig geheilt werden. Dies führt in etwa 80 % der Fälle zu einer Remission. ⓘ
Prognose
Die Prognose von Magenkrebs ist im Allgemeinen schlecht, da der Tumor zum Zeitpunkt der Entdeckung häufig bereits Metastasen gebildet hat und die meisten Betroffenen bei der Diagnose bereits älter sind (das Durchschnittsalter liegt zwischen 70 und 75 Jahren). Die durchschnittliche Lebenserwartung nach der Diagnose liegt bei etwa 24 Monaten, und die Fünf-Jahres-Überlebensrate bei Magenkrebs beträgt weniger als 10 %. ⓘ
Nahezu 300 Gene stehen im Zusammenhang mit der Prognose von Magenkrebs, wobei es sowohl ungünstige Gene gibt, bei denen eine hohe Expression mit einer schlechten Überlebensrate verbunden ist, als auch günstige Gene, bei denen eine hohe Expression mit einer längeren Überlebenszeit verbunden ist. Beispiele für Gene mit schlechter Prognose sind ITGAV, DUSP1 und P2RX7. ⓘ
Epidemiologie
Mit 952.000 diagnostizierten Fällen im Jahr 2012 ist Magenkrebs weltweit die fünfthäufigste Krebsart. Er ist sowohl bei Männern als auch in Entwicklungsländern häufiger anzutreffen. Im Jahr 2012 machte er 8,5 % der Krebsfälle bei Männern aus und war damit die vierthäufigste Krebserkrankung bei Männern. Ebenfalls 2012 lag die Zahl der Todesfälle bei 700.000, was einen leichten Rückgang gegenüber 774.000 im Jahr 1990 bedeutet und ihn zur dritthäufigsten krebsbedingten Todesursache (nach Lungen- und Leberkrebs) macht. ⓘ
Weniger als 5 % der Magenkrebserkrankungen treten bei Menschen unter 40 Jahren auf, wobei 81,1 % dieser 5 % auf die Altersgruppe der 30- bis 39-Jährigen und 18,9 % auf die Altersgruppe der 20- bis 29-Jährigen entfallen. ⓘ
Im Jahr 2014 verursachte Magenkrebs 0,61 % der Todesfälle (13 303 Fälle) in den USA. In China war Magenkrebs für 3,56 % aller Todesfälle verantwortlich (324 439 Fälle). Die höchste Rate an Magenkrebserkrankungen gab es in der Mongolei mit 28 Fällen pro 100.000 Menschen. ⓘ
Im Vereinigten Königreich ist Magenkrebs die fünfzehnthäufigste Krebserkrankung (2011 wurde bei rund 7.100 Menschen Magenkrebs diagnostiziert) und die zehnthäufigste Ursache für krebsbedingte Todesfälle (2012 starben rund 4.800 Menschen). ⓘ
Die Inzidenz- und Mortalitätsraten von Magenkrebs sind in Afrika sehr unterschiedlich. Das GLOBOCAN-System ist derzeit die am weitesten verbreitete Methode, um diese Raten zwischen den Ländern zu vergleichen, aber die afrikanischen Inzidenz- und Mortalitätsraten unterscheiden sich von Land zu Land, was möglicherweise darauf zurückzuführen ist, dass nicht alle Länder Zugang zu einem Registrierungssystem haben. Es wurden so drastische Unterschiede wie geschätzte Raten von 0,3/100000 in Botswana bis 20,3/100000 in Mali beobachtet. In Uganda ist die Inzidenz von Magenkrebs von 0,8/100000 in den 1960er Jahren auf 5,6/100000 gestiegen. Im Vergleich zu Ländern mit hoher Inzidenz, wie Japan und China, ist das Vorkommen von Magenkrebs zwar relativ gering. Eine vermutete Ursache für die Unterschiede innerhalb Afrikas und zwischen anderen Ländern sind unterschiedliche Stämme des Bakteriums H. pylori. Im Allgemeinen wird davon ausgegangen, dass eine Infektion mit H. pylori das Risiko für Magenkrebs erhöht, was in Afrika jedoch nicht der Fall ist, was diesem Phänomen den Namen "afrikanisches Rätsel" einbrachte. Obwohl diese Bakterienart in Afrika vorkommt, gibt es Hinweise darauf, dass unterschiedliche Stämme mit Mutationen im bakteriellen Genotyp zu den Unterschieden in der Krebsentwicklung zwischen afrikanischen Ländern und anderen Ländern außerhalb des Kontinents beitragen können. Der zunehmende Zugang zur Gesundheitsversorgung und zu Behandlungsmaßnahmen wurde jedoch allgemein mit der steigenden Inzidenz in Verbindung gebracht, insbesondere in Uganda. ⓘ
Weltweit stellt das Magenkarzinom den zweithäufigsten Tumor des Menschen dar. In Deutschland macht Magenkrebs nur rund 5 % aller malignen Erkrankungen aus. Das Auftreten variiert regional erheblich. Länder mit hohem Auftreten sind Japan, Chile, Costa Rica, Kolumbien, China, Portugal, Russland und Bulgarien. In diesen Staaten ist das Auftreten rund vier- bis sechsfach im Vergleich zu Ländern mit niedrigem Risiko erhöht. In der westlichen Welt geht die Krebsart mittlerweile im Vergleich zu anderen Krebsarten zurück. So war sie 1930 die häufigste Krebstodesursache in den USA, heute ist Magenkrebs nur noch für rund 2,5 % der Krebstoten verantwortlich. Dies lässt sich durch ein besseres Langzeitüberleben der Patienten erklären, ist aber vor allem der Abnahme der Neuerkrankungsrate zu verdanken. Diese fiel von 38:100.000 in den 1930er-Jahren auf rund 5:100.000 im 21. Jahrhundert. In den meisten Staaten sind Männer gegenüber Frauen doppelt so oft von der Krankheit betroffen. ⓘ
Andere Tiere
Der Magen ist ein muskuläres Organ des Magen-Darm-Trakts, das die Nahrung aufnimmt und den Verdauungsprozess durch Absonderung von Magensaft einleitet. Die häufigsten Krebsarten des Magens sind Adenokarzinome, aber auch andere histologische Formen sind bekannt. Die Anzeichen sind unterschiedlich, können aber Erbrechen (insbesondere wenn Blut vorhanden ist), Gewichtsverlust, Anämie und Appetitlosigkeit umfassen. Der Stuhlgang kann dunkel und teerartig sein. Um festzustellen, ob Krebs im Magen vorhanden ist, können spezielle Röntgenaufnahmen und/oder Ultraschalluntersuchungen des Abdomens durchgeführt werden. Die Gastroskopie, ein Test, bei dem der Magen mit einem Endoskop untersucht wird, ist ein nützliches Diagnoseinstrument, mit dem auch Proben der vermuteten Masse für eine histopathologische Analyse entnommen werden können, um Krebs zu bestätigen oder auszuschließen. Die definitivste Methode der Krebsdiagnose ist eine offene chirurgische Biopsie. Die meisten Magentumore sind bösartig und weisen eine Ausbreitung auf Lymphknoten oder Leber auf, was die Behandlung erschwert. Abgesehen von Lymphomen ist die Operation die häufigste Behandlungsmöglichkeit für Magenkrebs, doch ist sie mit erheblichen Risiken verbunden. ⓘ
Histopathologie
Die Mehrheit der Karzinome zeigt unter dem Mikroskop Siegelringzellen. In den Zellen ist der Zellkern an den Rand gedrängt, und sie reagieren stark mit der PAS-Färbung. Seltener treten Karzinome auf, die den Drüsen des Darmes ähneln. Es sind auch Gallertkarzinome beschrieben, bei denen außerhalb der Krebszellen Massen von PAS-positivem Schleim liegen, sowie entdifferenzierte Karzinome, deren Herkunft sich nur durch immunhistochemische Methoden klären lässt. Neben diesen Tumoren, die vom Epithel des Magens ausgehen, sind auch neuroendokrine Tumoren beschrieben. ⓘ
Molekularbiologie
Molekularbiologische Befunde werden für die Einschätzung der Prognose und für die Wahl der Therapie immer wichtiger. 2014 wurde auf Basis genetischer Untersuchungen eine Klassifikation in vier Typen vorgeschlagen:
- EBV-positive Tumoren
- MSI-Tumoren
- genomisch – stabile Tumoren
- Chromosomen – instabile Tumoren
Aus dem TCGA-Projekt (The Cancer Genome Atlas) standen genetische und molekularbiologische Analysen von 295 Adenokarzinomen des Magens zur Verfügung. Die Gewebeproben der Tumoren wurden mit 6 verschiedenen molekularen Plattformen untersucht:
- array-based somatic copy number analysis: Verfahren zur Bestimmung der Anzahl somatischer DNA – Kopien
- whole-exome sequencing: Sequenzierung der DNA
- array-based DNA methylation profiling: Analyse der DNA-Hypermethylierung
- messenger RNA sequencing: Sequenzierung der mRNA
- microRNA (miRNA) sequencing: Sequenzierung der microRNA
- reverse-phase protein array (RPPA): Analyse der gebildeten Proteine ⓘ
Epstein-Barr-Virus-positive Tumoren
Das Epstein-Barr-Virus konnte in 9 % der Fälle aufgespürt werden. EBV-positive Tumoren hatten häufig eine extrem starke DNA-Hypermethylierung. Sie wiesen oft eine PIK3CA-Mutation auf und amplifizierten JAK2, PD-L1 und PD-L2, d. h. diese Proteine wurden über-normal stark gebildet. Diese Tumoren wären potentielle Kandidaten für eine Immuntherapie mit PD-L1-Inhibitoren. Bisher sind sie für das Magenkarzinom allerdings noch nicht zugelassen. Klinische Studien brachten bisher keinen Erfolg. ⓘ
MSI-Tumoren
64 Tumoren wiesen eine sehr starke Mutationsrate auf. Es kommt zur Mikrosatelliten-Bildung. Die Abkürzung MSI steht für "MikroSatellit Instabil". Das Mismatch-Reparatur-Protein MLH1 wird häufig nicht exprimiert, wodurch bestimmte DNA-Schäden nicht erfolgreich repariert werden können. Das führt zur Ausbildung zahlreicher Mutationen, die eventuell Ziel für eine Target-Therapie werden könnten. Durch eine Hypermethylierung des MLH1-Promotors wird die Produktion dieses DNA-Reparaturmoleküls abgeschaltet. ⓘ
Genomisch-stabile Tumoren
Die verbliebenen Tumoren wurden nach dem Vorhandensein oder Fehlen extensiver somatischer Aberrationen der Kopienzahl(engl. somatic copy-number aberrations = SCNA), d. h. der Veränderung der Genaktivität in genomisch-stabile und chromosomeninstabile unterteilt. 58 Tumoren zeigten ein stabiles Genomen mit wenig Mutationen. Histologisch waren es häufig diffus wachsenden Magenkarzinome. Gene von Proteinen für die Zellmigration waren häufig aktiviert. Besonders häufig waren Mutationen von CDH1 und RHOA. Ferner wurde eine Fusion von CLDN18- und ARHGAP-Genen nachgewiesen. ⓘ
Chromosomeninstabile Tumoren
Die übrigen 147 Tumoren gehörten der verbleibenden chromosomeninstabilen Gruppe (CIN) mit vielen Mutationen an. Histologisch waren sie meistens intestinal differenziert. Besonders häufig war eine Mutation von TP53 anzutreffen, welches das Protein p53 kodiert. Ferner fand sich eine Aktivierung von RTK-RAS. ⓘ
TNM-Klassifikation
Die TNM-Klassifikation dient der Stadieneinteilung der Tumorausbreitung (sogenanntes Staging). TNM ist eine Abkürzung für ⓘ
- T = Tumor: Ausdehnung des Primärtumors
- N = Nodus: Lymphknoten, Fehlen oder Vorhandensein von regionären Lymphknotenmetastasen
- M = Metastasen: Fehlen oder Vorhandensein von Fernmetastasen ⓘ
Derzeit gültig ist die 7. Auflage der Kriterien nach AJCC staging system (American Joint Committee on Cancer). ⓘ
| TX | Primärtumor kann nicht bestimmt werden. |
| T0 | Keine Evidenz für einen Primärtumor |
| Tis | Carcinoma in situ: Intraepithelialer Tumor ohne Invasion der Lamina propria |
| T1 | Infiltration der Lamina propria oder der Tela submucosa (Synonym: Frühkarzinom) |
| T1a | Infiltration der Lamina propria oder Lamina muscularis mucosae |
| T1b | Infiltration der Tela submucosa |
| T2 | Infiltration der Tunica muscularis |
| T3 | Infiltration des subserösen Bindegewebes ohne Invasion des visceralen Peritoneums oder benachbarter Strukturen. T3 schließt auch Tumoren ein, welche sich entlang des gastrocolischen oder gastrohepatischen Ligaments ausbreiten, sowie das Omentum majus oder minus erreichen, ohne Durchdringung des visceralen Peritonuems, welche diese Strukturen umgibt. |
| T4 | Infiltration von Nachbarorganen (Milz, Colon transversum, Leber, Zwerchfell, Pancreas, Bauchwand, Nebenniere, Niere, Dünndarm oder Retroperitoneum) |
| T4a | Infiltration der Serosa (viszerales Peritoneum) |
| T4b | Infiltration von Nachbarorganen (Milz, Colon transversum, Leber, Zwerchfell, Pancreas, Bauchwand, Nebenniere, Niere, Dünndarm oder Retroperitoneum) |
| NX | Befall lokaler Lymphknoten nicht beurteilbar |
| N0 | Keine lokalen Lymphknoten befallen |
| N1 | Metastasen in ein bis zwei lokalen Lymphknoten |
| N2 | Metastasen in drei bis sechs lokalen Lymphknoten |
| N3 | Metastasen in sieben oder mehr lokalen Lymphknoten |
| M0 | Keine Fernmetastasen nachgewiesen |
| M1 | Fernmetastasen |
Therapie
| TNM-Stadium | Therapie ⓘ |
|---|---|
| uT1aN0M0* (Mucosakarzinom, Magenfrühkarzinom) |
Endoskopische Resektion (EMR, ESD) |
| alle Stadien ≥ uT1b* (operabel) | Operation (komplette oder Teil-Gastrektomie mit D2-Lymphadenektomie) |
| Stadien uT3 und uT4* (operabel) | zusätzlich vorgeschaltet zur o. g. Operation: Neoadjuvante Chemotherapie mit Cisplatin und Fluorouracil (bzw. Oxaliplatin, Capecitabin); Stellenwert der adjuvanten (Radio-)Chemotherapie ist umstritten, wird bisher nicht empfohlen |
| lokal inoperabel oder metastasiert (M1) | Palliative Chemotherapie auf Basis der o. g. Substanzen, bei HER2-Positivität möglichst mit Trastuzumab |
| * der Buchstabe 'u' bei der TNM-Formel steht für durch Ultraschall, d. h. endosonografisch gewonnene Befunde | |
Die wichtigste Behandlungsmaßnahme ist seit dem Ende des 19. Jahrhunderts die operative Entfernung des Tumors, möglichst vollständig, mit einem Sicherheitsabstand von 5 cm beim intestinalen Typ bzw. 8 cm beim diffusen Typ. Daraus ergibt sich je nach Lokalisation eine teilweise (4/5) oder vollständige Magenentfernung, evtl. unter Mitnahme von Teilen der Speiseröhre oder des Zwölffingerdarmes. Eine 4/5 Resektion nach Billroth ist ausschließlich beim intestinalen Typ in Verbindung mit einer Lokalisation im untersten Teil des Magens, dem Antrum, möglich. In allen anderen Fällen muss bei Aussicht auf Heilung eine Gastrektomie mit einer nach Y-Roux ausgeschalteten Jejunalschlinge erfolgen. Die umgebenden Lymphknoten werden mitentfernt, bei Infiltration auch die Milz oder Teile der Leber. Anschließend wird das verbleibende Magen- oder Speiseröhrenende wieder mit dem Zwölffingerdarm verbunden (Operationstechnik nach Billroth I oder II). ⓘ
Lokale Abtragung bzw. endoskopische Resektion
Falls ein Magenkarzinom nur auf die Schleimhaut begrenzt ist („Mukosakarzinom“ im Stadium T1aN0M0, dies lässt sich mit hoher Sicherheit durch die endosonografische Untersuchung feststellen) besteht die Therapie aus einer lokalen endoskopischen Abtragung. Zwei verschiedene Techniken finden hier Anwendung: die endoskopische Mukosaresektion (EMR), bei der die Läsion zunächst mit steriler Kochsalzlösung unterspritzt und anschließend mit einer Schlinge abgetragen wird, oder die endoskopische submukosale Dissektion (ESD), bei der die Läsion mikrochirurgisch abgetragen wird. Letztere hat den Vorteil, dass die Läsion en bloc abgetragen werden kann, was die spätere histopathologische Beurteilung erleichtert. Allerdings ist die ESD wohl auch mit etwas höheren Komplikationsraten verbunden. ⓘ
Gastrektomie und neoadjuvante Chemotherapie
In den operablen Stadien T1b, T2, T3, T4 ist eine endoskopische Abtragung nicht mehr möglich oder sinnvoll. Stattdessen soll eine Operation (komplette oder partielle Gastrektomie) mit sogenannter Lymphknotendissektion (Mitentfernung der ableitenden Lymphwege mit Lymphstationen) erfolgen. ⓘ
Bei den operablen Magenkarzinomen im Stadium T3 oder T4 empfehlen die deutschen Leitlinien grundsätzlich die Durchführung einer neoadjuvanten Chemotherapie, d. h. einer Chemotherapie vor der Operation um den Tumor zu verkleinern und damit das Operationsergebnis zu verbessern. Zwei große Therapiestudien haben einen Überlebensvorteil für derartig behandelten im Vergleich zu chemotherapeutisch unbehandelten Patienten gezeigt, zum einen die britische MAGIC-Studie, bei der Patienten mit einer Kombination aus Epirubicin, Cisplatin und Fluorouracil („ECF“) behandelt wurden, zum anderen die französische FNCLCC/FFCD-Studie, bei der die Patienten Cisplatin und Fluorouracil erhielten. Statt Fluorouracil und Cisplatin werden wegen besserer Verträglichkeit heute vielfach Capecitabin und Oxaliplatin genommen. Eine weitere vielversprechende Kombination ist Docetaxel – Oxaliplatin – Fluorouracil. ⓘ
Adjuvante Chemotherapie oder Radiochemotherapie
Der Stellenwert einer adjuvanten Chemotherapie oder Radiochemotherapie (d. h. Chemotherapie evtl. kombiniert mit Strahlentherapie nach der erfolgten Operation) wird zurzeit noch unterschiedlich beurteilt. Nach deutschen Leitlinien (Stand 15. Dezember 2012) wird im Allgemeinen keine adjuvante Therapie empfohlen. Einzige Ausnahme bildet die Situation, wenn der Tumor nicht komplett operativ entfernt werden konnte. In asiatischen Ländern wird das anders beurteilt und gehandhabt und eine adjuvante Therapie vielfach durchgeführt, z. B. mit Capecitabin und Oxaliplatin. ⓘ
Palliative Therapie
Falls der Tumor primär inoperabel ist (z. B. weil er in der Nähe großer Blutgefäße liegt, „lokal fortgeschrittenes Karzinom“) oder mehrere Fernmetastasen zeigt, ist in der Regel keine Heilung mehr möglich. Die Therapie erfolgt dann nicht mehr mit kurativer („heilender“), sondern mit palliativer („lindernder“) Zielsetzung. Mit den o. g. Chemotherapeutika lässt sich in den meisten Fällen eine Beschwerdelinderung und Verlängerung der Überlebenszeit erreichen. Falls der Tumor histopathologisch HER2-positiv ist, sollte wenn möglich Trastuzumab (Herceptin®) zum Einsatz kommen. ⓘ
Nachsorge
Es konnte bisher nicht gezeigt werden, dass Nachsorgeuntersuchungen zu einer Früherkennung von Rezidiven und damit zu einem besseren Überleben führen. Deswegen sind die Empfehlungen zur spezifischen Nachsorge in den aktuellen Leitlinien zurückhaltend. Es werden dort keine routinemäßigen diagnostischen Untersuchungen wie z. B. Magenspiegelung, Sonografie, Thorax-Röntgen oder Computertomographie empfohlen. Etwas anderes ist es natürlich, wenn der in Nachsorge befindliche Patient spezifische Beschwerden hat, die durch ein Rezidiv verursacht sein könnten. Hier muss dann natürlich entsprechende Diagnostik durchgeführt werden, wobei allerdings die Prognose von Patienten mit einem symptomatischen (= Beschwerden verursachenden) Rezidiv als generell schlecht gilt. ⓘ