Rotavirus
| Rotavirus ⓘ | |
|---|---|

| |
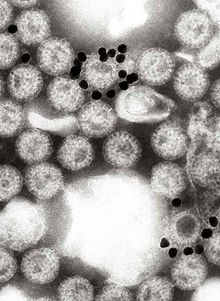
| Computergestützte Rekonstruktion eines Rotavirus auf der Grundlage mehrerer elektronenmikroskopischer Aufnahmen | |
| Klassifizierung von Viren | |
| (ohne Rangfolge): | Virus |
| Bereich: | Riboviren |
| Königreich: | Orthornaviren |
| Phylum: | Duplornaviricota |
| Klasse: | Resentoviricetes |
| Ordnung: | Reovirales |
| Familie: | Reoviridae |
| Unterfamilie: | Sedoreovirinae |
| Gattung: | Rotavirus |
| Spezies | |
| |
Rotaviren sind eine Gattung von doppelsträngigen RNA-Viren aus der Familie der Reoviridae. Rotaviren sind die häufigste Ursache von Durchfallerkrankungen bei Säuglingen und Kleinkindern. Fast jedes Kind auf der Welt hat sich bis zum Alter von fünf Jahren mindestens einmal mit einem Rotavirus infiziert. Mit jeder Infektion entwickelt sich eine Immunität, so dass nachfolgende Infektionen weniger schwerwiegend sind. Erwachsene sind nur selten betroffen. Es gibt neun Arten der Gattung, die als A, B, C, D, F, G, H, I und J bezeichnet werden. Rotavirus A, die häufigste Art, verursacht mehr als 90 % der Rotavirus-Infektionen beim Menschen. ⓘ
Das Virus wird über den fäkal-oralen Weg übertragen. Es infiziert und schädigt die Zellen, die den Dünndarm auskleiden, und verursacht eine Gastroenteritis (die oft als "Magen-Darm-Grippe" bezeichnet wird, obwohl sie nichts mit der Grippe zu tun hat). Obwohl das Rotavirus 1973 von Ruth Bishop und ihren Kollegen durch elektronenmikroskopische Aufnahmen entdeckt wurde und für etwa ein Drittel der Krankenhauseinweisungen wegen schwerer Diarrhöe bei Säuglingen und Kindern verantwortlich ist, wurde seine Bedeutung in der öffentlichen Gesundheit, insbesondere in Entwicklungsländern, bisher unterschätzt. Das Rotavirus wirkt sich nicht nur auf die menschliche Gesundheit aus, sondern infiziert auch andere Tiere und ist ein Krankheitserreger in der Viehzucht. ⓘ
Rotavirale Enteritis ist in der Regel eine leicht zu behandelnde Kinderkrankheit, aber bei Kindern unter 5 Jahren verursachte das Rotavirus im Jahr 2019 schätzungsweise 151.714 Todesfälle durch Durchfallerkrankungen. In den Vereinigten Staaten verursachte das Rotavirus vor der Einführung des Rotavirus-Impfprogramms in den 2000er Jahren jedes Jahr etwa 2,7 Millionen Fälle von schwerer Gastroenteritis bei Kindern, fast 60.000 Krankenhausaufenthalte und etwa 37 Todesfälle. Nach der Einführung des Rotavirus-Impfstoffs in den Vereinigten Staaten sind die Hospitalisierungsraten deutlich zurückgegangen. Die öffentlichen Gesundheitskampagnen zur Bekämpfung des Rotavirus konzentrieren sich auf die orale Rehydratationstherapie für infizierte Kinder und die Impfung zur Vorbeugung der Krankheit. Die Häufigkeit und der Schweregrad von Rotavirus-Infektionen sind in den Ländern, die den Rotavirus-Impfstoff in ihre routinemäßige Impfpolitik für Kinder aufgenommen haben, deutlich zurückgegangen. ⓘ
Die Gattung Rotavirus umfasst Viren der Unterfamilie Sedoreovirinae in der Familie Reoviridae mit einem Genom aus elf Segmenten einer doppelsträngigen RNA (dsRNA). Rotaviren besitzen sehr komplexe Viruspartikel (Virionen), die aus zwei konzentrischen Kapsiden und einer inneren Corestruktur bestehen; dies wird auch als dreischichtige Kapsidstruktur bezeichnet. Zwischen äußerem und innerem Kapsid sind in TEM-Aufnahmen Proteinbrücken und Kanäle zu erkennen, die in der Negativkontrastierung radähnlich erscheinen. Von diesem Aussehen ist auch der Name der Gattung (von lateinisch rota „Rad“) abgeleitet. Rotaviren wurden erstmals in den 1950er Jahren als Erreger einer Diarrhoe bei der Maus identifiziert, seither fand man sie bei mehreren Säugetieren und Vögeln. Für den Menschen sind Subtypen aus drei Rotavirusspezies bekannt, die man als Humane Rotaviren zusammenfasst. ⓘ
Virologie
Arten von Rotaviren
Es gibt neun Arten von Rotaviren, die als A, B, C, D, F, G, H, I und J bezeichnet werden. Der Mensch wird in erster Linie durch die Art Rotavirus A infiziert. Die Arten A-I verursachen Krankheiten bei anderen Tieren, die Art H bei Schweinen, D, F und G bei Vögeln, I bei Katzen und J bei Fledermäusen. Innerhalb des Rotavirus A gibt es verschiedene Stämme, die als Serotypen bezeichnet werden. Wie beim Influenzavirus wird ein duales Klassifizierungssystem verwendet, das auf zwei Proteinen auf der Oberfläche des Virus basiert. Das Glykoprotein VP7 definiert die G-Serotypen und das proteaseempfindliche Protein VP4 die P-Serotypen. Da die beiden Gene, die die G- und P-Typen bestimmen, getrennt an die Nachkommen weitergegeben werden können, finden sich unterschiedliche Kombinationen. Für das Rotavirus A wurde ein System zur Genotypisierung des gesamten Genoms entwickelt, das zur Bestimmung der Herkunft atypischer Stämme verwendet wurde. Die Prävalenz der einzelnen G-Typen und P-Typen variiert zwischen und innerhalb von Ländern und Jahren. Es gibt mindestens 36 G-Typen und 51 P-Typen, aber bei Infektionen des Menschen überwiegen nur einige wenige Kombinationen von G- und P-Typen. Diese sind G1P[8], G2P[4], G3P[8], G4P[8], G9P[8] und G12P[8]. ⓘ
Aufbau
Das Genom der Rotaviren besteht aus 11 einzigartigen Doppelhelix-RNA-Molekülen (dsRNA) mit insgesamt 18 555 Nukleotiden. Jede Helix, bzw. jedes Segment, ist ein Gen, das mit abnehmender Größe von 1 bis 11 nummeriert ist. Jedes Gen kodiert für ein Protein, mit Ausnahme des Gens 9, das für zwei kodiert. Die RNA ist von einem dreischichtigen ikosaedrischen Proteinkapsid umgeben. Die Viruspartikel haben einen Durchmesser von bis zu 76,5 nm und sind nicht umhüllt. ⓘ
Proteine

Es gibt sechs virale Proteine (VP), die das Viruspartikel (Virion) bilden. Diese Strukturproteine werden als VP1, VP2, VP3, VP4, VP6 und VP7 bezeichnet. Zusätzlich zu den VP gibt es sechs Nicht-Strukturproteine (NSP), die nur in Zellen gebildet werden, die mit dem Rotavirus infiziert sind. Diese werden als NSP1, NSP2, NSP3, NSP4, NSP5 und NSP6 bezeichnet. ⓘ
Mindestens sechs der zwölf vom Rotavirus-Genom kodierten Proteine binden RNA. Die Rolle dieser Proteine bei der Replikation des Rotavirus ist nicht vollständig geklärt; man nimmt an, dass ihre Funktionen mit der RNA-Synthese und -Verpackung im Virion, dem mRNA-Transport zum Ort der Genomreplikation sowie der mRNA-Translation und der Regulierung der Genexpression zusammenhängen. ⓘ
Strukturelle Proteine
VP1 befindet sich im Kern des Viruspartikels und ist ein RNA-abhängiges RNA-Polymerase-Enzym. In einer infizierten Zelle produziert dieses Enzym mRNA-Transkripte für die Synthese viraler Proteine und stellt Kopien der RNA-Segmente des Rotavirus-Genoms für neu produzierte Viruspartikel her. ⓘ
VP2 bildet die Kernschicht des Virions und bindet das RNA-Genom. ⓘ
VP3 ist Teil des inneren Kerns des Virions und ist ein Enzym namens Guanylyltransferase. Dabei handelt es sich um ein Kappenenzym, das die Bildung der 5'-Kappe bei der posttranskriptionellen Modifikation der mRNA katalysiert. Die Kappe stabilisiert die virale mRNA, indem sie sie vor Nukleinsäure-abbauenden Enzymen, den so genannten Nukleasen, schützt. ⓘ
VP4 befindet sich auf der Oberfläche des Virions und ragt als Spike heraus. Es bindet an Moleküle auf der Oberfläche von Zellen, die als Rezeptoren bezeichnet werden, und sorgt für den Eintritt des Virus in die Zelle. VP4 muss durch das Proteaseenzym Trypsin, das im Darm vorkommt, in VP5* und VP8* umgewandelt werden, bevor das Virus infektiös wird. VP4 bestimmt, wie virulent das Virus ist, und es bestimmt den P-Typ des Virus. Beim Menschen gibt es einen Zusammenhang zwischen der Blutgruppe (Lewis-Antigensystem, ABO-Blutgruppensystem und Sekretorstatus) und der Anfälligkeit für Infektionen. Nicht-Sekretoren scheinen gegen eine Infektion mit den Typen P[4] und P[8] resistent zu sein, was darauf hindeutet, dass Blutgruppenantigene die Rezeptoren für diese Genotypen sind. Diese Resistenz hängt vom Genotyp des Rotavirus ab. ⓘ
VP6 bildet den Hauptteil des Kapsids. Es ist stark antigen und kann zur Identifizierung von Rotavirus-Spezies verwendet werden. Dieses Protein wird in Labortests für Rotavirus-A-Infektionen verwendet. ⓘ
VP7 ist ein Glykoprotein, das die äußere Oberfläche des Virions bildet. Abgesehen von seinen strukturellen Funktionen bestimmt es den G-Typ des Stammes und ist zusammen mit VP4 an der Immunität gegen Infektionen beteiligt. ⓘ
Nicht-strukturelle virale Proteine
NSP1, das Produkt von Gen 5, ist ein nicht-strukturelles RNA-bindendes Protein. NSP1 blockiert auch die Interferonreaktion, den Teil des angeborenen Immunsystems, der die Zellen vor einer Virusinfektion schützt. NSP1 veranlasst das Proteosom, wichtige Signalkomponenten abzubauen, die erforderlich sind, um die Produktion von Interferon in einer infizierten Zelle anzuregen und auf das von benachbarten Zellen ausgeschüttete Interferon zu reagieren. Zu den Zielen des Abbaus gehören mehrere IRF-Transkriptionsfaktoren, die für die Transkription von Interferon-Genen erforderlich sind. ⓘ
NSP2 ist ein RNA-bindendes Protein, das sich in zytoplasmatischen Einschlüssen (Viroplasmen) ansammelt und für die Genomreplikation erforderlich ist. ⓘ
NSP3 wird in infizierten Zellen an virale mRNAs gebunden und ist für die Abschaltung der zellulären Proteinsynthese verantwortlich. NSP3 inaktiviert zwei Translationsinitiationsfaktoren, die für die Synthese von Proteinen aus der Wirts-mRNA wesentlich sind. Zunächst stößt NSP3 das Poly(A)-bindende Protein (PABP) vom Translationsinitiationsfaktor eIF4F ab. PABP ist für eine effiziente Translation von Transkripten mit einem 3'-Poly(A)-Schwanz erforderlich, der auf den meisten Wirtszelltranskripten zu finden ist. Zweitens inaktiviert NSP3 eIF2 durch Stimulierung seiner Phosphorylierung. Für eine effiziente Translation von Rotavirus-mRNA, der der 3'-Poly(A)-Schwanz fehlt, ist keiner dieser Faktoren erforderlich. ⓘ
NSP4 ist ein virales Enterotoxin, das Durchfall auslöst und das erste virale Enterotoxin war, das entdeckt wurde. Es ist ein Viroporin, das das zytosolische Ca2+ in Säugetierzellen erhöht. ⓘ
NSP5 wird vom Genomsegment 11 des Rotavirus A kodiert. In virusinfizierten Zellen reichert sich NSP5 im Viroplasma an. ⓘ
NSP6 ist ein nukleinsäurebindendes Protein und wird von Gen 11 aus einem offenen Leseraster kodiert, das außerhalb der Phase liegt. ⓘ
| RNA-Abschnitt (Gen) | Größe (Basenpaare) | Protein | UniProt | Molekulargewicht kDa | Standort | Kopien pro Partikel | Funktion ⓘ |
|---|---|---|---|---|---|---|---|
| 1 | 3302 | VP1 | P22678 | 125 | An den Scheitelpunkten des Kerns | 12 | RNA-abhängige RNA-Polymerase |
| 2 | 2690 | VP2 | A2T3R5 | 102 | Bildet die innere Schale des Kerns | 120 | RNA-Bindung |
| 3 | 2591 | VP3 | A2T3S5 | 88 | An den Scheitelpunkten des Kerns | 12 | Methyltransferase mRNA-Kappungsenzym |
| 4 | 2362 | VP4 | A2T3T2 | 87 | Oberflächen-Spike | 180 | Zellanhaftung, Virulenz |
| 5 | 1611 | NSP1 | Q99FX5 | 59 | Nicht-strukturell | 0 | 5'RNA-Bindung, Interferon-Antagonist |
| 6 | 1356 | VP6 | Q6LE89 | 45 | Inneres Capsid | 780 | Strukturelles und artspezifisches Antigen |
| 7 | 1104 | NSP3 | P03536 | 37 | Nicht-strukturell | 0 | Erhöht die virale mRNA-Aktivität und schaltet die zelluläre Proteinsynthese aus |
| 8 | 1059 | NSP2 | A2T3P0 | 35 | Nicht-strukturell | 0 | NTPase, beteiligt an der RNA-Verpackung |
| 9 | 1062 | VP71 VP72 | P03533 | 38 und 34 | Oberfläche | 780 | Struktur- und Neutralisierungsantigen |
| 10 | 751 | NSP4 | P04512 | 20 | Nicht-strukturell | 0 | Enterotoxin (Viroporin) |
| 11 | 667 | NSP5 NSP6 | A2T3Q9 P11203 | 22 | Nicht-strukturell | 0 | ssRNA- und dsRNA-bindender Modulator von NSP2, Phosphoprotein |
Diese Tabelle basiert auf dem Affen-Rotavirus-Stamm SA11. Die Zuordnungen der RNA-Protein-Kodierungen unterscheiden sich bei einigen Stämmen. ⓘ
Replikation

Die Anheftung des Virus an die Wirtszelle wird durch VP4 eingeleitet, das sich an Moleküle, sogenannte Glykane, auf der Zelloberfläche anlagert. Das Virus dringt durch rezeptorvermittelte Endozytose in die Zellen ein und bildet ein Vesikel, das als Endosom bezeichnet wird. Proteine in der dritten Schicht (VP7 und der VP4-Spike) stören die Membran des Endosoms, wodurch ein Unterschied in der Kalziumkonzentration entsteht. Dies führt zum Zerfall der VP7-Trimere in einzelne Proteinuntereinheiten, wobei die VP2- und VP6-Proteinhüllen um die virale dsRNA zurückbleiben und ein doppellagiges Partikel (DLP) bilden. ⓘ
Die elf dsRNA-Stränge verbleiben im Schutz der beiden Proteinhüllen und die virale RNA-abhängige RNA-Polymerase erzeugt mRNA-Transkripte des doppelsträngigen viralen Genoms. Indem die virale RNA im Kern verbleibt, entgeht sie den Reaktionen des angeborenen Wirtsimmunsystems, einschließlich der RNA-Interferenz, die durch das Vorhandensein von doppelsträngiger RNA ausgelöst wird. ⓘ
Während der Infektion produzieren die Rotaviren mRNA sowohl für die Proteinbiosynthese als auch für die Genreplikation. Die meisten Rotavirus-Proteine reichern sich im Viroplasma an, wo die RNA repliziert wird und die DLPs zusammengebaut werden. Im Viroplasma sind die viralen Positiv-Sinn-RNAs, die als Vorlagen für die Synthese viraler genomischer dsRNA verwendet werden, vor siRNA-induziertem RNase-Abbau geschützt. Das Viroplasma bildet sich bereits zwei Stunden nach der Virusinfektion um den Zellkern und besteht aus viralen Fabriken, die vermutlich von zwei viralen Nichtstrukturproteinen gebildet werden: NSP5 und NSP2. Die Hemmung von NSP5 durch RNA-Interferenz in vitro führt zu einem starken Rückgang der Replikation des Rotavirus. Die DLPs wandern zum endoplasmatischen Retikulum, wo sie ihre dritte, äußere Schicht (bestehend aus VP7 und VP4) erhalten. Die Nachkommenviren werden durch Lyse aus der Zelle freigesetzt. ⓘ
Übertragung

Rotaviren werden über den fäkal-oralen Weg, über den Kontakt mit kontaminierten Händen, Oberflächen und Gegenständen sowie möglicherweise über die Atemwege übertragen. Virale Diarrhöe ist hoch ansteckend. Die Fäkalien einer infizierten Person können mehr als 10 Billionen infektiöse Partikel pro Gramm enthalten; weniger als 100 dieser Partikel sind erforderlich, um eine Infektion auf eine andere Person zu übertragen. ⓘ
Rotaviren sind in der Umwelt stabil und wurden in Flussmündungsproben in Mengen von bis zu 1-5 infektiösen Partikeln pro US-Gallone gefunden. Die Viren überleben zwischen 9 und 19 Tagen. Hygienemaßnahmen, die zur Beseitigung von Bakterien und Parasiten geeignet sind, scheinen bei der Bekämpfung des Rotavirus unwirksam zu sein, da die Inzidenz von Rotavirus-Infektionen in Ländern mit hohen und niedrigen Gesundheitsstandards ähnlich ist. ⓘ
Anzeichen und Symptome
Die Rotavirus-Enteritis ist eine leichte bis schwere Erkrankung, die durch Übelkeit, Erbrechen, wässrigen Durchfall und leichtes Fieber gekennzeichnet ist. Sobald sich ein Kind mit dem Virus infiziert hat, beträgt die Inkubationszeit etwa zwei Tage, bevor Symptome auftreten. Die Krankheitsphase ist akut. Die Symptome beginnen oft mit Erbrechen, gefolgt von vier bis acht Tagen mit heftigem Durchfall. Dehydrierung ist bei Rotavirus-Infektionen häufiger als bei den meisten durch bakterielle Erreger verursachten Infektionen und ist die häufigste Todesursache im Zusammenhang mit einer Rotavirus-Infektion. ⓘ
Infektionen mit dem Rotavirus A können während des gesamten Lebens auftreten: Die erste Infektion führt in der Regel zu Symptomen, aber nachfolgende Infektionen verlaufen in der Regel mild oder asymptomatisch, da das Immunsystem einen gewissen Schutz bietet. Folglich ist die Rate der symptomatischen Infektionen bei Kindern unter zwei Jahren am höchsten und nimmt bis zum Alter von 45 Jahren allmählich ab. Die schwersten Symptome treten tendenziell bei Kindern im Alter von sechs Monaten bis zwei Jahren, bei älteren Menschen und bei Personen mit Immunschwäche auf. Aufgrund der in der Kindheit erworbenen Immunität sind die meisten Erwachsenen nicht anfällig für das Rotavirus; die Gastroenteritis bei Erwachsenen hat in der Regel eine andere Ursache als das Rotavirus, aber asymptomatische Infektionen bei Erwachsenen können die Übertragung der Infektion in der Gemeinschaft aufrechterhalten. Es gibt einige Hinweise darauf, dass die Blutgruppe einen Einfluss auf die Anfälligkeit für eine Infektion mit Rotaviren haben kann. ⓘ
Krankheitsmechanismen

Rotaviren vermehren sich hauptsächlich im Darm und infizieren Enterozyten in den Dünndarmzotten, was zu strukturellen und funktionellen Veränderungen des Epithels führt. Beim Menschen und insbesondere in Tiermodellen gibt es Hinweise auf eine extraintestinale Verbreitung des infektiösen Virus in andere Organe und Makrophagen. ⓘ
Die Diarrhöe wird durch mehrere Aktivitäten des Virus verursacht. Durch die Zerstörung von Darmzellen, den so genannten Enterozyten, kommt es zu einer Malabsorption. Das toxische Rotavirus-Protein NSP4 induziert die alters- und kalziumionenabhängige Chloridsekretion, stört die durch den SGLT1-Transporter (Natrium/Glukose-Cotransporter 2) vermittelte Wasserrückresorption, reduziert offenbar die Aktivität der Disaccharidasen der Bürstengrenzmembran und aktiviert die kalziumionenabhängigen Sekretionsreflexe des enterischen Nervensystems. Die erhöhte Kalziumionenkonzentration im Zytosol (die für die Bildung der Nachkommenviren erforderlich ist) wird durch NSP4 erreicht, das als Viroporin wirkt. Dieser Anstieg der Kalziumionen führt zur Autophagie (Selbstzerstörung) der infizierten Enterozyten. ⓘ
NSP4 wird auch sezerniert. Diese extrazelluläre Form, die durch Protease-Enzyme im Darm modifiziert wird, ist ein Enterotoxin, das über Integrin-Rezeptoren auf nicht infizierte Zellen wirkt, die wiederum einen Anstieg der intrazellulären Kalziumionenkonzentration, sekretorischen Durchfall und Autophagie verursachen. ⓘ
Das Erbrechen, das für die rotavirale Enteritis charakteristisch ist, wird durch die Infektion der enterochromaffinen Zellen in der Auskleidung des Verdauungstrakts durch das Virus verursacht. Die Infektion stimuliert die Produktion von 5'-Hydroxytryptamin (Serotonin). Dadurch werden vagale afferente Nerven aktiviert, die wiederum die Zellen des Hirnstamms aktivieren, die den Brechreflex steuern. ⓘ
Gesunde Enterozyten sezernieren Laktase in den Dünndarm; Milchunverträglichkeit aufgrund von Laktasemangel ist ein Symptom der Rotavirusinfektion, das über Wochen anhalten kann. Nach der Wiederaufnahme von Milch in die Ernährung des Kindes kommt es häufig zu einem erneuten Auftreten von leichtem Durchfall, der auf die bakterielle Fermentierung des Zweifachzuckers Laktose im Darm zurückzuführen ist. ⓘ
Immunreaktionen
Spezifische Reaktionen
Rotaviren lösen sowohl B- als auch T-Zellen-Immunreaktionen aus. Antikörper gegen die VP4- und VP7-Proteine des Rotavirus neutralisieren die virale Infektiosität in vitro und in vivo. Es werden spezifische Antikörper der Klassen IgM, IgA und IgG gebildet, die nachweislich vor einer Rotavirus-Infektion durch passive Übertragung der Antikörper auf andere Tiere schützen. Mütterliches trans-plazentares IgG könnte eine Rolle beim Schutz von Neugeborenen vor Rotavirus-Infektionen spielen, andererseits aber auch die Wirksamkeit des Impfstoffs verringern. ⓘ
Angeborene Reaktionen
Nach einer Infektion mit Rotaviren kommt es zu einer raschen angeborenen Immunreaktion, an der Interferone vom Typ I und III und andere Zytokine (insbesondere Th1 und Th2) beteiligt sind, die die Replikation des Virus hemmen und Makrophagen und natürliche Killerzellen an die mit dem Rotavirus infizierten Zellen heranführen. Die dsRNA des Rotavirus aktiviert Mustererkennungsrezeptoren wie Toll-like-Rezeptoren, die die Produktion von Interferonen anregen. Das Rotavirus-Protein NSP1 wirkt den Wirkungen der Typ-1-Interferone entgegen, indem es die Aktivität der Interferon-regulierenden Proteine IRF3, IRF5 und IRF7 unterdrückt. ⓘ
Marker für den Schutz
Die Konzentrationen von IgG und IgA im Blut und IgA im Darm korrelieren mit dem Schutz vor einer Infektion. Rotavirus-spezifisches Serum-IgG und -IgA in hohen Titern (z. B. >1:200) sollen schützend wirken, und es besteht ein signifikanter Zusammenhang zwischen IgA-Titern und der Wirksamkeit von Rotavirus-Impfstoffen. ⓘ
Diagnose und Nachweis
Die Diagnose einer Rotavirus-Infektion folgt in der Regel auf die Diagnose einer Gastroenteritis als Ursache für schweren Durchfall. Die meisten Kinder, die mit Gastroenteritis ins Krankenhaus eingeliefert werden, werden auf Rotavirus A getestet. Die spezifische Diagnose einer Infektion mit Rotavirus A wird durch den Nachweis des Virus im Stuhl des Kindes mittels Enzymimmunoassay gestellt. Es gibt mehrere zugelassene Testkits auf dem Markt, die empfindlich und spezifisch sind und alle Serotypen von Rotavirus A nachweisen. Andere Methoden wie die Elektronenmikroskopie und die PCR (Polymerase-Kettenreaktion) werden in Forschungslabors eingesetzt. Mit der reversen Transkriptions-Polymerase-Kettenreaktion (RT-PCR) können alle Spezies und Serotypen der humanen Rotaviren nachgewiesen und identifiziert werden. ⓘ
Behandlung und Prognose
Die Behandlung einer akuten Rotavirus-Infektion ist unspezifisch und umfasst die Behandlung der Symptome und vor allem die Behandlung der Dehydrierung. Unbehandelt können Kinder an der daraus resultierenden schweren Dehydrierung sterben. Je nach Schwere des Durchfalls besteht die Behandlung aus einer oralen Rehydratationstherapie, bei der das Kind zusätzliches Wasser mit einem bestimmten Salz- und Zuckergehalt zu trinken bekommt. Im Jahr 2004 empfahlen die Weltgesundheitsorganisation (WHO) und UNICEF die Verwendung einer niedrigosmolaren oralen Rehydratationslösung und eine Zinkergänzung als zweigleisige Behandlung der akuten Diarrhöe. Einige Infektionen sind so schwerwiegend, dass sie einen Krankenhausaufenthalt rechtfertigen, bei dem die Flüssigkeitszufuhr über eine intravenöse Therapie oder eine nasogastrale Intubation erfolgt und die Elektrolyte und der Blutzucker des Kindes überwacht werden. Rotavirus-Infektionen führen nur selten zu anderen Komplikationen, und bei einem gut behandelten Kind ist die Prognose ausgezeichnet. Probiotika verkürzen nachweislich die Dauer der Rotavirus-Diarrhöe, und laut der Europäischen Gesellschaft für Pädiatrische Gastroenterologie "gehören zu den wirksamen Maßnahmen die Verabreichung spezifischer Probiotika wie Lactobacillus rhamnosus oder Saccharomyces boulardii, Diosmectit oder Racecadotril." ⓘ
Vorbeugung
Rotaviren sind hoch ansteckend und können nicht mit Antibiotika oder anderen Medikamenten behandelt werden. Da verbesserte sanitäre Verhältnisse die Prävalenz von Rotaviruserkrankungen nicht verringern und die Zahl der Krankenhausaufenthalte trotz des Einsatzes oraler Rehydrierungsmedikamente hoch bleibt, besteht die wichtigste Maßnahme der öffentlichen Gesundheit in der Impfung. Im Jahr 1998 wurde in den Vereinigten Staaten ein Impfstoff gegen Rotaviren zur Verwendung zugelassen. Klinische Studien in den Vereinigten Staaten, Finnland und Venezuela hatten ergeben, dass der Impfstoff eine 80- bis 100-prozentige Wirksamkeit bei der Vorbeugung schwerer, durch das Rotavirus A verursachter Durchfälle hat, und die Forscher hatten keine statistisch signifikanten schwerwiegenden unerwünschten Wirkungen festgestellt. Der Hersteller zog den Impfstoff jedoch 1999 vom Markt zurück, nachdem sich herausstellte, dass der Impfstoff bei einem von 12 000 geimpften Säuglingen zu einem erhöhten Risiko für Darmverschluss (Intussuszeption) beigetragen haben könnte. Diese Erfahrung löste eine intensive Debatte über die relativen Risiken und Vorteile eines Rotavirus-Impfstoffs aus. Im Jahr 2006 erwiesen sich zwei neue Impfstoffe gegen die Rotavirus-A-Infektion bei Kindern als sicher und wirksam, und 2009 empfahl die WHO, den Rotavirus-Impfstoff in alle nationalen Impfprogramme aufzunehmen. ⓘ
Die Inzidenz und der Schweregrad von Rotavirus-Infektionen sind in den Ländern, die diese Empfehlung befolgt haben, deutlich zurückgegangen. Eine 2014 durchgeführte Überprüfung verfügbarer klinischer Studiendaten aus Ländern, die routinemäßig Rotavirus-Impfstoffe in ihren nationalen Immunisierungsprogrammen verwenden, ergab, dass Rotavirus-Impfstoffe die Zahl der Rotavirus-Krankenhausaufenthalte um 49-92 Prozent und die Zahl der Krankenhausaufenthalte wegen Durchfallerkrankungen aller Art um 17-55 Prozent reduziert haben. In Mexiko, das 2006 zu den ersten Ländern der Welt gehörte, die einen Rotavirus-Impfstoff einführten, sank die Zahl der Todesfälle durch Durchfallerkrankungen während der Rotavirus-Saison 2009 um mehr als 65 Prozent bei Kindern unter zwei Jahren. In Nicaragua, das 2006 als erstes Entwicklungsland einen Rotavirus-Impfstoff einführte, gingen schwere Rotavirus-Infektionen um 40 Prozent und die Besuche in der Notaufnahme um die Hälfte zurück. In den Vereinigten Staaten hat die Rotavirus-Impfung seit 2006 zu einem Rückgang der rotavirusbedingten Krankenhausaufenthalte um bis zu 86 Prozent geführt. Die Impfstoffe haben möglicherweise auch Krankheiten bei nicht geimpften Kindern verhindert, indem sie die Zahl der zirkulierenden Infektionen begrenzt haben. In Entwicklungsländern in Afrika und Asien, wo die meisten Todesfälle durch Rotaviren auftreten, haben zahlreiche Sicherheits- und Wirksamkeitsstudien sowie jüngste Studien zu den Auswirkungen und der Wirksamkeit von Rotarix und RotaTeq nach der Einführung gezeigt, dass die Impfstoffe die Zahl der schweren Erkrankungen bei Säuglingen drastisch reduzieren. Im September 2013 wurde der Impfstoff allen Kindern im Alter von zwei bis drei Monaten im Vereinigten Königreich angeboten. Es wird erwartet, dass er die Fälle von schweren Infektionen halbiert und die Zahl der Kinder, die aufgrund der Infektion ins Krankenhaus eingeliefert werden, um 70 Prozent reduziert. In Europa ist die Zahl der Krankenhauseinweisungen nach einer Infektion mit Rotaviren nach Einführung des Impfstoffs um 65 % bis 84 % zurückgegangen. Weltweit hat die Impfung die Zahl der Krankenhauseinweisungen und der Besuche in der Notaufnahme um durchschnittlich 67 % verringert. ⓘ
Rotavirus-Impfstoffe sind in über 100 Ländern zugelassen, und mehr als 80 Länder haben eine routinemäßige Rotavirus-Impfung eingeführt, fast die Hälfte mit Unterstützung der GAVI-Impfstoffallianz. Um Rotavirus-Impfstoffe in allen Ländern verfügbar, zugänglich und erschwinglich zu machen - insbesondere in Ländern mit niedrigem und mittlerem Einkommen in Afrika und Asien, wo die meisten Todesfälle durch Rotaviren auftreten -, haben sich PATH (ehemals Program for Appropriate Technology in Health), die WHO, die U.S. Centers for Disease Control and Prevention und GAVI mit Forschungseinrichtungen und Regierungen zusammengetan, um Erkenntnisse zu gewinnen und zu verbreiten, Preise zu senken und die Einführung zu beschleunigen. ⓘ
Der Impfstoff kann Typ-1-Diabetes verhindern. ⓘ
Epidemiologie
Das Rotavirus A, das für mehr als 90 % der Rotavirus-Gastroenteritis beim Menschen verantwortlich ist, ist weltweit endemisch. Jedes Jahr verursachen Rotaviren in den Entwicklungsländern Millionen von Durchfallerkrankungen, von denen fast 2 Millionen zu einer Krankenhauseinweisung führen. Im Jahr 2019 starben schätzungsweise 151.714 Kinder unter fünf Jahren an Rotavirus-Infektionen, 90 Prozent davon in Entwicklungsländern. Fast jedes Kind hat sich im Alter von fünf Jahren mit Rotaviren infiziert. Rotaviren sind die Hauptursache für schwere Durchfälle bei Säuglingen und Kindern, sie sind für etwa ein Drittel der Fälle verantwortlich, die einen Krankenhausaufenthalt erfordern, und verursachen 37 % der Todesfälle, die auf Durchfall zurückzuführen sind, sowie 5 % aller Todesfälle bei Kindern unter fünf Jahren. Jungen werden doppelt so häufig wie Mädchen wegen Rotavirus-Infektionen ins Krankenhaus eingeliefert. In der Zeit vor der Impfung traten Rotavirus-Infektionen hauptsächlich in kühlen, trockenen Jahreszeiten auf. Die Zahl der auf Lebensmittelkontaminationen zurückzuführenden Infektionen ist unbekannt. ⓘ
Ausbrüche von Rotavirus-A-Durchfall sind bei hospitalisierten Säuglingen, Kleinkindern, die Kindertagesstätten besuchen, und älteren Menschen in Pflegeheimen häufig. Im Jahr 1981 kam es in Colorado zu einem Ausbruch, der durch verunreinigtes Stadtwasser verursacht wurde. Im Jahr 2005 ereignete sich in Nicaragua die größte jemals registrierte Durchfall-Epidemie. Dieser ungewöhnlich große und schwere Ausbruch wurde mit Mutationen im Genom des Rotavirus A in Verbindung gebracht, die dem Virus möglicherweise halfen, der in der Bevölkerung vorherrschenden Immunität zu entgehen. Ein ähnlich großer Ausbruch ereignete sich 1977 in Brasilien. ⓘ
Das Rotavirus B, auch Rotavirus des Erwachsenendurchfalls oder ADRV genannt, hat in China große Epidemien mit schwerem Durchfall verursacht, an denen Tausende von Menschen aller Altersgruppen erkrankten. Diese Epidemien sind auf eine Verunreinigung des Trinkwassers durch Abwässer zurückzuführen. Rotavirus-B-Infektionen traten 1998 auch in Indien auf; der verursachende Stamm wurde CAL genannt. Im Gegensatz zum ADRV ist der CAL-Stamm endemisch. Bislang beschränken sich die durch Rotavirus B verursachten Epidemien auf das chinesische Festland, und Erhebungen deuten darauf hin, dass in den Vereinigten Staaten keine Immunität gegen diese Art besteht. Rotavirus C wurde mit seltenen und sporadischen Fällen von Durchfall bei Kindern in Verbindung gebracht, und es kam zu kleinen Ausbrüchen in Familien. ⓘ
Vermeidbare Todesfälle bei Kindern durch Rotavirus-Impfung, 2016. Jährliche Zahl der vermeidbaren Todesfälle bei Kindern unter fünf Jahren durch Rotavirus, wenn eine vollständige Abdeckung mit dem Rotavirus-Impfstoff erreicht würde. ⓘ
Andere Tiere
Rotaviren infizieren die Jungtiere vieler Tierarten und sind eine der Hauptursachen für Durchfallerkrankungen bei Wild- und Zuchttieren weltweit. Als Krankheitserreger bei Nutztieren, insbesondere bei jungen Kälbern und Ferkeln, verursachen Rotaviren den Landwirten wirtschaftliche Verluste aufgrund der Behandlungskosten in Verbindung mit einer hohen Morbiditäts- und Mortalitätsrate. Diese Rotaviren sind ein potenzielles Reservoir für den genetischen Austausch mit menschlichen Rotaviren. Es gibt Hinweise darauf, dass tierische Rotaviren den Menschen infizieren können, entweder durch direkte Übertragung des Virus oder indem sie ein oder mehrere RNA-Segmente zu Reassortanten mit menschlichen Stämmen beisteuern. ⓘ
Geschichte

1943 wiesen Jacob Light und Horace Hodes nach, dass ein filtrierbarer Erreger in den Fäkalien von Kindern mit infektiösem Durchfall auch bei Rindern Kolik (Viehdurchfall) verursacht. Drei Jahrzehnte später stellte sich heraus, dass es sich bei den konservierten Proben des Erregers um das Rotavirus handelte. In den dazwischen liegenden Jahren wurde ein Virus bei Mäusen nachgewiesen, das mit dem Virus verwandt ist, das den Durchfall verursacht. 1973 beschrieben Ruth Bishop und Kollegen verwandte Viren, die bei Kindern mit Gastroenteritis gefunden wurden. ⓘ
1974 schlug Thomas Henry Flewett den Namen Rotavirus vor, nachdem er beobachtet hatte, dass ein Rotaviruspartikel unter dem Elektronenmikroskop wie ein Rad (lat. rota) aussieht. Vier Jahre später wurde der Name vom Internationalen Komitee für Taxonomie der Viren offiziell anerkannt. Im Jahr 1976 wurden verwandte Viren bei mehreren anderen Tierarten beschrieben. Diese Viren, die alle eine akute Gastroenteritis verursachen, wurden als kollektiver Krankheitserreger anerkannt, der Menschen und andere Tiere weltweit befällt. Rotavirus-Serotypen wurden erstmals 1980 beschrieben, und im folgenden Jahr wurden Rotaviren vom Menschen erstmals in Zellkulturen aus Affennieren gezüchtet, indem man dem Kulturmedium Trypsin (ein Enzym, das im Zwölffingerdarm von Säugetieren vorkommt und von dem man heute weiß, dass es für die Replikation von Rotaviren unerlässlich ist) zusetzte. Die Möglichkeit, Rotaviren in Kulturen zu züchten, beschleunigte die Forschung, und Mitte der 1980er Jahre wurden die ersten Impfstoffkandidaten untersucht. ⓘ
Genom
Systematik


Einen ähnlichen Aufbau mit zwei konzentrischen Schalen haben auch die Viren der Gattungen Coltivirus und Orbivirus (letztere beispielsweise mit Spezies Blauzungenvirus), beide in derselben Unterfamilie Sedoreovirinae. ⓘ
Die Gattung Rotavirus wird derzeit in 9 Spezies (A-J) eingeteilt. Spezies E wurde noch nicht als eigenständige Spezies bestätigt. Als eines der wichtigsten Definitionskriterien einer Rotavirus-Spezies gilt, dass nur zwischen den Subtypen ein Reassortment stattfinden kann, nicht jedoch zwischen einzelnen Spezies. Sie bilden somit einen einheitlichen Genpool, der mittels Antigenshift und Antigendrift neue Subtypen bilden kann. Bei Sequenzvergleichen des Coreproteins VP2 erscheinen die Spezies Rotavirus A und C als eng verwandt, während Rotavirus B deutliche Sequenzunterschiede aufweist. ⓘ
- Gattung Rotavirus
- Spezies Rotavirus A
- Subtyp Simianes Rotavirus A
- Subtyp Aviäres Rotavirus A
- Subtyp Bovines Rotavirus A
- Subtyp Porcines Rotavirus A
- Subtyp Caprines Rotavirus A
- Subtyp Equines Rotavirus A
- Subtyp Humanes Rotavirus A
- Subtyp Lapines Rotavirus A
- Subtyp Kaninchen-Rotavirus
- Vorläufige Subtypen der Spezies:
- Subtyp Rotavirus der Lämmer
- Subtyp Canines Rotavirus
- Subtyp Rhesus-Rotavirus ⓘ
- Spezies Rotavirus B
- Subtyp (Serogruppe) Bovines Rotavirus B
- Subtyp Humanes Rotavirus B ⓘ
- Spezies Rotavirus C
- Subtyp Humanes Rotavirus C ⓘ
- Spezies Rotavirus D
- Subtyp Hühner-Rotavirus D ⓘ
- Spezies Rotavirus E *
- Subtyp Porcines Rotavirus E ⓘ
- Spezies Rotavirus F
- Subtyp Hühner-Rotavirus F ⓘ
- Spezies Rotavirus G
- Subtyp Hühner-Rotavirus G ⓘ
- Spezies Rotavirus H ⓘ
- Spezies Rotavirus I
- Spezies Rotavirus J ⓘ