Glutamin
 Skelettformel von L-Glutamin
| |||
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Glutamin
| |||
| Andere Namen
L-Glutamin
(Levo)Glutamid 2,5-Diamino-5-oxopentansäure 2-Amino-4-carbamoylbutansäure Endari | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
| ||
| Abkürzungen | Gln, Q | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| EC-Nummer |
| ||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C5H10N2O3 | ||
| Molekulare Masse | 146,146 g-mol-1 | ||
| Schmelzpunkt | zersetzt sich bei 185°C | ||
Löslichkeit in Wasser
|
löslich | ||
| Acidität (pKa) | 2,2 (Carboxyl), 9,1 (Amino) | ||
Chirale Drehung ([α]D)
|
+6,5º (H2O, c = 2) | ||
| Pharmakologie | |||
ATC-Code
|
A16AA03 (WHO) | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Referenzen in der Infobox
| |||
| Klinische Daten | |
|---|---|
| Handelsnamen | Endari, Nutrestore |
| AHFS/Drugs.com | Monographie |
| MedlinePlus | a617035 |
| Lizenz-Daten |
|
| Wege der Verabreichung | Durch den Mund |
| Klasse von Medikamenten | Gastrointestinales Mittel |
| ATC-Code |
|
| Rechtlicher Status | |
| Rechtlicher Status |
|
| Bezeichner | |
IUPAC-Bezeichnung
| |
| CAS-Nummer | |
| PubChem CID | |
| Arzneimittelbank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| PDB-Ligand |
|
| Chemische und physikalische Daten | |
| Formel | C5H10N2O3 |
| Molekulare Masse | 146,15 g-mol-1 |
| 3D-Modell (JSmol) | |
SMILES
| |
InChI
| |
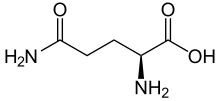
Glutamin (Symbol Gln oder Q) ist eine α-Aminosäure, die in der Biosynthese von Proteinen verwendet wird. Ihre Seitenkette ähnelt der von Glutaminsäure, allerdings ist die Carbonsäuregruppe durch ein Amid ersetzt. Sie wird als ladungsneutrale, polare Aminosäure eingestuft. Sie ist für den Menschen nicht essentiell und bedingt essentiell, d. h. der Körper kann sie normalerweise in ausreichender Menge selbst synthetisieren, aber in bestimmten Stresssituationen steigt der Bedarf des Körpers an Glutamin und Glutamin muss über die Nahrung zugeführt werden. Es wird durch die Codons CAA und CAG kodiert. ⓘ
Im menschlichen Blut ist Glutamin die am häufigsten vorkommende freie Aminosäure. ⓘ
Zu den Nahrungsquellen für Glutamin gehören vor allem eiweißreiche Lebensmittel wie Rindfleisch, Huhn, Fisch, Milchprodukte, Eier, Gemüse wie Bohnen, Rüben, Kohl, Spinat, Karotten, Petersilie, Gemüsesäfte und auch Weizen, Papaya, Rosenkohl, Sellerie, Grünkohl und fermentierte Lebensmittel wie Miso. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
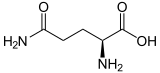
| Struktur von L-Glutamin, dem natürlich vorkommenden Enantiomer | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glutamin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H10N2O3 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 146,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
(Zersetzung) 185–186 °C | ||||||||||||||||||
| pKS-Wert |
| ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
7500 mg·kg−1 (LD50, Ratte, oral) | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Funktionen
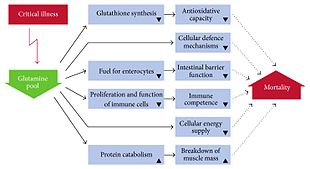
Mit einem Mengenanteil von 20 % ist Glutamin Hauptbestandteil des Pools an freien Aminosäuren im Blutplasma (400–600 µmol/l). Glutamin kommt in der höchsten Konzentration in den Muskelzellen (ca. 35 mmol/l) vor, die dieses auch hauptsächlich synthetisieren. Es ist unter anderem für die Wassereinlagerung in die Zelle verantwortlich und bewirkt bei körperlicher Belastung eine Vergrößerung des Zellvolumens, was als anaboles, die Proliferation unterstützendes Signal zu betrachten ist. Das heißt, die Protein- und Glykogenbildung wird gefördert. ⓘ
Hyperkatabole und hypermetabole Krankheitszustände gehen mit einer deutlichen Glutaminverarmung im Blut und in der Muskulatur einher, ohne dass reaktiv die Glutaminsynthese gesteigert wird. Charakteristisch für die Reaktion auf ein Trauma oder eine Infektion ist die Reduktion freien Glutamins in der Muskulatur um etwa 50 %. Dieser Verlust intrazellulären Glutamins wurde sowohl nach selektiven Operationen, Polytraumen und Verbrennungen als auch bei Infektionen und Pankreatitis unabhängig von der Ernährung festgestellt. Glutamin stellt nicht nur einen Baustein für die Proteinsynthese, sondern u. a. auch für die Zellen des Gastrointestinaltraktes (Enterozyten, Kolonozyten) und für Leberzellen ein wichtiges Substrat dar. Daraus wurde die These entwickelt, dass Glutamin eine bedingt essentielle Aminosäure sei, die besonders bei schweren Erkrankungen notwendig ist. Entsprechend entstand die Hypothese, dass eine Glutamin-Supplementierung bei schwerkranken Patienten zu einem besseren Ergebnis führen würde. ⓘ
Hingegen zeigte eine internationale multizentrische randomisierte Doppelblindstudie an über 1200 schwerkranken mechanisch beatmeten Intensivpatienten mit Multiorganversagen, die in der Verumgruppe sowohl enteral als auch parenteral Glutamin erhielten, eine signifikant erhöhte Mortalität von 32,4 % (Placebo 27,2 %) mit einem adjustierten Risikofaktor von 1,09 nach 28 Tagen. Auch nach sechs Monaten war die Mortalität unter Glutaminbehandlung signifikant höher, jedoch hatte Glutamin keinen Einfluss auf das Organversagen oder die Infektionsrate. Somit erscheint eine Glutamin-Substitution in der Intensivmedizin obsolet, und in einem Kommentar wird sogar von einer „Glutamintoxizität“ gesprochen. Der verminderte Glutaminspiegel bei schwerkranken Patienten könnte somit weniger eine Folge eines Mangels als vielmehr ein positiver Adaptationsmechanismus sein. ⓘ
Glutamin spielt eine Rolle bei einer Vielzahl biochemischer Funktionen:
- Proteinsynthese, wie jede andere der 20 proteinogenen Aminosäuren
- Lipidsynthese, insbesondere bei Krebszellen.
- Regulierung des Säure-Basen-Gleichgewichts in der Niere durch Bildung von Ammonium
- Zellenergie, als Quelle neben Glukose
- Stickstoffspende für viele anabole Prozesse, einschließlich der Synthese von Purinen
- Kohlenstoffspende als Quelle zur Auffüllung des Zitronensäurezyklus
- Ungiftiger Transporter von Ammoniak in den Blutkreislauf.
- Integrität der gesunden Darmschleimhaut, obwohl kleine randomisierte Studien keinen Nutzen bei Morbus Crohn gezeigt haben. ⓘ
Rolle im Stoffwechsel und bei Krebs
Für die Zellkultur vieler Tumorzellen ist Glutamin in hohem Überschuss notwendig. Wie bereits oben erwähnt hat das menschliche Blut eine Konzentration von 500 bis 900 µmol/l Glutamin, in der Zellkultur wird allerdings meist mit 2000–4000 µmol/l gearbeitet. Das liegt daran, dass viele Arten von Tumorzellen wesentlich mehr Glutamin aufnehmen und verstoffwechseln als normale Körperzellen. Über die Gründe wird in der wissenschaftlichen Literatur zurzeit viel diskutiert. Als eine mögliche Ursache für die erhöhte Glutaminaufnahme und -abhängigkeit von Tumoren wird von verschiedenen Autoren die erhöhte Expression des Onkogens myc vorgeschlagen. Aufgrund dieser Abhängigkeit werden und wurden verschiedene Glutaminanaloga wie DON, Azaserin oder Acivicin zur Behandlung verschiedener solider Tumoren getestet. ⓘ
Krebszellen sind auf den Glutaminstoffwechsel als Kohlenstoff- und Stickstoffquelle angewiesen. Der Glutamingehalt im Blutserum ist der höchste unter den anderen Aminosäuren und ist für viele Zellfunktionen unerlässlich. ⓘ
Studien haben auf die Bedeutung von Glutamin bei bestimmten Tumoren hingewiesen. So wurde beispielsweise berichtet, dass die Hemmung des Glutamin-Stoffwechsels das Wachstum verschiedener Tumore wie Brust-, Leber-, Nieren- und T-Zellen-Lymphoblasten-Leukämie verhindert. ⓘ
Vorläufer
Glutamin hält das Redoxgleichgewicht aufrecht, indem es an der Glutathionsynthese beteiligt ist und durch reduktive Carboxylierung zu anabolen Prozessen wie der Lipidsynthese beiträgt. ⓘ
Glutamin bewahrt auch die Verfügbarkeit von Stickstoff für die Synthese von Nukleotiden und nicht-essentiellen Aminosäuren. Eine der wichtigsten Funktionen von Glutamin ist seine Fähigkeit, in α-KG umgewandelt zu werden, das dazu beiträgt, den Fluss des Tricarbonsäurezyklus aufrechtzuerhalten und ATPs zu erzeugen. ⓘ
Funktion im Nervensystem
Glutamin ist chemisch eng verwandt mit der exzitatorischen Aminosäure Glutaminsäure (häufig wird nur von der ionisierten Form, dem Glutamat, gesprochen), die als Neurotransmitter bei glutamatergen Synapsen im zentralen Nervensystem vorkommt. An diesen Synapsen wird ein Teil des Glutamats nach der Ausschüttung in den synaptischen Spalt in benachbarte Gliazellen aufgenommen. Um das aufgenommene Glutamat zurück in die präsynaptischen Neuronen zu transportieren, wird es in den Gliazellen in Glutamin umgewandelt, da Glutamin keine exzitatorische Auswirkung auf die postsynaptische Membran aufweist. In den Neuronen wird Glutamin dann wieder in Glutamat umgewandelt. ⓘ
Polyglutamin
Eine Reihe wichtiger Proteine beinhalten Polyglutamin-Einheiten, das heißt längere, sich wiederholende Glutamin-Glutamin-Verknüpfungen. Beispiel dafür sind das FOXP2-Protein oder das die Chorea Huntington auslösende Huntingtin. Im Huntingtin bewirkt eine durch eine autosomal-dominante Mutation bedingte Verlängerung der Polyglutamin-Einheit das Ausbrechen der Krankheit. ⓘ
Herstellung
Glutamin wird industriell mit Mutanten von Brevibacterium flavum hergestellt, die mit Glukose als Kohlenstoffquelle ca. 40 g/L in 2 Tagen liefern. Glutamin wird durch das Enzym Glutaminsynthetase aus Glutamat und Ammoniak synthetisiert. Das wichtigste glutaminproduzierende Gewebe ist die Muskelmasse, auf die etwa 90 % des gesamten synthetisierten Glutamins entfallen. In geringen Mengen wird Glutamin auch von der Lunge und dem Gehirn freigesetzt. Obwohl die Leber in der Lage ist, Glutamin zu synthetisieren, ist ihre Rolle im Glutamin-Stoffwechsel eher regulierend als produzierend, da die Leber große Mengen von Glutamin aus dem Darm aufnimmt. ⓘ
Großtechnisch wird L-Glutamin fermentativ hergestellt. ⓘ
Verbraucher
Die eifrigsten Verbraucher von Glutamin sind die Zellen des Darms, die Nierenzellen für den Säure-Basen-Haushalt, aktivierte Immunzellen und viele Krebszellen. ⓘ
Verwendungen
Ernährung
Glutamin ist die häufigste natürlich vorkommende, nicht essentielle Aminosäure im menschlichen Körper und eine der wenigen Aminosäuren, die die Blut-Hirn-Schranke direkt überwinden können. Der Mensch erhält Glutamin durch den Abbau von Proteinen aus der Nahrung. In Zuständen, in denen Gewebe aufgebaut oder repariert wird, wie beim Wachstum von Babys oder bei der Heilung von Wunden oder schweren Krankheiten, ist Glutamin bedingt essenziell. ⓘ
Sichelzellenanämie
2017 genehmigte die US-amerikanische Food and Drug Administration (FDA) das orale L-Glutamin-Pulver, das unter dem Namen Endari vermarktet wird, zur Verringerung schwerer Komplikationen der Sichelzellenkrankheit bei Menschen ab fünf Jahren mit dieser Erkrankung. ⓘ
Die Sicherheit und Wirksamkeit von oralem L-Glutamin-Pulver wurde in einer randomisierten Studie an Personen im Alter von fünf bis 58 Jahren mit Sichelzellenanämie untersucht, die innerhalb der letzten 12 Monate vor Aufnahme in die Studie zwei oder mehr schmerzhafte Krisen hatten. Die Probanden wurden nach dem Zufallsprinzip einer Behandlung mit oralem L-Glutamin-Pulver oder Placebo zugeteilt, und die Wirkung der Behandlung wurde über 48 Wochen untersucht. Probanden, die mit oralem L-Glutamin-Pulver behandelt wurden, hatten im Durchschnitt weniger Krankenhausaufenthalte wegen Schmerzen, die mit einem parenteral verabreichten Betäubungsmittel oder Ketorolac behandelt wurden (Sichelzellenkrisen), als Probanden, die ein Placebo erhielten (Median 3 vs. Median 4), weniger Krankenhausaufenthalte wegen Sichelzellenschmerzen (Median 2 vs. Median 3) und weniger Tage im Krankenhaus (Median 6,5 Tage vs. Median 11 Tage). Bei den Probanden, die L-Glutamin-Pulver zum Einnehmen erhielten, trat auch seltener ein akutes Brustsyndrom (eine lebensbedrohliche Komplikation der Sichelzellkrankheit) auf als bei den Patienten, die ein Placebo erhielten (8,6 Prozent gegenüber 23,1 Prozent). ⓘ
Zu den häufigen Nebenwirkungen von oralem L-Glutamin-Pulver gehören Verstopfung, Übelkeit, Kopfschmerzen, Bauchschmerzen, Husten, Schmerzen in den Extremitäten, Rückenschmerzen und Brustschmerzen. ⓘ
L-Glutamin-Pulver zum Einnehmen erhielt den Orphan-Drug-Status. Die FDA erteilte die Zulassung für Endari an Emmaus Medical Inc. ⓘ
Medizinisches Lebensmittel
Glutamin wird als medizinisches Lebensmittel vermarktet und verschrieben, wenn ein Arzt der Meinung ist, dass eine Person in seiner Obhut zusätzliches Glutamin benötigt, weil der Stoffwechselbedarf über das hinausgeht, was durch körpereigene Synthese oder Ernährung gedeckt werden kann. ⓘ
Sicherheit
Glutamin ist bei Erwachsenen und bei Frühgeborenen sicher. Obwohl Glutamin zu Glutamat und Ammoniak verstoffwechselt wird, die beide neurologische Wirkungen haben, sind ihre Konzentrationen nicht stark erhöht, und es wurden keine schädlichen neurologischen Wirkungen festgestellt. Der beobachtete sichere Wert für die zusätzliche Zufuhr von L-Glutamin bei normalen, gesunden Erwachsenen liegt bei 14 g/Tag. ⓘ
Unerwünschte Wirkungen von Glutamin wurden bei Personen, die häusliche parenterale Ernährung erhalten, und bei Personen mit Leberfunktionsanomalien festgestellt. Obwohl Glutamin keine Auswirkungen auf die Vermehrung von Tumorzellen hat, ist es dennoch möglich, dass eine Glutaminergänzung bei einigen Krebsarten schädlich ist. ⓘ
Das Absetzen der Glutamin-Supplementierung bei Personen, die an einen sehr hohen Glutaminkonsum gewöhnt sind, kann einen Entzugseffekt auslösen, der das Risiko von Gesundheitsproblemen wie Infektionen oder einer gestörten Integrität des Darms erhöht. ⓘ
Struktur
Glutamin kann in zwei enantiomeren Formen vorkommen: L-Glutamin und D-Glutamin. In der Natur kommt die L-Form vor. Glutamin enthält eine α-Aminogruppe, die unter biologischen Bedingungen in der protonierten -NH3+-Form vorliegt, und eine Carbonsäuregruppe, die unter physiologischen Bedingungen in der deprotonierten -COO--Form, dem so genannten Carboxylat, vorliegt. ⓘ
Forschung
Glutamin-Mundspülungen können zur Vorbeugung von oraler Mukositis bei Patienten, die sich einer Chemotherapie unterziehen, nützlich sein, aber intravenöses Glutamin scheint nicht zur Vorbeugung von Mukositis im Magen-Darm-Trakt geeignet zu sein. ⓘ
Es wurde angenommen, dass eine Glutaminsupplementierung das Potenzial hat, Komplikationen bei schwerkranken oder abdominal operierten Menschen zu verringern, aber dies basierte auf klinischen Studien von schlechter Qualität. Eine Supplementierung scheint bei Erwachsenen oder Kindern mit Morbus Crohn oder entzündlichen Darmerkrankungen nicht sinnvoll zu sein, aber klinische Studien (Stand 2016) waren nicht aussagekräftig genug. Bei Säuglingen mit erheblichen Magen- oder Darmproblemen scheint eine Supplementierung keine Wirkung zu haben. ⓘ
Einige Sportler verwenden L-Glutamin als Ergänzung. Studien belegen die positiven Auswirkungen der chronischen oralen Verabreichung des Ergänzungsmittels auf Verletzungen und Entzündungen, die durch intensives aerobes und erschöpfendes Training ausgelöst werden, aber die Auswirkungen auf die Muskelerholung nach einem Krafttraining sind unklar. ⓘ
Enantiomere
Glutamin besitzt ein Stereozentrum, somit existieren zwei chirale Enantiomere. In den Proteinen kommt, neben anderen Aminosäuren, ausschließlich L-Glutamin [Synonym: (S)-Glutamin] peptidisch gebunden vor. Spiegelbildlich aufgebaut dazu ist das D-Glutamin [Synonym: (R)-Glutamin], das in Proteinen nicht vorkommt. Racemisches DL-Glutamin [Synonyme: (RS)-Glutamin und (±)-Glutamin] besitzt geringe Bedeutung. ⓘ
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Glutamin“ ohne weiteren Namenszusatz (Deskriptor) erwähnt wird, ist L-Glutamin gemeint. ⓘ
| Enantiomere von Glutamin ⓘ | ||
| Name | L-Glutamin | D-Glutamin |
| Andere Namen | (S)-Glutamin | (R)-Glutamin |
| Strukturformel |  |
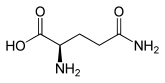
|
| CAS-Nummer | 56-85-9 | 5959-95-5 |
| 6899-04-3 (unspez.) | ||
| EG-Nummer | 200-292-1 | 673-968-0 |
| 230-006-0 (unspez.) | ||
| ECHA-Infocard | 100.000.266 | 100.199.389 |
| 100.027.278 (unspez.) | ||
| PubChem | 5961 | 145815 |
| 738 (unspez.) | ||
| DrugBank | DB00130 | DB02174 |
| − (Racemat) | ||
| FL-Nummer | 17.007 | - |
| Wikidata | Q181619 | Q27102193 |
| Q27103623 (unspez.) | ||
Vorkommen
Glutamin kommt zu durchschnittlich 3,9 % – gebunden in Proteinen – vor; auch in freier Form findet sich die Aminosäure häufig in allen Pflanzen, Tieren, Pilzen und Bakterien als zentraler Metabolit im Stoffwechsel aller Lebewesen. ⓘ
Nahrungsmittel mit hohem Glutamingehalt sind ⓘ
| Lebensmittel | Glutamin [mg/100g] ⓘ |
|---|---|
| Weizen | 4080 |
| Dinkelmehl | 5170 |
| Linsen | 4490 |
| Mungbohne | 4810 |
| Sojabohnen | 6490 |
| Erdnüsse | 5630 |
| Käse | 3050–8100 |
| Rindfleisch | 4130 |
| Hammelfleisch | 4300 |
| Schweinefleisch | 3910 |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Glutamin als Proteinbestandteil, jedoch kein freies L-Glutamin. ⓘ
Geschichte
L-Glutamin wurde 1877 erstmals beschrieben. Gemeinsam mit einem seiner Doktoranden kam Ernst Schulze zu der Schlussfolgerung, dass in den Runkelrüben die Glutaminsäure als Amid vorliegt, welches sie Glutamin nannten (analog zu Asparagin und Asparaginsäure). Kurz darauf untersuchte Ernst Schulze diese Zusammenhänge in Kürbiskeimlingen und kam zu demselben Ergebnis. Die Strukturaufklärung für Glutaminsäure / Glutamin war bereits 1872 durch den deutschen Chemiker Wilhelm Dittmar erfolgt. Dittmar war zu dieser Zeit an der agrikulturchemischen Versuchsanstalt in Bonn-Poppelsdorf unter Heinrich Ritthausen tätig, der bereits 1866 die Glutaminsäure entdeckt hatte. ⓘ
Eigenschaften
Das farblose, kristalline Glutamin ist unlöslich in Alkoholen, Benzol und Chloroform. Mäßig löslich ist es hingegen in Wasser (100 g/l bei 40 °C). ⓘ
- Van-der-Waals-Volumen: 114
- Lipidlöslichkeit: LogP = −3,5 ⓘ

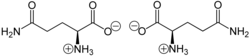
Glutamin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe wandert. ⓘ
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Zwitterion auch seine geringste Löslichkeit in Wasser hat. Sein isoelektrischer Punkt liegt bei 5,65. ⓘ
Biochemie
Für die Biosynthese inklusive Strukturformeln siehe Abschnitt Weblinks. ⓘ
L-Glutamin wird aus der L-Glutaminsäure durch die Glutamin-Synthetase hergestellt. Dabei wird Adenosintriphosphat (ATP) verbraucht. Im Körper kann L-Glutamin zu Succinat in drei Reaktionsschritten abgebaut werden. ⓘ

