Hochleistungsflüssigkeitschromatographie
 Ein HPLC-Aufbau; von links nach rechts: Eine Pumpvorrichtung, die einen Gradienten aus zwei verschiedenen Lösungsmitteln erzeugt, eine stahlverstärkte Säule und ein Detektor zur Messung der Extinktion. | |
| Akronym | HPLC |
|---|---|
| Klassifizierung | Chromatographie |
| Analyten | organische Moleküle Biomoleküle Ionen Polymere |
| Andere Techniken | |
| Verwandt | Chromatographie Wässrige Normalphasenchromatographie Hydrophile Interaktionschromatographie Ionenaustauschchromatographie Größenausschlusschromatographie Mizellare Flüssigkeitschromatographie |
| Bindestrich | Flüssigchromatographie-Massenspektrometrie |


Die Hochleistungs-Flüssigkeitschromatographie (HPLC), früher Hochdruck-Flüssigkeitschromatographie genannt, ist eine Technik der analytischen Chemie, die zur Trennung, Identifizierung und Quantifizierung der einzelnen Bestandteile eines Gemischs eingesetzt wird. Dabei wird ein unter Druck stehendes flüssiges Lösungsmittel, das die Probenmischung enthält, mit Hilfe von Pumpen durch eine Säule geleitet, die mit einem festen Adsorptionsmittel gefüllt ist. Jede Komponente in der Probe interagiert leicht unterschiedlich mit dem Adsorptionsmaterial, was zu unterschiedlichen Durchflussraten für die verschiedenen Komponenten und zur Trennung der Komponenten beim Verlassen der Säule führt. ⓘ
Die HPLC wird in der Produktion (z. B. bei der Herstellung pharmazeutischer und biologischer Produkte), im Rechtswesen (z. B. beim Nachweis leistungssteigernder Medikamente im Urin), in der Forschung (z. B. bei der Trennung der Bestandteile einer komplexen biologischen Probe oder ähnlicher synthetischer Chemikalien voneinander) und in der Medizin (z. B. beim Nachweis des Vitamin-D-Gehalts im Blutserum) eingesetzt. ⓘ
Die Chromatographie kann als ein Massenübertragungsprozess mit Adsorption beschrieben werden. Bei der HPLC werden eine unter Druck stehende Flüssigkeit und ein Probengemisch mit Hilfe von Pumpen durch eine mit einem Adsorptionsmittel gefüllte Säule geleitet, was zu einer Trennung der Probenbestandteile führt. Die aktive Komponente der Säule, das Adsorptionsmittel, ist in der Regel ein körniges Material aus festen Partikeln (z. B. Siliziumdioxid, Polymere usw.) mit einer Größe von 2-50 μm. Die Bestandteile der Probenmischung werden aufgrund ihrer unterschiedlichen Wechselwirkung mit den Adsorptionsmittelteilchen voneinander getrennt. Die unter Druck stehende Flüssigkeit ist in der Regel ein Gemisch von Lösungsmitteln (z. B. Wasser, Acetonitril und/oder Methanol) und wird als "mobile Phase" bezeichnet. Ihre Zusammensetzung und Temperatur spielen eine wichtige Rolle im Trennungsprozess, da sie die Wechselwirkungen zwischen den Probenbestandteilen und dem Adsorptionsmittel beeinflussen. Diese Wechselwirkungen sind physikalischer Natur, wie z. B. hydrophobe (dispersive), Dipol-Dipol- und ionische Wechselwirkungen, meist eine Kombination davon. ⓘ
Die HPLC unterscheidet sich von der herkömmlichen ("Niederdruck"-) Flüssigkeitschromatographie durch den wesentlich höheren Betriebsdruck (50-350 bar), während bei der herkömmlichen Flüssigkeitschromatographie in der Regel die Schwerkraft ausreicht, um die mobile Phase durch die Säule zu leiten. Aufgrund der geringen Probenmenge, die bei der analytischen HPLC aufgetrennt wird, sind die typischen Säulenabmessungen 2,1-4,6 mm Durchmesser und 30-250 mm Länge. Außerdem werden HPLC-Säulen mit kleineren Adsorbenspartikeln (2-50 μm durchschnittliche Partikelgröße) hergestellt. Dies verleiht der HPLC ein überlegenes Auflösungsvermögen (die Fähigkeit, zwischen Verbindungen zu unterscheiden) bei der Trennung von Gemischen, was sie zu einem beliebten Chromatographieverfahren macht. ⓘ
Das Schema eines HPLC-Geräts umfasst in der Regel einen Entgaser, einen Probenehmer, Pumpen und einen Detektor. Der Probenehmer bringt das Probengemisch in den Strom der mobilen Phase, die es in die Säule leitet. Die Pumpen fördern den gewünschten Fluss und die Zusammensetzung der mobilen Phase durch die Säule. Der Detektor erzeugt ein Signal, das proportional zur Menge der Probenkomponente ist, die aus der Säule austritt, und ermöglicht so eine quantitative Analyse der Probenkomponenten. Ein digitaler Mikroprozessor und eine Benutzersoftware steuern das HPLC-Gerät und ermöglichen die Datenanalyse. Einige Modelle mechanischer Pumpen in einem HPLC-Gerät können mehrere Lösungsmittel in zeitlich wechselnden Verhältnissen miteinander mischen und so einen Zusammensetzungsgradienten in der mobilen Phase erzeugen. Verschiedene Detektoren sind gebräuchlich, z. B. UV/Vis-Detektoren, Photodioden-Array-Detektoren (PDA) oder massenspektrometrische Detektoren. Die meisten HPLC-Geräte verfügen auch über einen Säulenofen, mit dem sich die Temperatur, bei der die Trennung durchgeführt wird, einstellen lässt. ⓘ
Hochleistungsflüssigkeitschromatographie (englisch high performance liquid chromatography, HPLC) – in den Anfangszeiten dieser Technik auch Hochdruckflüssigchromatographie (englisch high pressure liquid chromatography) genannt – ist eine analytische Methode in der Chemie. Die HPLC ist ein Flüssigchromatographie-Verfahren, mit dem man nicht nur Substanzen trennt, sondern diese auch über Standards identifizieren und quantifizieren (die genaue Konzentration bestimmen) kann. Im Unterschied zur Gaschromatographie, die eine sehr gute Trennmethode für verdampfbare Stoffe ist, können mittels HPLC auch nicht-flüchtige Substanzen analysiert werden. Die HPLC kann auch präparativ genutzt werden. ⓘ
HPLC wurde in den 1960er Jahren entwickelt. Zu den Pionieren zählen Joseph Jack Kirkland, Josef Franz Karl Huber, Csaba Horváth und John Calvin Giddings. ⓘ
Betrieb
Das zu trennende und zu analysierende Probengemisch wird in einem diskreten kleinen Volumen (in der Regel Mikroliter) in den Strom der mobilen Phase gegeben, der durch die Säule fließt. Die Komponenten der Probe bewegen sich mit unterschiedlichen Geschwindigkeiten durch die Säule, die von spezifischen physikalischen Wechselwirkungen mit dem Adsorptionsmittel (auch stationäre Phase genannt) abhängen. Die Geschwindigkeit jeder Komponente hängt von ihrer chemischen Beschaffenheit, von der Beschaffenheit der stationären Phase (Säule) und von der Zusammensetzung der mobilen Phase ab. Die Zeit, in der ein bestimmter Analyt eluiert (aus der Säule austritt), wird als seine Retentionszeit bezeichnet. Die unter bestimmten Bedingungen gemessene Retentionszeit ist ein identifizierendes Merkmal für einen bestimmten Analyten. ⓘ
Es gibt viele verschiedene Arten von Säulen, die mit Adsorbentien gefüllt sind, die sich in Teilchengröße, Porosität und Oberflächenchemie unterscheiden. Die Verwendung von Packungsmaterialien mit kleinerer Teilchengröße erfordert einen höheren Betriebsdruck ("Gegendruck") und verbessert in der Regel die chromatografische Auflösung (den Grad der Peak-Trennung zwischen aufeinanderfolgenden Analyten, die aus der Säule austreten). Die Sorptionsmittelpartikel können hydrophob oder polar sein. ⓘ
Als mobile Phasen werden üblicherweise alle mischbaren Kombinationen von Wasser mit verschiedenen organischen Lösungsmitteln verwendet (die häufigsten sind Acetonitril und Methanol). Bei einigen HPLC-Techniken werden wasserfreie mobile Phasen verwendet (siehe Normalphasenchromatographie unten). Die wässrige Komponente der mobilen Phase kann Säuren (wie Ameisen-, Phosphor- oder Trifluoressigsäure) oder Salze enthalten, um die Trennung der Probenbestandteile zu unterstützen. Die Zusammensetzung der mobilen Phase kann während der chromatographischen Analyse konstant gehalten ("isokratischer Elutionsmodus") oder variiert werden ("Gradientenelutionsmodus"). Die isokratische Elution ist typischerweise bei der Trennung von Probenbestandteilen wirksam, die sich in ihrer Affinität zur stationären Phase stark unterscheiden. Bei der Gradientenelution wird die Zusammensetzung der mobilen Phase in der Regel von einer niedrigen zu einer hohen Elutionsstärke variiert. Die Elutionsstärke der mobilen Phase spiegelt sich in den Retentionszeiten der Analyten wider, wobei eine hohe Elutionsstärke eine schnelle Elution (=kurze Retentionszeiten) bewirkt. Ein typisches Gradientenprofil in der Umkehrphasenchromatographie beginnt z. B. bei 5 % Acetonitril (in Wasser oder wässrigem Puffer) und steigt über 5-25 Minuten linear auf 95 % Acetonitril an. Zeiträume mit konstanter Zusammensetzung der mobilen Phase können Teil eines jeden Gradientenprofils sein. Beispielsweise kann die Zusammensetzung der mobilen Phase für 1-3 Minuten konstant bei 5 % Acetonitril gehalten werden, gefolgt von einer linearen Veränderung bis zu 95 % Acetonitril. ⓘ

Die gewählte Zusammensetzung der mobilen Phase hängt von der Intensität der Wechselwirkungen zwischen verschiedenen Probenkomponenten ("Analyten") und der stationären Phase ab (z. B. hydrophobe Wechselwirkungen bei der Umkehrphasen-HPLC). Je nach ihrer Affinität für die stationäre und die mobile Phase verteilen sich die Analyten während des Trennungsprozesses in der Säule zwischen den beiden Phasen. Dieser Verteilungsprozess ähnelt dem, der bei einer Flüssig-Flüssig-Extraktion abläuft, ist jedoch kontinuierlich und nicht schrittweise. In diesem Beispiel, bei dem ein Wasser/Acetonitril-Gradient verwendet wird, werden die hydrophoberen Komponenten später eluieren (von der Säule kommen), sobald die mobile Phase eine höhere Konzentration an Acetonitril aufweist (d. h. in einer mobilen Phase mit höherer Elutionsstärke). ⓘ
Die Wahl der Komponenten der mobilen Phase, der Zusätze (wie Salze oder Säuren) und der Gradientenbedingungen hängt von der Art der Säule und der Probenkomponenten ab. Häufig wird eine Reihe von Probeläufen mit der Probe durchgeführt, um die HPLC-Methode zu finden, die eine angemessene Trennung ermöglicht. ⓘ
Geschichte und Entwicklung
Bevor es die HPLC gab, verwendeten die Wissenschaftler Standard-Flüssigkeitschromatographietechniken. Flüssigchromatografische Systeme waren weitgehend ineffizient, da die Fließgeschwindigkeit der Lösungsmittel von der Schwerkraft abhängig war. Die Trennungen dauerten viele Stunden, manchmal sogar Tage. Die Gaschromatographie (GC) war damals leistungsfähiger als die Flüssigchromatographie (LC), aber man glaubte, dass die Gasphasentrennung und Analyse von sehr polaren Biopolymeren mit hohem Molekulargewicht unmöglich sei. Die GC war für viele Biochemiker aufgrund der thermischen Instabilität der gelösten Stoffe unwirksam. Infolgedessen wurden alternative Methoden erdacht, die bald zur Entwicklung der HPLC führten. ⓘ
In Anlehnung an die bahnbrechende Arbeit von Martin und Synge aus dem Jahr 1941 sagten Cal Giddings, Josef Huber und andere in den 1960er Jahren voraus, dass die LC im hocheffizienten Modus betrieben werden kann, indem der Packungspartikeldurchmesser deutlich unter den für die LC (und GC) typischen Wert von 150 μm reduziert und der Druck zur Erhöhung der Geschwindigkeit der mobilen Phase eingesetzt wird. Diese Vorhersagen wurden in den 60er und 70er Jahren ausführlich erprobt und verfeinert. Die frühe Entwicklungsforschung begann mit der Verbesserung von LC-Partikeln, und die Erfindung von Zipax, einem oberflächlich porösen Partikel, war vielversprechend für die HPLC-Technologie. ⓘ
Die 1970er Jahre brachten zahlreiche Entwicklungen bei der Hardware und der Instrumentierung. Die Forscher begannen, Pumpen und Injektoren zu verwenden, um ein rudimentäres HPLC-System zu entwickeln. Gasverstärkerpumpen waren ideal, da sie mit konstantem Druck arbeiteten und keine leckfreien Dichtungen oder Rückschlagventile für einen gleichmäßigen Fluss und eine gute Quantifizierung benötigten. Bei Dupont IPD (Industrial Polymers Division) wurden Meilensteine in der Hardware gesetzt, wie z. B. die Verwendung eines Gradientengeräts mit geringem Quellvolumen und der Ersatz des Septuminjektors durch ein Schleifeninjektionsventil. ⓘ
Auch wenn die instrumentellen Entwicklungen wichtig waren, geht es bei der Geschichte der HPLC in erster Linie um die Geschichte und Entwicklung der Partikeltechnologie. Nach der Einführung von Partikeln mit porösen Schichten gab es einen stetigen Trend zur Verringerung der Partikelgröße, um die Effizienz zu verbessern. Mit der Verringerung der Partikelgröße traten jedoch neue Probleme auf. Die praktischen Nachteile ergeben sich aus dem übermäßigen Druckabfall, der erforderlich ist, um die mobile Flüssigkeit durch die Säule zu drücken, und aus der Schwierigkeit, eine gleichmäßige Packung aus extrem feinen Materialien herzustellen. Jedes Mal, wenn die Partikelgröße deutlich verringert wird, muss in der Regel eine weitere Runde der Geräteentwicklung erfolgen, um den Druck zu bewältigen. ⓘ
Typen
Partitionschromatographie

Die Partitionschromatographie war eine der ersten Chromatographiearten, die von Chemikern entwickelt wurde. Das Prinzip des Verteilungskoeffizienten wurde in der Papierchromatographie, der Dünnschichtchromatographie, der Gasphasen- und der Flüssig-Flüssig-Trennung angewandt. Der Nobelpreis für Chemie 1952 wurde Archer John Porter Martin und Richard Laurence Millington Synge für die Entwicklung dieser Technik verliehen, die für die Trennung von Aminosäuren verwendet wurde. Bei der Partitionschromatographie wird ein Lösungsmittel auf der Oberfläche oder in den Körnern oder Fasern einer "inerten" festen Trägermatrix zurückgehalten, wie bei der Papierchromatographie, oder es wird eine coulombische und/oder Wasserstoffdonor-Wechselwirkung mit der stationären Phase genutzt. Analysemoleküle verteilen sich zwischen einer flüssigen stationären Phase und dem Eluenten. Wie bei der Hydrophilen Interaktionschromatographie (HILIC; eine Untertechnik innerhalb der HPLC) trennt diese Methode die Analyten auf der Grundlage von Unterschieden in ihrer Polarität. Bei der HILIC wird meist eine gebundene polare stationäre Phase und eine mobile Phase verwendet, die hauptsächlich aus Acetonitril mit Wasser als starker Komponente besteht. Die Partitions-HPLC wurde in der Vergangenheit auf ungebundenen Silika- oder Aluminiumoxidträgern eingesetzt. Beide eignen sich gut für die Trennung von Analyten durch relative polare Unterschiede. Gebundene HILIC-Phasen haben den Vorteil, dass sie saure, basische und neutrale gelöste Stoffe in einem einzigen chromatographischen Lauf trennen. ⓘ
Die polaren Analyten diffundieren in eine stationäre Wasserschicht, die mit der polaren stationären Phase verbunden ist, und werden so zurückgehalten. Je stärker die Wechselwirkungen zwischen dem polaren Analyten und der polaren stationären Phase (im Verhältnis zur mobilen Phase) sind, desto länger ist die Elutionszeit. Die Stärke der Wechselwirkung hängt von den funktionellen Gruppen ab, die Teil der Molekülstruktur des Analyten sind, wobei stärker polarisierte Gruppen (z. B. Hydroxyl-) und Gruppen, die zu Wasserstoffbrückenbindungen fähig sind, eine stärkere Retention bewirken. Coulombische (elektrostatische) Wechselwirkungen können die Retention ebenfalls erhöhen. Die Verwendung polarer Lösungsmittel in der mobilen Phase verringert die Retentionszeit der Analyten, während hydrophobe Lösungsmittel die Retentionszeit tendenziell erhöhen. ⓘ
Normalphasenchromatographie
Die Normalphasenchromatographie war eine der ersten HPLC-Arten, die von Chemikern entwickelt wurde. Diese auch als Normalphasen-HPLC (NP-HPLC) bezeichnete Methode trennt Analyten aufgrund ihrer Affinität zu einer polaren stationären Oberfläche wie z. B. Siliziumdioxid, d. h. sie basiert auf der Fähigkeit des Analyten, polare Wechselwirkungen (z. B. Wasserstoffbrückenbindungen oder Dipol-Dipol-Wechselwirkungen) mit der Oberfläche des Sorptionsmittels einzugehen. Die NP-HPLC verwendet eine unpolare, nichtwässrige mobile Phase (z. B. Chloroform) und eignet sich gut zur Trennung von Analyten, die in unpolaren Lösungsmitteln leicht löslich sind. Der Analyt verbindet sich mit der polaren stationären Phase und wird von dieser zurückgehalten. Die Adsorptionsstärke nimmt mit zunehmender Polarität des Analyten zu. Die Stärke der Wechselwirkung hängt nicht nur von den funktionellen Gruppen in der Struktur des Analytenmoleküls ab, sondern auch von sterischen Faktoren. Die Auswirkung der sterischen Hinderung auf die Wechselwirkungsstärke ermöglicht es dieser Methode, strukturelle Isomere aufzulösen (zu trennen). ⓘ
Die Verwendung polarer Lösungsmittel in der mobilen Phase verringert die Retentionszeit der Analyten, während hydrophobe Lösungsmittel zu einer langsameren Elution führen (längere Retentionszeiten). Sehr polare Lösungsmittel, wie z. B. Spuren von Wasser in der mobilen Phase, neigen dazu, an der festen Oberfläche der stationären Phase zu adsorbieren und eine stationär gebundene (Wasser-)Schicht zu bilden, von der angenommen wird, dass sie eine aktive Rolle bei der Retention spielt. Dieses Verhalten ist eine Besonderheit der Normalphasenchromatographie, da es fast ausschließlich durch einen adsorptiven Mechanismus bestimmt wird (d. h. die Analyten interagieren mit einer festen Oberfläche und nicht mit der solvatisierten Schicht eines Liganden, der an die Oberfläche des Sorptionsmittels gebunden ist; siehe auch Umkehrphasen-HPLC unten). Die Adsorptionschromatographie ist nach wie vor weit verbreitet für die Trennung von Strukturisomeren, sowohl in Säulen- als auch in Dünnschichtchromatographieformaten auf aktivierten (getrockneten) Silika- oder Aluminiumoxidträgern. ⓘ
Partitions- und NP-HPLC gerieten in den 1970er Jahren mit der Entwicklung der Umkehrphasen-HPLC in Vergessenheit, da die Retentionszeiten aufgrund des Vorhandenseins einer Wasser- oder protischen organischen Lösungsmittelschicht auf der Oberfläche der Silika- oder Aluminiumoxid-Chromatographiemedien schlecht reproduzierbar waren. Diese Schicht verändert sich bei jeder Änderung der Zusammensetzung der mobilen Phase (z. B. des Feuchtigkeitsgehalts), wodurch sich die Retentionszeiten verschieben. ⓘ
In jüngster Zeit ist die Partitionschromatographie mit der Entwicklung von Hilic-gebundenen Phasen, die eine bessere Reproduzierbarkeit aufweisen, und aufgrund eines besseren Verständnisses des Anwendungsbereichs dieser Technik wieder populär geworden. ⓘ
Verdrängungschromatographie
Das Grundprinzip der Verdrängungschromatographie ist folgendes: Ein Molekül mit einer hohen Affinität für die Chromatographiematrix (der Verdränger) konkurriert effektiv um Bindungsstellen und verdrängt somit alle Moleküle mit geringerer Affinität. Es gibt deutliche Unterschiede zwischen Verdrängungs- und Elutionschromatographie. Im Elutionsmodus treten die Substanzen typischerweise in schmalen, gaußförmigen Peaks aus einer Säule aus. Eine breite Trennung der Peaks, vorzugsweise bis zur Basislinie, ist erwünscht, um eine maximale Aufreinigung zu erreichen. Die Geschwindigkeit, mit der eine Komponente eines Gemischs im Elutionsmodus die Säule hinunterwandert, hängt von vielen Faktoren ab. Damit sich zwei Substanzen mit unterschiedlichen Geschwindigkeiten bewegen und dadurch aufgetrennt werden können, müssen jedoch erhebliche Unterschiede in der Wechselwirkung zwischen den Biomolekülen und der Chromatographiematrix bestehen. Die Betriebsparameter werden so eingestellt, dass der Effekt dieses Unterschieds maximiert wird. In vielen Fällen kann eine Basislinientrennung der Peaks nur mit Gradientenelution und niedriger Säulenbeladung erreicht werden. Zwei Nachteile der Chromatographie im Elutionsmodus, insbesondere im präparativen Maßstab, sind daher die Komplexität des Betriebs aufgrund des Pumpen von Gradientenlösungsmitteln und der geringe Durchsatz aufgrund der geringen Säulenbeladung. Die Verdrängungschromatographie hat gegenüber der Elutionschromatographie den Vorteil, dass die Komponenten in aufeinanderfolgende Zonen reiner Substanzen und nicht in "Peaks" aufgelöst werden. Da das Verfahren die Nichtlinearität der Isothermen ausnutzt, kann eine größere Säulenbeschickung auf einer gegebenen Säule getrennt werden, wobei die gereinigten Komponenten in deutlich höherer Konzentration gewonnen werden. ⓘ
Umkehrphasenchromatographie (RPC)
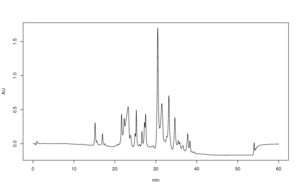
Die Umkehrphasen-HPLC (RP-HPLC) hat eine unpolare stationäre Phase und eine wässrige, mäßig polare mobile Phase. Eine gängige stationäre Phase ist ein Siliciumdioxid, das mit RMe2SiCl oberflächenmodifiziert wurde, wobei R eine geradkettige Alkylgruppe wie C18H37 oder C8H17 ist. Bei solchen stationären Phasen ist die Retentionszeit für weniger polare Moleküle länger, während polare Moleküle leichter eluieren (zu Beginn der Analyse). Der Untersucher kann die Retentionszeiten verlängern, indem er der mobilen Phase mehr Wasser hinzufügt; dadurch wird die Affinität des hydrophoben Analyten für die hydrophobe stationäre Phase im Verhältnis zu der nun hydrophileren mobilen Phase verstärkt. In ähnlicher Weise kann ein Forscher die Retentionszeit verkürzen, indem er dem Eluenten mehr organisches Lösungsmittel hinzufügt. Die RP-HPLC ist so weit verbreitet, dass sie oft fälschlicherweise als "HPLC" bezeichnet wird, ohne weiter spezifiziert zu werden. Die pharmazeutische Industrie setzt RP-HPLC regelmäßig ein, um Medikamente vor ihrer Freigabe zu qualifizieren. ⓘ
Die RP-HPLC arbeitet nach dem Prinzip der hydrophoben Wechselwirkungen, das auf die hohe Symmetrie der dipolaren Wasserstruktur zurückzuführen ist und bei allen Prozessen in den Biowissenschaften die wichtigste Rolle spielt. Die RP-HPLC ermöglicht die Messung dieser Wechselwirkungskräfte. Die Bindung des Analyten an die stationäre Phase ist proportional zur Kontaktfläche um das unpolare Segment des Analytmoleküls bei Assoziation mit dem Liganden auf der stationären Phase. Dieser solvophobe Effekt wird von der Kraft des Wassers zur "Hohlraumreduktion" um den Analyten und die C18-Kette gegenüber dem Komplex aus beiden dominiert. Die bei diesem Prozess freigesetzte Energie ist proportional zur Oberflächenspannung des Eluenten (Wasser: 7,3×10-6 J/cm², Methanol: 2,2×10-6 J/cm²) und zur hydrophoben Oberfläche des Analyten bzw. des Liganden. Die Retention kann durch Zugabe eines weniger polaren Lösungsmittels (Methanol, Acetonitril) in die mobile Phase verringert werden, um die Oberflächenspannung des Wassers zu reduzieren. Die Gradientenelution nutzt diesen Effekt, indem sie die Polarität und die Oberflächenspannung der wässrigen mobilen Phase im Laufe der Analyse automatisch verringert. ⓘ
Die strukturellen Eigenschaften des Analytenmoleküls spielen eine wichtige Rolle bei seinen Retentionsmerkmalen. Im Allgemeinen wird ein Analyt mit einer größeren hydrophoben Oberfläche (C-H, C-C und allgemein unpolare Atombindungen wie S-S und andere) länger zurückgehalten, da er nicht mit der Wasserstruktur interagiert. Andererseits werden Analyten mit einer größeren polaren Oberfläche (die durch das Vorhandensein polarer Gruppen wie -OH, -NH2, COO- oder -NH3+ in ihrer Struktur entsteht) weniger zurückgehalten, da sie besser in das Wasser integriert sind. Solche Wechselwirkungen unterliegen sterischen Effekten, da sehr große Moleküle nur einen eingeschränkten Zugang zu den Poren der stationären Phase haben können, wo die Wechselwirkungen mit den Oberflächenliganden (Alkylketten) stattfinden. Eine solche Oberflächenbehinderung führt in der Regel zu einer geringeren Retention. ⓘ
Die Retentionszeit nimmt mit der hydrophoben (unpolaren) Oberfläche zu. Verzweigtkettige Verbindungen eluieren schneller als ihre entsprechenden linearen Isomere, da die Gesamtoberfläche kleiner ist. Ebenso eluieren organische Verbindungen mit einfachen C-C-Bindungen später als solche mit einer C=C- oder C-C-Dreifachbindung, da die Doppel- oder Dreifachbindung kürzer ist als eine einfache C-C-Bindung. ⓘ
Neben der Oberflächenspannung der mobilen Phase (Organisationsstärke in der Eluentenstruktur) können auch andere Modifikatoren der mobilen Phase die Retention der Analyten beeinflussen. So bewirkt beispielsweise die Zugabe anorganischer Salze einen moderaten linearen Anstieg der Oberflächenspannung wässriger Lösungen (ca. 1,5×10-7 J/cm² pro Mol für NaCl, 2,5×10-7 J/cm² pro Mol für (NH4)2SO4), und da die Entropie der Analyt-Lösungsmittel-Grenzfläche durch die Oberflächenspannung gesteuert wird, führt die Zugabe von Salzen tendenziell zu einer Verlängerung der Retentionszeit. Diese Technik wird zur schonenden Trennung und Rückgewinnung von Proteinen und zum Schutz ihrer biologischen Aktivität bei der Proteinanalyse eingesetzt (hydrophobe Interaktionschromatographie, HIC). ⓘ
Ein weiterer wichtiger Faktor ist der pH-Wert der mobilen Phase, da er den hydrophoben Charakter des Analyten verändern kann. Aus diesem Grund wird bei den meisten Methoden ein Puffermittel, wie z. B. Natriumphosphat, zur Kontrolle des pH-Werts verwendet. Puffer dienen mehreren Zwecken: Kontrolle des pH-Werts, Neutralisierung der Ladung auf der Siliciumdioxidoberfläche der stationären Phase und Neutralisierung der Analytenladung als Ionenpaarungsmittel. Ammoniumformiat wird in der Massenspektrometrie häufig zugesetzt, um den Nachweis bestimmter Analyten durch die Bildung von Analyten-Ammonium-Addukten zu verbessern. Eine flüchtige organische Säure wie Essigsäure oder am häufigsten Ameisensäure wird häufig der mobilen Phase zugesetzt, wenn die Massenspektrometrie zur Analyse des Säuleneluants verwendet wird. Trifluoressigsäure wird in der Massenspektrometrie aufgrund ihrer Persistenz im Detektor und im Lösungsmittelzufuhrsystem nur selten verwendet, kann aber bei der Verbesserung der Retention von Analyten wie Carbonsäuren in Anwendungen mit anderen Detektoren wirksam sein, da es sich um eine ziemlich starke organische Säure handelt. Die Auswirkungen von Säuren und Puffern variieren je nach Anwendung, verbessern aber im Allgemeinen die chromatographische Auflösung. ⓘ
Umkehrphasensäulen sind im Vergleich zu normalen Kieselgelsäulen recht schwer zu beschädigen; allerdings bestehen viele Umkehrphasensäulen aus alkylderivatisierten Kieselgelpartikeln und sollten niemals mit wässrigen Basen verwendet werden, da diese die darunter liegenden Kieselgelpartikel zerstören. Sie können mit wässriger Säure verwendet werden, aber die Säule sollte der Säure nicht zu lange ausgesetzt werden, da sie die Metallteile der HPLC-Ausrüstung korrodieren kann. RP-HPLC-Säulen sollten nach Gebrauch mit sauberem Lösungsmittel gespült werden, um Säurereste oder Puffer zu entfernen, und in einer geeigneten Lösungsmittelzusammensetzung gelagert werden. Der Metallgehalt von HPLC-Säulen muss niedrig gehalten werden, wenn die bestmögliche Fähigkeit zur Trennung von Substanzen erhalten bleiben soll. Ein guter Test für den Metallgehalt einer Säule ist die Injektion einer Probe, die aus einer Mischung von 2,2'- und 4,4'-Bipyridin besteht. Da das 2,2'-Bipy das Metall chelatisieren kann, wird die Form des Peaks für das 2,2'-Bipy verzerrt (tailed), wenn Metallionen auf der Oberfläche der Kieselsäure vorhanden sind... ⓘ
Größenausschlusschromatographie
Bei der Größenausschlusschromatografie (SEC), die auch als Gelpermeationschromatografie oder Gelfiltrationschromatografie bezeichnet wird, werden Partikel auf der Grundlage der Molekülgröße (eigentlich nach dem Stokes-Radius eines Partikels) getrennt. Im Allgemeinen handelt es sich dabei um eine Chromatographie mit geringer Auflösung, weshalb sie häufig für den letzten Schritt der Aufreinigung, das "Polieren", verwendet wird. Sie eignet sich auch zur Bestimmung der Tertiär- und Quartärstruktur von gereinigten Proteinen. SEC wird vor allem für die Analyse großer Moleküle wie Proteine oder Polymere eingesetzt. SEC funktioniert, indem diese kleineren Moleküle in den Poren eines Partikels eingeschlossen werden. Die größeren Moleküle gehen einfach an den Poren vorbei, da sie zu groß sind, um in die Poren einzudringen. Größere Moleküle fließen daher schneller durch die Säule als kleinere Moleküle, d. h. je kleiner das Molekül, desto länger die Retentionszeit. ⓘ
Diese Technik wird häufig für die Bestimmung des Molekulargewichts von Polysacchariden verwendet. SEC ist die offizielle (vom Europäischen Arzneibuch empfohlene) Technik für den Molekulargewichtsvergleich verschiedener im Handel erhältlicher niedermolekularer Heparine. ⓘ
Ionenaustauschchromatographie
Bei der Ionenaustauschchromatographie (IC) beruht die Retention auf der Anziehung zwischen gelösten Ionen und geladenen Stellen, die an die stationäre Phase gebunden sind. Gelöste Ionen mit der gleichen Ladung wie die geladenen Stellen auf der Säule werden von der Bindung ausgeschlossen, während gelöste Ionen mit der entgegengesetzten Ladung der geladenen Stellen der Säule auf der Säule zurückgehalten werden. Gelöste Ionen, die auf der Säule zurückgehalten werden, können durch Änderung der Lösungsmittelbedingungen von der Säule eluiert werden (z. B. Erhöhung der Ionenwirkung des Lösungsmittelsystems durch Erhöhung der Salzkonzentration der Lösung, Erhöhung der Säulentemperatur, Änderung des pH-Werts des Lösungsmittels usw.). ⓘ
Zu den Arten von Ionenaustauschern gehören Polystyrolharze, Zellulose- und Dextran-Ionenaustauscher (Gele) sowie kontrolliertporiges Glas oder poröses Siliziumdioxid. Polystyrolharze ermöglichen eine Quervernetzung, die die Stabilität der Kette erhöht. Eine höhere Quervernetzung verringert die Auslenkung, was die Äquilibrierungszeit verlängert und letztlich die Selektivität verbessert. Cellulose- und Dextran-Ionenaustauscher besitzen größere Poren und niedrige Ladungsdichten, wodurch sie sich für die Proteintrennung eignen. ⓘ
Im Allgemeinen bevorzugen Ionenaustauscher die Bindung von Ionen mit höherer Ladung und kleinerem Radius. ⓘ
Eine Erhöhung der Konzentration des Gegenions (in Bezug auf die funktionellen Gruppen in den Harzen) verkürzt die Retentionszeit. Eine Verringerung des pH-Wertes verringert die Retentionszeit beim Kationenaustausch, während eine Erhöhung des pH-Wertes die Retentionszeit beim Anionenaustausch verringert. Durch die Senkung des pH-Werts des Lösungsmittels in einer Kationenaustauschersäule stehen beispielsweise mehr Wasserstoffionen zur Verfügung, die um die Positionen auf der anionischen stationären Phase konkurrieren und dadurch schwach gebundene Kationen eluieren. ⓘ
Diese Form der Chromatographie ist in folgenden Anwendungen weit verbreitet: Wasserreinigung, Vorkonzentration von Spurenbestandteilen, Ligandenaustauschchromatographie, Ionenaustauschchromatographie von Proteinen, Hoch-pH-Anionenaustauschchromatographie von Kohlenhydraten und Oligosacchariden und andere. ⓘ
Bioaffinitätschromatographie
Dieses chromatographische Verfahren beruht auf der Eigenschaft biologisch aktiver Substanzen, stabile, spezifische und reversible Komplexe zu bilden. An der Bildung dieser Komplexe sind allgemeine molekulare Kräfte beteiligt, wie die Van-der-Waals-Wechselwirkung, die elektrostatische Wechselwirkung, die Dipol-Dipol-Wechselwirkung, die hydrophobe Wechselwirkung und die Wasserstoffbrückenbindung. Eine effiziente, biospezifische Bindung wird durch das gleichzeitige und konzertierte Wirken mehrerer dieser Kräfte an den komplementären Bindungsstellen gebildet. ⓘ
Wässrige Normalphasenchromatographie
Die wässrige Normalphasenchromatographie (ANP) ist eine chromatographische Technik, die den Bereich der mobilen Phase zwischen der Umkehrphasenchromatographie (RP) und der organischen Normalphasenchromatographie (ONP) umfasst. Diese Technik wird eingesetzt, um eine einzigartige Selektivität für hydrophile Verbindungen zu erreichen, die eine Normalphasenelution unter Verwendung von Umkehrphasen-Lösungsmitteln aufweisen. ⓘ
Isokratische und Gradientenelution

Eine Trennung, bei der die Zusammensetzung der mobilen Phase während des gesamten Verfahrens konstant bleibt, wird als isokratisch (d. h. mit konstanter Zusammensetzung) bezeichnet. (In diesem Beispiel bleibt der Prozentsatz des Methanols während des gesamten Verfahrens konstant, d. h. 10 %) Der Begriff wurde von Csaba Horvath geprägt, der einer der Pioniere der HPLC war, ⓘ
Die Zusammensetzung der mobilen Phase muss nicht konstant bleiben. Eine Trennung, bei der die Zusammensetzung der mobilen Phase während des Trennvorgangs geändert wird, wird als Gradientenelution bezeichnet. Ein Beispiel ist ein Gradient, der bei 10 % Methanol beginnt und nach 20 Minuten bei 90 % Methanol endet. Die beiden Komponenten der mobilen Phase werden in der Regel als "A" und "B" bezeichnet; A ist das "schwache" Lösungsmittel, das die gelösten Stoffe nur langsam eluieren lässt, während B das "starke" Lösungsmittel ist, das die gelösten Stoffe schnell von der Säule eluiert. Bei der Umkehrphasenchromatographie ist das Lösungsmittel A häufig Wasser oder ein wässriger Puffer, während B ein mit Wasser mischbares organisches Lösungsmittel ist, wie z. B. Acetonitril, Methanol, THF oder Isopropanol. ⓘ
Bei isokratischer Elution nimmt die Peakbreite mit der Retentionszeit linear gemäß der Gleichung für N, der Anzahl der theoretischen Platten, zu. Dies hat den Nachteil, dass spät eluierende Peaks sehr flach und breit werden. Ihre Form und Breite kann dazu führen, dass sie nicht mehr als Peaks erkannt werden. ⓘ

Die Gradientenelution verringert die Retention der später eluierenden Komponenten, so dass diese schneller eluieren und die Peaks für die meisten Komponenten schmaler (und höher) werden. Dadurch verbessert sich auch die Peakform für "tailled peaks", da die zunehmende Konzentration des organischen Elutionsmittels den "tailing part" eines Peaks nach vorne schiebt. Dadurch wird auch die Peakhöhe erhöht (der Peak sieht "schärfer" aus), was bei der Spurenanalyse wichtig ist. Das Gradientenprogramm kann plötzliche "schrittweise" Erhöhungen des Prozentsatzes der organischen Komponente oder unterschiedliche Steigungen zu verschiedenen Zeiten beinhalten - je nachdem, wie eine optimale Trennung in möglichst kurzer Zeit erreicht werden soll. ⓘ
Bei der isokratischen Elution ändert sich die Selektivität nicht, wenn sich die Abmessungen der Säule (Länge und Innendurchmesser) ändern, d. h. die Peaks eluieren in der gleichen Reihenfolge. Bei der Gradientenelution kann sich die Elutionsreihenfolge ändern, wenn sich die Abmessungen oder die Flussrate ändern. ⓘ
Die treibende Kraft in der Umkehrphasenchromatographie geht von der hohen Ordnung der Wasserstruktur aus. Die Rolle der organischen Komponente der mobilen Phase besteht darin, diese hohe Ordnung zu reduzieren und damit die verzögernde Kraft der wässrigen Komponente zu verringern. ⓘ
Parameter
Theoretische
Für HPLC-Trennungen gibt es theoretische Parameter und Gleichungen, die die Auftrennung der Komponenten in Signalpeaks beschreiben, wenn sie von Instrumenten wie einem UV-Detektor oder einem Massenspektrometer erfasst werden. Die Parameter leiten sich im Wesentlichen aus zwei chromatographischen Theorien ab: der Plattentheorie (als Teil der Partitionschromatographie) und der Ratenlehre der Chromatographie / Van-Deemter-Gleichung. Natürlich können sie durch die Analyse von HPLC-Chromatogrammen in die Praxis umgesetzt werden, obwohl die Raten-Theorie als die genauere Theorie gilt. ⓘ
Sie entsprechen der Berechnung des Retentionsfaktors für eine papierchromatographische Trennung, beschreiben jedoch, wie gut die HPLC ein Gemisch in zwei oder mehr Komponenten trennt, die als Peaks (Banden) auf einem Chromatogramm zu erkennen sind. Die HPLC-Parameter sind der Effizienzfaktor (N), der Retentionsfaktor (kappa prime) und der Trennfaktor (alpha). Zusammen sind die Faktoren Variablen in einer Auflösungsgleichung, die beschreibt, wie gut sich die Peaks zweier Komponenten trennen oder überlappen. Diese Parameter werden meist nur zur Beschreibung von HPLC-Umkehrphasen- und HPLC-Normalphasentrennungen verwendet, da diese Trennungen in der Regel subtiler sind als andere HPLC-Verfahren (z. B. Ionenaustausch und Größenausschluss). ⓘ
Das Leervolumen ist der Raum in einer Säule, der vom Lösungsmittel eingenommen wird. Es ist der Raum innerhalb der Säule, der sich außerhalb des inneren Packungsmaterials der Säule befindet. Das Leervolumen wird auf einem Chromatogramm als der erste nachgewiesene Komponentenpeak gemessen, bei dem es sich in der Regel um das Lösungsmittel handelt, das in der Probenmischung vorhanden war; im Idealfall fließt das Probenlösungsmittel durch die Säule, ohne mit ihr in Wechselwirkung zu treten, ist aber dennoch als Unterschied zum HPLC-Lösungsmittel nachweisbar. Das Hohlraumvolumen wird als Korrekturfaktor verwendet. ⓘ
Der Effizienzfaktor (N) misst praktisch, wie scharf die Peaks der Komponenten im Chromatogramm sind, und zwar als Verhältnis der Fläche der Komponentenpeaks ("Retentionszeit") zur Breite der Peaks an ihrem breitesten Punkt (an der Basislinie). Hohe, scharfe und relativ schmale Peaks deuten darauf hin, dass die Trennmethode eine Komponente effizient aus einem Gemisch entfernt hat; hohe Effizienz. Der Wirkungsgrad hängt stark von der HPLC-Säule und der verwendeten HPLC-Methode ab. Der Effizienzfaktor ist gleichbedeutend mit der Plattenzahl und der "Anzahl der theoretischen Platten". ⓘ
Der Retentionsfaktor (kappa prime) gibt an, wie lange eine Komponente des Gemischs an der Säule haften bleibt, gemessen an der Fläche unter der Kurve ihres Peaks in einem Chromatogramm (da HPLC-Chromatogramme eine Funktion der Zeit sind). Jeder Chromatogrammpeak hat seinen eigenen Retentionsfaktor (z. B. kappa1 für den Retentionsfaktor des ersten Peaks). Dieser Faktor kann durch das Hohlraumvolumen der Säule korrigiert werden. ⓘ
Der Trennfaktor (alpha) ist ein relativer Vergleich, wie gut zwei benachbarte Komponenten des Gemischs getrennt wurden (d. h. zwei benachbarte Banden in einem Chromatogramm). Dieser Faktor wird als Verhältnis der Retentionsfaktoren eines Paares benachbarter Chromatogramm-Peaks definiert und kann auch durch das Hohlraumvolumen der Säule korrigiert werden. Je höher der Wert des Trennungsfaktors über 1,0 liegt, desto besser ist die Trennung, bis zu einem Wert von etwa 2,0, ab dem eine HPLC-Methode für die Trennung wahrscheinlich nicht mehr erforderlich ist. Die Auflösungsgleichungen setzen die drei Faktoren in Beziehung, so dass eine hohe Effizienz und hohe Trennfaktoren die Auflösung der Komponentenpeaks bei einer HPLC-Trennung verbessern. ⓘ
Innendurchmesser

Der Innendurchmesser (ID) einer HPLC-Säule ist ein wichtiger Parameter, der die Nachweisempfindlichkeit und Trennselektivität bei der Gradientenelution beeinflusst. Er bestimmt auch die Menge des Analyten, die auf die Säule geladen werden kann. Größere Säulen werden in der Regel bei industriellen Anwendungen eingesetzt, z. B. bei der Aufreinigung eines Arzneimittels für die spätere Verwendung. Säulen mit niedrigem ID haben eine höhere Empfindlichkeit und einen geringeren Lösungsmittelverbrauch auf Kosten der Ladekapazität. ⓘ
Größere ID-Säulen (über 10 mm) werden aufgrund ihrer großen Ladekapazität zur Reinigung von brauchbaren Materialmengen verwendet. ⓘ
Säulen im analytischen Maßstab (4,6 mm) sind der gängigste Säulentyp, obwohl kleinere Säulen schnell an Beliebtheit gewinnen. Sie werden bei der traditionellen quantitativen Analyse von Proben eingesetzt und verwenden häufig einen UV-Vis-Absorptionsdetektor. ⓘ
Enge Säulen (1-2 mm) werden für Anwendungen verwendet, bei denen eine höhere Empfindlichkeit gewünscht wird, entweder mit speziellen UV-Vis-Detektoren, Fluoreszenzdetektion oder mit anderen Detektionsmethoden wie Flüssigchromatographie-Massenspektrometrie ⓘ
Kapillarsäulen (unter 0,3 mm) werden fast ausschließlich mit alternativen Nachweisverfahren wie der Massenspektrometrie verwendet. Sie bestehen in der Regel aus Quarzglaskapillaren und nicht aus Edelstahlrohren wie die größeren Säulen. ⓘ
Partikelgröße
Bei den meisten herkömmlichen HPLC-Verfahren ist die stationäre Phase an der Außenseite von kleinen kugelförmigen Silikapartikeln (sehr kleine Kügelchen) angebracht. Diese Partikel gibt es in verschiedenen Größen, wobei 5 µm-Perlen am häufigsten vorkommen. Kleinere Partikel bieten im Allgemeinen eine größere Oberfläche und bessere Trennungen, aber der für eine optimale lineare Geschwindigkeit erforderliche Druck steigt mit dem Kehrwert des Partikeldurchmessers zum Quadrat. ⓘ
Nach den Gleichungen für Säulengeschwindigkeit, Effizienz und Gegendruck verdoppelt eine Halbierung des Partikeldurchmessers bei gleichbleibender Säulengröße die Säulengeschwindigkeit und -effizienz, vervierfacht jedoch den Gegendruck. Und die HPLC mit kleinen Partikeln kann auch die Breitenverbreiterung verringern. Größere Partikel werden in der präparativen HPLC (Säulendurchmesser 5 cm bis >30 cm) und für Nicht-HPLC-Anwendungen wie die Festphasenextraktion verwendet. ⓘ
Porengröße
Viele stationäre Phasen sind porös, um eine größere Oberfläche zu bieten. Kleine Poren bieten eine größere Oberfläche, während eine größere Porengröße zu einer besseren Kinetik führt, insbesondere bei größeren Analyten. Ein Protein beispielsweise, das nur geringfügig kleiner als eine Pore ist, kann zwar in die Pore eindringen, sie aber nicht mehr ohne weiteres verlassen. ⓘ
Pumpendruck
Pumpen haben unterschiedliche Druckkapazitäten, aber ihre Leistung wird an ihrer Fähigkeit gemessen, einen konstanten und reproduzierbaren Volumenstrom zu erzeugen. Der Druck kann bis zu 60 MPa (6000 lbf/in2) bzw. etwa 600 Atmosphären erreichen. Moderne HPLC-Systeme wurden so verbessert, dass sie bei viel höheren Drücken arbeiten können und daher in der Lage sind, viel kleinere Partikelgrößen in den Säulen zu verwenden (<2 μm). Diese "Ultrahochleistungsflüssigkeitschromatographiesysteme" oder UHPLCs, die auch als Ultrahochdruckchromatographiesysteme bezeichnet werden können, arbeiten bei einem Druck von bis zu 120 MPa (17.405 lbf/in2) oder etwa 1200 Atmosphären. Der Begriff "UPLC" ist ein Markenzeichen der Waters Corporation, wird aber manchmal auch für die allgemeinere Technik der UHPLC verwendet. ⓘ
Detektoren
HPLC-Detektoren lassen sich in zwei Hauptkategorien einteilen: universell oder selektiv. Universaldetektoren messen in der Regel eine Bulk-Eigenschaft (z. B. den Brechungsindex) durch Messung des Unterschieds einer physikalischen Eigenschaft zwischen der mobilen Phase und der mobilen Phase mit dem gelösten Stoff, während selektive Detektoren eine Eigenschaft des gelösten Stoffes (z. B. die UV-Vis-Absorption) messen, indem sie einfach auf die physikalische oder chemische Eigenschaft des gelösten Stoffes reagieren. Bei der HPLC wird in der Regel ein UV-Vis-Absorptionsdetektor verwendet, es kann jedoch auch eine Vielzahl anderer Chromatographiedetektoren eingesetzt werden. Ein universeller Detektor, der die UV-Vis-Absorptionsdetektion ergänzt, ist der Detektor für geladene Aerosole (CAD). Eine Art häufig verwendeter Detektor sind Brechungsindexdetektoren, die Messwerte liefern, indem sie die Änderungen des Brechungsindex des Elutionsmittels messen, während es sich durch die Durchflusszelle bewegt. In bestimmten Fällen ist es möglich, mehrere Detektoren zu verwenden, z. B. wird bei der LCMS normalerweise UV-Vis mit einem Massenspektrometer kombiniert. ⓘ
In Verbindung mit einem elektrochemischen Detektor (ECD) detektiert die HPLC-ECD selektiv Neurotransmitter wie Noradrenalin, Dopamin, Serotonin, Glutamat, GABA, Acetylcholin und andere in Forschungsanwendungen der neurochemischen Analyse. Mit der HPLC-ECD lassen sich Neurotransmitter bis in den femtomolaren Bereich nachweisen. Andere Methoden zum Nachweis von Neurotransmittern sind Flüssigchromatographie-Massenspektrometrie, ELISA oder Radioimmunoassays. ⓘ
- UV/VIS-Detektor
- Diodenarraydetektor (DAD)
- Multiwellenlängendetektor (MWD)
- Lichtstreudetektor
- Fluoreszenzdetektor
- Brechungsindexdetektor
- Massenspektrometer
- Leitfähigkeitsdetektor
- Elektrochemischer Detektor: Amperometrie, Coulometrie
- Radioaktivitäts-Detektor
- Stickstoffselektiver Detektor ⓘ
Autosampler
Durch den Einsatz von HPLC-Autosamplern kann eine große Anzahl von Proben automatisch in ein HPLC-System injiziert werden. Darüber hinaus haben HPLC-Autosampler ein Injektionsvolumen und eine Technik, die bei jeder Injektion genau gleich ist, und bieten daher ein hohes Maß an Präzision des Injektionsvolumens. Es ist möglich, die Probe in der Probenahmekammer zu rühren, wodurch die Homogenität gefördert wird. ⓘ
Anwendungen
Herstellung
Die HPLC findet sowohl im Labor als auch in der klinischen Wissenschaft zahlreiche Anwendungen. Sie wird häufig in der pharmazeutischen Entwicklung eingesetzt, da sie ein zuverlässiges Verfahren zur Gewinnung und Sicherstellung der Produktreinheit ist. Obwohl mit der HPLC extrem hochwertige (reine) Produkte hergestellt werden können, ist sie nicht immer die primäre Methode, die bei der Herstellung von Bulk-Arzneimitteln eingesetzt wird. Nach dem Europäischen Arzneibuch wird die HPLC nur bei 15,5 % der Synthesen eingesetzt. Im US-amerikanischen Arzneibuch hingegen spielt sie bei 44 % der Synthesen eine Rolle. Dies könnte möglicherweise auf unterschiedliche finanzielle und zeitliche Zwänge zurückzuführen sein, da HPLC in großem Maßstab eine teure Technik sein kann. Ein Zuwachs an Spezifität, Präzision und Genauigkeit, der mit der HPLC erzielt wird, geht leider mit einem Anstieg der Kosten einher. ⓘ
Legal
Diese Technik wird auch zum Nachweis illegaler Drogen im Urin verwendet. Die gebräuchlichste Methode zum Nachweis von Drogen ist ein Immunoassay. Diese Methode ist sehr viel bequemer. Die Bequemlichkeit geht jedoch auf Kosten der Spezifität und der Erfassung eines breiten Spektrums von Drogen. Da es sich bei der HPLC um eine Methode zur Bestimmung (und möglicherweise Erhöhung) der Reinheit handelt, ist die Verwendung der HPLC allein zur Bewertung der Drogenkonzentration nicht ausreichend. Daher wird die HPLC in diesem Zusammenhang häufig in Verbindung mit der Massenspektrometrie eingesetzt. Durch die Verwendung der Flüssigchromatographie anstelle der Gaschromatographie in Verbindung mit der MS wird die Notwendigkeit der Derivatisierung mit Acetylierungs- oder Alkylierungsmitteln umgangen, die einen aufwändigen zusätzlichen Schritt darstellen kann. Diese Technik wurde zum Nachweis einer Vielzahl von Substanzen wie Dopingmitteln, Drogenmetaboliten, Glucuronidkonjugaten, Amphetaminen, Opioiden, Kokain, BZDs, Ketamin, LSD, Cannabis und Pestiziden eingesetzt. Durch die Kombination von HPLC und Massenspektrometrie wird die absolute Notwendigkeit der Standardisierung von HPLC-Versuchsläufen reduziert. ⓘ
Forschung
Ähnliche Tests können zu Forschungszwecken durchgeführt werden, um die Konzentrationen potenzieller klinischer Kandidaten wie Antimykotika und Asthma-Medikamente zu bestimmen. Diese Technik ist natürlich auch bei der Beobachtung mehrerer Spezies in gesammelten Proben nützlich, erfordert aber die Verwendung von Standardlösungen, wenn Informationen über die Speziesidentität gesucht werden. Sie wird als Methode zur Bestätigung der Ergebnisse von Synthesereaktionen eingesetzt, da die Reinheit bei dieser Art von Forschung von wesentlicher Bedeutung ist. Die Massenspektrometrie ist jedoch nach wie vor die zuverlässigere Methode zur Identifizierung von Arten. ⓘ
Medizinische
In der Medizin kann die HPLC zur Analyse von Arzneimitteln eingesetzt werden, fällt aber eher in die Kategorie der Nährstoffanalyse. Während Urin das gebräuchlichste Medium für die Analyse von Arzneimittelkonzentrationen ist, wird für die meisten medizinischen Analysen mit HPLC Blutserum als Probe entnommen. Andere Nachweismethoden für Moleküle, die für klinische Studien nützlich sind, wurden mit HPLC getestet, nämlich Immunoassays. In einem Beispiel wurden kompetitive Proteinbindungsassays (CPBA) und HPLC hinsichtlich ihrer Empfindlichkeit beim Nachweis von Vitamin D verglichen. Es wurde festgestellt, dass die Empfindlichkeit und die Spezifität dieses CPBA nur 40 % bzw. 60 % der Kapazität der HPLC erreichen, was für die Diagnose von Vitamin-D-Mangel bei Kindern nützlich ist. Obwohl es sich um ein teures Instrument handelt, ist die Genauigkeit der HPLC nahezu unübertroffen. ⓘ
Praktische Durchführung und Anwendungen
Eine chemische Verbindung kann man mittels HPLC nur bedingt identifizieren, indem man die Retentionszeit der unbekannten Substanz mit der eines Standards (einer bekannten Substanz) vergleicht (externe Standardisierung). Ist die Retentionszeit gleich, kann man der Probe mit der unbekannten Substanz auch etwas Standard zusetzen und untersuchen, ob beim Chromatogramm nach wie vor nur eine Spitze (engl. peak) sichtbar ist, ob ein „Doppel-Peak“ entstanden ist oder ob am Chromatogramm zwei getrennte „Peaks“ mit sehr ähnlicher Retentionszeit sichtbar werden (interne Standardisierung). Wenn nach Zusatz von Standard zur Probe nur eine Spitze sichtbar ist, kann man noch nicht davon ausgehen, dass die chemische Verbindung in der Probe und im Standard identisch ist. Ein weiterer Parameter wäre der Abgleich des UV-Spektrums bei Verwendung eines Diodenarray-Detektors oder der Massenspur bei einem gekoppelten Massenspektrometer. Allerdings bieten Retentionszeit, UV-Spektrum und MS-Spektrum bei Isomeren oft nur unzureichende Identifikationsmerkmale. Hier kann diese Technik in der Praxis die effiziente Identifizierung nur erleichtern, indem sie sehr gut andere Möglichkeiten ausschließt. ⓘ
Alternativ führt man dieses Experiment unter zwei unterschiedlichen Trennbedingungen (z. B. HPLC-Trennungen mit zwei unterschiedlichen Säulen) durch. So kann man damit unbekannte chemische Verbindungen mit einer gewissen Sicherheit identifizieren. ⓘ
Will man die Konzentration einer chemischen Substanz bestimmen (z. B. von Vitamin E in einem pflanzlichen Öl), so kann man dies tun, indem man Standards dieser chemischen Substanz mit bekannten Konzentrationen herstellt und die Peak-Fläche der Standards mit den Peak-Flächen der Substanz in den Proben vergleicht. Wie bei jedem analytischen Verfahren ist darauf zu achten, dass bei einer vorangehenden Probenaufarbeitung die Wiederfindungsrate mit in die Berechnung der Konzentration einbezogen wird. ⓘ
Chromatographische Trennungen werden nicht ausschließlich zu analytischen Zwecken eingesetzt, sondern auch für präparative Zwecke im Labor und in der chemischen Industrie, um ein Produkt (z. B. Proteine) zu reinigen oder sehr ähnliche Substanzen (z. B. Enantiomere) voneinander zu trennen. Hierbei kommen Säulen mit bis zu einem Meter Durchmesser zum Einsatz. ⓘ

Methodenentwicklung
Die Trennung der Substanzen ist von vielen Parametern abhängig, darunter
- Art der Substanzen,
- Art und Maße der Trennsäule,
- Zusammensetzung der mobilen Phase,
- Temperatur,
- pH-Wert
- Durchflussgeschwindigkeit der mobilen Phase ⓘ
Zum Erreichen einer vollständigen und reproduzierbaren Trennung muss meist für jedes komplexere Stoffgemisch, gerade bei der Gradientenmethode, eine eigene Methode entwickelt werden. Schon geringe Abweichungen von einer Methode können eine Änderung der Selektivität bedeuten. Ziel einer Methodenentwicklung ist ein Chromatogramm, bei dem alle Spitzen vollständig getrennt sind, jedoch in minimalem Abstand voneinander auftauchen, um die Dauer eines Trennvorgangs möglichst gering zu halten. Um die Parameter nicht zeitaufwändig und kostspielig durch Versuch und Irrtum (engl. trial and error) bestimmen zu müssen, bedienen sich chemische, pharmazeutische und die Nahrungsmittelindustrie oft einer Simulationssoftware, die, auf experimentellen Daten oder Molekülstrukturen der Proben beruhend, passende Methoden prognostizieren kann. ⓘ
Aktuelle Entwicklungen: UHPLC

In den letzten Jahren ging der Trend zu immer höherem Probendurchsatz mit immer kleineren Probenvolumina. Als neutrale Bezeichnung für HPLC mit stark gesteigerter Leistung ist die Abkürzung UHPLC (kurz für engl. Ultra High Performance Liquid Chromatography) geeignet. Diese Bezeichnung ist analog zu „High Frequency“ (HF) und „Ultra High Frequency“ (UHF) oder „High Temperature“ (HT) und „Ultra High Temperature“ (UHT) zu verstehen. Verschiedene Hersteller von HPLC-Anlagen haben dagegen unterschiedliche Abkürzungen und Begriffe geprägt:
- RRLC: Rapid Resolution Liquid Chromatography
- RSLC: Rapid Separation Liquid Chromatography
- UFLC: Ultra Fast Liquid Chromatography
- UPLC: Ultra Performance Liquid Chromatography
- ULDC: Ultra Low Dispersion Chromatography ⓘ
Allen Techniken gemeinsam ist, dass hierbei Partikel mit einem Durchmesser von 2,2 bis 1,7 μm als Säulenmaterial genutzt werden. Dadurch können Geschwindigkeit und Effizienz einer chromatographischen Trennung deutlich verbessert werden. Eine typische UHPLC-Analytik, inkl. Gradientenelution und anschließender Equilibrierung dauert 5 bis 10 Minuten (Faustregel 1/10 der HPLC), wobei Probenvolumina von 0,5 bis 2 µl verwendet werden. Es gibt aber auch etablierte Methoden, mit einer Analysezeit von weniger als einer Minute. Für die Durchführung einer Trennung mit einem solchen Säulenmaterial ist ein deutlich höherer Arbeitsdruck von bis zu 1000 Bar erforderlich, der von klassischen HPLC-Anlagen nicht erreicht werden kann. Sowohl die Säulen als auch die anderen Bauteile wie Injektionsgeber, Pumpen, Ventile und Verbindungselemente müssen unter diesen Bedingungen zuverlässig arbeiten. ⓘ
Bei diesen Verfahren wird die Analysezeit durch optimierte Anlagenbauteile verkürzt (z. B. schnelle, verschleppungsarme Probengeber, kleinere Kapillaren, empfindliche Detektoren, geringe Gradientenverzögerung). ⓘ
Die erste UHPLC-Anlage wurde unter dem Namen UPLCTM von der Firma Waters Corporation 2004 auf den Markt gebracht. Inzwischen ist die UHPLC eine Standardmethode und im Begriff die klassische HPLC in weiten Teilen abzulösen. Dazu trägt im Wesentlichen die immer größer werdende Verbreitung sowie der einfache Methodentransfer bei. ⓘ
Simulated moving bed (SMB)–Technologie
Ein weiteres hocheffektives Trenn- und Reinigungsverfahren, speziell in der Naturstoff- oder Arzneistoffanalytik. Es wird das Prinzip der kontinuierlichen Gegenstromverteilung angewandt. ⓘ