Löslichkeit


In der Chemie ist die Löslichkeit die Fähigkeit eines Stoffes, des gelösten Stoffes, mit einem anderen Stoff, dem Lösungsmittel, eine Lösung zu bilden. Unlöslichkeit ist die gegenteilige Eigenschaft, nämlich die Unfähigkeit des gelösten Stoffes, eine solche Lösung zu bilden. ⓘ
Das Ausmaß der Löslichkeit eines Stoffes in einem bestimmten Lösungsmittel wird im Allgemeinen als die Konzentration des gelösten Stoffes in einer gesättigten Lösung gemessen, d. h. einer Lösung, in der kein weiterer gelöster Stoff mehr gelöst werden kann. An diesem Punkt befinden sich die beiden Stoffe im Löslichkeitsgleichgewicht. Für einige gelöste Stoffe und Lösungsmittel kann es keine solche Grenze geben; in diesem Fall werden die beiden Stoffe als "in allen Verhältnissen mischbar" (oder einfach "mischbar") bezeichnet. ⓘ
Der gelöste Stoff kann ein Feststoff, eine Flüssigkeit oder ein Gas sein, während das Lösungsmittel normalerweise fest oder flüssig ist. Beide können reine Stoffe sein oder selbst Lösungen darstellen. Gase sind immer in allen Verhältnissen mischbar, außer in sehr extremen Situationen, und ein fester oder flüssiger Stoff kann nur in einem Gas "gelöst" werden, wenn er zuvor in den gasförmigen Zustand übergeht. ⓘ
Die Löslichkeit hängt hauptsächlich von der Zusammensetzung des gelösten Stoffes und des Lösungsmittels (einschließlich ihres pH-Werts und des Vorhandenseins anderer gelöster Stoffe) sowie von Temperatur und Druck ab. Die Abhängigkeit lässt sich häufig mit den Wechselwirkungen zwischen den Teilchen (Atomen, Molekülen oder Ionen) der beiden Stoffe und mit thermodynamischen Konzepten wie Enthalpie und Entropie erklären. ⓘ
Unter bestimmten Bedingungen kann die Konzentration des gelösten Stoffes seine übliche Löslichkeitsgrenze überschreiten. Das Ergebnis ist eine übersättigte Lösung, die metastabil ist und den überschüssigen gelösten Stoff schnell ausscheidet, wenn sich eine geeignete Keimbildungsstelle findet. ⓘ
Das Konzept der Löslichkeit findet keine Anwendung, wenn eine irreversible chemische Reaktion zwischen den beiden Stoffen stattfindet, wie z. B. bei der Reaktion von Calciumhydroxid mit Salzsäure, auch wenn man informell sagen könnte, dass der eine den anderen "aufgelöst" hat. Die Löslichkeit ist auch nicht dasselbe wie die Lösungsgeschwindigkeit, d. h. wie schnell sich ein fester Stoff in einem flüssigen Lösungsmittel auflöst. Diese Eigenschaft hängt von vielen anderen Variablen ab, z. B. von der physikalischen Form der beiden Stoffe und von der Art und Intensität des Mischens. ⓘ
Das Konzept und die Messung der Löslichkeit sind nicht nur in der Chemie von großer Bedeutung, sondern auch in vielen anderen Wissenschaften wie der Geologie, der Biologie, der Physik und der Ozeanographie sowie in der Technik, der Medizin, der Landwirtschaft und sogar bei nichttechnischen Tätigkeiten wie Malen, Putzen, Kochen und Brauen. Die meisten chemischen Reaktionen von wissenschaftlichem, industriellem oder praktischem Interesse laufen erst ab, nachdem die Reagenzien in einem geeigneten Lösungsmittel aufgelöst wurden. Wasser ist das bei weitem am häufigsten verwendete Lösungsmittel. ⓘ
Der Begriff "löslich" wird manchmal für Stoffe verwendet, die kolloidale Suspensionen aus sehr feinen Feststoffteilchen in einer Flüssigkeit bilden können. Die quantitative Löslichkeit solcher Stoffe ist jedoch im Allgemeinen nicht genau definiert. ⓘ
Quantifizierung der Löslichkeit
Nach dem europäischen Arzneibuch versteht man unter Löslichkeit das bei Sättigung vorliegende Verhältnis von gelöster Substanzmasse zum Volumen des Lösungsmittels bei Raumtemperatur. Diese Definition unterscheidet sich von der Definition der Massenkonzentration, welche (trotz gleicher Einheit von g/l) das Verhältnis von Substanzmasse zu Volumen der Lösung angibt. Die Massenkonzentration wird zum Beispiel von der IUPAC als eine mögliche quantitative Angabe für die Löslichkeit definiert (analytische Zusammensetzung einer gesättigten Lösung, ausgedrückt in Form des Anteils eines gelösten Stoffes in einem bestimmten Lösungsmittel). ⓘ
Das bekannte CRC Handbook of Chemistry and Physics gibt die Löslichkeit als Substanzmasse der Verbindung (mit Ausnahme des Kristallwassers von Hydraten), die sich in 100 g Wasser lösen lassen an. ⓘ
Im Allgemeinen unterscheidet man:
- qualitative Löslichkeit: Ist der Stoff in einem bestimmten Lösungsmittel überhaupt in erkennbarem Maße löslich?
- quantitative Löslichkeit: Sie gibt die genaue Stoffmenge an, die sich maximal im Einheitsvolumen eines bestimmten Lösungsmittels löst. ⓘ
Pro Menge des Lösungsmittels
Insbesondere in Chemiehandbüchern wird die Löslichkeit eines Stoffes in einer Flüssigkeit häufig als Gramm des gelösten Stoffes pro Deziliter (100 ml) Lösungsmittel (g/dL) oder, seltener, als Gramm pro Liter (g/L) angegeben. Die Menge des Lösungsmittels kann stattdessen auch in Masse ausgedrückt werden, z. B. in g/100g" oder g/kg. In diesem Fall kann die Zahl als Prozentsatz ausgedrückt werden, und die Abkürzung "w/w" kann verwendet werden, um "Gewicht pro Gewicht" anzugeben. (Die Werte in g/L und g/kg sind für Wasser praktisch identisch, nicht aber für andere Lösungsmittel). ⓘ
Alternativ kann die Menge des gelösten Stoffes auch in Mol statt in Masse ausgedrückt werden; wird die Menge des Lösungsmittels in Kilogramm angegeben, ist der Wert die Molalität der Lösung (mol/kg). ⓘ
Pro Menge der Lösung
Die Löslichkeit eines Stoffes in einer Flüssigkeit kann auch als Menge des gelösten Stoffes pro Menge der Lösung und nicht als Menge des Lösungsmittels ausgedrückt werden. In Anlehnung an die gängige Praxis bei der Titration kann sie z. B. als Mol des gelösten Stoffes pro Liter Lösung (mol/L), der Molarität der Lösung, ausgedrückt werden. ⓘ
In spezielleren Zusammenhängen kann die Löslichkeit durch den Molenbruch (Mol des gelösten Stoffes pro Gesamtmol des gelösten Stoffes plus Lösungsmittel) oder durch den Massenanteil im Gleichgewicht (Masse des gelösten Stoffes pro Masse des gelösten Stoffes plus Lösungsmittel) angegeben werden, beides dimensionslose Zahlen zwischen 0 und 1, die als Prozentsätze ausgedrückt werden können. ⓘ
Flüssige und gasförmige gelöste Stoffe
Bei Lösungen von Flüssigkeiten oder Gasen in Flüssigkeiten können die Mengen beider Stoffe als Volumen und nicht als Masse oder Molmenge angegeben werden, z. B. Liter gelöster Stoff pro Liter Lösungsmittel oder Liter gelöster Stoff pro Liter Lösung. Der Wert kann als Prozentsatz angegeben werden, und die Abkürzung "v/v" für "Volumen pro Volumen" kann verwendet werden, um diese Wahl anzugeben. ⓘ
Umrechnung von Löslichkeitswerten
Die Umrechnung zwischen diesen verschiedenen Arten der Löslichkeitsmessung ist nicht immer trivial, da sie die Kenntnis der Dichte der Lösung voraussetzt, die oft nicht gemessen wird und nicht vorhergesagt werden kann. Während die Gesamtmasse beim Auflösen erhalten bleibt, kann das Endvolumen sowohl vom Volumen des Lösungsmittels als auch von der Summe der beiden Volumina abweichen. ⓘ
Außerdem dissoziieren viele Feststoffe (z. B. Säuren und Salze) beim Lösen auf nichttriviale Weise; umgekehrt kann das Lösungsmittel mit den Molekülen oder Ionen des gelösten Stoffes Koordinationskomplexe bilden. In diesen Fällen ist die Summe der Moleküle des gelösten Stoffes und des Lösungsmittels nicht wirklich die Gesamtmolzahl der unabhängigen Teilchen der Lösung. Um dieses Problem zu umgehen, wird die Löslichkeit pro Mol Lösung in der Regel so berechnet und angegeben, als ob der gelöste Stoff nicht dissoziiert oder Komplexe bildet, d. h., es wird so getan, als ob die Molmenge der Lösung die Summe der Molmengen der beiden Stoffe ist. ⓘ
Zur Beschreibung des Ausmaßes der Löslichkeit verwendete Qualifikatoren
Das Ausmaß der Löslichkeit reicht von unendlich löslich (ohne Begrenzung, d. h. mischbar), wie Ethanol in Wasser, bis zu im Wesentlichen unlöslich, wie Titandioxid in Wasser. Eine Reihe anderer beschreibender Begriffe werden ebenfalls verwendet, um das Ausmaß der Löslichkeit für eine bestimmte Anwendung zu beschreiben. In der U.S. Pharmacopoeia finden sich beispielsweise folgende Bezeichnungen, die sich nach der Masse msv des Lösungsmittels richten, die erforderlich ist, um eine Masseneinheit msu des gelösten Stoffes zu lösen: (Die Löslichkeiten der Beispiele sind Näherungswerte für Wasser bei 20-25 °C.) ⓘ
| Begriff | Bereich | Beispiel | g/dL | msv/msu ⓘ |
|---|---|---|---|---|
| Sehr löslich | <1 | Calciumnitrat | 158.7 | 0.63 |
| Leicht löslich | 1 bis 10 | Calciumchlorid | 65 | 1.54 |
| Löslich | 10 bis 30 | Natriumoxalat | 3.9 | 26 |
| Schwer löslich | 30 bis 100 | |||
| Schwach löslich | 100 bis 1000 | Calciumsulfat | 0.21 | 490 |
| Sehr schwer löslich | 1000 bis 10.000 | Dicalciumphosphat | 0.02 | 5000 |
| Praktisch unlöslich oder unlöslich | ≥ 10,000 | Bariumsulfat | 0.000245 | 409000 |
Die Schwellenwerte für die Bezeichnung eines Stoffes als unlöslich oder ähnliche Begriffe können von der jeweiligen Anwendung abhängen. In einer Quelle heißt es zum Beispiel, dass Stoffe als "unlöslich" bezeichnet werden, wenn ihre Löslichkeit weniger als 0,1 g pro 100 ml Lösungsmittel beträgt. ⓘ
Molekulare Betrachtung
Die Löslichkeit tritt in einem dynamischen Gleichgewicht auf, d. h. die Löslichkeit ergibt sich aus den gleichzeitigen und gegenläufigen Prozessen der Auflösung und der Phasenverbindung (z. B. Ausfällung von Feststoffen). Das Löslichkeitsgleichgewicht tritt ein, wenn die beiden Prozesse mit gleicher und entgegengesetzter Geschwindigkeit ablaufen. ⓘ
Der Begriff Löslichkeit wird auch in einigen Bereichen verwendet, in denen der gelöste Stoff durch Solvolyse verändert wird. So wird beispielsweise von vielen Metallen und ihren Oxiden gesagt, sie seien "in Salzsäure löslich", obwohl die wässrige Säure den Feststoff irreversibel zu löslichen Produkten zersetzt. Es stimmt auch, dass die meisten ionischen Feststoffe durch polare Lösungsmittel aufgelöst werden, aber solche Prozesse sind reversibel. In den Fällen, in denen der gelöste Stoff beim Verdampfen des Lösungsmittels nicht zurückgewonnen wird, spricht man von Solvolyse. Das thermodynamische Konzept der Löslichkeit lässt sich nicht ohne Weiteres auf die Solvolyse anwenden. ⓘ
Wenn sich ein gelöster Stoff auflöst, kann er in der Lösung mehrere Spezies bilden. Zum Beispiel enthält eine wässrige Suspension von Eisenhydroxid, Fe(OH)
2, sowohl die Reihe [Fe(H2O)x(OH)x](2x)+ als auch andere Spezies. Außerdem hängen die Löslichkeit von Eisenhydroxid und die Zusammensetzung seiner löslichen Bestandteile vom pH-Wert ab. Im Allgemeinen kann die Löslichkeit in der Lösungsmittelphase nur für einen bestimmten gelösten Stoff angegeben werden, der thermodynamisch stabil ist, und der Wert der Löslichkeit umfasst alle Spezies in der Lösung (im obigen Beispiel alle eisenhaltigen Komplexe). ⓘ
Faktoren, die die Löslichkeit beeinflussen
Die Löslichkeit wird für bestimmte Phasen definiert. So dürfte sich beispielsweise die Löslichkeit von Aragonit und Calcit in Wasser unterscheiden, obwohl beide Polymorphe von Calciumcarbonat sind und die gleiche chemische Formel haben. ⓘ
Die Löslichkeit einer Substanz in einer anderen wird durch das Gleichgewicht der zwischenmolekularen Kräfte zwischen dem Lösungsmittel und dem gelösten Stoff sowie durch die Entropieänderung bestimmt, die mit der Solvatisierung einhergeht. Faktoren wie Temperatur und Druck verändern dieses Gleichgewicht und damit auch die Löslichkeit. ⓘ
Die Löslichkeit kann auch stark von der Anwesenheit anderer im Lösungsmittel gelöster Spezies abhängen, z. B. von komplexbildenden Anionen (Liganden) in Flüssigkeiten. Die Löslichkeit hängt auch vom Überschuss oder Mangel eines gemeinsamen Ions in der Lösung ab, ein Phänomen, das als Common-Ion-Effekt bekannt ist. In geringerem Maße hängt die Löslichkeit auch von der Ionenstärke der Lösungen ab. Die letzten beiden Effekte lassen sich mit der Gleichung für das Löslichkeitsgleichgewicht quantifizieren. ⓘ
Bei einem Feststoff, der sich in einer Redoxreaktion auflöst, hängt die Löslichkeit voraussichtlich vom Potenzial ab (innerhalb des Potenzialbereichs, in dem der Feststoff die thermodynamisch stabile Phase bleibt). So wird beispielsweise beobachtet, dass die Löslichkeit von Gold in Hochtemperaturwasser fast um eine Größenordnung höher ist (d. h. etwa zehnmal höher), wenn das Redoxpotenzial mit einem stark oxidierenden Fe3O4-Fe2O3-Redoxpuffer gesteuert wird, als mit einem mäßig oxidierenden Ni-NiO-Puffer. ⓘ
Die Löslichkeit (metastabil, bei Konzentrationen, die sich der Sättigung nähern) hängt auch von der physikalischen Größe des Kristalls oder Tröpfchens der gelösten Substanz ab (oder, genau genommen, von der spezifischen Oberfläche oder der molaren Oberfläche der gelösten Substanz). Zur Quantifizierung siehe die Gleichung in dem Artikel über das Löslichkeitsgleichgewicht. Bei stark defekten Kristallen kann die Löslichkeit mit dem zunehmenden Grad der Unordnung zunehmen. Diese beiden Effekte treten aufgrund der Abhängigkeit der Löslichkeitskonstante von der Gibbs-Energie des Kristalls auf. Die letzten beiden Effekte sind zwar oft schwer zu messen, aber von praktischer Bedeutung. Sie sind zum Beispiel die treibende Kraft für die Alterung von Ausscheidungen (die Kristallgröße nimmt mit der Zeit spontan zu). ⓘ
Temperatur
Die Löslichkeit eines bestimmten gelösten Stoffes in einem bestimmten Lösungsmittel ist eine Funktion der Temperatur. Je nach der Enthalpieänderung (ΔH) der Auflösungsreaktion, d. h. dem endothermen (ΔH > 0) oder exothermen (ΔH < 0) Charakter der Auflösungsreaktion, kann die Löslichkeit einer bestimmten Verbindung mit der Temperatur zu- oder abnehmen. Die van 't Hoff-Gleichung setzt die Änderung der Löslichkeitsgleichgewichtskonstante (Ksp) in Beziehung zur Temperaturänderung und zur Änderung der Reaktionsenthalpie. Bei den meisten festen und flüssigen Stoffen nimmt die Löslichkeit mit der Temperatur zu, weil die Auflösungsreaktion endotherm ist (ΔH > 0). In flüssigem Wasser nimmt bei hohen Temperaturen (z. B. bei Annäherung an die kritische Temperatur) die Löslichkeit ionischer gelöster Stoffe tendenziell ab, da sich die Eigenschaften und die Struktur des flüssigen Wassers ändern; die niedrigere Dielektrizitätskonstante führt zu einem weniger polaren Lösungsmittel und zu einer Änderung der Hydratationsenergie, die sich auf das ΔG der Auflösungsreaktion auswirkt. ⓘ
Gasförmige gelöste Stoffe zeigen ein komplexeres Verhalten in Abhängigkeit von der Temperatur. Mit steigender Temperatur werden Gase in der Regel weniger löslich in Wasser (exotherme Lösungsreaktion, die mit ihrer Hydratation zusammenhängt) (bis zu einem Minimum, das bei den meisten permanenten Gasen unter 120 °C liegt), aber löslicher in organischen Lösungsmitteln (endotherme Lösungsreaktion, die mit ihrer Solvatation zusammenhängt). ⓘ
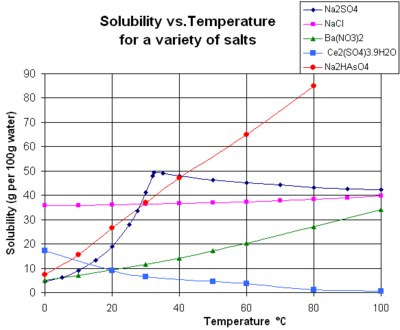
Die Grafik zeigt Löslichkeitskurven für einige typische feste anorganische Salze in flüssigem Wasser (Temperatur in Grad Celsius, d. h. Kelvin minus 273,15). Viele Salze verhalten sich wie Bariumnitrat und Dinatriumhydrogenarsenat und zeigen eine starke Zunahme der Löslichkeit mit der Temperatur (ΔH > 0). Einige gelöste Stoffe (z. B. Natriumchlorid in Wasser) weisen eine Löslichkeit auf, die ziemlich unabhängig von der Temperatur ist (ΔH ≈ 0). Einige wenige, wie Calciumsulfat (Gips) und Cer(III)-sulfat, werden mit zunehmender Temperatur weniger wasserlöslich (ΔH < 0). Dies gilt auch für Calciumhydroxid (Portlandit), dessen Löslichkeit bei 70 °C etwa die Hälfte des Wertes bei 25 °C beträgt. Die Auflösung von Calciumhydroxid in Wasser ist ebenfalls ein exothermer Prozess (ΔH < 0) und gehorcht der van 't Hoff-Gleichung und dem Prinzip von Le Chatelier. Eine Senkung der Temperatur begünstigt die Abfuhr der Lösungswärme aus dem System und damit die Auflösung von Ca(OH)2: die Löslichkeit von Portlandit nimmt also bei niedrigen Temperaturen zu. Diese Temperaturabhängigkeit wird manchmal als "rückläufige" oder "inverse" Löslichkeit bezeichnet. Gelegentlich wird ein komplexeres Muster beobachtet, wie z. B. bei Natriumsulfat, wo der weniger lösliche Dekahydratkristall (Mirabilit) bei 32 °C Kristallwasser verliert und eine löslichere wasserfreie Phase (Thenardit) mit einer geringeren Änderung der freien Gibbs-Energie (ΔG) bei der Auflösungsreaktion bildet. ⓘ
Die Löslichkeit von organischen Verbindungen nimmt fast immer mit der Temperatur zu. Die Technik der Rekristallisation, die zur Reinigung von Feststoffen verwendet wird, hängt von den unterschiedlichen Löslichkeiten eines gelösten Stoffes in heißen und kalten Lösungsmitteln ab. Es gibt einige wenige Ausnahmen, wie z. B. bestimmte Cyclodextrine. ⓘ
Druck
Für kondensierte Phasen (Feststoffe und Flüssigkeiten) ist die Druckabhängigkeit der Löslichkeit in der Regel schwach und wird in der Praxis meist vernachlässigt. Unter der Annahme einer idealen Lösung kann die Abhängigkeit quantifiziert werden als:
wobei der Index die Komponenten angibt, der Molenbruch der -ten Komponente in der Lösung, der Druck ist, der Index bezieht sich auf die konstante Temperatur, ist das partielle Molvolumen der -ten Komponente in der Lösung, ist das partielle Molvolumen der -Komponente im sich auflösenden Feststoff, und ist die universelle Gaskonstante. ⓘ
Die Druckabhängigkeit der Löslichkeit hat gelegentlich auch praktische Bedeutung. So kann z. B. die Ausfällung von Calciumsulfat (dessen Löslichkeit mit abnehmendem Druck abnimmt) auf Ölfeldern und in Bohrlöchern mit der Zeit zu einem Rückgang der Produktivität führen. ⓘ
Löslichkeit von Gasen
Das Henry'sche Gesetz wird zur Quantifizierung der Löslichkeit von Gasen in Lösungsmitteln verwendet. Die Löslichkeit eines Gases in einem Lösungsmittel ist direkt proportional zum Partialdruck des Gases über dem Lösungsmittel. Diese Beziehung ähnelt dem Raoult'schen Gesetz und kann wie folgt geschrieben werden:
wobei eine temperaturabhängige Konstante ist (zum Beispiel 769,2 L-atm/mol für Sauerstoff (O2) in Wasser bei 298 K), der Partialdruck (in atm) ist, und ist die Konzentration des gelösten Gases in der Flüssigkeit (in mol/L). ⓘ
Die Löslichkeit von Gasen wird manchmal auch mit dem Bunsenschen Löslichkeitskoeffizienten quantifiziert. ⓘ
Bei Vorhandensein kleiner Blasen hängt die Löslichkeit des Gases nicht vom Blasenradius ab, sondern nur von der Auswirkung des Radius auf den Druck (d. h. die Löslichkeit des Gases in der Flüssigkeit, die mit kleinen Blasen in Kontakt ist, erhöht sich aufgrund der Druckerhöhung um Δp = 2γ/r; siehe Young-Laplace-Gleichung). ⓘ
Das Henry'sche Gesetz gilt für Gase, die bei der Auflösung keine Änderung der chemischen Speziation erfahren. Das Sieverts'sche Gesetz zeigt einen Fall, in dem diese Annahme nicht zutrifft. ⓘ
Die Löslichkeit von Kohlendioxid in Meerwasser wird auch von der Temperatur, dem pH-Wert der Lösung und dem Karbonatpuffer beeinflusst. Die Abnahme der Löslichkeit von Kohlendioxid im Meerwasser bei steigender Temperatur ist auch ein wichtiger Rückwirkungsfaktor (positive Rückkopplung), der vergangene und künftige Klimaveränderungen verschärft, wie in Eisbohrkernen aus der Vostok-Station in der Antarktis beobachtet wurde. Auf der geologischen Zeitskala kommt es aufgrund der Milankovich-Zyklen zu einem Temperaturanstieg, wenn sich die astronomischen Parameter der Erdumlaufbahn und der Rotationsachse allmählich ändern und die Sonneneinstrahlung auf die Erdoberfläche verändern. Wenn eine Deglazierungsperiode beginnt, wird durch die fortschreitende Erwärmung der Ozeane CO2 in die Atmosphäre freigesetzt, da es im wärmeren Meerwasser weniger löslich ist. Ein höherer CO2-Gehalt in der Atmosphäre verstärkt wiederum den Treibhauseffekt, und Kohlendioxid wirkt als Verstärker der allgemeinen Erwärmung. ⓘ
Der Index i bezieht sich dabei auf das Gas in möglichen gemischten Lösungen, wie etwa bei der Lösung des Gasgemisches „Luft“ in Wasser. ⓘ
Eine Abweichung von der Proportionalität zwischen Gasdruck und Gleichgewichtskonzentration macht sich erst bei sehr hohen Drücken (im Vergleich zum Atmosphärendruck) bemerkbar. ⓘ
Polarität
Ein beliebter Aphorismus zur Vorhersage der Löslichkeit lautet "Gleiches löst Gleiches", was in der lateinischen Sprache auch als "Similia similibus solventur" ausgedrückt wird. Diese Aussage besagt, dass sich ein gelöster Stoff am besten in einem Lösungsmittel auflöst, das eine ähnliche chemische Struktur wie er selbst aufweist, und zwar aufgrund der günstigen Mischungsentropie. Diese Sichtweise ist vereinfacht, aber sie ist eine nützliche Faustregel. Die Gesamtlösungskapazität eines Lösungsmittels hängt in erster Linie von seiner Polarität ab. So ist beispielsweise ein sehr polarer (hydrophiler) Stoff wie Harnstoff in stark polarem Wasser sehr gut löslich, in relativ polarem Methanol weniger löslich und in unpolaren Lösungsmitteln wie Benzol praktisch unlöslich. Im Gegensatz dazu ist ein unpolarer oder lipophiler gelöster Stoff wie Naphthalin in Wasser unlöslich, in Methanol gut löslich und in unpolarem Benzol gut löslich. ⓘ

Noch einfacher ausgedrückt: Eine einfache ionische Verbindung (mit positiven und negativen Ionen) wie Natriumchlorid (Kochsalz) ist in einem stark polaren Lösungsmittel (mit einer gewissen Trennung von positiven (δ+) und negativen (δ-) Ladungen im kovalenten Molekül) wie Wasser leicht löslich, denn das Meer ist salzig, da es seit frühen geologischen Zeitaltern gelöste Salze ansammelt. ⓘ
Die Löslichkeit wird durch die Mischungsentropie (ΔS) begünstigt und hängt von der Auflösungsenthalpie (ΔH) und dem hydrophoben Effekt ab. Die freie Auflösungsenergie (Gibbs-Energie) ist temperaturabhängig und ergibt sich aus der Beziehung: ΔG = ΔH - TΔS. Ein kleineres ΔG bedeutet eine größere Löslichkeit. ⓘ
Chemiker machen sich die Unterschiede in der Löslichkeit oft zunutze, um Verbindungen aus Reaktionsgemischen zu trennen und zu reinigen, indem sie die Technik der Flüssig-Flüssig-Extraktion anwenden. Dies gilt für viele Bereiche der Chemie, von der Arzneimittelsynthese bis zur Wiederaufbereitung abgebrannter Kernbrennstoffe. ⓘ
Geschwindigkeit des Auflösens
Die Auflösung ist kein sofortiger Prozess. Die Auflösungsgeschwindigkeit (in kg/s) hängt mit dem Löslichkeitsprodukt und der Oberfläche des Materials zusammen. Die Geschwindigkeit, mit der sich ein Feststoff auflöst, kann von seiner Kristallinität (bzw. deren Fehlen im Falle amorpher Feststoffe), der Oberfläche (Kristallitgröße) und dem Vorhandensein von Polymorphismus abhängen. Viele praktische Systeme veranschaulichen diesen Effekt, z. B. bei der Entwicklung von Methoden zur kontrollierten Abgabe von Arzneimitteln. In manchen Fällen kann es lange dauern, bis sich ein Löslichkeitsgleichgewicht einstellt (Stunden, Tage, Monate oder viele Jahre, je nach Art des gelösten Stoffes und anderen Faktoren). ⓘ
Die Auflösungsgeschwindigkeit lässt sich häufig durch die Noyes-Whitney-Gleichung oder die Nernst-Brunner-Gleichung in der Form
wobei:
- = Masse des gelösten Stoffes
- = Zeit
- = Oberfläche der Grenzfläche zwischen der sich auflösenden Substanz und dem Lösungsmittel
- = Diffusionskoeffizient
- = Dicke der Grenzschicht des Lösungsmittels an der Oberfläche des sich lösenden Stoffes
- = Massenkonzentration des Stoffes an der Oberfläche
- = Massenkonzentration des Stoffes in der Masse des Lösungsmittels ⓘ
Für eine durch Diffusion (oder Stoffübergang bei Vermischung) begrenzte Auflösung, gleich der Löslichkeit der Substanz. Wird die Auflösungsrate einer reinen Substanz auf die Oberfläche des Feststoffs normiert (die sich in der Regel während des Auflösungsprozesses mit der Zeit ändert), so wird sie in kg/m2s ausgedrückt und als "intrinsische Auflösungsrate" bezeichnet. Die intrinsische Auflösungsrate ist in der United States Pharmacopeia definiert. ⓘ
Die Auflösungsraten variieren um Größenordnungen zwischen verschiedenen Systemen. Typischerweise gehen sehr niedrige Auflösungsraten mit niedrigen Löslichkeiten einher, und Substanzen mit hohen Löslichkeiten weisen hohe Auflösungsraten auf, wie die Noyes-Whitney-Gleichung nahelegt. ⓘ
Theorien der Löslichkeit
Löslichkeitsprodukt
Löslichkeitskonstanten werden verwendet, um gesättigte Lösungen von ionischen Verbindungen mit relativ geringer Löslichkeit zu beschreiben (siehe Löslichkeitsgleichgewicht). Die Löslichkeitskonstante ist ein Spezialfall einer Gleichgewichtskonstante. Da sie ein Produkt der Ionenkonzentrationen im Gleichgewicht ist, wird sie auch als Löslichkeitsprodukt bezeichnet. Sie beschreibt das Gleichgewicht zwischen den gelösten Ionen des Salzes und dem ungelösten Salz. Die Löslichkeitskonstante ist auch "anwendbar" (d. h. nützlich) für die Ausfällung, die Umkehrung der Auflösungsreaktion. Wie bei anderen Gleichgewichtskonstanten kann die Temperatur den numerischen Wert der Löslichkeitskonstante beeinflussen. Die Löslichkeitskonstante ist zwar nicht so einfach wie die Löslichkeit, aber der Wert dieser Konstante ist im Allgemeinen unabhängig von der Anwesenheit anderer Spezies im Lösungsmittel. ⓘ
Andere Theorien
Die Flory-Huggins-Lösungstheorie ist ein theoretisches Modell zur Beschreibung der Löslichkeit von Polymeren. Die Hansen-Löslichkeitsparameter und die Hildebrand-Löslichkeitsparameter sind empirische Methoden für die Vorhersage der Löslichkeit. Es ist auch möglich, die Löslichkeit anhand anderer physikalischer Konstanten wie der Schmelzenthalpie vorherzusagen. ⓘ
Der Oktanol-Wasser-Verteilungskoeffizient, in der Regel ausgedrückt als sein Logarithmus (Log P), ist ein Maß für die unterschiedliche Löslichkeit einer Verbindung in einem hydrophoben Lösungsmittel (1-Oktanol) und einem hydrophilen Lösungsmittel (Wasser). Der Logarithmus dieser beiden Werte ermöglicht eine Einstufung der Verbindungen nach ihrer Hydrophilie (oder Hydrophobie). ⓘ
Die mit dem Lösen verbundene Energieänderung wird in der Regel pro Mol gelöster Substanz als Lösungsenthalpie angegeben. ⓘ
Anwendungen
Die Löslichkeit ist von grundlegender Bedeutung für zahlreiche wissenschaftliche Disziplinen und praktische Anwendungen, die von der Erzaufbereitung und der Wiederaufbereitung von Kernmaterial bis hin zur Verwendung von Arzneimitteln und dem Transport von Schadstoffen reichen. ⓘ
Die Löslichkeit wird häufig als eine der "charakteristischen Eigenschaften eines Stoffes" bezeichnet, was bedeutet, dass die Löslichkeit häufig zur Beschreibung des Stoffes, zur Angabe der Polarität eines Stoffes, zur Unterscheidung von anderen Stoffen und als Leitfaden für die Verwendung des Stoffes verwendet wird. Indigo wird zum Beispiel als "unlöslich in Wasser, Alkohol oder Ether, aber löslich in Chloroform, Nitrobenzol oder konzentrierter Schwefelsäure" beschrieben. ⓘ
Die Löslichkeit eines Stoffes ist bei der Trennung von Gemischen nützlich. So kann beispielsweise ein Gemisch aus Salz (Natriumchlorid) und Kieselsäure durch Auflösen des Salzes in Wasser und Abfiltrieren der ungelösten Kieselsäure getrennt werden. Bei der Synthese chemischer Verbindungen, sei es im Labor im Milligrammmaßstab oder in der Industrie im Tonnenmaßstab, werden die relativen Löslichkeiten des gewünschten Produkts sowie der nicht umgesetzten Ausgangsstoffe, Neben- und Nebenprodukte genutzt, um eine Trennung zu erreichen. ⓘ
Ein weiteres Beispiel hierfür ist die Synthese von Benzoesäure aus Phenylmagnesiumbromid und Trockeneis. Benzoesäure ist in einem organischen Lösungsmittel wie Dichlormethan oder Diethylether besser löslich und löst sich beim Schütteln mit diesem organischen Lösungsmittel in einem Scheidetrichter bevorzugt in der organischen Schicht auf. Die anderen Reaktionsprodukte, einschließlich des Magnesiumbromids, verbleiben in der wässrigen Schicht, was deutlich zeigt, dass eine Trennung aufgrund der Löslichkeit erreicht wird. Dieses als Flüssig-Flüssig-Extraktion bekannte Verfahren ist eine wichtige Technik in der synthetischen Chemie. Um eine maximale Extraktion zu gewährleisten, wird Recycling eingesetzt. ⓘ
Unterschiedliche Löslichkeit
In fließenden Systemen bestimmen Unterschiede in der Löslichkeit oft den durch Auflösung und Ausfällung angetriebenen Transport von Spezies. Dies geschieht, wenn in verschiedenen Teilen des Systems unterschiedliche Bedingungen herrschen. Selbst geringfügig abweichende Bedingungen können, wenn genügend Zeit zur Verfügung steht, erhebliche Auswirkungen haben. ⓘ
So sind beispielsweise relativ schwer lösliche Verbindungen in extremeren Umgebungen löslich, was zu geochemischen und geologischen Auswirkungen der Aktivität hydrothermaler Fluide in der Erdkruste führt. Diese sind häufig die Quelle hochwertiger wirtschaftlicher Mineralvorkommen und kostbarer oder halbedler Edelsteine. Ebenso lösen sich Verbindungen mit geringer Löslichkeit über einen längeren Zeitraum (geologische Zeit) auf, was zu bedeutenden Auswirkungen wie ausgedehnten Höhlensystemen oder karstigen Landoberflächen führt. ⓘ
Löslichkeit von ionischen Verbindungen in Wasser
Einige ionische Verbindungen (Salze) lösen sich in Wasser auf, was auf die Anziehung zwischen positiven und negativen Ladungen zurückzuführen ist (siehe: Solvatation). So ziehen beispielsweise die positiven Ionen des Salzes (z. B. Ag+) das teilweise negative Sauerstoffatom in H2O an. Umgekehrt ziehen die negativen Ionen des Salzes (z. B. Cl-) die teilweise positiven Wasserstoffe in H2O an. Hinweis: Das Sauerstoffatom ist teilweise negativ, weil es elektronegativer ist als Wasserstoff und umgekehrt (siehe: chemische Polarität). ⓘ
- AgCl(s) ⇌ Ag+(aq) + Cl-(aq) ⓘ
Es gibt jedoch eine Grenze dafür, wie viel Salz in einem bestimmten Wasservolumen aufgelöst werden kann. Diese Konzentration ist die Löslichkeit und steht im Zusammenhang mit dem Löslichkeitsprodukt, Ksp. Diese Gleichgewichtskonstante hängt von der Art des Salzes (z. B. AgCl gegenüber NaCl), der Temperatur und dem gemeinsamen Ioneneffekt ab. ⓘ
Man kann die Menge an AgCl, die sich in 1 Liter reinem Wasser löst, wie folgt berechnen:
- Ksp = [Ag+] × [Cl-] / M2 (Definition des Löslichkeitsprodukts; M = mol/L)
- Ksp = 1,8 × 10-10 (aus einer Tabelle der Löslichkeitsprodukte)
[Ag+] = [Cl-], in Abwesenheit von anderen Silber- oder Chloridsalzen, also
- [Ag+]2 = 1,8 × 10-10 M2
- [Ag+] = 1,34 × 10-5 mol/L ⓘ
Das Ergebnis: 1 Liter Wasser kann bei Raumtemperatur 1,34 × 10-5 Mol AgCl lösen. Im Vergleich zu anderen Salzen ist AgCl schlecht in Wasser löslich. Kochsalz (NaCl) zum Beispiel hat einen viel höheren Ksp = 36 und ist daher besser löslich. Die folgende Tabelle gibt einen Überblick über die Löslichkeitsregeln für verschiedene ionische Verbindungen. ⓘ
| Löslich | Unlöslich ⓘ |
|---|---|
| Verbindungen der Gruppe I und NH4+ (außer Lithiumphosphat) | Carbonate (außer Gruppe I, NH4+ und Uranylverbindungen) |
| Nitrate | Sulfite (außer Verbindungen der Gruppe I und NH4+) |
| Acetate (Ethanoate) (außer Ag+-Verbindungen) | Phosphate (außer Gruppe I- und NH4+-Verbindungen (außer Li+)) |
| Chloride (Chlorate und Perchlorate), Bromide und Jodide (außer Ag+, Pb2+, Cu+ und Hg22+) | Hydroxide und Oxide (außer Gruppe I, NH4+, Ba2+, Sr2+ und Tl+) |
| Sulfate (außer Ag+, Pb2+, Ba2+, Sr2+ und Ca2+) | Sulfide (außer Verbindungen der Gruppe I, Gruppe II und NH4+) |
Löslichkeit von organischen Verbindungen
Der oben unter Polarität beschriebene Grundsatz, dass sich Gleiches in Gleichem auflöst, ist der übliche Leitfaden für die Löslichkeit organischer Systeme. So löst sich beispielsweise Vaseline in Benzin, da sowohl Vaseline als auch Benzin unpolare Kohlenwasserstoffe sind. In Ethylalkohol oder Wasser hingegen löst sie sich nicht, da die Polarität dieser Lösungsmittel zu hoch ist. Zucker löst sich nicht in Benzin, da Zucker im Vergleich zu Benzin zu polar ist. Ein Gemisch aus Benzin und Zucker kann daher durch Filtration oder Extraktion mit Wasser getrennt werden. ⓘ
Feste Lösung
Dieser Begriff wird in der Metallurgie häufig verwendet, um das Ausmaß zu bezeichnen, in dem sich ein Legierungselement im Grundmetall auflöst, ohne eine separate Phase zu bilden. Die Solvus- oder Löslichkeitslinie (oder -kurve) ist die Linie (oder Linien) in einem Phasendiagramm, die die Grenzen der Zugabe von gelösten Stoffen angibt. Das heißt, die Linien zeigen die maximale Menge eines Bestandteils, die zu einem anderen Bestandteil hinzugefügt werden kann und noch in fester Lösung vorliegt. In der kristallinen Struktur des Festkörpers kann das "gelöste" Element entweder den Platz der Matrix innerhalb des Gitters einnehmen (eine Substitutionsposition, z. B. Chrom in Eisen) oder einen Platz in einem Raum zwischen den Gitterpunkten einnehmen (eine Zwischengitterposition, z. B. Kohlenstoff in Eisen). ⓘ
Bei der Herstellung von Mikroelektronik bezieht sich die Löslichkeit von Festkörpern auf die maximale Konzentration von Verunreinigungen, die in das Substrat eingebracht werden kann. ⓘ
Bei festen Verbindungen (im Gegensatz zu Elementen) kann die Löslichkeit eines gelösten Elements auch von den Phasen abhängen, die sich im Gleichgewicht trennen. So kann beispielsweise die Menge des in der ZnSb-Phase löslichen Sn erheblich davon abhängen, ob die sich im Gleichgewicht abscheidenden Phasen (Zn4Sb3+Sn(L)) oder (ZnSnSb2+Sn(L)) sind. Darüber hinaus kann sich die ZnSb-Verbindung mit Sn als gelöstem Element nach Erreichen der Löslichkeitsgrenze in andere Phasenkombinationen aufspalten, die von der ursprünglichen chemischen Zusammensetzung während der Synthese abhängen. Jede Kombination führt zu einer anderen Löslichkeit von Sn in ZnSb. Daher können Löslichkeitsstudien in Verbindungen, die auf das erste Auftreten von Sekundärphasen schließen, die Löslichkeit unterschätzen. Während die maximale Anzahl von Phasen, die sich im Gleichgewicht gleichzeitig abscheiden, durch die Gibb'sche Phasenregel bestimmt werden kann, gibt es für chemische Verbindungen selbst keine Begrenzung für die Anzahl solcher Phasentrennungskombinationen. Daher kann es schwierig sein, die "maximale Löslichkeit" in festen Verbindungen experimentell zu bestimmen, was die Äquilibrierung vieler Proben erfordert. Wenn der vorherrschende kristallografische Defekt (meist interstitielle oder substitutionelle Punktdefekte) in der festen Lösung chemisch erahnt werden kann, dann kann die Anwendung einiger einfacher thermodynamischer Richtlinien die Anzahl der für die Bestimmung der maximalen Löslichkeit erforderlichen Proben erheblich reduzieren. ⓘ
Inkongruente Auflösung
Viele Stoffe lösen sich kongruent (d. h. die Zusammensetzung des Feststoffs und der gelösten Substanz stimmen stöchiometrisch überein). Einige Stoffe können sich jedoch inkongruent auflösen, d. h. die Zusammensetzung des gelösten Stoffes in Lösung stimmt nicht mit der des Feststoffs überein. Diese Solubilisierung geht mit einer Veränderung des "primären Feststoffs" und möglicherweise der Bildung einer sekundären festen Phase einher. Im Allgemeinen bleibt jedoch auch ein Teil des primären Feststoffs erhalten, und es stellt sich ein komplexes Löslichkeitsgleichgewicht ein. So kann beispielsweise die Auflösung von Albit zur Bildung von Gibbsit führen. ⓘ
- NaAlSi3O8(s) + H+ + 7H2O ⇌ Na+ + Al(OH)3(s) + 3H4SiO4. ⓘ
In diesem Fall dürfte die Löslichkeit von Albit vom Verhältnis zwischen Feststoff und Lösungsmittel abhängen. Diese Art der Löslichkeit ist in der Geologie von großer Bedeutung, da sie zur Bildung von metamorphen Gesteinen führt. ⓘ
Im Prinzip können sowohl kongruente als auch inkongruente Auflösungen zur Bildung sekundärer fester Phasen im Gleichgewicht führen. Daher wird in der Materialwissenschaft die Löslichkeit für beide Fälle allgemeiner in Phasendiagrammen mit chemischer Zusammensetzung beschrieben. ⓘ
Vorhersage der Löslichkeit
Die Löslichkeit ist eine Eigenschaft, die in vielen Bereichen der Wissenschaft von Interesse ist, u. a. in den Bereichen Umweltvorhersage, Biochemie, Pharmazie, Entwicklung von Arzneimitteln, Agrochemie und Bindung von Protein-Liganden. Die Wasserlöslichkeit ist aufgrund der lebenswichtigen biologischen und transporttechnischen Funktionen des Wassers von grundlegendem Interesse. Neben diesem eindeutigen wissenschaftlichen Interesse an der Wasserlöslichkeit und den Lösungsmitteleffekten sind genaue Vorhersagen der Löslichkeit auch für die Industrie von Bedeutung. Die Fähigkeit, die Löslichkeit eines Moleküls genau vorherzusagen, bedeutet in vielen chemischen Produktentwicklungsprozessen, wie z. B. bei Arzneimitteln, potenziell große finanzielle Einsparungen. In der pharmazeutischen Industrie sind Löslichkeitsvorhersagen Teil des frühen Stadiums der Leitstrukturoptimierung von Arzneimittelkandidaten. Die Löslichkeit ist bis hin zur Formulierung ein Thema. Für solche Vorhersagen wurde eine Reihe von Methoden angewandt, darunter quantitative Struktur-Wirkungs-Beziehungen (QSAR), quantitative Struktur-Eigenschafts-Beziehungen (QSPR) und Data Mining. Diese Modelle liefern effiziente Vorhersagen zur Löslichkeit und stellen den derzeitigen Standard dar. Der Nachteil solcher Modelle besteht darin, dass sie keine physikalischen Erkenntnisse liefern können. Eine auf der physikalischen Theorie basierende Methode, die mit vertretbarem Aufwand ein ähnliches Maß an Genauigkeit erreichen kann, wäre sowohl in der Wissenschaft als auch in der Industrie ein leistungsstarkes Werkzeug. ⓘ
Physikalisch-theoretisch begründete Methoden verwenden in der Regel thermodynamische Zyklen, ein Konzept aus der klassischen Thermodynamik. Die beiden gebräuchlichen thermodynamischen Zyklen umfassen entweder die Berechnung der freien Energie der Sublimation (Feststoff zu Gas, ohne einen flüssigen Zustand zu durchlaufen) und der freien Energie der Lösung eines gasförmigen Moleküls (Gas zu Lösung) oder der freien Energie der Fusion (Feststoff zu einer geschmolzenen Phase) und der freien Energie des Mischens (geschmolzen zu Lösung). Diese beiden Prozesse sind in den folgenden Diagrammen dargestellt. ⓘ


Diese Zyklen wurden für Versuche von Vorhersagen nach ersten Prinzipien (Lösung mit Hilfe der grundlegenden physikalischen Gleichungen) unter Verwendung von physikalisch motivierten Lösungsmittelmodellen, zur Erstellung von parametrischen Gleichungen und QSPR-Modellen und Kombinationen aus beiden verwendet. Die Verwendung dieser Zyklen ermöglicht die Berechnung der freien Solvatationsenergie indirekt entweder über ein Gas (im Sublimationszyklus) oder eine Schmelze (Fusionszyklus). Dies ist hilfreich, da die direkte Berechnung der freien Solvatationsenergie äußerst schwierig ist. Die freie Solvatationsenergie kann mit Hilfe verschiedener Formeln in einen Löslichkeitswert umgewandelt werden. Der allgemeinste Fall ist unten dargestellt, wobei der Zähler die freie Solvatationsenergie, R die Gaskonstante und T die Temperatur in Kelvin ist. ⓘ
Bekannte angepasste Gleichungen für die Vorhersage der Löslichkeit sind die allgemeinen Löslichkeitsgleichungen. Diese Gleichungen gehen auf die Arbeit von Yalkowsky et al. zurück. Zunächst wird die ursprüngliche Formel angegeben, gefolgt von einer überarbeiteten Formel, die von einer anderen Annahme der vollständigen Mischbarkeit in Octanol ausgeht. ⓘ
Diese Gleichungen beruhen auf den Grundsätzen des Fusionszyklus. ⓘ
Quantitative Löslichkeit
Löslichkeit und Löslichkeitsprodukt
Die Löslichkeit eines Stoffes in einem Lösungsmittel muss nicht begrenzt sein. So ist Schwefelsäure mit Wasser in beliebigen Verhältnissen mischbar. ⓘ

Bei der Mischung von Phenol mit Wasser gibt es bei Raumtemperatur zwei Bereiche, eine Lösung von bis zu 8 % Phenol in Wasser und eine Lösung von bis zu 25 % Wasser in Phenol. Dazwischen bleibt ein Bereich „verbotener“ Mischungsverhältnisse. Werden Phenol und Wasser in diesen Verhältnissen zusammengemischt, führt dies zur Ausbildung von zwei flüssigen Phasen. Der Bereich der nicht möglichen Mischungsverhältnisse wird als Mischungslücke bezeichnet. Oberhalb einer bestimmten Temperatur, der oberen kritischen Temperatur der Lösung, im Fall von Phenol und Wasser bei ca. 340 K (67 °C), ist das Gemisch jedoch vollständig in jedem Verhältnis mischbar. ⓘ
Die quantitative Löslichkeit oder Löslichkeitsgrenze gibt bei begrenzt löslichen Systemen die maximale Konzentration des einen Stoffes in dem anderen an, bei der das Gemisch unter Gleichgewichtsbedingungen noch einphasig ist. Die Löslichkeitsgrenze ist temperaturabhängig. Wird die Löslichkeitsgrenze überschritten, so scheidet sich eine zweite Phase aus. Fehlt die nötige Aktivierungsenergie oder Diffusion für das Ausscheiden der zweiten Phase, so bleibt das Gemisch auch oberhalb der Löslichkeitsgrenze einphasig in einem metastabilen, übersättigten Zustand. ⓘ
Bei Salzen folgt die Löslichkeit aus dem Löslichkeitsprodukt unter der Bedingung, dass sich das Salz in und Ionen teilt.
Liegt keines der beteiligten Ionen zusätzlich aus einer Mischung vor, kann die Löslichkeit des betreffenden Salzes berechnet werden. Die Löslichkeit des Salzes ist:
In gemischten Lösungen, wie im natürlichen Wasser mit einer Vielzahl von Ionen, stimmen die Konzentrationen von Anionen und Kationen nicht stöchiometrisch paarweise überein (wie es der Lösung einzelner Salze entspräche). Ein Beispiel hierfür ist der gelöste Kalk, der durch gelöstes Kohlenstoffdioxid als Calciumhydrogencarbonat in Lösung geht und den wesentlichen Beitrag zur Wasserhärte bildet. Über das Dissoziationsgleichgewicht der Kohlensäure verschiebt sich mit dem wechselnden Kohlenstoffdioxidgehalt des Wassers (durch Atmung und Photosynthese der Wasserorganismen) auch die Konzentrationen der Carbonat- und Hydrogencarbonat-Anionen, die Konzentration der Calcium-Kationen bleibt unberührt. In diesem Fall entscheidet das Produkt aus den nicht äquivalenten Konzentrationen an Calcium- und Carbonat-Ionen darüber, ob und in welchem Umfang es wegen einer Überschreitung des Löslichkeitsproduktes zu einer Ausfällung von Calciumcarbonat (als Kesselstein oder Seekreide) kommt. ⓘ
Die quantitative Löslichkeit wird, wie allgemein die Konzentration von Lösungen, in verschiedenen Einheiten angegeben (auch ergänzt um die Temperatur):
- g/l Lösung (Massenkonzentration), ggf. auch mg/l
- g/g Lösung (Massenanteil, „Massenprozent“ bei Bezug auf 100 g)
- l/l Lösung (Volumenkonzentration, Vol.-% bei Bezug auf 100 l), ggf. auch ml/l
- mol/l Lösung (Stoffmengenkonzentration)
- val/l Lösung (Normalität, veraltet)
- mol/kg Lösemittel (Molalität) ⓘ
Bestimmung durch Leitfähigkeitsmessungen
Für in Wasser sehr schwer lösliche Salze (z. B. BaSO4, PbS, HgS, AgCl) kann das Löslichkeitsprodukt aus Leitfähigkeitsmessungen mit empfindlichen Konduktometern ermittelt werden. Zur Berechnung wird ferner die Grenzleitfähigkeit des Salzes bei unendlicher Verdünnung benötigt. ⓘ
Friedrich Kohlrausch und Arnold F. Holleman entwickelten diese Bestimmungsmethode. ⓘ
Temperaturabhängigkeit

Die Löslichkeit eines Stoffes in einem anderen hängt in erster Näherung von der Lösungsenthalpie ab: Ist die Lösungsreaktion endotherm (positive Lösungsenthalpie), so steigt die Löslichkeit beim Erhitzen. Bei einer exothermen Lösungsreaktion sinkt die Löslichkeit beim Erhitzen. Ist die Lösungsenthalpie annähernd null, wie etwa bei Kochsalz, so ändert sich die Löslichkeit beim Erhitzen kaum. ⓘ
Wie hoch die Löslichkeit ist, hängt jedoch nicht nur von der Lösungsenthalpie, sondern auch von der Lösungsentropie ab. Eine negative Lösungsenthalpie trägt damit zwar zu einer guten Löslichkeit bei, dennoch kann ein Salz schwer löslich sein, falls die Lösungsentropie gleichfalls negativ ist. ⓘ
Beispiel für die Berechnung der Konzentration der gesättigten Lösung eines Salzes
Berechnung der Konzentration c für eine gesättigte Lösung von Aluminiumsulfat in Wasser, bei bekanntem KL ⓘ
Das heißt: aus jedem Mol Aluminiumsulfat entstehen in der Lösung 2 Mol Aluminium- und 3 Mol Sulfationen. Weiterhin gelten folgende Zusammenhänge:
Die Faktoren vor c, wie die Exponenten in der vorhergehenden Gleichung, sind die stöchiometrischen Faktoren. In die Gleichung für KL eingesetzt, ergibt sich:
womit:
Die Zahlenwerte für die Löslichkeitsprodukte erhält man aus den freien Standard-Enthalpien. ⓘ
Lösung in Feststoffen
Die Gesetzmäßigkeiten der Löslichkeit bleiben prinzipiell auch für Feststoffe erhalten. Auch hier können unterschiedliche Phasen beobachtet werden. Ist ein festes Gemisch einphasig, liegt eine Lösung vor. Kristalline Stoffe bilden dabei Mischkristalle oder intermetallische Verbindungen. Getrennte Phasen liegen oft sehr feinverteilt vor. Dies ist besonders der Fall bei gegenüber der Diffusionsgeschwindigkeit hoher Abkühlgeschwindigkeit bei der Entstehung oder bei eutektischer Zusammensetzung. Daher ist mit bloßem Auge eine Beurteilung der Löslichkeit meist nicht möglich, besonders da auch einphasige Systeme oft kristallin gekörnt sind und außerdem interkristalline Korngrenzenphasen entstehen können. Hilfsmittel sind Diagramme des Temperaturverlaufes der Abkühlung, wo Phasenumwandlungen als Haltepunkte oder Knicke erscheinen, und lichtmikroskopische sowie weitere kristallographische Untersuchungen mit noch höherem Aufwand. ⓘ
Wesentlich häufiger als bei Flüssigkeiten liegen bei Feststoffen metastabile Lösungen vor. Diese entstehen besonders dann, wenn im bereits erstarrten Gemisch bei Temperaturabnahme die Löslichkeit abnimmt und keine ausreichende Diffusionsgeschwindigkeit mehr gegeben ist. Durch Lösungsglühen kann eine gleichmäßige Löslichkeit in einer Legierung nahe dem thermodynamischen Gleichgewicht erreicht werden. ⓘ
Die Löslichkeit von Feststoffen ineinander bzw. deren Mehrphasigkeit und die Veränderung dieser Eigenschaft mit der Temperatur ist von großer Bedeutung für die Bildung technischer Legierungen. Dabei ist auch oft eine Mehrphasigkeit erwünscht. Kupfer/Nickel und Silber/Gold sind Beispiele für Systeme mit vollständiger Löslichkeit bei jeder Zusammensetzung, das Letztere kommt als Elektron auch natürlich vor. Stähle sind dagegen weit überwiegend mehrphasig (Ferrit, Austenit, Martensit, Zementit), als einphasige Legierungen sind nur hochlegierte ferritische Chromstähle mit 15 % bis 30 % Chrom und weniger als 0,1 % Kohlenstoff von technischer Bedeutung. Das System Kupfer/Zink hat bei Raumtemperatur fünf verschiedene Phasen, die durch Mischungslücken getrennt sind. Je nach Zusammensetzung liegt nur eine davon oder in der Mischungslücke zwischen zwei Phasen ein Gemisch dieser beiden vor. Im technisch relevanten Bereich (Messing: Kupfergehalt min. 50 %) liegen zwei dieser Phasen. ⓘ
Das System Kupfer/Zinn, zu dem die Zinnbronze als älteste technische Legierung gehört, ist ein Beispiel für metastabile Verhältnisse: Zwischen 520 °C und 586 °C ist Zinn in Kupfer mit einem Anteil bis zu 15,8 % der bei dieser Temperatur bereits festen Legierung löslich. Obwohl bei Raumtemperatur im Gleichgewicht die Löslichkeit von Zinn nahe null liegt, bleibt Material, das bei der erhöhten Temperatur eine solche Zinnkonzentration nicht überschritten hat, bei weiterer Abkühlung einphasig, da nun kaum noch Diffusion stattfindet. Andererseits entmischt sich bereits bei der vorangehenden Erstarrung die Schmelze und das zuletzt erstarrte Material kann die Grenze von 15,8 % Zinn schon bei deutlich niedrigeren Zinngehalten der Legierung überschreiten. Wegen der großen Diffusionsträgheit des Zinns können diese Konzentrationsunterschiede nur durch längeres Glühen bei ca. 750 °C ausgeglichen werden. Beide Effekte zusammen führen dazu, dass gegossene Zinnbronze je nach Abkühlgeschwindigkeit bei Zinngehalten von maximal 4 % bis 6 % einphasig ist und durch Glühen sogar Einphasigkeit bis 15 % erreicht werden kann, obwohl bei Raumtemperatur keine nennenswerte Löslichkeit gegeben ist. ⓘ






























![{\displaystyle L={\frac {c_{eq}\mathrm {(} A^{+})}{m}}={\frac {c_{eq}\mathrm {(} B^{-})}{n}}={\sqrt[{n+m}]{\frac {K_{L}}{n^{n}\cdot m^{m}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/454763e592e3c6b088e034b7abc892d7ae59f8fe)




![{\displaystyle c={\sqrt[{5}]{\frac {K_{L}}{2^{2}\cdot 3^{3}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/313c5bc819b7ae9d82f11c2c1fa7e35f26d17adb)