Deuterium
 Deuterium-Isotop, hervorgehoben in einer verkürzten Tabelle der Nuklide mit den Ordnungszahlen 1 bis 29. Die Anzahl der Neutronen beginnt bei Null und nimmt von unten nach oben zu. Die Anzahl der Protonen beginnt bei eins und nimmt nach rechts hin zu. Stabile Isotope in blau. | |
| Allgemein | |
|---|---|
| Symbol | 2H |
| Bezeichnungen | Deuterium, Wasserstoff-2, H-2, Wasserstoff-2, D |
| Protonen (Z) | 1 |
| Neutronen (N) | 1 |
| Nuklid-Daten | |
| Natürliche Häufigkeit | 0,0156% (Erde) |
| Isotopenmasse | 2,01410177811 Da |
| Spin | 1+ |
| Überschüssige Energie | 13135,720±0,001 keV |
| Bindungsenergie | 2224,52±0,20 keV |
| Isotope des Wasserstoffs Vollständige Tabelle der Nuklide | |
Deuterium (oder Wasserstoff-2, Symbol 2
H
oder Deuterium, auch als schwerer Wasserstoff bezeichnet) ist eines der beiden stabilen Isotope des Wasserstoffs (das andere ist Protium, oder Wasserstoff-1). Der Kern eines Deuteriumatoms, Deuteron genannt, enthält ein Proton und ein Neutron, während das weitaus häufigere Protium keine Neutronen im Kern hat. Deuterium kommt in den Ozeanen der Erde in einer natürlichen Häufigkeit von etwa einem Atom auf 6420 Wasserstoffatome vor. Damit macht Deuterium etwa 0,0156 % (0,0312 % der Masse) des gesamten natürlich vorkommenden Wasserstoffs in den Ozeanen aus, während Protium mehr als 99,98 % ausmacht. Die Häufigkeit von Deuterium ändert sich geringfügig von einer Art von natürlichem Wasser zur anderen (siehe Wiener Standard-Meereswasser). ⓘ
Der Name Deuterium leitet sich vom griechischen Wort deuteros ab, das "zweite" bedeutet, um die beiden Teilchen zu bezeichnen, aus denen der Kern besteht. Deuterium wurde 1931 von Harold Urey entdeckt und benannt. Mit der Entdeckung des Neutrons im Jahr 1932 wurde die Kernstruktur des Deuteriums offensichtlich, und Urey erhielt 1934 den Nobelpreis "für seine Entdeckung des schweren Wasserstoffs". Bald nach der Entdeckung des Deuteriums stellten Urey und andere Proben von "schwerem Wasser" her, in denen der Deuteriumgehalt hoch konzentriert war. ⓘ
Deuterium wird im Inneren von Sternen schneller vernichtet als es produziert wird. Es wird angenommen, dass andere natürliche Prozesse nur eine unbedeutende Menge an Deuterium erzeugen. Nahezu alles in der Natur vorkommende Deuterium wurde beim Urknall vor 13,8 Milliarden Jahren erzeugt, da das Grund- oder Urverhältnis von Wasserstoff-1 zu Deuterium (etwa 26 Deuteriumatome auf eine Million Wasserstoffatome) aus dieser Zeit stammt. Dieses Verhältnis findet sich auch bei den Gasriesenplaneten, wie dem Jupiter. Die Analyse des Deuterium-Protium-Verhältnisses in Kometen ergab Ergebnisse, die dem durchschnittlichen Verhältnis in den Ozeanen der Erde (156 Deuteriumatome pro Million Wasserstoffatome) sehr ähnlich sind. Dies bestärkt die Theorie, dass ein Großteil des Wassers in den Ozeanen der Erde von Kometen stammt. Das Deuterium-Protium-Verhältnis des Kometen 67P/Churyumov-Gerasimenko, das von der Raumsonde Rosetta gemessen wurde, ist etwa dreimal so hoch wie das des Wassers auf der Erde. Dieser Wert ist der höchste, der bisher bei einem Kometen gemessen wurde. ⓘ
Das Deuterium-Protium-Verhältnis ist daher weiterhin ein aktives Forschungsthema sowohl in der Astronomie als auch in der Klimatologie. ⓘ
| Strukturformel ⓘ | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||
| Name | Deuterium | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | D2 (molekulare Form) | ||||||||||||
| Kurzbeschreibung |
farb- und geruchloses Gas | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | |||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Dichte |
0,17 kg·m−3 | ||||||||||||
| Schmelzpunkt |
−254,43 °C | ||||||||||||
| Siedepunkt |
−249,58 °C | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Der Name Deuterium stammt von Gilbert Newton Lewis (der Lehrer von Urey), der auch als erster schweren Wasserstoff herstellte. Hinweise auf das Isotop gab es schon mit der Entwicklung der Massenspektrometrie in den 1920ern. ⓘ
Unterschiede zum gewöhnlichen Wasserstoff (Protium)
Chemisches Symbol

Deuterium wird häufig durch das chemische Symbol D dargestellt. Da es ein Isotop des Wasserstoffs mit der Massenzahl 2 ist, wird es auch durch 2 dargestellt
H
. Die IUPAC erlaubt sowohl D als auch 2
H
erlaubt, obwohl 2
H
bevorzugt wird. Wegen der häufigen Verwendung des Isotops in verschiedenen wissenschaftlichen Verfahren wird der Einfachheit halber ein eigenes chemisches Symbol verwendet. Außerdem führt der große Massenunterschied zu Protium (1H) (Deuterium hat eine Masse von 2,014102 u, verglichen mit dem mittleren Wasserstoff-Atomgewicht von 1,007947 u und der Masse von Protium von 1,007825 u) zu nicht vernachlässigbaren chemischen Unterschieden bei protiumhaltigen Verbindungen, während die Gewichtsverhältnisse der Isotope in anderen chemischen Elementen in dieser Hinsicht weitgehend unbedeutend sind. ⓘ
Spektroskopie
In der Quantenmechanik hängen die Energieniveaus der Elektronen in den Atomen von der reduzierten Masse des Systems aus Elektron und Kern ab. Für das Wasserstoffatom wird die Rolle der reduzierten Masse am einfachsten im Bohr'schen Atommodell deutlich, wo die reduzierte Masse in einer einfachen Berechnung der Rydberg-Konstante und der Rydberg-Gleichung auftaucht, aber die reduzierte Masse taucht auch in der Schrödinger-Gleichung und der Dirac-Gleichung zur Berechnung der atomaren Energieniveaus auf. ⓘ
Die reduzierte Masse des Systems in diesen Gleichungen liegt nahe an der Masse eines einzelnen Elektrons, unterscheidet sich aber von ihr um einen kleinen Betrag, der etwa dem Verhältnis der Masse des Elektrons zum Atomkern entspricht. Für Wasserstoff beträgt dieser Betrag etwa 1837/1836, also 1,000545, und für Deuterium ist er sogar noch kleiner: 3671/3670, also 1,0002725. Die Energien der spektroskopischen Linien von Deuterium und leichtem Wasserstoff (Wasserstoff-1) unterscheiden sich also durch das Verhältnis dieser beiden Zahlen, das 1,000272 beträgt. Die Wellenlängen aller Deuterium-Spektroskopielinien sind um den Faktor 1,000272 kürzer als die entsprechenden Linien des leichten Wasserstoffs. In der astronomischen Beobachtung entspricht dies einer blauen Dopplerverschiebung um das 0,000272-fache der Lichtgeschwindigkeit, also 81,6 km/s. ⓘ
Bei der Schwingungsspektroskopie wie der Infrarot- und der Raman-Spektroskopie sowie bei Rotationsspektren wie der Mikrowellenspektroskopie sind die Unterschiede noch viel ausgeprägter, da die reduzierte Masse des Deuteriums deutlich höher ist als die des Protiums. In der Kernspinresonanzspektroskopie hat Deuterium eine ganz andere NMR-Frequenz (z. B. 61 MHz, während Protium bei 400 MHz liegt) und ist viel weniger empfindlich. Bei der Protium-NMR werden in der Regel deuterierte Lösungsmittel verwendet, um zu verhindern, dass das Lösungsmittel das Signal überlagert, obwohl auch eine eigenständige Deuterium-NMR möglich ist. ⓘ
Nukleosynthese beim Urknall
Es wird angenommen, dass Deuterium eine wichtige Rolle bei der Festlegung der Anzahl und des Verhältnisses der Elemente gespielt hat, die im Urknall entstanden sind. Wenn man die Thermodynamik und die durch die kosmische Expansion verursachten Veränderungen kombiniert, kann man den Anteil der Protonen und Neutronen auf der Grundlage der Temperatur an dem Punkt berechnen, an dem sich das Universum genug abgekühlt hat, um die Bildung von Kernen zu ermöglichen. Diese Berechnung ergibt, dass zu Beginn der Nukleogenese auf jedes Neutron sieben Protonen kamen, ein Verhältnis, das auch nach Abschluss der Nukleogenese stabil bleiben würde. Dieses Verhältnis war anfangs zugunsten der Protonen, vor allem weil die geringere Masse des Protons ihre Erzeugung begünstigte. Als sich das Universum ausdehnte, kühlte es ab. Freie Neutronen und Protonen sind weniger stabil als Heliumkerne, und die Protonen und Neutronen hatten einen starken energetischen Grund, Helium-4 zu bilden. Die Bildung von Helium-4 erfordert jedoch den Zwischenschritt der Bildung von Deuterium. ⓘ
Während eines Großteils der wenigen Minuten nach dem Urknall, in denen die Nukleosynthese stattgefunden haben könnte, war die Temperatur so hoch, dass die mittlere Energie pro Teilchen größer war als die Bindungsenergie von schwach gebundenem Deuterium; daher wurde jegliches Deuterium, das gebildet wurde, sofort zerstört. Diese Situation ist als Deuterium-Engpass bekannt. Der Engpass verzögerte die Bildung von Helium-4, bis das Universum kühl genug wurde, um Deuterium zu bilden (bei einer Temperatur, die etwa 100 keV entspricht). Zu diesem Zeitpunkt kam es zu einem plötzlichen Ausbruch der Elementbildung (zuerst Deuterium, das sofort zu Helium fusionierte). Kurz darauf, zwanzig Minuten nach dem Urknall, wurde das Universum jedoch zu kühl, um eine weitere Kernfusion und Nukleosynthese zu ermöglichen. Zu diesem Zeitpunkt waren die Elementhäufigkeiten nahezu unverändert, wobei die einzige Veränderung darin bestand, dass einige der radioaktiven Produkte der Urknall-Nukleosynthese (wie Tritium) zerfielen. Der Deuterium-Engpass bei der Bildung von Helium sowie das Fehlen stabiler Möglichkeiten für Helium, sich mit Wasserstoff oder mit sich selbst zu verbinden (es gibt keine stabilen Kerne mit Massenzahlen von fünf oder acht), bedeutete, dass sich beim Urknall nur eine unbedeutende Menge an Kohlenstoff oder Elementen, die schwerer als Kohlenstoff sind, bildete. Diese Elemente mussten also in Sternen entstehen. Gleichzeitig sorgte das Ausbleiben der Kernbildung während des Urknalls dafür, dass im späteren Universum reichlich Wasserstoff zur Verfügung stand, um langlebige Sterne, wie unsere Sonne, zu bilden. ⓘ
Häufigkeit
Deuterium kommt in der Natur in Spuren als Deuteriumgas, geschrieben 2
H
2 oder D2, aber die meisten der natürlich vorkommenden Atome im Universum sind mit einem typischen 1
H
Atom gebunden, ein Gas namens Wasserstoffdeuterid (HD oder 1
H
2
H
). ⓘ
Das Vorhandensein von Deuterium auf der Erde, in anderen Teilen des Sonnensystems (wie durch Planetensonden bestätigt) und in den Spektren von Sternen ist auch ein wichtiges Datum in der Kosmologie. Durch die Gammastrahlung der gewöhnlichen Kernfusion wird Deuterium in Protonen und Neutronen zerlegt, und außer der Nukleosynthese des Urknalls sind keine natürlichen Prozesse bekannt, die Deuterium auch nur annähernd in der beobachteten natürlichen Häufigkeit hätten erzeugen können. Deuterium wird durch den seltenen Cluster-Zerfall und die gelegentliche Absorption von natürlich vorkommenden Neutronen durch leichten Wasserstoff erzeugt, aber dies sind triviale Quellen. Man nimmt an, dass im Inneren der Sonne und anderer Sterne nur wenig Deuterium vorhanden ist, da bei diesen Temperaturen die Kernfusionsreaktionen, die Deuterium verbrauchen, viel schneller ablaufen als die Proton-Proton-Reaktion, die Deuterium erzeugt. Die Deuteriumkonzentration in der äußeren Sonnenatmosphäre entspricht jedoch in etwa der des Jupiters und ist wahrscheinlich seit der Entstehung des Sonnensystems unverändert geblieben. Die natürliche Häufigkeit von Deuterium scheint überall dort, wo Wasserstoff vorkommt, ein sehr ähnlicher Anteil an Wasserstoff zu sein, es sei denn, es sind offensichtliche Prozesse am Werk, die es konzentrieren. ⓘ
Das Vorhandensein von Deuterium in einem geringen, aber konstanten Anteil am gesamten Wasserstoff ist ein weiteres Argument für die Urknalltheorie gegenüber der Theorie des stationären Zustands des Universums. Die beobachteten Verhältnisse von Wasserstoff, Helium und Deuterium im Universum lassen sich nur schwer mit einem Urknallmodell erklären. Es wird geschätzt, dass sich die Deuteriumhäufigkeiten seit ihrer Entstehung vor etwa 13,8 Milliarden Jahren nicht wesentlich verändert haben. Messungen des Deuteriumgehalts in der Milchstraße aus der Ultraviolett-Spektralanalyse zeigen ein Verhältnis von bis zu 23 Deuteriumatomen pro Million Wasserstoffatome in ungestörten Gaswolken, was nur 15 % unter dem von WMAP geschätzten ursprünglichen Verhältnis von etwa 27 Atomen pro Million aus dem Urknall liegt. Dies wurde dahingehend interpretiert, dass bei der Sternentstehung in unserer Galaxie weniger Deuterium zerstört wurde als erwartet, oder dass das Deuterium vielleicht durch einen großen Zufluss von primordialem Wasserstoff von außerhalb der Galaxie wieder aufgefüllt wurde. Im Weltraum, nur wenige hundert Lichtjahre von der Sonne entfernt, beträgt die Deuteriumhäufigkeit nur 15 Atome pro Million, aber dieser Wert wird vermutlich durch die unterschiedliche Adsorption von Deuterium an Kohlenstoffstaubkörnern im interstellaren Raum beeinflusst. ⓘ
Die Häufigkeit von Deuterium in der Jupiteratmosphäre wurde von der Raumsonde Galileo direkt gemessen und beträgt 26 Atome pro Million Wasserstoffatome. ISO-SWS-Beobachtungen ergaben 22 Atome pro Million Wasserstoffatome auf dem Jupiter, und man geht davon aus, dass diese Häufigkeit in etwa dem ursprünglichen Verhältnis im Sonnensystem entspricht. Dies entspricht etwa 17 % des irdischen Deuterium-Wasserstoff-Verhältnisses von 156 Deuteriumatomen pro Million Wasserstoffatome. ⓘ
Bei Kometenkörpern wie dem Kometen Hale-Bopp und dem Halleyschen Kometen wurde ein relativ hoher Deuteriumgehalt gemessen (etwa 200 Atome D pro Million Wasserstoffatome), der gegenüber dem vermuteten Verhältnis im protosolaren Nebel angereichert ist, was wahrscheinlich auf die Erwärmung zurückzuführen ist, und der den Verhältnissen im Meerwasser der Erde ähnelt. Die jüngste Messung von Deuteriummengen von 161 Atomen D pro Million Wasserstoff im Kometen 103P/Hartley (einem ehemaligen Kuiper-Gürtel-Objekt), ein Verhältnis, das fast genau dem in den Ozeanen der Erde entspricht, unterstreicht die Theorie, dass das Oberflächenwasser der Erde größtenteils aus Kometen stammen könnte. Kürzlich wurde von Rosetta das Deuterium-Protium (D-H)-Verhältnis von 67P/Churyumov-Gerasimenko gemessen, das etwa dreimal so hoch ist wie das von Wasser auf der Erde, ein hoher Wert. Dies hat das Interesse an der Vermutung geweckt, dass das Wasser auf der Erde teilweise asteroiden Ursprungs sein könnte. ⓘ
Auch auf anderen terrestrischen Planeten, insbesondere auf dem Mars und der Venus, wurde eine Deuteriumkonzentration beobachtet, die über der mittleren solaren Häufigkeit liegt. ⓘ
Die natürliche Häufigkeit des Isotops Deuterium beträgt auf der Erde 0,015 Prozent (Stoffmengenanteil). Das auf der Erde vorkommende Wasser (1,4 Milliarden Kubikkilometer oder 1,4 ·1018 Tonnen) besteht zu rund einem Neuntel (2 u von 18 u) bzw. zu 11,19 Prozent seiner Masse aus Wasserstoff (einschließlich Deuterium), daher enthält es 0,0035 Prozent oder 5·1013 Tonnen Deuterium. Dieses ist überwiegend als DHO und sehr selten als D2O gebunden. ⓘ
Im Wasserdampf der Venusatmosphäre hat Deuterium einen Stoffmengenanteil von 1,6 %, in Proben des Kometen Tschurjumow-Gerassimenko wurde ein 2H/1H-Verhältnis von 0,053 % gemessen. ⓘ
Herstellung
Deuterium wird für industrielle, wissenschaftliche und militärische Zwecke hergestellt, indem man von gewöhnlichem Wasser ausgeht - von dem ein kleiner Teil natürlich vorkommendes schweres Wasser ist - und dann das schwere Wasser durch das Girdler-Sulfid-Verfahren, Destillation oder andere Methoden abtrennt. ⓘ
Theoretisch könnte Deuterium für schweres Wasser in einem Kernreaktor erzeugt werden, aber die Abtrennung aus gewöhnlichem Wasser ist das billigste Verfahren zur Massenproduktion. ⓘ
Der weltweit führende Lieferant von Deuterium war Atomic Energy of Canada Limited bis 1997, als die letzte Schwerwasseranlage stillgelegt wurde. Kanada verwendet schweres Wasser als Neutronenmoderator für den Betrieb des CANDU-Reaktors. ⓘ
Ein weiterer großer Produzent von schwerem Wasser ist Indien. Bis auf eine Ausnahme sind alle indischen Atomkraftwerke Schwerwasserdruckanlagen, die natürliches (d.h. nicht angereichertes) Uran verwenden. Indien verfügt über acht Schwerwasseranlagen, von denen sieben in Betrieb sind. Sechs Anlagen, von denen fünf in Betrieb sind, basieren auf dem D-H-Austausch in Ammoniakgas. Die beiden anderen Anlagen extrahieren Deuterium aus natürlichem Wasser in einem Verfahren, das Schwefelwasserstoffgas unter hohem Druck verwendet. ⓘ
Indien kann sich zwar selbst mit schwerem Wasser für den Eigenbedarf versorgen, exportiert aber inzwischen auch schweres Wasser in Reaktorqualität. ⓘ
Eigenschaften
Physikalische Eigenschaften
Im Vergleich zu Wasserstoff in seiner natürlichen Zusammensetzung auf der Erde hat reines Deuterium (D2) einen höheren Schmelzpunkt (18,72 K gegenüber 13,99 K), einen höheren Siedepunkt (23,64 K gegenüber 20,27 K), eine höhere kritische Temperatur (38,3 K gegenüber 32,94 K) und einen höheren kritischen Druck (1,6496 MPa gegenüber 1,2858 MPa). ⓘ
Die physikalischen Eigenschaften von Deuteriumverbindungen können erhebliche kinetische Isotopeneffekte und andere physikalische und chemische Eigenschaften aufweisen, die sich von denen der Protiumanaloga unterscheiden. D2O ist beispielsweise zähflüssiger als H2O. Chemisch gesehen gibt es bei Verbindungen schwerer Wasserstoffisotope im Vergleich zu Protium Unterschiede in der Bindungsenergie und -länge, die größer sind als die Isotopenunterschiede bei allen anderen Elementen. Die Bindungen, an denen Deuterium und Tritium beteiligt sind, sind etwas stärker als die entsprechenden Bindungen in Protium, und diese Unterschiede reichen aus, um erhebliche Veränderungen bei biologischen Reaktionen zu bewirken. Pharmazeutische Unternehmen sind daran interessiert, dass Deuterium schwerer aus Kohlenstoff zu entfernen ist als Protium. ⓘ
Deuterium kann Protium in Wassermolekülen ersetzen und schweres Wasser (D2O) bilden, das etwa 10,6 % dichter ist als normales Wasser (so dass daraus hergestelltes Eis im normalen Wasser sinkt). Schweres Wasser ist bei eukaryontischen Tieren leicht giftig, wobei eine 25%ige Substitution des Körperwassers zu Zellteilungsproblemen und Sterilität führt und eine 50%ige Substitution den Tod durch ein zytotoxisches Syndrom (Versagen des Knochenmarks und der Magen- und Darmschleimhaut) verursacht. Prokaryontische Organismen hingegen können in reinem schwerem Wasser überleben und wachsen, auch wenn sie sich nur langsam entwickeln. Trotz dieser Toxizität stellt der Verzehr von schwerem Wasser unter normalen Umständen keine gesundheitliche Gefahr für den Menschen dar. Es wird geschätzt, dass eine 70 kg schwere Person 4,8 Liter schweres Wasser ohne ernsthafte Folgen trinken kann. Kleine Dosen von schwerem Wasser (einige Gramm beim Menschen, die eine Deuteriummenge enthalten, die mit der normalerweise im Körper vorhandenen Menge vergleichbar ist) werden routinemäßig als harmlose Stoffwechselkontrollmittel bei Menschen und Tieren verwendet. ⓘ
Quanteneigenschaften
Das Deuteron hat den Spin +1 ("Triplett-Zustand") und ist somit ein Boson. Die NMR-Frequenz von Deuterium unterscheidet sich deutlich von der des normalen leichten Wasserstoffs. Auch mit Hilfe der Infrarotspektroskopie lassen sich viele deuterierte Verbindungen leicht unterscheiden, da sich die IR-Absorptionsfrequenz bei der Schwingung einer chemischen Bindung, die Deuterium enthält, stark von der des leichten Wasserstoffs unterscheidet. Die beiden stabilen Isotope des Wasserstoffs lassen sich auch mit Hilfe der Massenspektrometrie unterscheiden. ⓘ
Das Triplett-Deuteron-Nukleon ist bei EB = 2,23 MeV kaum gebunden, und keiner der höheren Energiezustände ist gebunden. Das Singulett-Deuteron ist ein virtueller Zustand mit einer negativen Bindungsenergie von ~60 keV. Es gibt kein derartiges stabiles Teilchen, aber dieses virtuelle Teilchen existiert vorübergehend bei der inelastischen Neutronen-Proton-Streuung und ist für den ungewöhnlich großen Neutronenstreuungsquerschnitt des Protons verantwortlich. ⓘ
Kerneigenschaften (das Deuteron)
Masse und Radius des Deuterons
Der Kern des Deuteriums wird als Deuteron bezeichnet. Er hat eine Masse von 2,013553212745(40) Da (etwas mehr als 1,875 GeV). ⓘ
Der Ladungsradius des Deuterons beträgt 2,12799(74) fm. ⓘ
Wie der Protonenradius ergibt auch die Messung mit Myon-Deuterium ein kleineres Ergebnis: 2,12562(78) fm. ⓘ
Spin und Energie
Deuterium ist eines von nur fünf stabilen Nukliden mit einer ungeraden Anzahl von Protonen und einer ungeraden Anzahl von Neutronen. (2
H
, 6
Li
, 10
B
, 14
N
, 180m
Ta
sowie die langlebigen radioaktiven Nuklide 40
K
, 50
V
, 138
La
, 176
Lu
natürlich vorkommen.) Die meisten ungeraden Kerne sind in Bezug auf den Betazerfall instabil, weil die Zerfallsprodukte gerade sind und daher aufgrund von Kernpaarungseffekten stärker gebunden sind. Deuterium hingegen profitiert davon, dass sein Proton und sein Neutron an einen Spin-1-Zustand gekoppelt sind, was zu einer stärkeren Kernanziehung führt; der entsprechende Spin-1-Zustand existiert nicht im Zwei-Neutronen- oder Zwei-Protonen-System, und zwar aufgrund des Pauli-Ausschlussprinzips, das erfordern würde, dass das eine oder andere identische Teilchen mit demselben Spin eine andere Quantenzahl, wie z. B. einen Bahndrehimpuls, aufweist. Der Bahndrehimpuls eines der beiden Teilchen führt jedoch zu einer niedrigeren Bindungsenergie für das System, was in erster Linie auf den zunehmenden Abstand der Teilchen im steilen Gradienten der Kernkraft zurückzuführen ist. In beiden Fällen führt dies dazu, dass der Diprotonen- und Dineutronenkern instabil ist. ⓘ
Das Proton und das Neutron, aus denen das Deuterium besteht, können durch neutrale Stromwechselwirkungen mit Neutrinos dissoziiert werden. Der Wirkungsquerschnitt für diese Wechselwirkung ist vergleichsweise groß, und Deuterium wurde im Experiment des Sudbury Neutrino Observatory erfolgreich als Neutrinoziel verwendet. ⓘ
Diatomares Deuterium (D2) hat ortho- und para-Kernspin-Isomere wie diatomarer Wasserstoff, jedoch mit Unterschieden in der Anzahl und Population der Spin-Zustände und Rotationsniveaus, die dadurch entstehen, dass das Deuteron ein Boson mit Kernspin gleich 1 ist. ⓘ
Isospin-Singlettzustand des Deuterons
Aufgrund der Ähnlichkeit der Masse und der Kerneigenschaften von Proton und Neutron werden sie manchmal als zwei symmetrische Typen desselben Objekts, eines Nukleons, betrachtet. Zwar hat nur das Proton eine elektrische Ladung, doch ist diese aufgrund der schwachen elektromagnetischen Wechselwirkung im Vergleich zur starken Kernwechselwirkung oft vernachlässigbar. Die Symmetrie zwischen Proton und Neutron ist als Isospin bekannt und wird mit I (oder manchmal T) bezeichnet. ⓘ
Der Isospin ist eine SU(2)-Symmetrie, wie der gewöhnliche Spin, also völlig analog dazu. Das Proton und das Neutron, die beide Isospin-1⁄2 haben, bilden ein Isospin-Doublett (analog zu einem Spin-Doublett), wobei ein "unterer" Zustand (↓) ein Neutron und ein "oberer" Zustand (↑) ein Proton ist. Ein Nukleonenpaar kann sich entweder in einem antisymmetrischen Isospin-Zustand, Singulett genannt, oder in einem symmetrischen Zustand, Triplett genannt, befinden. In Bezug auf den "down"- und "up"-Zustand ist das Singulett
- was auch geschrieben werden kann: ⓘ
Dies ist ein Kern mit einem Proton und einem Neutron, d. h. ein Deuteriumkern. Das Triplett ist
und besteht somit aus drei Arten von Kernen, die symmetrisch sein sollen: ein Deuterium-Kern (eigentlich ein hoch angeregter Zustand davon), ein Kern mit zwei Protonen und ein Kern mit zwei Neutronen. Diese Zustände sind nicht stabil. ⓘ
Näherungsweise Wellenfunktion des Deuterons
Die Wellenfunktion des Deuterons muss antisymmetrisch sein, wenn die Isospin-Darstellung verwendet wird (da ein Proton und ein Neutron keine identischen Teilchen sind, muss die Wellenfunktion im Allgemeinen nicht antisymmetrisch sein). Abgesehen von ihrem Isospin haben die beiden Nukleonen auch Spin und räumliche Verteilungen ihrer Wellenfunktion. Letztere ist symmetrisch, wenn das Deuteron unter der Parität symmetrisch ist (d. h. eine "gerade" oder "positive" Parität hat), und antisymmetrisch, wenn das Deuteron unter der Parität antisymmetrisch ist (d. h. eine "ungerade" oder "negative" Parität hat). Die Parität wird vollständig durch den Gesamtbahndrehimpuls der beiden Nukleonen bestimmt: Ist er gerade, dann ist die Parität gerade (positiv), ist er ungerade, dann ist die Parität ungerade (negativ). ⓘ
Da das Deuteron ein Isospin-Singlett ist, ist es antisymmetrisch, wenn die Nukleonen aufgrund des Isospins ausgetauscht werden, und muss daher symmetrisch sein, wenn ihr Spin und ihr Ort doppelt ausgetauscht werden. Daher kann es sich in einem der beiden folgenden Zustände befinden:
- Symmetrischer Spin und Symmetrie unter Parität. In diesem Fall multipliziert der Austausch der beiden Nukleonen die Deuterium-Wellenfunktion mit (-1) aufgrund des Isospin-Austauschs, (+1) aufgrund des Spin-Austauschs und (+1) aufgrund der Parität (Ortsaustausch), insgesamt also mit (-1), wie für die Antisymmetrie erforderlich.
- Antisymmetrischer Spin und antisymmetrisch unter Parität. In diesem Fall multipliziert der Austausch der beiden Nukleonen die Deuterium-Wellenfunktion mit (-1) aus dem Isospin-Austausch, (-1) aus dem Spin-Austausch und (-1) aus dem Paritäts-Austausch (Orts-Austausch), also insgesamt mit (-1), wie für die Antisymmetrie erforderlich. ⓘ
Im ersten Fall ist das Deuteron ein Spin-Triplett, so dass sein Gesamtspin s gleich 1 ist. Es hat auch eine gerade Parität und daher einen geraden Bahndrehimpuls l ; je niedriger sein Bahndrehimpuls, desto niedriger seine Energie. Der Zustand mit der niedrigsten möglichen Energie ist also s = 1, l = 0. ⓘ
Im zweiten Fall ist das Deuteron ein Spin-Singlett, d. h. sein Gesamtspin s ist 0. Es hat auch eine ungerade Parität und daher einen ungeraden Bahndrehimpuls l. Der Zustand mit der niedrigsten möglichen Energie ist daher s = 0, l = 1. ⓘ
Da s = 1 zu einer stärkeren Kernanziehung führt, befindet sich der Deuteriumgrundzustand im Zustand s = 1, l = 0. ⓘ
Die gleichen Überlegungen führen zu den möglichen Zuständen eines Isospin-Tripletts mit s = 0, l = gerade oder s = 1, l = ungerade. Der Zustand mit der niedrigsten Energie hat also s = 1, l = 1, höher als der des Isospin-Singletts. ⓘ
Die soeben dargelegte Analyse ist in der Tat nur eine Annäherung, sowohl weil Isospin keine exakte Symmetrie ist, als auch, was noch wichtiger ist, weil die starke Kernwechselwirkung zwischen den beiden Nukleonen mit dem Drehimpuls in der Spin-Bahn-Wechselwirkung zusammenhängt, die verschiedene s- und l-Zustände vermischt. Das heißt, s und l sind zeitlich nicht konstant (sie pendeln nicht mit der Hamiltonfunktion), und im Laufe der Zeit kann ein Zustand wie s = 1, l = 0 zu einem Zustand von s = 1, l = 2 werden. Die Parität ist weiterhin zeitlich konstant, so dass sich diese Zustände nicht mit ungeraden l-Zuständen (wie s = 0, l = 1) vermischen. Der Quantenzustand des Deuteriums ist also eine Überlagerung (Linearkombination) des Zustands s = 1, l = 0 und des Zustands s = 1, l = 2, auch wenn die erste Komponente viel größer ist. Da der Gesamtdrehimpuls j auch eine gute Quantenzahl ist (er ist eine Zeitkonstante), müssen beide Komponenten das gleiche j haben, also j = 1. Dies ist der Gesamtspin des Deuteriumkerns. ⓘ
Zusammenfassend lässt sich sagen, dass der Deuteriumkern in Bezug auf den Isospin antisymmetrisch ist und den Spin 1 und eine gerade (+1) Parität hat. Der relative Drehimpuls seiner Nukleonen l ist nicht genau definiert, und das Deuteron ist eine Überlagerung von meist l = 0 mit einigen l = 2. ⓘ
Magnetische und elektrische Multipole
Um das magnetische Dipolmoment μ des Deuteriums theoretisch zu bestimmen, verwendet man die Formel für ein magnetisches Kernmoment
mit
g(l) und g(s) sind g-Faktoren der Nukleonen. ⓘ
Da das Proton und das Neutron unterschiedliche Werte für g(l) und g(s) haben, muss man ihre Beiträge trennen. Jedes erhält die Hälfte des Deuterium-Bahndrehimpulses und Spin . Man kommt zu ⓘ
wobei die Indizes p und n für das Proton und das Neutron stehen und g(l)n = 0. ⓘ
Wenn man die gleichen Identitäten wie hier verwendet und den Wert g(l)p = 1 einsetzt, kommt man zu folgendem Ergebnis, ausgedrückt in Einheiten des Kernmagnetons μN
Für den Zustand s = 1, l = 0 (j = 1) erhält man
Für den Zustand s = 1, l = 2 (j = 1) erhält man
Der gemessene Wert des magnetischen Dipolmoments von Deuterium beträgt 0,857 μN, was 97,5 % des Wertes von 0,879 μN entspricht, den man durch einfache Addition der Momente von Proton und Neutron erhält. Dies deutet darauf hin, dass der Zustand des Deuteriums in guter Näherung ein s = 1, l = 0-Zustand ist, bei dem beide Nukleonen in die gleiche Richtung rotieren, ihre magnetischen Momente sich aber wegen des negativen Moments des Neutrons subtrahieren. ⓘ
Die etwas niedrigere experimentelle Zahl als diejenige, die sich aus der einfachen Addition der Protonen- und (negativen) Neutronenmomente ergibt, zeigt jedoch, dass Deuterium tatsächlich eine lineare Kombination der meisten s = 1, l = 0-Zustände mit einer leichten Beimischung von s = 1, l = 2-Zuständen ist. ⓘ
Der elektrische Dipol ist wie üblich Null. ⓘ
Das gemessene elektrische Quadrupol des Deuteriums beträgt 0,2859 e-fm2. Obwohl die Größenordnung angemessen ist, da der Deuteriumradius in der Größenordnung von 1 Femtometer liegt (siehe unten) und seine elektrische Ladung e ist, reicht das obige Modell für seine Berechnung nicht aus. Genauer gesagt, erhält der elektrische Quadrupol keinen Beitrag aus dem Zustand l =0 (der der dominante ist) und einen Beitrag aus einem Term, der die Zustände l =0 und l =2 mischt, da der elektrische Quadrupoloperator nicht mit dem Drehimpuls kommutiert. ⓘ
Der letztgenannte Beitrag ist in Ermangelung eines reinen l = 0-Beitrags dominant, kann aber nicht berechnet werden, ohne die genaue räumliche Form der Wellenfunktion der Nukleonen im Deuterium zu kennen. ⓘ
Höhere magnetische und elektrische Multipolmomente können aus ähnlichen Gründen nicht mit dem obigen Modell berechnet werden. ⓘ
Anwendungen
Deuterium hat eine Reihe von kommerziellen und wissenschaftlichen Anwendungen. Dazu gehören: ⓘ
Kernreaktoren
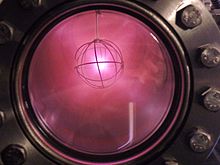
Deuterium wird in schwerwassermoderierten Spaltreaktoren verwendet, in der Regel in Form von flüssigem D2O, um Neutronen zu verlangsamen, ohne die hohe Neutronenabsorption von normalem Wasserstoff. Dies ist eine übliche kommerzielle Verwendung für größere Mengen Deuterium. ⓘ
In Forschungsreaktoren wird flüssiges D2 in kalten Quellen verwendet, um Neutronen auf sehr niedrige Energien und Wellenlängen zu dämpfen, die für Streuexperimente geeignet sind. ⓘ
Experimentell ist Deuterium das am häufigsten verwendete Nuklid in Kernfusionsreaktoren, insbesondere in Kombination mit Tritium, da die D-T-Reaktion eine hohe Reaktionsgeschwindigkeit (oder einen hohen Wirkungsquerschnitt) und eine hohe Energieausbeute aufweist. Es gibt ein noch ergiebigeres D-3
He
Fusionsreaktion, obwohl der Break-even-Punkt der D-3
He
höher ist als bei den meisten anderen Fusionsreaktionen; zusammen mit der Knappheit von 3
He
macht sie als praktische Energiequelle unwahrscheinlich, solange nicht zumindest die D-T- und D-D-Fusionsreaktionen in kommerziellem Maßstab durchgeführt worden sind. Die kommerzielle Kernfusion ist noch keine ausgereifte Technologie. ⓘ
NMR-Spektroskopie

Deuterium wird in der Wasserstoff-Kernresonanzspektroskopie (Protonen-NMR) am häufigsten auf folgende Weise verwendet. Bei der NMR müssen die interessierenden Verbindungen normalerweise in Lösung analysiert werden. Aufgrund der Kernspineigenschaften von Deuterium, die sich von denen des leichten Wasserstoffs unterscheiden, der normalerweise in organischen Molekülen vorkommt, unterscheiden sich die NMR-Spektren von Wasserstoff/Protium stark von denen von Deuterium, und in der Praxis wird Deuterium von einem NMR-Gerät, das auf leichten Wasserstoff abgestimmt ist, nicht "gesehen". Deuterierte Lösungsmittel (einschließlich schwerem Wasser, aber auch Verbindungen wie deuteriertes Chloroform, CDCl3) werden daher routinemäßig in der NMR-Spektroskopie verwendet, damit nur die Licht-Wasserstoff-Spektren der interessierenden Verbindung gemessen werden können, ohne dass das Lösungsmittel-Signal gestört wird. ⓘ
Die Kernspinresonanzspektroskopie kann auch verwendet werden, um Informationen über die Umgebung des Deuterons in isotopisch markierten Proben zu erhalten (Deuterium-NMR). So lässt sich beispielsweise die Flexibilität des Schwanzes, einer langen Kohlenwasserstoffkette, in deuteriummarkierten Lipidmolekülen mit Hilfe der Festkörper-Deuterium-NMR quantifizieren. ⓘ
Deuterium-NMR-Spektren sind im festen Zustand besonders aussagekräftig, da das Quadrupolmoment des Deuteriums im Vergleich zu den größeren quadrupolaren Kernen, wie z. B. Chlor-35, relativ klein ist. ⓘ

Aufspüren von
In der Chemie, der Biochemie und den Umweltwissenschaften wird Deuterium als nichtradioaktiver, stabiler Isotopen-Tracer verwendet, z. B. beim Test mit doppelt markiertem Wasser. In chemischen Reaktionen und Stoffwechselwegen verhält sich Deuterium ähnlich wie gewöhnlicher Wasserstoff (mit einigen chemischen Unterschieden, wie erwähnt). Deuterium lässt sich am einfachsten durch seine Masse von normalem Wasserstoff unterscheiden, und zwar mittels Massenspektrometrie oder Infrarotspektrometrie. Deuterium kann durch Femtosekunden-Infrarotspektroskopie nachgewiesen werden, da der Massenunterschied die Frequenz der Molekülschwingungen drastisch beeinflusst; die Schwingungen der Deuterium-Kohlenstoff-Bindung liegen in Spektralbereichen, die frei von anderen Signalen sind. ⓘ
Die Messung kleiner Schwankungen der natürlichen Häufigkeiten von Deuterium sowie der stabilen schweren Sauerstoffisotope 17O und 18O ist für die Hydrologie von Bedeutung, um den geografischen Ursprung der Gewässer der Erde zu ermitteln. Die schweren Wasserstoff- und Sauerstoffisotope im Regenwasser (so genanntes Meteorwasser) sind in Abhängigkeit von der Umgebungstemperatur der Region, in der der Niederschlag fällt, angereichert (und die Anreicherung hängt somit mit dem mittleren Breitengrad zusammen). Die relative Anreicherung der schweren Isotope im Regenwasser (bezogen auf das mittlere Meerwasser) fällt, wenn sie gegen die Temperatur aufgetragen wird, vorhersehbar entlang einer Linie, die als globale Meteorwasserlinie (GMWL) bezeichnet wird. Anhand dieses Diagramms können Proben von Niederschlagswasser zusammen mit allgemeinen Informationen über das Klima, in dem es entstanden ist, identifiziert werden. Verdunstungs- und andere Prozesse in Gewässern sowie Grundwasserprozesse verändern auch die Verhältnisse von schweren Wasserstoff- und Sauerstoffisotopen in Süß- und Salzwasser auf charakteristische und oft regional unterschiedliche Weise. Das Verhältnis der Konzentration von 2H zu 1H wird in der Regel mit einem Delta als δ2H angegeben, und die geografischen Muster dieser Werte werden in Karten, den so genannten Isoscapes, dargestellt. Stabile Isotope werden in Pflanzen und Tiere eingebaut, und eine Analyse der Verhältnisse bei einem Zugvogel oder einem Insekt kann einen groben Hinweis auf ihre Herkunft geben. ⓘ
Kontrasteigenschaften
Die Neutronenstreuungstechniken profitieren besonders von der Verfügbarkeit deuterierter Proben: Die H- und D-Querschnitte sind sehr unterschiedlich und haben verschiedene Vorzeichen, was eine Kontrastvariation in solchen Experimenten ermöglicht. Ein weiteres Problem des gewöhnlichen Wasserstoffs ist sein großer inkohärenter Neutronenquerschnitt, der bei D gleich Null ist. Die Substitution von Wasserstoffatomen durch Deuteriumatome verringert somit das Streurauschen. ⓘ
Wasserstoff ist ein wichtiger und wesentlicher Bestandteil aller Materialien der organischen Chemie und der Biowissenschaften, aber er interagiert kaum mit Röntgenstrahlen. Da Wasserstoff (und Deuterium) stark mit Neutronen wechselwirken, füllen Neutronenstreutechniken in Verbindung mit einer modernen Deuterierungsanlage eine Nische bei vielen Untersuchungen von Makromolekülen in der Biologie und vielen anderen Bereichen. ⓘ
Nuklearwaffen
Dieses Thema wird weiter unten behandelt. Es ist bemerkenswert, dass, obwohl die meisten Sterne, einschließlich der Sonne, die meiste Zeit ihres Lebens Energie durch die Fusion von Wasserstoff zu schwereren Elementen erzeugen, eine solche Fusion von leichtem Wasserstoff (Protium) unter den auf der Erde erreichbaren Bedingungen nie erfolgreich war. Alle künstlichen Fusionen, einschließlich der Wasserstofffusion in so genannten Wasserstoffbomben, erfordern daher schweren Wasserstoff (entweder Tritium oder Deuterium oder beides), damit der Prozess funktioniert. ⓘ
Drogen
Ein deuteriertes Arzneimittel ist ein Arzneimittel mit kleinen Molekülen, bei dem ein oder mehrere der im Arzneimittelmolekül enthaltenen Wasserstoffatome durch Deuterium ersetzt worden sind. Aufgrund des kinetischen Isotopeneffekts können deuteriumhaltige Arzneimittel eine deutlich geringere Stoffwechselrate und damit eine längere Halbwertszeit aufweisen. Im Jahr 2017 erhielt Deuteretrabenazin als erstes deuteriertes Medikament die FDA-Zulassung. ⓘ
Verstärkte essenzielle Nährstoffe
Deuterium kann verwendet werden, um bestimmte oxidationsanfällige C-H-Bindungen in essenziellen oder bedingt essenziellen Nährstoffen wie bestimmten Aminosäuren oder mehrfach ungesättigten Fettsäuren (PUFA) zu verstärken, wodurch sie resistenter gegen oxidative Schäden werden. Deuterierte mehrfach ungesättigte Fettsäuren, wie z. B. Linolsäure, verlangsamen die Kettenreaktion der Lipidperoxidation, die lebende Zellen schädigt. Der von Retrotope entwickelte deuterierte Ethylester der Linolsäure (RT001) befindet sich in einer Mitleidsstudie bei kindlicher neuroaxonaler Dystrophie und hat eine Phase-I/II-Studie bei Friedreich-Ataxie erfolgreich abgeschlossen. ⓘ
Thermostabilisierung
Lebendimpfstoffe, wie der orale Poliovirus-Impfstoff, können durch Deuterium stabilisiert werden, entweder allein oder in Kombination mit anderen Stabilisatoren wie MgCl2. ⓘ
Verlangsamung zirkadianer Oszillationen
Bei Ratten, Hamstern und Gonyaulax-Dinoflagellaten hat sich gezeigt, dass Deuterium die Oszillationszeit der zirkadianen Uhr verlängert. Bei Ratten stört die chronische Aufnahme von 25 % D2O die zirkadiane Rhythmik, indem sie die zirkadiane Periode der vom suprachiasmatischen Kern abhängigen Rhythmen im Hypothalamus des Gehirns verlängert. Experimente an Hamstern stützen ebenfalls die Theorie, dass Deuterium direkt auf den suprachiasmatischen Kern einwirkt, um die freilaufende zirkadiane Periode zu verlängern. ⓘ
Geschichte
Verdacht auf Isotope leichterer Elemente
Die Existenz nicht radioaktiver Isotope leichterer Elemente wurde bereits 1913 bei Untersuchungen von Neon vermutet und 1920 durch Massenspektrometrie leichter Elemente nachgewiesen. Die damals vorherrschende Theorie besagte, dass sich die Isotope eines Elements durch das Vorhandensein zusätzlicher Protonen im Kern unterscheiden, die von einer gleichen Anzahl von Kernelektronen begleitet werden. Nach dieser Theorie würde der Deuteriumkern mit der Masse zwei und der Ladung eins zwei Protonen und ein Kernelektron enthalten. Man ging jedoch davon aus, dass das Element Wasserstoff mit einer gemessenen durchschnittlichen Atommasse, die sehr nahe an 1 Da, der bekannten Masse des Protons, liegt, immer einen Kern aus einem einzigen Proton (einem bekannten Teilchen) hat und kein zweites Proton enthalten kann. Daher wurde angenommen, dass Wasserstoff keine schweren Isotope hat. ⓘ
Deuterium entdeckt

Deuterium wurde erstmals Ende 1931 von Harold Urey, einem Chemiker an der Columbia University, spektroskopisch nachgewiesen. Ureys Mitarbeiter, Ferdinand Brickwedde, destillierte fünf Liter kryogen erzeugten flüssigen Wasserstoffs zu 1 ml Flüssigkeit und nutzte dazu das Labor für Tieftemperaturphysik, das kurz zuvor am National Bureau of Standards in Washington, D.C. (heute National Institute of Standards and Technology) eingerichtet worden war. Diese Technik war zuvor zur Isolierung schwerer Isotope von Neon verwendet worden. Durch das kryogene Boiloff-Verfahren wurde der Anteil des Masse-2-Isotops des Wasserstoffs so weit konzentriert, dass seine spektroskopische Identifizierung eindeutig möglich war. ⓘ
Namensgebung für das Isotop und Nobelpreis
Urey schuf die Namen Protium, Deuterium und Tritium in einem 1934 veröffentlichten Artikel. Der Name basiert zum Teil auf dem Rat von G. N. Lewis, der den Namen "Deuterium" vorgeschlagen hatte. Der Name leitet sich vom griechischen deuteros ("zweiter") ab, und der Kern sollte "Deuteron" oder "Deuteron" genannt werden. Isotope und neue Elemente erhielten traditionell den Namen, den ihr Entdecker wählte. Einige britische Wissenschaftler, wie Ernest Rutherford, wollten, dass das Isotop "diplogen" heißt, abgeleitet vom griechischen diploos ("doppelt"), und dass der Kern "diplon" genannt wird. ⓘ
Die für die normale Häufigkeit dieses schweren Wasserstoffisotops abgeleitete Menge war so gering (nur etwa 1 Atom von 6400 Wasserstoffatomen im Meerwasser (156 Deuterium pro Million Wasserstoffatome)), dass sie frühere Messungen der (durchschnittlichen) Wasserstoffatommasse nicht merklich beeinflusst hatte. Dies erklärt, warum es zuvor nicht experimentell vermutet worden war. Urey war in der Lage, Wasser zu konzentrieren, um eine partielle Anreicherung von Deuterium nachzuweisen. Lewis hatte 1933 die ersten Proben von reinem schwerem Wasser hergestellt. Die Entdeckung von Deuterium, die noch vor der Entdeckung des Neutrons im Jahr 1932 erfolgte, war ein experimenteller Schock für die Theorie, aber als das Neutron entdeckt wurde und damit die Existenz von Deuterium erklärbar wurde, erhielt Urey 1934 den Nobelpreis für Chemie für Deuterium. Lewis war verbittert darüber, dass sein ehemaliger Schüler diese Anerkennung nicht erhielt. ⓘ
"Schweres Wasser"-Experimente im Zweiten Weltkrieg
Kurz vor dem Krieg verlegten Hans von Halban und Lew Kowarski ihre Forschungen zur Neutronenmoderation von Frankreich nach Großbritannien und schmuggelten den gesamten Weltvorrat an schwerem Wasser (das in Norwegen hergestellt worden war) in sechsundzwanzig Stahlfässern über die Grenze. ⓘ
Während des Zweiten Weltkriegs war bekannt, dass Nazi-Deutschland Experimente mit schwerem Wasser als Moderator für einen Kernreaktor durchführte. Diese Experimente waren besorgniserregend, da sie es ihnen ermöglichen könnten, Plutonium für eine Atombombe herzustellen. Dies führte schließlich zu der alliierten Operation "Norwegische Schwerwassersabotage", deren Ziel die Zerstörung der Deuteriumproduktions- und Anreicherungsanlage Vemork in Norwegen war. Zu dieser Zeit wurde dies als wichtig für den möglichen Kriegsverlauf angesehen. ⓘ
Nach dem Ende des Zweiten Weltkriegs entdeckten die Alliierten, dass Deutschland sich nicht so ernsthaft um das Programm bemühte, wie man zuvor angenommen hatte. Die Deutschen hatten nur einen kleinen, teilweise gebauten Versuchsreaktor fertig gestellt (der versteckt war) und waren nicht in der Lage gewesen, eine Kettenreaktion aufrechtzuerhalten. Am Ende des Krieges verfügten die Deutschen nicht einmal über ein Fünftel der für den Betrieb des Reaktors erforderlichen Menge an schwerem Wasser, was zum Teil auf die norwegische Sabotageaktion mit schwerem Wasser zurückzuführen war. Doch selbst wenn es den Deutschen gelungen wäre, einen Reaktor in Betrieb zu nehmen (wie es den USA mit Chicago Pile-1 Ende 1942 gelang), wären sie noch mindestens mehrere Jahre von der Entwicklung einer Atombombe entfernt gewesen. Der Entwicklungsprozess dauerte selbst bei maximalem Aufwand und maximaler Finanzierung sowohl in den USA als auch in der UdSSR etwa zweieinhalb Jahre (vom ersten kritischen Reaktor bis zur Bombe). ⓘ
Bei thermonuklearen Waffen

Die 62 Tonnen schwere Ivy-Mike-Bombe, die von den Vereinigten Staaten gebaut und am 1. November 1952 zur Explosion gebracht wurde, war die erste vollständig erfolgreiche "Wasserstoffbombe" (thermonukleare Bombe). In diesem Zusammenhang war sie die erste Bombe, bei der der größte Teil der freigesetzten Energie aus Kernreaktionsstufen stammt, die auf die primäre Kernspaltungsstufe der Atombombe folgen. Bei der Ivy-Mike-Bombe handelte es sich um ein fabrikähnliches Gebäude und nicht um eine abwerfbare Waffe. In ihrem Zentrum befand sich ein sehr großer zylindrischer, isolierter Vakuumkolben oder Kryostat, der kryogenes flüssiges Deuterium in einem Volumen von etwa 1000 Litern (160 Kilogramm Masse, wenn dieses Volumen vollständig gefüllt war) enthielt. Dann wurde eine herkömmliche Atombombe (die "Primärbombe") an einem Ende der Bombe verwendet, um die extremen Temperatur- und Druckbedingungen zu schaffen, die für die Auslösung der thermonuklearen Reaktion erforderlich waren. ⓘ
Innerhalb weniger Jahre wurden sogenannte "trockene" Wasserstoffbomben entwickelt, die keinen kryogenen Wasserstoff benötigen. Freigegebene Informationen deuten darauf hin, dass alle seither gebauten thermonuklearen Waffen in ihren Sekundärstufen chemische Verbindungen aus Deuterium und Lithium enthalten. Das Material, das das Deuterium enthält, ist meist Lithiumdeuterid, wobei das Lithium aus dem Isotop Lithium-6 besteht. Wenn das Lithium-6 mit schnellen Neutronen aus der Atombombe beschossen wird, entsteht Tritium (Wasserstoff-3), und dann gehen das Deuterium und das Tritium schnell in eine thermonukleare Fusion über, wobei reichlich Energie, Helium-4 und noch mehr freie Neutronen freigesetzt werden. "Reine" Fusionswaffen wie die Zar-Bombe gelten als überholt. Bei den meisten modernen ("geboosteten") thermonuklearen Waffen liefert die Fusion nur einen kleinen Teil der Gesamtenergie. Die Spaltung eines natürlichen Uran-U-238-Stampfers durch schnelle Neutronen, die bei der D-T-Fusion erzeugt werden, führt zu einer viel größeren (d. h. verstärkten) Energiefreisetzung als die Fusionsreaktion selbst. ⓘ
Moderne Forschung
Im August 2018 gaben Wissenschaftler die Umwandlung von gasförmigem Deuterium in eine flüssige metallische Form bekannt. Dies kann Forschern helfen, riesige Gasplaneten wie Jupiter, Saturn und verwandte Exoplaneten besser zu verstehen, da solche Planeten vermutlich eine große Menge an flüssigem metallischem Wasserstoff enthalten, der für ihre beobachteten starken Magnetfelder verantwortlich sein könnte. ⓘ
Daten für elementares Deuterium
Formel: D2 oder 2
1H
2 ⓘ
- Dichte: 0,180 kg/m3 bei STP (0 °C, 101,325 kPa).
- Atommasse: 2,0141017926 Da.
- Mittlere Häufigkeit in Meerwasser (aus VSMOW) 155,76 ± 0,1 ppm (ein Verhältnis von 1 Teil auf etwa 6420 Teile), d. h. etwa 0,015 % der Atome in einer Probe (nach Anzahl, nicht nach Gewicht) ⓘ
Daten bei etwa 18 K für D2 (Tripelpunkt):
- Dichte:
- Flüssigkeit: 162,4 kg/m3
- Gas: 0,452 kg/m3
- Viskosität: 12,6 μPa-s bei 300 K (Gasphase)
- Spezifische Wärmekapazität bei konstantem Druck cp:
- Fest: 2950 J/(kg-K)
- Gas: 5200 J/(kg-K) ⓘ
Antideuterium
Ein Antideuteron ist das antimaterielle Gegenstück zum Deuteriumkern und besteht aus einem Antiproton und einem Antineutron. Das Antideuteron wurde erstmals 1965 im Protonen-Synchrotron am CERN und im Wechselgradienten-Synchrotron am Brookhaven National Laboratory erzeugt. Ein vollständiges Atom, bei dem ein Positron den Kern umkreist, würde als Antideuterium bezeichnet werden, aber seit 2019 wurde noch kein Antideuterium erzeugt. Das vorgeschlagene Symbol für Antideuterium lautet
D
d. h. D mit einem Überstrich. ⓘ
Gewinnung
Deuterium lässt sich aufgrund des großen relativen Massenunterschieds leichter anreichern als die Isotope anderer Elemente wie Uran. In den ersten Anreicherungsstufen kommt gewöhnlich der Girdler-Sulfid-Prozess zum Einsatz. Dabei wird ausgenutzt, dass in einer wässrigen Schwefelwasserstoff-Lösung die Wasserstoffatome und die Deuteriumatome ihre Plätze zwischen beiden Molekülarten tauschen: Bei niedrigen Temperaturen wandert das Deuterium bevorzugt in das Wassermolekül, bei hohen Temperaturen in das Schwefelwasserstoffmolekül. In der letzten Anreicherungsstufe wird das Gemisch aus H2O, HDO und D2O durch Destillation getrennt. ⓘ
Neben dem Girdler-Sulfid-Prozess kann Deuterium auch durch Destillation und Elektrolyse angereichert werden. ⓘ
Sicherheitshinweise
Deuterium ist im Anhang VI der Verordnung (EG) Nr. 1272/2008 (CLP) nicht aufgeführt, ist aber in dieser Beziehung wie Wasserstoff zu betrachten, da sich alle Isotope eines Elements bezüglich ihres chemischen Verhaltens und ihrer Gefährlichkeit sehr ähnlich sind. ⓘ










![{\displaystyle \mu ={\frac {1}{4(j+1)}}\left[({g^{(s)}}_{p}+{g^{(s)}}_{n}){\big (}j(j+1)-l(l+1)+s(s+1){\big )}+{\big (}j(j+1)+l(l+1)-s(s+1){\big )}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3c23357e4baf596b679ef024306fab09a5396a8)

