Antibiotikum
| Antibiotikum ⓘ | |
|---|---|
| Wirkstoffklasse | |
 Prüfung der Empfindlichkeit von Staphylococcus aureus gegenüber Antibiotika mit der Kirby-Bauer-Scheibendiffusionsmethode: Antibiotika diffundieren von antibiotikahaltigen Scheiben und hemmen das Wachstum von S. aureus, was zu einer Hemmzone führt. |
Ein Antibiotikum ist eine antimikrobielle Substanz, die gegen Bakterien wirkt. Es ist der wichtigste antibakterielle Wirkstoff zur Bekämpfung bakterieller Infektionen, und antibiotische Medikamente werden in großem Umfang zur Behandlung und Vorbeugung solcher Infektionen eingesetzt. Sie können Bakterien entweder abtöten oder ihr Wachstum hemmen. Eine begrenzte Anzahl von Antibiotika hat auch eine antiprotozoische Wirkung. Antibiotika sind nicht wirksam gegen Viren wie Erkältungen oder Grippe; Medikamente, die Viren hemmen, werden als antivirale Medikamente oder Virostatika und nicht als Antibiotika bezeichnet. ⓘ
Manchmal wird der Begriff Antibiotikum - wörtlich "gegen das Leben", von den griechischen Wurzeln ἀντι anti, "gegen" und βίος bios, "Leben" - allgemein für jede Substanz verwendet, die gegen Mikroben eingesetzt wird, aber im üblichen medizinischen Sprachgebrauch sind Antibiotika (wie Penicillin) solche, die auf natürliche Weise produziert werden (von einem Mikroorganismus, der einen anderen bekämpft), während nicht-antibiotische antibakterielle Mittel (wie Sulfonamide und Antiseptika) vollständig synthetisch hergestellt werden. Beide Klassen haben jedoch das gleiche Ziel, nämlich die Abtötung oder Verhinderung des Wachstums von Mikroorganismen, und beide gehören zur antimikrobiellen Chemotherapie. Zu den "antibakteriellen Mitteln" gehören antiseptische Medikamente, antibakterielle Seifen und chemische Desinfektionsmittel, während Antibiotika eine wichtige Klasse von antibakteriellen Mitteln sind, die speziell in der Medizin und manchmal auch in der Viehzucht eingesetzt werden. ⓘ
Antibiotika werden seit dem Altertum verwendet. Viele Zivilisationen nutzten die örtliche Anwendung von verschimmeltem Brot, wobei zahlreiche Hinweise auf die positive Wirkung aus dem alten Ägypten, Nubien, China, Serbien, Griechenland und Rom stammen. Der erste Mensch, der die Verwendung von Schimmelpilzen zur Behandlung von Infektionen direkt dokumentierte, war John Parkinson (1567-1650). Im 20. Jahrhundert revolutionierten Antibiotika die Medizin. Alexander Fleming (1881-1955) entdeckte 1928 das moderne Penicillin, dessen breite Anwendung sich in Kriegszeiten als äußerst nützlich erwies. Die Wirksamkeit und der leichte Zugang zu Antibiotika haben jedoch auch zu deren übermäßigem Einsatz geführt, und einige Bakterien haben eine Resistenz gegen sie entwickelt. Die Weltgesundheitsorganisation hat die Antibiotikaresistenz als eine weit verbreitete "ernste Bedrohung [eingestuft], die nicht länger eine Vorhersage für die Zukunft ist, sondern bereits jetzt in jeder Region der Welt auftritt und jeden Menschen jeden Alters in jedem Land betreffen kann". Die Zahl der auf Antibiotikaresistenz zurückzuführenden Todesfälle lag 2019 weltweit bei 1,27 Millionen. ⓘ
Ein Antibiotikum (früher auch Antibioticum, von griech. ἀντί- anti- „gegen“ und βίος bios „Leben“; Plural: Antibiotika, Antibiotica) im ursprünglichen Sinne ist ein natürlich gebildetes niedermolekulares Stoffwechselprodukt von Pilzen oder Bakterien, das schon in geringer Konzentration das Wachstum anderer Mikroorganismen hemmt oder diese abtötet. Als Antibiotikum im weiteren Sinn gilt auch eine antimikrobiell eingesetzte Substanz, die in der Natur nicht vorkommt und teilsynthetisch, vollsynthetisch oder gentechnisch gewonnen wird, nicht jedoch Desinfektionsmittel. ⓘ
Antibiotika und ihre Derivate werden vielfach als Antiinfektiva (Arzneistoffe zur Behandlung von Infektionskrankheiten) verwendet. ⓘ
Im allgemeinen Sprachgebrauch bezieht sich die Bezeichnung Antibiotika meistens auf Arzneistoffe oder Arzneimittel zur Behandlung bakterieller Infektionskrankheiten. Zusammen mit Mitteln gegen Infektionskrankheiten durch Protozoen (Antiprotozoika), gegen Pilze (Antimykotika), gegen Viren (Virostatika) und Würmer (Anthelminthika) bilden sie die Gruppe der Therapeutika gegen Infektionskrankheiten (Antiinfektiva). ⓘ
Etymologie
Der Begriff "Antibiose", der "gegen das Leben" bedeutet, wurde von dem französischen Bakteriologen Jean Paul Vuillemin eingeführt, um das Phänomen zu beschreiben, das diese frühen antibakteriellen Medikamente zeigten. Die Antibiose wurde erstmals 1877 bei Bakterien beschrieben, als Louis Pasteur und Robert Koch beobachteten, dass ein über die Luft übertragener Bazillus das Wachstum von Bacillus anthracis hemmen konnte. Diese Medikamente wurden später von Selman Waksman, einem amerikanischen Mikrobiologen, 1947 in Antibiotika umbenannt. ⓘ
Der Begriff Antibiotikum wurde erstmals 1942 von Selman Waksman und seinen Mitarbeitern in Zeitschriftenartikeln verwendet, um jede Substanz zu beschreiben, die von einem Mikroorganismus produziert wird und das Wachstum anderer Mikroorganismen in hoher Verdünnung antagonistisch beeinflusst. Diese Definition schloss Substanzen aus, die Bakterien abtöten, aber nicht von Mikroorganismen produziert werden (z. B. Magensäfte und Wasserstoffperoxid). Auch synthetische antibakterielle Verbindungen wie die Sulfonamide wurden ausgeschlossen. Im heutigen Sprachgebrauch wird der Begriff "Antibiotikum" für alle Medikamente verwendet, die Bakterien abtöten oder ihr Wachstum hemmen, unabhängig davon, ob diese Medikamente von einem Mikroorganismus produziert werden oder nicht. ⓘ
Der Begriff "Antibiotikum" leitet sich von anti + βιωτικός (biōtikos), "lebensfähig, lebendig", ab, das wiederum von βίωσις (biōsis), "Lebensweise", und das von βίος (bios), "Leben", stammt. Der Begriff "antibakteriell" leitet sich von griechisch ἀντί (anti), "gegen" + βακτήριον (baktērion), Diminutiv von βακτηρία (baktēria), "Stab, Stock", ab, weil die ersten entdeckten Bakterien Stäbe waren. ⓘ
Verwendung
Medizinische Anwendungen
Antibiotika werden zur Behandlung oder Vorbeugung von bakteriellen Infektionen und manchmal auch von Protozoen-Infektionen eingesetzt. (Metronidazol ist gegen eine Reihe von parasitären Krankheiten wirksam). Wenn der Verdacht besteht, dass eine Infektion für eine Krankheit verantwortlich ist, der verantwortliche Erreger aber noch nicht identifiziert werden konnte, wird eine empirische Therapie durchgeführt. Diese beinhaltet die Verabreichung eines Breitbandantibiotikums auf der Grundlage der vorliegenden Anzeichen und Symptome und wird in Erwartung der Laborergebnisse eingeleitet, was mehrere Tage dauern kann. ⓘ
Wenn der verantwortliche pathogene Mikroorganismus bereits bekannt ist oder identifiziert wurde, kann eine endgültige Therapie eingeleitet werden. Dabei wird in der Regel ein Antibiotikum mit engem Wirkungsspektrum eingesetzt. Die Wahl des Antibiotikums richtet sich auch nach dessen Kosten. Die Identifizierung des Erregers ist von entscheidender Bedeutung, da dadurch die Kosten und die Toxizität der Antibiotikatherapie gesenkt und die Möglichkeit der Entstehung einer Antibiotikaresistenz verringert werden kann. Um eine Operation zu vermeiden, können bei einer unkomplizierten akuten Appendizitis Antibiotika verabreicht werden. ⓘ
Antibiotika können als Präventivmaßnahme verabreicht werden, was in der Regel auf Risikogruppen wie Menschen mit geschwächtem Immunsystem (insbesondere bei HIV-Infektionen zur Vorbeugung von Lungenentzündungen), Menschen, die immunsuppressive Medikamente einnehmen, Krebspatienten und Menschen, die sich einer Operation unterziehen müssen, beschränkt ist. Bei chirurgischen Eingriffen werden sie eingesetzt, um Infektionen der Einschnitte zu verhindern. Sie spielen eine wichtige Rolle bei der Antibiotikaprophylaxe in der Zahnmedizin, wo sie eine Bakteriämie und die daraus resultierende infektiöse Endokarditis verhindern können. Antibiotika werden auch zur Vorbeugung von Infektionen bei Neutropenie, insbesondere im Zusammenhang mit Krebs, eingesetzt. ⓘ
Der Einsatz von Antibiotika zur Sekundärprävention der koronaren Herzkrankheit wird durch die derzeitigen wissenschaftlichen Erkenntnisse nicht gestützt und kann sogar die kardiovaskuläre Mortalität, die Gesamtmortalität und das Auftreten von Schlaganfällen erhöhen. ⓘ
Wege der Verabreichung
Für die Antibiotikabehandlung gibt es viele verschiedene Verabreichungswege. Antibiotika werden in der Regel über den Mund eingenommen. In schwereren Fällen, insbesondere bei tief sitzenden systemischen Infektionen, können Antibiotika intravenös oder per Injektion verabreicht werden. Ist die Infektionsstelle leicht zugänglich, können Antibiotika auch topisch in Form von Augentropfen auf die Bindehaut bei Bindehautentzündungen oder Ohrentropfen bei Ohrentzündungen und akuten Fällen von Schwimmerohr verabreicht werden. Die topische Anwendung ist auch eine der Behandlungsmöglichkeiten für einige Hautkrankheiten wie Akne und Zellulitis. Zu den Vorteilen der topischen Anwendung gehört, dass eine hohe und anhaltende Konzentration des Antibiotikums am Ort der Infektion erreicht wird, dass das Potenzial für eine systemische Absorption und Toxizität verringert wird und dass die erforderliche Gesamtmenge des Antibiotikums reduziert wird, wodurch auch das Risiko eines Antibiotikamissbrauchs verringert wird. Es wurde berichtet, dass die topische Anwendung von Antibiotika auf bestimmten Arten von Operationswunden das Risiko von Infektionen an der Operationsstelle verringert. Bei der topischen Verabreichung von Antibiotika gibt es jedoch einige allgemeine Gründe zur Besorgnis. Es kann zu einer gewissen systemischen Absorption des Antibiotikums kommen; die Menge des aufgetragenen Antibiotikums ist schwer genau zu dosieren, und es besteht auch die Möglichkeit, dass lokale Überempfindlichkeitsreaktionen oder Kontaktdermatitis auftreten. Es wird empfohlen, Antibiotika so schnell wie möglich zu verabreichen, insbesondere bei lebensbedrohlichen Infektionen. Viele Notaufnahmen halten zu diesem Zweck Antibiotika bereit. ⓘ
Weltweiter Verbrauch
Der Verbrauch von Antibiotika ist von Land zu Land sehr unterschiedlich. In dem 2018 veröffentlichten WHO-Bericht über die Überwachung des Antibiotikaverbrauchs wurden Daten aus 65 Ländern aus dem Jahr 2015 analysiert. Gemessen in definierten Tagesdosen pro 1.000 Einwohner und Tag. Die Mongolei hatte den höchsten Verbrauch mit einer Rate von 64,4. Burundi hatte mit 4,4 den niedrigsten Wert. Amoxicillin und Amoxicillin/Clavulansäure waren die am häufigsten konsumierten Arzneimittel. ⓘ
Nebenwirkungen

Antibiotika werden vor ihrer Zulassung für den klinischen Einsatz auf etwaige negative Auswirkungen untersucht und gelten in der Regel als sicher und gut verträglich. Einige Antibiotika werden jedoch mit einer Vielzahl von Nebenwirkungen in Verbindung gebracht, die je nach Art des verwendeten Antibiotikums, der bekämpften Mikroben und des einzelnen Patienten von leicht bis sehr schwerwiegend reichen. Die Nebenwirkungen können die pharmakologischen oder toxikologischen Eigenschaften des Antibiotikums widerspiegeln oder mit Überempfindlichkeits- oder allergischen Reaktionen einhergehen. Die unerwünschten Wirkungen reichen von Fieber und Übelkeit bis hin zu schweren allergischen Reaktionen, einschließlich Photodermatitis und Anaphylaxie. ⓘ
Zu den häufigen Nebenwirkungen oraler Antibiotika gehören Durchfälle, die auf eine Störung der Artenzusammensetzung der Darmflora zurückzuführen sind, was beispielsweise zu einem übermäßigen Wachstum pathogener Bakterien wie Clostridium difficile führt. Die Einnahme von Probiotika während einer Antibiotikabehandlung kann dazu beitragen, antibiotikabedingte Durchfälle zu verhindern. Antibiotika können auch die Vaginalflora beeinträchtigen und zu einem übermäßigen Wachstum von Hefepilzarten der Gattung Candida im Vulvo-Vaginalbereich führen. Weitere Nebenwirkungen können sich aus der Wechselwirkung mit anderen Arzneimitteln ergeben, wie z. B. die Möglichkeit von Sehnenschäden bei der Verabreichung eines Chinolon-Antibiotikums mit einem systemischen Kortikosteroid. ⓘ
Einige Antibiotika können auch das Mitochondrium schädigen, eine von Bakterien stammende Organelle, die in eukaryontischen Zellen, einschließlich des Menschen, zu finden ist. Die Schädigung der Mitochondrien verursacht oxidativen Stress in den Zellen und wurde als ein Mechanismus für die Nebenwirkungen von Fluorchinolonen vorgeschlagen. Es ist auch bekannt, dass sie Chloroplasten angreifen. ⓘ
Wechselwirkungen
Antibabypillen
Es gibt nur wenige gut kontrollierte Studien darüber, ob die Einnahme von Antibiotika das Risiko eines Versagens der Antibabypille erhöht. Die meisten Studien deuten darauf hin, dass Antibiotika die Wirkung von Antibabypillen nicht beeinträchtigen. So zeigen klinische Studien, dass die durch Antibiotika verursachte Versagensrate bei Antibabypillen sehr gering ist (etwa 1 %). Situationen, die das Risiko eines Versagens der Antibabypille erhöhen können, sind z. B. Nichteinhaltung der Einnahmevorschriften (fehlende Einnahme der Pille), Erbrechen oder Durchfall. Magen-Darm-Störungen oder Schwankungen in der Resorption des oralen Kontrazeptivums, die den Serumspiegel von Ethinylestradiol im Blut beeinflussen. Frauen mit Menstruationsstörungen haben ein höheres Risiko für ein Versagen der Einnahme und sollten darauf hingewiesen werden, dass sie während der Antibiotikabehandlung und eine Woche nach deren Beendigung eine Ersatzverhütung anwenden sollten. Bei Verdacht auf patientenspezifische Risikofaktoren für eine verminderte Wirksamkeit der oralen Kontrazeptiva wird eine Ersatzverhütung empfohlen. ⓘ
In Fällen, in denen Antibiotika die Wirksamkeit von Antibabypillen beeinträchtigen können, wie z. B. bei dem Breitbandantibiotikum Rifampicin, kann dies auf eine erhöhte Aktivität von Leberenzymen zurückzuführen sein, die einen verstärkten Abbau der Wirkstoffe der Pille verursachen. Auch Auswirkungen auf die Darmflora, die zu einer verminderten Aufnahme von Östrogenen im Dickdarm führen könnten, wurden vorgeschlagen, doch sind diese Vorschläge nicht schlüssig und umstritten. Kliniker haben empfohlen, während der Behandlung mit Antibiotika, bei denen der Verdacht auf Wechselwirkungen mit oralen Kontrazeptiva besteht, zusätzliche empfängnisverhütende Maßnahmen zu ergreifen. Es sind weitere Studien zu den möglichen Wechselwirkungen zwischen Antibiotika und Antibabypillen (oralen Kontrazeptiva) erforderlich sowie eine sorgfältige Bewertung der patientenspezifischen Risikofaktoren für ein mögliches Versagen der oralen Kontrazeptiva, bevor die Notwendigkeit einer zusätzlichen Verhütungsmaßnahme ausgeschlossen werden kann. ⓘ
Alkohol
Zwischen Alkohol und bestimmten Antibiotika können Wechselwirkungen auftreten, die zu Nebenwirkungen und einer verminderten Wirksamkeit der Antibiotikatherapie führen können. Während es unwahrscheinlich ist, dass mäßiger Alkoholkonsum die Wirkung vieler gängiger Antibiotika beeinträchtigt, gibt es bestimmte Arten von Antibiotika, bei denen Alkoholkonsum zu schweren Nebenwirkungen führen kann. Die möglichen Risiken von Nebenwirkungen und die Wirksamkeit hängen daher von der Art des verabreichten Antibiotikums ab. ⓘ
Antibiotika wie Metronidazol, Tinidazol, Cephamandol, Latamoxef, Cefoperazon, Cefmenoxim und Furazolidon verursachen eine Disulfiram-ähnliche chemische Reaktion mit Alkohol, indem sie dessen Abbau durch Acetaldehyd-Dehydrogenase hemmen, was zu Erbrechen, Übelkeit und Kurzatmigkeit führen kann. Darüber hinaus kann die Wirksamkeit von Doxycyclin und Erythromycinsuccinat durch Alkoholkonsum verringert werden. Zu den weiteren Auswirkungen von Alkohol auf die antibiotische Wirkung gehört eine veränderte Aktivität der Leberenzyme, die die antibiotische Verbindung abbauen. ⓘ
Pharmakodynamik
Der Erfolg einer antimikrobiellen Therapie mit antibakteriellen Wirkstoffen hängt von mehreren Faktoren ab. Dazu gehören die Abwehrmechanismen des Wirtes, der Ort der Infektion sowie die pharmakokinetischen und pharmakodynamischen Eigenschaften des Antibiotikums. Die bakterientötende Wirkung von Antibiotika kann von der bakteriellen Wachstumsphase abhängen und erfordert oft eine laufende Stoffwechselaktivität und Teilung der Bakterienzellen. Diese Erkenntnisse beruhen auf Laborstudien, und auch in der Klinik hat sich gezeigt, dass die bakterielle Infektion beseitigt wird. Da die Aktivität von Antibiotika häufig von ihrer Konzentration abhängt, umfasst die In-vitro-Charakterisierung der antibakteriellen Aktivität in der Regel die Bestimmung der minimalen Hemmkonzentration und der minimalen bakteriziden Konzentration eines Antibiotikums. Zur Vorhersage der klinischen Ergebnisse wird die antimikrobielle Aktivität eines Antibiotikums in der Regel mit seinem pharmakokinetischen Profil kombiniert, und mehrere pharmakologische Parameter werden als Marker für die Wirksamkeit des Arzneimittels verwendet. ⓘ
Kombinationstherapie
Bei wichtigen Infektionskrankheiten, einschließlich Tuberkulose, wurde die Kombinationstherapie (d. h. die gleichzeitige Anwendung von zwei oder mehr Antibiotika) eingesetzt, um das Entstehen von Resistenzen zu verzögern oder zu verhindern. Bei akuten bakteriellen Infektionen werden Antibiotika als Teil einer Kombinationstherapie aufgrund ihrer synergistischen Wirkung verschrieben, um das Behandlungsergebnis zu verbessern, da die kombinierte Wirkung beider Antibiotika besser ist als ihre Einzelwirkung. Methicillin-resistente Staphylococcus aureus-Infektionen können mit einer Kombinationstherapie aus Fusidinsäure und Rifampicin behandelt werden. Antibiotika, die in Kombination verwendet werden, können auch antagonistisch sein, und die kombinierte Wirkung der beiden Antibiotika kann geringer sein, als wenn eines der Antibiotika als Monotherapie verabreicht wird. So sind beispielsweise Chloramphenicol und Tetracycline Antagonisten der Penicilline. Dies kann jedoch je nach Art der Bakterien variieren. Im Allgemeinen sind Kombinationen aus einem bakteriostatischen und einem bakterientötenden Antibiotikum antagonistisch. ⓘ
Neben der Kombination eines Antibiotikums mit einem anderen werden Antibiotika manchmal zusammen mit resistenzverändernden Mitteln verabreicht. So können beispielsweise β-Lactam-Antibiotika in Kombination mit β-Lactamase-Hemmern wie Clavulansäure oder Sulbactam eingesetzt werden, wenn ein Patient mit einem β-Lactamase produzierenden Bakterienstamm infiziert ist. ⓘ
Klassen
Man unterscheidet grundsätzlich zwei Arten der Wirkung:
- bakteriostatisch (Bakterien werden an der Vermehrung gehindert, aber nicht abgetötet)
- bakterizid (Bakterien werden abgetötet, etwa durch Bakteriolyse, also Auflösung ihrer Zellwand) ⓘ
Ansatzpunkt für die gewünschte Wirkung sind Strukturen oder Mechanismen der Bakterienzellen, die in tierischen bzw. menschlichen Zellen nicht vorkommen. So kann die Wirkung beispielsweise durch eine Hemmung der bakteriellen Zellwandsynthese, der Proteinsynthese am Ribosom, der DNA-Replikation oder der Folsäuresynthese erfolgen. Bakterien sind die einzigen bekannten Organismen, deren Zellwand aus Murein besteht. Dieser Zucker kommt ausschließlich in Bakterien vor – kein anderes bekanntes Lebewesen kann Murein produzieren. Ferner besitzen Bakterien andere Ribosomen zur Proteinbiosynthese und andere Enzyme zur DNA-Replikation als der Mensch. Menschliche Zellen bilden auch keine Folsäure wie Bakterien, sondern nehmen sie mit der Nahrung auf. Nur so ist es möglich, dass Antibiotika für den Menschen vergleichsweise gut verträglich sind. ⓘ
Die Vielfalt an Bakterien, auf die ein Antibiotikum wirkt, sein Wirkungsspektrum, ist je nach Antibiotikum unterschiedlich breit. Antibiotika, bei denen dieses Wirkungsspektrum sehr breit ist, die also auf eine Vielzahl unterschiedlicher Bakterien wirken, nennt man Breitbandantibiotika. ⓘ
Nach der chemischen Struktur unterscheidet man verschiedene Antibiotikagruppen: ⓘ


Herstellung
Dank der Fortschritte in der medizinischen Chemie sind die meisten modernen antibakteriellen Wirkstoffe halbsynthetische Abwandlungen verschiedener Naturstoffe. Dazu gehören zum Beispiel die Beta-Lactam-Antibiotika, zu denen die Penicilline (die von Pilzen der Gattung Penicillium produziert werden), die Cephalosporine und die Carbapeneme gehören. Zu den Verbindungen, die immer noch aus lebenden Organismen isoliert werden, gehören die Aminoglykoside, während andere antibakterielle Wirkstoffe - beispielsweise die Sulfonamide, die Chinolone und die Oxazolidinone - ausschließlich durch chemische Synthese hergestellt werden. Viele antibakterielle Verbindungen sind relativ kleine Moleküle mit einem Molekulargewicht von weniger als 1000 Dalton. ⓘ
Seit den ersten bahnbrechenden Bemühungen von Howard Florey und Chain im Jahr 1939 hat die Bedeutung von Antibiotika, einschließlich antibakterieller Wirkstoffe, für die Medizin zu einer intensiven Forschung zur Herstellung antibakterieller Wirkstoffe in großem Maßstab geführt. Nach dem Screening von antibakteriellen Wirkstoffen gegen ein breites Spektrum von Bakterien erfolgt die Herstellung der Wirkstoffe durch Fermentation, in der Regel unter stark aeroben Bedingungen. ⓘ
Resistenz
Das Auftreten von antibiotikaresistenten Bakterien ist ein häufiges Phänomen. Das Auftreten von Resistenzen spiegelt häufig evolutionäre Prozesse wider, die während einer Antibiotikatherapie ablaufen. Die Antibiotikabehandlung kann zur Selektion von Bakterienstämmen führen, die physiologisch oder genetisch besser in der Lage sind, hohe Dosen von Antibiotika zu überleben. Unter bestimmten Bedingungen kann dies zu einem bevorzugten Wachstum resistenter Bakterien führen, während das Wachstum anfälliger Bakterien durch das Medikament gehemmt wird. So wurde beispielsweise 1943 im Luria-Delbrück-Experiment eine antibakterielle Selektion für Stämme nachgewiesen, die zuvor Antibiotikaresistenzgene erworben hatten. Antibiotika wie Penicillin und Erythromycin, die früher eine hohe Wirksamkeit gegen viele Bakterienarten und -stämme hatten, sind aufgrund der zunehmenden Resistenz vieler Bakterienstämme weniger wirksam geworden. ⓘ
Die Resistenz kann in Form eines biologischen Abbaus von Arzneimitteln auftreten, z. B. durch Sulfamethazin abbauende Bodenbakterien, die durch den Kot von Medikamentenschweinen mit Sulfamethazin in Kontakt kommen. Das Überleben von Bakterien ist oft das Ergebnis einer vererbbaren Resistenz, aber die Resistenzbildung gegen antibakterielle Mittel erfolgt auch durch horizontalen Gentransfer. Eine horizontale Übertragung ist dort wahrscheinlicher, wo Antibiotika häufig eingesetzt werden. ⓘ
Die Antibiotikaresistenz kann biologische Kosten verursachen, wodurch die Fitness resistenter Stämme verringert wird, was die Ausbreitung antibakteriell resistenter Bakterien einschränken kann, z. B. wenn keine antibakteriellen Wirkstoffe zur Verfügung stehen. Zusätzliche Mutationen können jedoch diese Fitnesskosten kompensieren und das Überleben dieser Bakterien fördern. ⓘ
Paläontologische Daten zeigen, dass sowohl Antibiotika als auch Antibiotikaresistenz uralte Substanzen und Mechanismen sind. Nützliche antibiotische Ziele sind solche, bei denen Mutationen die bakterielle Reproduktion oder Lebensfähigkeit negativ beeinflussen. ⓘ
Es gibt mehrere molekulare Mechanismen der antibakteriellen Resistenz. Intrinsische Antibiotikaresistenz kann Teil des genetischen Aufbaus von Bakterienstämmen sein. Beispielsweise kann ein antibiotischer Angriffspunkt im bakteriellen Genom fehlen. Eine erworbene Resistenz resultiert aus einer Mutation im bakteriellen Chromosom oder dem Erwerb extrachromosomaler DNA. Bakterien, die Antibiotika produzieren, haben Resistenzmechanismen entwickelt, die nachweislich antibakteriell resistenten Stämmen ähneln und auf diese übertragen worden sein können. Die Ausbreitung der antibakteriellen Resistenz erfolgt häufig durch vertikale Übertragung von Mutationen während des Wachstums und durch genetische Rekombination der DNA durch horizontalen genetischen Austausch. So können beispielsweise antibakterielle Resistenzgene zwischen verschiedenen Bakterienstämmen oder -arten über Plasmide ausgetauscht werden, die diese Resistenzgene tragen. Plasmide, die mehrere verschiedene Resistenzgene tragen, können eine Resistenz gegen mehrere antibakterielle Wirkstoffe verleihen. Eine Kreuzresistenz gegen mehrere antibakterielle Wirkstoffe kann auch auftreten, wenn ein von einem einzigen Gen kodierter Resistenzmechanismus eine Resistenz gegen mehr als eine antibakterielle Verbindung vermittelt. ⓘ
Antibakteriell resistente Stämme und Arten, die manchmal als "Superbugs" bezeichnet werden, tragen heute zum Auftreten von Krankheiten bei, die eine Zeit lang gut unter Kontrolle waren. So stellen beispielsweise neu auftretende Bakterienstämme, die Tuberkulose verursachen und gegen bisher wirksame antibakterielle Behandlungen resistent sind, eine große therapeutische Herausforderung dar. Schätzungen zufolge treten jedes Jahr weltweit fast eine halbe Million neuer Fälle von multiresistenter Tuberkulose (MDR-TB) auf. NDM-1 beispielsweise ist ein neu identifiziertes Enzym, das die bakterielle Resistenz gegen eine breite Palette von Beta-Laktam-Antibiotika vermittelt. Die britische Gesundheitsbehörde Health Protection Agency hat erklärt, dass "die meisten Isolate mit NDM-1-Enzym gegen alle intravenösen Standardantibiotika zur Behandlung schwerer Infektionen resistent sind." Am 26. Mai 2016 wurde in den Vereinigten Staaten ein E. coli "Superbug" identifiziert, der gegen Colistin, das Antibiotikum der "letzten Verteidigungslinie", resistent ist. ⓘ
Fehlgebrauch

Im ICU Book heißt es: "Die erste Regel bei Antibiotika ist, sie nicht zu verwenden, und die zweite Regel ist, nicht zu viele von ihnen zu verwenden." Eine unsachgemäße Antibiotikabehandlung und ein übermäßiger Einsatz von Antibiotika haben zum Auftreten von antibiotikaresistenten Bakterien beigetragen. Die Selbstverschreibung von Antibiotika ist ein Beispiel für unsachgemäßen Gebrauch. Viele Antibiotika werden häufig zur Behandlung von Symptomen oder Krankheiten verschrieben, die nicht auf Antibiotika ansprechen oder die sich wahrscheinlich ohne Behandlung zurückbilden. Auch werden für bestimmte bakterielle Infektionen falsche oder suboptimale Antibiotika verschrieben. Der übermäßige Einsatz von Antibiotika wie Penicillin und Erythromycin wird seit den 1950er Jahren mit der Entstehung von Antibiotikaresistenzen in Verbindung gebracht. Der weit verbreitete Einsatz von Antibiotika in Krankenhäusern wurde auch mit der Zunahme von Bakterienstämmen und -arten in Verbindung gebracht, die auf die Behandlung mit den gängigsten Antibiotika nicht mehr ansprechen. ⓘ
Zu den häufigen Formen des Antibiotika-Missbrauchs gehören der übermäßige Einsatz von prophylaktischen Antibiotika bei Reisenden und das Versäumnis von Ärzten, die richtige Dosierung von Antibiotika auf der Grundlage des Gewichts des Patienten und der Vorgeschichte der Einnahme zu verschreiben. Andere Formen des Missbrauchs sind die nicht vollständige Einnahme des Antibiotikums, die falsche Dosierung und Verabreichung oder das Versäumnis, sich ausreichend zu erholen. Eine unangemessene Antibiotikabehandlung ist zum Beispiel die Verschreibung von Antibiotika zur Behandlung von Virusinfektionen wie Erkältungen. In einer Studie über Atemwegsinfektionen wurde festgestellt, dass "Ärzte mit größerer Wahrscheinlichkeit Antibiotika an Patienten verschreiben, die sie zu erwarten scheinen". Multifaktorielle Maßnahmen, die sich sowohl an Ärzte als auch an Patienten richten, können die unangemessene Verschreibung von Antibiotika verringern. Der Mangel an diagnostischen Schnelltests vor Ort, insbesondere in ressourcenbeschränkten Gebieten, gilt als eine der Ursachen für den Missbrauch von Antibiotika. ⓘ
Mehrere Organisationen, die sich mit der Resistenz gegen antimikrobielle Mittel befassen, setzen sich dafür ein, den unnötigen Einsatz von Antibiotika zu unterbinden. Die Problematik des Missbrauchs und der Überbeanspruchung von Antibiotika wurde durch die Gründung der US Interagency Task Force on Antimicrobial Resistance aufgegriffen. Diese Task Force zielt darauf ab, aktiv gegen die Antibiotikaresistenz vorzugehen, und wird von den US Centers for Disease Control and Prevention, der Food and Drug Administration (FDA) und den National Institutes of Health sowie anderen US-Behörden koordiniert. Eine Kampagnengruppe einer Nichtregierungsorganisation ist Keep Antibiotics Working. In Frankreich wurde 2002 eine Regierungskampagne mit dem Titel "Antibiotika sind kein Automatismus" gestartet, die zu einer deutlichen Verringerung unnötiger Antibiotikaverschreibungen, insbesondere bei Kindern, führte. ⓘ
Das Auftreten von Antibiotikaresistenzen hat dazu geführt, dass die Verwendung von Antibiotika im Vereinigten Königreich 1970 eingeschränkt wurde (Swann-Bericht 1969), und die Europäische Union hat die Verwendung von Antibiotika als Wachstumsförderer seit 2003 verboten. Darüber hinaus haben sich mehrere Organisationen (u. a. die Weltgesundheitsorganisation, die National Academy of Sciences und die US-amerikanische Food and Drug Administration) dafür ausgesprochen, den Einsatz von Antibiotika in der Nutztierhaltung zu beschränken. Häufig verzögern sich jedoch regulatorische und gesetzgeberische Maßnahmen zur Begrenzung des Antibiotikaeinsatzes, was zum Teil auf den Widerstand der Industrie, die Antibiotika einsetzt oder verkauft, gegen derartige Vorschriften zurückzuführen ist, sowie auf die Zeit, die für die Erforschung des kausalen Zusammenhangs zwischen dem Einsatz von Antibiotika und der Resistenz gegen sie benötigt wird. Zwei Bundesgesetze (S.742 und H.R. 2562), die darauf abzielen, die nichttherapeutische Verwendung von Antibiotika bei US-Lebensmitteltieren auslaufen zu lassen, wurden vorgeschlagen, aber nicht verabschiedet. Diese Gesetzesentwürfe wurden von Organisationen des öffentlichen Gesundheitswesens und der Medizin unterstützt, darunter die American Holistic Nurses' Association, die American Medical Association und die American Public Health Association. ⓘ
Trotz der Zusagen von Lebensmittelunternehmen und Restaurants, Fleisch von mit Antibiotika behandelten Tieren einzuschränken oder ganz zu vermeiden, nimmt der Kauf von Antibiotika für den Einsatz bei Nutztieren jedes Jahr zu. ⓘ
In der Tierhaltung werden Antibiotika in großem Umfang eingesetzt. In den Vereinigten Staaten wurde die Frage des Auftretens von antibiotikaresistenten Bakterienstämmen aufgrund des Einsatzes von Antibiotika in der Tierhaltung 1977 von der US Food and Drug Administration (FDA) aufgeworfen. Im März 2012 ordnete das US-Bezirksgericht für den südlichen Bezirk von New York im Rahmen einer Klage des Natural Resources Defense Council und anderer an, dass die FDA die Genehmigungen für den Einsatz von Antibiotika in der Viehzucht, die gegen die FDA-Vorschriften verstoßen, widerrufen muss. ⓘ
Studien haben gezeigt, dass weit verbreitete falsche Vorstellungen über die Wirksamkeit und Notwendigkeit von Antibiotika zur Behandlung häufiger leichter Krankheiten zu deren übermäßigem Einsatz beitragen. ⓘ
Die Wirksamkeit von Antibiotika steht grundsätzlich außer Frage und ist in vielen Fällen lebensrettend. Der organisierte Einsatz von Antibiotika zur Krankheitsvorbeugung und Leistungssteigerung in der Tiermast wird von Medizinern abgelehnt. Der Einsatz von Antibiotika bei Virusinfektionen und Entzündungen der oberen Atemwege oder beispielsweise der Nasennebenhöhlen ist aufgrund der Wirkungslosigkeit von Antibiotika gegenüber Viren in der Regel sinnlos (eine Ausnahme ist die Forschungschemikalie Feglymycin) und kann verstärkt zur Resistenzentwicklung von Bakterien beitragen. Aus diesen Gründen muss die Indikation für jede Antibiotikatherapie individuell und verantwortungsvoll entschieden werden. Dies wird im englischen Sprachraum auch als „Antibiotic Stewardship“ bezeichnet. ⓘ
Geschichte
Vor dem frühen 20. Jahrhundert beruhte die Behandlung von Infektionen in erster Linie auf medizinischer Folklore. Mischungen mit antimikrobiellen Eigenschaften, die bei der Behandlung von Infektionen eingesetzt wurden, wurden bereits vor über 2.000 Jahren beschrieben. Viele alte Kulturen, darunter die alten Ägypter und die alten Griechen, verwendeten speziell ausgewählte Schimmelpilze und pflanzliche Stoffe zur Behandlung von Infektionen. Bei Untersuchungen nubischer Mumien in den 1990er Jahren wurde festgestellt, dass sie erhebliche Mengen an Tetracyclin enthielten. Es wurde vermutet, dass das damals gebraute Bier die Quelle war. ⓘ
Die Verwendung von Antibiotika in der modernen Medizin begann mit der Entdeckung synthetischer, aus Farbstoffen gewonnener Antibiotika. ⓘ
Synthetische Antibiotika auf der Basis von Farbstoffen

Die synthetische antibiotische Chemotherapie als Wissenschaft und die Entwicklung von antibakteriellen Mitteln begann in Deutschland mit Paul Ehrlich in den späten 1880er Jahren. Ehrlich stellte fest, dass bestimmte Farbstoffe menschliche, tierische oder bakterielle Zellen färbten, während andere dies nicht taten. Daraufhin stellte er die Idee vor, dass es möglich sein könnte, Chemikalien zu entwickeln, die wie ein selektives Medikament wirken würden, das sich an Bakterien bindet und diese abtötet, ohne den menschlichen Wirt zu schädigen. Nachdem er Hunderte von Farbstoffen gegen verschiedene Organismen getestet hatte, entdeckte er 1907 ein medizinisch nützliches Medikament, die erste synthetische antibakterielle organoarsenische Verbindung Salvarsan, die heute Arsphenamin heißt. ⓘ

Dies läutete die Ära der antibakteriellen Behandlung ein, die mit der Entdeckung einer Reihe von synthetischen Antibiotika auf Arsenbasis durch Alfred Bertheim und Ehrlich im Jahr 1907 begann. Ehrlich und Bertheim hatten mit verschiedenen aus Farbstoffen gewonnenen Chemikalien experimentiert, um Trypanosomiasis bei Mäusen und Spirochaeta-Infektionen bei Kaninchen zu behandeln. Während ihre ersten Präparate zu giftig waren, hatten Ehrlich und Sahachiro Hata, ein japanischer Bakteriologe, der mit Ehrlich auf der Suche nach einem Medikament zur Behandlung der Syphilis zusammenarbeitete, mit dem 606sten Präparat ihrer Versuchsreihe Erfolg. Im Jahr 1910 gaben Ehrlich und Hata ihre Entdeckung, die sie als Medikament 606" bezeichneten, auf dem Kongress für Innere Medizin in Wiesbaden bekannt. Die Firma Hoechst begann Ende 1910 mit der Vermarktung des Mittels unter dem Namen Salvarsan, heute bekannt als Arsphenamin. Das Medikament wurde in der ersten Hälfte des 20. Jahrhunderts zur Behandlung von Syphilis eingesetzt. 1908 erhielt Ehrlich den Nobelpreis für Physiologie oder Medizin für seine Beiträge zur Immunologie. Hata wurde 1911 für den Nobelpreis für Chemie und 1912 und 1913 für den Nobelpreis für Physiologie oder Medizin nominiert. ⓘ
Das erste Sulfonamid und das erste systemisch wirksame antibakterielle Medikament, Prontosil, wurde 1932 oder 1933 von einem Forscherteam unter der Leitung von Gerhard Domagk in den Bayer-Laboratorien des IG-Farben-Konglomerats in Deutschland entwickelt, wofür Domagk 1939 den Nobelpreis für Physiologie oder Medizin erhielt. Sulfanilamid, der Wirkstoff von Prontosil, war nicht patentierbar, da er bereits seit einigen Jahren in der Farbstoffindustrie verwendet wurde. Prontosil hatte eine relativ breite Wirkung gegen grampositive Kokken, aber nicht gegen Enterobakterien. Der Erfolg von Prontosil stimulierte die Forschung in hohem Maße. Die Entdeckung und Entwicklung dieses Sulfonamidwirkstoffs eröffnete die Ära der antibakteriellen Mittel. ⓘ
Vielfach wird heute noch das 1910 von Paul Ehrlich eingeführte Arsphenamin als das zuerst entdeckte Antibiotikum der Geschichte angesehen. Sein Wirkungsspektrum war auf Spirochäten begrenzt (Schmalspektrum-Antibiotikum); es ermöglichte dadurch erstmals eine wirksame und relativ ungefährliche Therapie der damals weit verbreiteten Syphilis. ⓘ
Anders als das spätere Penicillin beruhten Arsphenamin und seine bis 1945 in Deutschland hergestellten Nachfolger (u. a. das 1934 zunächst als Antiinfektivum eingeführte Sulfamidochrysoidin, Handelsname Prontosil) noch nicht auf Schimmelpilzen, sondern auf künstlich hergestellten Farbstoffen. Arsphenamin ist in der modernen Medizin inzwischen von neueren Wirkstoffen abgelöst worden. Als nächstes Antibiotikum wurde dann 1935 das von Gerhard Domagk entdeckte Sulfonamid auf den Markt gebracht. ⓘ
Penicillin und andere natürliche Antibiotika
Seit dem späten 19. Jahrhundert wurden Beobachtungen gemacht, dass das Wachstum einiger Mikroorganismen das Wachstum anderer Mikroorganismen hemmt. Diese Beobachtungen der Antibiose zwischen Mikroorganismen führten zur Entdeckung natürlicher antibakterieller Wirkstoffe. Louis Pasteur stellte fest: "Wenn wir in den zwischen einigen Bakterien beobachteten Antagonismus eingreifen könnten, würde dies vielleicht die größten Hoffnungen für die Therapeutik wecken". ⓘ
1874 stellte der Arzt Sir William Roberts fest, dass Kulturen des Schimmelpilzes Penicillium glaucum, der bei der Herstellung einiger Blauschimmelkäsesorten verwendet wird, keine bakterielle Kontamination aufwiesen. 1876 leistete der Physiker John Tyndall ebenfalls einen Beitrag zu diesem Bereich. ⓘ
Im Jahr 1895 veröffentlichte der italienische Arzt Vincenzo Tiberio eine Arbeit über die antibakterielle Wirkung einiger Schimmelpilzextrakte. ⓘ
1897 legte der Doktorand Ernest Duchesne eine Dissertation mit dem Titel "Contribution à l'étude de la concurrence vitale chez les micro-organismes: antagonisme entre les moisissures et les microbes" (Beitrag zur Untersuchung des vitalen Wettbewerbs bei Mikroorganismen: Antagonismus zwischen Schimmelpilzen und Mikroben) vor, die erste bekannte wissenschaftliche Arbeit, die sich mit den therapeutischen Möglichkeiten von Schimmelpilzen aufgrund ihrer antimikrobiellen Aktivität befasste. In seiner Arbeit schlug Duchesne vor, dass Bakterien und Schimmelpilze in einem ständigen Kampf ums Überleben stehen. Duchesne beobachtete, dass E. coli durch Penicillium glaucum eliminiert wurde, wenn beide in derselben Kultur gezüchtet wurden. Er beobachtete auch, dass die Tiere nicht an Typhus erkrankten, wenn er ihnen tödliche Dosen von Typhusbakterien zusammen mit Penicillium glaucum einimpfte. Leider verhinderte Duchesnes Armeedienst nach seinem Abschluss weitere Forschungen. Duchesne starb an Tuberkulose, eine Krankheit, die heute mit Antibiotika behandelt wird. ⓘ
1928 postulierte Sir Alexander Fleming die Existenz von Penicillin, einem von bestimmten Schimmelpilzen produzierten Molekül, das bestimmte Bakterienarten abtötet oder deren Wachstum stoppt. Fleming arbeitete an einer Kultur von krankheitsverursachenden Bakterien, als er die Sporen eines grünen Schimmelpilzes, Penicillium rubens, in einer seiner Kulturplatten bemerkte. Er beobachtete, dass die Anwesenheit des Schimmels das Wachstum der Bakterien tötete oder verhinderte. Fleming postulierte, dass der Schimmelpilz eine antibakterielle Substanz absondern müsse, die er 1928 Penicillin nannte. Fleming glaubte, dass seine antibakteriellen Eigenschaften für die Chemotherapie genutzt werden könnten. Er charakterisierte zunächst einige seiner biologischen Eigenschaften und versuchte, einige Infektionen mit einem Rohpräparat zu behandeln, war aber nicht in der Lage, es ohne die Hilfe von ausgebildeten Chemikern weiterzuentwickeln. ⓘ
Ernst Chain, Howard Florey und Edward Abraham gelang es 1942, das erste Penicillin, Penicillin G, zu reinigen, aber es wurde außerhalb des alliierten Militärs nicht vor 1945 allgemein verfügbar. Später entwickelte Norman Heatley die Rückextraktionstechnik zur effizienten Reinigung von Penicillin in großen Mengen. Die chemische Struktur von Penicillin wurde erstmals 1942 von Abraham vorgeschlagen und später von Dorothy Crowfoot Hodgkin 1945 bestätigt. Gereinigtes Penicillin zeigte eine starke antibakterielle Wirkung gegen ein breites Spektrum von Bakterien und hatte eine geringe Toxizität für den Menschen. Außerdem wurde seine Wirkung im Gegensatz zu den synthetischen Sulfonamiden nicht von biologischen Bestandteilen wie Eiter gehemmt. (siehe unten) Die Entwicklung von Penicillin führte zu einem neuen Interesse an der Suche nach antibiotischen Verbindungen mit ähnlicher Wirksamkeit und Sicherheit. Für ihre erfolgreiche Entwicklung von Penicillin, das Fleming zufällig entdeckt hatte, aber nicht selbst entwickeln konnte, als therapeutisches Medikament teilten sich Chain und Florey den Nobelpreis für Medizin 1945 mit Fleming. ⓘ
Florey schrieb René Dubos die Pionierarbeit zu, gezielt und systematisch nach antibakteriellen Verbindungen zu suchen, was zur Entdeckung von Gramicidin führte und Floreys Penicillin-Forschung wiederbelebte. 1939, zeitgleich mit dem Ausbruch des Zweiten Weltkriegs, meldete Dubos die Entdeckung des ersten natürlich gewonnenen Antibiotikums, Tyrothricin, einer Verbindung aus 20 % Gramicidin und 80 % Tyrocidin aus Bacillus brevis. Es war eines der ersten kommerziell hergestellten Antibiotika und erwies sich bei der Behandlung von Wunden und Geschwüren während des Zweiten Weltkriegs als sehr wirksam. Gramicidin konnte jedoch aufgrund seiner Toxizität nicht systemisch eingesetzt werden. Auch Tyrocidin erwies sich für die systemische Anwendung als zu toxisch. Die in dieser Zeit gewonnenen Forschungsergebnisse wurden während des Zweiten Weltkriegs nicht zwischen den Achsenmächten und den Alliierten ausgetauscht und waren während des Kalten Krieges nur eingeschränkt zugänglich. ⓘ
Ende des 20. Jahrhunderts
In der Mitte des 20. Jahrhunderts nahm die Zahl der neuen antibiotischen Substanzen, die für die medizinische Verwendung eingeführt wurden, erheblich zu. Von 1935 bis 1968 wurden 12 neue Klassen eingeführt. Danach ging die Zahl der neuen Klassen jedoch deutlich zurück, und zwischen 1969 und 2003 wurden nur noch zwei neue Klassen eingeführt. ⓘ
Hintergrund
Entdeckung und Anwendung der Antibiotika gehören zu den bedeutendsten Entwicklungen der Medizingeschichte und wurden auch in Romanform geschildert. Louis Pasteur formulierte den Satz „Leben verhindert Leben“, nachdem er 1877 erkannt hatte, dass sich manche Bakterienarten gegenseitig am Wachstum hindern. ⓘ
Balds Augensalbe
2015 wurde von einem englischen Forscherteam das sogenannte Bald’s Leechbook aus dem 10. Jahrhundert untersucht. Sie fanden heraus, dass eine nach einem darin erwähnten Rezept angefertigte Augensalbe in vitro eine bakterizide Wirkung gegenüber dem Bakterium Staphylococcus aureus zeigte. In einem Modell aus infiziertem Mausgewebe vermochte sie die Keimzahl eines multiresistenten Krankenhauskeims Staphylococcus aureus (MRSA) deutlich zu reduzieren. Die Salbe enthielt eine Zubereitung aus Knoblauch, Zwiebeln, Wein und Ochsengalle. ⓘ
Seit 1941: Weite Verbreitung und Forschung bis heute
Mit dem Penicillin begann der eigentliche Siegeszug der Antibiotika in der Medizin. Die Erfolge des Penicillins führten zur Suche und Entdeckung weiterer Antibiotika: Streptomycin, Chloramphenicol, Aureomycin, Tetracyclin und vieler anderer. Die meisten heute bekannten Antibiotika leiten sich von Naturstoffen ab. ⓘ
Der bekannteste „Produzent“ von Antibiotika ist der Schimmelpilz Penicillium chrysogenum (früher P. notatum). Sein Produkt, das Penicillin, ist heute in der Laiensprache ein Synonym für Antibiotika. Auch heute noch werden zahlreiche medizinisch verwendete Antibiotika biotechnologisch produziert, als Produzenten dienen Bakterien wie die Streptomyceten. Eine ebenfalls sehr große Gruppe von Antibiotika sind Semisyntheseprodukte, die also chemisch verändert wurden, sich aber auch von natürlichen Produzenten ableiten. Nicht selten werden solche Substanzen aber heute mit modernen chemischen Methoden auch vollsynthetisch hergestellt, d. h. man verzichtet vollständig auf einen biotechnologischen Verfahrensschritt. ⓘ
In den 1970er und 1980er Jahren wurde verstärkt auf dem Gebiet der Antibiotika geforscht. Heute zählen Antibiotika zu den weltweit am häufigsten verschriebenen Medikamenten, mit dreizehn Prozent Marktanteil bilden sie den größten Einzelbereich nach der gesamten Erfassung unseres Arzneimittelverbrauchs. Von den heute etwa 8.000 bekannten antibiotischen Substanzen werden nur etwa 80 therapeutisch angewendet. In Deutschland sind 2005 laut BfArM insgesamt 2.775 Antibiotikapräparate zugelassen. 1987 hatten 10 bis 15 dieser Präparate einen Marktanteil von etwa vier Fünftel des Gesamtumsatzes. Im Jahr 1997 betrug der Anteil des Penicillins neun Prozent. ⓘ
Antibiotika-Pipeline
Sowohl die WHO als auch die Infectious Disease Society of America berichten, dass die schwache Antibiotika-Pipeline nicht mit der zunehmenden Fähigkeit der Bakterien zur Resistenzentwicklung Schritt hält. Der Bericht der Infectious Disease Society of America stellt fest, dass die Zahl der jährlich neu zugelassenen Antibiotika rückläufig ist, und nennt sieben Antibiotika gegen gramnegative Bazillen, die sich derzeit in Phase 2 oder 3 der klinischen Prüfung befinden. Diese Medikamente decken jedoch nicht das gesamte Resistenzspektrum der gramnegativen Bazillen ab. Nach Angaben der WHO befinden sich einundfünfzig neue therapeutische Wirkstoffe - Antibiotika (einschließlich Kombinationen) - in klinischen Studien der Phasen 1-3 (Stand: Mai 2017). Antibiotika, die auf multiresistente grampositive Erreger abzielen, haben weiterhin eine hohe Priorität. ⓘ
In den letzten sieben Jahren haben einige Antibiotika die Marktzulassung erhalten. Das Cephalosporin Ceftarolin und die Lipoglykopeptide Oritavancin und Telavancin zur Behandlung akuter bakterieller Haut- und Hautstrukturinfektionen und ambulant erworbener bakterieller Lungenentzündungen. Das Lipoglykopeptid Dalbavancin und das Oxazolidinon Tedizolid wurden ebenfalls für die Behandlung akuter bakterieller Haut- und Hautstrukturinfektionen zugelassen. Das erste einer neuen Klasse von makrozyklischen Schmalbandantibiotika, Fidaxomicin, wurde für die Behandlung von C. difficile-Kolitis zugelassen. Zu den ebenfalls zugelassenen neuen Cephalosporin-Lactamase-Hemmer-Kombinationen gehören Ceftazidim-Avibactam und Ceftolozan-Avibactam für komplizierte Harnwegsinfektionen und intraabdominale Infektionen. ⓘ
- Ceftolozan/Tazobactam (CXA-201; CXA-101/Tazobactam): Antipseudomonische Cephalosporin/β-Laktamase-Inhibitor-Kombination (Zellwandsynthese-Inhibitor). FDA-Zulassung am 19. Dezember 2014.
- Ceftazidim/Avibactam (Ceftazidim/NXL104): Antipseudomonische Cephalosporin/β-Laktamase-Inhibitor-Kombination (Zellwandsynthese-Inhibitor). FDA-Zulassung am 25. Februar 2015.
- Ceftarolin/Avibactam (CPT-Avibactam; Ceftarolin/NXL104): Anti-MRSA-Cephalosporin/β-Laktamase-Inhibitor-Kombination (Zellwandsynthese-Inhibitor).
- Cefiderocol: Cephalosporin-Siderophor. FDA-Zulassung am 14. November 2019.
- Imipenem/Relebactam: Carbapenem/β-Lactamase-Inhibitor-Kombination (Zellwandsynthese-Inhibitor). FDA-zugelassen am 16. Juli 2019.
- Meropenem/Vaborbactam: Carbapenem/ β-Lactamase-Inhibitor-Kombination (Zellwandsynthese-Inhibitor). FDA-zugelassen am 29. August 2017.
- Delafloxacin: Chinolon (Inhibitor der DNA-Synthese). FDA-zugelassen am 19. Juni 2017.
- Plazomicin (ACHN-490): halbsynthetisches Aminoglykosid-Derivat (Proteinsynthese-Hemmer). FDA-zugelassen am 25. Juni 2018.
- Eravacyclin (TP-434): synthetisches Tetracyclin-Derivat (Proteinsynthese-Inhibitor, der auf bakterielle Ribosomen abzielt). FDA-zugelassen am 27. August 2018.
- Omadacyclin: halbsynthetisches Tetracyclin-Derivat (Proteinsynthesehemmer, der auf bakterielle Ribosomen abzielt). FDA-Zulassung am 2. Oktober 2018.
- Lefamulin: Pleuromutilin-Antibiotikum. FDA-Zulassung am 19. August 2019.
- Brilacidin (PMX-30063): Peptid-Abwehrprotein-Mimetikum (Störung der Zellmembran). In Phase 2. ⓘ
Mögliche Verbesserungen umfassen eine Klärung der Vorschriften für klinische Studien durch die FDA. Außerdem könnten geeignete wirtschaftliche Anreize die Pharmaunternehmen dazu bewegen, in dieses Vorhaben zu investieren. In den USA wurde der Antibiotic Development to Advance Patient Treatment (ADAPT) Act mit dem Ziel eingeführt, die Entwicklung von Antibiotika zur Bekämpfung der wachsenden Bedrohung durch "Superbugs" zu beschleunigen. Nach diesem Gesetz kann die FDA Antibiotika und Antimykotika zur Behandlung lebensbedrohlicher Infektionen auf der Grundlage kleinerer klinischer Studien genehmigen. Die CDC wird den Einsatz von Antibiotika und die entstehende Resistenz überwachen und die Daten veröffentlichen. Das FDA-Verfahren zur Kennzeichnung von Antibiotika, die so genannten "Suszeptibilitätstest-Interpretationskriterien für mikrobielle Organismen" oder "Breakpoints", wird den Angehörigen der Gesundheitsberufe genaue Daten liefern. Laut Allan Coukell, Senior Director für Gesundheitsprogramme bei The Pew Charitable Trusts, "würde ADAPT die klinischen Studien praktikabler machen, indem es den Arzneimittelentwicklern erlaubt, sich auf kleinere Datensätze zu stützen, und die Befugnis der FDA klärt, bei diesen Arzneimitteln ein höheres Maß an Ungewissheit zu tolerieren, wenn sie eine Risiko-Nutzen-Kalkulation vornimmt." ⓘ
Aufstockung der Antibiotika-Pipeline und Entwicklung anderer neuer Therapien
Da immer wieder antibiotikaresistente Bakterienstämme auftauchen und sich ausbreiten, besteht ein ständiger Bedarf an der Entwicklung neuer antibakterieller Behandlungen. Zu den derzeitigen Strategien gehören traditionelle chemiebasierte Ansätze wie die Entdeckung von Arzneimitteln auf der Basis von Naturstoffen, neuere chemiebasierte Ansätze wie das Design von Arzneimitteln, traditionelle biologische Ansätze wie die Immunglobulintherapie und experimentelle biologische Ansätze wie die Phagentherapie, die Transplantation von fäkalen Mikrobiota, Behandlungen auf der Basis von Antisense-RNA und CRISPR-Cas9-Behandlungen. ⓘ
Entdeckung von Antibiotika auf der Grundlage von Naturprodukten
Die meisten der derzeit verwendeten Antibiotika sind Naturstoffe oder Naturstoffderivate, und auf der Suche nach neuen Antibiotika werden Bakterien-, Pilz-, Pflanzen- und Tierextrakte untersucht. Die Organismen können aus ökologischen, ethnomedizinischen, genomischen oder historischen Gründen für die Tests ausgewählt werden. So werden beispielsweise Heilpflanzen mit der Begründung untersucht, dass sie von traditionellen Heilern zur Vorbeugung oder Heilung von Infektionen verwendet werden und daher möglicherweise antibakterielle Verbindungen enthalten. Auch Bodenbakterien werden auf der Grundlage untersucht, dass sie historisch gesehen eine sehr ergiebige Quelle für Antibiotika sind (70 bis 80 % der derzeit verwendeten Antibiotika stammen von Aktinomyceten). ⓘ
Neben dem Screening von Naturstoffen auf direkte antibakterielle Aktivität werden sie manchmal auch auf ihre Fähigkeit untersucht, Antibiotikaresistenz und Antibiotikatoleranz zu unterdrücken. Einige Sekundärmetaboliten hemmen beispielsweise die Wirkstoff-Efflux-Pumpen, wodurch die Konzentration des Antibiotikums, das sein zelluläres Ziel erreichen kann, erhöht und die bakterielle Resistenz gegen das Antibiotikum verringert wird. Zu den Naturstoffen, von denen bekannt ist, dass sie bakterielle Effluxpumpen hemmen, gehören das Alkaloid Lysergol, die Carotinoide Capsanthin und Capsorubin sowie die Flavonoide Rotenon und Chrysin. Andere natürliche Produkte, diesmal eher Primärmetaboliten als Sekundärmetaboliten, haben gezeigt, dass sie die Antibiotika-Toleranz beseitigen. Glukose, Mannitol und Fruktose verringern beispielsweise die Antibiotikatoleranz von Escherichia coli und Staphylococcus aureus und machen sie anfälliger für die Abtötung durch Aminoglykosid-Antibiotika. ⓘ
Naturstoffe können auch auf ihre Fähigkeit untersucht werden, bakterielle Virulenzfaktoren zu unterdrücken. Virulenzfaktoren sind Moleküle, zelluläre Strukturen und Regulierungssysteme, die es Bakterien ermöglichen, die Immunabwehr des Körpers zu umgehen (z. B. Urease, Staphyloxanthin), sich zu menschlichen Zellen zu bewegen, sich an sie anzuheften und/oder in sie einzudringen (z. B. Typ-IV-Pili, Adhäsine, Internaline), die Aktivierung von Virulenzgenen zu koordinieren (z. B. Quorum Sensing) und Krankheiten zu verursachen (z. B. Exotoxine). Beispiele für Naturstoffe mit antivirulenter Wirkung sind das Flavonoid Epigallocatechingallat (das Listeriolysin O hemmt), das Chinon Tetrangomycin (das Staphyloxanthin hemmt) und das Sesquiterpen Zerumbon (das die Motilität von Acinetobacter baumannii hemmt). ⓘ
Immunglobulin-Therapie
Antikörper (Anti-Tetanus-Immunglobulin) werden seit den 1910er Jahren zur Behandlung und Vorbeugung von Tetanus eingesetzt, und dieser Ansatz ist nach wie vor ein nützliches Mittel zur Bekämpfung bakterieller Erkrankungen. Der monoklonale Antikörper Bezlotoxumab beispielsweise wurde von der US-amerikanischen Zulassungsbehörde FDA und der EMA für rezidivierende Clostridium-difficile-Infektionen zugelassen, und weitere monoklonale Antikörper befinden sich in der Entwicklung (z. B. AR-301 für die Zusatzbehandlung von S. aureus bei beatmungsassoziierter Lungenentzündung). Antikörperbehandlungen wirken, indem sie an bakterielle Exotoxine und andere Virulenzfaktoren binden und diese neutralisieren. ⓘ
Phagentherapie

Die Phagentherapie wird als Methode zur Behandlung antibiotikaresistenter Bakterienstämme untersucht. Bei der Phagentherapie werden bakterielle Krankheitserreger mit Viren infiziert. Bakteriophagen und ihre Wirtsbereiche sind äußerst spezifisch für bestimmte Bakterien, so dass sie im Gegensatz zu Antibiotika die Darmmikrobiota des Wirtsorganismus nicht stören. Bakteriophagen, die auch einfach als Phagen bezeichnet werden, infizieren und töten Bakterien in erster Linie während lytischer Zyklen. Phagen schleusen ihre DNA in das Bakterium ein, wo sie transkribiert und zur Herstellung neuer Phagen verwendet wird, woraufhin die Zelle lysiert und neue Phagen freisetzt, die weitere Bakterien desselben Stammes infizieren und vernichten können. Die hohe Spezifität der Phagen schützt die "guten" Bakterien vor der Zerstörung. ⓘ
Der Einsatz von Bakteriophagen hat jedoch auch einige Nachteile. Bakteriophagen können Virulenzfaktoren oder toxische Gene in ihrem Genom beherbergen, und vor dem Einsatz kann es ratsam sein, Gene mit Ähnlichkeit zu bekannten Virulenzfaktoren oder Toxinen durch Genomsequenzierung zu identifizieren. Darüber hinaus stellt die orale und intravenöse Verabreichung von Phagen zur Ausrottung bakterieller Infektionen ein viel höheres Sicherheitsrisiko dar als die topische Anwendung. Ein weiteres Problem sind die ungewissen Immunreaktionen auf diese großen Antigencocktails. ⓘ
Es gibt erhebliche regulatorische Hürden, die für solche Therapien überwunden werden müssen. Trotz zahlreicher Herausforderungen bleibt der Einsatz von Bakteriophagen als Ersatz für antimikrobielle Mittel gegen MDR-Erreger, die auf herkömmliche Antibiotika nicht mehr ansprechen, eine attraktive Option. ⓘ
Fäkale Mikrobiota-Transplantationen

Bei der fäkalen Mikrobiota-Transplantation wird die gesamte intestinale Mikrobiota eines gesunden menschlichen Spenders (in Form von Stuhl) auf Patienten mit einer C. difficile-Infektion übertragen. Obwohl dieses Verfahren von der US-amerikanischen Arzneimittelbehörde FDA nicht offiziell zugelassen wurde, ist seine Anwendung bei Patienten mit antibiotikaresistenter C. difficile-Infektion unter bestimmten Bedingungen erlaubt. Die Heilungsraten liegen bei etwa 90 %, und es wird an der Entwicklung von Stuhlbanken, standardisierten Produkten und Methoden zur oralen Verabreichung gearbeitet. ⓘ
Behandlungen auf der Grundlage von Antisense-RNA
Bei der Behandlung auf der Grundlage von Antisense-RNA (auch Gen-Silencing-Therapie genannt) werden a) bakterielle Gene identifiziert, die für essenzielle Proteine kodieren (z. B. die Gene acpP, lpxC und rpsJ von Pseudomonas aeruginosa), b) einzelsträngige RNA synthetisiert, die komplementär zur mRNA ist, die für diese essenziellen Proteine kodiert, und c) die einzelsträngige RNA mit Hilfe von zelldurchdringenden Peptiden oder Liposomen an die Infektionsstelle gebracht. Die Antisense-RNA hybridisiert dann mit der bakteriellen mRNA und blockiert deren Translation in das essenzielle Protein. Die Behandlung mit Antisense-RNA hat sich in In-vivo-Modellen der P. aeruginosa-Pneumonie als wirksam erwiesen. ⓘ
Antisense-RNA kann nicht nur essenzielle bakterielle Gene zum Schweigen bringen, sondern auch bakterielle Gene, die für die Antibiotikaresistenz verantwortlich sind. So wurde beispielsweise eine Antisense-RNA entwickelt, die das mecA-Gen von S. aureus zum Schweigen bringt (das Gen, das für das modifizierte Penicillin-bindende Protein 2a kodiert und S. aureus-Stämme methicillinresistent macht). Es hat sich gezeigt, dass Antisense-RNA, die auf die mecA-mRNA abzielt, die Anfälligkeit von Methicillin-resistenten Staphylokokken gegenüber Oxacillin sowohl in In-vitro- als auch in In-vivo-Studien wiederherstellt. ⓘ
CRISPR-Cas9-basierte Behandlungen
Anfang der 2000er Jahre wurde ein System entdeckt, das Bakterien in die Lage versetzt, sich gegen eindringende Viren zu verteidigen. Das als CRISPR-Cas9 bezeichnete System besteht aus (a) einem Enzym, das DNA zerstört (die Nuklease Cas9), und (b) den DNA-Sequenzen von zuvor eingedrungenen Viren (CRISPR). Diese viralen DNA-Sequenzen ermöglichen es der Nuklease, fremde (virale) und nicht eigene (bakterielle) DNA anzugreifen. ⓘ
Obwohl die Funktion von CRISPR-Cas9 in der Natur darin besteht, Bakterien zu schützen, können die DNA-Sequenzen in der CRISPR-Komponente des Systems so verändert werden, dass die Cas9-Nuklease auf bakterielle Resistenzgene oder bakterielle Virulenzgene anstelle von viralen Genen abzielt. Das modifizierte CRISPR-Cas9-System kann dann mithilfe von Plasmiden oder Bakteriophagen in bakterielle Krankheitserreger eingebracht werden. Dieser Ansatz wurde erfolgreich eingesetzt, um die Antibiotikaresistenz zum Schweigen zu bringen und die Virulenz von entero-hämorrhagischen E. coli in einem In-vivo-Infektionsmodell zu verringern. ⓘ
Verringerung des Selektionsdrucks für Antibiotikaresistenz

Neben der Entwicklung neuer antibakterieller Behandlungen ist es wichtig, den Selektionsdruck für das Auftreten und die Verbreitung von Antibiotikaresistenzen zu verringern. Zu den Strategien, mit denen dies erreicht werden kann, gehören bewährte Maßnahmen zur Infektionskontrolle wie die Verbesserung der Infrastruktur (z. B. weniger beengte Wohnverhältnisse), bessere sanitäre Einrichtungen (z. B. sicheres Trinkwasser und Lebensmittel) und die Entwicklung von Impfstoffen, andere Ansätze wie das Antibiotic Stewardship und experimentelle Ansätze wie die Verwendung von Prä- und Probiotika zur Infektionsprävention. Es wird ein Antibiotika-Zyklus vorgeschlagen, bei dem die Ärzte Antibiotika zur Behandlung von Mikrobenkrankheiten abwechselnd einsetzen, aber neuere Studien haben gezeigt, dass solche Strategien gegen Antibiotikaresistenzen unwirksam sind. ⓘ
Impfstoffe
Impfstoffe beruhen auf der Modulation oder Verstärkung des Immunsystems. Eine Impfung erregt oder verstärkt die Immunkompetenz eines Wirts zur Abwehr einer Infektion, was zur Aktivierung von Makrophagen, zur Produktion von Antikörpern, zu Entzündungen und anderen klassischen Immunreaktionen führt. Antibakterielle Impfstoffe haben zu einem drastischen Rückgang der weltweiten bakteriellen Erkrankungen geführt. Impfstoffe, die aus abgeschwächten ganzen Zellen oder Lysaten hergestellt werden, sind weitgehend durch weniger reaktogene, zellfreie Impfstoffe ersetzt worden, die aus gereinigten Komponenten, einschließlich Kapselpolysacchariden und deren Konjugaten, Proteinträgern sowie inaktivierten Toxinen (Toxoiden) und Proteinen bestehen. ⓘ
Zum Begriff
Die Bezeichnung Antibiotikum leitet sich von Antibiose ab, einer von Paul Vuillemin 1889 eingeführten Bezeichnung für eine Beziehung zwischen Lebewesen, die für einen der Beteiligten Nachteile mit sich bringt, indem dessen Wachstum und/oder Fortpflanzung gehemmt oder es abgetötet wird. ⓘ
Obwohl Antibiose schon lange bekannt ist, gilt als der erste therapeutisch antimikrobiell eingesetzte Stoff das synthetisch hergestellte Arsphenamin. Die Bezeichnung Chemotherapeutikum für chemisch-synthetische antimikrobielle Stoffe stammt aus der Zeit der großtechnischen synthetischen Herstellung der Sulfonamide. Erst später wurde das Penicillin als erster natürlich vorkommender antimikrobieller Wirkstoff in die antibakterielle Therapie eingeführt. Heute bezeichnet man allgemein sowohl Stoffe biologischen Ursprungs (Antibiotika im ursprünglichen Sinn) als auch synthetisch hergestellte Chemotherapeutika als Antibiotika. ⓘ
Außer im chemischen wird inzwischen auch im biologischen Sinn die Definition weiter gefasst. Sie beschränkt den biogenen Ursprung der Antibiotika nicht nur auf Mikroorganismen wie Pilze und Bakterien, sondern umfasst auch Stoffe wie Phytoalexine und Defensine aus höher organisierten Lebewesen wie Pflanzen und Tieren; auch beim Menschen ist das Vorhandensein körpereigener antibiotisch wirksamer Stoffe bekannt. ⓘ
β-Lactame
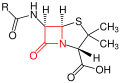
β-Lactam-Antibiotika (kurz β-Lactame) binden fest (kovalent) und irreversibel an bestimmte Penicillin-Binde-Proteine (PBP), die zuständig für das Entstehen von Peptidbindungen in dem bakteriellen Zellwandbestandteil Murein sind. Es sind verschiedene solcher PBP, wie etwa die D-Alanin-Transpeptidasen, als Angriffspunkte für β-Lactam-Antibiotika bekannt. Durch die Blockade dieser Enzyme kommt es zur Störung der Mureinbiosynthese, so dass die wichtigen Zellwandbestandteile nicht neu produziert werden können. Aus den entstehenden Läsionen („Löcher“) entsteht eine Instabilität der Zellwand und der hohe osmotische Druck führt zur Lyse und somit zum Absterben der Zelle. Unter extremen Bedingungen (Labor) lassen sich regelrecht ‚platzende‘ Bakterienzellen beobachten. ⓘ
Grundstruktur der Penicilline – der β-Lactamring ist rot markiert.
Grundstruktur der Cephalosporine – der β-Lactamring ist rot markiert. ⓘ
β-Lactam-Antibiotika wirken im Prinzip bakterizid. Typische Vertreter sind Penicilline, Cephalosporine, Monobactame und Carbapeneme. Für eine feinere Unterteilung sei auf den Artikel β-Lactam-Antibiotika verwiesen. ⓘ
β-Lactam-Antibiotika werden für bestimmte Anwendungen mit β-Lactamase-Inhibitoren kombiniert. β-Lactamase-Inhibitoren blockieren die von manchen Bakterien gebildeten β-Lactamasen, die β-Lactam-Antibiotika durch Spaltung unwirksam machen würden. Feste Kombinationen sind Clavulansäure + Amoxicillin, Sulbactam + Ampicillin, Tazobactam + Piperacillin. ⓘ
Glykopeptide
Glykopeptide gehören ebenfalls zu den bakteriolytisch wirkenden Antibiotika. Sie wirken ausschließlich auf grampositive Bakterien. Ähnlich wie β-Lactame hemmen sie die Biosynthese des bakteriellen Zellwandbestandteils Murein (Peptidoglycan), jedoch ist der Wirkungsmechanismus ein anderer. Glykopeptide verhindern durch Komplexierung von endständigen D-Alanyl-D-Alanin-Sequenzen der Peptidoglykane deren Verlängerung und Quervernetzung, indem so die Transglycosylase gehemmt wird. In der wachsenden Bakterienzellwand entstehen Perforationen (Löcher), durch die aufgrund des hohen osmotischen Druckunterschiedes unkontrolliert Wasser in die Bakterienzelle einströmt (diffundiert), weswegen diese schließlich platzt. Arzneistoffe aus der Gruppe der Glykopeptide sind beispielsweise Vancomycin, Dalbavancin und Teicoplanin. ⓘ
Nach Gabe einer initialen Normdosis erfolgt die Bestimmung der Erhaltungsdosis anhand der Serumspiegel im Blut, vor allem bei gleichzeitiger Therapie mit Aminoglykosiden, bei Patienten mit gefährdeter oder unzureichender Nierenfunktion sowie bei hoher Dosierung und/oder längerer Behandlungsdauer. ⓘ
Lincosamide
Lincosamide binden an die 50-S-Untereinheit der Ribosomen und verursachen dort eine Hemmung der Proteinsynthese der Bakterien. Aufgrund der ähnlichen Wirkungsweise wie Makrolide kann es zu Kreuzresistenzen kommen. Lincosamide haben eine bakteriostatische Wirkung. ⓘ
Aminoglykosid-Antibiotika
Aminoglykoside stören ebenfalls die bakterielle Proteinsynthese. Sie lagern sich an die 30 S-Ribosomen an, während die Proteinbiosynthese noch stattfindet. Es entstehen Proteine, die das Bakterium nicht nutzen kann und die sogar den Aufbau der Zellwand behindern. Diese Antibiotika wirken bakterizid. ⓘ
Polypeptid-Antibiotika
Polypeptid-Antibiotika wirken in der Zellmembran. Die Transportmechanismen werden hier gestört, weshalb für die Zellfunktion schädliche Stoffe nicht mehr ausgefiltert werden. Zu den Polypeptid-Antibiotika gehören die Polymyxine, Bacitracin und Tyrothricin. ⓘ
Lipopeptid-Antibiotika
Verschiedene Untergruppen von Lipopeptiden zeigen antibiotische Eigenschaften. Je nach Untergruppe tritt der antibiotische Effekt durch Porenbildung im Erreger, durch Blockade der Zellwandsynthese (bei Pilzen) oder durch Hemmung der Proteinbiosynthese ein. ⓘ
Epoxid-Antibiotika
Epoxid-Antibiotika sind irreversible Hemmstoffe des Enzyms MurA (UDP-N-Acetylglucosamin-enolpyruvyl-transferase). MurA katalysiert den ersten Schritt der Mureinbiosynthese: den Transfer einer Enolpyruvyleinheit aus Phosphoenolpyruvat (PEP) an UDP-N-Acetylglucosamin (UNAG). Die Wirkung ist bakterizid. ⓘ
Chinolon-Antibiotika
Chinolon-Antibiotika (kurz: Chinolone) werden ausschließlich synthetisch hergestellt. Sie gehören hinsichtlich ihres Wirkungsprinzips zu den Gyrasehemmern. Das Enzym DNA-Gyrase ist im Bakterium für das Entdrillen der DNA-Stränge unverzichtbar und führt während der DNA-Replikation zur Verringerung auftretender innermolekularer Spannungen. Durch die Verabreichung von Gyrasehemmern wird dieses Enzym inaktiviert, sodass die DNA nicht mehr entdrillt und folglich nicht repliziert werden kann. Auch von einigen Chinolonen (Ciprofloxacin, Norfloxacin) ist bekannt, dass sie in Gegenwart von mehrwertigen Kationen (z. B. Ca2+ aus Milch bzw. Milchprodukten oder Mg2+ aus Antazida) schlechter vom Körper aufgenommen werden und schwächer wirken. ⓘ
Streptogramine
Streptogramine existieren in zwei biochemisch unterschiedlich Subgruppen. Beide binden an die P-Stelle der 50S-Untereinheit des Ribosoms und hemmen so die Elongation der Proteinsynthese. Subgruppe A und B einzeln betrachtet sind nur bakteriostatisch wirksam. Zusammen eingesetzt (typischerweise in 70:30-Mischung), zeigt sich ein bakterizider Synergismus, der aufgrund einer Konformationsänderung der 50S-Untereinheit nach Bindung von A-Streptograminen die Aktivität von B-Streptograminen vervielfacht. Gruppe-A-Streptogramine alleine blockieren eine frühe Phase der Elongation, indem sie die Donor- und Akzeptorstellen des Ribosoms blockieren. Ihnen ist es nur möglich an das Ribosom zu binden, wenn dieses frei von einer gebundenen Acyl-tRNA ist. Gruppe-B-Streptogramine jedoch können in jeder Phase der Proteinsynthese das Ribosom besetzen und führen so zu einer Hemmung der Elongation, als auch zu einer Freisetzung von inkompletten Peptiden. ⓘ
Sulfonamide

Sulfonamide sind eine Gruppe synthetischer chemischer Verbindungen, die die eine Sulfonamidgruppe enthalten. Sie werden auch als Wachstumsfaktoranaloga bezeichnet und stören die Nucleinsäuresynthese mittels eines Eingriffs in den Folsäurezyklus. Die Wirkungsweise ist bakteriostatisch. ⓘ
Sulfanilamid war der erste 1906 entwickelte Sulfonylharnstoff, der jedoch erst Ende der 1930er Jahre als antimikrobielles Mittel eingesetzt wurde. Antimikrobielle Sulfonamid-Mittel sind bakteriostatisch (verhindern die Vermehrung von Bakterien, töten sie jedoch nicht unbedingt ab) und stören die Synthese von Folsäure in Bakterien, die für die Bildung von Nukleinsäuren und letztendlich für DNA und RNA wesentlich ist. Menschen erhalten Folsäure aus ihrer Nahrung, aber Bakterien müssen sie synthetisieren. Antimikrobielle Sulfonamid-Mittel können mit Trimethoprim kombiniert werden, um sie bakterizid zu machen (Bakterien abzutöten), da Trimethoprim auf ein anderes Enzym im Folsäuresyntheseweg einwirkt. ⓘ
Oxazolidinone
Oxazolidinone hemmen den Beginn der Synthese eines Peptidstrangs an der Stelle, an der sich Ribosom, Boten- oder messenger-RNA und Start-tRNA-AS-Komplex zusammenlagern. Sie wirken meist bakteriostatisch auf Gram-positive Bakterien; Cycloserin als ein Vertreterwirkstoff hemmt auch Gram-negative Bakterien sowie das Mycobacterium tuberculosis. ⓘ
Ansamycine
Ansamycine (wichtigste Untergruppe sind die Rifamycine) wirken durch irreversible Bindung an die Beta-Untereinheit der prokaryotischen DNA-abhängigen RNA-Polymerase. Auf diese Weise blockieren sie die Bindung des Enzyms an die DNA und damit die Initiierung der Kettenbildung. Durch Unterdrückung der RNA-Transkription wird letztlich die Proteinsynthese in Bakterien gehemmt. Die Wirkung von Ansamycinen ist bakterizid. ⓘ
Nitroimidazole
Nitroimidazole wirken über reaktive Zwischenprodukte, die – insbesondere in sauerstoffarmen und nur in geringem Umfang in Zellen mit normaler Sauerstoffversorgung – bei der Reduktion der Nitrogruppe entstehen. Diese wirken bakterizid, indem sie bei suszeptiblen Erregern (obligat anaerobe Bakterien, bestimmte Protozoen) DNA-Strangabbrüche bewirken. Die reaktiven Reduktionsprodukte der neueren bicyclischen Nitroimidazole Delamanid und Pretomanid hemmen bei Mykobakterien die Bildung von Mykolsäuren, die Zellwandbestandteile darstellen. ⓘ
Einteilung nach dem Wirkmechanismus
Hemmung der Zellwandsynthese
- β-Lactam-Antibiotika:
- Carbapeneme: Imipenem, Meropenem, Ertapenem
- Cephalosporine
- Monobactame: Aztreonam
- Penicilline: Penicillin G (Benzylpenicillin), Penicillin V (Phenoxymethylpenicillin)
- Ureidopenicilline (Acylaminopenicilline): Piperacillin, Mezlocillin, Azlocillin
- Aminopenicilline: Ampicillin, Amoxicillin
- Isoxazolylpenicilline: Flucloxacillin, Methicillin, Oxacillin
- β-Lactamase-Hemmer: Clavulansäure, Sulbactam, Tazobactam
- Sultamicillin
- Nukleosid-Antibiotika, z. B. Puromycin, Blasticidin S, Polyoxine
- Epoxid-Antibiotika: Fosfomycin
- Glycopeptide: Teicoplanin, Vancomycin
- Polypeptide: Bacitracin, Colistin, Gramicidin, Polymyxin B, Tyrothricin, Teixobactin
- Fosmidomycin
- Bicylische Nitroimidazole: Pretomanid, Delamanid ⓘ
Hemmung der Proteinbiosynthese am Ribosom
- Aminoglykoside: Amikacin, Gentamicin, Kanamycin, Neomycin, Netilmicin, Streptomycin, Tobramycin
- Chloramphenicol
- Fusidinsäure
- Ketolide: Cethromycin, Narbomycin, Telithromycin
- Lincosamide: Clindamycin, Lincomycin
- Lipopeptide: Daptomycin, Caspofungin
- Streptogramine: Dalfopristin, Quinupristin
- Makrolide: Azithromycin, Clarithromycin, Erythromycin, Roxithromycin
- Oxazolidinone: Cycloserin (heute als Terizidon), Linezolid, Tedizolid, Eperezolid
- Tetracycline: Doxycyclin, Minocyclin, Tetracyclin, Oxytetracyclin
- Glycylcycline: Tigecyclin ⓘ
Wirkung auf bakterielle Nukleinsäuren
- Gyrasehemmer (Hemmer der DNA-Replikation)
- Fluorchinolone:
- Generation 1: Norfloxacin,
- Generation 2: Ciprofloxacin, Ofloxacin, Enoxacin
- Generation 3: Levofloxacin
- Generation 4: Moxifloxacin ⓘ
- Aminocumarine ⓘ
- Bakterizide DNA-Schäden (Komplexbildung, Strangbruch)
- 2- und 5-Nitroimidazole: Metronidazol, Tinidazol, Nimorazol ⓘ
- Folsäureantagonisten
- Sulfonamide: Sulfadiazin, Sulfadoxin, Sulfamethoxazol, Sulfasalazin
- Diaminopyrimidine: Pyrimethamin, Trimethoprim ⓘ
- Ansamycine (Hemmer der bakteriellen RNA-Polymerase)
- Rifamycine: Rifampicin ⓘ
Hemmung des Energiestoffwechsels
- Bedaquilin ⓘ
Probleme
Wechselwirkungen
Viele Antibiotika können die Wirkung anderer Medikamente oder Genussmittel beeinflussen. So können beispielsweise manche Gyrasehemmer den Abbau des Stimulans Coffein in der Leber behindern; die Wechselwirkung ist möglicherweise klinisch relevant. Hohe Coffeinspiegel können Herzklopfen, Kopfschmerz und Schwindel verursachen. Verschiedene Antibiotika der Tetracyclin-Gruppe verlieren an Wirkung in Kombination mit Milch, Käse, Quark und Joghurt. Sie werden durch die in Milch und Milchprodukten enthaltenen Calciumionen (Ca2+) durch Komplexbildung inaktiviert. ⓘ
Besondere Anwendungsgebiete
Tierhaltung
Antibiotika werden auch in der Tierhaltung eingesetzt. Zu unterscheiden sind dabei zwei verschiedene Verwendungen: einerseits als Arzneimittel, die gezielt im Rahmen einer veterinärmedizinischen Behandlung eingesetzt werden. Andererseits die Anwendung von Antibiotika als Wachstums- und Leistungsförderer, die besonders umstritten ist. Diese letztgenannte Einsatzart ist in der EU Anfang 2006 verboten worden, nachdem sie bereits 1995 in Dänemark, seit 1997 in Vorarlberg und 1999 in der Schweiz aufgrund einzelstaatlicher Selbstbeschränkungen nicht mehr eingesetzt werden dürfen. ⓘ
Wenn ein einzelnes Tier an einem bakteriellen Infekt erkrankt ist, kann die veterinärmedizinische Behandlung unter Umständen die antibiotische Behandlung des gesamten Bestandes erfordern. Bei dieser Metaphylaxe genannten Anwendung wird ein besonders hoher Selektionsdruck auf die in der Stallung vorhandenen Bakterienstämme hervorgerufen, der nur die wenigen (durch natürliche Mutation normalerweise vorhandenen) resistenten Erreger überleben lässt. Alle empfindlichen Mikroorganismen werden aber abgetötet. Die verbleibenden Erreger bilden dann den resistenten Stamm, wenn sie nicht als Restinfektion durch die Immunreaktion des Tieres oder Menschen abgetötet werden. Dadurch kann das Antibiotikum gegen die bekannten Infektionen unwirksam werden. Resistente Bakterien können dann andere Organismen erreichen und zu erschwerten Krankheitsverläufen bis hin zu Therapieversagen führen. Dadurch haben sich in der Vergangenheit bereits erhöhte Resistenzen gegen Antibiotika bei Tieren und Menschen ereignet. Hauptsächlich gefährdet sind Arbeiter in Schweine- und Geflügelbetrieben. In den USA wird schätzungsweise mindestens dieselbe Menge Antibiotika an Tiere verabreicht wie an Menschen. Antibiotikaresistente Salmonella-, Campylobacter- und Escherichia-choli-Stämme, die humanpathogen sind, werden mit steigender Häufigkeit in großen Geflügel- und Rinderproduktionsbetrieben nachgewiesen. ⓘ
Molekularbiologische Forschung
Antibiotika werden auch als Selektionsmittel in der Molekularbiologie verwendet. Beim Klonieren wird die Eigenschaft der Resistenz gegen ein bestimmtes Antibiotikum als Erkennungszeichen benutzt, ob ein Stamm ein bestimmtes Gen trägt, das man dem Bakterium einbauen möchte. Sowohl das neue Gen als auch die Resistenzinformationen sind auf einem Plasmid lokalisiert. Das Bakterium wird auf einem Medium vermehrt, welches das entsprechende Antibiotikum enthält. Dadurch wird auch ein späterer Verlust des Plasmids signalisiert, da bei dessen Verlust auch die Resistenz verloren geht und das Bakterium auf dem Medium stirbt. ⓘ

Verbrauchsstatistik
Seit 1992 haben die klassischen β-Lactame (Penicilline, Aminopenicilline und Cephalosporine) ihre führende Position gemessen in definierten Tagesdosen ausgebaut, während der Anteil der Tetracycline zurückging. Aminopenicilline (überwiegend Amoxicillin) haben dabei die Oralpenicilline praktisch ersetzt. ⓘ
Forschung und Alternativen
Neben der Weiterentwicklung bekannter Substanzklassen mit bekannten Wirkprinzipien, die den Großteil der in den letzten Jahrzehnten erfolgten Markteinführungen ausmachen, wird auch die Entwicklung von Substanzen mit neuartigen Angriffspunkten als erforderlich angesehen. Neben den bisher vorherrschenden Targets (Zellwandsynthese, ribosomale Proteinsynthese, DNA-Replikation, Folsäuresynthese) könnten etwa ⓘ
- an der Aminosäurensynthese beteiligte Enzyme
- die bakteriellen Fettsäurebiosynthese
- Proteine, die eine Rolle bei der Interaktion zwischen Wirt und Erreger spielen
- Proteine, die zur Persistenz der Bakterien bzw. zu deren Überleben beitragen ⓘ
als zusätzliche Angriffspunkte verstärkt von Bedeutung werden. Ebenso gewinnt die Ausweitung der Suche nach neuen Molekülen auf ökologische Nischen und die Genome von Mikroorganismen, insbesondere auch nicht kultivierter (Metagenom), an Bedeutung. Eine innovative Strategie stellt die Hemmung pathogener Erreger dar, ohne sie abzutöten. Dadurch entfällt der Selektionsdruck, der zur Verbreitung einer Resistenz beiträgt. ⓘ
Einige neue Stoffe bzw. Stoffgruppen und Wirkprinzipien wurden in der jüngeren Vergangenheit aus der präklinischen Forschung beschrieben: Plectasin beispielsweise, das aus der Gruppe der bei Pilzen, Tieren und Pflanzen verbreiteten sogenannten Defensine stammt und nicht nur die bakterielle Zellwandsynthese stört, sondern auch das Immunsystem des Wirts stimulieren soll; Platensimycin und Platencin, zwei aus dem Bodenbakterium Streptomyces platensis isolierte Stoffe, die selektiv die bakterielle Lipid-Biosynthese inhibieren; die neuartigen RNA-Polymerase-Hemmer Myxopyronin, Corallopyronin und Ripostatin; die MTAN-Inhibitoren, die in das Quorum sensing eingreifen und die Fähigkeit bestimmter Bakterien unterdrücken schützende Biofilme zu bilden; Closthioamid, ein strukturell ungewöhnliches Molekül mit zahlreichen Schwefelatomen, das vom anaeroben Bodenbakterium Clostridium cellulolyticum gebildet wird und gegen multiresistente Krankheitserreger aktiv ist; das Triclosan-Derivat PT70, das die Mykolsäuresynthese der Mykobakterien hemmt. ⓘ
In der Phase der Grundlagenforschung befinden sich erst vor kurzem entdeckte und antibiotisch wirksame Acyldepsipeptide (ADEPs). Sie setzen in Bakterienzellen eine spezielle Kontrollfunktion außer Kraft, was einen neuartigen Wirkungsmechanismus darstellt. Die neuartigen Wirkstoffe haben als Zielmolekül eine ClpP-Protease, ein Proteine-zerschneidendes Enzym. Normalerweise bewirkt diese spezielle Protease über einen strikt kontrollierten Prozess das Recycling von defekten Bakterienproteinen. Wird dieser Kontrollprozess durch ADEPs unterbunden, baut die ClpP-Protease auch gesunde und für den Stoffwechsel des Bakteriums lebenswichtige Proteine ab, zu denen auch das für die Zellteilung wichtige FtsZ-Protein gehört. Die Bakterien können sich somit nicht mehr teilen und sterben ab. Mit der neuen Wirkstoffgruppe der ADEPs erhoffen sich die Forscher ein neuartiges, breit wirksames Antibiotikum, das auch in der Lage wäre, multiresistente Bakterien abzutöten. ⓘ
Forscher der Christian-Albrechts-Universität zu Kiel haben entdeckt, dass der Süsswasserpolyp Hydra magnipapillata ein Protein mit der Bezeichnung Hydramacin-1 bildet, das eine Reihe von Bakterien regelrecht verklumpen lässt und tötet. Es gelang ihnen auch das zugehörige Gen zu isolieren, sodass sie das Protein in Reinform für weitere Untersuchungen herstellen konnten. Dabei konnten sie feststellen, dass Hydramacin-1 schon in relativ geringer Dosierung Enterobakterien, Klebsiellen, Streptokokken und Yersinien abzutöten vermag. Allerdings war es gegen einige andere Keime wie beispielsweise Staphylococcus aureus weniger wirksam. ⓘ
Hilfe bei Infektionen mit resistenten Bakterien verspricht ferner die Therapie mit Bakteriophagen – hochspezialisierten Viren, welche Bakterien als Wirtszellen nutzen. Derzeit arbeiten verschiedene Pharmaunternehmen an der Zulassung der Phagentherapie. ⓘ
Eine neue Stoffgruppe stellt das Teixobactin aus dem Bodenbakterium Eleftheria terrae dar, das im Januar 2015 durch einen Artikel in der Fachzeitschrift Nature vorgestellt wurde. Die gegen Gram-positive Bakterien wirksame Substanz Teixobactin soll bisher keine Resistenzentwicklung bei denjenigen Bakterien zeigen, die für Teixobactin empfindlich sind, weil in den Aufbau der Bakterienzellwand „an vielen entscheidenden Stellen“ eingegriffen wird und durch viele gleichzeitig notwendige Anpassungen der Bakterien eine Resistenzbildung erschwert wird. ⓘ
Eine weitere Gruppe unter den neuartigen Antibiotika sind die gegen gramnegative Keime wirksamen Outer Membrane Protein Targeting Antibiotics (abgekürzt „Ompta“). Sie interagieren mit Bestandteilen der Außenmembran gramnegativer Bakterien, indem sie einerseits an fettähnliche Membrankomponenten binden und andererseits an das Membranprotein BamA. Dieses ist für den Aufbau der äußeren Hülle der Bakterien wichtig. Weil die Membran nicht mehr gebildet werden kann, sterben die Keime ab. Vorbilder für synthetische Ompta sind natürliche antimikrobielle Proteine wie das im Schwein vorkommende Protegrin oder das Thanatin aus der Wanze. Ein erster Kandidat, Murepavadin, war bis 2019 in der klinischen Prüfung gegen Atemwegsinfektionen durch Pseudomonas aeruginos, eine weitere Substanz (POL7306) soll 2020 in die klinische Prüfung am Menschen überführt werden. ⓘ
Kritik

Rückstände in der Umwelt
Antibiotikaresistente Bakterien werden in großen Mengen über Gülle und Mistausbringung aus der Intensivtierhaltung direkt in der Umwelt freigesetzt. Daneben werden auch durch direkten Stoffeintrag Antibiotika selbst in die Umwelt eingetragen. Dort entfalten sie eine biologische Wirkung und könnten auch dort noch eine Zunahme antibiotikaresistenter Bakterien bewirken. Neuere Studien belegen einen starken Anstieg multiresistenter Bakterien in der Umwelt. Der Weg der resistenten Erreger zurück zum Menschen ist überall dort möglich, wo Kontakt zu fäkal verunreinigtem Wasser wie Badegewässern besteht. Wissenschaftler fordern, den Eintrag von Antibiotika aus der Tierhaltung zu verringern. ⓘ